一种以多羟基醇作为分子伴侣协同高效制备蛋白基纳米乳液的方法及制得的蛋白基纳米乳液与流程
 2021-01-07 10:01:51|
2021-01-07 10:01:51| 286|
286| 起点商标网
起点商标网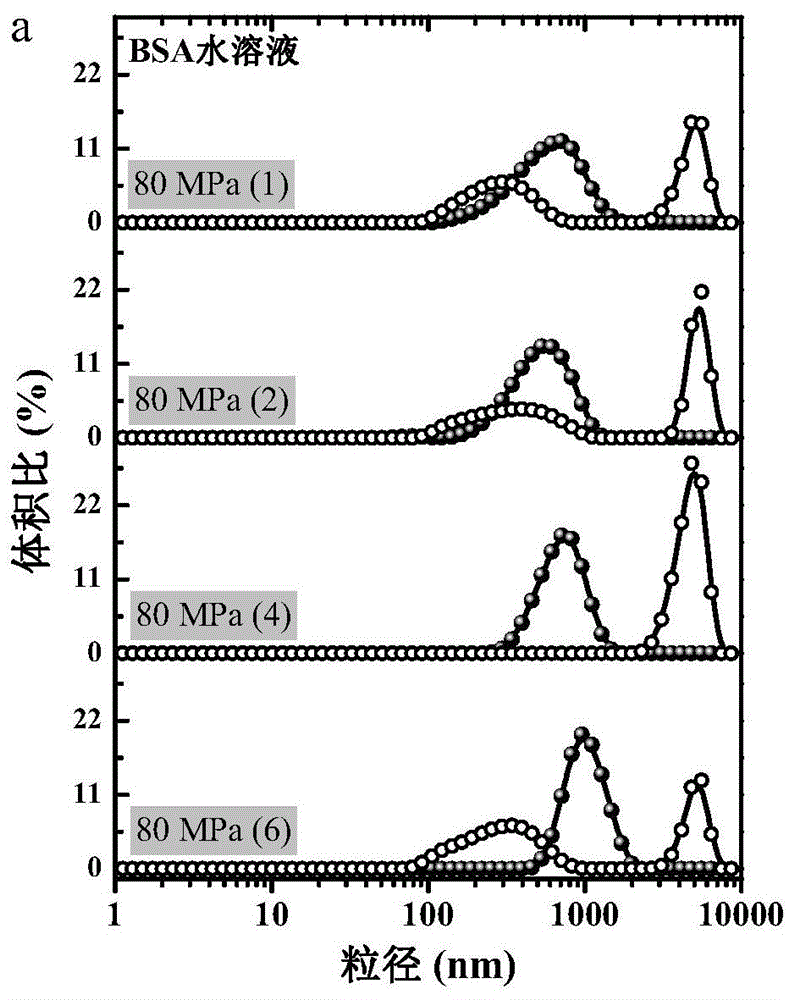
本发明属于乳液制备技术领域,具体涉及一种以多羟基醇作为分子伴侣协同高效制备蛋白基纳米乳液的方法及制得的蛋白基纳米乳液。
背景技术:
纳米乳液通常指粒径介于20~200nm的乳液,由于此类体系不仅具有比普通乳液更好的稳定性、透光性,而且可显著地提高荷载的脂溶性生物活性物质的生物利用率或效价,若以挥发性精油为油相进行纳米包埋不仅可提高其贮藏稳定性,还可显著增加其在水相中的溶解度及抗菌活性,因而在作为脂溶生物活性物质包埋输送载体、纳米涂层、食品添加剂、经皮给药等方面具有广阔的应用前景。然而,此类乳液通常采用小分子表面活性剂作为乳化剂,越来越多证据显示,摄入过多的合成表面活性剂对健康是不利的。鉴于此,开发食品级纳米乳液势在必行。基于蛋白质优异的乳化性能,研发以蛋白质作为乳化剂的食品级纳米乳液则成为食品领域的一个重要发展方向。但是,蛋白质的界面活性及乳化效率远低于小分子量表面活性剂,因而较多的场合需要更剧烈的乳化过程、更高的蛋白浓度(或更低的油相比例)才能获得纳米乳液。不仅如此,相关纳米乳液的稳定性也存在一定的问题。因此,开发高效制备高稳定性蛋白基纳米乳液的技术是相关领域亟待突破的一项重要课题。
中国发明专利申请201911206534.9和201811059266.8分别利用大豆分离蛋白与茶皂素的复合物以及酪蛋白酸钠和乳清分离蛋白为乳化剂制备得到蛋白基纳米乳液。前者乳化剂成分复杂,后者虽采用了单一蛋白质成分作为乳化剂,但却建立在多级乳化方式的基础上,乳液需经过剪切预乳化(形成粗乳液),一级高能均质(均质压力为80~110mpa)和二级高能均质(均质压力为50mpa)才能够形成,操作不便,成本较高。此外,两者均采用了较高的乳化剂浓度(如8%)。因此,利用较低浓度的单一蛋白组分高效制备稳定的蛋白基纳米乳液具有更重要的意义。
近年来越来越多的研究表明蛋白质可以作为优秀的乳化剂用以制备纳米乳液,然而不难发现,在相关工作中,乳液粒径大多超过200nm。针对蛋白纳米乳液难制备且存在稳定性较差的缺点,国内外也尝试一些策略及技术予以解决,但是总体上来看,效果都不是太好。分子量小的球蛋白(如乳清蛋白)由于具有良好的界面、乳化活性及较小的动力学粒径,在形成纳米乳液方面具有一定的优势,如用量更小、均质强度更低,但是其在高压过程中极易发生变性、聚集,从而会导致相应乳液稳定性下降。那么,能不能采用一些简便的物化手段既促进蛋白纳米乳液的形成,又提高其稳定性?这是一个相关领域亟待有所突破的重要科技问题。许多多羟基化合物,如海藻糖、蔗糖或甘油等,是常用的酶或其他功能蛋白的活性保护剂。鉴于大部分蛋白的功能活性源于其高级结构(二级至四级结构),多羟基化合物保护蛋白的活性,实质上就是提高蛋白质的构象稳定性。
技术实现要素:
为了克服现有技术存在的上述不足,本发明的目的是提供了一种以多羟基醇作为分子伴侣协同高效制备蛋白基纳米乳液的方法及制得的蛋白基纳米乳液。
本发明的首要目的在于提供一种高效、便捷的蛋白基纳米乳液的制备方法。
本发明的另一目的在于提供一种通过上述方法制备得到的食品级蛋白基纳米乳液。本发明创造性地采用多羟基醇为分子伴侣,在维持蛋白质构象的同时促进蛋白基纳米乳液的高效制备。
本发明的目的至少通过如下技术方案之一实现。
本发明提供的一种以多羟基醇作为分子伴侣协同高效制备蛋白基纳米乳液的方法,包括如下步骤:
将蛋白溶于多羟基醇的溶液中,混合均匀,得到蛋白质分散液,然后与油相混合,经初步均质(简单均质)和高能乳化后得到所述蛋白基纳米乳液(水包油型纳米乳液)。
进一步地,所述蛋白为酪蛋白酸钠、血清蛋白、卵清蛋白、溶菌酶、β-乳球蛋白、豆类7s蛋白、豆类11s蛋白、大豆分离蛋白或乳清蛋白中的至少一种。
进一步地,所述多羟基醇为蔗糖、海藻糖、甘油、二羟基丙酮、赤藓糖醇、山梨醇、聚乙二醇中的至少一种。
进一步地,所述油相为正十二烷、正己烷、柠檬精油、玫瑰精油、大豆油、花生油、橄榄油、亚麻籽油和调和油中的至少一种。
进一步地,在所述蛋白基纳米乳液中,多羟基醇的质量百分比浓度为10wt%-40wt%。
优选地,在所述蛋白基纳米乳液中,多羟基醇的质量百分比浓度为40wt%。
进一步地,在所述蛋白基纳米乳液中,蛋白质的质量百分比浓度为1.0wt%-3.0wt%。
优选地,在所述蛋白基纳米乳液中,蛋白质的质量百分比浓度为1.0wt%。
进一步地,所述油相的体积占比为1%-30%。
优选地,所述油相与蛋白质分散液的体积比为1:9。
进一步地,所述初步均质的转速为2000-30000,所述初步均质的时间为0.5-3min。所述均质为低能乳化,采用剪切均质进行乳化。
进一步地,所述乳化包括高压微射流乳化处理和高压均质乳化处理中的一种以上。
进一步地,所述高压微射流乳化处理的压力为40-100mpa,高压微射流乳化处理的次数为1-6次;所述高压均质乳化处理的压力为40-100mpa,所述高压均质乳化处理的次数为1-6次。
本发明提供一种由上述的制备方法制得的蛋白基纳米乳液。
与现有技术及产品相比,本发明的制备方法及所得到的产物具有如下优点及有益效果:
(1)本发明提供的制备方法中,所用动植物蛋白来源广泛、制取成本低、属环境友好、可降解型乳化剂,并且对人体无害,甚至具有一定营养价值;
(2)本发明提供的制备方法中,所使用的蛋白质乳化效率高,仅需低浓度(如1wt%)的蛋白即可成功制备稳定的纳米乳液;
(3)本发明所得到的蛋白基纳米乳液的水力学直径可低至148nm;
(4)本发明所得蛋白基纳米乳液稳定性高,对油相具有优异的保护或控释效果;
(5)本发明的制备方法对设备要求低、简单易行、成本低、能耗低,适合大规模工业化生产与加工,所得蛋白基纳米乳液在日化用品、药品、食品及保健品行业具有广阔的应用前景。
附图说明
图1a为实施例1对照组制备的蛋白基纳米乳液的粒度分布图;
图1b为实施例1实验组制备的蛋白基纳米乳液的粒度分布图;
图2a为实施例2实验组和对照组制备的蛋白基纳米乳液的粒度分布图;
图2b为实施例3实验组和对照组制备的蛋白基纳米乳液的粒度分布图;
图3为bsa水溶液(浓度为1wt%)在不同压力、不同次数的微射流处理下的粒度分布图;
图4为实施例1中,当微射流处理次数为6次时,实验组和对照组得到的蛋白基纳米乳液中bsa的三级结构变化效果图。
具体实施方式
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
实施例1
一种以多羟基醇作为分子伴侣协同高效制备蛋白基纳米乳液的方法(实验组),包括如下步骤:
(1)准确称取1g的bsa粉末(牛血清白蛋白粉末),将其分散于99g质量浓度为40wt%的蔗糖溶液中,于室温下连续搅拌2h使蛋白质颗粒充分分散,得到蛋白质分散液,调节ph为7.0,加入叠氮钠防止微生物生长,叠氮钠在蛋白质分散液中的质量浓度为0.02g/100g,将所得蛋白质分散液置于4℃下低温静置12h以使蛋白质充分水化,获得蛋白质质量浓度为1g/100g的bsa贮存液。
(2)制备乳液前,将bsa贮存液(bsa分散液)于室温搅拌0.5h,使其温度恢复至室温,并促进蛋白分散均匀。
(3)量取90ml的bsa分散液作为乳液水相于100ml烧杯中,添加10ml的柠檬精油于水相上部,无需任何混匀操作。
(4)对油水混合体系进行剪切乳化,其中,所用剪切机械头直径为1cm,剪切速率为5000rpm,剪切时间为2min,得到粗乳液。
(5)新鲜制备的粗乳液立刻经动态高压微射流均质乳化,设定均质压力为80mpa,高压均质乳化次数分别为1,、2、4、6,得到4组经不同高压均质乳化次数处理的蛋白基纳米乳液(蔗糖溶液包埋柠檬精油的乳液,实验组),其中,bsa浓度c=1.0wt%、柠檬精油的体积比φ=0.1(10%(v/v))。
对照组:
为了印证本实施例中蛋白基纳米乳液制备方案的有效性,特别地,增设对比操作,以蒸馏水代替40wt%蔗糖溶液经相同处理后得到蛋白基纳米乳液(对照组的蛋白基纳米乳液)。
本实例对比了高浓度多羟基醇(40wt%蔗糖)的存在与否对bsa稳定的纳米乳液的制备过程的影响,并且通过不同次数的微射流处理,优化了蛋白基纳米乳液的制备方案。粒径分析结果表明(图1a和图1b)在40wt%蔗糖的帮助下即便通过一次微射流处理也能得到蛋白基纳米乳液(液滴粒径<200nm),充分说明了高浓度多羟基化合物的存在有利于蛋白基纳米乳液的高效制备,图1a和图1b中的实心球表示新鲜制备乳液(0d),空心球表示室温贮藏10d后的乳液,图1a和图1b中的80mpa(1)、80mpa(2)、80mpa(4)与80mpa(6)分别代表80mpa下微射流处理1、2、4或6次。同时还可以发现,随着微射流均质次数的增加,得到的蛋白基纳米乳液的水力学直径也逐渐降低,最低可低至154.9nm。即使在室温下贮藏10h,微射流处理4-6次的纳米乳液的粒径仍处于200nm范围之内,这与用蛋白质的蒸馏水溶液制备得到的乳液形成了鲜明的对比。反观用蒸馏水代替蔗糖溶液以同样方式制备得到的蛋白基乳液,多次微射流处理也无法使其粒径降至纳米级,甚至随着处理次数的增加,乳液粒径呈显著上升趋势,最高达到976nm(如表1所示),说明多次高能乳化无法实现传统蛋白基纳米乳液的制备。此外,制得的纳米乳液很不稳定,在本实例中室温下10h的储藏实验印证了这一点(表1)。表1是本发明实施例1中80mpa微射流处理bsa水溶液或bsa-40wt%蔗糖溶液包埋柠檬精油的乳液(c=1.0wt%、φ=0.1)的水合粒径(dh)。其中,dh0表示新鲜制备乳液(0d)的水合粒径;dh10表示室温贮藏10d后的乳液的水合粒径。所有数值均为平均值±标准偏差(n=3)的形式。不同的小写字母表示室温贮藏10d前后乳液dh在p<0.05水平上差异显著(横向比较);不同的大写字母表示不同蔗糖浓度或不同微射流方式下乳液dh在p<0.05水平上差异显著(纵向比较)。
表1
通过考察bsa在水溶液中经不同微射流方案处理后粒径的变化发现,不论均质强度如何,微射流处理均能引起bsa水合粒径的增加,由图3可以直观地观察到随着均质压力的增加甚至出现了粒径达1μm的bsa聚集体,图3是bsa水溶液(c=1.0wt%)在不同压力、不同次数的微射流处理下的粒度分布。这与目前流行的观点一致,即:在高压乳化的场合,反复的乳化处理过程会导致一些蛋白质(特别是球蛋白)变性,从而导致相关乳液失稳,如油滴絮凝及脂肪上浮。若将蛋白质分散于不同浓度(10wt%、20wt%、30wt%、40wt%或50wt%)的蔗糖溶液,由于多糖对蛋白质结构的保护作用,在80mpa的均质压力场中,蛋白质的三级结构几乎没有受到影响(图4),意味着多羟基醇的存在大大提高了蛋白质在高压均质过程中的构象稳定性,表2中的数据再次表明多羟基醇的存在对蛋白质维持其原有结构的积极作用,这一重要结论为实施例1的成功奠定了理论基础。图4为80mpa微射流处理6次bsa在水溶液或40wt%蔗糖溶液中三级结构的变化(内源荧光光谱的变化)。其中,λex295反映色氨酸,λex275反映酪氨酸,λex258反映苯丙氨酸。实线表示未经微射流处理,虚线表示80mpa微射流处理6次(处理1-5次前后的荧光光谱差异均不明显)。
表2是经80mpa微射流处理1次的bsa在不同蔗糖浓度的溶液中水合粒径的变化。其中peakbsadh表示bsa蔗糖溶液的粒度分布中除去蔗糖单体与蔗糖聚集体外bsa粒度分布峰计算得到的bsa水合粒径。所有数值均为平均值±标准偏差(n=3)的形式。不同的小写字母表示微射流处理前后peakbsadh在p<0.05水平上差异显著(横向比较);不同的大写字母表示不同蔗糖浓度时peakbsadh在p<0.05水平上差异显著(纵向比较)。
表2
实施例2
按照实施例1的实验组方法,制备wpi稳定的纳米乳液,除蛋白样品换作wpi粉末(乳清蛋白粉末),均质次数分别换作1次和6次,其他操作同实施例1。实施例2的对照组为只采用蒸馏水代替40wt%蔗糖,采用实施例2实验组方法得到的蛋白基纳米乳液。
按照本实施例的方案依然可以高效制得稳定的蛋白基纳米乳液(表3)。值得注意的是,由于wpi优良的起泡性,在均质过程中不可避免地形成小气泡,得到的新鲜纳米乳液的粒径略大于室温放置10小时的纳米乳。由此实施例中的对比操作无法得到纳米乳液,乳液粒径均为微米级,然而10小时的室温储存后可以明显观察到液滴平均粒径的显著下降,粒径分布图中的代表大粒径液滴的尾峰也消失了(图2a),图2a为实施例2中80mpa微射流处理1次或6次后,乳清分离蛋白(wpi)水溶液、40wt%蔗糖溶液与乳清分离蛋白(wpi)水溶液混合液分别包埋柠檬精油得到的乳液(c=1.0wt%、φ=0.1)粒度分布图;图2a和图2b中,实心球表示新鲜制备乳液(0d);空心球表示室温贮藏10d后的乳液,nb表示未均质处理的bsa溶液,40mpa(1)、60mpa(1)、80mpa(1)、80mpa(2)、80mpa(4)与80mpa(6)分别代表不同压力下微射流处理1、2、4与6次。造成这一现象最主要的原因是新鲜制备的乳液本身含有较大的油滴,在储藏过程中大油滴倾向于聚结,随后发生破乳上浮,柠檬精油与外界环境接触后挥发,从而导致乳液中小液滴的比例显著增加。
实施例3
按照实施例1的实验组方法,制备spi稳定的纳米乳液,除蛋白样品换作spi粉末(大豆分离蛋白粉末),均质次数分别换作1次和6次,其他操作同实施例1。实施例3的对照组为只采用蒸馏水代替40wt%蔗糖,采用实施例3实验组方法得到的蛋白基纳米乳液。
按照本实施例的方案依然可以高效制得稳定的蛋白基纳米乳液(如下表3所示),在高浓度蔗糖存在的条件下,新鲜制备的spi稳定的纳米乳液与wpi稳定的纳米乳液表现相似(参照图2b所示),图2b为实施例2中80mpa微射流处理1次或6次后,大豆分离蛋白(spi)水溶液、40wt%蔗糖溶液与大豆分离蛋白(spi)水溶液混合液分别包埋柠檬精油得到的乳液的粒度分布图。令人惊奇的是,在对比操作中以蒸馏水代替40wt%的蔗糖溶液,经6次80mpa高压微射流处理也能得到稳定的纳米级乳液,乳液粒径低至154.7nm(表3)。这说明选用合适的蛋白乳化剂通过传统方式也能制得较为稳定的蛋白基纳米乳液,但是采用本发明所述方法(以多羟基醇作为分子伴侣)制备蛋白基纳米乳液更具普适性,得到的乳液稳定性更好。表3是本发明实施例2-3中80mpa微射流处理1次或6次后,wpi水溶液、wpi与40wt%蔗糖溶液的混合液、spi水溶液、spi与40wt%蔗糖溶液的混合液分别包埋柠檬精油得到的乳液(c=1.0wt%、φ=0.1)的水合粒径。其中,dh0表示新鲜制备乳液(0d)的水合粒径;dh10表示室温贮藏10d后的乳液的水合粒径。所有数值均为平均值±标准偏差(n=3)的形式。不同的小写字母表示室温贮藏10d前后乳液dh在p<0.05水平上差异显著(横向比较);不同的大写字母表示不同蛋白、不同蔗糖浓度或不同微射流方式下乳液dh在p<0.05水平上差异显著(纵向比较)。
表3
实施例4
按照实施例1的实验组方法,制备bsa稳定的纳米乳液,除多羟基醇换作海藻糖,均质次数分别换作1次和6次,其他操作同实施例1。
由于wpi和spi的起泡性较强,新鲜制备得到的纳米乳液中可能混杂小气泡,从而在一定程度上影响粒径分析,因此本实施例选用bsa为蛋白样品,按照本实施例的方案经一次高压微射流均质即可高效制得稳定的蛋白基纳米乳液,提高均质次数至6次,液滴粒径降至150nm以下,所有纳米乳液在室温下贮存10小时粒径依然处于200nm范围内,说明海藻糖也可以作为一种优异的多羟基醇类分子伴侣协同高效制备蛋白基纳米乳液。
实施例5
按照实施例1的实验组方法,制备bsa稳定的纳米乳液,除多羟基醇换作甘油,均质次数换作1次,均质压力分别换作40mpa、60mpa和80mpa,其他操作同实施例1。实施例5的对照组为只采用蒸馏水代替40wt%蔗糖,采用实施例5实验组方法得到的蛋白基纳米乳液。
由于以上实施例均采用性质相近的糖类物质作为多羟基醇分子伴侣,因此本实施例特地选用理化性质与糖类成分有所差异的甘油(丙三醇)作为多羟基醇分子伴侣制备纳米乳液。结果如预期所料,在80mpa的均质压力下经过一次高压均质即可得到粒径<200nm的蛋白基纳米乳液,10h的室温贮藏实验表明该纳米乳液稳定性良好。因此,甘油也可以作为一种高效的多羟基醇类分子伴侣促进蛋白基纳米乳液的形成。
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



