判别土壤中参与硝酸盐依赖性锑氧化过程的菌种及其关键功能基因的方法与流程
 2021-02-02 17:02:03|
2021-02-02 17:02:03| 266|
266| 起点商标网
起点商标网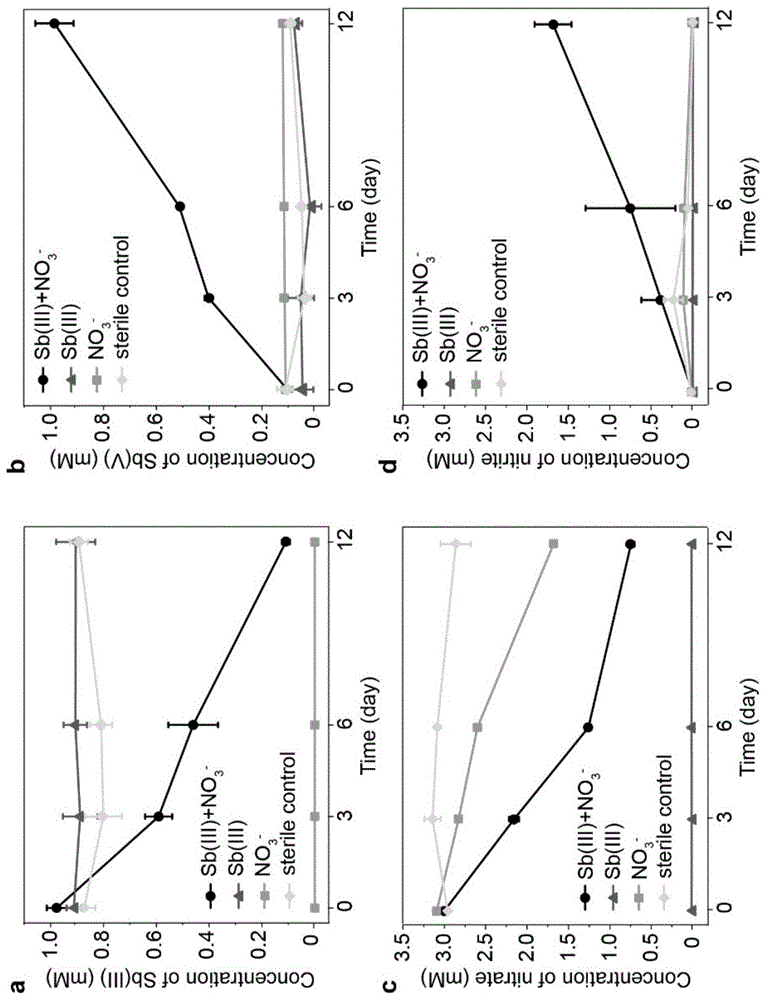
本发明属于土壤微生物生态学领域,具体涉及一种利用稳定同位素示踪-宏基因组-分箱组装联用平台,判别土壤中参与硝酸盐依赖性锑氧化过程的菌种及其关键功能基因的方法。
背景技术:
锑已被列为疑似致癌物,长期接触可对包括心、肺、肝和肾在内的各种器官系统造成损害。虽然锑在自然界中广泛存在,但采矿、冶炼和工业等人为活动大大增加了锑的释放,从而导致环境中的锑污染。
锑的两种氧化状态,即锑铁矿(sb(iii))和锑酸盐(sb(v)),是自然界中的主要形态,强烈地影响了sb的迁移率、生物利用度和毒性。例如,sb(iii)比sb(v)毒性大。因此,sb(iii)氧化可以通过将毒性较大的sb(iii)氧化为毒性较小的sb(v)来降低其毒性,这对于减少sb污染的生态毒性具有重要意义。
与广泛的生物地球化学循环研究相比,微生物介导的sb循环近年来成为关注热点。微生物对sb(iii)的氧化可能是一种有效的锑污染生物修复手段。因此,了解锑转化的微生物过程和相关功能基因具有重要的环境意义,但是目前对sb(iii)氧化微生物的了解还十分有限。尤其是与好氧sb(iii)氧化相比,厌氧sb(iii)氧化研究较少,因此其机理在很大程度上尚不清楚。在稻田、湿地等自然缺氧环境中,厌氧sb(iii)氧化比好氧sb(iii)氧化更为普遍。因此,对厌氧锑氧化菌的研究和鉴定对这一生物地球化学过程有重要意义。
中国专利申请cn201910539841.2公开了一种判别土壤中参与锑还原过程的菌种及其关键功能基因的方法,该发明利用13c-已酸和sb(v)对采集的水稻土样品进行微宇宙培育,利用超高速离心机对13c-已酸和sb(v)培育土壤的微生物总dna进行离心分层,对分层后多个浮力密度中的sb(v)还原菌基因进行实时定量pcr分析和微生物群落分析,判断该水稻土中是否含有代谢活性的已酸利用型sb(v)还原菌。
上述专利的缺陷在于:该发明利用12c-已酸和sb(v)及水稻土样品建立微宇宙体系,并待体系内所有sb(v)还原成sb(iii)后进行多次稀释富集培养,对富集培养体系中土壤的总dna建立宏基因组文库及分箱组装分析,由于进行了多次传代富集后微生物群落与原位环境存在差异,对原位环境中的功能微生物及相应的代谢通路的揭示有限。
技术实现要素:
考虑到稻田中普遍存在的缺氧条件和高浓度的硝酸盐,硝酸盐依赖性锑氧化菌可能对sb在这些环境中的循环起着重要作用。dna稳定同位素示踪(sip)技术可以在不进行分离培养的情况下将微生物特性与环境样品中的功能联系起来,从而能够更好地了解稻田土壤中与硝酸盐依赖性锑氧化生物过程有关的功能微生物群落。另外,由于现有的功能基因数据库中暂无与锑氧化功能相关的功能基因,但由于锑和砷拥有相似的化学结构,也有多项研究提出细菌可以使用相似的代谢途径来转化锑和砷,因此可以以砷氧化基因作为参考分析对象。本发明的目的在于利用稳定同位素示踪-宏基因组-分箱组装联用平台,判别土壤中参与硝酸盐依赖性锑氧化过程的菌种,揭示驱动锑氧化过程发生的关键功能基因,同时也为将来鉴定参与其他重(类)金属转化微生物的研究提供了一种先进有效的方法。
本发明的目的通过下述技术方案实现:
一种判别土壤中参与硝酸盐依赖性锑氧化过程的菌种的方法,通过微宇宙培养体系,经过饥饿培养消耗土壤自身的底物后,在体系中加入hco3-作为代谢底物,以及向体系提供sb(iii)作为电子供体,no3-作为电子受体。使培养体系中只存在一个主导的电子交换过程,即以加入的sb(iii)作为电子供体,以no3-作为电子受体,微生物依赖硝酸盐进行代谢的同时耦联驱动了锑的氧化,使sb(iii)失去电子氧化成sb(v)。
本发明对受sb(iii)胁迫下稻田土壤厌氧培养体系的sb(iii)氧化现象进行观察,利用dna-sip技术来识别能够在该培养体系中驱动sb(iii)氧化过程的微生物的系统发育信息,再利用宏基因组-分箱组装技术评估sb(iii)氧化微生物的代谢潜力,并重点分析被dna-sip确定为参与了锑氧化过程的微生物的关键功能基因。
具体地,本发明的方法包括以下步骤:
(1)采集存在锑污染的土壤,加入到无机盐培养基中,厌氧培养,直至消耗完土壤本底有机物;然后分成三组微宇宙体系,向第一组(13c+n+sb)微宇宙体系加入13c-hco3-、硝酸盐和sb(iii)进行培养,以标记并观察具有硝酸盐还原耦联锑氧化能力的微生物;向第二组(12c+n+sb)微宇宙体系加入12c-hco3-、硝酸盐和sb(iii)进行培养,以进一步确认体系中具有硝酸盐还原耦联锑氧化能力的微生物,排除第一组中因为其他原因(如atcg比例)存在于重质组分的干扰微生物;向第三组(13c+n)微宇宙体系加入13c-hco3-和硝酸盐进行培养,以排除没有参与锑氧化代谢的微生物;三组微宇宙体系培养至少60天;
在第一组(13c+n+sb)中利用13c-hco3-的硝酸盐依赖性锑氧化微生物的dna会因为13c的标记而变重,而第二组(12c+n+sb)中利用12c-hco3-的硝酸盐依赖性锑氧化微生物的dna会因为无13c的标记存在于轻质组分(用来排除第一组中因为其他原因(如atcg比例)存在于重质组分的干扰微生物),第三组(13c+n)是为了排除体系中(第一组中)能利用碳酸氢钠和硝酸盐但没有耦合锑氧化能力的菌(会有不少种类必须排除)。
所述的土壤是自然缺氧环境下的土壤,比如稻田或湿地土壤;
所述无机盐培养基的组成是:10.55g/lna2hpo4·12h2o,1.5g/lkh2po4,0.3g/lnh4cl,0.1g/lmgcl2,0.01mg/l维生素h,0.02mg/l烟酸,0.1mg/l维生素b1,0.01mg/l对氨基苯甲酸,0.005mg/l维生素b5,0.05mg/l盐酸吡哆胺,0.01mg/l氰钴胺,10μl/lhcl(25%,w/w),1.5mg/lfecl2·4h2o,0.19mg/lcocl2·6h2o,0.1mg/lmncl2·2h2o,0.07mg/lzncl2,0.024mg/lnicl2·6h2o,0.036mg/lnamoo4·2h2o,0.006mg/lh3bo3,0.002mg/lcucl2·2h2o;
所述的厌氧培养,是培养过程中向培养体系做n2吹扫;所述的厌氧培养不少于一个月;
优选地,所述各组微宇宙体系中,13c-hco3-的终浓度为0.3-0.6g/l,12c-hco3-的终浓度为0.3-0.6g/l,硝酸盐的终浓度为0.1-0.3g/l,sb(iii)的终浓度为0.1-0.2g/l;培养过程中定期(优选每12天)添加以上物质,强化促进微生物代谢,提高后续提取的含13c的dna产量,以便直接进行宏基因组测序;
所述的13c-hco3-和12c-hco3-优选采用钠盐;所述的硝酸盐优选硝酸钠;所述的sb(iii)优选采用c8h4k2o12sb2·3h2o;
(2)对培养后的三组微宇宙体系,提取其中的土壤微生物总dna,将所得dna提取物加入cscl溶液做超高速离心,收集各层离心组分;
步骤(2)所述的超高速离心是以178,000×g离心48小时;
(3)测定各层离心组分的浮力密度(buoyantdensity,bd)值,以bd值将三组微宇宙体系的土壤微生物总dna分成20-25个分层,去除各分层中的cscl,并对各层离心组分做q-pcr扩增;
以各层离心组分的bd值为横坐标,以功能基因aioa的q-pcr扩增数值为纵坐标,作图;第一组(13c+n+sb)微宇宙体系形成1个峰,bd值在1.70-1.76,为重质组分;第二组(12c+n+sb)微宇宙体系形成1个峰,bd值在1.68-1.72,为轻质组分;第三组(13c+n)微宇宙体系形成1个峰,bd值在1.68-1.72,为轻质组分;
在三组微宇宙体系的重质或轻质组分中各选择1-3个q-pcr扩增数值较高的分层,进行16srrna基因v4-v5区域的高通量测序;
(4)将得到的16srrnav4-v5区域测序数据与已有的16srrna数据库进行比对,将具有97%以上相似度的划归为一个小组(otu),分析各个otu在三组微宇宙体系中的丰度;
每个小组(otu)对应于一个不同的16srrna序列,也即对应于一种不同的细菌(微生物);
(5)在微生物群落测序结果中关注丰度较高的小组(otus),通过以下步骤确定代表硝酸盐依赖性锑氧化的微生物:
第一步,排除(13c+n)组中在重质组分明显富集的otus,由于(13c+n)组没有加入sb(iii),说明这些在重质组分富集的otus为其他同化13c-hco3-的微生物,而非参与锑氧化代谢的微生物;
第二步,在(12c+n+sb)组的轻质组分富集,且在(13c+n+sb)组重质组分富集的otus,就是具有硝酸盐依懒性锑氧化能力的微生物;这些otus所代表的微生物在微宇宙系统中发生了硝酸盐还原耦联锑氧化的过程,(13c+n+sb)组中微生物同化了体系中的底物13c-hco3-,13c使其dna“变重”,由(12c+n+sb)组的轻质组分“移动”到(13c+n+sb)组的重质组分,具有以上特性的otus则被判断为具有硝酸盐依懒性锑氧化能力的微生物。
一种判别土壤中参与硝酸盐依赖性锑氧化过程的关键功能基因的方法,包括以下步骤:
(1)建立第一组(13c+n+sb)微宇宙体系重质组分dna的宏基因组文库,获得原始测序reads,进行测序数据质控,过滤低质量数据,然后进行序列拼接,得到contigs,再进行序列比对,把contigs的独立数据集的reads进行映射用来评估其丰度,再对contigs进行binning组装,取完整度>90%和冗余度<10%的分箱(bins)进行下游分析;
所述建立宏基因组文库,优选使用illuminahiseq4000平台建立;
所述的数据质控,优选使用trimmomatic-0.36进行分析;
所述的序列拼接,优选使用megahit进行;
所述的序列比对,优选使用bowtie2进行;
所述binning组装,优选使用默认设置的concoct(版本0.4.0)进行;
(2)在宏基因组分箱(bins)中分析与锑氧化、氮循环功能相关的基因的丰度大小,由此获得与sb(iii)氧化代谢能力相关的基因,并获知在锑氧化过程中与n元素耦联作用相关的关键基因,由此更进一步了解稻田土壤中微生物驱动的硝酸盐耦联锑氧化过程的生物地球化学机制。
本发明相对于现有技术具有如下的优点及效果:
本发明利用的稳定同位素示踪-宏基因组-分箱组装联用平台,能够不依赖分离或富集培养准确判别土壤中参与了重(类)金属转化过程的微生物。利用dna-sip直接锚定群落中的关键功能微生物,避免了多次传代富集后微生物群落与原位环境存在差异,能直接对dna-sip锚定的功能微生物dna进行宏基因组分析,进一步依靠分箱组装方法,廓清稻田土壤锑氧化功能微生物类群及关键功能微生物的代谢信息,对于了解微生物驱动的锑氧化过程、锑氧化菌以及关键功能基因的认知有着重大的意义。
附图说明
图1为sip微宇宙培育体系的sb(iii)(a)、sb(v)(b)、no3-(c)和no2-(d)浓度变化示意图。
图2为不同培养时间13/12c+n+sb和13/12c+n处理的dna在不同浮力密度组分中aioa基因的相对丰度。
图3为sip微宇宙培育体系中具有不同的浮力密度dna组分的otu相对丰度气泡图(a)及在13/12c+n+sb和13/12c+n处理中丰度线性判别分析(b)。
图4为具有锑氧化潜能微生物的基因组bins和read深度的体统发育从属关系示意图。
图5为锑氧化微宇宙体系的dna宏基因组-分箱组装分析中,与锑氧化、氮循环基因相关的热图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例
一种判别土壤中参与硝酸盐依赖性锑氧化过程的菌种的方法,包括以下步骤:
(1)样品采集和处理
土壤样本采集于湖南锡矿山锑矿附近,长期受锑污染的稻田土壤已经形成对微生物群选择性,可能富集了锑代谢微生物,在地表30-40厘米深的稻田土壤中采集样本,低温保存运送至实验室。
(2)建立dna-sip微宇宙培育体系
用采集回来的稻田土壤样品建立三组微宇宙体系,微宇宙体系用50ml的灭菌血清瓶建立,在瓶内加入约2g土壤以及40ml无机盐培养基(mineralsaltsmedium,msm),在瓶内注入n2吹扫使微宇宙体系保持厌氧状态;
msm溶液组成:10.55g/lna2hpo4·12h2o,1.5g/lkh2po4,0.3g/lnh4cl,0.1g/lmgcl2,0.01mg/l维生素h,0.02mg/l烟酸,0.1mg/l维生素b1,0.01mg/l对氨基苯甲酸,0.005mg/l维生素b5,0.05mg/l盐酸吡哆胺,0.01mg/l氰钴胺,10μl/lhcl(25%,w/w),1.5mg/lfecl2·4h2o,0.19mg/lcocl2·6h2o,0.1mg/lmncl2·2h2o,0.07mg/lzncl2,0.024mg/lnicl2·6h2o,0.036mg/lnamoo4·2h2o,0.006mg/lh3bo3,0.002mg/lcucl2·2h2o;
经过一个月的饥饿培养,消耗土壤本底底物,然后分成三组:
向第一组(13c+n+sb)微宇宙体系加入0.672g/l(终浓度)13c-nahco3、0.255g/l(终浓度)的nano3和0.632g/l(终浓度)c8h4k2o12sb2·3h2o进行培育,向第二组(12c+n+sb)微宇宙培育体系加入0.672g/l(终浓度)12c-nahco3、0.255g/l(终浓度)的nano3和0.632g/l(终浓度)c8h4k2o12sb2·3h2o进行培育,向第三组(13c+n)微宇宙培育体系加入0.672g/l(终浓度)13c-nahco3和0.255g/l(终浓度)的nano3进行培育,并每12天对相应微宇宙体系原料物质进行再次补充。
在培育的第0天、30天和60天对三组微宇宙体系取样,用土壤dna提取试剂盒进行土壤微生物总dna的提取。
另外,利用连续流动分析仪(san++,skalar,breda,holland)对三组微宇宙体系上清液中的no3-和no2-浓度进行定量,用高效液相色谱-氢化物发生-原子荧光分析仪(hplc-hg-afs)对体系整个培养过程中溶液的sb(iii)和sb(v)浓度进行测定,观察到只有同时添加了sb(iii)和no3-的微宇宙体系里存在sb(iii)氧化成sb(v)的现象,即sb(iii)浓度下降,sb(v)浓度上升;同时也出现no3-还原为no2-现象,即no3-浓度下降,no2-浓度上升(图1)。而没有添加sb(iii)或no3-或灭菌的对照组中没有发生以上现象,说明同时添加了sb(iii)和no3-的活性微宇宙中发生了微生物驱动的硝酸盐依赖性锑氧化过程。
(3)利用超高速离心机对dna-sip培育体系的土壤微生物总dna进行离心分层
取10μgdna提取物放入5.1ml超速离心专用快封管中,加入cscl溶液至接近装满离心管,并用tris-edta(ph值8.0)和cscl溶液调整离心管内bd值至1.73g/ml(bd值用折光仪测量),随后封管。把离心管放入超速离心机中以178,000×g的离心力在20℃下超速离心48小时,取出离心管放入组分回收装置中,用固定流速泵对组分回收装置中的离心管混合液进行分层收集回收组分,每层大概210μl共24层。
(4)对每个dna分层组分进行bd值测定以及pcr扩增
测定各层回收组分的bd值,然后用核酸助沉剂和乙醇沉淀去除cscl,得到净化后的回收组分。
由于锑和砷拥有相似的化学结构,细菌可以使用相似的代谢途径来转化锑和砷,目前还没有明确的锑氧化基因,因此以砷氧化基因作为参考分析对象。利用已知的砷氧化基因引物aioaf(5’-ccacttctgcatcgtgggntgyggnta-3’)和aioar(5’-ggagttgtaggcgggcckrttrtgdat-3’)对回收组分进行q-pcr扩增。结果如图2所示:
第一组(13c+n+sb)微宇宙体系形成1个峰,bd值在1.70-1.76,为重质组分;第二组(12c+n+sb)微宇宙体系形成1个峰,bd值在1.68-1.72,为轻质组分;第三组(13c+n)微宇宙体系形成1个峰,bd值在1.68-1.72,为轻质组分;
(5)挑选多个浮力密度组分dna进行16srrna测序
根据bd值及功能基因q-pcr的作图确定dna重质和轻质组分在全组分分层中的分布,在第一组(13c+n+sb)和第三(13c+n)组微宇宙体系的重质组分中分别选择3个分层,第二(12c+n+sb)组微宇宙体系轻质组分中选择3个分层,对以上分层进行16srrna基因v4-v5区域的高通量测序。
将得到的测序数据与已有的16srrna数据库进行比对分析以及归类操作,将序列按照彼此的相似性分归为许多小组,一个小组就是一个操作分类单元(otu),通常按97%以上的相似度,每个otu对应于一个不同的16srrna序列,也就是每个otu对应于一个不同的细菌(微生物)种。
(6)通过dna-sip对稻田土壤中锑氧化活性细菌群落的分析
通过otu分析,分析样品中的微生物群落多样性和不同微生物群种的丰度。图3为群落中丰度最高的前25个otu。
在(13c+n+sb)组微宇宙体系中13c-dna富集的otu可能具有硝酸盐还原耦联sb(iii)氧化的能力。然而,由于nahco3还可以被很多其他的微生物同化,因此需要对比(13c+n+sb)组与(13c+n)组微宇宙体系,以及对比(13c+n+sb)组与(12c+n+sb)组微宇宙体系排除干扰,来判断参与sb(iii)氧化过程的细菌。
由于体系中只存在硝酸盐还原耦联锑氧化为主导的电子交换过程,锑氧化体系中的参与氧化过程的微生物利用了13c-nahco3作为底物进行代谢,使其dna得到了13c的标记,在dna超速离心过程中13c在重质组分中聚集,因此在第一组(13c+n+sb)微宇宙体系重质组分中富集的otus系统发育信息所代表的微生物可能具有硝酸盐还原耦联锑氧化发生的能力;而在第二组(12c+n+sb)微宇宙培育体系中,由于加入的是12c,因此硝酸盐还原耦联锑氧化发生的微生物otus则在轻质组分中富集;在第三组(13c+n)微宇宙培养体系重组分中富集的otus被判断能同化nahco3的微生物的系统发育信息,但由于体系中不含有锑,因此这些微生物不一定能发生硝酸盐还原耦联锑氧化反应。
判断方法为:
第一步,排除(13c+n)组在重质组分明显富集的otus,由于(13c+n)组没有加入sb(iii),这些在重质组分富集的otus为其他同化13c-nahco3的微生物,而非参与锑氧化代谢的微生物;
第二步,排除上述干扰后继续观察,otus在(12c+n+sb)组的轻质组分富集,且在(13c+n+sb)组的重质组分富集,说明这些otus所代表的微生物在微宇宙系统中发生了硝酸盐还原耦联锑氧化的过程,(13c+n+sb)组中微生物同化了的nahco3因为13c使nahco3“变重”,所以由(12c+n+sb)组的轻质组分“移动”到(13c+n+sb)组的重质组分,具有以上特性的otus则被判断为具有硝酸盐还原耦联sb(iii)氧化能力的微生物。
如图3所示,根据上述判断方法,对比微生物在(13c+n+sb)、(12c+n+sb)、(13c+n)三组微宇宙体系的dna-sip群落otu结果,判断出azoarcussp.、azospirasp.和chelativoranssp.具有上述特征,对这些锑氧化代谢菌在dna浮力密度组分中的丰度分布进行分析,发现硝酸盐依赖性锑氧化体系中这3种锑氧化菌都同化了13c-nahco3,使得自身dna“变重”,从而出现在浮力密度重层,因此在浮力密度重层中的这些锑氧化菌的分布和轻层明显不同。因此推断为参与锑氧化代谢的细菌。
一种判别土壤中参与硝酸盐依赖性锑氧化过程的关键功能基因的方法,包括以下步骤:
(1)重质组分dna样品的宏基因组分析,并进行分箱组装
在illuminahiseq4000平台建立含锑氧化功能微生物的(13c+n+sb)组重质组分dna的宏基因组文库,获得原始测序reads,利用trimmomatic-0.36进行测序数据质控,过滤低质量数据,然后使用megahit进行序列拼接,得到contigs,再使用bowtie2进行序列比对,把contigs的独立数据集的reads进行映射用来评估其丰度,再对contigs使用默认设置的concoct(版本0.4.0)进行binning组装,取完整度>90%和冗余度<10%的bins进行下游分析。
(2)宏基因组-分箱组装揭示锑氧化代谢相关的功能基因的分析
利用宏基因组分析研究sb(iii)氧化微生物群落的代谢潜力,特别针对那些通过dna-sip鉴定的锑氧化菌。
经过分析,从宏基因组数据中获得了15个高质量的bins,这些bins属于proteobacteria、gemmatimonadetes和verrucomicrobia三个门类(图4),在这些bins中也检测到在dna-sip中推断的锑氧化菌(完整度>95%,受污染程度<5%),如azoarcussp.(bin9)、azospirasp.(bin10)和chelativoranssp.(bin14)(图4)。
在宏基因组bins中分析与氮循环、锑氧化等相关的功能注析基因的丰度大小(图5),另因现有数据库中没有与锑循环相关的功能基因,但由于锑和砷拥有相似的化学结构,已经有研究提出细菌可以使用相似的代谢途径来转化锑和砷,因此以砷循环基因作为参考分析对象。由此获得与sb(iii)氧化代谢能力相关的基因,并获知在锑氧化过程中与氮等元素耦联作用的生物地球化学循环相关关键基因,由此更进一步了解稻田土壤中微生物驱动的硝酸盐耦联锑氧化过程的生物地球化学机制。
锑氧化基因分析:由图5的分箱遗传注释表明,大多数分箱(除与devosia相关的bin6和与gemmatimons相关的bin8及bin15外)含有aioa基因,而仅在三个分箱(与thauera相关的bin4、与vulgatibacterae相关的bin12和与chelativorans相关的bin14)中观察到aiob基因(图5)。
锑氧化耦联的氮循环基因分析:对与反硝化作用有关的基因(包括负责no3-、no2-、no-和n2o还原的基因)分析发现:总体来说硝酸盐还原基因(narg、narz、nari、napa等)是所有分箱中检测到的最丰富的基因,其次是no2-还原基因(nirk、nirs等)和no还原基因(norb、norc等),而编码n2o还原酶的基因(nosz)在8个分箱中检测到(图5)。其中,ramlibacter相关联的bin3、ramlibacter相关联的bin9、azospira相关联的bin10和anaeromyxobacter相关联的bin13被观察到包含了从no3-到n2整个反硝化过程的驱动基因(图5)。
此结果揭示了稻田土壤中潜在的硝酸盐依赖性锑氧化菌及其功能基因,拓展了目前对稻田土壤锑氧化菌的生态功能以及微生物驱动的锑的地球化学循环过程的认知。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



