嵌合FC受体结合蛋白及其用途的制作方法
 2021-02-02 17:02:38|
2021-02-02 17:02:38| 296|
296| 起点商标网
起点商标网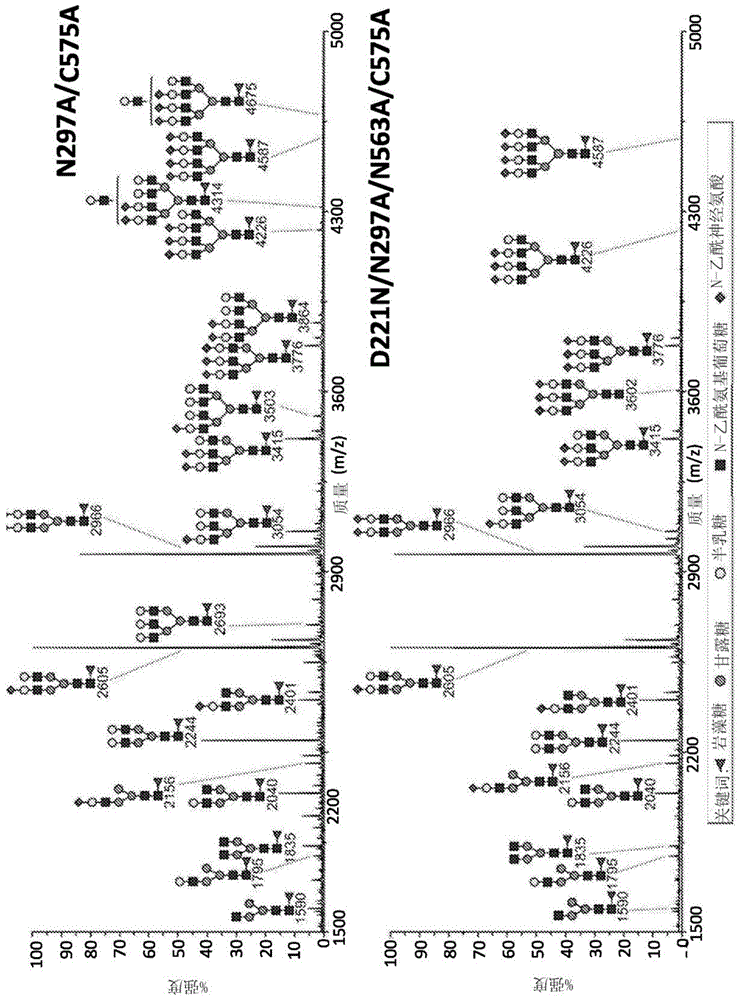
本发明涉及蛋白质,以及包含此类蛋白质的组合物。本发明还涉及此类蛋白质和组合物的医学用途。特别地,本发明的蛋白质或组合物可用于预防或治疗自身免疫性疾病或炎性疾病,或用于预防或治疗通过唾液酸依赖性受体的结合介导的疾病,或用作疫苗或抗癌剂。本发明还涉及使用这样的蛋白质预防或治疗自身免疫性疾病或炎性疾病或通过唾液酸依赖性受体的结合介导的疾病的方法。本发明还涉及编码所述蛋白质的核酸,以及制造所述蛋白质的方法。
背景技术:
自身免疫性疾病(ad)很常见,仅在美国就有五千万公民受到影响。静脉注射免疫球蛋白(ivig)治疗涉及施用纯化的免疫球蛋白g,是ad的最常见治疗方法之一,并获得了美国食品药物管理局(fda)批准,用于治疗多种疾病,例如特发性血小板减少症(itp)、川崎病(kawasaki'sdisease)、格林-巴利(guillain-barré)、皮肌炎和慢性炎症性脱髓鞘性多发性神经病。
自1980年以来,全球ivig消耗量增长了300倍以上,目前每年消耗100吨。nhs和全球范围内ivig的供应严重受限,这意味着急需这种药物的患者通常被剥夺了该药物的使用。这种药物还存在明显的临床局限性,其制造依赖于人类供体,并且<5%的注射ivig(正确糖基化的和/或寡聚-fc)具有治疗活性,因此当用于特发性血小板减少性紫癜(itp)时,需要高剂量(2g/公斤)。因此,ivig非常昂贵,并且由于负荷过量蛋白质而引起的不良事件并不罕见。
而与自身免疫性疾病相关的igg的一些效应机制可能是f(ab′)2介导的,例如,通过抗独特型相互作用阻断/中和受体、细胞因子、过敏毒素和致病性自身抗体,许多抗炎功能被认为是由fc部分介导的。它们包括fcrn饱和、fcγr表达的阻断和调节、树突状细胞、b细胞和t调节细胞功能的调节以及补体成分的阻断/清除。ivig在体内注射时通过与低亲和力抑制性受体结合并形成免疫复合物(ic)和/或二聚体来抑制有害炎症,从而使ivig与这些受体以更高的强度(亲和力)相互作用,从而介导更有效的抗炎效果。
上面提到的问题已经导致了许多尝试来生产能够大规模表达、可以用作诸如ivig的疗法中人igg的替代品、用于治疗自身免疫性疾病和炎性疾病的人工制剂。
迄今为止已描述的此类人工制剂的实例包括“sif”(fc受体的选择性免疫调节剂),例如momenta制造的sif-3、辉瑞制造的“stradomers”和本发明人生产的基于免疫球蛋白的杂合蛋白“hexa-fc”。对以这种方式生产的每种分子进行了设计,以促进寡聚结构的形成,所述寡聚结构并入以高亲和力与经典和非经典fc受体(包括fcγri、fcγriia、fcγriib、fcγriiia、fcrl5),和非经典受体(包括dc-sign)结合的结合结构域。
细胞还携带各种受体,这些受体依赖于包含唾液酸的聚糖来结合。此类唾液酸依赖性受体的实例包括siglec-1和siglec-2。已知许多疾病是通过与这些唾液酸依赖性受体结合而介导的。例如,许多感染因子(例如逆转录病毒)会与细胞结合,并通过与细胞的唾液酸依赖性受体结合而引起相关感染。这些受体在临床上也涉及神经病理学的控制。
多种证据表明,糖基化对于驱动igg的抗炎或促炎能力至关重要65。fc中唯一可用的碳水化合物连接位点(asn-297)的糖基化对于与1型受体(fcγ)和2型受体(聚糖依赖性)的相互作用至关重要,但也用于驱动与补体级联反应的相互作用30,2,66。
在人类中,输注fc片段足以缓解儿童的特发性血小板减少性紫癜(itp),证明了fc在体内的治疗作用5。fc的这些抗炎特性在igg脱糖基化后消失,并且已经确定,一系列带有唾液酸化的fc的igg对控制动物模型中的炎症具有重要作用6,7。较高的唾液酸化水平还会导致血清保留时间更长8,9,并且在人和小鼠中的研究表明,igg流入和流出中枢神经系统(cns)依赖于聚糖和唾液酸10-15。
因此,唾液酸化的fc的功效诱使人们去修饰asn297上现有的聚糖,通过化学手段或通过在fc蛋白主链上进行诱变程序,破坏蛋白质-asn297-碳水化合物界面(16-18)。但是,对现有聚糖进行化学修饰非常昂贵,且依赖于人类fc的可持续来源,而对fc进行诱变或在糖苷酶缺陷型/转基因细胞系中表达,对于增强asn297唾液酸化至与fcγr的结合亲和力显著增强所需的水平方面,几乎没有改善17,18。最近,已显示,共同施用两种糖基转移酶fc融合蛋白可以将内源性igg转化为唾液酸化的抗炎igg,从而以血小板依赖性方式减弱动物模型中的自身免疫疾病19。
尽管体内酶促唾液酸化可以绕开许多与化学或诱变方法生产唾液酸化igg有关的技术问题,但它可能不适用于所有临床环境,例如在神经系统疾病(例如视神经脊髓炎)中,该疾病的目标部位通常没有血小板,并且两种不同的fc融合体需要同时穿过血脑屏障。这种方法还存在脱靶聚糖修饰的风险,以及长期施用fc融合蛋白的已知免疫原性20。
迄今为止,诱变研究还受到另外两个方面的限制。侧链变化通常仅限于丙氨酸或丝氨酸,功能研究主要限于fcγr结合研究21,22。因此,更彻底地探索在fc中引入额外的n-聚糖位点可能会如何影响与fcγr和其他非典型fc-聚糖受体(包括siglecs和c型凝集素)结合的变化,具有学术兴趣和潜在的临床价值。
人igg1-fc通常不结合聚糖受体,因为与asn-297连接的聚糖大部分埋在由ch2-ch3同型二聚体形成的腔内26,27。通过赋予位于下部铰链的fcγr结合区的构象变化,在asn-297上连接的聚糖的位置和含量还能够调节fc与经典fcγr结合的亲和力28。在此,本发明人表明通过诱变程序,破坏二硫键,同时增强igg1-fc中的n-联糖基化,可以克服asn-297定向受体结合的这些局限性。
技术实现要素:
根据本发明的第一方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段(tailpiece)区,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,以去除形成非固有(extrinsic)二硫键的半胱氨酸残基,并且其中每条多肽链都包含至少一个糖基化位点。这些蛋白质在本文中称为“半胱氨酸残基分子/蛋白质”或“半胱氨酸突变体”。非固有二硫键是指在不同的多肽链之间形成的二硫键(例如与伴侣多肽链或另一条多肽链(例如来自不同单体的多肽链)形成的链间二硫键)。它不包括形成链内二硫键的半胱氨酸残基。为了避免疑问,显然,在铰链区中可能存在形成链间连接的半胱氨酸,实际上,这是将两条多肽链保持在一起的一种方式。
适当地,本发明的蛋白质缺少与seqidno:1的残基248(该残基又与人igm尾区的残基575相对应)相对应的残基上的半胱氨酸。
适当地,本发明的蛋白质缺少hexa-fc分子中存在的seqidno:1的位置89(该位置对应于人igg的残基309)的半胱氨酸残基。
适当地,本发明的蛋白质缺少与seqidno:1的残基89和248相对应的各位置上的半胱氨酸残基。
适当地,本发明的蛋白质在这些区域之一中包含额外的糖基化位点,在衍生该区域的天然序列中不存在所述额外的糖基化位点。在一个实施方案中,所述额外的糖基化位点在铰链区中。合适地,所述额外的糖基化位点位于铰链区的氨基末端。合适地,铰链区中的额外的糖基化位点在对应于seqidno:1的残基1(其又对应于人igg铰链区的残基221)的残基上。
“糖基化位点”是指可以容纳聚糖(例如糖)的连接的氨基酸。糖基化是共翻译和翻译后修饰的一种形式。聚糖在膜和分泌蛋白中起多种结构和功能作用。在n-联糖基化中,糖通过蛋白质上天冬酰胺或精氨酸侧基的氮(nh)连接。在o-联糖基化中,糖通过羟基基团(oh)上的氧与丝氨酸、苏氨酸或酪氨酸连接。n-联糖基化序列子(sequon)由asn-x-thr/ser具体说明,其中x是脯氨酸以外的任何氨基酸。没有o-联氨基酸共有序列。天然igg1的fc中没有o-联连接的聚糖。然而,iga1的铰链序列可以在丝氨酸或苏氨酸上被o-糖基化。这些o-联聚糖因此可以被末端唾液酸化。
合适地,本发明蛋白质的糖基化位点是天冬酰胺或精氨酸侧链的氮,n-联聚糖与其连接或可以与其连接。
根据本发明的第二方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链都包含免疫球蛋白g重链恒定区、免疫球蛋白尾段区和铰链区,其中每条多肽链的氨基酸序列都在n-末端(例如asn-221)或接近n-末端具有糖部分,并且在c-末端(例如asn563或asn573)或接近c-末端具有糖部分。此类分子在本文中也称为“血凝素结合蛋白”或“双糖分子”。接近n-或c-末端是指在末端的约12个残基内,例如在8个残基内、在5个残基内或在3个残基内。在一个具体的实施方案中,氨基末端糖部分连接至位于+1至+12位置(包括端值)的氨基酸。在一个具体的实施方案中,羧基末端糖部分连接至位于-12至-3位置(包括端值)的氨基酸。+1至+12位(包括端值)是指氨基酸残基位于多肽n末端的第一个至第十二个残基(包括端值)。-12至-3(包括端值)是指氨基酸残基位于多肽c末端的第12个至第3个残基(包括端值)。
根据本发明的第三方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含免疫球蛋白g重链恒定区和免疫球蛋白尾段,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而少具有至少两个糖基化位点。这些蛋白质在本文中也称为“糖基化修饰蛋白质”。
根据本发明的第四方面,提供了一种组合物,其包含根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质。在一个特定的实施方案中,其中掺入所述组合物中的本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质的至少50%,例如至少75%或至少95%为单体形式。合适地,所述组合物是药学上可接受的制剂,其包含本发明的蛋白质和至少一种药学上可接受的载体。
根据本发明的第五方面,提供了根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质,其用作药物。本发明第五方面所使用的蛋白质可以按照本发明第二方面以组合物的形式提供。
本发明的蛋白质或组合物可以用作预防和/或治疗自身免疫性疾病或炎性疾病的药物。在说明书的其他地方考虑了此类疾病的合适实例。
或者,本发明的蛋白质或组合物可以用作预防和/或治疗通过结合唾液酸依赖性受体介导的疾病的药物。在一个实施方案中,受体可以选自由以下组成的组:siglec-1、siglec-2、siglec-3、siglec-4、cd23、dec-1、dec-2、dc-sign、clec-4a、clec-4d、mbl、mmr和dec-205。如说明书中其他地方所考虑的,此类疾病的合适实例包括逆转录病毒感染。在一个实施方案中,受体可以选自由以下组成的组:siglec-1、siglec-2、siglec-3和siglec-4。
或者,本发明的蛋白质或组合物,特别是根据本发明第二方面的蛋白质或组合物,可以用作预防和/或治疗通过结合血凝素受体介导的疾病(包括病毒感染)的药物。在n末端(例如asn-221)或接近n末端处具有糖部分并且在c末端(例如asn563或asn573)或接近c末端处具有糖部分的本发明的分子可以用作病原体阻断剂,特别是阻断唾液酸依赖性病原体,例如唾液酸依赖性病毒,例如流感病毒(flu)和新城疫病毒。“血凝素结合蛋白”特别适合用于治疗或预防由依赖唾液酸受体相互作用的病原体介导的疾病。
发明人发现,c575a突变体(包含两个糖,包括asn563处的尾部糖)以及d221n/c575a(存在所有糖)均不抑制血凝反应。
病毒(例如flu)不断突变并发展出对疫苗的耐药性,例如中和抗体。然而,不太可能发生聚糖结合位点的突变,或者如果发生了,它们将仅以非常低的频率出现,因为这种突变会抑制重要的病毒功能,例如进入宿主细胞。无法进入宿主细胞的病毒很可能会被免疫系统清除。因此,能够阻断这些唾液酸受体的分子可以用作病原体阻断剂。
唾液酸化的碳水化合物在脊椎动物中普遍表达,并与多种病原体结合,包括副流感病毒、副粘病毒、正呼肠孤病毒属(orthoreoviruse)、人sars(cov)、诺如病毒、肠病毒、轮状病毒和腺病毒。
这些聚糖含有唾液酸,通常在n-聚糖、o-聚糖和糖鞘脂的分支末端,它们表现出高度的多样性。除了将唾液酸连接到链中随后的碳水化合物残基的不同糖苷键类型以外,这种多样性还来自于可能的唾液酸修饰,例如乙酰化、甲基化、羟基化和硫酸盐化。尽管与半乳糖(gal)或n-乙酰半乳糖胺(galnac)连接的α2,3和α2,6糖苷键是在这些唾液酸聚糖结构中最常见的类型。在某种程度上,病毒宿主范围的特异性可以由糖苷键类型决定,例如在流感病毒中所见。
已经表明,人甲型流感病毒优先结合在末端唾液酸和gal之间具有α2,6键的唾液酸化聚糖。另一方面,禽病毒偏爱结合在该位置具有α2,3键的聚糖。本发明的分子包含此类唾液酸化的键,因此可以被这些类型的病毒结合,如本文以来自甲型流感的血凝素所举例说明的。许多其他病原体,包括细菌、真菌、寄生虫,也结合唾液酸化的聚糖以进入或引起疾病,因此,本文所述的分子据预测对于这些病况也具有治疗益处。
这些发现表明,本发明在空间上分离的唾液酸化的fc片段蛋白因此可以作为病原体宿主细胞相互作用的阻断剂而具有治疗用途。但是,它们也可能对感染后有益。流感通常与致命的细菌性肺炎有关。有趣的是,这些细菌(例如b组链球菌和肺炎链球菌)具有暴露的唾液酸化被膜,可以直接结合副流感病毒,从而相互促进它们进入体内并在体内传播(tong等人,frontcellinfectmicrobiol.2018aug17;8:280.doi:10.3389/fcimb.2018.00280.ecollection2018)。因此,结合和/或阻断唾液酸受体的本发明蛋白质可以阻断这种相互作用,并因此帮助机体在感染流感时遏制(contain)对死亡率有重大贡献的细菌。
阻断剂可以通过两种方式工作。与流感一样,通过结合对α2,3唾液酸具有亲和力的分子或通过结合人类受体,从而阻止唾液酸化的病原体(例如上述细菌)进入。
发明人已经注意到,asn221和asn563处的糖彼此间隔大约
dna支架的使用表明,以20-100距离呈现合成的非哺乳动物细胞衍生的唾液酸-lacnac配体的二价支架在抑制病毒的血凝反应方面与较大的支架一样有效,或者通常更有效(bandlow等人jacs139:16389-16397,2017)。此类支架显示,仅使用两个糖配体就可以实现比单价结合提高1360倍的效果,前提是这些糖必须以52-59的距离排列,从而同时结合ha三聚体中三个结合位点中的两个(bandlow等人hembiochem.20(2):159-165,2019)。尽管基于dna的支架可以使得待确定的唾液酸-lacnac配体的排列得以确定,但是基于dna的材料比fc的刚性更高,并且不易于制造或在体内使用。这些相同的研究还暴露了其他间隔基(包括基于peg的间隔基)的固有局限性(尽管端到端的长度相似)。本发明的fc分子将不会具有与dna支架相同的缺点。
不希望受到理论的束缚,这些分子中暴露的糖部分因此可能能够阻断唾液酸结合结构域,从而阻止进入唾液酸依赖性病毒(如flu和新城疫病毒)或其他唾液酸依赖性病原体。如上所述,它们还可能阻断肺炎相关细菌与副流感病毒之间的相互作用,从而阻碍细菌进入细胞。
介导可以使用这些分子来治疗或预防的疾病或感染的唾液酸依赖性病原体的实例包括:革兰氏阳性菌,例如肺炎链球菌、猪链球菌、无乳链球菌、脑膜炎奈瑟氏球菌、大肠杆菌k1和空肠弯曲菌;或革兰氏阴性菌,例如铜绿假单胞菌、流感嗜血杆菌、杜克雷嗜血杆菌(haemophilusducrey)、幽门螺杆菌(helicobacterpylori)、嗜肺军团菌(legionellapneumophila)、多杀性巴斯德氏菌(pasteurellamultocida)、肠沙门氏菌和霍乱弧菌;其他细菌,例如犬新孢子虫;寄生虫,例如恶性疟原虫、克氏锥虫、刚地弓形虫(toxoplasmagondii)和杜氏利什曼原虫(leishmaniadonovani);和病毒,例如流感病毒、猪繁殖与呼吸综合征病毒、轮状病毒、新城疫病毒、冠状病毒(包括mers和sars)和hiv-1(82见表1),以及下面列出的病毒。roy和mandal86还报告,杜氏利什曼原虫(leishmaniadonovani)通过选择性利用siglecs并损害先天性免疫臂,从而利用唾液酸在巨噬细胞中进行结合和吞噬作用。
还参见matrosovich等人,topcurrchem367:1-28,2015;mikulak等人frontiersinimmunology.vol.8:article314,2017,doi:10.3389/fimmu.2017.00314;wasik等人trendsinimmunology.24(12):991-1001,2016;dietrich等人,proteinscience.26:2342-2354,2017;tong等人,frontcellinfectmicrobiol.2018aug17;8:280.doi:10.3389/fcimb.2018.00280.ecollection2018;tong等人,cellmicrobiol.2018apr;20(4).doi:10.1111/cmi.12818.epub2018jan16;khatua等人indianjmedres.138:648-662,2013;和varki.trendsinmolmed14(8):351-360,2008。
合适的病毒包括:正粘病毒科,例如流感病毒;冠状病毒科,例如牛冠状病毒;副粘病毒科,例如新城疫病毒和风疹病毒(rubulaviruses)(腮腺炎);杯状病毒科,例如诺如病毒;小rna病毒科,例如人肠病毒;呼肠孤病毒科,例如轮状病毒;多瘤病毒科,例如默克尔细胞多瘤病毒(merkelcellpolyomavirus),其可能导致人类皮肤癌;以及腺病毒科,例如ad37,其导致人眼角膜结膜炎。
在一个具体的实施方案中,介导可以使用本发明的蛋白质或包含所述蛋白质的药物组合物来治疗或预防的疾病或感染的唾液酸依赖性病原体包括:肺炎链球菌、猪链球菌、无乳链球菌、脑膜炎奈瑟氏球菌、大肠杆菌、空肠弯曲菌、铜绿假单胞菌、流感嗜血杆菌、杜克雷嗜血杆菌、幽门螺杆菌、嗜肺军团菌、多杀性巴斯德氏菌、肠沙门氏菌、霍乱弧菌、犬新孢子虫、恶性疟原虫、克氏锥虫、刚地弓形虫、杜氏利什曼原虫、流感病毒、猪繁殖与呼吸综合征病毒、轮状病毒、副粘病毒(例如新城疫病毒和风疹病毒)、诺如病毒、肠病毒、轮状病毒、多瘤病毒(例如默克尔细胞多瘤病毒)、冠状病毒(包括mers和sars)、腺病毒(例如ad37)和慢病毒(例如hiv-1)。
根据本发明的第六方面,提供了一种预防或治疗自身免疫性疾病或炎性疾病的方法,该方法包括向需要这种预防或治疗的受试者提供治疗有效量的根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质。受试者可以是人类受试者。
根据本发明的第七方面,提供了一种预防或治疗通过(i)唾液酸依赖性受体的结合,和/或(ii)fcγ受体的结合介导的疾病的方法,该方法包括向需要这种预防或治疗的受试者提供治疗有效量的根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质。合适地,受试者是人类。在一个实施方案中,唾液酸依赖性受体可以选自由以下组成的组:siglec-1、siglec-2、siglec-3、siglec-4、cd23、dec-1、dec-2、dc-sign、clec-4a、clec-4d、mbl、mmr和dec-205。在一个实施方案中,fcγ受体选自由以下组成的组:fcγri、fcγriia、fcγriib、fcγriiia和fcγriiib。在一个实施方案中,本发明的蛋白质能够结合fcγriiia和c1q。
疾病可以是感染、癌症或自身免疫性疾病。疾病可能是流感或逆转录病毒感染。
包含n563a取代(例如n563a/c575a或c309l/n563a/c575a)并形成多聚体的分子可能适用于治疗癌症,尤其是如果引入mab或其他抗原结合支架的情况下。
其他合适的分子是在221位具有asn(例如d221n/c309l/n297a/c575a和d221n/c575a)的那些分子。由于这两种突变体不结合fcγr,因此它们可能特别适用于预防例如流感的感染,因为它们会阻止结合,而不会干扰中和性igg,中和性igg能够通过fcγriiia依赖性adcc清除病毒。
本发明的第五、第六或第七方面的医学用途或治疗方法可以在静脉内免疫球蛋白(ivig)或皮下免疫球蛋白(scig)疗法中或鼻内或气雾剂递送中使用本发明的蛋白质来治疗或预防流感或其他感染。
根据本发明的第八方面,提供了编码根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质的核酸。
根据本发明的第九方面,提供了一种生产根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质的方法,该方法包括在宿主细胞中表达根据本发明第六方面的核酸。
在一个具体的实施方案中,宿主细胞是中国仓鼠卵巢(cho)细胞。
具体实施方式
本发明基于发明人的令人惊讶的发现,即,去除igg重链恒定区和尾段区通过二硫桥(不同于通过能够与伴侣多肽形成二硫桥的铰链区)共价键合另一条多肽的能力,特别是igm尾段中半胱氨酸的缺失,可以导致嵌合蛋白与i型和ii型受体结合的能力增强,特别是如果嵌合蛋白的多肽链也发生了突变,以在氨基末端或接近氨基末端处引入了糖基化位点(例如d221n突变)时。这对其例如作为ivig、scig和疫苗使用具有重要的治疗意义。此外,对一级序列的改变能够使蛋白质在生理条件下为单体。如本文所述,本发明的半胱氨酸残基蛋白显示出与低亲和力抑制性fcγ受体和聚糖受体的结合增强,可用于治疗或预防疾病。
分子与聚糖受体(特别是树突状细胞特异性细胞间粘附分子-3-捕获非整合素(dc-sign))结合的能力与ivig或scig中的治疗效用有关。以前已经发现,不到5%的天然单体igg分子以允许它们与dc-sign相互作用的方式正确糖基化,因此使这些分子不适合用于治疗目的。
本发明的fc受体结合分子对各种唾液酸依赖性受体如sig-1、sig-2、sig-3、sig-4和cd23具有增加的亲和力,就结合这些受体的能力而言,这是有利的。已显示,现有技术中先前描述的许多寡聚或聚合fc受体结合分子可以激活补体级联。由于不利后果(例如过敏性休克)的风险,这在潜在的治疗分子中是一个显著的缺点。令人惊讶地,本发明的某些蛋白质不导致补体级联的激活(参见表1)。
令人惊讶地,本发明的特定分子(例如,糖基化修饰蛋白质)表现出与c1q和fcγriiia的显著结合。与fcγriiia或c1q的结合对于激活人nk细胞中抗体依赖性细胞介导的细胞毒性(adcc)至关重要。本发明的糖基化修饰蛋白质可以容纳一种或多种有效载荷(payload)。在有效载荷能够结合癌症抗原的实施方案中,例如,如果有效载荷是免疫球蛋白结合蛋白(例如fab、f(ab’)2、scfv或纳米抗体等)或非免疫球蛋白支架蛋白(例如在skriec等人,trendsbiotechnol.2015jul;33(7):408-18.doi:10.1016/j.tibtech.2015.03.012.epub2015apr27中公开的),这样的分子将特别适合用于治疗癌症。
令人惊讶地,包含与n末端asn221序列子连接的复杂唾液酸化聚糖的特定igg1-fc突变体能够结合甲型和乙型流感病毒血凝素并破坏甲型流感介导的人红细胞凝集(blundell等人,2019.journalofimmunology202(5):1595-1611)。这些分子特别适合用作阻断病原体传染性的药剂,例如利用唾液酸依赖性受体来进入细胞的病毒或细菌,例如流感病毒和新城疫病毒。在这方面特别合适的分子是d221n/c309l/n297a/c575a和d221n/c575a(参见表3)。出人意料的是,结合血凝素的分子在每个末端都具有糖并形成单体,而多聚化的分子则不会强烈结合血凝素。
根据本发明的第一方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段区,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,以去除形成非固有二硫键的半胱氨酸残基,并且其中每条多肽链都包含至少一个糖基化位点。
适当地,本发明的每条多肽都包含两个免疫球蛋白g重链恒定结构域。
合适地,本发明的每条多肽在铰链区中均包含至少一个可以与伴侣多肽上的相应半胱氨酸形成链间二硫桥的半胱氨酸残基。合适地,铰链区包含2、3、4个或更多个可以与伴侣多肽中的半胱氨酸残基形成链间二硫桥的半胱氨酸残基。
在一个实施方案中,每个免疫球蛋白g重链恒定区包含两个免疫球蛋白结构域ch2和ch3(也称为cγ2和cγ3)。igg重链恒定区可以选自由以下组成的组:igg1、igg2、igg3和igg4。合适地,igg重链恒定区是igg1或igg2。
本发明的嵌合蛋白可以包含人igg1的残基221至447,联合人igm的尾段的残基561至576。人igg1的残基221至230代表铰链区。
本发明的某些嵌合蛋白可以形成单体。
与衍生其的天然/野生型免疫球蛋白中存在的序列相比,本发明的蛋白质具有氨基酸序列的修饰。这些可以抑制本发明的嵌合/杂合蛋白的聚合并产生增强的受体结合能力。
合适地,氨基酸序列的修饰是缺失了igg重链恒定区和尾段区内的、参与非固有二硫桥形成的半胱氨酸残基。合适地,与获得该区域的天然序列相比,修饰是缺失了尾区内的半胱氨酸残基,例如在对应于seqidno:1的248位的位置上。此外,关于已知的hexa-fc分子,还缺失了igg恒定重区中对应于seqidno:1的89位上的半胱氨酸。
半胱氨酸的缺失可以通过它们的取代或删除或化学修饰来实现,从而破坏形成二硫键的能力。在一个实施方案中,使用硫醇封端剂修饰尾段半胱氨酸残基;硫醇封端剂是一种与还原的半胱氨酸残基中的巯基反应的化合物,可防止它们形成二硫键。合适的硫醇封端剂的实例包括碘乙酸、碘乙酰胺和n-乙基马来酰亚胺。
在合适的实施方案中,半胱氨酸残基,例如对应于seqidno:1的残基248的半胱氨酸残基,被不同的氨基酸取代。半胱氨酸残基可以被任何氨基酸残基(例如丙氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、亮氨酸、蛋氨酸、天冬酰胺、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、苏氨酸、缬氨酸、色氨酸或酪氨酸残基)。适当地,对应于seqidno:1的残基248的半胱氨酸残基被丙氨酸残基替代。适当地,相对于hexa-fc分子而言,对应于seqidno:1的残基89的半胱氨酸残基被亮氨酸残基替代。
包含这种修饰的本发明蛋白质的实例包括具有seqidno:2中公开的序列的多肽链。seqidno:2的蛋白质是本发明蛋白质的特别有用的实例。它代表了高度适用于其中需要本发明蛋白质与唾液酸依赖性受体结合的医学用途和方法的实施方案(例如,以预防或治疗通过唾液酸依赖性受体的结合介导的疾病)。
现在将在以下段落中进一步描述本发明的各个方面和实施方案。
糖基化位点修饰
本发明的嵌合多肽可以具有零个、一个、两个、三个或更多个糖基化位点。适当地,形成单体的“半胱氨酸残基分子”将具有至少一个糖基化位点。
在一实施方案中,在对应于seqidno:1的残基77的位置上存在糖基化位点。在一实施方案中,在对应于seqidno:1的残基236的位置上存在糖基化位点。
发明人发现,引入人工糖基化位点能够产生比没有这种人工糖基化位点的蛋白的唾液酸化程度更高的蛋白,因此可以生产具有更高功效的蛋白质,用于唾液酸依赖性疗法或其他唾液酸非依赖性疗法。这种唾液酸化也可以赋予所述分子更长的半衰期。
众所周知,富含甘露糖的分子或与dc-sign、dec-205、mmr和mbl结合的分子可能更适合疫苗方法。所有这些受体都存在于巨噬细胞上,巨噬细胞是抗原呈递细胞,并与疫苗功效有关,例如n-糖基化可将非糖蛋白转化为甘露糖受体配体,并在体内展示抗原特异性t细胞应答。(kreerc,kuepperjm,zehnerm,quastt,kolanusw,schumakb,burgdorfs.oncotarget.2017jan24;8(4):6857-6872.doi:10.18632/oncotarget.14314)。因此,预计结合这些受体的本发明蛋白可用于疫苗或用作疫苗。
因此,在一个实施方案中,本发明的第一或第二方面的蛋白质包含提供额外糖基化位点的修饰。合适地,所述修饰在铰链区提供了额外的糖基化位点,例如通过增加天冬酰胺残基,例如在对应于seqidno:1中位置1(对应于人igg的d221)的位置处。合适地,通过取代天然天冬氨酸残基来进行在位置1处添加天冬酰胺残基的修饰。
在另一个实施方案中,在对应于seqidno:1的残基1的位置上存在糖基化位点。在一个特定的实施方案中,该多肽链包含三个糖基化位点,分别位于位置1、77和236,它们对应于seqidno:1中的位置。
包含这种修饰的本发明蛋白质的实例包括具有seqidno:3中公开的序列的多肽链。
在一个实施方案中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,本发明的第一或第二方面的蛋白质中的每条嵌合多肽链都发生了改变,从而具有一个额外的糖基化位点。在一个具体的实施方案中,与衍生铰链区的天然序列相比,每条多肽链在铰链区中包含额外的糖基化位点。在一个具体的实施方案中,所述额外的糖基化位点(嵌合多肽链中的)在对应于seqidno:1的残基1的位置。
在人工糖基化位点上存在额外的聚糖也可能会带来进一步的优势,因为它可能会增加蛋白质的稳定性。当前,为了增加免疫球蛋白的稳定性,通常将免疫球蛋白进行化学糖基化,例如通过体外酶促反应或非酶促反应。然而,人工糖基化位点的存在允许通过表达所述蛋白质的细胞引入这种修饰,因此可以避免化学糖基化这一额外步骤。结果,与ivig治疗中使用的传统药剂相比,可以以成本和时间更有效的方式生产本发明的蛋白质。
从衍生多肽的天然免疫球蛋白区(非铰链区)中去除形成非固有二硫键的半胱氨酸残基,并添加(例如通过添加或取代)一个或多个能够被糖基化的额外糖基化位点(例如天冬酰胺残基)的这种修饰,减少了嵌合蛋白的聚合,因此大部分嵌合蛋白采用单体形式,并产生受体结合能力增强的分子。
在合适的实施方案中,本发明的蛋白质还可包含对免疫球蛋白g恒定重链区(例如免疫球蛋白g重链恒定区cγ2)的糖基化位点的修饰。例如,这样的糖基化位点可以存在于对应于seqidno:1的n77(其对应于iggcγ2中的n297)的残基处。在一个具体的实施方案中,在对应于seqidno:1的n77的残基上的天冬酰胺残基被另一个氨基酸(例如丙氨酸)取代。在另一个合适的实施方案中,本发明的蛋白质还可以包含对尾区(例如igm尾区)的糖基化位点的修饰。例如,这样的糖基化位点可以存在于对应于seqidno:1的n236(其对应于igm的n563)的残基处。在一个具体的实施方案中,在对应于seqidno:1的n236的残基上的天冬酰胺残基被另一个氨基酸(例如丙氨酸)取代。包含了这种修饰的本发明蛋白质在需要和利用结合唾液酸依赖性受体的能力的应用中可能是特别有用的。包含这样的修饰的本发明的蛋白质的实例包括具有seqidno:4-8中任何一个所公开的序列的多肽链。
wo2016/009232(利物浦热带医学院)公开了嵌合蛋白的多聚体形式,其在糖基化位点的数目上具有改变/修饰。本发明的蛋白质可以包含其中公开的任何糖基化修饰。
在一个实施方案中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,本发明的第一、第二或第三方面的蛋白质中的每个多肽的氨基酸序列都发生了改变,从而少具有一个糖基化位点。在一个特定的实施方案中,与天然免疫球蛋白序列相比,缺失对应于seqidno:1的残基77的天冬酰胺残基。在另一个实施方案中,与天然免疫球蛋白序列相比,缺失对应于seqidno:1的残基236的天冬酰胺残基。
在一个实施方案中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而少具有两个糖基化位点。在一个特定的实施方案中,与天然免疫球蛋白序列相比,缺失了对应于seqidno:1的残基77和seqidno:1的残基236的天冬酰胺残基。
不希望受到任何假设的束缚,发明人认为,原本能够在蛋白质单体或形成单体的单个多肽之间形成非固有二硫键的关键半胱氨酸残基的缺失,连同在单体内存在的糖基化位点上添加(或去除)较大聚糖的能力,能够显著抑制本发明蛋白质的聚合。如本发明其他地方所讨论的,这些改变足以将以聚合形式存在的某些蛋白质的比例从大于80%降低至小于<1%。
观察到的糖基化修饰的另一个优点是,存在的更大和更复杂的聚糖更有可能终止于唾液酸(神经氨酸)中。已知以这种方式终止的聚糖可以与dc-sign相互作用,并且就本发明的蛋白质而言,观察到了与dc-sign和siglec-1的结合增强。
尾段修饰
igm和iga重链恒定区包含18个氨基酸的“尾段”,其包含聚合必不可少的半胱氨酸残基。另一个尾段区是人ige变体的尾段区(称为ige尾段)。ige尾段(ige-tp)与经典ige(ige-c)的不同之处在于,其具有以半胱氨酸残基终止的八氨基酸羧基末端尾段(essrrggc;seqidno:45)[quinn等人sci.rep.6,20509;doi:10.1038/srep20509;2016]。
在多种实施方案中,尾段区基于选自igm、iga和ige的免疫球蛋白的尾段区。在一个特定的实施方案中,尾段区基于人igm的尾段区,其是ptlynvslvmsdtagtcy(seqidno:14)(rabbitts等人,nucl.acidres.9(18):4509-4524,1981;smith等人,j.immunol.154:2226-2236,1995)。igm的尾段区的其他合适的变体描述于sorensen等人。(j.immunol.156:2858-2865,1996)。另一个尾段区是人iga的尾段区,它是pthvnvsvvmaqvdgtcy(putnam等人,j.biol.chem.254:2885-2674;seqidno:15)。另一个尾段区是人ige-tp的尾段区,它是(essrrggc;seqidno:45)。或者,尾段区可以是合成多肽。我们的意思是,该序列可能不存在于天然免疫球蛋白尾段中或不衍生自天然免疫球蛋白尾段。在这种情况下,合成的免疫球蛋白尾段序列的长度在12至26个氨基酸之间,并且用作可能包含或不包含一个或多个糖基化位点的间隔区或支架序列。合成的免疫球蛋白尾段可能适合用于本发明的血凝素结合蛋白,因为羧基末端糖(聚糖)的位置可以最佳地定位,以使其距离氨基末端的糖约
可以基于天然序列对本发明蛋白质中的尾段区进行修饰,以缺失可以形成非固有二硫键的半胱氨酸残基。尾段可以经由间隔区连接。
修饰尾段氨基酸序列以抑制聚合
进行修饰以从衍生多肽的天然尾段区中去除形成非固有二硫键的半胱氨酸残基,或在合成尾段中将其排除,这会减少嵌合蛋白的聚合,从而大多数嵌合蛋白采用单体形式,并产生具有增强的受体结合能力的分子。
如上所述,用于并入本发明蛋白质的免疫球蛋白尾段可以基于任何免疫球蛋白分子。合适地,尾段可以基于选自igm、iga和ige的免疫球蛋白的尾段。
基于igm的尾段特别适合并入本发明的蛋白质中。本文参考igm尾段(其被并入seqidno:1的参考蛋白和seqidno:2至seqidno:11的本发明的示例性蛋白中)描述了示例性的修饰。应当理解,其他免疫球蛋白的尾段可以在对应于关于igm所举例说明的残基上进行修饰。此外,可以以与关于igm所述相同的方式,对源自igm以外的免疫球蛋白的尾段进行修饰。
适合并入本发明蛋白质的尾段可以与天然免疫球蛋白尾段(例如igm尾段)具有至少55%的同一性,只要它们包含相关的修饰。实际上,合适的尾段可以与天然免疫球蛋白尾段的相应部分的序列具有至少55%、至少65%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的同一性,只要进行了适当地修饰。
特别地,适合并入本发明蛋白质的尾段可以与seqidno:2的igm衍生序列(即seqidno:2的氨基酸残基232-249)具有至少55%的同一性。适当地,用于掺入本发明蛋白质的尾段可以与seqidno:2的残基232-249具有至少55%、至少65%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的同一性。
本发明的蛋白质可以在尾段内包含至少一个糖基化位点。这些可能是天然免疫球蛋白尾段序列所保留的天然存在的糖基化位点。或者,本发明的蛋白质可以在尾段区中包含人工引入的糖基化位点,或天然存在和人工位点的组合。适当地,在尾段的羧基末端引入另外的糖基化位点。
糖基化程度增高的分子可具有增强的体内半衰期。
bas等人(jimmunol.2019jan25.pii:ji1800896.doi:10.4049/jimmunol.1800896)已显示,fc的唾液酸化可以将fc的体内半衰期延长多达9倍(从数天到数周),因此,鉴于其高唾液酸化的性质,本发明人预计,本发明的蛋白质在体内也将具有有利的药代动力学特征。较长的体内半衰期在治疗上特别是对流感而言非常重要,并且是神经氨酸酶(neuraminidase)抑制剂(包括奥司他韦,其体内半衰期仅6-10小时)的显著缺点。
间隔区
如上所述,本发明的蛋白质可以包含间隔区。适当地,间隔区可以在fc受体结合部分和尾段区之间。
合适的间隔区可以是至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个或更多个氨基酸残基长。更合适地,间隔区可以是四个氨基酸残基长。在seqidno:2所示的本发明的示例性蛋白质中,间隔区可以在残基228至231。
适当地,间隔区可以具有序列lvlg(seqidno:16)。
间隔区的存在可以改善尾段碳水化合物的部署(例如,如果本发明如seqidno:1或seqidno:2所示,则对应于蛋白质的氨基酸残基n236),并因此改善与聚糖受体的相互作用,而不损害通过fc恒定域介导的相互作用。
铰链区修饰
除了fc受体结合部分和尾段区以外,形成本发明蛋白质的多肽链还包含铰链区。
在合适的实施方案中,铰链区可以位于fc受体结合部分的n-末端。铰链区可以是天然的或合成的铰链区。合适地,铰链区包含至少一个半胱氨酸残基,其能够与另一条多肽上的相应半胱氨酸形成二硫桥,从而将两条多肽保持在一起以形成fc单体。尾段中的疏水性氨基酸(例如缬氨酸)也很可能使两条多肽通过非共价相互作用而相互作用/聚集在一起。
在合适的实施方案中,铰链区是天然铰链区的全部或一部分。天然铰链区是天然存在于抗体的fc和fab部分之间的区域。天然铰链区可以源自与fc受体结合部分相同的物种。或者,它可以衍生自不同物种。天然铰链区通常具有三个主要部分:上部、中间部和下部。上部决定两个fab区之间的排列,并介导每个fab臂的柔韧性和取向。中间区域中的两个半胱氨酸残基(例如igg1中的cys226和cys229)在两条重链之间形成链间二硫键,以将它们连接在一起。下部铰链负责fc区相对于fab臂的柔韧性和位置。igg1中fab和fc片段之间的完整铰链区正式地由val215和ser239之间的23个残基(epkscdkthtcppcpapellggp–seqidno:17)组成,其中fab区正式地终止于val215,fc区起始于ser239。在igg1中,下部铰链从残基216到226,中间铰链从227到230,下部铰链从231到238。在本发明的蛋白质中不需要使用天然铰链的全部“正式”长度。用于本发明的合适的铰链区是dkthtcppcp(seqidno:18)。从asp221到pro230。该区域有两个半胱氨酸残基,它们与伴侣多肽中的半胱氨酸形成二硫键,从而有助于将两条多肽链保持在一起以形成fc单体。
在天然免疫球蛋白中,两条重链通过可变数目的二硫键在铰链区相连:igg1和igg4为2个,igg2为4个,igg3为11个。
在合适的实施方案中,天然铰链区(或其片段)可以衍生自与fc受体结合部分相同类别或亚类的抗体。或者,它可以衍生自与fc受体结合部分不同类别或亚类的抗体。
在合适的实施方案中,铰链区衍生自igg1。更合适地,铰链区可以衍生自人igg1。举例来说,根据seqidno:2的本发明的蛋白质包含衍生自人igg1的铰链区。
应当理解,铰链区可以用作本发明蛋白质中一个或多个另外的n-联糖基化位点的插入和/或连接的位置。
在合适的实施方案中,铰链区的n-末端可以以抑制本发明蛋白质聚合的方式被糖基化。合适地,糖基化可以在对应于seqidno:1的残基1的位置。铰链区的糖基化可能是有益的,因为它可以致使聚糖暴露,这可以修饰本发明的蛋白质的功能。包含这样的修饰的本发明的蛋白质的实例包括具有seqidno:3、5、6、7、9和59中任何一个所公开的序列的多肽链。作为示例,并且如本说明书的实施例部分中进一步解释的那样,铰链区的糖基化可以减少蛋白质与fc-γ受体的相互作用,同时增加与唾液酸依赖性受体(如siglec-1)的相互作用。
在另一个实施方案中,铰链区是合成的。合成铰链区是长度或序列与天然存在的铰链区不同的铰链区。举例来说,合成铰链区和天然铰链区之间的长度差异可能是由于合成铰链区中残基的添加或缺失(例如半胱氨酸残基的添加或缺失)。合成铰链区和天然铰链区之间的序列差异可能是由于合成铰链区中一个或多个残基被取代(例如,半胱氨酸残基被另一个残基(如丝氨酸或丙氨酸)取代)。
在合适的实施方案中,铰链区可以是至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个、至少15个、至少20个、至少23个、至少25个、至少30个或更多个氨基酸残基长。
举例而非限制性的,本发明的蛋白质可以包含铰链区,其中铰链区具有选自以下的序列:vpstpptpspstpptpsps(seqidno:19)、vppppp(seqidno:20)、epkscdkthtcppcp(seqidno:21)、erkccvecppcp(seqidno:22)、eskygppcpscp(seqidno:23)、cppc(seqidno:24)、cpsc(seqidno:25)和sppc(seqidno:26)。其他合适的天然和合成铰链对本领域技术人员而言是已知的。例如,dkthtcppcp(seqidno:27)中存在的两个半胱氨酸可用于igg1的ch2和ch3配对的域间二硫键形成。
在合适的实施方案中,铰链区可以是串联的天然铰链的多个拷贝,例如连接在一起的天然铰链序列的2、3、4、5、6或更多个拷贝。增加铰链的长度将使有效载荷与免疫球蛋白区保持一定距离。
修饰铰链区氨基酸序列以抑制聚合
用于并入本发明蛋白质的铰链区可以基于任何免疫球蛋白分子。合适地,铰链区可以基于选自以下的免疫球蛋白的铰链区:igg、iga、ige、igd和igm。更合适地,igg免疫球蛋白的铰链区可以选自由以下组成的组:igg1、igg2、igg3和igg4。
基于免疫球蛋白igg1的铰链区特别适合并入本发明的蛋白质中。本文参考igg1铰链区(其被并入seqidno:1的参考蛋白和seqidno:2至seqidno:11的本发明的示例性蛋白中)描述了铰链区的示例性修饰。
应当理解,其他igg免疫球蛋白的铰链区可以在对应于关于igg1所举例说明的那些残基的残基上进行修饰。此外,可以以与关于igg1所述相同的方式,对衍生自igg以外的免疫球蛋白的铰链区进行修饰。
适合并入本发明蛋白质的铰链区可以与天然免疫球蛋白铰链区(例如igg铰链区)具有至少55%的同一性,只要它们包含相关的修饰。实际上,合适的铰链区可以与天然铰链区的相应部分的序列具有至少55%、至少65%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的同一性,只要进行了适当地修饰。
特别地,适合于并入本发明蛋白质中的铰链区可以与seqidno:2的igg铰链区衍生序列具有至少55%的同一性,只要它们包含seqidno:2中的修饰。适当地,用于掺入本发明蛋白质的铰链区可以与seqidno:2的铰链区的残基具有至少55%、至少65%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的同一性。
修饰铰链区糖基化以抑制聚合
本发明的蛋白质可以在铰链区内包含糖基化位点。糖基化位点可以是天然免疫球蛋白铰链区序列所保留的天然存在的糖基化位点。或者,本发明的蛋白质可以在铰链区中包含人工引入的糖基化位点,或天然存在和人工位点的组合。在一个实施方案中,对嵌合多肽序列的铰链区进行修饰,从而引入在衍生该区域的天然序列中不存在的糖基化位点。在一个实施方案中,本发明的嵌合多肽中的铰链区在位置1(对应于seqidno:1的该位置)上包含天冬酰胺(n)残基,而在天然序列中它是天冬氨酸(d)。该额外的糖基化位点的存在增强了嵌合蛋白的聚糖受体结合特性。例如,将d221n/c309l/n297a/n563a/c575a与c309l/n297a/n563a/c575a进行比较(见图3)。
有效载荷
如本说明书中其他地方提到的,本发明的蛋白质,特别是根据本发明第三方面的蛋白质,可以与治疗性有效载荷缀合。如本文所用,术语“治疗性有效载荷”是指本身具有治疗作用的化合物。治疗性有效载荷的治疗作用可以是本发明蛋白质的治疗作用的补充或独立于本发明蛋白质的治疗作用。
治疗性有效载荷可以是具有治疗作用的任何部分。例如,化学物质(例如毒素)、抗原性肽或“抗原结合结构域”,例如能够与抗原结合的源自抗体的结构域。抗原结合结构域可以包含抗体轻链可变区(vl)和抗体重链可变区(vh):然而,它不必同时包含两者。例如,fd片段具有两个vh区并且通常保留一些抗原结合能力。可以(作为有效载荷)连接至铰链区的“抗原结合结构域”(或抗体的片段)的实例包括:fab、f(ab’)2、fd、fv、scfv、dab和纳米抗体。
抗原结合区可以是任何免疫球蛋白片段,例如fab、fab2或scfv。本发明的合适蛋白质可以是在羧基末端连接有尾段区的igg抗体。
在合适的实施方案中,可以将本发明的蛋白质,特别是根据本发明的第三方面的蛋白质,或形成本发明的此类蛋白质的一个或两个单独的多肽链与治疗性有效载荷缀合。合适地,可以将有效载荷与本发明蛋白质的fc受体结合部分缀合。或者,可以将其与本发明蛋白质的铰链区缀合。有效载荷可以化学缀合到本发明蛋白质的fc受体结合部分,或者它可以是编码本发明蛋白质的dna序列的一部分,使得其通过常规氨基酸键缀合。适当地,有效载荷是免疫球蛋白区(例如fab、f(ab’)2、scfv或纳米抗体)、抗原性肽或化学合成的聚糖。
在本发明的蛋白质,特别是根据本发明的第三方面的蛋白质与治疗性有效载荷缀合的实施方案中,此类有效载荷可以缀合至一条或两条多肽链的铰链区。应当理解,可以将铰链区设计成调节fc受体结合部分和治疗性有效载荷(如果存在的话)之间的距离。当治疗性有效载荷与本发明的蛋白质缀合时,可能需要增加fc受体结合部分和治疗性有效载荷之间的距离,以便提供足够的空间用于将聚糖分子连接至糖基化位点。适当地,有效载荷可以通过化学缀合的方式缀合至铰链区域,或者可以将其作为编码本发明蛋白质的dna的一部分引入。合适地,铰链区还可以提供用于将聚糖分子连接至人工糖基化位点(例如,在对应于seqidno:1的残基1的残基处,例如seqidno:3所示)的空间。
本发明的示例性蛋白质
seqidno:2-8中列出了本发明的单体蛋白质的实例,这些蛋白质缺失了igghc和尾区内的、能够形成非固有二硫键的半胱氨酸。本发明的蛋白质可以包含如seqidno:2至seqidno:8中任一项所公开的氨基酸序列。在合适的实施方案中,本发明的蛋白质可以由如seqidno:2至seqidno:8中任一项所公开的氨基酸序列组成。
表4中显示了具有seqidno:2-8所示序列的每条多肽中存在的具体修饰(相对于hexa-fc分子序列(seqidno:1所示)),这些修饰从分子的命名法可以明显看出(例如,c309l在hexa-fc蛋白的309位具有取代半胱氨酸的亮氨酸残基)。
seqidno:1的嵌合多肽包含人igg1的残基221至447(对应于seqidno:1的残基1至227),以及基于并改编自人igm的尾段的558至576(对应于seqidno:1的残基232至249)的残基。seqidno:1是hexa-fc中存在的序列。相对于衍生它们的野生型免疫球蛋白序列,该序列在89位具有一个半胱氨酸残基以代替天然亮氨酸,在90位具有一个亮氨酸以代替组氨酸。
seqidno:2直接对应于seqidno:1,除了在89位存在亮氨酸残基,在90位存在组氨酸,并在248位存在丙氨酸残基。该分子也称为c309l/c575a。命名没有提到90位的his,因为这是在野生型igg1中存在的氨基酸。
seqidno:3直接对应于seqidno:2,除了在seqidno:2的残基1上存在d至n取代。该分子也称为d221n/c309l/c575a。如上所述,该取代在seqidno:2的蛋白质中引入了新的糖基化位点。
seqidno:4直接对应于seqidno:2,但是其中seqidno:1内的一个糖基化位点已被突变;特别是具有n236a取代。该分子也称为c309l/n563a/c575a。
seqidno:5直接对应于seqidno:3,但是其中seqidno:1内的两个糖基化位点已被突变;特别是具有以下两个取代:n77a和n236a。该分子也称为d221n/n297a/c309l/n563a/c575a。
seqidno:6和7各自直接对应于seqidno:3,但是其中seqidno:1内的一个糖基化位点已被突变;具体而言,seqidno:6包含n236a取代(该分子也称为d221n/c309l/n563a/c575a);并且seqidno:7包括n77a取代(该分子也称为d221n/c309l/n297a//c575a)。
seqidno:8直接对应于seqidno:2,但是其中seqidno:1内的一个糖基化位点已被突变;具体而言,seqidno:8包括n77a取代(该分子也称为/c309l/n297a/c575a)。
seqidno:9直接对应于seqidno:1,但包含残基1处的d至n取代、n77a、90位的组氨酸、n236a取代和c248a取代(该分子也称为d221n/n297a/n563a/c575a)。
seqidno:9直接对应于seqidno:9,但在221位包含d。(n297a/n563a/c575a)。
seqidno:11直接对应于seqidno:2,除了在248位具有丙氨酸残基。
(c309l)。
seqidno:59直接对应于seqidno:1,除了在seqidno:1的残基1上存在d至n取代,在90位存在组氨酸,并在248位存在丙氨酸残基(该分子也称为d221n/c575a)。
在本发明的一个特定方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段区,其中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而缺失了免疫球蛋白g重链恒定区和免疫球蛋白尾段区内的、能够形成非固有二硫键的任何半胱氨酸,并且其中该蛋白质是表1-4任一个中所公开的蛋白质。
在本发明的一个特定方面,提供了一种嵌合fc受体结合蛋白,其中该蛋白质是表1-4任一个中所公开的蛋白质。
在本发明的一个特定方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含如seqidno:1-11中任一个所公开的氨基酸序列。在合适的实施方案中,嵌合fc受体结合蛋白具有治疗性有效载荷。在合适的实施方案中,所述治疗性有效载荷连接至铰链区域,特别是在铰链区的1位上(对应于seqidno:1中的1位)。
应当理解,在嵌合多肽(其中不存在完整的igg或igm序列)中,基于全长igg或igm分子的残基编号不再有意义。因此,在本公开中,我们还将参考参考嵌合蛋白序列,其以seqidno:1列出。该序列代表单个嵌合多肽链。当提及该序列时,全长igm序列的cys575被重编号为嵌合多肽链的cys248(seqidno:1的第248个残基)。
为避免疑问,由具有seqidno:1所示序列的嵌合蛋白/多肽链组成的蛋白将不构成本发明的蛋白,因为它不会包含必需的修饰。
在本发明的一个特定方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段区,其中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而具有了一个额外的糖基化位点,并缺失了免疫球蛋白g重链恒定区和免疫球蛋白尾段区内的、能够形成非固有二硫键的任何半胱氨酸。合适地,另外的糖基化位点在铰链区中对应于seqidno:1的残基1的位置,并且不存在对应于seqidno:1的残基248的半胱氨酸残基。
抑制本发明蛋白质的聚合
在本发明的特定蛋白质中,当与相应的野生型尾段(例如igm尾段)的序列和糖基化相比时,其尾段区的氨基酸序列和糖基化被修饰,以抑制蛋白质的聚合。以聚合物形式存在的蛋白质的比例降低,或者以单体形式存在的蛋白质的比例增加,均可以证明此类蛋白质的聚合的抑制。可以参考在合适的对照蛋白中存在的聚合蛋白或单体蛋白的比例进行评估。这种合适的对照蛋白可以包括野生型尾段,例如igm尾段,并且任选地可以包括天然铰链区。
在缺乏本发明蛋白质(例如,以seqidno:2为例)的修饰的对照蛋白质(例如seqidno:1)中,单体占总蛋白质的不到20%。相比之下,发明人已经发现,在生理条件下,本发明的蛋白质(例如包含seqidno:2所公开的序列的蛋白质)的90%以上以单体形式存在。
因此,在本发明的“半胱氨酸残基分子/蛋白质”的情况下,例如包含seqidno:2至seqidno:8中任一个所公开的序列的那些,其中该氨基酸序列,特别是能够形成非固有二硫键的关键半胱氨酸残基,以及尾段区和铰链区的糖基化与天然/野生型序列相比都进行了修饰,如果90%或以上的蛋白质在生理条件下以单体形式存在,则该修饰可被证明是抑制聚合的修饰。实际上,在合适的实施方案中,聚合的抑制可导致95%或更多的蛋白质以单体形式存在,例如96%或更多,97%或更多,98%或更多,甚至99%或更多。在合适的实施方案中,聚合的抑制可导致基本上所有的本发明蛋白质在生理条件下均以单体形式存在。
可以确定样品中聚合物或单体蛋白比例的合适方法包括尺寸排阻色谱法(sec)图12和sds-page丙烯酰胺梯度凝胶图2。
适用于本发明蛋白质的igg序列
本发明的分子/蛋白质并入了一个、两个或更多个免疫球蛋白g重链恒定结构域。在合适的实施方案中,每条多肽链并入了两个免疫球蛋白g重链恒定结构域。在合适的实施方案中,每条多肽链并入了三个免疫球蛋白g重链恒定结构域和一个免疫球蛋白g重链可变区。在合适的实施方案中,本发明蛋白质中所使用的免疫球蛋白g重链恒定区衍生自选自以下的免疫球蛋白:igg1;igg2;igg3;和igg4。特别地,免疫球蛋白g重链恒定区可以衍生自igg1。在合适的实施方案中,两个免疫球蛋白g重链恒定结构域可以来自相同的免疫球蛋白区域(例如igg1或igg4)。在合适的实施方案中,两个免疫球蛋白g重链恒定结构域可以来自不同区域(例如结构域1可以是来自igg1的结构域1,而结构域2可以是来自igg2的结构域2,即igg1,ch2和igg2,ch3)。
应当理解,与衍生它们的天然序列相比,本发明蛋白质中使用的免疫球蛋白g重链恒定区可以包括其序列的改变,只要它们满足形成fc受体结合部分的要求。仅通过举例的方式,本发明的合适的蛋白质可以利用igg衍生的序列,该序列与衍生它们的相关天然igg序列具有至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性。
本发明蛋白质的单体
为了避免疑问,在本公开的上下文中,提及本发明的蛋白质的“单体”旨在涵盖由两条彼此缔合的嵌合多肽链组成的分子。适当地,两条嵌合多肽链可以通过在接头区中的半胱氨酸残基之间形成的一个或多个链间二硫键相连。例如,如本申请中其他地方所讨论的,在本发明的示例性蛋白质(dkthtcppcpapellggp;seqidno:28)中使用的铰链中有一对半胱氨酸残基,其二硫键帮助将两条多肽链保持在一起,以形成fc单体。因此,可以看出,出于目前的目的,“三聚体”将由上述三个“单体”组成,即总共六条嵌合多肽链。“六聚体”将由六个单体组成,因此共有十二条嵌合多肽链。
本发明的组合物和药物组合物
本发明的第五方面提供了一种组合物,其包含本发明的蛋白质(例如根据本发明的第一、第二或第三方面的蛋白质或本发明的另一种蛋白质)。在一个实施方案中,在这种组合物中,掺入该组合物中的本发明的蛋白质的至少95%是单体形式。在一个实施方案中,在这种组合物中,掺入该组合物中的本发明第一方面的蛋白质的至少95%是单体形式。
适当地,本发明的第五方面的组合物可以是药物组合物,其中蛋白质与药学上可接受的载体一起提供。
在包含本发明的第一、第二或第三方面的蛋白质的组合物的合适实施方案中,无论是药物组合物还是其他,并入组合物中的本发明的第一、第二或第三方面的蛋白质的至少96%或至少97%为单体形式。实际上,在合适的实施方案中,并入组合物中的本发明的第一方面、第二方面或第三方面的蛋白质的至少98%或至少99%为单体形式。适当地,并入这种组合物中的本发明第一、第二或第三方面的蛋白质的基本上全部蛋白质都可以是单体形式。
在包含本发明的第一方面的蛋白质的组合物的合适实施方案中,无论是药物组合物还是其他,并入组合物中的本发明的第一方面的蛋白质的至少96%或至少97%为单体形式。实际上,在合适的实施方案中,并入组合物中的本发明的第一方面的蛋白质的至少98%或至少99%为单体形式。适当地,并入这种组合物中的本发明第一方面蛋白质的基本上全部蛋白质都可以是单体形式。
在包含本发明的另一种蛋白质的组合物的合适实施方案中,无论是药物组合物还是其他,蛋白质可以是多聚体形式。
除了活性成分之外,根据本发明以及根据本发明使用的药物组合物可以包含药学上可接受的载体。如本文所用,药学上可接受的载体包括:赋形剂、缓冲剂、稳定剂或本领域技术人员众所周知的其他材料。此类材料应是无毒的,并且应不干扰活性成分的功效。载体的确切性质将取决于施用途径,施用途径可以是口服或通过注射施用,例如静脉内或眼内施用。
合适的药物载体的实例是本领域众所周知的,包括磷酸盐缓冲盐水溶液、水、脂质体、各种类型的润湿剂、无菌溶液等。包含此类载体的组合物可以通过众所周知的常规方法配制。这些药物组合物可以以合适的剂量施用于受试者。剂量方案将由主治医师和临床因素决定。如医学领域众所周知的,任意一名患者的剂量取决于许多因素,包括患者的体型、体表面积、年龄、待施用的特定化合物、性别、施用时间和途径、总体健康状况以及同时施用的其他药物。用于肠胃外施用的制剂包括无菌水溶液或非水溶液,以及混悬剂。非水溶剂的实例是丙二醇、聚乙二醇和可注射的有机酯,例如油酸乙酯。水性载体包括水、水溶液或悬浮液,包括盐水和缓冲介质。肠胃外媒介物包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸林格氏液或固定油。静脉内媒介物包括液体和营养补充剂、电解质补充剂(例如基于林格氏右旋糖的补充剂)等。也可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。另外,在人类来源的某些实施方案中,组合物可能包含蛋白质载体,例如血清白蛋白或免疫球蛋白。
用于口服施用的药物组合物可以是片剂、胶囊剂、粉剂、液体或半固体形式。片剂可以包含固体载体,例如明胶或佐剂。液体药物组合物通常包含液体载体,例如水、石油、动物油或植物油、矿物油或合成油。可以包括生理盐水溶液,右旋糖或其他糖溶液,或二醇,例如乙二醇、丙二醇或聚乙二醇。
对于静脉内注射或在患处注射,活性成分将是肠胃外可接受的水溶液的形式,其不含热原且具有合适的ph、等渗性和稳定性。本领域相关技术人员能够使用例如等渗媒介物如氯化钠注射液、林格氏注射液、乳酸林格氏注射液来制备合适的溶液。根据需要,可以包括防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂。
固体制剂可以通过冻干、喷雾干燥或通过超临界流体技术干燥来生产。局部制剂可以包括粘度调节剂,其延长了药物停留在作用部位的时间。在某些实施方案中,本发明的蛋白质可以与保护蛋白质免于快速释放的载体一起制备,例如控释制剂,包括植入物、透皮贴剂和微胶囊递送系统。可以使用可生物降解的、生物相容的聚合物,例如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。局部施用可以是对皮肤或其他身体部位,例如眼睛。
取决于待治疗的病况,组合物可以单独施用或与其他治疗同时或相继组合施用。
制备此类制剂的许多方法是本领域技术人员已知的。用于本发明的合适的制剂可见于remington'spharmaceuticalsciences,mackpublishingcompany,philadelphia,pa.,17thed.,1985。对于药物递送方法的简要综述,参见例如langer(science249:1527-1533,1990)。
本发明蛋白质的医学用途
本发明的组合物中提供的本发明的蛋白质,例如半胱氨酸修饰的蛋白质、血凝素结合蛋白的糖基化修饰蛋白质,可以用作药物。
本发明的蛋白质,例如半胱氨酸残基分子,可以例如用作ivig或scig中的药物。蛋白质及组合物的这种医学用途特别适用于预防或治疗自身免疫性疾病或炎性疾病。不管它们是否与治疗性有效载荷缀合,以这种方式在医学上使用本发明的蛋白质都是有效的。
本发明的蛋白质,例如血凝素结合蛋白,可以用作预防或治疗通过结合唾液酸依赖性受体介导的疾病的药物。
如本说明书中其他地方提到的,本发明的蛋白质,例如半胱氨酸残基分子,特别是在seqidno:1的残基1处包含人工糖基化位点的蛋白质(例如在包含seqidno:3的蛋白质中),具有结合唾液酸依赖性受体(例如siglec-1,请参见表1)的能力,从而防止其他分子与受体结合。发明人认为,蛋白质结合siglec-1和其他唾液酸依赖性受体的能力是其唾液酸化程度更高的结果(图9)。
在特定的实施方案中,本发明的蛋白质能够结合选自以下的至少一种受体:siglec-1、siglec-2、siglec-3、siglec-4、cd23、dec-1、dec-2、dc-sign、clec-4a、clec-4d、mbl、mmr和dec-205。
本发明的蛋白质可用作希望与其他分子竞争与唾液酸依赖性受体(siglec-1)的结合,并因此抑制或阻止其他分子与唾液酸依赖性受体的结合的疾病中的药物。仅举例来说,本发明蛋白质与唾液酸依赖性受体(如siglec-1)的结合可具有抑制逆转录病毒与这些受体结合的治疗作用,从而预防或治疗逆转录病毒感染(如hiv或t细胞白血病病毒感染)。
在特定的实施方案中,本发明的特定蛋白质能够结合血凝素,因此可以用作抑制病原体感染(例如唾液酸依赖性病毒,例如流感病毒或新城疫病毒)的药剂。特别有用的分子包括在分子的两个末端处(例如在asn221和asn563处)或接近两个末端处,或在彼此的约
在特定的实施方案中,本发明的蛋白质能够结合选自以下的至少一种fc受体:fcγri、fcγriia、fcγriib、fcγriiia和fcγriiib。
举例来说,本发明的d221n/c309l/n297a/n563a/c575a和d221n/c309l/n563a/c575a蛋白比igg1-fc更强地结合抑制性fcγriib,并且已知该受体对于控制炎症很重要(lünemann,j.d.等人nat.rev.neurol.11,80–89(2015);在线发布于2015年1月6日;doi:10.1038/nrneurol.2014.253),它在治疗炎性疾病方面可能有用。
已知fcγriiia在ivig通过抑制性itam控制炎症中是重要的(mkaddem等人,jclinimmunol2014(34):s46-s50)。因此,结合fcγriiia的分子(例如c309l/n563a/c575a)或结合fcγriiia和fcγriib的分子(例如d221n/c309l/n563a/c575a)也可用于治疗炎性疾病。
fcγriiia还可以结合免疫复合物并通过非抑制性itam触发激活由nk细胞介导的adcc,这是抗肿瘤mab功效的众所周知的机制(例如,参见wang等人,proteincell.9(1):63–73,2018)。因此,结合fcγriiia的分子也可能触发细胞杀伤,无论是肿瘤还是病原体。
通过ivig去除c1q也已显示可用于治疗神经系统疾病(journalofneuroimmunology229(2010)256–262和jneurolneurosurgpsychiatry2011;82:87e91.doi:10.1136/jnnp.2010.205856)。因此,结合c1q的分子(例如d221n/c309l/n563a/c575a)也应可用于控制由补体介导的炎症,尤其是因为该突变蛋白还结合抑制性fcγriib和fcγriiia。
没有效应子功能的突变体,例如c309l/n297a/n563a/c575a,在治疗上也可能有用。例如,可以将它们引入不需要外来活化免疫应答的阻断性mab(blockingmab)中。wang等人(proteincell2018,9(1):63–73,2018,doi10.1007/s13238-017-0473-8)已经描述了其中可能希望增加或减少与fcγr、聚糖受体或补体的结合的示例病况。
因此,此类蛋白质可能在其中可能需要与唾液酸依赖性受体结合和/或与fcγ受体结合和/或与c1q结合的许多疾病中具有治疗效果。
因此,本发明的半胱氨酸残基分子/蛋白质,特别是其中已引入人工糖基化位点的那些,可以用作其中预防其他分子与唾液酸依赖性受体结合可能具有治疗作用的疾病中的药物。仅通过举例的方式,防止与siglec-1结合可能对逆转录病毒感染(例如hiv或t细胞白血病病毒感染)或感染因子经由siglec-1结合的其他病况具有治疗作用。因此,本发明的半胱氨酸残基分子/蛋白质,特别是包含对应于seqidno:2的残基1处存在的糖基化位点的人工糖基化位点的蛋白质,可以用于预防或治疗感染。适当地,本发明的蛋白质可以用于预防或治疗逆转录病毒感染。
包含seqidno:2-8或由seqidno:2-8组成的本发明蛋白质特别适用于上述医学用途。
下文考虑了此类疾病的其他合适实例,这些疾病可以受益于通过本发明蛋白质的医学用途而进行的预防或治疗。
预计,与fcγriiia和c1q具有强结合力的那些本发明蛋白质(例如c309l/n563a/c575a)特别适用于治疗癌症;因此,可以包括有效载荷。有效载荷可以是癌症抗原的结合结构域(例如抗体片段)。
本发明蛋白质的其他医学用途可以参考与此类蛋白质缀合的治疗性有效载荷来选择。合适的治疗性有效载荷可以选自由以下组成的组:免疫调节剂、药物、多肽或蛋白质、碳水化合物和核酸。
合适的免疫调节剂可以上调或下调免疫系统的成分。
与上调免疫系统成分的免疫调节剂缀合的本发明的蛋白质可用作疫苗。举例来说,可用作疫苗的免疫调节剂可以是病原体相关分子模式(pamp)分子或抗原。因此,本发明提供了本发明蛋白质作为疫苗的用途。
与下调免疫系统成分的免疫调节剂缀合的本发明的蛋白质可用作用于自身免疫性疾病(例如类风湿性关节炎)的药物。
下调免疫系统成分的这种免疫调节剂的实例是红细胞生成素(erythropoietin)。因此,应当理解,在合适的实施方案中,可以将红细胞生成素与本发明的蛋白质缀合。此类缀合蛋白可用于预防或治疗自身免疫性疾病。
如本文所用,术语“药物”是指具有治疗活性的化合物,例如小分子,其可以与本发明的蛋白质缀合。仅通过举例的方式,合适的药物治疗性有效载荷可以是可用于治疗癌症的药物,例如单甲基澳瑞他汀e(auristatine)。适当地,药物(例如单甲基澳瑞他汀e)可以进一步与抗体缀合。因此,本发明的蛋白质可以与抗癌药物(例如单甲基澳瑞他汀e)缀合。此类缀合蛋白可用于预防或治疗癌症。
仅举例来说,用于与本发明蛋白质缀合的合适的蛋白质治疗性有效载荷可以是细胞因子受体。细胞因子受体可用于抑制致病细胞因子,例如通过结合此类致病细胞因子,从而防止它们与细胞致病性地结合。
与本发明蛋白质缀合的合适的碳水化合物有效载荷可以是例如透明质酸。
与本发明蛋白质缀合的合适的核酸有效载荷可以是例如未甲基化的cpg寡聚脱氧核苷酸。以这种方式缀合的本发明蛋白质适合作为免疫刺激物用于医学用途。
使用本发明蛋白质的治疗方法
本发明的蛋白质(例如在本发明的组合物中提供的)可以用作药物。所述蛋白质可以与治疗性有效载荷缀合。或者,它们可以不与治疗性有效载荷缀合。
蛋白质及其组合物的这种医学用途特别适用于预防或治疗自身免疫性疾病或炎性疾病,无论蛋白质是否与治疗性有效载荷缀合。
另外,如已经提到的,发明人惊奇地发现,本发明的蛋白质,特别是缺失了igghc和尾段区中的、能够形成非固有二硫桥的半胱氨酸残基以及在seqidno:1的残基1处具有人工糖基化位点的蛋白质(例如seqidno:3的蛋白质),具有结合唾液酸依赖性受体(例如siglec-1受体)的能力。蛋白质因此可以防止其他分子与所述受体结合,或者可用于触发此类受体以达到治疗效果。
因此,未与治疗性有效载荷缀合的本发明蛋白质可以特别用于预防或治疗其中防止其他分子与siglec-1结合可能具有治疗作用的疾病。仅举例来说,防止与唾液酸依赖性受体(如siglec-1)结合可能在预防或治疗感染如逆转录病毒感染(如人免疫缺陷病毒或t细胞白血病病毒感染)和/或依赖唾液酸结合进入宿主细胞的其他感染例如流感和新城疫病毒中,具有治疗作用。
下文考虑了此类疾病的其他合适实例,这些疾病可以受益于通过本发明蛋白质的医学用途而进行的预防或治疗。
可以通过任何技术向受试者提供本发明的蛋白质,通过该技术,受试者将最终接受治疗有效量的本发明的蛋白质。
因此,在合适的实施方案中,可以直接向受试者提供本发明的蛋白质。在一个实施方案中,可以例如向受试者提供包含单体形式的本发明蛋白质的本发明组合物。
在另一个实施方案中,可以向受试者间接提供单体蛋白。举例来说,在一个实施方案中,可以向受试者施用根据本发明的第八方面的核酸(编码本发明蛋白质的核酸),并通过表达核酸产生蛋白质,以提供治疗有效量的本发明蛋白质。因此,在第十方面,本发明提供了根据本发明第八方面的核酸,其用作药物。以这种方式的本发明核酸的医学用途可能在参考本发明蛋白质的医学用途所描述的应用中有益。
可以预防或治疗的疾病
包括siglec在内的大多数聚糖受体都是抑制性受体,因此通过连接至fc片段的多个聚糖使这些受体交联的分子可用于疗法中控制有害炎症。
使用本发明的蛋白预防或治疗的合适的自身免疫性疾病或炎性疾病包括可用ivig治疗的那些。这些可以是目前用ivig常规治疗的疾病,或已发现ivig在临床上有用的疾病,例如自身免疫性血细胞减少症、格林-巴利综合征、重症肌无力、抗因子viii自身免疫性疾病、皮肌炎、血管炎和葡萄膜炎。ivig通常用于治疗特发性血小板减少性紫癜(itp)、川崎病、格林-巴利综合征和慢性炎性脱髓鞘性多发性神经病。ivig还可以用于治疗对主流疗法无响应的其他多种自身免疫性疾病,包括关节炎、糖尿病、肌炎、克罗恩氏结肠炎(crohn’scolitis)和系统性红斑狼疮。
适用于治疗的自身免疫性疾病或炎性疾病包括自身免疫性血细胞减少症、特发性血小板减少性紫癜、类风湿性关节炎、系统性红斑狼疮、哮喘、川崎病、格林-巴利综合征、史蒂文斯-约翰逊综合征(stevens–johnsonsyndrome)、视神经脊髓炎、克罗恩氏结肠炎、糖尿病、慢性炎性脱髓鞘性多发性神经病、重症肌无力、抗因子viii自身免疫性疾病、皮肌炎、血管炎、葡萄膜炎、补体介导的疾病和阿尔茨海默氏病。应当理解,可以用本发明的蛋白质来治疗自身免疫性疾病或炎性疾病(例如上面列出的那些),而无需治疗性有效载荷。在这样的实施方案中,可以通过ivig或scig提供治疗。作为替代方案或补充,这些疾病可以通过与治疗性有效载荷缀合的本发明的蛋白来治疗。这种治疗性有效载荷可以是例如下调免疫系统成分的免疫调节剂。
待治疗的病况可以包括细胞因子网络失衡的炎性疾病,由病原性自身抗体、补体或自动侵袭性(autoaggressive)t细胞介导的自身免疫性疾病,或慢性复发性自身免疫、炎性或感染性疾病或过程的急性或慢性期。此外,包括了具有炎性成分的其他医学病况,例如肌萎缩性侧索硬化症、亨廷顿氏病、阿尔茨海默氏病、帕金森氏病、心肌梗塞、中风、乙型肝炎、丙型肝炎、人免疫缺陷病毒相关的炎症、t细胞白血病病毒相关的炎症、肾上腺脑白质营养不良和癫痫病,尤其是那些被认为与病毒后脑炎相关的疾病,包括拉斯穆森综合征(rasmussensyndrome)、韦斯特综合症(westsyndrome)和伦诺克斯·盖索特综合征(lennox-gastautsyndrome)。
待治疗的病况可以是血液免疫性疾病,例如特发性血小板减少性紫癜、同种免疫/自身免疫性血小板减少症、获得性免疫血小板减少症、自身免疫性中性粒细胞减少症、自身免疫性溶血性贫血、细小病毒b19相关的红细胞发育不良、获得性抗因子viii自身免疫反应、获得性vonwillebrand病、多发性骨髓瘤和意义未明的单克隆丙种球蛋白病、再生障碍性贫血、纯红细胞发育不良、戴-布二氏贫血(diamond-blackfananemia)、新生儿溶血性疾病、免疫介导的中性粒细胞减少症、血小板输注无效、新生儿输血后紫癜、溶血尿毒症、全身性血管炎、血栓性血小板减少性紫癜或埃文氏综合征(evan'ssyndrome)。
或者,可以治疗神经免疫疾病,例如神经炎、格林-巴利综合征、慢性炎性脱髓鞘性多发性神经根神经病、副蛋白血症igm脱髓鞘性多发性神经病、兰伯特-伊顿肌无力综合征(lambert-eatonmyasthenicsyndrome)、重症肌无力、多灶性运动神经病、与抗gm1抗体相关的下运动神经元综合征、脱髓鞘、多发性硬化症和视神经炎、僵人综合症(stiffmansyndrome)、伴有抗yo抗体的副肿瘤性小脑变性、副肿瘤性脑脊髓炎、伴有抗hu抗体的感觉神经病、癫痫、脑炎、脊髓炎、脊髓病(特别是与人类t细胞嗜淋巴病毒1相关的)、自身免疫性糖尿病神经病或急性特发性自主神经失调神经病和阿尔茨海默氏病。
可以治疗风湿性疾病,例如川崎病、类风湿关节炎、费蒂综合症(felty'ssyndrome)、anca阳性血管炎、自发性多发性肌炎、皮肌炎、抗磷脂综合症、反复自然流产、系统性红斑狼疮、幼年特发性关节炎、雷诺氏病(raynaud's)、crest综合征或葡萄膜炎。
可以治疗皮肤免疫疾病,例如表皮坏死、坏疽、肉芽肿、自身免疫性皮肤水疱病包括寻常性天疱疮、大疱性类疱疮和落叶型天疱疮、白癜风、链球菌中毒性休克综合征、硬皮病、全身性硬化症包括弥漫性和局限性皮肤系统性硬化、特应性皮炎或类固醇依赖性特应性皮炎。
可以治疗肌肉骨骼免疫疾病,例如包涵体肌炎、坏死性筋膜炎、炎性肌病、肌炎、抗decorin(bj抗原)肌病、副肿瘤性坏死性肌病、x连锁空泡性肌病、青霉胺(penacillamine)诱发的多发性肌炎、动脉粥样硬化、冠状动脉病或心肌病。
可以治疗胃肠道免疫疾病,例如恶性贫血、自身免疫性慢性活动性肝炎、原发性胆汁性肝硬化、乳糜泻、疱疹样皮炎、隐源性肝硬化、反应性关节炎、克罗恩病、惠普尔病(whipple'sdisease)、溃疡性结肠炎或硬化性胆管炎。
疾病可以是例如感染后疾病炎症、哮喘、伴有抗β细胞抗体的1型糖尿病、干燥综合征(sjogren'ssyndrome)、混合性结缔组织病、艾迪生氏病(addison'sdisease)、沃格特-小柳-原田综合症(vogt-koyanagi-haradasyndrome)、膜增生性肾小球肾炎、古德氏综合征(goodpasture'ssyndrome)、格雷夫斯氏病(graves'disease)、桥本氏甲状腺炎(hashimoto'sthyroiditis)、韦格纳肉芽肿病(wegener'sgranulomatosis)、多发性微小动脉瘤、churg-strauss综合征(churg-strausssyndrome)、结节性多发性动脉炎或多系统器官衰竭。
用于治疗的示例性疾病是特发性血小板减少性紫癜(itp)。
应当理解,能够通过ivig治疗的病况,例如上面列出的那些,也可以通过scig治疗。因此,本发明还提供了本发明的蛋白质或组合物在用scig治疗这些病况中的用途。
发明人认为,本发明的蛋白质可以使其自身用于改进的活化和/或致耐受性疫苗中。这样的疫苗可能适用于可能不需要补体激活的个体。
本发明的蛋白质可用于预防或治疗由siglec-1受体介导的疾病。这样的疾病包括感染因子通过siglec-1结合的疾病,例如病毒感染。合适的病毒感染包括由例如人类免疫缺陷病毒、t细胞白血病病毒引起的逆转录病毒感染。
由siglec-1受体介导的疾病可以用本发明的蛋白质预防或治疗,而不管它们是否与治疗性有效载荷缀合。未与治疗性有效载荷缀合的本发明蛋白可以通过竞争性结合阻断siglec-1受体来预防或治疗疾病。或者,本发明的蛋白,无论是否与治疗性有效载荷缀合,都可以通过触发来自这些受体的效应子功能来实现治疗活性。与治疗性有效载荷缀合的本发明蛋白质可以通过治疗性有效载荷的治疗作用,或通过治疗性有效载荷的治疗作用以及通过竞争性结合阻断siglec-1受体的组合,来预防或治疗疾病。
如说明书中其他地方所述,本发明的那些蛋白质(其中缺失了存在于igg重链恒定区和尾段区的天然序列中的、形成链间二硫键的半胱氨酸残基,并引入了额外的糖基化位点(例如seqidno:3所示))代表用于预防或治疗由siglecs(例如siglec-1)调节的疾病的特别合适的实施方案。
本发明的蛋白质,特别是那些能够结合血凝素的蛋白质,可能尤其适用于预防或治疗病毒感染,其中这些蛋白质可以单独使用,也可以与ivig治疗组合使用,例如与中和性单克隆抗体或为了流感反应性富集的ivig组合。
本发明的核酸
本发明的第八方面提供了编码本发明蛋白的核酸。在合适的实施方案中,核酸可以编码嵌合多肽,其中缺失了对应于igm的575位(相当于seqidno:1的c248)的半胱氨酸。在这样的实施方案中,248位(对应于seqidno:1)的半胱氨酸残基可以被丙氨酸残基取代。在另一个实施方案中,除了半胱氨酸残基修饰以外,该嵌合多肽还在对应于seqidno:1的残基1的位置处包含人工糖基化位点。
本发明的核酸可以是编码本发明蛋白质的dna分子。或者,本发明的核酸可以是编码本发明蛋白的rna分子。
适当地,本发明的核酸可以包含seqidno:13,其编码seqidno:2的多肽。
在合适的实施方案中,本发明的核酸可以与seqidno:12具有至少70%的同一性,与seqidno:12具有至少75%的同一性,与seqidno:12具有至少80%的同一性,与seqidno:12具有至少85%的同一性,与seqidno:12具有至少90%的同一性,与seqidno:12具有至少95%的同一性,与seqidno:12具有至少96%的同一性,与seqidno:12具有至少97%的同一性,与seqidno:12具有至少98%的同一性,或与seqidno:12具有至少99%的同一性。
应当理解,可以将本发明的核酸并入较大的核酸序列中,该较大的核酸序列将包含不编码本发明蛋白质的区域。仅举例来说,可以将本发明的核酸并入表达质粒中,例如pfuse-hlgg1-fc-tp-lh309/310cl或pfuse-hlgg1-fc-tp-l310h。
本发明蛋白质的生产
本发明的蛋白质既适合作为临床候选者,又适合大规模生产。fc片段是一类众所周知的化合物,甚至已用于治疗儿童的特发性血小板减少症(itp)。使用可用于中国仓鼠卵巢(cho)细胞(制药行业的生产主力)的现有抗体流水线,也很容易制造它们。
本发明的第九方面提供了生产本发明蛋白质的方法。这些方法包括在宿主细胞中表达根据本发明第六方面的核酸。
在合适的实施方案中,宿主细胞可以是真核宿主细胞。特别地,合适的真核表达宿主可以选自由以下组成的组:酵母(例如巴斯德毕赤酵母和酿酒酵母)和哺乳动物细胞系统。
合适的哺乳动物细胞系统可以选自由以下组成的组:hek-293细胞、cho-k1细胞、小鼠来源的ns0细胞和bhk细胞。其他合适的哺乳动物细胞系统是技术人员已知的。应当理解,合适的宿主细胞将包含将聚糖连接至表达的蛋白质的手段。
在一个特定的实施方案中,本发明的蛋白质在cho-k1细胞中表达。
还应理解,表达本发明蛋白的细胞类型可能影响本发明蛋白与唾液酸之间形成的键的类型。举例来说,在cho-k1细胞中生产的本发明蛋白质可能只形成α2,3键,因此可能只结合siglec-1(与siglec-2相反)受体,或流感嗜血凝集素,对a2,3-连接的唾液酸具有偏好。
然而,在其他类型的细胞,例如人细胞(例如hela或hek细胞)中表达本发明蛋白质,可以允许形成α2,3键和α2,6键。α2,6键的存在可以使本发明蛋白质结合siglec-2受体(也称为cd22)。本发明蛋白质结合siglec-2受体的能力在自身免疫疾病的治疗中可能特别有用,例如通过ivig或scig治疗。
因此,将认识到,可以参考要实现的所需糖基化和该蛋白质的预期治疗用途来选择要在其中表达本发明蛋白质的细胞。
发明人相信,形成单体的本发明蛋白质提供了各种实际的优点。例如,由于本发明蛋白质以均一的单体形式产生,因此简化了制造过程。因此,可以省去选择仅特定大小的蛋白质的步骤。某些蛋白质具有不聚合的能力的事实,也可以延长包含本发明的那些蛋白质的产品的贮藏寿命,而不必担心它们会聚合并失去其生物学活性。
本发明的某些方面。
1.糖基化修饰的蛋白
如上所述,wo2016/009232(利物浦热带医学院)公开了嵌合蛋白的多聚体形式,其在糖基化位点的数目上具有改变/修饰。为了形成多聚体蛋白,其中公开的蛋白应缺失asn77或asn236残基,但不能同时缺失两者(参见wo2016/009232的第5页,第2段)。
出人意料的是,发明人发现包含缺失了(通过取代)asn77和asn236残基之一或两者和半胱氨酸248的免疫球蛋白的fc受体结合部分的嵌合蛋白显示出与fcγri、fcgriiia和fcγriib的优异结合并结合c1q和c5b-9。因此,此类分子是免疫增强剂,这使得它们特别适合用作用于诸如疫苗接种之类的目的的抗原递送媒介物。关于与fcγriiia、fcγri和c1q的结合,参见上文。突变体c309l/n563a/c575a可能适合疫苗接种目的。因此,可以将来自特定病毒(例如流感、寨卡病毒或hiv)的抗原连接至此类嵌合fc突变体(作为治疗性有效载荷)并用于疫苗接种。
因此,根据本发明的第三方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含免疫球蛋白g重链恒定区和免疫球蛋白尾段区,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而少具有至少两个糖基化位点。这些蛋白质在本文中称为“糖基化修饰蛋白质”。在一个特定的实施方案中,这种蛋白质也缺失了尾区中的半胱氨酸(例如在575位)。
在糖基化修饰蛋白的一个实施方案中,与衍生免疫球蛋白g重链恒定区和免疫球蛋白尾段区的天然免疫球蛋白序列相比,在每条多肽链中,缺失了对应于seqidno:1的残基77和seqidno:1的残基236的位置处的天冬酰胺残基。在一个实施方案中,对应于seqidno:1的残基77的位置上的天冬酰胺残基已被丙氨酸取代。在一个实施方案中,对应于seqidno:1的残基236的位置上的天冬酰胺残基已被丙氨酸取代。在其他实施方案中,这种蛋白质还缺失了对应于seqidno:1的残基248的位置上的半胱氨酸残基。包含这样的修饰的本发明的蛋白质的实例包括具有seqidno:9和10中任何一个所公开的序列的多肽链。
在糖基化修饰蛋白的一个特定实施方案中,所述嵌合fc受体结合蛋白在对应于seqidno:1中89位的位置处具有半胱氨酸残基。
在糖基化修饰蛋白的一个特定实施方案中,所述嵌合fc受体结合蛋白缺失了对应于seqidno:1中248位的位置处的半胱氨酸残基。
在糖基化修饰蛋白的一个特定实施方案中,所述嵌合fc受体结合蛋白能够结合fcγri和fcγriib。在另一个实施方案中,所述嵌合fc受体结合蛋白能够结合c1q。在另一个实施方案中,所述嵌合fc受体结合蛋白能够结合c1q和c5b-9。
每条嵌合多肽链还包含铰链区。在合适的实施方案中,铰链区可以位于fc受体结合部分的n-末端。铰链区可以是天然的或合成的铰链区,如本文进一步所述。
在另一个实施方案中,每条嵌合多肽链还包含位于免疫球蛋白g重链恒定区和免疫球蛋白尾段区之间的接头区。合适的接头区在本说明书的其他地方。
在另一个实施方案中,本发明的糖基化修饰蛋白的一条或两条嵌合多肽链包含治疗性有效载荷部分。合适的治疗性有效载荷在本说明书的其他地方描述。合适地,可以将有效载荷与本发明蛋白质的fc受体结合部分缀合。或者,可以将其与本发明蛋白质的铰链区缀合。
糖基化修饰蛋白质的实例包含seqidno:10中的氨基酸序列。seqidno:10的蛋白质是非常有用的蛋白质实例,非常适合其中需要蛋白质与fcγriib受体结合(例如,以将有效载荷递送给表达这些受体的免疫细胞,例如b细胞)的医学用途和方法。
适用于本发明的半胱氨酸残基分子/蛋白质的每个方面可以应用于本节中描述的糖基化修饰的蛋白质。
因此,根据另一方面,提供了包含本文所述的糖基化修饰蛋白的组合物。
根据本发明的另一方面,提供了包含本文所述的糖基化修饰蛋白的组合物,其用作药物。
这样的糖基化修饰蛋白质或组合物可以用作预防和/或治疗传染病的药物。特别地,它们可以用作疫苗,以将抗原呈递给机体。此类疾病的合适实例是病毒,例如hiv,其使用唾液酸受体(例如siglec-1)调节体内感染性和随后的免疫反应(hammonds等人,plospathog.2017jan27;13(1):e1006181.doi:10.1371/journal.ppat.1006181.ecollection2017jan.)。
或者,本发明的蛋白质或组合物可以用作预防和/或治疗通过结合fcγri和/或fcγriib介导的疾病的药物。通过结合fcγri和/或fcγriib介导的疾病在本说明书的其他地方进行了讨论(另参见:akinrinmadeoa,chettys,daramolaak,islammu,thepent,barths.biomedicines.2017sep12;5(3).pii:e56.doi:10.3390/biomedicines5030056.review)。
预防或治疗疾病的方法包括向需要这种预防或治疗的受试者提供治疗有效量的糖基化修饰蛋白或包含其的组合物。受试者可以是人类受试者。施用可以是ivig或scig。
根据另一方面,提供了编码这种糖基化修饰蛋白质的核酸。
根据另一方面,提供了一种生产如上所述的糖基化修饰蛋白质的方法,该方法包括在宿主细胞中表达编码这种糖基化修饰蛋白质的核酸。
2.cys309修饰的蛋白质
本发明的另一种蛋白质是这样的蛋白质:它们缺失了重链恒定区中的、能够形成非固有二硫键的半胱氨酸残基,但在尾段区中具有至少一个能够形成非固有二硫键的半胱氨酸残基。这种蛋白质的实例包含seqidno:11中所示的氨基酸序列。
因此,根据本发明的另一个方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链都包含免疫球蛋白g重链恒定区、免疫球蛋白尾段区和铰链区,其中每条多肽链的氨基酸序列均缺失了重链恒定区中的、能够形成非固有二硫键的半胱氨酸残基,但在尾段区中具有至少一个能够形成非固有二硫键的半胱氨酸残基。
包含这种修饰的本发明蛋白质的实例包括具有seqidno:4、6或11中公开的序列的多肽链;每个都显示与fcγri和fcγriiia强结合。
在一个实施方案中,这种cys309修饰的蛋白质能够结合fcγri和fcγriiia。结合fcγri和fcγriiia的能力在抗癌剂和疫苗中是期望的。
适用于本发明的半胱氨酸残基分子/蛋白质的每个方面也可以应用于本节中描述的cys309修饰的蛋白质。
3.血凝素结合分子
本发明的另一种蛋白质是能够结合血凝素的蛋白质。这样的分子在蛋白质的每个末端处或接近每个末端处具有糖部分。具有asn221和asn563的分子是特别合适的。
预计此类分子适合治疗或预防由通过唾液酸受体进入细胞的病原体介导的疾病,例如流感。
当前用于流感的药物疗效有限:奥司他韦(oseltamivir,tamiflutm)和扎那米韦(zanamivir)小幅减少成人首次缓解流感症状的时间。使用奥司他韦可以增加成人恶心、呕吐、精神病事件和儿童呕吐的风险。奥司他韦对2009a/h1n1流感患者的死亡率没有保护作用。用任一神经氨酸酶抑制剂(ni)预防均可减少个人和家庭的症状性流感。在决定使用ni预防或治疗流感时,应考虑利与弊之间的平衡。所有可用的抗流感药物(例如奥司他韦)都是病毒神经氨酸酶的小分子抑制剂。这是他们唯一的作用机制。此外,这些类型的药物并非没有风险。例如,许多研究已记录到威胁生命的异常行为,包括最近一项针对10-19岁儿童的研究。参见plosone.2015jul1;10(7):e0129712.doi:10.1371/journal.pone.0129712.ecollection2015。
由于奥司他韦目前是一种在药品和保健产品监管局的严格监控下的黑色三角形药物,因此显然需要开发更安全的替代品。奥司他韦也存在供应问题,因为它源自天然产物,这意味着它并不总是可以大量使用。
因此,根据本发明的第二方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链都包含免疫球蛋白g重链恒定区、免疫球蛋白尾段区和铰链区,其中每条多肽链的氨基酸序列都在n-末端(例如asn-221)或接近n-末端处具有糖部分,并且在c-末端(例如asn563或asn573)或接近c-末端处具有糖部分。
“在……处”或“接近”是指末端氨基酸或在该末端的12个氨基酸内,例如在8个氨基酸内或在5个氨基酸内。
这样的分子可以用作病原体阻断剂,特别是阻断唾液酸依赖性病毒,例如流感(flu)和新城疫病毒。
可以被阻断的其他病原体的实例包括:革兰氏阳性菌,例如肺炎链球菌、脑膜炎奈瑟氏球菌、大肠杆菌k1和空肠弯曲菌;或革兰氏阴性菌,例如铜绿假单胞菌、流感嗜血杆菌、杜克雷嗜血杆菌、多杀性巴斯德氏菌;和寄生虫,例如克氏锥虫和杜氏利什曼原虫;和病毒,例如:流感病毒、猪繁殖与呼吸综合征病毒、轮状病毒、副粘病毒(例如新城疫病毒和风疹病毒)、诺如病毒、肠病毒、轮状病毒、多瘤病毒(例如默克尔细胞多瘤病毒)、冠状病毒(包括mers和sars)、腺病毒(例如ad37)和慢病毒(例如hiv-1)。
在一个特定的实施方案中,该分子在n-末端包含一个asn,在c-末端-3位包含一个asn。c末端-3位是从c末端开始的第三个氨基酸。需要在此处添加糖部分,是因为高尔基体需要nxs/t基序才能将糖连接到asn(n)。
根据本发明的另一个方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链都包含免疫球蛋白g重链恒定区、免疫球蛋白尾段区和铰链区,其中每条多肽链的氨基酸序列都在n-末端(例如asn-221)或接近n-末端处具有糖部分,并且在c-末端(例如asn563)或接近c-末端处具有糖部分,其用于治疗或预防由依赖唾液酸受体相互作用的病原体介导的疾病。唾液酸相互作用,是指病原体,例如病毒或细菌,与宿主唾液酸受体结合。
根据本发明的另一个方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链都包含免疫球蛋白g重链恒定区、免疫球蛋白尾段区和铰链区,其中每条多肽链的氨基酸序列都在n-末端(例如asn-221)或接近n-末端处具有糖部分,并且在c-末端(例如asn563)或接近c-末端处具有糖部分,其用于治疗或预防病毒感染,例如流感病毒或新城疫病毒。
根据本发明的另一个方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和尾段区,并且其中每条多肽链包含两个相距约
根据本发明的另一个方面,提供了一种嵌合fc受体结合蛋白,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段区,并且其中每条多肽链包含两个相距约
在一个特定的实施方案中,这样的双糖分子还缺失了免疫球蛋白g重链恒定区和尾段区(例如免疫球蛋白尾段区)中的、能够形成链间二硫键的任何半胱氨酸氨基酸。在一个具体的实施方案中,这样的双糖分子在生理条件下形成单体。
据预测,结合唾液酸受体的本发明蛋白质适合于预防或治疗由需要结合唾液酸才能进入细胞的病原体(例如病毒)介导的疾病。不同于本质上由dna编码的蛋白质是可突变的,与碳水化合物的结合接触不太可能发生突变,否则病原体(例如病毒)无法与进入所需的唾液酸结合。与受体上的这些唾液酸结合的本发明分子使病原体(例如病毒)无法通过ha或神经氨酸酶与之相互作用。不希望被理论所束缚,由于含有唾液酸,本发明的分子也可能竞争病毒神经氨酸酶并且也干扰其作用。因此,本发明的分子不只具有一种作用机制,而是可能通过多种作用机制干扰病毒。大多数具有单特异性的小分子药物和抗体(例如单克隆抗体或神经氨酸酶抑制剂)无法做到这一点。
还预测,本发明的这些分子将逃避病原体(例如病毒)采用的耐药性机制。例如,阻断血凝素(ha)或神经酰胺酶(na)上的受体结合位点(rbs)的中和抗体(无论是通过疫苗产生还是被动疗法中使用的)也与这些分子的相邻区域接触。换句话说,它们在ha或na上都有较大的表面积足迹(footprint)。这些足迹区在不同毒株之间显示出高度的序列多样性,这就是为什么rbs反应性抗体通常是毒株特异性的原因,使得不可避免地每年不断地重新配制疫苗。因为本发明的分子比完整抗体小得多,并且仅具有聚糖结合接触,所以相邻相互作用的可能性小得多,因此降低了逃逸突变的机会。
本发明的蛋白质
如本文所用,“本发明的蛋白质”是嵌合fc受体结合蛋白,与衍生其的天然/野生型免疫球蛋白中存在的序列相比,其包含氨基酸序列的一个或多个修饰,如本文所述。本发明的一类蛋白质是“半胱氨酸残基分子”。本发明的另一类蛋白质是“血凝素结合蛋白”。本发明的另一类蛋白质是“糖基化修饰的蛋白质”,本发明的另一类蛋白质是“cys309”修饰的蛋白质。因此,尽管本发明的第一方面涉及本发明的“半胱氨酸残基分子”蛋白,本发明的第二方面涉及本发明的“血凝素结合”蛋白,并且本发明的第三方面涉及本发明的“糖基化修饰”的蛋白质,但是第四、第五、第六、第七、第八和第九方面涉及本发明的任何蛋白质,即“半胱氨酸残基分子”、“糖基化修饰的蛋白质”、“cys309修饰的蛋白质”、“血凝素结合”蛋白和本发明的任何其他蛋白质。
现在将参考以下实施例和附图进一步描述本发明,其中:
图1.显示生成聚糖和半胱氨酸突变体的示意图。
a)显示各种hexa-fc聚糖突变体的示意图,其中cys575突变为丙氨酸以产生c575a组突变体。红色星号表示铰链asn221、cg2asn297和尾段asn563聚糖位点。
b)显示来自(a)的c575a组的聚糖突变体的示意图,其中将cys309和亮氨酸310另外改变为亮氨酸和组氨酸(如天然igg1fc序列中存在的那样),以产生c309l/c575a组突变体。红色星号表示铰链asn221、cg2asn297和尾段asn563聚糖位点。
图2.通过sds-page表征突变的fc蛋白。
a,n563a/c575a、n297a/n563a/c575a形成了梯形多聚体(红色箭头),其折叠中间体(蓝色箭头)不同于hexa-fc-对照形成的中间体。asn-563感受态突变体c575a和n297a/c575a主要以单体运行,也存在二聚体和三聚体。因此,在存在cys-309但不存在cys-575的情况下,去除asn-563有利于多聚化。向这些突变体中添加nx(t/s)聚糖序列子产生n-末端糖基化的铰链(d221n系列突变体)不会影响多聚化,但会增加所有突变体的分子量。b,与a相同的突变体,但在还原条件下运行。在fc中观察到的分子量下降表示n-联聚糖的序列缺失。因此,n297a/n563a/c575a突变体具有最小的分子量,因为它没有与fc连接的聚糖,而d221n/c575a具有最大的分子量,因为它具有三个连接的聚糖。先前已经描述了在asn-221、asn-297和asn-563上连接的聚糖的类型23。c,在a所示的突变体中用亮氨酸取代cys-309,以产生双半胱氨酸敲除,其以单体运行。c309l/n297a/c575a单体的分子量不同,最有可能代表asn-563的糖基化差异。d,与c中相同的突变体,但在还原条件下运行。所有蛋白质均在非还原或还原条件下以每泳道1μg蛋白质在4-8%丙烯酰胺梯度凝胶上进行电泳,转移到硝酸纤维素膜上,并用抗人igg-fc(sigma)进行印迹。
图3.c309l和c575a双半胱氨酸igg1-fc单体糖基化突变体与聚糖受体的结合。
通过elisa表明,缺失n297和/或n563聚糖的突变体严格限制了其结合聚糖受体的能力。除了mbl、mmr和dc-sign以外,向asn-297和/或asn-563缺陷型突变体中的221位添加n-联糖可恢复与所有研究受体的结合。将asn-221插入asn-297/asn563感受态突变体c309l/c575a中可增强与所有研究的聚糖受体的相互作用。误差线代表平均值附近的标准偏差,n=2个独立实验。
图4.c575aigg1-fc糖基化突变体与聚糖受体的结合。
与cys-309也突变为丙氨酸的同等突变体相比,易于通过cys-309相互作用发生多聚化的蛋白质(如图2a所示)使聚糖-受体啮合的能力较弱。除siglec-1外,asn-221的插入无作用,或不利于多聚体与聚糖受体的结合。误差线代表平均值附近的标准偏差,n=2个独立实验。
图5.c309l和c575a双半胱氨酸igg1-fc单体糖基化突变体与经典fcγr的结合。
d221n/c309l/n563a/c575a突变体显示与fcγri,fcγriib和fcγriiia的结合增强,而c309l/n563a/c575a仅显示与fcγri和fcγriiia的结合增强,这归因于存在或不存在asn-221。对于所研究的任何突变体,未观察到与fcγriia或fcγriiib的结合的改善。误差线代表平均值附近的标准偏差,n=2个独立实验。关键词:x-igg1-fcwt;*-hexa-fcwt;有交叉的圆圈–c309l;空心圆–c309l/c575a;空心三角形–c309l/n297a/c575a;空心倒三角形(指向下)-c309l/n563a/c575a;空心方形-c309l/n297a/n563a/c575a;黑色圆圈–d221n/c309l/c575a;黑色三角形–d221n/c309l/n297a/c575a;黑色倒三角形–d221n/c309l/n563a/c575a;黑色正方形–d221n/c309l/n297a/n563a/c575a。
图6.c575aigg1-fc糖基化突变体与经典fcγr的结合。
易于通过cys-309相互作用进行多聚化的突变体n563a/c575a(如图2a所示)与fcγri和fcγriiia强烈结合,如带有相同突变的c309l/n563a/c575a单体(图5)所见。类似地,d221n/n563a/c575a突变体显示与fcγri和fcγriii的结合增强,但与之形成鲜明对照地,包含相同突变的单体(图5中的d221n/c309l/n563a/c575a)不结合fcγriib。因此,在多聚体中,asn-221的存在会限制与fcγriib的相互作用,而asn-221与单体连接时,该相互作用会增强。如用单体发现的,未观察到与fcγriia或fcγriiib的结合的改善。误差线代表平均值附近的标准偏差,n=2个独立实验。关键词:x-igg1-fcwt;*-hexa-fcwt;空心圆–c575a;空心三角形–n297a/c575a;空心倒三角形(指向下)-n563a/c575a;空心方形-n297a/n563a/c575a;黑色圆圈–d221n/c575a;黑色三角形–d221n/n297a/c575a;黑色倒三角形–d221n/n563a/c575a;黑色正方形–d221n/n297a/n563a/c575a。
图7.c309l和c575a双半胱氨酸igg1-fc单体糖基化突变体与补体的结合。
c309l/n563a/c575a和c309l/n297a/n563a/c575a突变体均与c1q结合并允许c5b-9沉积。将asn-221插入这两个突变体中以产生d221n/c309l/n563a/c575a和d221n/c309l/n297a/n563a/c575a允许clq沉积,但阻止了随后的c5b-9沉积。这表明asn-221聚糖的存在阻止了经典途径的后续下游激活,但允许c1q结合。如在c309l/n297a/c575a或d221n/c309l/n297a/c575a中,仅去除了asn-297聚糖的突变体无法结合c1q或固定c5b-9。误差线代表平均值附近的标准偏差,n=2个独立实验。关键词:x-igg1-fcwt;空心圆-c309l/c575a;空心三角形–c309l/n297a/c575a;空心倒三角形(指向下)-c309l/n563a/c575a;空心方形-c309l/n297a/n563a/c575a;黑色圆圈–d221n/c309l/c575a;黑色三角形–d221n/c309l/n297a/c575a;黑色倒三角形–d221n/c309l/n563a/c575a;黑色正方形–d221n/c309l/n297a/n563a/c575a。
图8.c575aigg1-fc糖基化突变体与补体的结合。
除d221n/n563a/c575a以外,asn-221的存在抑制了与c1q的结合,但是包括d221n/n563a/c575a在内的所有含asn-221的突变体均无法固定c5b-9,如先前针对cys-309/cys-575感受态多聚体所描述的23。误差线代表平均值附近的标准偏差,n=2个独立实验。关键词:x-igg1-fcwt;有交叉的圆圈–c309l;空心圆–c575a;空心三角形–n297a/c575a;空心倒三角形(指向下)-n563a/c575a;空心方形-n297a/n563a/c575a;黑色圆圈–d221n/c575a;黑色三角形–d221n/n297a/c575a;黑色倒三角形–d221n/n563a/c575a;黑色正方形–d221n/n297a/n563a/c575a。
图9.来自n297a/c575a和d221n/n297a/n563a/c575aigg1-fc突变体的全甲基化n-聚糖的maldi-tofms谱图。
以正离子模式获得数据以观察[m+na]+分子离子。所有结构均基于生物合成途径的组成和知识。括号外显示的结构尚未明确定义其触角位置。
图10.fc糖基化的影响。
(a)c575a/c309a组和(b)c575a组的fc糖基化突变体与血凝素的elisa结合。(c)fc糖基化对血凝抑制的影响。将恒定量的甲型流感病毒h1n1新喀里多尼亚群岛/20/99(influenzaanewcaledonia/20/99virush1n1)与滴定量的fc聚糖突变体一起孵育,并添加到人o+红细胞中,然后在室温下沉积1小时。未凝集的rbc形成一个小的光环。n=2个独立实验。
图11.
该模型显示了可变糖基化的igg1fc与聚糖受体的顺式相互作用。igg1中asn297的聚糖(左)被包埋,无法直接与受体相互作用。但是,在fc的n-末端和c-末端(asn221和asn563)均带有聚糖的单体会暴露(中和右),因此可以与受体有更大的顺式结合,而这是唾液酸依赖性受体所喜欢的41。
图12.
c309l/c575a双半胱氨酸敲除突变体(左列)和c575a半胱氨酸突变体(右列)的sec-hplc色谱图。
实施例
简介
越来越多地探索多聚化的fc和fc融合蛋白用于新的药物和疫苗方法。一个潜在的多产领域是其作为仿生替代品用于静脉内免疫球蛋白(ivig)疗法的开发。ivig是获得fda批准的非常成功的生物药,用于治疗特发性血小板减少性紫癜(itp)、川崎病、格林-巴利综合征、格雷夫斯眼病和许多多发性神经病。临床医生越来越多地将ivig视为治疗多种其他疾病的万不得已的灵药,这些疾病包括:贫血、关节炎、狼疮、移植排斥、流产和慢性疼痛。特别是当这些疾病对常规疗法无反应时。
当前药物的许多其他不足之处,加重了对ivig的全球短缺和需求,最主要的是其制造依赖于人类供体,引发了安全问题并大大增加了成本。雪上加霜的是,<5%的注射产品(正确糖基化的和/或寡聚-fc)具有治疗活性,导致需要高剂量(2g/kg)。因此,ivig是昂贵的,并且由于过量ivig加载而引起的不良事件并不少见。因此,迫切需要临床开发用于临床的ivig的合成替代品。
ivig的作用机理尚未完全了解。尽管fab’2和fc介导的机制都可能参与,但在人体内注入fc片段足以改善itp。ivig通过与低亲和力抑制性受体结合和/或在体内形成复合物来抑制有害炎症,从而使ivig与这些受体以更高的亲和力相互作用,从而介导更有效的抗炎作用。尚不确定所涉及的确切的受体或受体的组合,但是经典(1型,例如fcγriib、fcγriiia)和非经典(2型,例如fcγr,例如dc-sign、cd22、fcrl5)都与其治疗功效相关。
基于fc复合物可以诱导耐受这一发现,正在积极研究许多不同的fc多聚化方法。一种利用人igg2铰链区的方法在引入小鼠igg2a-fc时会产生分子量不同的梯形顺序多聚体。被称为“stradomerstm”的高阶多聚体与低亲和力的fcγr和sign-r1强烈结合,并被证明可以保护动物免受胶原蛋白诱发的关节炎、itp、炎性神经病和自身免疫性重症肌无力的影响。
发明人采取了另一种多聚化方法,该方法通过将寡聚igm的18个氨基酸尾段融合到igg1-fc中,同时将309位的leu取代为cys,以得到称为hexa-fc的分子。这些分子形成了确定的五聚体和六聚体结构,其与受体的结合被证明严重依赖于n-联糖基化。糖基化对于增加溶解度以及影响与聚糖受体和fc受体的相互作用都是重要的。hexa-fc在cγ2结构域的asn297位置处和hexa-fc的18个氨基酸igm尾段的asn563位置处包含两个n-联糖基化位点。六聚体fc还与人类新生儿受体(fcrn)结合,已知这种相互作用对于维持长的体内半衰期和增强免疫原性至关重要。在三个专利申请中已经报道了相似分子在itp小鼠模型中的功效(wo2015132364、wo2015132365和wo2017129737)。
糖基化对于内质网中蛋白质的正确折叠以及将正确折叠的蛋白质输出到高尔基体进行翻译后修饰很重要。附着的聚糖还增加了蛋白质的溶解度,并且已经显示出能够显著影响igg与聚糖受体和fc受体的相互作用。fc中唯一可用的碳水化合物连接位点(asn297)的糖基化对于与1型和2型受体的相互作用必不可少。asn297的fc聚糖通常是双触角复合体类型,表现出高水平的核心glcnac残基岩藻糖基化,部分半乳糖基化和平分glcnac。在这些结构中,少于20%被唾液酸化。分支和末端结构(例如唾液酸)水平低的原因被认为是由于fc蛋白骨架对asn297聚糖加工的限制所致。
在ivig的去糖基化之后,fc的抗炎特性丧失了,已确定一系列带有igg的α2,6-唾液酸化的fc对控制炎症起了重要作用。唾液酸化水平越高,血清保留时间越长8,9。实际上,唾液酸化的fc的功效诱使人们去修饰asn297上现有的聚糖,通过化学手段或通过在fc蛋白骨架上进行诱变程序,破坏蛋白质-asn297-碳水化合物界面。
人igg1-fc通常不结合聚糖受体,因为与asn-297连接的聚糖大部分包埋在由ch2-ch3同型二聚体形成的腔内26,27。通过赋予位于下部铰链的fcγr结合区的构象变化,在asn-297上连接的聚糖的位置和含量还能够调节fc与经典fcγr结合的亲和力28。在此,发明人表明,通过诱变程序,破坏二硫键,同时增强igg1-fc中的n-联糖基化,可以克服asn-297定向受体结合的这些局限性(图1)。
为此,发明人通过删除关键的二硫键和/或插入/删除先前描述的igg-fc多聚体内的n-联天冬酰胺连接位点2,23,29,30,创建了一组人类单体igg1-fc突变体(图1)。这种方法不仅产生与低亲和力fcγr的结合增强的分子,而且还赋予了与先前不确定结合igg1-fc的受体(包括siglec-1、siglec-2、siglec-3、siglec-4、cd23、dectin-1、dectin-2、clec-4a(dcir)、clec-4d、mmr、mbl和dec-205)的结合。此外,发明人能够鉴定这样的单体突变体,其具有有限的结合fcγr的能力(例如cl309-310lh/n297a/n563a/c575a),但是对c1q的亲和力增强,这可以成为针对补体介导的疾病的有吸引力的治疗剂。
本文中,发明人表明,asn297处的n-聚糖(与ivig相比,其糖富含高甘露糖和半乳糖)对于hexa-fc受体结合至关重要。但是,发现连接至尾段asn563的聚糖比连接于asn297的聚糖更大,更复杂,并且在低聚物形式时,对受体结合并不关键,但对于确定形成的低聚物的类型至关重要。同时去除asn297和asn563会导致蛋白质表达显著下降,无法寡聚以及受体结合完全丧失。这些发现表明了n-联糖基化和尾段在维持hexa-fc的结构和功能方面的重要性,并因此转化为这些分子用于药物或疫苗应用的潜力。
另外,发明人采取了一种未探索过的方法来修饰糖基化,其通过以各种组合的方式将最多三个额外的n-联糖基化位点引入igg1-fc的暴露区域中(图1和9)。hexa-fc通常在cγ2结构域的asn297位置和hexa-fc的十八个氨基酸igm尾段的asn563处包含两个n-联糖基化位点。
材料和方法
许多这些方法和工具也公开于blundell等人(jimmunology.202(5):1595-1611,2019)。
糖基化突变体的产生。
先前已经针对在309和575位均包含半胱氨酸的hexa-fc描述了所有组合形式的聚糖突变体的产生23。为了制备图1a中描述的新突变体(其中将cys575突变为丙氨酸),对于编码指定聚糖修饰的每个质粒载体,使用一对内部错配引物5’-accctgcttgctcaactct-3’(seqidno:29)/3’-ggccagctagctcagtaggcggtgccagc-5’(seqidno:30)进行了pcr重叠延伸诱变。先前已经描述了用于这些新的pcr反应的亲本质粒23。然后使用引物对5’-tcaccgtcttgcaccaggact-3’(seqidno:31)/3’-agtcctggtgcaagacggtga-5’(seqidno:32)对所得的c575a突变体进行进一步修饰,以去除cys309/leu310,从而得到图1b中描述的双半胱氨酸敲除组。为了验证所需突变的并入并检查pcr诱导的错误,使用先前描述的侧翼引物23在两条链上对新突变体的开放阅读框进行了测序。
按照先前描述的方法2,30,使用fugene(promega)用质粒转染cho-k1细胞(欧洲细胞培养物保藏中心),并选择阳性克隆,扩增并纯化。
通过pcr重叠延伸诱变来构建以下取代突变,使用野生型载体(pfuse-higg1-fc-tp-lh309/310cl)作为模板,使用针对每个突变的内部错配引物对(如下所示)。
n297a:5’-gagcagtacgccagcacgtac-3’(seqidno:33)/
3’-ctcgtcatgcggtcgtgcatg-5’(seqidno:34);
n563a:5’-ccctgtacgccgtgtccctg-3’(seqidno:35)/
3’-gggacatgcggcacagggac-5’(seqidno:36);
d221n:5’-gttagatctaacaaaactcac-3’(seqidno:37)/
3’-caatctagattgttttgagtg-5’(seqidno:38);
c575a:5’-accctgcttgctcaactct-3’(seqidno:39)/
3’-ggccagctagctcagtaggcggtgccagc-5’(seqidno:40);
c309l:5’-tcaccgtcttgcaccaggact-3’(seqidno:31)/
3’-agtcctggtgcaagacggtga-5’(seqidno:32)
n297a/n563a:引物对n563a用于n297a突变质粒;
d221n/n297a:引物对n297a用于d221n突变质粒;
d221n/n563a:引物对n563a用于d221n突变质粒;
d221n/n297a/n563a:引物对n563a用于d221n/n297a突变质粒;
n563a/c575a:引物对c575a用于n563a突变质粒。
重叠pcr中使用了以下侧翼引物。它们是5’-accctgcttgctcaactct-3’(seqidno:43)和3’-tggtttgtccaaactcatcaa-5’(seqidno:44),它们是用于亚克隆到野生型载体中的ecori/bglii和nhei(都来自newenglandbiolabs)位点的上游或下游的71或22个碱基对。由eurofins合成编码人iga尾段(pthvnvsvvmaevdgtcy;seqidno:45)的dna,并作为avrii/nhei片段克隆到pfuse-higg1-fc-tp-lh309/310cl中。为了验证所需突变的并入并检查pcr诱导的错误,使用同一组侧翼引物在两条链上对新表达质粒的整个编码序列进行测序。按照先前对于hexa-fc描述的方法2,3,使用fugene(promega)用质粒转染cho-k1细胞(欧洲细胞培养物保藏中心),并选择阳性克隆,扩增并纯化。
受体和补体结合测定
先前已描述了有关突变体与四聚体人dc-sign(elicityl)、siglec-1、siglec-4和siglec-3(stratechscientific)结合的方法2,30。用于检测凝集素结合的elisa方案也用于siglec-2、cd23、dec-1、dec-2、clec-4a、clec-4d、mbl和mmr(stratechscientific或bio-techne),并且也已在先前进行了描述2,30。c1q和c5b-9的结合也已在先前进行了描述2,30。
使用elisa研究fc突变体与人fcγri、fcγriia、fcγriib、fcγriiia和fcγriiib(bio-techne)的结合。除非另有说明,否则在4℃下,将受体以2μg/ml在ph9的碳酸盐缓冲液(sigma-aldrich)中在elisa板(nunc)上包被过夜。将板在含有5%脱脂奶粉的pbs/0.1%tween-20(pbst)中封闭。将板在pbst中洗涤3次,然后添加指定浓度的fc突变蛋白,并在4℃保持过夜。如上所述洗涤板,并与1:500稀释的碱性磷酸酶缀合的山羊fab'2抗人igg(jacksonlaboratories)一起孵育2小时。洗涤板,并用100μl/孔的sigmafast对硝基苯基磷酸盐溶液(sigma-aldrich)显影15分钟。在405nm下读取板,并用graphpadprism绘制数据。
与血凝素结合
将elisa板用ph9的碳酸盐缓冲液中的5μg/ml重组ha(来自不同甲型和乙型流感病毒(bei资源)或天然甲型流感病毒h1n1新喀里多尼亚群岛(2bscientific))包被,并在4℃放置过夜。将板用tsm缓冲液(20mmtris-hcl,150mmnacl,2mmcacl2,2mmmgcl2)洗涤五次,然后用每孔150μl的含5%牛血清白蛋白的tms缓冲液封闭2h。如前所述洗涤后,在一式三份孔中加入100μl的在tsm缓冲液中的30μg/mlfc片段。fc片段在4℃下结合过夜。将板用过量的tsm缓冲液洗涤五次,然后在每孔中加入100μl在tms缓冲液中稀释500倍的碱性磷酸酶缀合的f(ab′)2山羊抗人igg1fcγ片段特异性检测抗体。室温下,在摇摆平台上,将与聚糖受体结合的糖基化fc片段与缀合抗体结合1小时。如上洗涤板,并用每孔100μl对磷酸硝基苯酯显影10分钟。使用lt-4500微孔板吸光度读数仪(labtech)在405nm处读取板,并用graphpadprism绘制数据。
血凝抑制测定
为了确定最佳的病毒与红细胞比例,在u形96孔板(thermoscientific)中制备了两倍的病毒原液(2bscientific)稀释液。向每个孔中加入相同体积的1%人o+红细胞悬液(innovativeresearch),并在室温下孵育60分钟,直到在阴性对照中形成红细胞沉淀。定量最佳病毒与红细胞浓度(4ha单位)后,从2μm浓度开始,依次制备fc、对照ivig(gammagard,baxterhealthcare)或多克隆山羊抗流感h1n1(bio-rad)的系列两倍稀释液,并与50μl最佳病毒稀释液混合。在4℃下孵育30分钟后,向所有孔中添加50μl人红细胞悬液,并在室温下孵育平板1h,此后可在阳性对照中观察到红细胞沉淀。
n糖组学分析(n-glycomicanalysis)
n糖组学分析是基于先前开发的方案,进行了一些修改84。简而言之,通过与nebrapidtmpngasef孵育从每个样品释放50ug的n-聚糖,并使用sep-pakc18色谱柱(waters)从肽中分离出来。将释放的n-聚糖过甲基化,然后进行基质辅助的激光解吸电离(maldi)ms分析。使用4800maldi-tof/tof质谱仪(appliedbiosystems)以正离子模式采集数据。使用dataexplorer(appliedbiosystems)和glycoworkbench分析数据85。所选峰的拟议分配基于组成以及生物合成途径的知识。
结果
二硫键合和糖基化影响hexa-fc的多聚化状态
为了确定两个n联糖基化位点(asn-297和asn-563)和两个半胱氨酸残基(cys-309和cys-575)在hexa-fc的多聚化中的作用,我们使用先前描述的hexa-fc作为模板,通过定点诱变,创建了两组糖基化和半胱氨酸缺陷型突变体(图1)23。我们还在n末端(d221n)插入了一个n联连接位点,以研究额外的糖基化对fc功能的影响(图1)。将这些突变的igg1-fcdna转染入cho-k1细胞后,建立了稳定的克隆细胞系,并通过蛋白a/g亲和层析纯化了分泌的fc。通过sds-page分析纯化的igg1-fc蛋白,并用抗人igg-fc进行免疫印迹(图2a、b)。
当在非还原条件下进行分析时(图2a),c575a突变体主要以单体(~55kda)的形式迁移,而二聚体(~110kda)和三聚体(~165kda)的比例很小。在asn-221处将聚糖插入c575a突变体(产生d221n/c575a)会导致三聚体组分损失,所观察到的二聚体比例降低,但是由于额外的n末端连接的asn-221糖,每种物质的分子量均有所增加(图2a、b)。
因为我们之前已经证明,去除hexa-fc中的尾段聚糖(asn-563)会导致形成十二聚体23,所以我们认为在c575a主链中引入类似的突变也会导致十二聚体形成增加。出乎意料的是,如在n563a/c575a、n297a/n563a/c575a、d221n/n563a/c575a和d221n/n297a/n563a/c575a突变体中,asn-563的去除导致形成不同分子量的梯形图,从~50至大于500kda(图2a,红色箭头),最有可能代表单体、二聚体、三聚体、四聚体、五聚体、六聚体等。这些物质之间的弱带最可能是25kda的折叠中间体,其中包括fc-半聚体(图2a,蓝色箭头)。由于这些突变体中存在cys-309(图2a、b),梯形图最有可能是通过两个相邻单体中cys-309中唯一可自由利用的巯基之间形成二硫键而形成的。我们推测,这四个n563a突变体中尾段聚糖的缺失使位于尾段中的疏水性氨基酸残基(val-564、leu-566和ile-567)聚集,从而在cys309上形成二硫键。
通过在还原条件下运行这些突变体,我们能够确定每个位置上连接的各种聚糖的相对大小和占有率,表明asn-221和asn-563连接的聚糖比在asn-297上连接的聚糖更大,并且完全无糖基化的空突变体(n297a/n563a/c575a)比hexa-fc或c575a聚糖感受态分子轻约10kda(图2b)。由于这些突变体中存在cys309(图1,图2a、b),梯形图可能是通过两个相邻单体中cys309上唯一可自由利用的巯基之间形成二硫键而形成的。我们推测,这四个n563a突变体中尾段聚糖的缺失使位于尾段中的疏水性氨基酸残基(val564、leu566和ile567)聚集,从而在cys309上形成二硫键。
为了检验cys-309确实导致了n563a缺陷型突变体出现梯形的假设,我们生成了第二组c575a突变体,其中cys-309突变为leu-309,leu-310突变为his-310,如在野生型igg1-fc序列中所示(图1b)。我们还生成了突变c309l,其中仍存在尾段cys575。该突变体在非还原条件下的运行与hexa-fc类似,但是出现了中间体(图2c,蓝色箭头),这在hexa-fc中不存在,这表明在cys-575的存在下,cys-309能够稳定四级结构。
重要的是,cys-309的缺失还导致以前在cys-309感受态突变体中看到的梯形消失(图2,c组与a组),所有双半胱氨酸突变体现在主要以单体形式运行。c309l/n297a/c575a突变体以四种不同的单体形式运行(图2c),在还原下分解为两个条带(图2d)。这些条带最有可能代表asn-563上出现的聚糖变体。鉴于c309l/c575a突变体中不存在这些变体,我们得出的结论是,asn-297聚糖的存在也控制了asn-563上的糖基化效率。在某种程度上,asn-221聚糖的存在也限制了这些asn-563糖型的出现,因为在还原下,在d221n/c309l/n297a/c575a突变体中只能看到一个条带(图2d)。
尽管在sds-page上双半胱氨酸敲除组主要以单体形式运行(图2c),但还包含n563a取代的双半胱氨酸敲除组以溶液中单体和多聚体的混合物的形式运行(图12)。因此,去除笨重的asn563聚糖会暴露出尾段中的疏水氨基酸残基,有助于溶液中的非共价相互作用,这在糖的存在下不易发生。
asn-297和asn-563聚糖对于单体与聚糖受体的相互作用至关重要,而asn-221的存在可以弥补它们的缺失
为了确定双半胱氨酸敲除突变体(图1b)中哪个n联聚糖有助于受体结合,我们通过elisa研究了它们与可溶性重组聚糖受体的相互作用(图3,并总结于表1中)。与igg1-fc对照形成鲜明对比的是,其中同时存在asn-297和asn-563的尾段单体(例如c309l/c575a)结合了所研究的所有十二种聚糖受体(图3)。
如在c309l/n563a/c575a或c309l/n297a/n563a/c575a突变体中,去除asn-563上的聚糖,消除了与这十二种受体的结合,这表明聚糖受体结合需要asn-563。
如在c309l/n297a/c575a中,去除asn-297上的聚糖也消除了与所有受体的结合,但siglec-1除外。该数据表明,asn-563和asn-297两者的存在是c309l/c575a单体突变体结合聚糖受体所必需的。
除mbl、mmr和dc-sign外,双无糖基化敲除突变体c309l/n297a/n563a/c575a的结合可通过在asn-221上添加唾液酸化聚糖来恢复(如d221n/c309l/n297a/n563a/c575a所示)。与缺失asn221的所有同等突变体相比,asn221聚糖为所有唾液酸化的糖做出了贡献,可以用于解释与其他聚糖受体结合的显著改善。这与我们以前的工作一致,我们在完全具有半胱氨酸能力的多聚体中证明asn-221的末端唾液酸化率>75%23,并且该聚糖的存在应该说明了与所研究的其他九种聚糖受体结合的显著改善(与缺失asn-221的所有同等突变体相比)。
有趣的是,由于保留了尾段中的cys-575而形成半胱氨酸连接的多聚体的c309l突变体(图2c)无法与所研究的任何聚糖受体结合,但cd23除外(图3)。因此,仅当与低价分子连接时,与asn-563尾段相连的聚糖才可用于结合,并且最有可能被包埋在通过共价(例如通过cys-309)或非共价(例如c309l/n563a/c575a)键形成的多聚体中。
然后,我们研究了c575a突变体组的结合,其中仍然存在cys-309(图1a),并且我们已经观察到,还具有形成二聚体和梯形多聚体的倾向(图2a)。其中由cys-309介导的二硫键仍可能发生的这一组分子,与所有研究的聚糖受体(图4)结合程度较差,如c309l多聚体所观察到的。siglec-1是唯一的例外,asn-221聚糖的存在无法改善结合,如一组真正的单体所见。我们得出的结论是,当在真正的单体上表达时,所有三个连接位点(asn-221、asn-297和asn-563)上的n-聚糖都倾向于与聚糖受体结合,并且asn-221本身(作为唯一的聚糖)的存在足以赋予这种广泛的结合特异性,如d221n/n297a/n563a/c575a和d221n/c309l/n297a/n563a/c575a突变体两者所解释的。
我们观察到,无糖基化突变体n297a/n563a/c575a具有结合聚糖受体的倾向(图4)。其对应的c309l/n297a/n563a/c575a(其中不存在cys309)缺乏结合力,表明它可能是非聚糖依赖性的,并且这是通过多聚反应增加亲和力相互作用的结果(图2a)。
基于asn-221的单体显示出与低亲和力fcγr的结合增强
考虑到高糖基化单体与聚糖受体的显著结合,我们测试了这种额外的糖基化位点对与经典fcγr结合的影响(图5,并总结于表2中)。与igg1-fc和其中不存在asn-221的对照相比,即使在不存在asn-297和asn-563两者,例如在d221n/c309l/n297a/n563a/c575a突变体中,asn-221的存在也能改善单体与fcγriib(cd32b)的结合(图5,对于fcγriib,比较实心符号和非实心符号)。但是,asn-221的存在并不能改善与fcγriiia的结合(将d221n/c309l/n563a/c575a与c309l/n563a/c575a进行比较),但是两种聚糖突变体的结合均明显优于igg1-fc单体对照(图5)。对于这两个突变体,针对igg1-fc对照,也观察到与fcγri的结合有所改善,但是对于所测试的任何突变体,在fcγriia或fcγriiib方面均未见改善。
然后,我们研究了通过cys-309形成的多聚体的结合(图1a和2a)。在多聚体中,asn-221的存在通常会降低与所有fcγr的结合(图6,并总结于表2中),而与聚糖受体的结合(尽管比单体所观察到的要低)得以保留(图4)。与hexa-fc或igg1-fc对照相比,其中asn-563和cys-575都突变为丙氨酸的多聚体(如在n563a/c575a中)与fcγri和fcγriiia的结合非常强烈,与fcγriib的结合有所改善(图6)。最后,无糖基化的多聚体(例如n297a/n563a/c575a)显示出与fcγri和抑制性fcγriib受体的结合得到改善(图6)。
基于asn-221的单体和多聚体显示补体活化降低
使用elisa评估了复杂单体(图7)和多聚体(图8)对c1q的结合和经典补体途径的激活,如先前所述23,30(总结于表3)。除d221n/c309l/n563a/c575a外,所有含asn-221的单体与c1q的结合都劣于igg1-fc或缺乏asn-221的对照(图7a),并且所有四个含asn-221的单体都不能激活经典补体途径至其末端成分(图7b)。用cys-309感受态突变体概括了这些发现,所述突变体包括显示出形成多聚体的突变体(例如针对n297a/n563a/c575a的d221n/n297a/n563a/c575a)。我们还鉴定了能够形成多聚体的突变体(例如c309l和d221n/n563a/c575a),它们与hexa-fc相比强烈地结合c1q但不能固定c5b-9(图8,图a与图b)。
基于asn221的单体和多聚体表现出复杂的唾液酸化模式
已显示,igg抗体的fc上的n-聚糖的结构能够影响多种受体相互作用。例如,ivig与聚糖受体的相互作用已被归因于n-聚糖唾液酸对fc的直接和/或间接作用28,51,48。因此,我们通过基于maldi-tof质谱的糖组学分析研究了两组糖基化和半胱氨酸缺陷型突变体上n-聚糖的性质(图9)。
先前我们已经证明,来自igg1-fc和临床ivig制剂的n-聚糖主要由具有0、1或2个半乳糖残基的双触角复合n-聚糖控制。这些复杂结构中的少数也被单唾液酸化2,22。n297a/c575a和d221n/n297a/n563a/c575a的代表性糖组学数据显示在图9中。
在这两个样品中,光谱均显示出较高水平的n-聚糖加工,双触角半乳糖基化和唾液酸化水平提高。此外,还观察到较大的三触角和四触角复合n-聚糖,它们可以被完全唾液酸化(例如,m/z3776和4586处的峰)。因此,糖组学分析表明,asn-221和asn-575均含有更大的、加工程度更高的n-聚糖,这在igg1-fc对照中没有观察到。如所预测的,在糖基化缺陷型双突变体(n297a/n563a/c575a和c309l/n297a/n563a/c575a)上未检测到聚糖。
asn221聚糖增强了与流感血凝素的结合
为了确定任何高唾液酸化的fc突变体是否具有生物学上的有用特性,我们研究了它们与血凝素的结合,血凝素是一种原型病毒唾液酸结合配体(图10a、10b)。我们使用临床上可用的ivig作为阳性对照,因为已知ivig含有高浓度的针对多种流感血凝素的igg抗体67。
如所预期的,ivig与来自甲型和乙型流感病毒的重组血凝素强烈结合(图10a、10b)。除无糖基化突变体(c309l/n297a/n563a/c575a和n297a/n563a/c575a)和igg1-fc对照之外,所有经过聚糖修饰的fc片段均结合a组和b组病毒的重组血凝素。结合也反映在存在大量的突变蛋白的唾液酸化n-聚糖。含有asn221的突变体比不含asn221的突变体具有更强的结合力(图10a、10b)。
尽管与天然灭活流感毒株a新喀里多尼亚/20/99病毒(h1n1)的结合比与重组血凝素的结合要差,但两个突变体(d221n/c309l/n297a/c575a和d221n/c575a)与天然病毒的结合都优于ivig或其缺失asn221的同等突变体(将c575a与d221n/c575a比较)(图10a、10b)。这种令人惊讶的发现为使用在氨基末端被糖基化的本发明分子(例如具有asn221的分子)用于治疗或预防病毒感染(例如流感)打开了大门,尤其是当该分子还在羧基末端(例如asn563或asn573)或接近羧基末端处被糖基化的情况下。
含有asn221的突变体抑制流感引起的血凝反应。
为了测试与血凝素的结合是否具有任何功能相关性,我们使用了基于世界卫生组织(who)的血凝抑制(hi)方案来量化与天然病毒强烈结合的突变体的流感特异性抑制效价(图10c)。浓度低至0.1μm的d221n/c309l/n297a/c575a和d221n/c575a都可防止新喀里多尼亚/20/99病毒(h1n1)引起血凝反应,并且比摩尔当量的ivig或抗h1n1多克隆igg更有效。相反,尽管在一些实验中最高浓度的c575a突变体观察到了部分抑制,但缺少asn221的等效分子,即c309l/n297a/c575a和c575a,未能抑制血凝反应(图10c)。因此,甲型流感病毒的受体结合仅被存在asn221的突变体竞争。通过sec-hplc测定,d221n/c309l/n297a/c575a和d221n/c575a突变体均完全以单体运行(请参见图12),这表明单体中聚糖(特别是asn221)的位置比在多聚体中更易于结合天然病毒。
表1.
表2
表3.
表4本发明的某些示例性蛋白质中的突变
生成商业化的多聚体fc会引发重大的生物加工和安全性问题,而单体fc的生产并未发现这些问题。例如,由于通过甘露糖受体的细胞摄取,已发现hexa-fc中存在的高甘露糖型聚糖增加了igg清除率。因此,这里开发的重组单体fc(其不含寡聚甘露糖,但仍显示与选定聚糖受体的结合有所改善)可能具有显著的治疗潜力,例如作为ivig的替代品。此外,鉴于fc-唾液酸化在降低igg抗体依赖性细胞毒性活性方面的已知作用,也可能使用该突变来开发具有改善的效应子功能的治疗性抗体。
尽管如此,多聚fc(例如具有seqidno:9-11的那些)仍可能是有用的,例如当在疫苗中递送抗原或作为高亲和力受体阻断剂时。许多病原体依靠聚糖感染宿主细胞,差异糖基化的fc多聚体可能是有用的感染抑制剂。我们的高唾液酸化分子的一项直接应用可能是阻止逆转录病毒(包括hiv和人类t细胞白血病病毒)对淋巴细胞的siglec-1依赖性感染。我们预期,这些突变体在人细胞系(例如hek)中的表达将得到具有α2,6键的高唾液酸化分子,其与ivig功效相关的α2,6-依赖性受体(如siglec-2)的结合提高。这样的受体模仿策略需要克服由多个低亲和力聚糖结合位点之和所产生的天然受体的高亲和力,现在这可以用d221n系列的高唾液酸化多聚体实现。因此,通过在hexa-fc内添加或去除糖基化和二硫键合位点,可以产生新的效应子功能组合。
讨论
许多研究小组推测,多价fc构建体可能具有治疗涉及病原性抗体的免疫病况的潜力2,29,31,32,并且最近的一项研究表明,六聚体fc可以阻断fcγr,从而导致其在体外和体内下调和长时间破坏fcγr效应子功能33。六聚体-fc最近也显示出在itp的小鼠模型中抑制血小板吞噬作用33,34。
尽管六聚体fc可能会提供令人兴奋的新治疗方法来控制自身免疫性疾病,但必须谨慎权衡其有益效果与fcγr交联后所观察到的促炎性反应的急性风险,以及由于长期免疫抑制而导致的感染或癌症风险增加。多聚体-fc的这些潜在缺点促使我们研究是否可以开发保留多聚体的优点(例如与低亲和力受体的高亲和力结合)但没有这些潜在风险的复杂单体。
尽管通过诱变和/或直接修饰asn-297聚糖进行fc工程改造后,可以改进fcγr的亲和力和/或选择性1,17,35-40,但与聚糖受体的相互作用在很大程度上被忽略,尽管有大量文献证明了它们在控制有害炎症方面的重要性41-44。但是,在fc多聚体或其fc片段的背景下23,33,通过向全长igg分子中引入突变来增强受体相互作用45–47的这些方法可能不一定具有先验性。
此外,已报道的fc突变或聚糖修饰主要集中于保守的asn-297聚糖,该聚糖主要包埋在fc中4,16-19,因此单体igg1无法与更广泛的聚糖受体相互作用。尽管最近已证明siglec-248、dc-sign2,49,50、dcir51和fcrl52,52都是ivig的配体,但这些相互作用也可能源自特定的fab介导的结合53。因此,完整igg的糖基化是非常重要的,但是fc和fab结构域的相对贡献,以及参与ivig功效的最重要受体的身份仍然存在争议。
我们采用了另一种方法来进行聚糖修饰,该方法是向多聚体igg1-fc中以多种组合的方式引入两个额外的n-联糖基化位点(asn-221和asn-563)23。为了研究额外糖基化对单体功能的影响,对这些聚糖修饰的多聚体(hexa-fc)进行了进一步突变,以去除单个fc部分之间形成链间二硫键所需的一个或两个半胱氨酸残基(cys-309和cys-575)(图1b)。这种方法产生了复杂的糖基化单体(图2c),包括带有所有三个所连接聚糖的d221n/c309l/c575a突变体,其显示与fcγriib、dc-sign和dcir的结合增强;这些受体与ivig的功效有关(表1)7,16,19,54,55。
与单糖基化(例如igg1-fc)或非糖基化(c309l/n297a/n563a/c575a)对照相比,d221n/c309l/c575a三聚糖突变体与所有研究的聚糖受体(包括最近与ivig功效有关的受体,例如cd2356、cd2248和dcir(clec4a)51)更强烈且广泛地结合(图3和表1)。
观察到的与cd22的结合特别令人惊讶,因为该受体更喜欢α-2,6连接的神经氨酸而不是cho-k1细胞附设的α-2,3连接,尽管最近的标记实验表明,cd22/siglec-2与b细胞受体中免疫球蛋白的非聚糖依赖性相互作用是可能的68。我们还观察到d221n/c309l/c575a与dectin的显著结合(图3),dectin是更通常识别由真菌病原体表达的β-1,3-葡聚糖的受体69。尽管已知dectin-1会可变地结合糖基化的人四分子交联体蛋白家族分子(tetraspanin)cd37和cd6370,但igg1免疫复合物的抗炎活性可能是由fc半乳糖基化以及与dectin-1和fcγriib的结合介导的71。
将多个聚糖位点插入fc的主体内,特别是在asn-221处,也能够实现新的受体相互作用,而这种相互作用是asn-297定向方法无法实现的。例如,我们生成了双聚糖d221n/c309l/n297a/c575a突变体,该突变体显示出与siglec-1和siglec-4(mag)的显著结合,这两种受体在临床上均参与了神经病变的控制24,25。该突变体显示与fcγr或补体蛋白均没有可观察到的结合(图5和表2、3)。
由于聚糖介导的结合对于流感病毒感染呼吸道细胞必不可少,因此导致受体结合丧失的血凝素突变不太可能幸免于免疫反应期间诱导的中和抗体。d221n/c575a突变体的模型显示,从fc的n末端尖端到c末端尖端的距离约为
迫切需要替代的抗流感治疗策略。
在2009年和1918年的大流行中使用ivig分别使流感的死亡率降低了26%和50%73,74,最近的一项随机安慰剂对照研究表明,通过增强ivig(flu-ivig)制剂中的流感特异性抗体可以改善这些数字75。由于flu-ivig是在未来流行病之前生产的,因此对新兴毒株的中和活性可能不大或没有。flu-ivig与fc唾液酸结合结构域阻断剂的组合可增强flu-ivig制剂的功效。如此有效地抑制血凝反应的d221n/c575a和d221n/c309l/n297a/c575a突变体(图10c),都不结合fcγriiia(图5、6和表1),因此不会期望通过中和flu-ivig中存在的igg来干扰针对流感病毒感染的细胞的fcγriiia依赖性adcc。
因此,预测结合血凝素的本发明分子,例如d221n/c575a和d221n/c309l/n297a/c575a,可用于阻止病毒感染,并且可以单独使用或与ivig(例如flu-ivig)结合使用。这样的分子也可以作为真正的单体运行(如通过sec-hplc所测),这使得它们特别适合用于治疗用途,因为(i)由于仅生产一种形式,所以可制造性和加工将更加容易;(ii)可以得到均质制剂,以确保可复制的产品可用于给药。
fc片段的鼻内递送在治疗上也可能是有益的,因为fc融合白介素-7可以在鼻内递送后长期预防致命的流感病毒76。先前我们已经证明,fc多聚体可以结合新生儿fc受体(fcrn)77。因此,与新生儿fcrn的结合可能会增加递送至肺的fc阻断剂的停留时间78,79。高唾液酸化方法的潜在缺点可能是fc聚糖对病毒神经氨酸酶的敏感性,但是利用炔烃唾液酸进行代谢寡糖工程可以得到耐神经氨酸酶的fc阻断剂80。
在另一个实例中,多个突变体显示与dec-205结合(图3,4和表1),dec-205是树突状细胞表达的主要内吞受体,这表明这些构建体可用于疫苗中抗原的靶向递送。当前将抗原递送至dec-205的方法依赖于dec-205特异性递送,通常将抗原与抗dec-205mab融合57-59,而靶向多种dc受体(包括dec-205)的方法可能会产生更有效的抗原递送,例如在疫苗中。
为了在疫苗中使用,抗原必须通过多个fc区以近邻相互作用与多个低亲和力fcγr81,特别是fcγriia、fcγriib和fcγriiia81–83结合而聚集。如上所述,我们产生了与fcγriib(例如n297a/n563a/c575a)、fcγriiia(例如c309l和d221n/n563a/c575a)差异结合或具有结合fcγriib和fcγriiia两者的能力(例如n563a/c575a)的多聚体。由n563a/c575a突变体形成的多聚体可能特别有意义,因为它们也能够结合2型聚糖受体并激活补体级联,两者均与疫苗的功效有关29。
如表1-3所示,我们已经确定了:i)能够结合c1q并激活补体,但与fcγr或聚糖受体之间几乎没有或没有可检测的相互作用的突变fc分子(例如c309l/n297a/n563a/c575a);ii)补体激活增强、与fcγr结合增强且几乎不与聚糖受体结合的分子(例如c309l/n563a/c575a);iii)与c1q结合增强但c5b-9沉积很少的分子,它们保留了与fcγ受体和聚糖受体的相互作用(例如d221n/c309l/n563a/c575a);最后iv)与唾液酸依赖性聚糖受体(特别是siglec-1和siglec-4和血凝素)的结合增强、与fcγr或补体几乎没有或没有相互作用的分子(例如d221n/c309l/n297a/c575a)。这些分子中的每一个在309和575位都缺失了半胱氨酸残基。因此,通过在我们原始的六聚fc平台2,29,23中添加或去除糖基化和/或二硫键合位点,可以制得具有所需结合特性的新分子库(repertoires)。
我们还描述了由六聚体fc产生的多聚体,其具有可能更理想的特性,可减轻不需要的fcγr依赖性促炎作用。例如,d221n/n297a/n563a/c575a多聚体无法结合fcγr或激活补体,但显示出与聚糖受体(包括siglec-1)的结合增强(表1-3)。
我们还开发了可用作疫苗递送媒介(例如,在fc-抗原融合物中)或用作高亲和力受体阻断剂的多聚体。为了在疫苗中有用,抗原必须通过多个fc区以近邻相互作用与多个低亲和力fcγr60,特别是fcγriia、fcγriib和fcγriiia60–62结合而聚集。如上所述,我们产生了与fcγriib(例如n297a/n563a/c575a)、fcγriiia(例如c309l和d221n/n563a/c575a)差异结合或具有结合fcγriib和fcγriiia两者的能力(例如n563a/c575a)的多聚体。由n563a/c575a突变体形成的多聚体可能特别有意义,因为它们也能够结合2型聚糖受体并激活补体级联,两者均与疫苗的功效有关29。
310处的组氨酸对于与新生儿fcrn相互作用至关重要,这种相互作用是维持体内长半衰期以及将igg从血液转移到分泌物(例如肺)中所必需的。双半胱氨酸突变体在310处具有his,但近c575a的突变体没有。然而,发明人已经显示,通过用his代替hexa-fc中的leu310,可以恢复与fcrn的结合77。具有310his的分子具有较长的半衰期。
最近已经描述了基于igg1的fc多聚体(称为stradomer)用于治疗多种补体介导的疾病31,63,64。已显示stradomer隔离c1q,从而阻止了炎症部位的经典途径的激活63。与尾段驱动的多聚化相反,这些分子是通过人igg2铰链与igg1的fc的c-末端融合蛋白所提供的半胱氨酸残基形成的31。igg2铰链的序列允许通过四个可能的半胱氨酸残基之一进行多聚化,但是与本文所述的分子相反,igg2铰链中不存在n-联连接位点,因此不会实现与聚糖受体的结合。
尾段中提供的另外的疏水残基也允许单体之间的非共价相互作用,这无法从igg2铰链中包含的氨基酸残基预测,如c309l/n297a/n563a/c575a所示。这些疏水残基已经在不存在尾基cys-575的情况下显示使igg1-fc单体在到达靶位点时组装成高效的多聚体(参见wo2017/005767)。拥有n563a的突变体倾向于在溶液中多聚化,但是在十二烷基硫酸钠(sds)凝胶上它们会以单体运行,因为促进多聚化的非共价相互作用被sds破坏了。
在这里,我们显示,可以生成诸如d221n/c309l/n563a/c575a和d221n/n563a/c575a和c309l的突变体,它们与c1q紧密结合,而不会在下游沉积c5b-9膜攻击复合物。如在c309l/n297a/n563a/c575a突变体中的,去除asn-297和asn-563两者会另外生成无法与fcγr或聚糖受体相互作用但仍保留与c1q结合的能力的单体。因此,此类分子可用于治疗补体介导的疾病。因此,通过在六聚fc中添加或去除糖基化和二硫键合位点,可以制得具有所需结合特性的新分子库。
参考文献
1.dalzielm,crispinm,scanlancn,zitzmannn,dwekra.emergingprinciplesforthetherapeuticexploitationofglycosylation.science(80-)[internet]2014;343:1235681,11235681,8.availablefrom:http://www.ncbi.nlm.nih.gov/pubmed/24385630
2.czajkowskydm,andersenjt,fuchsa,wilsontj,mekhaield,colonnam,hej,shaoz,mitchellda.,wug,etal.developingtheivigbiomimetic,hexa-fc,fordrugandvaccineapplications.scirep[internet]2015;5:9526.availablefrom:http://www.nature.com/doifinder/10.1038/srep09526
3.shieldsrl,laij,keckr,o’connellly,hongk,gloriamengy,weikertsha,prestalg.lackoffucoseonhumanigg1n-linkedoligosaccharideimprovesbindingtohumanfcγriiiandantibody-dependentcellulartoxicity.jbiolchem2002;277:26733–40.
4.luxa,yux,scanlancn,nimmerjahnf.impactofimmunecomplexsizeandglycosylationoniggbindingtohumanfcγrs.jimmunol2013;190:4315–23.
5.debrem,bonnetmc,fridmanwh,carosellae,philippen,reinertp,vilmere,kaplanc,teillaudjl,griscellic.infusionoffcgammafragmentsfortreatmentofchildrenwithacuteimmunethrombocytopenicpurpura.lancet[internet]1993;342:945–9.availablefrom:file://o/referenzmanager/immunglobulin.pdfs/debre1993.pdf
6.anthonyrm,nimmerjahnf,ashlinedj,reinholdvn,paulsonjc,ravetchjv.recapitulationofiviganti-inflammatoryactivitywitharecombinantiggfc.science(80-)[internet]2008;320:373–6.availablefrom:http://www.sciencemag.org/content/320/5874/373.abstract%5cnhttp://www.sciencemag.org/content/320/5874/373.full.pdf
7.anthonyrm,kobayashit,wermelingf,ravetchjv.intravenousgammaglobulinsuppressesinflammationthroughanovelt(h)2pathway:commentary.nature2011;475:110–3.
8.liul.antibodyglycosylationanditsimpactonthepharmacokineticsandpharmacodynamicsofmonoclonalantibodiesandfc-fusionproteins.j.pharm.sci.2015;104:1866–84.
9.lih,sethuramann,stadheimta,zhad,prinzb,ballewn,bobrowiczp,choib-k,cookwj,cukanm,etal.optimizationofhumanizediggsinglycoengineeredpichiapastoris.natbiotechnol[internet]2006;24:210–5.availablefrom:http://www.ncbi.nlm.nih.gov/pubmed/16429149
10.pepinskyrb,shaoz,jib,wangq,mengg,walusl,leex,huy,graffc,garbere,etal.exposurelevelsofanti-lingo-1li81antibodyinthecentralnervoussystemanddose-efficacyrelationshipsinratspinalcordremyelinationmodelsaftersystemicadministration.jpharmacolexpther2011;339:519–29.
11.st-amouri,paréi,alataw,coulombek,ringuette-gouletc,drouin-ouelletj,vandalm,souletd,bazinr,calonf.brainbioavailabilityofhumanintravenousimmunoglobulinanditstransportthroughthemurineblood-brainbarrier.jcerebbloodflowmetab[internet]2013;33:1983–92.availablefrom:http://www.ncbi.nlm.nih.gov/pubmed/24045402
12.hawkinscp,munropmg,mackenzief,kesselringj,toftsps,boulayepghdu,landondn,mcdonaldwi.durationandselectivityofblood-brainbarrierbreakdowninchronicrelapsingexperimentalallergicencephalomyelitisstudiedbygadolinium-dtpaandproteinmarkers.brain1990;113:365–78.
13.xuj,zhaol,zhangy,guoq,chenh.cd16andcd32genepolymorphismsmaycontributetoriskofidiopathicthrombocytopenicpurpura.medscimonit2016;22:2086–96.
14.zhangg,massaadca,gaot,pillail,bogdanovan,ghauris,sheikhka.sialylatedintravenousimmunoglobulinsuppressanti-gangliosideantibodymediatednerveinjury.expneurol[internet]2016;282:49–55.availablefrom:http://www.sciencedirect.com/science/article/pii/s0014488616301388
15.finkejm,ayreskr,brisbinrp,hillha,wingee,bankswa.antibodyblood-brainbarriereffluxismodulatedbyglycanmodification.biochimbiophysacta-gensubj2017;1861:2228–39.
16.washburnn,schwabi,ortizd,bhatnagarn,lansingjc,medeirosa,tylers,mekalad,cochrane,sarvaiyah,etal.controlledtetra-fcsialylationofivigresultsinadrugcandidatewithconsistentenhancedanti-inflammatoryactivity.procnatlacadsciusa[internet]2015;112:201422481.availablefrom:http://www.pnas.org/lookup/doi/10.1073/pnas.1422481112%5cnhttp://www.ncbi.nlm.nih.gov/pubmed/25733881%5cnhttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=pmc4371931
17.yux,baruahk,harveydj,vasiljevics,alonzids,songbd,higginsmk,bowdenta,scanlancn,crispinm.engineeringhydrophobicprotein-carbohydrateinteractionstofine-tunemonoclonalantibodies.jamchemsoc2013;135:9723–32.
18.dekkersg,plompr,koelemancam,visserr,vonhorstenhh,sandigv,rispenst,wuhrerm,vidarssong.multi-levelglyco-engineeringtechniquestogenerateiggwithdefinedfc-glycans.scirep[internet]2016;6:36964.availablefrom:http://dx.doi.org/10.1038/srep36964%5cnhttp://www.ncbi.nlm.nih.gov/pubmed/27872474
19.paganjd,kitaokam,anthonyrm.engineeredsialylationofpathogenicantibodiesinvivoattenuatesautoimmunedisease.cell[internet]2017;:1–14.availablefrom:http://linkinghub.elsevier.com/retrieve/pii/s0092867417314319
20.baldoba.chimericfusionproteinsusedfortherapy:indications,mechanisms,andsafety.drugsaf.2015;38:455–79.
21.boeschaw,brownep,chenghd,oforimo,normandine,nigrovicpa,alterg,ackermanme.highlyparallelcharacterizationofiggfcbindinginteractions.mabs2014;6:915–27.
22.crispinm,yux,bowdenta.crystalstructureofsialylatediggfc:implicationsforthemechanismofintravenousimmunoglobulintherapy.procnatlacadsci.110:3544–3546,2013
23.blundellpa,lenpl,allenj,watanabey,pleassrj.engineeringthefragmentcrystallizable(fc)regionofhumanigg1multimersandmonomerstofine-tuneinteractionswithsialicacid-dependentreceptors.jbiolchem292:12994-13007,2017
24.zhangg,massaadca,gaot,pillail,bogdanovan,ghauris,sheikhka.sialylatedintravenousimmunoglobulinsuppressanti-gangliosideantibodymediatednerveinjury.expneurol2016;282:49–55.
25.wongahy,fukamiy,sudom,kokubunn,hamadas,yukin.sialylatedigg-fc:anovelbiomarkerofchronicinflammatorydemyelinatingpolyneuropathy.jneurolneurosurgpsychiatry[internet]2016;87:275–9.availablefrom:http://jnnp.bmj.com/cgi/doi/10.1136/jnnp-2014-309964%5cnhttp://www.ncbi.nlm.nih.gov/pubmed/25814494
26.subedigp,hansonqm,barbaw.restrictedmotionoftheconservedimmunoglobuling1n-glycanisessentialforefficientfcγriiiabinding.structure[internet]2014;22:1478–88.availablefrom:http://www.sciencedirect.com/science/article/pii/s0969212614002457
27.frankm,walkerrc,lanzilottawn,prestegardjh,barbaw.immunoglobuling1fcdomainmotions:implicationsforfcengineering.jmolbiol2014;426:1799–811.
28.pincetica,bournazoss,dilillodj,maamaryj,wangtt,dahanr,fiebigerb-m,ravetchjv.typeiandtypeiifcreceptorsregulateinnateandadaptiveimmunity.natimmunol[internet]2014;15:707–16.availablefrom:http://www.nature.com/doifinder/10.1038/ni.2939%5cnhttp://www.ncbi.nlm.nih.gov/pubmed/25045879
29.czajkowskydm,huj,shaoz,pleassrj.fc-fusionproteins:newdevelopmentsandfutureperspectives.embomol.med.2012;4:1015–28.
30.mekhaieldna,czajkowskydm,andersenjt,shij,el-fahamm,doenhoffm,mcintoshrs,sandliei,hej,huj,etal.polymerichumanfc-fusionproteinswithmodifiedeffectorfunctions.scirep[internet]2011;1:1–11.availablefrom:http://www.nature.com/articles/srep00124
31.jaina,olsenhs,vyzasatyar,burche,sakoday,mérigeoney,cail,luc,tanm,tamadak,etal.fullyrecombinantigg2afcmultimers(stradomers)effectivelytreatcollagen-inducedarthritisandpreventidiopathicthrombocytopenicpurpurainmice.arthritisresther[internet]2012;14:r192.availablefrom:http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3580588&tool=pmcentrez&rendertype=abstract
32.ortizdf,lansingjc,rutitzkyl,kurtagice,prodt,choudhurya,washburnn,bhatnagarn,beneducec,holtek,etal.elucidatingtheinterplaybetweenigg-fcvalencyandfcgractivationforthedesignofimmunecomplexinhibitors.2016;158.
33.qureshios,rowleytf,junkerf,peterssj,crillys,compsonj,eddlestona,
34.lewis,bj.,spirig,r.,kasermann,f.,branchd.notitle.in:27thregionalcongressoftheinternationalsocietyofbloodtransfusion.copenhagen:embasevoxsanguinis;2017.page21.
35.lundj,poundjd,jonespt,duncanar,bentleyt,goodallm,levineba,jefferisr,winteg.multiplebindingsitesonthech2domainofiggformousefc??r11.molimmunol1992;29:53–9.
36.lundj,takahashin,poundjd,goodallm,jefferisr.multipleinteractionsofiggwithitscoreoligosaccharidecanmodulaterecognitionbycomplementandhumanfcyreceptoriandinfluencethesynthesisofitsoligosaccharidechains.jimmunol1996;157:4963–9.
37.jefferisr,lundj,poundjd.igg-fc-mediatedeffectorfunctions:moleculardefinitionofinteractionsitesforeffectorligandsandtheroleofglycosylation.immunol.rev.1998;163:59–76.
38.houded,pengy,berkowitzsa,engenjr.post-translationalmodificationsdifferentiallyaffectigg1conformationandreceptorbinding.molcellproteomics[internet]2010;9:1716–28.availablefrom:http://www.mcponline.org/content/9/8/1716.full.pdf
39.woofjm,burtondr.humanantibody-fcreceptorinteractionsilluminatedbycrystalstructures.natrevimmunol[internet]2004[cited2015feb18];4:89–99.availablefrom:http://www.ncbi.nlm.nih.gov/pubmed/15040582
40.saxenaa,wud.advancesintherapeuticfcengineering-modulationofigg-associatedeffectorfunctionsandserumhalf-life.front.immunol.2016;7.
41.macauleyms,crockerpr,paulsonjc.siglec-mediatedregulationofimmunecellfunctionindisease.nat.rev.immunol.2014;14:653–66.
42.bochnerbs,zimmermannn.roleofsiglecsandrelatedglycan-bindingproteinsinimmuneresponsesandimmunoregulation.j.allergyclin.immunol.2015;135:598–608.
43.mahajanvs,pillais.sialicacidsandautoimmunedisease.immunolrev2016;269:145–61.
44.büllc,heiset,ademagj,boltjetj.sialicacidmimeticstotargetthesialicacid-siglecaxis.trendsbiochem.sci.2016;41:519–31.
45.shieldsrl,laij,keckr,o’connellly,hongk,mengyg,weikertsha,prestalg.lackoffucoseonhumanigg1n-linkedoligosaccharideimprovesbindingtohumanfcγriiiandantibody-dependentcellulartoxicity.jbiolchem2002;277:26733–40.
46.shieldsrl,namenukak,hongk,mengyg,raej,briggsj,xied,laij,stadlena,lib,etal.highresolutionmappingofthebindingsiteonhumanigg1forfcγri,fcγrii,fcγriii,andfcrnanddesignofigg1variantswithimprovedbindingtothefcγr.jbiolchem2001;276:6591–604.
47.mooregl,chenh,karkis,lazarga.engineeredfcvariantantibodieswithenhancedabilitytorecruitcomplementandmediateeffectorfunctions.mabs2010;2:181–9.
48.seitejf,cornecd,renaudineauy,youinoup,mageedra,hillions.ivigmodulatesbcr-signalingthroughcd22andpromotesapoptosisinmaturehumanblymphocytes.blood[internet]2010;116:doi:10.1182/blood-2009-12-261461.availablefrom:file://o/referenzmanager/immunglobulin.pdfs/seite2010.pdf%5cnhttp://bloodjournal.hematologylibrary.org/content/early/2010/06/01/blood-2009-12-261461.full.pdf
49.fiebigerbm,maamaryj,pincetica,ravetchjv.protectioninantibody-andtcell-mediatedautoimmunediseasesbyantiinflammatoryiggfcsrequirestypeiifcrs.procnatlacadsci[internet]2015;:201505292.availablefrom:http://www.pnas.org/lookup/doi/10.1073/pnas.1505292112
50.schwabi,biburgerm,
51.massoudah,yonam,xued,chouialif,alturaihih,ablonaa,mouradw,piccirilloca,mazerbd.dendriticcellimmunoreceptor:anovelreceptorforintravenousimmunoglobulinmediatesinductionofregulatorytcells.jallergyclinimmunol2014;133.
52.francoa,damdinsurenb,iset,dement-brownj,lih,nagatas,tolnaym.humanfcreceptor-like5bindsintactiggviamechanismsdistinctfromthoseoffcreceptors.jimmunol[internet]2013;190:5739–46.availablefrom:http://www.jimmunol.org/cgi/doi/10.4049/jimmunol.1202860
53.vandebovenkampfs,hafkenscheidl,rispenst,romboutsy.theemergingimportanceofiggfabglycosylationinimmunity.jimmunol[internet]2016;196:1435–41.availablefrom:http://www.jimmunol.org/cgi/doi/10.4049/jimmunol.1502136%5cnhttp://www.ncbi.nlm.nih.gov/pubmed/26851295
54.kanekoy,nimmerjahnf,ravetchjv.anti-inflammatoryactivityofimmunoglobulingresultingfromfcsialylation.science(80-)[internet]2006;313:670–3.availablefrom:http://www.ncbi.nlm.nih.gov/pubmed/24072822%5cnhttp://www.ncbi.nlm.nih.gov/pubmed/16888140
55.tackenbergb,jelcici,baerenwaldta,oertelwh,sommern,nimmerjahnf,lünemannjd.impairedinhibitoryfcgammareceptoriibexpressiononbcellsinchronicinflammatorydemyelinatingpolyneuropathy.procnatlacadsciusa[internet]2009;106:4788–92.availablefrom:http://www.ncbi.nlm.nih.gov/pubmed/19261857%5cnhttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=pmc2660764
56.wangtt,maamaryj,tangs,bournazoss,daviscw,krammerf,schlesingersj,palesep,ahmedr,ravetchjv.anti-haglycoformsdrivebcellaffinityselectionanddetermineinfluenzavaccineefficacy.cell2015;162:160–9.
57.niezoldt,storcksdieckgenanntbonsmannm,maaskea,temchurav,heineckev,hannamand,buerj,ehrhardtc,hansenw,
58.jiangw,swiggardwj,heuflerc,pengm,mirzaa,steinmanrm,nussenzweigmc.thereceptordec-205expressedbydendriticcellsandthymicepithelialcellsisinvolvedinantigenprocessing.nature1995;375:151–5.
59.coconi-linaresn,ortega-dávilae,lópez-gonzálezm,garcía-machorroj,garcía-corderoj,steinmanrm,cedillo-barrónl,gómez-limma.targetingofenvelopedomainiiiproteinofdenvtype2todec-205receptorelicitsneutralizingantibodiesinmice.vaccine2013;31:2366–71.
60.nessportc,rajuts,chincn,vafao,brezskirj.avidityconfersfcγrbindingandimmuneeffectorfunctiontoaglycosylatedimmunoglobuling1.jmolrecognit2012;25:147–54.
61.winesbd,vandervenha,esparonse,kristensenab,kentsj,hogarthpm.dimericfcγrectodomainsasprobesofthefcreceptorfunctionofanti-influenzavirusigg.jimmunol[internet]2016;197:1507–16.availablefrom:http://www.jimmunol.org/lookup/doi/10.4049/jimmunol.1502551
62.bournazoss,ravetchjv.fcγreceptorfunctionandthedesignofvaccinationstrategies.immunity2017;47:224–33.
63.zhouh,olsenh,soe,mérigeone,rybind,owensj,larosag,blockds,stromese,zhangx.afullyrecombinanthumanigg1fcmultimer(gl-2045)inhibitscomplement-mediatedcytotoxicityandinducesic3b.bloodadv[internet]2017;1.availablefrom:http://www.bloodadvances.org/content/1/8/504?sso-checked=true
64.sunh,olsenhs,mérigeoney,soe,burche,kinseys,papadimitrioujc,drachenbergcb,bentzensm,blockds,etal.recombinanthumanigg1basedfcmultimers,withlimitedfcrbindingcapacity,caneffectivelyinhibitcomplement-mediateddisease.jautoimmun2017;84:97–108.
65.yu,x.,vasiljevic,s.,mitchell,d.a.,crispin,m.&scanlan,c.n.dissectingthemolecularmechanismofivigtherapy:theinteractionbetweenserumigganddc-signisindependentofantibodyglycoformorfcdomain.j.mol.biol.425,1253–1258(2013).
66.b.domon,c.e.costello,asystematicnomenclatureforcarbohydratefragmentationsinfab-ms/msspectraofglycoconjugates,glycoconjj,5(1988)397-409.
67.vanderven,h.a.,k.wragg,f.ana-sosa-batiz,a.b.kristensen,s.jegaskanda,a.k.wheatley,d.wentworth,b.d.wines,p.m.hogarth,s.rockman,ands.j.kent.anti-influenzahyperimmuneimmunoglobulinenhancesfc-functionalantibodyimmunityduringhumaninfluenzainfection.j.infect.dis.1–11.2018
68.alborziandehsheikh,a.,c.akatsu,a.imamura,h.h.m.abdu-allah,h.914
takematsu,h.ando,h.ishida,andt.tsubata.2018.proximitylabelingof915
cis-ligandsofcd22/siglec-2revealsstepwiseα2,6sialicacid-dependentand916
-independentinteractions.biochem.biophys.res.commun.495:854–859.
69.geijtenbeek,t.b.h.,ands.i.gringhuis.2009.signallingthroughc-type918lectinreceptors:shapingimmuneresponses.nat.rev.immunol.9:465–479
70.meyer-wentrup,f.,c.g.figdor,m.ansems,p.brossart,m.d.wright,g.j.adema,anda.b.vanspriel.2007.dectin-1interactionwithtetraspanincd37inhibitsil-6production.j.immunol.178:154–162.
71.karsten,c.m.,m.k.pandey,j.figge,r.kilchenstein,p.r.taylor,m.rosas,j.u.mcdonald,s.j.orr,m.berger,d.petzold,v.blanchard,a.winkler,c.hess,d.m.reid,i.vmajoul,r.t.strait,n.l.harris,g.
72.xu,r.,d.c.ekiert,j.c.krause,r.hai,j.e.crowe,andi.a.wilson.structuralbasisofpreexistingimmunitytothe2009h1n1pandemicinfluenzavirus.science328:357–360,2010.
73hung,i.f.n.,k.k.w.to,c.-k.lee,k.-l.lee,w.-w.yan,k.chan,w.m.chan,c.-w.ngai,k.-i.law,f.-l.chow,r.liu,k.-y.lai,c.c.y.lau,s.h.liu,k.-h.chan,c.-k.lin,andk.-y.yuen.2013.hyperimmuneivimmunoglobulintreatment:amulticenterdouble-blindrandomizedcontrolledtrialforpatientswithsevere2009influenzaa(h1n1)infection.chest144:464–473.
74.luke,t.c.,e.m.kilbane,j.l.jackson,ands.l.hoffman.2006.meta-analysis:convalescentbloodproductsforspanishinfluenzapneumonia:afutureh5n1treatment.ann.intern.med.145:599–609.
75.vanderven,h.a.,k.wragg,f.ana-sosa-batiz,a.b.kristensen,s.jegaskanda,a.k.wheatley,d.wentworth,b.d.wines,p.m.hogarth,s.rockman,ands.j.kent.2018.anti-influenzahyperimmuneimmunoglobulinenhancesfc-functionalantibodyimmunityduringhumaninfluenzainfection.j.infect.dis.1–11.
76.kang,m.c.,d.-h.choi,y.w.choi,s.j.park,h.namkoong,k.s.park,s.-s.ahn,c.d.surh,s.-w.yoon,d.-j.kim,j.choi,y.park,y.c.sung,ands.-w.lee.2015.intranasalintroductionoffc-fusedinterleukin-7provideslong-lastingprophylaxisfromlethalinfluenzainfection.j.virol.90:2273–2284.946
77.foss,s.,a.grevys,k.m.k.sand,m.bern,p.blundell,t.e.michaelsen,r.j.pleass,i.sandlie,andj.t.andersen.2016.enhancedfcrn-dependenttransepithelialdeliveryofiggbyfc-engineeringandpolymerization.j.control.release223:43–52.
78.sockolosky,j.t.,andf.c.szoka.2015.theneonatalfcreceptor,fcrn,asatargetfordrugdeliveryandtherapy.adv.drugdeliv.rev.91:109–124.
79.patton,j.s.,andp.r.byron.2007.inhalingmedicines:deliveringdrugstothebodythroughthelungs.nat.rev.drugdiscov.6:67–74.
80.heise,t.,c.büll,d.m.beurskens,e.rossing,m.i.dejonge,g.j.adema,t.j.boltje,andj.d.langereis.2017.metabolicoligosaccharideengineeringwithalkynesialicacidsconfersneuraminidaseresistanceandinhibitsinfluenzareproduction.bioconjug.chem.28:1811–1815.
81.nesspor,t.c.,t.s.raju,c.n.chin,o.vafa,andr.j.brezski.2012.avidityconfersfcγrbindingandimmuneeffectorfunctiontoaglycosylatedimmunoglobuling1.j.mol.recognit.25:147–154.
82.wines,b.d.,h.a.vanderven,s.e.esparon,a.b.kristensen,s.j.kent,andp.m.hogarth.2016.dimericfcγrectodomainsasprobesofthefcreceptorfunctionofanti-influenzavirusigg.j.immunol.197:1507–1516.
83.bournazos,s.,andj.v.ravetch.2017.fcγreceptorfunctionandthedesignofvaccinationstrategies.immunity47:224–233.
84.north,s.j.,j.jang-lee,r.harrison,k.canis,m.n.ismail,a.trollope,a.antonopoulos,p.c.pang,p.grassi,s.al-chalabi,a.t.etienne,a.dell,ands.m.haslam.2010.massspectrometricanalysisofmutantmice.methodsenzymol.478:27–77.
84.ceroni,a.,k.maass,h.geyer,r.geyer,a.dell,ands.m.haslam.2008.glycoworkbench:atoolforthecomputer-assistedannotationofmassspectraofglycans.j.proteomeres.7:1650–1659
85.khatuaetal.indianj.medicalres.138:648-662,2013.
86.roys,mandalc.plosnegltropdis.10(8):e0004904.doi:10.1371/journal.pntd.0004904.ecollection2016aug.
实施方案:
1、一种嵌合fc受体结合蛋白质,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段区,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,以去除形成非固有二硫键的半胱氨酸残基,并且其中每条多肽链都包含至少一个糖基化位点。
2、根据权利要求1所述的蛋白质,其中所述改变包括对应于seqidno:1的残基248的半胱氨酸残基的缺失。
3、根据权利要求1或2中任一项所述的蛋白质,其中所述对应于seqidno:1的残基248的半胱氨酸残基被丙氨酸残基替代。
4、根据前述权利要求中任一项所述的蛋白质,其中每条多肽链均发生了改变,从而在这些区域之一中引入糖基化位点,所述糖基化位点在衍生该区域的天然序列中不存在。
5、根据前述权利要求中任一项所述的蛋白质,其中每条多肽链均在铰链区中包含糖基化位点,所述糖基化位点在衍生该铰链区的天然序列中不存在。
6、根据权利要求5所述的蛋白质,其中所述另外的糖基化位点在对应于seqidno:1的残基1的位置。
7、根据权利要求4-6中任一项所述的蛋白质,其中所述糖基化位点是天冬酰胺残基。
8、根据前述权利要求中任一项所述的蛋白质,其中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而少具有一个糖基化位点。
9、根据权利要求8所述的蛋白质,其中,与天然免疫球蛋白序列相比,缺失对应于seqidno:1的残基77的天冬酰胺残基。
10、根据权利要求8所述的蛋白质,其中,与天然免疫球蛋白序列相比,缺失对应于seqidno:1的残基236的天冬酰胺残基。
11、根据前述权利要求中任一项所述的蛋白质,其中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而少具有两个糖基化位点。
12、根据权利要求11所述的蛋白质,其中,与天然免疫球蛋白序列相比,缺失了对应于seqidno:1的残基77和seqidno:1的残基236的天冬酰胺残基。
13、根据前述权利要求中任一项所述的蛋白质,其中在对应于seqidno:1的残基77的位置处存在糖基化位点。
14、根据前述权利要求中任一项所述的蛋白质,其中在对应于seqidno:1的残基236的位置处存在糖基化位点。
15、根据前述权利要求中任一项所述的蛋白质,其包含三个糖基化位点,分别位于位置1、77和236,它们对应于seqidno:1中的位置。
16、根据前述权利要求中任一项所述的蛋白质,其中每条多肽链包含两个免疫球蛋白g重链恒定结构域。
17、根据前述权利要求中任一项所述的蛋白质,其中所述蛋白质为单体形式。
18、根据前述权利要求中任一项所述的蛋白质,其中所述尾段基于选自igm、iga和ige的免疫球蛋白的尾段。
19、根据权利要求18所述的蛋白质,其中所述尾段基于igm的尾段。
20、根据前述权利要求中任一项所述的蛋白质,其中所述尾段与天然免疫球蛋白尾段具有至少70%的同一性。
21、根据前述权利要求中任一项所述的蛋白质,其中所述尾段与seqidno:2的氨基酸残基232-249具有至少70%的同一性。
22、根据权利要求21所述的蛋白质,其中所述尾段与seqidno:2的氨基酸残基232-249具有至少90%的同一性。
23、根据前述权利要求中任一项所述的蛋白质,其中所述免疫球蛋白g重链恒定区衍生自选自以下的免疫球蛋白:igg1、igg2、igg3和igg4。
24、根据权利要求23所述的蛋白质,其中所述免疫球蛋白g重链恒定区衍生自igg1。
25、根据前述权利要求中任一项所述的蛋白质,其中igg衍生序列与衍生它们的天然igg序列具有至少70%的序列同一性。
26、根据前述权利要求中任一项所述的蛋白质,其包含选自以下的序列:seqidno:2-8。
27、根据前述权利要求中任一项所述的蛋白质,其由选自以下的序列组成:seqidno:2-8。
28、一种嵌合fc受体结合蛋白质,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段区,其中,与衍生所述铰链区、免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而在铰链区中对应于seqidno:1的残基1处具有一个额外的糖基化位点,并缺失对应于seqidno:1的残基248的半胱氨酸残基。
29、根据前述权利要求中任一项所述的蛋白质,其中至少一条多肽链与治疗性有效载荷缀合。
30、根据权利要求29所述的蛋白质,其中所述治疗性有效载荷缀合到所述铰链区。
31、根据权利要求29或30所述的蛋白质,其中所述治疗性有效载荷是免疫调节剂。
32、根据权利要求29或30所述的蛋白质,其中所述治疗性有效载荷包含抗原结合结构域。
33、根据权利要求29或30所述的蛋白质,其中所述抗原结合结构域选自由以下组成的组:fab、f(ab’)2、fd、fv、scfv、dab和纳米抗体。
34、根据权利要求1至33中任一项所述的蛋白质,其用作药物。
35、根据权利要求34所述使用的蛋白质,其用于静脉内免疫球蛋白(ivig)或皮下免疫球蛋白(scig)疗法。
36、根据权利要求34或35所述使用的蛋白质,其用于预防和/或治疗自身免疫性疾病或炎性疾病。
37、根据权利要求34至36中任一项所述使用的蛋白质,其用于预防和/或治疗自身免疫性疾病或炎性疾病,所述自身免疫性疾病或炎性疾病选自由以下组成的组:自身免疫性血细胞减少症、格林-巴利综合征、重症肌无力、抗因子viii自身免疫性疾病、皮肌炎、血管炎和葡萄膜炎。
38、根据权利要求34所述使用的蛋白质,其用作疫苗。
39、根据权利要求34所述使用的蛋白质,其用于预防或治疗通过结合唾液酸依赖性受体介导的疾病。
40、根据权利要求34所述使用的蛋白质,其用于预防或治疗感染。
41、根据权利要求34所述使用的蛋白质,其用于预防或治疗逆转录病毒感染。
42、一种组合物,其包含根据权利要求1至33中任一项所述的蛋白质,其中所述组合物中包含的蛋白质的至少95%是单体形式。
43、一种预防或治疗自身免疫性疾病或炎性疾病的方法,所述方法包括向需要这种预防或治疗的受试者提供治疗有效量的根据权利要求1至33中任一项所述的蛋白质。
44、根据权利要求43所述的方法,其中所述受试者是人类受试者。
45、根据权利要求43或44所述的方法,其中所述蛋白质在静脉内免疫球蛋白(ivig)或皮下免疫球蛋白(scig)疗法中提供。
46、一种预防或治疗疾病的方法,所述方法包括向需要这种治疗的受试者提供治疗有效量的根据权利要求1至33中任一项所述的蛋白质作为疫苗。
47、根据权利要求46所述的方法,其中所述蛋白质与免疫调节剂缀合。
48、一种预防或治疗通过结合唾液酸依赖性受体介导的疾病的方法,所述方法包括向需要这种治疗的受试者提供治疗有效量的根据权利要求1至33中任一项所述的蛋白质作为疫苗。
49、根据权利要求48所述的方法,其中所述疾病是感染。
50、根据权利要求49所述的方法,其中所述感染是逆转录病毒感染。
51、编码根据权利要求1至33中任一项的蛋白质的核酸。
52、根据权利要求51所述的核酸,其用作药物。
53、一种生产根据权利要求1至33中任一项所述的蛋白质的方法,所述方法包括在宿主细胞中表达根据权利要求51所述的核酸。
54、一种嵌合fc受体结合蛋白质,其包含两条嵌合多肽链;其中每条嵌合多肽链均包含铰链区、免疫球蛋白g重链恒定区和免疫球蛋白尾段,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然序列相比,每条多肽链的氨基酸序列都发生了改变,从而少具有至少两个糖基化位点。
55、根据权利要求54所述的蛋白质,其中每条多肽链还在根据seqidno:1的位置1处包含糖基化位点,并且缺失了尾段中的、能够形成非固有二硫键的半胱氨酸。
56、根据权利要求54或55所述的蛋白质,其中,与衍生所述免疫球蛋白g重链恒定区和所述免疫球蛋白尾段区的天然免疫球蛋白序列相比,缺失了对应于seqidno:1的残基77和seqidno:1的残基236的位置处的天冬酰胺残基。
57、根据权利要求54至56中任一项所述的蛋白质,其中所述蛋白质能够结合fcγri和fcγriib。
58、根据权利要求54至57中任一项所述的蛋白质,其中所述蛋白质能够结合c1q。
序列表
<110>利物浦热带医学院
<120>嵌合fc受体结合蛋白及其用途
<130>p254103wo
<160>60
<170>patentinversion3.5
<210>1
<211>249
<212>prt
<213>人工序列
<220>
<223>参考蛋白:hexa-fc或hexagard
<400>1
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalcysleuglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythrcystyr
245
<210>2
<211>249
<212>prt
<213>人工序列
<220>
<223>c309l/c575a
<400>2
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>3
<211>249
<212>prt
<213>人工序列
<220>
<223>d221n/c309l/c575a
<400>3
asnlysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>4
<211>249
<212>prt
<213>人工序列
<220>
<223>c309l/n563a/c575a
<400>4
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyralavalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>5
<211>249
<212>prt
<213>人工序列
<220>
<223>d221n/c309l/n297a/n563a/c575a
<400>5
asnlysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyralavalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>6
<211>249
<212>prt
<213>人工序列
<220>
<223>d221n/c309l/n563a/c575a
<400>6
asnlysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyralavalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>7
<211>249
<212>prt
<213>人工序列
<220>
<223>-d221n/c309l/n297a/c575a
<400>7
asnlysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>8
<211>249
<212>prt
<213>人工序列
<220>
<223>c309l/n297a/c575a
<400>8
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>9
<211>249
<212>prt
<213>人工序列
<220>
<223>d221n/n297a/n563a/c575a
<400>9
asnlysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalcysleuglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyralavalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>10
<211>249
<212>prt
<213>人工序列
<220>
<223>n297a/n563a/c575a
<400>10
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalcysleuglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyralavalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>11
<211>249
<212>prt
<213>人工序列
<220>
<223>c309l
<400>11
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythrcystyr
245
<210>12
<211>750
<212>dna
<213>人工序列
<220>
<223>编码seq1(hexa-fc)的核酸
<400>12
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtctgcctccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcacctgctactga750
<210>13
<211>750
<212>dna
<213>人工序列
<220>
<223>编码c309l/c575a的核酸
<400>13
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>14
<211>18
<212>prt
<213>智人(homosapiens)
<400>14
prothrleutyrasnvalserleuvalmetseraspthralaglythr
151015
cystyr
<210>15
<211>18
<212>prt
<213>智人(homosapiens)
<400>15
prothrhisvalasnvalservalvalmetalaglnvalaspglythr
151015
cystyr
<210>16
<211>4
<212>prt
<213>人工序列
<220>
<223>间隔区
<400>16
leuvalleugly
1
<210>17
<211>23
<212>prt
<213>智人(homosapiens)
<400>17
gluprolyssercysasplysthrhisthrcysproprocysproala
151015
progluleuleuglyglypro
20
<210>18
<211>10
<212>prt
<213>智人(homosapiens)
<400>18
asplysthrhisthrcysproprocyspro
1510
<210>19
<211>19
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>19
valproserthrproprothrproserproserthrproprothrpro
151015
serproser
<210>20
<211>6
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>20
valpropropropropro
15
<210>21
<211>15
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>21
gluprolyssercysasplysthrhisthrcysproprocyspro
151015
<210>22
<211>12
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>22
gluarglyscyscysvalglucysproprocyspro
1510
<210>23
<211>12
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>23
gluserlystyrglyproprocysprosercyspro
1510
<210>24
<211>4
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>24
cysproprocys
1
<210>25
<211>4
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>25
cysprosercys
1
<210>26
<211>4
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>26
serproprocys
1
<210>27
<211>10
<212>prt
<213>人工序列
<220>
<223>铰链区
<400>27
asplysthrhisthrcysproprocyspro
1510
<210>28
<211>18
<212>prt
<213>人工序列
<220>
<223>本发明的示例性蛋白质
<400>28
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glypro
<210>29
<211>19
<212>dna
<213>人工序列
<220>
<223>正向引物
<400>29
accctgcttgctcaactct19
<210>30
<211>29
<212>dna
<213>人工序列
<220>
<223>反向引物
<400>30
ggccagctagctcagtaggcggtgccagc29
<210>31
<211>21
<212>dna
<213>人工序列
<220>
<223>正向引物
<400>31
tcaccgtcttgcaccaggact21
<210>32
<211>21
<212>dna
<213>人工序列
<220>
<223>反向引物
<400>32
agtcctggtgcaagacggtga21
<210>33
<211>21
<212>dna
<213>人工序列
<220>
<223>n297a正向引物
<400>33
gagcagtacgccagcacgtac21
<210>34
<211>21
<212>dna
<213>人工序列
<220>
<223>n297a反向引物
<400>34
ctcgtcatgcggtcgtgcatg21
<210>35
<211>20
<212>dna
<213>人工序列
<220>
<223>n563a正向引物
<400>35
ccctgtacgccgtgtccctg20
<210>36
<211>20
<212>dna
<213>人工序列
<220>
<223>n563a反向引物
<400>36
gggacatgcggcacagggac20
<210>37
<211>21
<212>dna
<213>人工序列
<220>
<223>d221n正向引物
<400>37
gttagatctaacaaaactcac21
<210>38
<211>21
<212>dna
<213>人工序列
<220>
<223>d221n反向引物
<400>38
caatctagattgttttgagtg21
<210>39
<211>19
<212>dna
<213>人工序列
<220>
<223>c575a正向引物
<400>39
accctgcttgctcaactct19
<210>40
<211>29
<212>dna
<213>人工序列
<220>
<223>c575a反向引物
<400>40
ggccagctagctcagtaggcggtgccagc29
<210>41
<211>21
<212>dna
<213>人工序列
<220>
<223>c309l正向引物
<400>41
tcaccgtcttgcaccaggact21
<210>42
<211>21
<212>dna
<213>人工序列
<220>
<223>c309l反向引物
<400>42
agtcctggtgcaagacggtga21
<210>43
<211>19
<212>dna
<213>人工序列
<220>
<223>重叠pcr正向引物
<400>43
accctgcttgctcaactct19
<210>44
<211>21
<212>dna
<213>人工序列
<220>
<223>重叠pcr反向引物
<400>44
tggtttgtccaaactcatcaa21
<210>45
<211>18
<212>prt
<213>人工序列
<220>
<223>修饰的"尾段"
<400>45
prothrhisvalasnvalservalvalmetalagluvalaspglythr
151015
cystyr
<210>46
<211>750
<212>dna
<213>人工序列
<220>
<223>编码d221n/c309l/c575a的核酸
<400>46
aacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>47
<211>750
<212>dna
<213>人工序列
<220>
<223>编码c309l/n563a/c575a的核酸
<400>47
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacgccgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>48
<211>750
<212>dna
<213>人工序列
<220>
<223>编码d221n/c309l/n297a/n563a/c575a的核酸
<400>48
aacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacgccgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>49
<211>750
<212>dna
<213>人工序列
<220>
<223>编码d221n/c309l/n563a/c575a的核酸
<400>49
aacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacgccgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>50
<211>750
<212>dna
<213>人工序列
<220>
<223>编码d221n/c309l/n297a/c575a的核酸
<400>50
aacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>51
<211>750
<212>dna
<213>人工序列
<220>
<223>编码c309l/n297a/c575a的核酸
<400>51
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>52
<211>750
<212>dna
<213>人工序列
<220>
<223>编码d221n/n297a/n563a/c575a的核酸
<400>52
aacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtctgcctccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacgccgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>53
<211>750
<212>dna
<213>人工序列
<220>
<223>编码n297a/n563a/c575a的核酸
<400>53
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtctgcctccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacgccgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>54
<211>750
<212>dna
<213>人工序列
<220>
<223>编码c309l的核酸
<400>54
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcacctgctactga750
<210>55
<211>249
<212>prt
<213>人工序列
<220>
<223>c309l/n297a/n563a/c575a
<400>55
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalleuhisglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyralavalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>56
<211>750
<212>dna
<213>人工序列
<220>
<223>编码c309l/n297a/n563a/c575a的核酸
<400>56
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtcttgcaccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacgccgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>57
<211>249
<212>prt
<213>人工序列
<220>
<223>n297a/c575a
<400>57
asplysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyralaserthrtyr
65707580
argvalvalservalleuthrvalcysleuglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>58
<211>750
<212>dna
<213>人工序列
<220>
<223>编码n297a/c575a的核酸
<400>58
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacgccagcacgtac240
cgtgtggtcagcgtcctcaccgtctgcctccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
<210>59
<211>249
<212>prt
<213>人工序列
<220>
<223>d221n/c575a
<400>59
asnlysthrhisthrcysproprocysproalaprogluleuleugly
151015
glyproservalpheleupheproprolysprolysaspthrleumet
202530
ileserargthrprogluvalthrcysvalvalvalaspvalserhis
354045
gluaspprogluvallyspheasntrptyrvalaspglyvalgluval
505560
hisasnalalysthrlysproargglugluglntyrasnserthrtyr
65707580
argvalvalservalleuthrvalcysleuglnasptrpleuasngly
859095
lysglutyrlyscyslysvalserasnlysalaleuproalaproile
100105110
glulysthrileserlysalalysglyglnproarggluproglnval
115120125
tyrthrleuproproserarggluglumetthrlysasnglnvalser
130135140
leuthrcysleuvallysglyphetyrproseraspilealavalglu
145150155160
trpgluserasnglyglnprogluasnasntyrlysthrthrpropro
165170175
valleuaspseraspglyserphepheleutyrserlysleuthrval
180185190
asplysserargtrpglnglnglyasnvalphesercysservalmet
195200205
hisglualaleuhisasnhistyrthrglnlysserleuserleuser
210215220
proglylysleuvalleuglyproproleutyrasnvalserleuval
225230235240
metseraspthralaglythralatyr
245
<210>60
<211>750
<212>dna
<213>人工序列
<220>
<223>编码d221n/c575a的核酸
<400>60
aacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60
ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120
tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240
cgtgtggtcagcgtcctcaccgtctgcctccaggactggctgaatggcaaggagtacaag300
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360
gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaag420
aaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggag480
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540
gacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg600
aacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagc660
ctctccctgtctccgggtaaattagtcctaggaccccccctgtacaacgtgtccctggtc720
atgtccgacacagctggcaccgcctactga750
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



