结合PD-1的抗体及其用途的制作方法
 2021-02-02 17:02:30|
2021-02-02 17:02:30| 388|
388| 起点商标网
起点商标网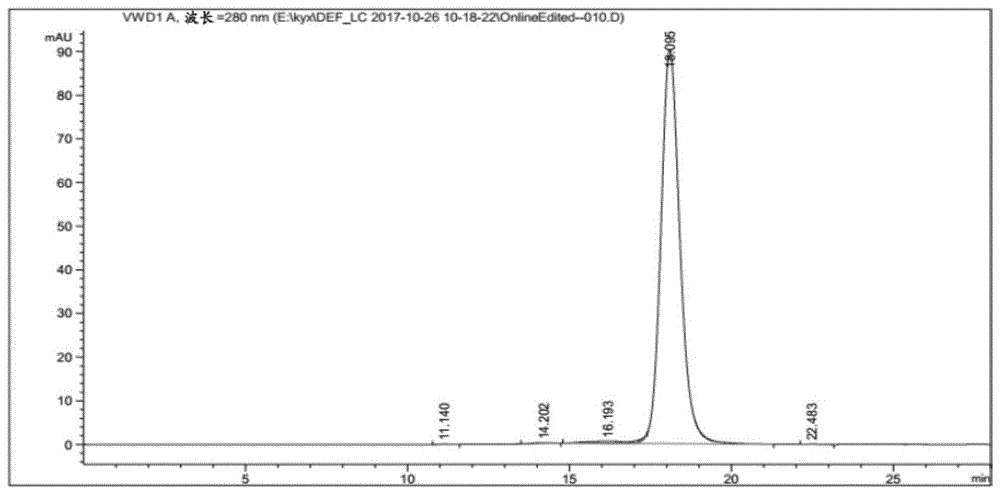
本发明一般涉及分离的单克隆抗体,特别是以高亲和力和功能性特异性结合人pd-1的单克隆抗体。还提供了编码所述抗体的核酸分子、表达载体、宿主细胞和表达所述抗体的方法。本发明还提供了包含所述抗体的免疫缀合物、双特异性分子和药物组合物,以及使用本发明的抗pd-1抗体的诊断和治疗方法。
背景技术:
治疗性抗体是制药工业增长最快的部分之一,尤其是靶向某些疾病相关细胞蛋白的单克隆抗体。
一种这样的靶蛋白是程序性细胞死亡蛋白1,也称为pd-1(cd279),由pdcd1基因编码(ishiday等人,emboj11:3887-95(1992);franciscolm等人,immunologicalreviews.236:219-42(2010)),其是t细胞调节剂cd28家族的成员,但是作为单体存在,缺乏在其他cd28家族成员中特有的未配对的半胱氨酸残基。
pd-1是属于免疫球蛋白超家族的55kdai型跨膜蛋白,并且在活化的b细胞、t细胞和骨髓细胞上表达(keirme,等人,annurevimmunol26:677-704(2008);agata等人(1996)intimmunol8:765-72;okazaki等人(2002)curr.opin.immunol.14:391779-82;bennett等人(2003)jimmunol170:711-8)。pd-1结合两个配体pd-l1和pd-l2(dongh,等人,natmed5:1365-9(1999);latchmany,等人,natimmunol2:261-8(2001))。在结合其配体后,发现pd-1抑制t细胞受体(tcr)的信号转导,并且下调免疫刺激细胞因子的分泌和存活蛋白的表达(keirme,等人,annurevimmunol26:677-704(2008);dongh,等人,natmed5:1365-9(1999))。
临床前研究显示在消除单独的pd-1途径信号传导(hiranof,等人,cancerres65:1089-96(2005))或与其他免疫检查点抑制组合(woosr,等人,cancerres72(4):917-27(2012))后肿瘤消退或延长的宿主存活。
已经开发了许多靶向pd-1受体的癌症免疫治疗剂。一种这样的抗pd-1抗体是nivolumab(由bristolmyerssquibb以商品名
尽管抗pd-1抗体已经开发和批准,但是仍需要具有增强的结合亲和力和其它期望的药物特征的另外的单克隆抗体。
技术实现要素:
本发明提供了结合人或猴pd-1的分离的单克隆抗体,例如人单克隆抗体。
在一个方面,本发明涉及一种分离的单克隆抗体(例如,人抗体),或其抗原结合部分,其具有包含cdr1区、cdr2区和cdr3区的重链可变区,其中cdr1区、cdr2区和cdr3区包含与下述具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列
(1)分别为seqidno:1、2和3;或
(2)分别为seqidno:1、2和4;
其中所述抗体或其抗原结合片段结合pd-1。这些氨基酸序列可分别由seqidno:40至43的核酸序列编码。
在一个方面,本发明的分离的单克隆抗体(例如,人抗体)或其抗原结合部分包含重链可变区,所述重链可变区包含与seqidno:8至16中的任一个具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列,其中所述抗体或其抗原结合片段结合pd-1。这些氨基酸序列可以分别由seqidno:44至52的核酸序列编码。
在一个实施方式中,本发明的单克隆抗体或其抗原结合部分包含轻链可变区,所述轻链可变区包含cdr1区、cdr2区和cdr3区,其中所述cdr1区、cdr2区和cdr3区包含分别与seqidno:5、6和7具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列,其中所述抗体或其抗原结合片段结合pd-1。这些氨基酸序列可以分别由seqidno:53至55的核酸序列编码。
在一个方面,本发明的分离的单克隆抗体(例如人抗体)或其抗原结合部分包含含有与seqidno:17具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列的轻链可变区,其中所述抗体或其抗原结合片段结合pd-1。这些氨基酸序列可以由seqidno:56的核酸序列编码。
在一个方面,本发明的分离的单克隆抗体或其抗原结合部分包含各自含有cdr1区、cdr2区和cdr3区的重链可变区和轻链可变区,其中所述重链可变区cdr1、cdr2和cdr3以及所述轻链可变区cdr1、cdr2和cdr3包含(1)分别与seqidno:1、2、3、5、6和7;或(2)分别与seqidno:1、2、4、5、6和7具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列,其中所述抗体或其抗原结合片段结合pd-1。
在一个实施方案中,抗体或其抗原结合部分包含重链可变区和轻链可变区,重链可变区和轻链可变区包含与以下具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列:(1)分别为seqidno:8和17;(2)分别为seqidno:9和17;(3)分别为seqidno:10和17;(4)分别为seqidno:11和17;(5)分别为seqidno:12和17;(6)分别为seqidno:13和17;(7)分别为seqidno:14和17;(8)分别为seqidno:15和17;或(9)分别为seqidno:16和17,其中抗体或其抗原结合片段结合pd-1。
在一个实施方案中,抗体或其抗原结合部分包含重链和轻链,其中重链包含如上所述的重链可变区和seqidno:18或19中所示的重链恒定区,并且轻链包含如上所述的轻链可变区和seqidno:20中所示的轻链恒定区。seqidno:18-20的氨基酸序列可以由seqidno:57-59的核酸序列编码。
在一个实施方案中,抗体或其抗原结合部分包含通过二硫键相互连接的重链和轻链,其包含分别与以下具有至少80%、85%、90%、95%、98%、99%或100%同一性的氨基酸序列:(1)分别为seqidno:21和39;(2)分别为seqidno:22和39;(3)分别为seqidno:23和39;(4)分别为seqidno:24和39;(5)分别为seqidno:25和39;(6)分别为seqidno:26和39;(7)分别为seqidno:27和39;(8)分别为seqidno:28和39;(9)分别为seqidno:29和39;(10)分别为seqidno:30和39;(11)分别为seqidno:31和39;(12)分别为seqidno:32和39;(13)分别为seqidno:33和39;(14)分别为seqidno:34和39;(15)分别为seqidno:35和39;(16)分别为seqidno:36和39;(17)分别为seqidno:37和39;或(18)分别为seqidno:38和39,其中抗体或其抗原结合片段结合pd-1。
与现有技术的抗pd-1抗体诸如nivolumab相比,本发明的抗体或其抗原结合部分具有相当的或甚至更好的对人pd-1或猴pd-1的结合亲和力/能力。此外,本发明的抗体或其抗原结合部分诱导t细胞释放更多的il-2和ifng,并且提供比现有技术的抗pd-1抗体诸如nivolumab更好的体内抗肿瘤效应。
具体地,本发明的抗体或其抗原结合部分以约1.406×10-9m或更低的kd结合人pd-1,并且抑制pd-l1/pd-l2与pd-1的结合。本发明的抗体或其抗原结合部分不结合小鼠pd-1,并且不与cd28、icos、btla或ctla-4交叉反应。此外,本发明的抗体或其抗原结合部分以较低ec50值与食蟹猴pd-1结合,并且诱导t细胞释放比现有技术的抗pd-1抗体如nivolumab更高水平的il-2分泌和ifng。本发明的抗体或其抗原结合部分刺激抗原特异性记忆应答和/或刺激抗体应答。
本发明的抗体可以是例如全长抗体,例如igg1或igg4同种型。或者,抗体可以是抗体片段,如fab或f(ab′)2片段,或单链抗体。重链恒定区是特别设计的,以使抗pd-1抗体不在表达pd-1的细胞上诱导抗体依赖性细胞介导的细胞毒性(adcc)或补体依赖性细胞毒性(cdc)。例如,人igg1重链可包含l234a、l235a、d265a和/或p329a突变,以消除adcc或cdc功能。本发明的抗体可以是小鼠、嵌合、人或人源化抗体,例如单克隆抗体。
本发明还提供了免疫缀合物,其包含与治疗剂例如放射性同位素连接的本发明抗体或其抗原结合部分。本发明还提供了双特异性分子,其包含与第二功能模块(例如第二抗体)连接的本发明的抗体或其抗原结合部分,所述第二功能模块具有与所述抗体或其抗原结合部分不同的结合特异性。
还提供了包含本发明的抗体或其抗原结合部分、或免疫缀合物、或双特异性分子,以及药学上可接受的载体的组合物。
本发明还包括编码本发明抗体或其抗原结合部分的核酸分子,以及包含这种核酸的表达载体和包含这种表达载体的宿主细胞。还提供了一种使用包含该表达载体的宿主细胞制备抗pd-1抗体的方法,该方法包括步骤(i)在宿主细胞中表达抗体和(ii)从宿主细胞分离抗体。
在另一方面,本发明提供了调节受试者中免疫应答的方法,包括向受试者施用本发明的抗体或其抗原结合部分,从而调节受试者中的免疫应答。优选地,本发明的抗体或其抗原结合部分增强、刺激或增加受试者的免疫应答。在另一方面,本发明提供了抑制受试者中肿瘤细胞生长的方法,包括向受试者施用治疗有效量的本发明的抗体或其抗原结合部分。在一个实施方案中,所述肿瘤是选自肺癌、淋巴瘤、间皮瘤、黑色素瘤或肾细胞癌的实体瘤。在另一个方面,本发明提供了治疗受试者中的感染性疾病的方法,包括向受试者施用治疗有效量的本发明的抗体或其抗原结合部分。在另一方面,所述方法包括在受试者中施用本发明的免疫缀合物、双特异性分子或能够表达所述免疫缀合物、双特异性分子的核酸分子。
更进一步,本发明提供了一种增强受试者中对抗原的免疫应答的方法,包括向受试者施用:(i)抗原;和(ii)抗pd-1抗体或其抗原结合部分,使得受试者中对抗原的免疫应答增强。抗原可以是例如肿瘤抗原、病毒抗原、细菌抗原或来自病原体的抗原。
本发明的抗体可与至少一种其它活性剂组合使用,所述其它活性剂例如免疫刺激性抗体(例如抗pd-l1抗体、抗tim-3抗体和/或抗ctla-4抗体)、细胞因子(例如il-2和/或il-21)或共刺激性抗体(例如抗cd137和/或抗gitr抗体)。
本发明的其它特征和优点将从以下详细描述和实施例变得明显,这些实施例不应被解释为限制性的。本申请中引用的所有参考文献、genbank条目、专利和公开的专利申请的内容明确地通过引用并入本文。
附图说明
图1显示抗pd-1抗体21f12的hplc图谱。
图2a-2d显示抗pd-1抗体21f12,19e11(a),21f12-1f6,21f12-1b12(b),21f12-1e11,21f12-1e10,21f12-3g1(c),和21f12-1e11,21f12-1b12,21f12-2e1,21f12-2h7(d)与人pd-1的结合能力。
图3a至3c显示抗pd-1抗体21f12-1f6结合人pd-1(a)、食蟹猴pd-1(b)及小鼠pd-1(c)的能力。
图4a至4d示出了抗pd-1抗体21f12-1f6与人cd28(a)、人icos(b)、人btla(c)和人ctla4(d)的交叉反应性。
图5a至5f显示抗pd-1抗体21f12-1b12(a),21f12,21f12-3g1(b),21f12,21f12-1e11,21f12-1b12,21f12-2e1,21f12-2h7(c),21f12-1c4,21f12(d),和21f12-1e10,21f12(e)对人pd-1/pd-l1相互作用的阻断能力,和抗pd-1抗体21f12-1b12对人pd-1/pd-l2相互作用的阻断能力(f)。
图6a和6b显示抗pd-1抗体21f12-1f6(a)、21f12、21f12-1c4、21f12-1e10、21f12-1b12和21f12-3g1(b)与cho-k1-pd-1细胞上表达的pd-1的结合能力。
图7a和7b显示抗pd-1抗体21f12-1f6与人pbmc(a)或食蟹猴pbmc(b)上表达的pd-1的结合能力。
图8a和8b显示抗pd-1抗体21f12-1f6诱导人t细胞释放il2(a)和ifng(b)。
图9显示抗pd-1抗体21f12-1f6对jurkat-nfat-pd1报告基因系统中的pd-1-pd-l1相互作用的阻断能力。
图10显示了抗体21f12-1f6与fcγri的结合能力。
具体实施方式
为了可以更容易地理解本公开,首先定义某些术语。在整个详细描述中阐述了另外的定义。
术语″pd-1″是指程序性细胞死亡蛋白1。术语″pd-1″包含变体、同种型、同源物、直系同源物和旁系同源物。举例来说,在某些情况下,特异性针对人pd-1蛋白的抗体可与来自除人以外的物种(例如食蟹猴)的pd-1蛋白交叉反应。在其它实施方案中,特异性针对人pd-1蛋白的抗体可完全特异性针对人pd-1蛋白且不展现与其它物种或其它类型的交叉反应性,或可与来自某些其它物种但不是所有其它物种的pd-1交叉反应。
术语″人pd-1″指人pd-1序列,如具有genbank登录号.np_005009.2的人pd-1的完整氨基酸序列。
术语“免疫应答”指的是例如淋巴细胞、抗原提呈细胞、吞噬细胞、粒细胞和由上述细胞或肝脏产生的可溶性大分子(包括抗体、细胞因子和补体)的作用,所述作用引起对入侵的病原体、被病原体感染的细胞或组织、癌细胞或在自身免疫或病理性炎症的情况下,对正常人类细胞或组织的选择性损伤、破坏或从人体内消除。
″抗原特异性t细胞应答″是指t细胞的应答,其由用t细胞对其具有特异性的抗原刺激t细胞而引起。t细胞在抗原特异性刺激后的应答的非限制性实例包括增殖和细胞因子产生(例如,il-2产生)。
如本文所提到的术语“抗体”包括完整抗体和其任何抗原结合片段(即“抗原结合部分”)或单链。完整抗体是糖蛋白,其包含通过二硫键相互连接的至少两条重(h)链和两条轻(l)链。每一条重链包含重链可变区(在本文中缩写为vh)和重链恒定区(在本文中缩写为ch)。重链恒定区包含三个结构域,即ch1、ch2和ch3。每一条轻链包含轻链可变区(在本文中缩写为vl)和轻链恒定区(在本文中缩写为cl)。轻链恒定区包含一个结构域,即cl。vh区和vl区可以进一步细分成被称为互补决定区(cdr)的高变区,所述高变区与被称为框架区(fr)的更保守的区域交替。每一个vh和vl由三个cdr和四个fr构成,它们从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,包括免疫系统的各种细胞(例如效应细胞)和经典补体系统的第一组分(c1q)。有时,重链恒定区被修改以消除这种功能。
如本文所用的术语抗体的“抗原结合部分”(或简称为“抗体部分”)指的是抗体的一个或多个片段,其保留与抗原(例如pd-1蛋白)特异性结合的能力。已经证实的是,抗体的抗原结合功能可以通过全长抗体的片段来执行。术语抗体的“抗原结合部分”内所涵盖的结合片段的实例包括(i)fab片段,即由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab′)2片段,即包含在铰链区通过二硫桥连接的两个fab片段的二价片段;(iii)由vh结构域和ch1结构域组成的fd片段;(iv)由单臂的vl结构域和vh结构域组成的fv片段;(v)由vh结构域组成的dab片段(ward等,(1989)nature341:544-546);(vi)分离的互补决定区(cdr);和(vii)纳米抗体,即含有单一可变结构域和两个恒定结构域的重链可变区。此外,尽管fv片段的两个结构域vl和vh由单独的基因编码,但是它们可以使用重组方法通过合成接头连接,所述合成接头使得它们能够被制成单一蛋白质链,其中所述vl区和vh区配对以形成单价分子(被称为单链fv(scfv);参见例如bird等(1988)science242:423-426;和huston等(1988)proc.natl.acad.sci.usa85:5879-5883)。这些单链抗体也意图被涵盖在术语抗体的“抗原结合部分”内。这些抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同的方式针对效用筛选片段。
如本文所用的“分离的抗体”意图指的是基本上不含具有不同的抗原特异性的其它抗体的抗体(例如特异性结合pd-1蛋白的分离的抗体基本上不含特异性结合除pd-1蛋白以外的抗原的抗体)。然而,特异性结合人类pd-1蛋白的分离的抗体可以对其它抗原,如来自其它物种的pd-1蛋白具有交叉反应性。此外,分离的抗体可以基本上不含其它细胞物质和/或化学物质。
如本文所用的术语“单克隆抗体”或“单克隆抗体组合物”指的是具有单一分子组成的抗体分子的制剂。单克隆抗体组合物对特定表位显示出单一结合特异性和亲和力。
术语“同种型”指的是由重链恒定区基因编码的抗体类别(例如igm或igg1)。
短语“识别抗原的抗体”和“对抗原具有特异性的抗体”在本文中可与术语“与抗原特异性结合的抗体”互换使用。
术语“抗体衍生物”指的是抗体的任何修饰形式,例如抗体与另一种药剂或抗体的缀合物。
如本文所用的“与人pd-1特异性结合”的抗体意图指的是与人pd-1蛋白(和可能的来自一种或多种非人类物种的pd-1蛋白)结合,但是基本上不与非pd-1蛋白结合的抗体。优选的是,所述抗体以“高亲和力”,即以1×10-8m或更小,更优选地5×10-9m或更小的kd与人pd-1蛋白结合。
如本文所用的术语“基本上不与蛋白质或细胞结合”意指不与所述蛋白质或细胞结合或不以高亲和力与所述蛋白质或细胞结合,即以1×10-6m或更大,更优选地1×10-5m或更大,更优选地1×10-4m或更大,更优选地1×10-3m或更大,甚至更优选地1×10-2m或更大的kd与所述蛋白质或细胞结合。
如本文所用的术语“k缔合”或“ka”意图指的是特定抗体-抗原相互作用的缔合速率,而如本文所用的术语“k解离”或“kd”意图指的是特定抗体-抗原相互作用的解离速率。如本文所用的术语“kd”意图指的是解离常数,其是由kd与ka的比率(即kd/ka)获得的并且被表示为摩尔浓度(m)。抗体的kd值可以使用本领域中公认的方法来确定。用于确定抗体的kd的优选方法是通过使用表面等离子共振,优选地使用生物传感器系统,如biacoretm系统。
术语igg抗体的“高亲和力”指的是对靶抗原具有1×10-6m或更小,更优选地5×10-8m或更小,甚至更优选地1×10-8m或更小,甚至更优选地5×10-9m或更小的kd的抗体。然而,“高亲和力”结合对于其它抗体同种型可以不同。例如,igm同种型的“高亲和力”结合指的是具有10-6m或更小,更优选地10-7m或更小,甚至更优选地10-8m或更小的kd的抗体。
术语″ic50″也称为半数最大抑制浓度,是指相对于抗体的缺失,抑制特定生物或生物化学功能50%的抗体的浓度。
术语“ec50”也被称为半数最大有效浓度,指的是在指定的暴露时间之后引起基线与最大值之间的一半响应的抗体浓度。
如本文所用,术语″抗体依赖性细胞毒性″、″抗体依赖性细胞介导的细胞毒性″或″adcc″是指细胞介导的免疫防御机制,由此免疫系统的效应细胞主动裂解靶细胞,例如肿瘤细胞,其膜表面抗原已被抗体结合。本发明的抗体不在表达pd-1的细胞上诱导adcc以保护免疫细胞。
术语″补体依赖性细胞毒性″或″cdc″通常指igg和igm抗体的效应子功能,其在与表面抗原结合时触发经典补体途径,诱导膜攻击复合物的形成和靶细胞裂解。本发明的抗体不诱导对pd-1表达细胞的cdc以保护免疫细胞。
术语“受试者”包括任何人类或非人类动物。术语“非人类动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,如非人类灵长类动物、羊、狗、猫、牛、马、鸡、两栖动物和爬行动物,尽管哺乳动物是优选的,如非人类灵长类动物、羊、狗、猫、牛和马。
在以下小节中更详细地描述本发明的各个方面。
本发明涉及抗pd-1抗体,其序列信息总结于下表1中。
表1中的cdr区已经通过kabat编号系统确定。然而,如本领域熟知的,cdr区也可通过其他系统例如chothia、ccg和imgt系统/方法基于重链/轻链可变区序列来确定。
本发明的抗体可以含有突变igg1恒定区,其具有seqidno:18的氨基酸序列。本发明的抗体还可以包含igg4恒定区,其具有seqidno:19的氨基酸序列。
具有提高的与pd-1结合能力和有利功能特性的抗pd-1抗体
与现有技术的抗pd-1抗体如nivolumab相比,本发明的抗体或其抗原结合部分对人pd-1或猴pd-1具有相当的或甚至更好的结合亲和力/能力。此外,本发明的抗体或其抗原结合部分诱导pbmc释放更多的il-2和ifnγ,并且提供比现有技术的抗pd-1抗体例如nivolumab更好的体内抗肿瘤效果。
具体而言,本发明的抗体或其抗原结合部分以约1.406×10-9m或更低的kd结合人pd-1,并抑制pd-l1/pd-l2与pd-1的结合。本发明的抗体或其抗原结合部分不结合小鼠pd-1,并且不与cd28、icos、btla或ctla-4交叉反应。此外,本发明的抗体或其抗原结合部分以较低的ec50值结合食蟹猴pd-1,并且诱导pbmc比现有技术的抗pd-1抗体如nivolumab释放更高水平的il-2分泌和ifnγ。本发明的抗体或其抗原结合部分刺激抗原特异性记忆应答,和/或刺激抗体应答。
本发明优选的抗体是人单克隆抗体。另外或可选地,抗体可以是例如嵌合或人源化单克隆抗体。
单克隆抗pd-1抗体
其它结合人pd-1的抗pd-1抗体的vh和vl序列(或cdr序列)可以与本发明的抗tim-3抗体的vh和vl序列(或cdr序列)“混合和匹配”。优选地,当vh和vl链(或此类链内的cdr)混合并匹配时,来自特定vh/vl配对的vh序列被结构相似的vh序列替代。同样,优选地,来自特定vh/vl配对的vl序列被结构相似的vl序列替代。
因此,在一个实施方案中,本发明的抗体或其抗原结合部分包含:
(a)包含上表1中所列氨基酸序列的重链可变区;以及
(b)包含上表1中所列氨基酸序列的轻链可变区,或另一种抗pd-1抗体的vl,其中所述抗体特异性结合人pd-1。
在另一个实施方案中,本发明的抗体或其抗原结合部分包含:
(a)上表1中所列的重链可变区的cdr1、cdr2和cdr3区;以及
(b)上表1中所列的轻链可变区的cdr1、cdr2和cdr3区,或另一种抗pd-1抗体的cdr,其中该抗体特异性结合人pd-1。
在另一个实施方案中,该抗体或其抗原结合部分包括与结合人pd-1的其它抗体的cdr组合的抗pd-1抗体的重链可变cdr2区,所述其它抗体的cdr例如来自重链可变区的cdr1和/或cdr3,和/或来自不同抗pd-1抗体的轻链可变区的cdr1、cdr2和/或cdr3。
此外,在本领域中公知的是,独立于cdr1结构域和/或cdr2结构域,cdr3结构域单独可以决定抗体对同源抗原的结合特异性,并且可以基于共同的cdr3序列可预测地产生具有相同的结合特异性的多种抗体。参见例如klimka等,britishj.ofcancer83(2):252-260(2000);beiboer等,j.mol.biol.296:833-849(2000);rader等,proc.natl.acad.sci.u.s.a.95:8910-8915(1998);barbas等,j.am.chem.soc.116:2161-2162(1994);barbas等,proc.natl.acad.sci.u.s.a.92:2529-2533(1995);ditzel等,j.immunol.157:739-749(1996);berezov等,biajournal8:scientificreview8(2001);igarashi等,j.biochem(东京)117:452-7(1995);bourgeois等,j.virol72:807-10(1998);levi等,proc.natl.acad.sci.u.s.a.90:4374-8(1993);polymenis和stoller,j.immunol.152:5218-5329(1994);以及xu和davis,immunity13:37-45(2000)。还参见美国专利号6,951,646;6,914,128;6,090,382;6,818,216;6,156,313;6,827,925;5,833,943;5,762,905和5,760,185。这些参考文献中的每一篇在此以引用的方式整体并入本文。
因此,在另一个实施方案中,本发明的抗体包含抗pd-1抗体的重链可变区的cdr2和至少抗pd-1抗体的重链和/或轻链可变区的cdr3,或另一种抗pd-1抗体的重链和/或轻链可变区的cdr3,其中该抗体能够特异性结合人pd-1。这些抗体优选(a)竞争结合pd-1;(b)保留功能特性;(c)结合相同的表位;和/或(d)具有与本发明的抗pd-1抗体相似的结合亲和力。在另一个实施方案中,抗体还可以包含抗pd-1抗体的轻链可变区的cdr2,或另一种抗pd-1抗体的轻链可变区的cdr2,其中所述抗体能够特异性结合人pd-1。在另一个实施方案中,本发明的抗体可以包括抗pd-1抗体的重链和/或轻链可变区的cdr1,或另一种抗pd-1抗体的重链和/或轻链可变区的cdr1,其中所述抗体能够特异性结合人pd-1。
保守修饰
在另一个实施方案中,本发明的抗体包含cdr1序列、cdr2序列和cdr3序列的重链可变区序列和/或轻链可变区序列,它们与本发明的那些抗pd-1抗体不同之处在于一个或多个保守修饰。在本领域中应当了解的是,可以进行某些保守序列修饰,所述修饰不去除抗原结合。参见例如brummell等(1993)biochem32:1180-8;dewildt等(1997)prot.eng.10:835-41;komissarov等(1997)j.biol.chem.272:26864-26870;hall等(1992)j.immunol.149:1605-12;kelley和o′connell(1993)biochem.32:6862-35;adib-conquy等(1998)int.immunol.10:341-6;以及beers等(2000)clin.can.res.6:2835-43。
因此,在一个实施方案中,抗体包含含有cdr1、cdr2和cdr3序列的重链可变区和/或含有cdr1、cdr2和cdr3序列的轻链可变区,其中:
(a)重链可变区cdr1序列包含上表1中列出的序列,和/或其保守修饰;和/或
(b)重链可变区cdr2序列包含上表1中所列的序列,和/或其保守修饰;和/或
(c)重链可变区cdr3序列包含上表1中列出的序列及其保守修饰;和/或
(d)轻链可变区cdr1和/或cdr2和/或cdr3序列包含上表1中所列的序列;和/或其保守修饰;和
(e)抗体特异性结合人pd-1。
如本文所用的术语“保守序列修饰”意图指的是不会显著影响或改变含有所述氨基酸序列的抗体的结合特性的氨基酸修饰。这样的保守修饰包括氨基酸取代、添加和缺失。可以通过本领域已知的标准技术,如定点诱变和pcr介导的诱变将修饰引入到本发明的抗体中。保守氨基酸取代是其中氨基酸残基被具有相似侧链的氨基酸残基置换的氨基酸取代。具有相似侧链的氨基酸残基的家族已经在本领域中被定义。这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、具有β-支化侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)和具有芳族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,本发明的抗体的cdr区内的一个或多个氨基酸残基可以被来自同一侧链家族的其它氨基酸残基置换并且可以使用本文所述的功能测定来测试改变的抗体的保留功能(即上述功能)。
工程化和修饰的抗体
可以使用具有本发明的抗pd-1抗体的vh序列/vl序列中的一个或多个的抗体作为起始材料来对修饰的抗体进行工程化以制备本发明的抗体。可以通过修饰一个或两个可变区(即vh和/或vl)内,例如一个或多个cdr区内和/或一个或多个框架区内的一个或多个残基来对抗体进行工程化。另外地或可选地,可以通过修饰一个或多个恒定区内的残基来对抗体进行工程化,例如以改变抗体的一种或多种效应功能。
在某些实施方案中,可以使用cdr移植来对抗体的可变区进行工程化。抗体主要通过位于六个重链互补决定区和轻链互补决定区(cdr)中的氨基酸残基与靶抗原相互作用。出于这个原因,在单个抗体之间cdr内的氨基酸序列比cdr之外的序列更具多样性。由于cdr序列负责大多数抗体-抗原相互作用,因此有可能通过构建表达载体来表达模拟特异性的天然存在的抗体的特性的重组抗体,所述表达载体包括移植到来自具有不同特性的不同抗体的框架序列上的来自所述特异性的天然存在的抗体的cdr序列(参见例如riechmann等(1998)nature332:323-327;jones等(1986)nature321:522-525;queen等(1989)proc.natl.acad.see.u.s.a.86:10029-10033;美国专利号5,225,539;5,530,101;5,585,089;5,693,762和6,180,370)。
因此,本发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合部分,其包含含有cdr1、cdr2和cdr3序列的重链可变区,所述cdr1、cdr2和cdr3序列包含如上所述的本发明序列,和/或包含含有cdr1、cdr2和cdr3序列的轻链可变区,所述cdr1、cdr2和cdr3序列包含如上所述的本发明序列。虽然这些抗体含有本发明单克隆抗体的vh和vlcdr序列,但它们可以含有不同的框架序列。
这样的框架序列可以从包括生殖系抗体基因序列的公共dna数据库或公开的参考文献中获得。例如,人类重链和轻链可变区基因的生殖系dna序列可以在“vbase”人类生殖系序列数据库(可在互联网上在www.mrc-cpe.cam.ac.uk/vbase处获得),以及kabat等(1991)(上文所引用);tomlinson等(1992),j.mol.biol.227:776-798;以及cox等(1994),eur.j.immunol.24:827-836中找到,这些文献中的每一篇的内容明确地以引用的方式并入本文。作为另一个实例,人类重链和轻链可变区基因的生殖系dna序列可以在基因库数据库中找到。例如,在hco7humab小鼠中发现的以下重链生殖系序列可以所附的基因库登录号:1-69(ng__0010109、nt__024637和bc070333)、3-33(ng__0010109和nt__024637)和3-7(ng__0010109和nt__024637)获得。作为另一个实例,在hco12humab小鼠中发现的以下重链生殖系序列可以所附的基因库登录号:1-69(ng__0010109、nt__024637和bc070333)、5-51(ng__0010109和nt__024637)、4-34(ng__0010109和nt__024637)、3-30.3(caj556644)和3-23(aj406678)获得。
使用本领域技术人员公知的被称作gappedblast的序列相似性搜索方法之一,将抗体蛋白质序列与编译的蛋白质序列数据库进行比较(altschul等(1997)(同上))。
用于本发明的抗体中的优选的框架序列是与本发明的抗体所使用的框架序列在结构上相似的那些框架序列。vhcdr1序列、cdr2序列和cdr3序列可以被移植到具有与作为框架序列的来源的生殖系免疫球蛋白基因中存在的序列相同的序列的框架区上,或cdr序列可以被移植到与生殖系序列相比含有一个或多个突变的框架区上。例如,已经发现在某些情况下,有益的是,使框架区内的残基突变以维持或增强抗体的抗原结合能力(参见例如美国专利号5,530,101;5,585,089;5,693,762和6,180,370)。
另一种类型的可变区修饰是使vh和/或vlcdr1区、cdr2区和/或cdr3区内的氨基酸残基突变,从而改善所关注的抗体的一种或多种结合特性(例如亲和力)。可以进行定点诱变或pcr介导的诱变以引入一个或多个突变并且可以在如本文所述和实施例中所提供的体外或体内测定中评价对抗体结合或所关注的其它功能特性的影响。优选的是,引入保守修饰(如本领域已知)。所述突变可以是氨基酸取代、添加或缺失,但是优选地是取代。此外,通常改变cdr区内不超过1个、2个、3个、4个或5个残基。
因此,在另一个实施方案中,本发明提供了分离的抗pd-1单克隆抗体或其抗原结合部分,其包含重链可变区,所述重链可变区包含:(a)包含本发明序列或与本发明序列相比具有1个、2个、3个、4个或5个氨基酸取代、缺失或添加的氨基酸序列的vhcdr1区;(b)包含本发明序列或与本发明序列相比具有1个、2个、3个、4个或5个氨基酸取代、缺失或添加的氨基酸序列的vhcdr2区;(c)包含本发明序列或与本发明序列相比具有1个、2个、3个、4个或5个氨基酸取代、缺失或添加的氨基酸序列的vhcdr3区;(d)包含本发明序列或与本发明序列相比具有1个、2个、3个、4个或5个氨基酸取代、缺失或添加的氨基酸序列的vlcdr1区;(e)包含本发明序列或与本发明序列相比具有1个、2个、3个、4个或5个氨基酸取代、缺失或添加的氨基酸序列的vlcdr2区;以及(f)包含本发明序列或与本发明序列相比具有1个、2个、3个、4个或5个氨基酸取代、缺失或添加的氨基酸序列的vlcdr3区。
本发明的工程化的抗体包括其中已经对vh和/或vl内的框架残基进行修饰,例如以改善抗体的特性的那些抗体。通常,进行这样的框架修饰以降低抗体的免疫原性。例如,一种方法是将一个或多个框架残基“回复突变”为相应的生殖系序列。更具体地,已经经历了体细胞突变的抗体可以含有与作为所述抗体的来源的生殖系序列不同的框架残基。这样的残基可以通过将抗体框架序列与作为抗体的来源的生殖系序列进行比较来鉴定。
另一种类型的框架修饰涉及使框架区内或甚至一个或多个cdr区内的一个或多个残基突变以去除t细胞表位,从而降低抗体的潜在免疫原性。这种方法也被称为“去免疫化”并且更详细地描述于美国专利公布号20030153043中。
除了在框架区或cdr区内进行修饰之外或作为在框架区或cdr区内进行修饰的替代方案,可以对本发明的抗体进行工程化以在fc区内包括修饰,通常以改变抗体的一种或多种功能特性,如血清半衰期、补体固定、fc受体结合和/或抗原依赖性细胞毒性。此外,可以对本发明的抗体进行化学修饰(例如可以将一个或多个化学部分连接到所述抗体上),或对其进行修饰以改变它的糖基化,从而再次改变所述抗体的一种或多种功能特性。
在一个实施方案中,对ch1的铰链区进行修饰以使得铰链区中半胱氨酸残基的数量改变,例如增加或减少。这种方法进一步描述于美国专利号5,677,425中。改变ch1的铰链区中半胱氨酸残基的数量以例如促进轻链和重链的组装或增加或降低抗体的稳定性。
在另一个实施方案中,使抗体的fc铰链区突变以缩短抗体的生物半衰期。更具体地,将一个或多个氨基酸突变引入到fc铰链片段的ch2-ch3结构域界面区中以使得相对于天然fc铰链结构域spa结合,所述抗体具有受损的葡萄球菌蛋白a(spa)结合。这种方法更详细地描述于美国专利号6,165,745中。
在又一个实施方案中,修饰抗体的糖基化。例如,可以制备无糖基化的抗体(即抗体缺乏糖基化)。可以改变糖基化以例如增加抗体对抗原的亲和力。这样的碳水化合物修饰可以通过例如改变抗体序列内一个或多个糖基化位点来实现。例如,可以进行一个或多个氨基酸取代,其引起一个或多个可变区框架糖基化位点的消除,从而消除该位点处的糖基化。这样的无糖基化可以增加抗体对抗原的亲和力。参见例如美国专利号5,714,350和6,350,861。
另外地或可选地,可以制备具有改变的糖基化类型的抗体,如具有减少的岩藻糖基残基量的低岩藻糖基化抗体或具有增加的平分型glcnac结构的抗体。已经证实这样的改变的糖基化谱增加了抗体的adcc能力。这样的碳水化合物修饰可以通过例如使抗体在具有改变的糖基化机制的宿主细胞中表达来实现。具有改变的糖基化机制的细胞已经在本领域中描述并且可以用作用于表达本发明的重组抗体的宿主细胞,从而产生具有改变的糖基化的抗体。例如,细胞系ms704、ms705和ms709缺乏岩藻糖基转移酶基因fut8(α(1,6)-岩藻糖基转移酶),因此在ms704、ms705和ms709细胞系中表达的抗体在它们的碳水化合物上缺乏岩藻糖。ms704、ms705和ms709fut8-/-细胞系是通过使用两种置换型载体靶向破坏cho/dg44细胞中的fut8基因而产生的(参见美国专利公布号20040110704和yamane-ohnuki等(2004)biotechnolbioeng87:614-22)。作为另一个实例,ep1,176,195描述了一种细胞系,其具有功能性破坏的fut8基因(所述基因编码岩藻糖基转移酶),因此通过减少或消除α-1,6键相关的酶,在这样的细胞系中表达的抗体表现出低岩藻糖基化。ep1,176,195还描述了这样的细胞系,所述细胞系具有低的将岩藻糖添加到与抗体的fc区结合的n-乙酰葡糖胺的酶活性或不具有酶活性,例如大鼠骨髓瘤细胞系yb2/0(atcccrl1662)。pct公布wo03/035835描述了一种变体cho细胞系lec13细胞,其具有降低的将岩藻糖连接到asn(297)连接的碳水化合物的能力,从而也引起在该宿主细胞中表达的抗体的低岩藻糖基化(还参见shields等(2002)j.biol.chem.277:26733-26740)。也可以在鸡蛋中产生具有修饰的糖基化谱的抗体,如pct公布wo06/089231中所述。可选地,可以在植物细胞,如浮萍中产生具有修饰的糖基化谱的抗体。用于在植物系统中产生抗体的方法公开于2006年8月11日提交的对应于alston&birdllp代理人案卷号040989/314911的美国专利申请中。pct公布wo99/54342描述了被工程化以表达修饰糖蛋白的糖基转移酶(例如β(1,4)-n-乙酰氨基葡萄糖转移酶iii(gntiii))的细胞系,因此在所述工程化的细胞系中表达的抗体表现出增加的平分型glcnac结构,这使得抗体的adcc活性增加(还参见umana等(1999)nat.biotech.17:176-180)。可选地,可以使用岩藻糖苷酶切割掉抗体的岩藻糖残基;例如,岩藻糖苷酶α-l-岩藻糖苷酶从抗体中去除岩藻糖基残基(tarentino等(1975)biochem.14:5516-23)。
本公开考虑的对本文中的抗体的另一种修饰是聚乙二醇化。可以将抗体进行聚乙二醇化以例如延长抗体的生物(例如血清)半衰期。为了将抗体进行聚乙二醇化,通常在其中使一个或多个peg基团连接到抗体或抗体片段上的条件下,使抗体或其片段与聚乙二醇(peg),如peg的反应性酯或醛衍生物反应。优选的是,经由与反应性peg分子(或类似的反应性水溶性聚合物)进行酰化反应或烷基化反应来进行聚乙二醇化。如本文所用的术语“聚乙二醇”意图涵盖已经用于衍生化其它蛋白质的peg的形式中的任一种,如单(c1-c10)烷氧基聚乙二醇或芳氧基聚乙二醇或聚乙二醇-顺丁烯二酰亚胺。在某些实施方案中,待聚乙二醇化的抗体是无糖基化的抗体。用于将蛋白质进行聚乙二醇化的方法是本领域已知的并且可以应用于本发明的抗体。参见例如epo154316和ep0401384。
抗体物理特性
本发明的抗体可以通过它们的各种物理特性来表征,以检测和/或区分其不同的类别。
例如,抗体可以在轻链可变区或重链可变区中含有一个或多个糖基化位点。这样的糖基化位点由于改变的抗原结合而可能导致抗体的免疫原性增加或抗体的pk改变(marshall等(1972)annurevbiochem41:673-702;gala和morrison(2004)jimmunol172:5489-94;wallick等(1988)jexpmed168:1099-109;spiro(2002)glycobiology12:43r-56r;parekh等(1985)nature316:452-7;mimura等(2000)molimmunol37:697-706)。已知糖基化在含有n-x-s/t序列的基序处发生。在一些情况下,优选具有不含可变区糖基化的抗pd-1抗体。这可以通过选择在可变区中不含所述糖基化基序的抗体或通过使糖基化区内的残基突变来实现。
在一个优选的实施方案中,所述抗体不含天冬酰胺异构位点。天冬酰胺的脱酰胺可能在n-g或d-g序列上发生并且引起异天冬氨酸残基的产生,这将弯结引入到多肽链中并且降低了它的稳定性(异天冬氨酸作用)。
每一种抗体将具有独特的等电点(pi),其一般落入6至9.5的ph值范围内。igg1抗体的pi值通常落入7-9.5的ph值范围内并且igg4抗体的pi值通常落入6-8的ph值范围内。据推测,具有在正常范围之外的pi值的抗体在体内条件下可能具有一些解折叠和不稳定性。因此,优选具有含有落入正常范围内的pi值的抗pd-1抗体。这可以通过选择具有在正常范围内的pi值的抗体或通过使带电荷的表面残基突变来实现。
编码本发明的抗体的核酸分子
在另一个方面,本发明提供了编码本发明的抗体的重链和/或轻链可变区或cdr的核酸分子。所述核酸可以全细胞、细胞裂解物或部分纯化或基本上纯的形式存在。当通过标准技术纯化去除其它细胞组分或其它污染物,例如其它细胞核酸或蛋白质时,核酸是“分离的”或“变成基本上纯的”。本发明的核酸可以是例如dna或rna并且可以含有或可以不含内含子序列。在一个优选的实施方案中,所述核酸是cdna分子。
本发明的核酸可以使用标准的分子生物学技术获得。对于由杂交瘤(例如如下文进一步描述,从携带人类免疫球蛋白基因的转基因小鼠制备的杂交瘤)表达的抗体,编码由杂交瘤制备的抗体的轻链和重链的cdna可以通过标准的pcr扩增或cdna克隆技术获得。对于从免疫球蛋白基因文库中获得的抗体(例如使用噬菌体展示技术),可以从所述基因文库中回收编码这样的抗体的核酸。
本发明的优选的核酸分子包括编码pd-1单克隆抗体的vh和vl或cdr序列的核酸分子。一旦获得了编码vh区段和vl区段的dna片段,就可以通过标准重组dna技术进一步操纵这些dna片段,例如以将可变区基因转化成全长抗体链基因、fab片段基因或scfv基因。在这些操纵中,将编码vl或vh的dna片段与编码另一种蛋白质,如抗体恒定区或柔性接头的另一个dna片段可操作地连接。如本文中所用的术语“可操作地连接”意图意指将两个dna片段连接以使得由这两个dna片段编码的氨基酸序列保持在框内。
可以通过将编码vh的dna与编码重链恒定区(ch1、ch2和ch3)的另一个dna分子可操作地连接来将编码vh区的分离的dna转化成全长重链基因。人类重链恒定区基因的序列是本领域已知的并且涵盖这些区域的dna片段可以通过标准的pcr扩增来获得。重链恒定区可以是igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定区,但是最优选地是igg1或igg4恒定区。对于fab片段重链基因,可以将编码vh的dna与仅编码重链ch1恒定区的另一个dna分子可操作地连接。
可以通过将编码vl的dna与编码轻链恒定区cl的另一个dna分子可操作地连接来将编码vl区的分离的dna转化成全长轻链基因(以及fab轻链基因)。人类轻链恒定区基因的序列是本领域已知的并且涵盖这些区域的dna片段可以通过标准的pcr扩增来获得。在优选的实施方案中,轻链恒定区可以是κ或λ恒定区。
为了产生scfv基因,将编码vh和vl的dna片段与编码柔性接头,例如编码氨基酸序列(gly4-ser)3的另一个片段可操作地连接,以使得vh序列和vl序列可以被表达为连续的单链蛋白,其中vl区和vh区由柔性接头连接(参见例如bird等(1988)science242:423-426;huston等(1988)proc.natl.acad.sci.usa85:5879-5883;mccafferty等(1990)nature348:552-554)。
本发明的单克隆抗体的制备
本发明的单克隆抗体(mab)可以使用kohler和milstein(1975)nature256:495的公知的体细胞杂交(杂交瘤)技术产生。otherembodimentsforproducingmonoclonalantibodiesincludeviraloroncogenictransformationofblymphocytesandphagedisplaytechniques.嵌合抗体或人源化抗体也是本领域公知的.参见例如美国专利号4,816,567;5,225,539;5,530,101;5,585,089;5,693,762和6,180,370,这些文献的内容具体地以引用的方式整体并入本文。
产生本发明的单克隆抗体的转染瘤的产生
本发明的抗体也可以使用例如本领域公知的重组dna技术和基因转染方法的组合在宿主细胞转染瘤中产生(例如morrison,s.(1985)science229:1202)。在一个实施方案中,将通过标准的分子生物学技术获得的编码部分或全长轻链和重链的dna插入一种或多种表达载体中以使得所述基因与转录和翻译调控序列可操作地连接。在本文中,术语“可操作地连接”意图意指将抗体基因连接到载体中以使得所述载体内的转录和翻译控制序列发挥它们的预期的调控抗体基因的转录和翻译的功能。
术语“调控序列”意图包括控制抗体链基因的转录或翻译的启动子、增强子和其它表达控制元件(例如多聚腺苷酸化信号)。这样的调控序列描述于例如goeddel(geneexpressiontechnology(《基因表达技术》):methodsinenzymology(酶学方法)185,加利福尼亚州圣地亚哥的学术出版社(academicpress,sandiego,calif.)(1990))中。用于哺乳动物宿主细胞表达的优选调控序列包括引导哺乳动物细胞中高水平的蛋白质表达的病毒元件,如源自于巨细胞病毒(cmv)、猿猴病毒40(sv40)、腺病毒(例如腺病毒主要晚期启动子(admlp))和多瘤的启动子和/或增强子。可选地,可以使用非病毒调控序列,如泛素启动子或β-球蛋白启动子。更进一步,调控元件由来自不同来源的序列构成,如srα启动子系统,所述srα启动子系统含有来自sv40早期启动子和1型人类t细胞白血病病毒的长末端重复序列的序列(takebe等(1988)mol.cell.biol.8:466-472)。选择与所使用的表达宿主细胞相容的表达载体和表达控制序列。
可以将抗体轻链基因和抗体重链基因插入相同的或单独的表达载体中。在优选的实施方案中,使用可变区以通过将它们插入已经编码所期望的同种型的重链恒定区和轻链恒定区的表达载体中以使得vh区段与所述载体内的一个或多个ch区段可操作地连接并且vl区段与所述载体内的cl区段可操作地连接来产生任何抗体同种型的全长抗体基因。另外地或可选地,重组表达载体可以编码促进抗体链从宿主细胞中分泌的信号肽。可以将抗体链基因克隆到载体中以使得信号肽与抗体链基因的氨基末端在框内连接。所述信号肽可以是免疫球蛋白信号肽或异源信号肽(即来自非免疫球蛋白的信号肽)。
除了抗体链基因和调控序列之外,本发明的重组表达载体还可以携带另外的序列,如调控载体在宿主细胞中的复制的序列(例如复制起点)和选择标记基因。选择标记基因有助于选择其中已经引入了载体的宿主细胞(参见例如美国专利号4,399,216;4,634,665和5,179,017)。例如,通常,选择标记基因向其中已经引入了载体的宿主细胞赋予对药物,如g418、潮霉素或甲氨蝶呤的抗性。优选的选择标记基因包括二氢叶酸还原酶(dhfr)基因(在甲氨蝶呤选择/扩增的情况下用于dhfr-宿主细胞)和neo基因(用于g418选择)。
为了表达轻链和重链,通过标准技术将编码重链和轻链的一种或多种表达载体转染到宿主细胞中。术语“转染”的各种形式意图涵盖通常用于将外源性dna引入到原核或真核宿主细胞中的多种技术,例如电穿孔、磷酸钙沉淀、deae-葡聚糖转染等。尽管在理论上有可能在原核或真核宿主细胞中表达本发明的抗体,但是在真核细胞中,并且最优选地在哺乳动物宿主细胞中表达抗体是最优选的,这是因为这样的真核细胞,特别是哺乳动物细胞比原核细胞更有可能组装和分泌正确折叠并且具有免疫活性的抗体。
用于表达本发明的重组抗体的优选的哺乳动物宿主细胞包括中国仓鼠卵巢(cho细胞)(包括dhfr-cho细胞,描述于urlaub和chasin,(1980)proc.natl.acad.sci.usa77:4216-4220中,与dhfr选择标记一起使用,例如,如r.j.kaufman和p.a.sharp(1982)j.mol.biol.159:601-621中所述)、nso骨髓瘤细胞、cos细胞和sp2细胞。特别是,对于与nso骨髓瘤细胞一起使用,另一种优选的表达系统是wo87/04462、wo89/01036和ep338,841中所公开的gs基因表达系统。当将编码抗体基因的重组表达载体引入哺乳动物宿主细胞中时,通过将所述宿主细胞培养足以允许所述抗体在所述宿主细胞中表达或更优选地,将所述抗体分泌到其中生长了所述宿主细胞的培养基中的时间段来产生所述抗体。可以使用标准的蛋白质纯化方法从培养基中回收抗体。
免疫缀合物
本发明的抗体可以与治疗剂缀合以形成免疫缀合物,如抗体-药物缀合物(adc)。合适的治疗剂包括抗代谢物、烷基化剂、dna小沟结合剂、dna嵌入剂、dna交联剂、组蛋白脱乙酰酶抑制剂、核输出抑制剂、蛋白酶体抑制剂、拓扑异构酶i或ii抑制剂、热激蛋白抑制剂、酪氨酸激酶抑制剂、抗生素和抗有丝分裂剂。在adc中,抗体和治疗剂优选地经由可切割的接头,如肽基、二硫化物或腙接头缀合。更优选的是,所述接头是肽基接头,如val-cit、ala-val、val-ala-val、lys-lys、pro-val-gly-val-val、ala-asn-val、val-leu-lys、ala-ala-asn、cit-cit、val-lys、lys、cit、ser或glu。adc可以如以下文献中所述来制备:美国专利号7,087,600;6,989,452;和7,129,261;pct公布wo02/096910;wo07/038,658;wo07/051,081;wo07/059,404;wo08/083,312;和wo08/103,693;美国专利公布20060024317;20060004081;和20060247295,这些文献的公开内容以引用的方式并入本文。
双特异性分子
在另一个方面,本公开的特征在于双特异性分子,所述双特异性分子包含与至少一种其它功能性分子,例如另一种肽或蛋白质(例如另一种抗体或受体的配体)连接的本发明的一种或多种抗体,以产生与至少两个不同的结合位点或靶分子结合的双特异性分子。因此,如本文所用的“双特异性分子”包括具有三种或更多种特异性的分子。
在一个实施方案中,除了抗fc结合特异性和抗lag-3结合特异性之外,双特异性分子还具有第三特异性。所述第三特异性可以针对抗增强因子(ef),例如与参与细胞毒性活性的表面蛋白结合,从而增加针对靶细胞的免疫应答的分子。例如,抗增强因子可以结合细胞毒性t细胞(例如经由cd2、cd3、cd8、cd28、cd4、cd40或icam-1)或其它免疫细胞,从而引起针对靶细胞的免疫应答增加。
双特异性分子可以具有许多不同的形式和尺寸。在尺寸谱的一端处,双特异性分子保留了传统的抗体形式,不同的是,它不具有具相同特异性的两个结合臂,而是具有各自具有不同特异性的两个结合臂。在另一个极端处是由通过肽链连接的两个单链抗体片段(scfv′s)组成的双特异性分子,即所谓的bs(scfv)2构建体。中等尺寸的双特异性分子包括通过肽基接头连接的两个不同的f(ab)片段。这些和其它形式的双特异性分子可以通过遗传工程化、体细胞杂交或化学方法来制备。参见例如kufer等(上文引用);cao和suresh,bioconjugatechemistry,9(6),635-644(1998);和vanspriel等,immunologytoday,21(8),391-397(2000)以及其中引用的参考文献。
药物组合物
在另一个方面,本公开提供了一种药物组合物,其包含与药学上可接受的载体一起配制的本发明的一种或多种抗体。所述组合物可以任选地含有一种或多种另外的药物活性成分,如另一种抗体或药物。本发明的药物组合物也可以在与例如另一种免疫刺激剂、抗癌剂、抗病毒剂或疫苗的组合疗法中施用,以使抗pd-1抗体增强针对疫苗的免疫应答。
所述药物组合物可以包含任何数量的赋形剂。可以使用的赋形剂包括载体、表面活性剂、增稠剂或乳化剂、固体粘合剂、分散或悬浮助剂、增溶剂、着色剂、调味剂、包衣剂、崩解剂、润滑剂、甜味剂、防腐剂、等渗剂和其组合。合适的赋形剂的选择和使用在gennaro编著,remington:thescienceandpracticeofpharmacy(《雷明顿:药学科学与实践》),第20版(lippincottwilliams&wilkins2003)中教导,其公开内容以引用的方式并入本文。
优选的是,所述药物组合物适用于静脉内、肌内、皮下、肠胃外、脊柱或表皮施用(例如通过注射或输注)。根据施用途径,活性化合物可以被包被在材料中以保护它防止酸和可能使它失活的其它自然条件的作用。如本文所用的短语“肠胃外施用”意指除肠内和局部施用以外的施用方式,通常通过注射,并且包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。可选地,本发明的抗体可以经由非肠胃外途径,如局部、表皮或粘膜施用途径,例如鼻内、口服、经阴道、经直肠、舌下或局部施用。
本发明的药物组合物可以包括药学上可接受的盐。“药学上可接受的盐”是指保留亲本化合物的所需生物活性并且不赋予任何不希望的毒理学作用的盐。这种盐的实例包括酸加成盐和碱加成盐。酸加成盐包括那些来自无毒无机酸的盐,所述无毒无机酸如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、亚磷酸等,以及来自无毒有机酸的盐,所述无毒有机酸如脂族一元和二元羧酸、苯基取代的烷酸、羟基烷酸、芳族酸、脂族和芳族磺酸等。碱加成盐包括那些来自碱土金属的盐,例如钠、钾、镁、钙等,以及来自无毒的有机胺的盐,所述有机胺例如n,n′-二苄基乙二胺、n-甲基葡糖胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、普鲁卡因等。
药物组合物可以呈无菌水溶液或分散液的形式。它们也可以被配制成微乳液、脂质体或适合于高药物浓度的其它有序结构。
可以与载体材料组合以产生单一剂型的活性成分的量将根据所治疗的受试者和特定施用方式而变化,并且一般将是产生治疗作用的组合物的量。一般,在百分之一百中,与药学上可接受的载体组合,该量将在约0.01%至约99%的活性成分,优选地约0.1%至约70%,最优选地约1%至约30%的活性成分的范围内。
调整给药方案以提供最佳的所期望的响应(例如治疗响应)。例如,可以施用单次推注,可以随时间推移施用几次分次剂量或可以按比例减少或增加剂量,如由治疗情况的紧急程度所指示。特别有利的是,将肠胃外组合物配制成剂量单位形式以易于施用和保持剂量均匀。如本文所用的剂量单位形式指的是适合作为单位剂量用于待治疗的受试者的物理上离散的单位;每一个单位含有被计算以与所需的药物载体联合产生所期望的治疗作用的预定量的活性化合物。可选地,抗体可以作为持续释放制剂施用,在这种情况下,需要不太频繁的施用。
对于抗体的施用,剂量在每公斤宿主体重约0.0001mg至100mg,并且更通常每公斤宿主体重0.01mg至5mg的范围内。例如,剂量可以是每公斤体重0.3mg、每公斤体重1mg、每公斤体重3mg、每公斤体重5mg或每公斤体重10mg或在1mg/kg-10mg/kg的范围内。示例性治疗方案需要每周施用一次、每两周施用一次、每三周施用一次、每四周施用一次、每月施用一次、每3个月施用一次或每3个月至6个月施用一次。本发明的抗pd-1抗体的优选的给药方案包括每公斤体重1mg或每公斤体重3mg,经由静脉内施用,其中使用以下给药时间表之一给予所述抗体:(i)每四周一次,持续六次剂量,然后每三个月一次;(ii)每三周一次;(iii)以每公斤体重3mg施用一次,继而以每公斤体重1mg每三周施用一次。在一些方法中,调整剂量以达到约1μg/ml-1000μg/ml的血浆抗体浓度,并且在一些方法中,达到约25μg/ml-300μg/ml的血浆抗体浓度。
“治疗有效剂量”的本发明的抗pd-1抗体优选地引起疾病症状的严重程度降低、无疾病症状期的频率和持续时间增加或预防由于疾病困扰引起的障碍或残疾。例如,对于治疗携带肿瘤的受试者,相对于未经治疗的受试者,“治疗有效剂量”优选地将肿瘤生长抑制至少约20%,更优选地至少约40%,甚至更优选地至少约60%,并且还更优选地至少约80%。治疗有效量的治疗性化合物可以在受试者中减小肿瘤尺寸或以其它方式改善症状,所述受试者通常是人类或可以是另外的哺乳动物。
所述药物组合物可以是受控释放制剂,包括植入物、透皮贴剂和微封装的递送系统。可以使用可生物降解的生物相容性聚合物,如乙烯-乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。参见例如sustainedandcontrolledreleasedrugdeliverysystems(《持续和受控释放药物递送系统》),j.r.robinson编著,纽约的marceldekker公司(marceldekker,inc.,newyork),1978。
治疗组合物可以经由医疗装置施用,如(1)无针皮下注射装置(例如美国专利号5,399,163;5,383,851;5,312,335;5,064,413;4,941,880;4,790,824和4,596,556);(2)微型输注泵(美国专利号4,487,603);(3)透皮装置(美国专利号4,486,194);(4)输注设备(美国专利号4,447,233和4,447,224);以及(5)渗透装置(美国专利号4,439,196和4,475,196);这些文献的公开内容以引用的方式并入本文。
在某些实施方案中,可以配制本发明的人类单克隆抗体以确保在体内的适当分布。例如,为了确保本发明的治疗性抗体穿过血脑屏障,可以将它们在脂质体中配制,所述脂质体可以另外包含靶向部分以增强向特定细胞或器官的选择性转运。参见例如美国专利号4,522,811;5,374,548;5,416,016;和5,399,331;v.v.ranade(1989)j.clin.pharmacol.29:685;umezawa等,(1988)biochem.biophys.res.commun.153:1038;bloeman等(1995)febslett.357:140;m.owais等(1995)antimicrob.agentschemother.39:180;briscoe等(1995)am.j.physiol.1233:134;schreier等(1994)j.biol.chem.269:9090;keinanen和laukkanen(1994)febslett.346:123;以及killion和fidler(1994)immunomethods4:273。
本发明的用途和方法
本发明的抗体(组合物、双特异性分子和免疫缀合物)具有许多体外和体内效用,包括例如通过阻断pd-1来增强免疫应答。这样的抗体可以在体外或离体向培养中的细胞施用,或例如在体内向人类受试者施用,以在多种情况下增强免疫力。因此,在一个方面,本发明提供了一种在受试者中调节免疫应答的方法,所述方法包括向所述受试者施用本发明的抗体或其抗原结合部分,以使得调节所述受试者中的免疫应答。优选的是,增强、刺激或上调所述应答。
优选的受试者包括需要增强免疫应答的人类患者。所述方法特别适用于治疗患有可以通过增强免疫应答(例如t细胞介导的免疫应答)来治疗的病症的人类患者。在一个特定的实施方案中,所述方法特别适用于体内治疗癌症。为了实现抗原特异性免疫力增强,可以将抗pd-1抗体与所关注的抗原一起施用或所述抗原可能已经存在于待治疗的受试者(例如携带肿瘤或携带病毒的受试者)体内。当将针对pd-1的抗体与另一种药剂一起施用时,这两者可以按任何一种顺序或同时施用。
鉴于本发明的抗pd-1抗体抑制pd-1与pd-l1/pd-l2结合和刺激抗原特异性t细胞应答的能力,本发明还提供了使用所述抗体刺激、增强或上调抗原特异性t细胞应答的体外和体内方法。例如,本发明提供了一种刺激抗原特异性t细胞应答的方法,所述方法包括使所述t细胞与本发明的抗体接触,从而刺激抗原特异性t细胞应答。可以使用抗原特异性t细胞应答的任何合适的指标来测量抗原特异性t细胞应答。
这样的合适的指标的非限制性实例包括在所述抗体存在下t细胞增殖增加和/或在所述抗体存在下细胞因子的产生增加。在一个优选的实施方案中,刺激了抗原特异性t细胞产生白细胞介素-2。
本发明还提供了用于在受试者中刺激免疫应答(例如抗原特异性t细胞应答)的方法,所述方法包括向所述受试者施用本发明的抗体,从而刺激所述受试者中的免疫应答(例如抗原特异性t细胞应答)。在一个优选的实施方案中,所述受试者是携带肿瘤的受试者并且刺激了针对所述肿瘤的免疫应答。在另一个优选的实施方案中,所述受试者是携带病毒的受试者并且刺激了针对所述病毒的免疫应答。
在另一个实施方案中,本发明提供了用于在受试者中抑制肿瘤细胞生长的方法,所述方法包括向所述受试者施用本发明的抗体,从而在所述受试者中抑制所述肿瘤的生长。在又一个实施方案中,本发明提供了用于在受试者中治疗病毒感染的方法,所述方法包括向所述受试者施用本发明的抗体,从而在所述受试者中治疗所述病毒感染。
本发明的这些和其它方法更详细地论述于下文中。
癌症
抗体对pd-1的阻断可以增强患者对癌细胞的免疫应答。在一个方面,本发明涉及使用抗pd-1抗体在体内治疗受试者,从而抑制癌性肿瘤的生长。抗pd-1抗体可以单独用于抑制癌性肿瘤的生长。可选地,抗pd-1抗体可以与其它免疫原性剂、标准癌症治疗或其它抗体结合使用,如下文所述。
因此,在一个实施方案中,本发明提供了一种在受试者中抑制肿瘤细胞生长的方法,所述方法包括向所述受试者施用治疗有效量的抗pd-1抗体或其抗原结合部分。优选的是,所述抗体可以是嵌合或人源化的抗pd-1抗体。
可以使用本发明的抗体抑制其生长的优选癌症包括通常对免疫治疗有响应的癌症。用于治疗的优选的癌症的非限制性实例包括肺癌、淋巴瘤、间皮瘤、黑色素瘤和肾细胞癌。此外,本发明还包括可以使用本发明的抗体抑制其生长的难治性或复发性恶性肿瘤。
可以使用本发明的方法治疗的其它癌症的实例包括骨癌、胰腺癌、皮肤癌、头部或颈部癌、皮肤或眼内恶性黑色素瘤、子宫癌、卵巢癌、直肠癌、肛区癌、胃癌、睾丸癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金氏病(hodgkin′sdisease)、非霍奇金氏淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、慢性或急性白血病,包括急性骨髓性白血病、慢性骨髓性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病;儿童实体肿瘤、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤(kaposi′ssarcoma)、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱发的癌症,包括石棉诱发的癌症,以及所述癌症的组合。本发明还可用于治疗转移性癌症,特别是表达pd-l1的转移性癌症(iwai等(2005)int.immunol.17:133-144)。
任选地,针对pd-1的抗体可以与免疫原性剂组合,如癌细胞、纯化的肿瘤抗原(包括重组蛋白、肽和碳水化合物分子)、细胞和被编码免疫刺激性细胞因子的基因转染的细胞(he等(2004)j.immunol.173:4919-28)。可以使用的肿瘤疫苗的非限制性实例包括黑色素瘤抗原的肽,如gp100、mage抗原、trp-2、mart1和/或酪氨酸酶的肽,或被转染以表达细胞因子gm-csf的肿瘤细胞。
pd-1阻断在与疫苗接种方案组合时可能更有效。已经设计了针对肿瘤进行疫苗接种的许多实验策略(参见rosenberg,s.,2000,developmentofcancervaccines(癌症疫苗的开发),ascoeducationalbookspring(《asco教育文集春季版》):60-62;logothetis,c.,2000,ascoeducationalbookspring(《asco教育文集春季版》):300-302;khayat,d.2000,ascoeducationalbookspring(《asco教育文集春季版》):414-428;foon,k.2000,ascoeducationalbookspring(《asco教育文集春季版》):730-738;还参见restifo,n.和sznol,m.,cancervaccines(癌症疫苗),第61章,第3023-3043页,devita等(编著),1997,cancer:principlesandpracticeofoncology(《癌症:肿瘤学原理与实践》),第五版)。在这些策略之一中,使用自体或同种异体肿瘤细胞制备疫苗。已经证实当将肿瘤细胞进行转导以表达gm-csf时,这些细胞疫苗是最有效的。已经证实gm-csf是用于肿瘤疫苗接种的抗原提呈的有效激活因子(dranoff等(1993)proc.natl.acad.sci.u.s.a.90:3539-43)。
对各种肿瘤中基因表达和大规模基因表达谱的研究已经引起了对所谓的肿瘤特异性抗原的定义(rosenberg,sa(1999)immunity10:281-7)。在许多情况下,这些肿瘤特异性抗原是在肿瘤和产生肿瘤的细胞中表达的分化抗原,例如黑色素细胞抗原gp100、mage抗原和trp-2。更重要的是,这些抗原中有许多可以被证实是在宿主中发现的肿瘤特异性t细胞的靶标。pd-1阻断可以与在肿瘤中表达的重组蛋白和/或肽的集合结合使用以产生针对这些蛋白的免疫应答。这些蛋白通常被免疫系统视为自身抗原并且因此对它们具有耐受性。肿瘤抗原可以包括蛋白质端粒酶,其为染色体的端粒合成所需并且在超过85%的人类癌症中表达而仅在有限数量的体细胞组织中表达(kim等(1994)science266:2011-2013)。可以通过各种手段保护这些体细胞组织免受免疫攻击。肿瘤抗原也可以是由于改变蛋白质序列或在两个无关序列之间产生融合蛋白的体细胞突变(即费城染色体中的bcr-abl)而在癌细胞中表达的“新抗原”或来自b细胞肿瘤的独特型。
其它肿瘤疫苗可以包括来自牵涉到人类癌症的病毒的蛋白质,如人类乳头瘤病毒(hpv)、肝炎病毒(hbv和hcv)以及卡波西疱疹肉瘤病毒(khsv)。可以与pd-1阻断结合使用的另一种形式的肿瘤特异性抗原是从肿瘤组织本身中分离的纯化的热激蛋白(hsp)。这些热激蛋白含有来自肿瘤细胞的蛋白质的片段并且这些hsp在向抗原提呈细胞递送以引发肿瘤免疫方面是非常有效的(suot和srivastava(1995)science269:1585-1588;tamura等(1997)science278:117-120)。
树突状细胞(dc)是可以用于引发抗原特异性应答的有效的抗原提呈细胞。dc可以离体产生并且负载各种蛋白质和肽抗原以及肿瘤细胞提取物(nestle等(1998)naturemedicine4:328-332)。也可以通过遗传手段将dc进行转导以使其也表达这些肿瘤抗原。为了免疫接种的目的,也已经将dc与肿瘤细胞直接融合(kugler等(2000)naturemedicine6:332-336)。作为疫苗接种的方法,dc免疫接种可以与pd-1阻断有效组合以激活更有效的抗肿瘤应答。
pd-1阻断也可以与标准癌症治疗组合。pd-1阻断可以与化疗方案有效组合。在这些情况下,有可能减少所施用的化疗试剂的剂量(mokyr等(1998)cancerresearch58:5301-5304)。这样的组合的实例是抗pd-1抗体与氨烯咪胺(decarbazine)组合用于治疗黑色素瘤。这样的组合的另一个实例是抗pd-1抗体与白细胞介素-2(il-2)组合用于治疗黑色素瘤。pd-1阻断和化疗的组合使用的科学依据是,作为大多数化疗化合物的细胞毒性作用的结果的细胞死亡应当引起抗原提呈途径中肿瘤抗原的水平升高。可以通过细胞死亡与pd-1阻断产生协同效应的其它组合治疗是放疗、手术和激素剥夺。这些方案中的每一个都在宿主中产生肿瘤抗原的来源。血管生成抑制剂也可以与pd-1阻断组合。抑制血管生成会引起肿瘤细胞死亡,这可以将肿瘤抗原供给到宿主抗原提呈途径中。
肿瘤通过多种机制逃避宿主免疫监视。这些机制中有许多可以通过使由肿瘤表达并且具有免疫抑制性的蛋白质失活来克服。这些尤其包括tgf-β(kehrl等(1986)j.exp.med.163:1037-1050)、il-10(howard和o′garra(1992)immunologytoday13:198-200)和fas配体(hahne等(1996)science274:1363-1365)。针对这些实体中的每一种的抗体可以与抗pd-1组合使用以抵消免疫抑制因子的作用并且促进宿主的肿瘤免疫应答。
激活宿主免疫应答的其它抗体可以与抗pd-1组合使用。这些包括树突状细胞的表面上的激活dc功能和抗原提呈的分子。抗cd40抗体能够有效地替代辅助t细胞活性(ridge等(1998)nature393:474-478)并且可以与pd-1抗体结合使用(ito等(2000)immunobiology201(5)527-40)。针对t细胞共刺激分子的激活抗体也可以提供升高水平的t细胞激活,所述t细胞共刺激分子诸如ctla-4(例如美国专利号5,811,097)、ox-40(weinberg等(2000)immunol164:2160-2169)、4-1bb(melero等(1997)naturemedicine3:682-685(1997))和icos(hutloff等(1999)nature397:262-266)。
还有几种实验性治疗方案,其涉及抗原特异性t细胞的离体激活和扩增以及将这些细胞过继转移到受者体内以刺激针对肿瘤的抗原特异性t细胞(greenberg和riddell(1999)science285:546-51)。这些方法也可以用于激活针对感染因子,如cmv的t细胞应答。在抗pd-1抗体存在下离体激活可以增加过继转移的t细胞的出现率和活性。
感染性疾病
本发明的其它方法用于治疗已经暴露于特定毒素或病原体的患者。因此,本发明的另一个方面提供了一种在受试者中治疗感染性疾病的方法,所述方法包括向所述受试者施用抗pd-1抗体或其抗原结合部分,从而针对所述感染性疾病对所述受试者进行治疗。优选地,抗体是嵌合抗体、人源化抗体或人抗体。
与如上所述的其对肿瘤的应用类似,抗体介导的pd-1阻断可以单独使用,或作为佐剂与疫苗组合使用,以刺激对病原体、毒素和自身抗原的免疫应答。这种治疗方法可能特别有用的病原体的实例包括目前没有有效疫苗的病原体,或常规疫苗不完全有效的病原体。这些包括但不限于hiv、肝炎(a、b和c)、流感、疱疹、贾第虫、疟疾、利什曼虫、金黄色葡萄球菌、铜绿假单胞菌。
组合治疗
在另一个方面,本发明提供了组合治疗方法,其中将本发明的抗pd-1抗体(或其抗原结合部分)与有效刺激免疫应答的一种或多种另外的抗体共同施用,从而进一步增强、刺激或上调受试者中的免疫应答。在一个实施方案中,本发明提供了一种用于在受试者中刺激免疫应答的方法,所述方法包括向所述受试者施用抗pd-1抗体和一种或多种另外的免疫刺激抗体,如抗lag-3抗体、抗pd-l1抗体和/或抗ctla-4抗体,从而在所述受试者中刺激免疫应答,例如以抑制肿瘤生长或刺激抗病毒应答。
在另一个实施方案中,本发明提供了治疗过度增殖性疾病(例如癌症)的方法,包括给予受试者抗pd-1抗体和一种或多种另外的免疫刺激性抗体,例如抗lag-3抗体、抗pd-l1抗体和/或抗ctla-4抗体,从而抑制肿瘤生长。
通过抗体阻断pd-1和一种或多种第二靶抗原如ctla-4和/或lag-3和/或pd-l1可增强患者中对癌细胞的免疫应答。使用本公开的抗体可以抑制其生长的癌症包括通常对免疫疗法有反应的癌症。用本公开内容的联合疗法治疗的癌症的代表性实例包括上文在讨论用抗pd-1抗体的单一疗法中具体列出的那些癌症。
在某些实施方案中,本文讨论的治疗性抗体的组合可以作为在药学上可接受的载体中的单一组合物同时施用,或作为在药学上可接受的载体中具有每种抗体的单独组合物同时施用。在另一个实施方案中,治疗性抗体的组合可以顺序施用。
此外,如果连续施用多于一个剂量的组合疗法,则在施用的每个时间点,连续施用的顺序可以颠倒或保持相同的顺序,连续施用可以与同时施用组合,或其任何组合。
组合pd-1和ctla-4和/或lag-3和/或pd-l1阻断也可进一步与标准癌症治疗联合。例如,联合pd-1和ctla-4和/或lag-3和/或pd-l1阻断可与化疗方案有效组合。在这些情况下,可以减少与本公开的组合一起施用的其它化疗试剂的剂量(mokyr等人(1998)cancerresearch58:5301-5304)。
在另一个实例中,抗pd-1和抗ctla-4抗体和/或抗lag-3抗体和/或抗pd-l1抗体的组合可以与抗肿瘤抗体结合使用,如rituxantm(利妥昔单抗(rituximab))、herceptintm(曲妥珠单抗(trastuzumab))、bexxartm(托西莫单抗(tositumomab))、zevalintm(异贝莫单抗(ibritumomab))、campathtm(阿仑单抗(alemtuzumab))、lymphocidetm(依帕妥珠单抗(eprtuzumab))、avastintm(贝伐单抗(bevacizumab))和tarcevatm(埃罗替尼(erlotinib))等。举例来说并且不希望受理论所束缚,使用抗癌抗体或与毒素缀合的抗癌抗体进行治疗可以引起癌细胞死亡(例如肿瘤细胞),这将增强由ctla-4、lag-3、pd-l1或pd-1介导的免疫应答。在一个示例性实施方案中,过度增殖性疾病(例如癌性肿瘤)的治疗可以包括抗癌抗体与抗pd-1和抗ctla-4和/或抗lag3和/或抗pd-l1抗体的组合,它们同时施用或依次施用或以其任何组合施用,这可以增强宿主的抗肿瘤免疫应答。
肿瘤通过多种机制逃避宿主免疫监视。这些机制中有许多可以通过使由肿瘤表达并且具有免疫抑制性的蛋白质失活来克服。这些尤其包括tgf-β(kehrl等(1986)j.exp.med.163:1037-1050)、il-10(howard和o′garra(1992)immunologytoday13:198-200)和fas配体(hahne等(1996)science274:1363-1365)。在另一个实例中,针对这些实体中的每一种的抗体可以进一步与抗pd-1和抗ctla-4和/或抗lag3和/或抗pd-l1抗体组合结合以抵消免疫抑制因子的作用并且促进宿主的抗肿瘤免疫应答。
可以用于激活宿主免疫应答的其它抗体可以进一步与抗pd-1和抗ctla-4和/或抗lag-3和/或抗pd-l1抗体组合结合使用。这些包括树突状细胞的表面上的激活dc功能和抗原提呈的分子。抗cd40抗体(ridge等(同上))可以与抗pd-1和抗ctla-4和/或抗lag-3和/或抗pd-l1组合结合使用(ito等(同上))。针对t细胞共刺激分子的其它激活抗体(weinberg等(同上);melero等(同上);hutloff等(同上))也可以提供升高水平的t细胞激活。
几种实验性治疗方案涉及抗原特异性t细胞的离体激活和扩增以及将这些细胞过继转移到受者体内以刺激针对肿瘤的抗原特异性t细胞(greenberg和riddell(同上))。这些方法也可以用于激活针对感染因子,如cmv的t细胞应答。在抗pd-1和抗ctla-4和/或抗lag-3和/或抗pd-l1抗体存在下离体激活预期可以增加过继转移的t细胞的出现率和活性。
通过以下实施例进一步说明本公开,所述实施例不应当被解释为构成进一步的限制。在整个本申请中所引用的所有附图和所有参考文献、基因库(genbank)序列、专利和公开的专利申请的内容明确地以引用的方式并入本文。
实施例
实施例1噬菌体淘选、筛选和亲和力成熟
噬菌体文库
通过克隆轻链可变区(vl)和重链可变区(vh)的库来产生抗体单链噬菌体展示文库。通过pcr扩增从主要收集自外周血的人淋巴细胞产生重链和轻链库。将vl库和vh库混合,并用重叠引物进行pcr。抗体的最终形式是具有通过柔性接头肽(ggggsggggsggggs(seqidno:60))连接的vh和vl片段的单链fv(scfv)。
针对人pd-1的噬菌体文库淘选
在immuno96microwell板(nunc,denmark)上进行展示特异性scfv片段的噬菌体颗粒的选择。首先,将50μg/ml磷酸缓冲盐溶液(pbs)中的pd-1重组蛋白(acrobiosystems,货号pd1-h5221)包被于板上,在4℃过夜,然后用pbs(2%mpbs)中的2%(w/v)奶粉封闭,加入含有约1011噬菌体颗粒的文库,并将板于室温(rt,25-28℃)温育2小时。通过用含有0.1%tween20的pbs(pbs-t)洗涤平板10-20次,然后用pbs洗涤10-20次,除去未结合的噬菌体。通过与50μl的1μg/μl胰蛋白酶温育10分钟,然后与50μl50mm甘氨酸-hclph2.0(10分钟后立即用50μl的200mmna2hpo4,ph7.5中和)温育,洗脱结合的噬菌体。进行四轮淘选。
噬菌体筛选
从第三和第四轮淘选中,挑选噬菌体并测试其与人pd-1的结合。具体地,将人pd-1(acrobiosystems,货号pd1-h5221)以0.1μg/ml包被在96孔板上,将单克隆噬菌体加入到板中。然后,洗去未结合的噬菌体,用抗m13第二抗体(abcam,货号ab50370)检测结合的噬菌体。
对elisa阳性克隆测序,从中鉴定了5个独特序列,包括克隆21f12、16b2、16c1、19e11和45e2。抗pd-1抗体21f12的重/轻链可变区的氨基酸序列id号显示于上表1中。
亲和力成熟
为了提高来自克隆21f12的抗体的结合亲和力,构建了hcdr1和hcdr3的两个噬菌体文库用于淘选。在3轮淘选后,通过elisa筛选测试变体与人pd-1(acrobiosystems,货号pd1-h5221)的阳性结合。阳性变体的解离速率等级通过octetred96(fortebio)确定。挑取解离速率提高的克隆,并转化为全长igg用于分析。变体抗pd-1抗体21f12-1b12、21f12-1e11、21f12-2e1、21f12-2h7、21f12-1c4、21f12-1e10、21f12-1f6和21f12-3g1的重链/轻链的氨基酸序列id号也总结于上表1中。
将编码每种抗pd-1抗体的重链和轻链的核苷酸序列插入表达载体pcdna3.1(invitrogen),其中抗体包含具有seqidno:18所示的突变igg1恒定区,和具有seqidno:20所示的氨基酸序列的轻链恒定区。根据制造商的说明书,使用expichotm表达系统(thermofisher)将载体共转染到cho-s细胞中。将转染的细胞在expichotm表达培养基中培养12天,然后收获培养上清液,并用蛋白a亲和层析(gehealthcare)纯化。
实施例2:抗pd-1单克隆抗体的物理和化学特性
在尺寸排阻色谱中测试来自克隆21f12的抗体。特别地,使用100mm磷酸钠+100mmna2so4,ph7.0作为运行缓冲液将20μg样品注射到tskg3000swxl柱上。运行时间为29分钟。所有测量均在agilent1220hplc上进行。使用openlab软件分析数据。
如图1所示,抗体21f12的主峰在sec中超过95%,提示纯化抗体的高纯度和完整性。
实施例3:结合人pd-1的抗pd-1抗体
进行elisa测定以确定抗体对人pd-1的相对结合能力。
通过在4℃,25ng/孔下温育过夜,将人pd-1蛋白(sinobiologicalinc,货号10377-h08h-100)固定在96孔板上。然后通过与1%bsa的pbs溶液在37℃温育一小时来封闭板。封闭后,用pbst(含0.05%tween20的pbs)洗涤平板三次。在结合缓冲液(含有0.05%tween20和0.5%bsa的pbs)中制备系列稀释的抗pd-1抗体(含有seqidno:18的突变igg1恒定区)或人igg对照(根据us20190016800a1制备,使用seqidno:61和62中所示的重链和轻链氨基酸序列),并与固定的蛋白质在37℃下温育一小时。结合后,用pbst洗涤平板三次,在37℃下与在结合缓冲液中稀释1/20,000的过氧化物酶标记的山羊抗人f(ab′)2抗体(jacksonimmunoresearch,货号109-035-097),再次洗涤,用tmb(thermofisher货号34028)显色15分钟,然后用1mh2so4终止。每个步骤每个板孔包含50μl的溶液。
测定450nm-620nm的吸光度。抗体与人pd-1结合的ec50值和结合曲线示于图2a至2d中,表明本发明的抗pd-1抗体特异性结合人pd-1。
实施例4:结合至人和食蟹猴pd-1的抗pd-1抗体
进行elisa测定以确定抗体对重组人、食蟹猴和小鼠pd-1的相对结合活性。
通过在4℃,25ng/孔过夜温育,将人pd-1蛋白(sinobiologicalinc.,cat#10377-h08h-100),食蟹猴pd-1蛋白(acrobiosystems,货号pd1-c5223),或小鼠pd-1蛋白(sinobiologicalinc.,货号50124-m08h)固定在96孔板上。然后通过与1%bsa的pbs溶液在37℃温育一小时来封闭平板。封闭后,用pbst(含0.05%tween20的pbs)洗涤平板三次。在结合缓冲液(含有0.05%tween20和0.5%bsa的pbs)中制备系列稀释的nivolumab类似物(用作阳性对照,使用seqidno:63和64中列出的重链和轻链氨基酸序列制备)、抗pd-1抗体21f12-1f6(含有seqidno:18的突变体igg1恒定区)、人igg对照(如实施例3中制备),并与固定的蛋白质在37℃下温育一小时。结合后,用pbst洗涤平板三次,在37℃下与在结合缓冲液中稀释1/20,000的过氧化物酶标记的山羊抗人f(ab′)2抗体(jacksonimmunoresearch,货号109-035-097)温育、再次洗涤、用tmb(thermofisher货号34028)显色15分钟,然后用1mh2so4终止。在每个步骤中每个板孔含有50μl溶液。
测定450nm-620nm的吸光度。抗体与人pd-1、食蟹猴pd-1或小鼠pd-1结合的ec50值和结合曲线显示于图3a至3c。数据表明,抗pd-1抗体21f12-1f6特异性结合人和猴pd-1,但不结合小鼠pd-1。尤其是,抗体21f12-1f6结合猴pd-1,与nivolumab类似物相比具有较低的ec50值。
实施例5:抗pd-1抗体对人和食蟹猴pd-1蛋白的结合亲和力
使用biacorex100系统(biacore,gehealthcare),通过表面等离子体共振(spr),测量抗体21f12-1f6对人pd-1和食蟹猴pd-1的动力学结合活性。
简言之,将50μg/ml固定缓冲液(10mm乙酸钠,ph4.5)中的山羊抗人fcγ(jacksonimmuno货号109-005-098)注射到流动池中,产生8008.5ru的固定化水平。将抗pd-1抗体21f12-1f6(具有seqidno:18的突变igg1恒恒定区)与运行缓冲液(hbs-ep+缓冲液)以5μl/分钟的流速注入流动池中。用运行缓冲液稀释制备不同浓度的人pd-1-his蛋白(acrobiossystems,货号pd1-h5221),浓度范围为12.5nm-200nm。以30μl/min的流速注射各浓度的人pd-1蛋白,结合期为120s,随后解离500s。在每个循环后,通过以30μl/min的流速注射10mm甘氨酸-hcl(ph1.5)30s来再生cm5芯片表面,背景扣除结合传感图用于分析结合速率ka和解离速率kd,并相应地计算平衡解离常数kd。使用biacorex100评价软件,将所得数据组与1∶1的langmuir结合模型拟合。
对于猴pd-1结合,将50μg/ml在固定缓冲液(10mm乙酸钠,ph4.5)中的山羊抗人fcγ(jacksonimmunocatalogtm#109-005-098)注射到流动池中,产生7807.1ru的固定化水平。将含有运行缓冲液(hbs-ep+缓冲液)的抗pd-1抗体21f12-1f6以5μl/min的流速注入流动池中。用运行缓冲液稀释制备不同浓度的食蟹猴pd-1-his蛋白(acrobiossystems,货号pd1-c5223),浓度范围为12.5nm至200nm。将各浓度的食蟹猴pd-1蛋白以30μl/min的流速注射至流动池中,进行120s的结合期,然后进行500s解离。在每个循环后,通过以30μl/min的流速注射10mm甘氨酸-hcl(ph1.5)30s来再生cm5芯片表面。背景扣除结合传感图用于分析结合速率ka和解离速率kd,并相应地计算平衡解离常数kd。使用biacorex100评价软件,将所得数据组与1∶1的langmuir结合模型拟合。
下表2总结了抗pd-1抗体21f12-1f6对人pd-1蛋白和食蟹猴pd-1蛋白的结合亲和力。
表2.抗pd-1抗体对人pd-1蛋白和食蟹猴pd-1蛋白的结合亲和力
实施例6:抗pd-1抗体不与人icos、人cd28、人ctla-4或人btla交叉反应
elisa测定用于测定抗pd-1抗体与重组人icos、人cd28、人ctla4和人btla的结合活性。
通过在4℃,25ng/孔过夜温育,将人icos(acrobiossystems,货号ics-h5250)、人cd28(acrobiossystems,货号11524-h02h)、人ctla-4(acrobiossystems,货号ct4-h5229)或人btla(acrobiossystems,货号bta-h52e0)固定在96孔板上。然后通过与1%bsa的pbs溶液在37℃温育一小时来封闭平板。封闭后,用pbst(含0.05%tween20的pbs)洗涤平板三次。在结合缓冲液(含有0.05%tween20和0.5%bsa的pbs)中制备系列稀释的nivolumab类似物(如实施例4中制备)、21f12-1f6(含有seqidno:18的突变体igg1恒定区)和人igg对照(如实施例3中制备),并与固定的蛋白质在37℃下温育一小时。结合后,用pbst洗涤平板三次,在37℃下与在结合缓冲液中稀释1/20,000的过氧化物酶标记的山羊抗人f(ab′)2抗体(jacksonimmunoresearch,货号109-035-097)温育1小时,再次洗涤,用tmb(thermofisher货号34028)显色15分钟,然后用1mh2so4终止。在每个步骤中每个板孔含有50μl溶液。
测定450nm-620nm的吸光度。抗体与人icos、人cd28、人ctla4和人btla结合的代表性结合曲线分别示于图4a至4d中。数据显示抗pd-1抗体21f12-1f6未与所测试的蛋白质结合。
实施例7抗pd1抗体阻断pd-1与pd-l1或pd-l2的相互作用
为了评估抗pd-1抗体抑制人pd-1结合人pd-l1或pd-l2的能力,进行elisa阻断测定。
通过在4℃,25ng/孔下温育过夜将人pd-1(在leadbiolabs中制备,seqidno:66中列出的np_005009.2的氨基酸序列)固定到96孔板上。通过与1%bsa的pbs溶液在37℃温育一小时来封闭非特异性结合位点。封闭后,用pbst(含0.05%tween20的pbs)洗涤平板三次。在结合缓冲液(含有0.05%tween20和0.5%bsa的pbs)中制备系列稀释的nivolumab类似物(如实施例4中制备)、抗pd-121f12抗体(均具有seqidno:18的突变igg1恒定区)和人igg对照(如实施例3中制备),并与以0.8μg/ml相同体积制备的人pd-l1-小鼠fc-标签(在leadbiolabs中制备,氨基酸序列如seqidno:65所示)混合,然后将获得的混合物与固定的蛋白质在37℃下温育一小时。之后,用pbst洗涤平板三次,在37℃下与在结合缓冲液中1/10,000稀释的过氧化物酶标记的山羊抗小鼠fcigg(jacksonimmunoresearch,货号115-035-164)温育一小时,再次洗涤,用tmb(thermofisher货号34028)显色15分钟,然后用1mh2so4终止。在每个步骤中每个板孔含有50μl溶液。
测定450nm-620nm的吸光度。这些抗体的代表性结合曲线和ic50值示于图5a至5e。结果表明本发明的抗pd-1抗体阻断人pd1和pd-l1之间的相互作用。
类似地,通过在4℃下温育过夜,将100ng/孔的人pd-1(在leadsobiolabs中制备,氨基酸序列如seqidno:66中所示)固定到96孔板上。通过与1%bsa的pbs溶液在37℃温育一小时来封闭非特异性结合位点。封闭后,用pbst(含0.05%tween20的pbs)洗涤平板三次。在结合缓冲液(含有0.05%tween20和0.5%bsa的pbs)中制备系列稀释的nivolumab类似物(如实施例4中制备的)、21f12-1f6(含有seqidno:18的突变体igg1恒定区)和人igg对照(如实施例3中制备的),并与以0.8μg/ml相同体积制备的人pd-l2-his-标记(sinobiological公司,货号10292-h08h)混合,然后将获得的混合物与固定化的蛋白质在37℃下温育一小时。之后,用pbst洗涤平板三次,在37℃下与在结合缓冲液中1/5,000稀释的过氧化物酶标记的小鼠抗his-标签抗体(genscript,目录#a00612)温育一小时,再次洗涤,用tmb(thermofisher目录#34028)显色15分钟,然后用1mh2so4终止。每个板孔在每个步骤中含有50μl溶液。
测定450nm-620nm的吸光度。这些抗体的代表性结合曲线和ic50值示于图5f。结果表明抗体21f12-1f6阻断了人pd-1和pd-l2之间的相互作用。
实施例8:抗pd-1抗体结合cho-k1-pd-1细胞表达的细胞表面pd-1
测试抗pd-1抗体与在cho-k1细胞上稳定表达的人pd-1结合的能力。
在37℃下,在含有5%co2的湿润培养箱中,在含有10%fbs的f-12k培养基中,将中国仓鼠卵巢上皮cho-k1细胞系(atcc,货号ccl-61)维持包含10%fbs的f-12k培养基中。用聚乙烯亚胺(mw25k,23966-2,polyscience)将编码seqidno:66的人pd-1的核酸序列转染到cho-k1细胞,有限稀释获得稳定表达人pd-1的克隆。
将系列稀释的抗pd-1抗体加入50μl上述制备的10000个cho-k1细胞中。将获得的混合物在4℃温育30分钟,然后用pbs缓冲液洗涤细胞两次。使用pbs缓冲液中的pe标记的驴抗人igg(jacksonimmunoresearch货号109-116-098)第二试剂(1∶100)通过将第二试剂与混合物在4℃下温育30分钟,然后洗涤两次来检测结合。之后,将细胞重悬于pbs缓冲液中。人pd-1结合的分析用bdaccuric5流式细胞仪(bdbioseience)进行。这些抗体的代表性结合曲线和ec50值示于图6a和6b。
结果表明,本发明的抗pd-1抗体(具有seqidno:18的突变igg1恒定区)和nivolumab类似物,与在cho-k1细胞上稳定表达的人pd-1特异性结合,具有相似的ec50值。
实施例9:抗pd-1抗体结合由受刺激的pbmc表达的细胞表面pd-1
测试抗pd-1抗体与在刺激的pbmc上表达的人pd-1和食蟹猴pd-1结合的能力。
通过密度梯度离心从外周血中分离人和食蟹猴pbmc。3*106个人pbmc用pbs(hyclone,货号sh3025601)中稀释的5μg/ml浓度的包被抗cd3(biogems,货号05121-25-500)抗体预刺激24小时。3*106个食蟹猴pbmc用浓度为20ng/ml的seb(toxintech,货号bt202)预刺激2天。将系列稀释的nivolumab类似物(如实施例4中制备的)和21f12-1f6(具有seqidno:18的突变igg1恒定区)分别加入100,000个人pbmc或100,000个食蟹猴pbmc中。将混合物在4℃下温育30分钟,然后用pbs(hyclone,货号sh3025601)洗涤细胞两次。根据制造商的说明书,将细胞与pe标记的山羊抗人igg(jacksonimmunoresearch,货号:109-116-098)第二试剂在4℃下温育30分钟,然后洗涤两次。之后,将细胞重悬于pbs缓冲液中。pd-1结合的分析用bdaccuric5流式细胞仪(bdbioscience)进行。这些抗体的代表性结合曲线和ec50值示于图7a和7b。
结果表明,两种抗pd-1抗体,21f12-1f6和nivolumab类似物,都可以特异性结合在人和食蟹猴刺激的pbmc上表达的pd-1,其中与nivolumab类似物相比,抗体21f12-1f6结合猴pd-1的ec50值较低。
实施例10抗pd-1抗体诱导人t细胞释放il-2和ifnγ
在seb刺激后,对人pbmc评价抗pd-1抗体的功能活性。
通过密度梯度离心从健康供体的外周血中分离人pbmc。肝素化的血液用两倍体积的pbs稀释,稀释的血液在sepmate-50(stemcell,货号86450)试管中分层。在室温下1200g离心10分钟后,收获含有淋巴细胞的级分,用pbs洗涤,重悬于由10%dmso(sigma,货号d2650)和90%fbs(gibco,货号10099141)组成的冷冻培养基中,然后储存于液氮中。7.5*106个人pbmc用浓度为20ng/ml的seb(toxintech,货号bt202)刺激24小时。将100,000个获得的细胞接种在96孔板的每个孔中的完全rpmi1640(gibco,货号22400089)中。将系列稀释的nivolumab类似物(如实施例4中制备的)、21f12-1f6(具有seqidno:18的突变igg1恒定区)和人igg对照(biolegen,货号qa16a15)分别加入培养基中。添加seb,使终浓度为20ng/ml,获得的混合物在37℃下温育2天,收集培养上清,使用人il2elisa试剂盒(r&d,货号dy202)和人ifn-γelisa试剂盒(r&d,货号dy285b),按照厂商说明书,通过elisa检测il-2和ifn-γ。
il-2水平示于图8a,而ifnγ水平示于图8b。
结果表明,与nivolumab类似物或igg对照的处理相比,用21f12-1f6处理,刺激的人pbmc释放更高水平的il2和ifnγ。
实施例11:抗pd-1抗体诱导jurkat-nfat-pd1报告基因发光
抗pd-1抗体的活性通过jurkat-nfat-pd-1报告基因测定进行评估。
当将jurkat-nfat-pd1效应细胞与cho-pdl1/cd3靶细胞共培养时,tcr-nfat介导的发光被pd-1-pd-l1相互作用抑制。在向细胞混合物中加入抗pd-1抗体后,阻断pd-1-pdl1相互作用,然后恢复发光。
在37℃下,在含有5%co2的湿润培养箱中,将中国仓鼠卵巢上皮cho-k1细胞系(atcc,货号ccl-61)维持在含有10%fbs的f-12k培养基中。使用聚乙烯亚胺(mw25k,23966-2,polyscience)将编码人pd-l1(如seqidno:67中所示的np_054862.1的氨基酸)和okt3-scfv(seqidno:68中所示的氨基酸序列)的核酸序列共转染到cho-k1细胞,并且通过有限稀释获得稳定表达人pd-l1和okt3-scfv的克隆。将得到的cho-pdl1/cd3靶细胞在第1天铺板到96孔板(30000细胞/孔)上。在第2天,弃去96孔板上的培养基(含有10%fbs的dmem-f12),然后将系列稀释的抗pd-1抗体和jurkat-nfat-pd1细胞(通过用编码seqidno:66的人pd-1和pgl4.30[luc2p/nfat-re/hygro](promega,e848a)的核酸序列通过电穿孔共转染jurkat细胞系(cbtccca,clonee6-1)制备,通过有限稀释得到稳定表达人pd-1和nfat的克隆)(30000细胞/孔)添加到平板上。将板在37℃,5%co2培养箱中温育六小时。然后将60μlone-glotm试剂(promega公司货号e6130)加入到测定板的孔中,并使用发光板读数器(tecanf200)测量发光。计算ec50值,并且图9中显示了阻断pd-l1和pd-1相互作用的代表性曲线。
结果表明,抗pd-1抗体21f12-1f6(具有seqidno:18的突变igg1恒定区)和nivolumab类似物阻断了人pd-1和pd-l1之间的相互作用,具有相似的ec50值。
实施例12:fcγri结合
将具有l234a、l235a、d265a和p329a突变的突变igg1恒定区或igg4恒定区用作抗体21f12-1f6的重链恒定区,以消除fcγr-fc相互作用。elisa测定用于测定所得抗体对人fcγri的相对结合活性。
通过在4℃下过夜温育将人fcγri(acrobiosystems,货号fca-h52h2)固定在96孔板上。然后通过与1%bsa的pbs溶液在37℃、200μl/孔下温育一小时来封闭平板。封闭后,用pbst(含0.05%tween20的pbs)洗涤平板三次。在结合缓冲液(含有0.05%tween20和0.5%bsa的pbs)中制备系列稀释的利妥昔单抗类似物(用作阳性对照,根据us5736137制备,具有seqidno:69和70中列出的重链和轻链氨基酸序列)、具有突变igg1恒定区的21f12-1f6和具有igg4恒定区的21f12-1f6,并与固定化的蛋白质在37℃下温育一小时。结合后,用pbst洗涤平板三次,在37℃下与在结合缓冲液中1/10,000稀释的过氧化物酶标记的山羊抗人f(ab′)2抗体(jacksonimmunoresearch,cat:109-035-097)温育1小时,再次洗涤,用tmb(thermofisher货号34028)显色15分钟,然后用1mh2so4终止。除非另有说明,否则在每个步骤中每个板孔含有50μl溶液。
测定450nm-620nm的吸光度。ec50和fcγr-i抗体结合的代表性结合曲线如图10所示。
结果表明,与具有野生型igg1重链恒定区的利妥昔单抗类似物相比,具有igg4重链恒定区或突变igg1重链恒定区的21f12-1f6与人fcγri结合非常弱。
实施例13抗pd-1抗体不诱导抗体依赖性细胞介导的细胞毒性(adcc)
对jurkat-pd1细胞进行抗体依赖性细胞介导的细胞毒性(adcc)测定。通过电穿孔用编码人pd-1(氨基酸如seqidno:66中所示)的核酸序列转染jurkat细胞系(cbtcccas,克隆e6-1)制备jurkat-pd-1细胞。通过有限稀释获得稳定表达人pd-1的克隆。
以10,000个细胞/孔的密度接种jurkat-pd1细胞,并在测定缓冲液(不含酚红mem培养基+1%fbs)中与100nm或10nm抗pd-1抗体(具有突变igg1恒定区或igg4恒定区)预温育30分钟。加入来自健康供体的pbmc效应细胞以10∶1、25∶1或50∶1的e/t比引发adcc效应。利妥昔单抗类似物(如实施例13中制备的)对daudi(cbtcccas,货号tchu140)的adcc作用用作内部对照以确保测定质量。在37℃,5%co2培养箱中温育24小时后,收集细胞上清液,使用细胞毒性ldh测定试剂盒(dojindo,货号ck12)测量释放的ldh。在f50(tecan)上读取od490nm的吸光度。根据下式计算细胞裂解的百分比,
%细胞裂解=100×(od样品-od靶细胞加效应细胞)/(od最大释放-od最小释放)。数据通过graphpadprism分析。
数据显示,具有突变型igg1恒定区的抗pd-1抗体21f12-1f6和具有igg4恒定区的抗pd-1抗体21f12-1f6,对jurkat-pd1细胞均没有adcc活性。
实施例14抗pd-1抗体不诱导补体依赖性细胞毒性(cdc)
对jurkat-pd1细胞的补体依赖性细胞毒性(cdc)测定。以每孔5,000个细胞的密度接种jurkat-pd1细胞,并与100nm或10nm抗体在测定缓冲液(无酚红mem培养基+1%fbs)中预温育30分钟。然后,向平板中加入浓度为10体积%、20体积%和50体积%的来自健康供体的血浆,以引发cdc效应。在37℃,5%co2培养箱中温育4小时后,向细胞中加入cell-titerglo试剂(promega,货号g7572),在f200(tecan)上读取rlu数据。根据下式计算细胞裂解的百分比,
%细胞溶解=100×(1-(rlu样品)/(rlu细胞+nhp)),其中nhp代表正常人血浆。
数据显示,具有突变型igg1恒定区的抗pd-1抗体21f12-1f6和具有igg4恒定区的抗pd-1抗体21f12-1f6,对jurkat-pd1细胞均没有cdc活性。
实施例15抗pd-1抗体具有体内抗肿瘤作用
在患有结肠癌的hpd-1ki小鼠中研究了抗pd-1抗体的体内功效。
对于本文的实验,表达人pd-1胞外部分的人源化小鼠c57bl/6j-pdcd1em1(pdcd1)smoc购自shanghaimodelorganismscenter,inc。
mc38鼠结肠癌细胞系购自obiotechnology(shanghai)corp.,ltd。使用逆转录病毒转导,用编码卵清蛋白(ova)(seqidno:71中列出的aab59956的氨基酸)的核酸序列转导mc38细胞。随后通过有限稀释克隆细胞。使用elisa试剂盒(cloudclonecorp,ceb459ge)选择高表达ova蛋白的克隆。mc38-ova克隆维持在含有10%胎牛血清的完全培养基中,所述胎牛血清含有4μg/ml嘌呤霉素(gibco,a11138-03)。
将c57bl/6j-pdcd1em1(pdcd1)smoc小鼠皮下植入1×106mc38-ova细胞,并在当平均肿瘤体积达到约80mm3(lxw2/2)时第0天随机分成3组(每组n=7)。在第0、3、7、10和14天,分别给小鼠腹膜内施用21f12-1f6(具有突变igg1恒定区,10mg/kg)、nivolumab类似物(如实施例4中制备,10mg/kg)和pbs。在实验期间每周两次通过卡尺测量监测肿瘤体积。
抗pd-1抗体21f12-1f6和nivolumab类似物的处理导致与pbs组相比显著的肿瘤生长抑制,并且21f12-1f6组与nivolumab类似物组相比显示更高的tgi率(89.95%相对于76.71%),如下表3所示。
表3.mc38-ova肿瘤生长抑制
a肿瘤体积数据表示为平均值±sem;
btgi=(1-施用组的肿瘤体积变化/对照组的肿瘤体积变化)×100%
c与pbs组比较,进行双向anova,然后进行tukey’s多重比较检验。
本申请中的序列总结如下。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



