新型GLP-1类似物的制作方法
 2021-02-02 17:02:59|
2021-02-02 17:02:59| 397|
397| 起点商标网
起点商标网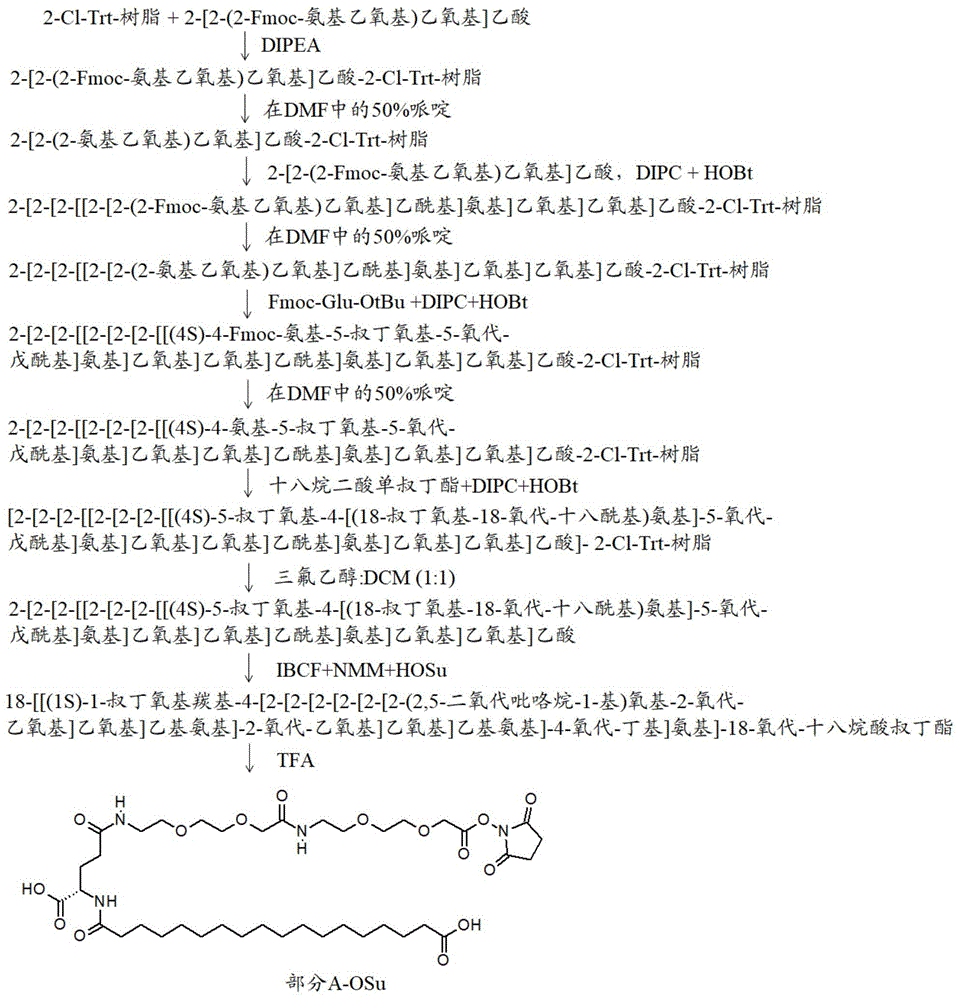
相关申请本申请要求三个印度临时申请的权益,所述印度临时申请具有申请号in201821013109(于2018年4月5日提交);in201821040468(于2018年10月26日提交)和in201821040474(于2018年10月26日提交),所述印度临时申请在此以引用的方式并入。公开内容的领域本公开内容涉及新型胰高血糖素样肽-1(glp-1)(7-38)类似物,其具有在c末端处具有leu或ile的氨基酸序列。新类似物是有效的glp-1激动剂,具有降低的副作用和改善的作用持续时间。本公开内容还涉及新类似物的酰化衍生物,其具有进一步改善的效力和作用持续时间,并且适合于口服施用。本文公开的类似物由延长的部分酰化,其增加了化合物的活性持续时间。本文公开的类似物可以用于治疗糖尿病和肥胖。公开内容的背景胰高血糖素样肽-1(glp-1)是一种激素,其主要在肠道的肠内分泌l细胞中产生,并且当含有脂肪、蛋白质水解物和/或葡萄糖的食物进入十二指肠时,分泌到血流内。glp-1源自前胰高血糖素原基因的细胞特异性翻译后加工。最初,从这个过程中鉴定了肽glp-1(1-37),但它是两种n末端截短的产物,glp-1(7-37)(seqidno:1)和glp-1(7-36)酰胺,其被发现识别胰腺受体,并且确定为体内的活性种类。已发现glp-1刺激胰岛素分泌,从而引起细胞的葡萄糖摄取以及减少的血清葡萄糖水平。glp-1激动剂可作为有利药物用于治疗2型糖尿病(t2dm),因为它们没有低血糖,并且具有重量减轻的积极益处。内源性物质glp-1(7-37)和glp-1(7-36)酰胺被肽酶切割,并且因此具有非常短的半衰期。努力通过开发具有改善的半衰期的glp-1类似物来改善性能。2005年批准的首个药物是以剂量水平10mcg每天两次给药的艾塞那肽(exenatide),并且发现显示了hba1c(葡萄糖控制的标志物)的显著改善。此外,novonordisk开发了具有1.8mgs.c./天的每天一次给药的利拉鲁肽(liraglutide)(美国专利号6,268,343)(seqidno:2),并且于2010年批准。进一步的研究和开发生产了每周一次的产品,如由gsk开发的阿必鲁肽(albiglutide)以及由elililly开发的度拉糖肽(dulaglutide)。最近,glp-1类似物索马鲁肽(semaglutide)(国际公布号wo2006/097537a2)由usfda批准。索马鲁肽(seqidno:3)以商品名上市。它作为每周一次的皮下注射进行施用。文献中报道了制备具有改善的效力和作用持续时间的glp-1类似物的许多尝试。美国专利号7,291,594b2(us‘594专利)公开了glp-1(7-35)衍生物,所述衍生物具有对其c末端添加的几个精氨酸和/或赖氨酸残基,以提供经由粘膜的高生物利用度。us‘594专利还公开了这些衍生物可以通过用其ser取代其glp-1氨基酸序列中的氨基酸8而赋予对二肽基肽酶iv(dpp-iv)的抗性,或者通过分别用gln和asn取代氨基酸26和34而赋予对胰蛋白酶的抗性。美国专利号7,893,017b2(us‘017专利)公开了酰化的glp-1类似物,其中通过修饰相对于序列glp-1(7-37)的7位和8位中的至少一个氨基酸残基,使glp-1类似物针对dpp-iv稳定,并且其中所述酰化是直接连接至所述glp-1类似物的c末端氨基酸残基的二酸。美国专利号8,951,959β2(us‘959专利)公开了dpp-iv抗性glp-1(7-37)类似物,所述类似物在相对于序列glp-1的8位中具有含有三氟甲基的非产蛋白质氨基酸残基,并且由包含两个酸性基团的部分对26位中的赖氨酸残基酰化。美国专利号7,084,243b2(us‘243专利)公开了作为dpp-iv抗性肽,相对于序列glp-1(7-37)在8位处具有val或gly的glp-1(7-37)类似物。国际公布号wo2017/149070a1(wo‘070)公开了在对应于glp-1(7-37)的8位的位置处具有trp的glp-1类似物,并且这些trp8化合物显示针对被dpp-iv降解是非常稳定的。国际公布号wo2004/103390a2(wo‘390)公开了在p’1位(对应于在glp-1(7-37)的情况下的9位)处的修饰可以产生glp-1类似物,其相对于天然底物具有对酶介导的(例如dpp-iv)切割极大降低的敏感性,然而,仍保留天然底物的生物活性。wo‘390还公开了具有在9位处具有四取代的cβ碳的氨基酸(例如叔亮氨酸)的glp-1(7-37)类似物,提供了对被dpp-iv降解具有抗性的glp类似物。国际公布号wo2015/086686a2(wo’686公布)公开了将α-甲基官能化的氨基酸直接掺入glp-1类似物的主链内,已确定产生蛋白酶抗性(包括dpp-iv抗性)肽。多种其它的dpp-iv抗性glp-1激动剂公开于专利公布中,例如国际公布号wo2007/030519a2、wo2004/078777a2、wo2007/039140a1、wo2014/209886a1、wo2012/016419a1、wo2017/211922a2、wo2016/198544a1和wo2013/051938a2。多种专利申请公开了具有增加的稳定性和更长的作用持续时间的c末端延伸的glp-1类似物。例如,美国专利号7,482,321b2、9,498,534b2和7,897,566b2。多种专利申请公开了酰化的glp-1类似物,其中glp-1类似物任选经由接头连接至亲脂性取代基,以提供更长的作用持续时间。美国专利号8,603,972b2(us‘972)公开了glp-1类似物的单酰化衍生物,其中在glp-1类似物的37位或38位处的lys残基是酰化的。美国专利号8,648,041b2、9,758,560b2、9,006,178b2、9,266,940b2、9,708,383b2和美国专利申请公布号us2015/0152157a1、us2015/0133374a1公开了glp-1类似物的二酰化衍生物。美国专利申请公布号us2016/0200791a1公开了glp-1类似物的三酰化衍生物。国际公布号wo2016/083499a1、wo2016/097108a1和wo2014/202727a1公开了酰化的glp-1类似物,其中glp-1类似物的lys残基经由分支接头连接至两个延长部分。国际公布号wo2009/030771a1和wo2018/083335a1公开了多种酰化剂(侧链),其可以连接至glp-1类似物的lys残基,以提供更长的作用持续时间。国际公布号wo2013/186240a2公开了艾塞那肽-4肽类似物,其在艾塞那肽-4氨基酸序列的2位处具有gly、ser或官能化的ser例如ser(och3)、d-ser或官能化的d-ser例如d-ser(och3)、aib、ala或d-ala。多种其它的glp-1类似物公开于专利申请中,例如国际公布号wo2005/027978a2、wo1998/008871a1、wo1999/043705a1、wo1999/043706a1、wo1999/043707a1、wo1999/043708a1、wo2000/034331a2、wo2009/030771a1、wo2011/080103a1、wo2012/140117a1、wo2012/062803a1、wo2012/062804a1、wo2013/037690a1、wo2014/202727a1、wo2015/000942a1、wo2015/022400a1、wo2016/083499a1、wo2016/097108a1和wo2017/149070a1。仍然需要开发在稳定性和作用持续时间方面具有最佳所需特性的glp-1类似物。公开内容的概述本公开内容的一个方面提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是ser、ser(ome)、d-ser、d-ser(ome)、ala或aib;x3不存在或是gln;x4是glu;x16是glu;x24是ile;x33是leu、d-leu、d-ile或ile;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u不存在或是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w不存在或选自-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-]、-c(o)-nh-(ch2)3-4-nh-]、-c(o)-c(ch3)2-nh-]和其中]是与基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-cooh或-c(o)-(ch2)n-ch3,其中n是14至20的整数。本公开内容的多肽是具有较少副作用的有效的glp-1激动剂。此外,本公开内容的多肽是稳定的,并且具有长的作用持续时间并且适合于口服施用。附图描述图1a示出了部分a-osu(中间体3)的制备。图1b示出了部分a-osu(中间体3)的制备。图2示出了部分c-osu的制备。图3示出了部分d-osu的制备。图4示出了部分e-osu的制备。图5示出了部分f-osu的制备。图6a和6b示出了化合物1在大鼠中的口服葡萄糖耐量测试(ogtt)的结果;单次注射;1mg/kg葡萄糖auc0-120分钟(图6a=22小时后,图6b=46小时后)。图7示出了在用化合物1长期治疗后,db/db2型糖尿病小鼠中的血糖水平降低。图8示出了用化合物1治疗后,db/db小鼠中的食物摄入降低。图9示出了化合物1在db/db小鼠中降低体重的功效。图10示出了用化合物1治疗后,db/db小鼠中的hb1ac降低。缩写aib:2-氨基异丁酸ado:8-氨基-3,6-二氧代-辛酸ogtt:口服葡萄糖耐量测试dipea:n,n’-二异丙基乙基胺hobt:1-羟基苯并三唑dipc:n,n’-二异丙基碳二亚胺hosu:n-羟基琥珀酰亚胺ibcf:氯甲酸异丁酯nmm:n-甲基吗啉thf:四氢呋喃dcm:二氯甲烷dmap:4-二甲基氨基吡啶dcc:二环己基碳二亚胺dmac:二甲基乙酰胺公开内容的描述本公开内容提供了稳定的长效glp-1类似物,其不需要频繁的皮下给药并且也适合于口服施用。令人惊讶地发现,当与亲本肽相比较时,在序列的c末端处添加额外的leu产生了具有显著改善的效力和作用持续时间的肽。当与亲本肽相比较时,具有额外ile的肽也显示了改善的效力和作用持续时间的相似作用。另外,本文的公开内容证实了可以经由酰化反应附加到其为glp-1(7-37)的类似物的肽的部分,以产生具有显著改善的效力和更长的作用持续时间的化合物。公开的化合物的延长部分具有更稳定的键,其对被生物酶的切割较不敏感。因此,本文公开的化合物是更稳定的,并且需要较不频繁的施用,增加了患者依从性。因此,在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34(seqidno:4)其中x2是ser、ser(ome)、d-ser、d-ser(ome)、ala或aib;x3不存在或是gln;x4是glu;x16是glu;x24是ile;x33是leu、d-leu、d-ile或ile;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)是酰化的。在一些实施方案中,x21可以被以下中报道的延长部分酰化:美国专利号6,268,343、8,951,959β2、8,603,972b2、8,648,041b2、9,758,560b2、9,006,178b2、9,266,940b2、9,708,383b2,以及美国专利申请公布号us2015/0152157a1和us2015/0133374a1;国际公布号wo2009/030771a1、wo2006/097537a2和wo2018/083335α1。在一些实施方案中,x21lys在其侧链氨基(ε氨基)处被包含脂肪酸基团的部分酰化。脂肪酸基团可以经由接头连接至x21lys。因此,在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是ser、ser(ome)、d-ser、d-ser(ome)、ala或aib;x3不存在或是gln;x4是glu;x16是glu;x24是ile;x33是leu、d-leu、d-ile或ile;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u不存在或是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w不存在或选自-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-]、-c(o)-nh-(ch2)3-4-nh-]、-c(o)-c(ch3)2-nh-]和其中]是与基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-cooh或-c(o)-(ch2)n-ch3,其中n是14至20的整数。在一些实施方案中,在x2处的氨基酸选自ser、ser(ome)、d-ser、d-ser(ome)、ala或aib。在一些实施方案中,x2是aib。在一些实施方案中,x3不存在。在一些实施方案中,x33是leu。在一些实施方案中,x33是ile。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w选自-c(o)-nh-(ch2)3-4-nh-]、-c(o)-c(ch3)2-nh-]和在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中u和w均不存在,并且z是-c(o)-(ch2)n-ch3,其中n是整数14。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-]。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-c(ch3)2-nh-]。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-nh-(ch2)4-nh-]。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-nh-(ch2)3-nh-]。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中z是-c(o)-(ch2)n-cooh,其中n是整数16。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中z是-c(o)-(ch2)n-ch3,其中n是整数14。在一些实施方案中,x2是ala或aib;x3不存在;x33是leu;u不存在;w不存在;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-ch3,其中n是整数14。在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是aib;x3不存在;x4是glu;x16是glu;x24是ile;x33是leu;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-],其中]是基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-cooh,其中n是整数16。在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是aib;x3不存在;x4是glu;x16是glu;x24是ile;x33是leu;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w是-c(o)-c(ch3)2-nh-],其中]是与基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-cooh,其中n是整数16。在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是aib;x3不存在;x4是glu;x16是glu;x24是ile;x33是leu;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w是-c(o)-nh-(ch2)3-4-nh-],其中]是与基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-cooh,其中n是整数16。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-nh-(ch2)4-nh-]。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-nh-(ch2)3-nh-]。在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是aib;x3不存在;x4是glu;x16是glu;x24是ile;x33是leu;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w是-c(o)-nh-(ch2)4-nh-],其中]是基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;z是-c(o)-(ch2)n-cooh或-c(o)-(ch2)n-ch3,其中n是14至20的整数。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中z是-c(o)-(ch2)n-cooh,其中n是整数16。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中z是-c(o)-(ch2)n-ch3,其中n是整数14。在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是aib;x3不存在;x4是glu;x16是glu;x24是ile;x33是leu;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w是其中]是与基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;并且z是-c(o)-(ch2)n-cooh,其中n是整数16。在一些实施方案中,本公开内容提供了包含以下氨基酸序列的多肽:h-x2-x3-x4-g-t-f-t-s-d-v-s-s-y-l-x16-g-q-a-a-x21-e-f-x24-a-w-l-v-r-g-r-g-x33-x34其中x2是ser、ser(ome)、d-ser、d-ser(ome);x3不存在;x4是glu;x16是glu;x24是ile;x33是leu;x34不存在,并且x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z其中q和t不存在;u是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-},其中}是与基团w的连接点;w是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-、-c(o)-nh-(ch2)3-4-nh-]、-c(o)-c(ch3)2-nh-],其中]是与基团y的连接点;y是-c(o)-(ch2)2-ch(cooh)nh--,其中--是与基团z的连接点;并且z是-c(o)-(ch2)n-cooh或-c(o)-(ch2)n-ch3,其中n是14至20的整数。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-nh-(ch2)3-4-nh-]。在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-ch2-o-(ch2)2-o-(ch2)2-nh-;在一些实施方案中,x21是lys,其中lys的侧链氨基(ε氨基)被如下部分酰化:{-q-t-u-w-y-z,其中w是-c(o)-c(ch3)2-nh-]。在一些实施方案中,x21是脂质修饰的lys,其中lys的侧链氨基(ε氨基)被如下部分酰化{-q-t-u-w-y-z其由表1中提供的部分表示。表1:关于基团{-q-t-u-w-y-z的代表部分在另一个实施方案中,本公开内容提供了根据前述实施方案中任何一个的多肽,其选自表2中提供的肽:表2:本公开内容的代表性多肽化合物*除非另有说明,否则结构中的所有氨基酸在α位都具有l构型。d当在序列中用作氨基酸的前缀时表示氨基酸的d构型。例如(dser)表示序列中的丝氨酸氨基酸具有d-构型。除非另有说明,否则本公开内容旨在涵盖序列中氨基酸的l和d异构体两者。如本文在公开内容中所述的,ser(ome)是其羟基甲基化的氨基酸丝氨酸,并且具有下述结构本公开内容中提到的多肽序列通过如由iupac批准的氨基酸的单字母代码表示。如本文用于定义本公开内容的实施方案的酰化部分的q、t、u、w、y和z不同于用于表示多肽序列的氨基酸的单字母代码。当在sd大鼠中进行口服葡萄糖耐量测试(ogtt)时,本公开内容的多肽令人惊讶地显示了血糖显著降低。当用口服葡萄糖攻击时,sd大鼠中的血糖降低百分比显著低于在x33位处缺少另外的leu或ile的相应多肽。本发明还参考下述实施例详细地说明。期望实施例在所有方面都视为说明性的,而不旨在限制本发明的范围。实施例:通用制备方法:本公开内容的多肽化合物可以通过本文下文所述的方法进行制备。该方法涉及两个步骤,涉及亲本线性肽的制备以及脂肪酸链随后连接至亲本肽。本文所述的肽可以使用固相技术通过化学合成进行制备,例如在以下中描述的那些:g.barany和r.b.merrifield,“thepeptides:analysis,synthesis,biology”;第2卷—“specialmethodsinpeptidesynthesis,parta”,第3-284页,e.gross和j.meienhofer编辑,academicpress,newyork,1980;以及j.m.stewart和j.d.young,“solid-phasepeptidesynthesis”,第2版,piercechemicalco.,rockford,ill.,1984。期望的策略基于用于临时保护α-氨基的fmoc(9-芴基甲基-氧基羰基)基团,与用于临时保护氨基酸侧链的保护基,例如叔丁基(-tbu)、叔丁氧基羰基(-boc)、三苯甲基(-trt)组合(参见例如,e.atherton和r.c.sheppard,“thefluorenylmethoxycarbonylaminoprotectinggroup”,于“thepeptides:analysis,synthesis,biology”;第9卷-“specialmethodsinpeptidesynthesis,partc”,第1-38页,s.undenfriend和j.meienhofer编辑,academicpress,sandiego,1987)。可以在不溶性聚合物支持物(也称为“树脂”)上,从肽的c末端开始以逐步方式合成肽。经由酰胺或酯连接的形成,通过将肽的c末端氨基酸附接到树脂而开始合成。这允许所得到的肽分别作为c末端酰胺或羧酸的最终释放。要求合成中使用的c末端氨基酸和所有其它氨基酸具有受到差异保护的α-氨基和侧链官能团(如果存在的话),使得在合成过程中可以选择性去除α-氨基保护基。氨基酸的偶联通过其羧基活化为活性酯,以及其与附接至树脂的n末端氨基酸的未封闭α-氨基的反应来进行。重复α-氨基脱保护和偶联的顺序,直到组装整个肽序列。然后通常在限制副反应的适当清除剂的存在下,使肽从树脂中释放,具有侧链官能团的伴随脱保护。最后通过反相hplc纯化所得到的肽。然后可以通过使活化的脂肪酸链与亲本肽偶联,使亲本肽与脂肪酸链偶联。可以通过有机化学中众所周知的方法来制备脂肪酸链。例如,可以使用能够制备线性脂肪酸链的固相合成方法来制备脂肪酸链。合成的线性肽通过如下文概述的制备型hplc方法进行纯化:制备型hplc:waters2555quaternary梯度模块(最大总流量:300ml/分钟,最大压力:3000psi)或shimadzulc-8a(最大总流量:150ml:最大压力:20mpa)柱:c18,10μ流量:75ml/分钟流动相:对于第一次纯化流动相a:ph7.5磷酸盐缓冲液流动相b:乙腈梯度:在300分钟内10%至40%的流动相-b。对于第二次纯化:流动相a:在水中的1%乙酸流动相b:在乙腈中的1%乙酸:正丙醇(50:50)梯度:在300分钟内15%至45%的流动相-b通过如下文概述的制备型hplc方法来纯化本公开内容的最终化合物:制备型hplc:waters2555quaternary梯度模块(最大总流量:300ml/分钟,最大压力:3000psi)或shimadzulc-8a(最大总流量:150ml:最大压力:20mpa)柱:c18,10μ流量:75ml/分钟流动相:对于第一次纯化对于第二次纯化流动相aph7.5磷酸盐缓冲液在水中的1%乙酸流动相b乙腈在乙腈中的1%乙酸:正丙醇(50:50)梯度在300分钟内10%至40%的流动相-b在300分钟内15%至45%的流动相-b通过如下文概述的rp-hplc方法来分析本公开内容的化合物的纯度:hplc方法b1:柱:ymcpack-ph(4.6mm×150mm3μ)洗脱液:流动相a:在水中的0.1%三氟乙酸流动相b:在乙腈中的0.1%三氟乙酸流速:1.5ml/分钟检测:在210nm处的uv检测柱温:50℃运行时间:50分钟。梯度:时间流动相a%流动相b%0.01901035.0208040.0208041.0901050.09010hplc方法b2:柱:ymc-packproc18(4mm×250mm,3μ)洗脱液:流动相a:缓冲液:乙腈(900:100)流动相b:缓冲液:乙腈(300:700)缓冲液:在水中的正磷酸二氢钾,用正磷酸将ph调节至3.0±0.1流速:1.0ml/分钟检测:在210nm处的uv检测柱温:50℃样品托盘温度:8℃运行时间:38分钟。时间流动相a%流动相b%010005100030010032010032.11000381000hplc方法b3:柱:watersx-selectcsh-c18(150mm×4.6mm;2.5μ)洗脱液:流动相a:缓冲液:乙腈(900:100)流动相b:缓冲液:乙腈(300:700)缓冲液:在水中的正磷酸二氢钾,用正磷酸将ph调节至1.5±0.1流速:0.9ml/分钟检测:在210nm处的uv检测柱温:40℃样品托盘温度:5℃运行时间:100分钟。通过如下文概述的lcms来分析本公开内容的化合物:使用waterswatersmicromassquattromicroapi或thermoscientificlcqfleettm,在lcms上记录质谱。通过将合适量的分析物溶解在稀释剂中来制备测试溶液,其最终浓度为1μg/ml至50μg/ml,取决于分析物的电离。将测试溶液以约10μl至50μl/分钟的速率输注到lcms内1分钟,并且以电喷雾电离(esi)正或负模式以及在适当的质量范围内记录质谱。实施例1:活化的脂肪酸侧链的制备:1.制备18-[[(1s)-1-羧基-4-[2-[2-[2-[2-[2-[2-(2,5-二氧代吡咯烷-1-基)氧基-2-氧代-乙氧基]乙氧基]乙基氨基]-2-氧代-乙氧基]乙氧基]乙基氨基]-4-氧代-丁基]氨基]-18-氧代-十八酸(部分a-osu,中间体3)如图1a中示意性表示的,使用2-氯三苯甲基氯树脂,通过固相合成来制备活化的脂肪酸侧链部分a-osu。在n,n’-二异丙基乙基胺(dipea)的存在下,将2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸(中间体1)连接至2-氯三苯甲基氯树脂,其产生2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸-2-cl-trt-树脂。可以通过2-[2-(2-氨基乙氧基)-乙氧基]乙酸与fmocn-羟基琥珀酰亚胺酯的偶联来制备中间体1。可选择的是,中间体1是可商购获得的并且可以作为本身获得。通过使用哌啶选择性去封闭2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸-2-cl-trt-树脂的氨基,来去除fmoc保护基,然后使用1-羟基苯并三唑(hobt)和n,n’-二异丙基碳二亚胺(dipc),将游离氨基偶联至2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸,其产生2-[2-[2-[[2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。然后通过使用哌啶选择性去封闭2-[2-[2-[[2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂的氨基,来去除fmoc基团,然后使用hobt和dipc,将游离氨基偶联至fmoc-glu-otbu,以获得2-[2-[2-[[2-[2-[2-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。使用哌啶将所得的2-[2-[2-[[2-[2-[2-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂选择性地去封闭,然后与十八烷二酸单叔丁酯偶联,以得到中间体2,即[2-[2-[2-[[2-[2-[2-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酸]-2-cl-trt-树脂。然后使用三氟乙醇:dcm(1:1),从2-cl-trt-树脂中切割中间体2。然后在氯甲酸异丁酯(ibcf)和n-甲基吗啉(nmm)的存在下,使所得的化合物与n-羟基琥珀酰亚胺(hosu)反应,随后用三氟乙酸脱保护,以产生标题化合物(部分a-osu,中间体3)。整个方法也可以如图1b中示意性表示的描绘。2.制备n-棕榈酰基-l-γ-谷氨酰基琥珀酰亚胺酯(部分b-osu)在ibcf和nmm的存在下,使l-谷氨酸α-叔丁酯(h-glu-otbu)与棕榈酸反应,以产生ch3-(ch2)14-c(o)-glu-otbu,然后在ibcf和nmm的存在下,使其与hosu反应,以产生ch3-(ch2)14-c(o)-glu(osu)-otbu,然后将其用三氟乙酸脱保护,以产生部分b-osu。3.制备18-[[(1s)-1-羧基-4-[4-[2-[2-[2-(2,5-二氧代吡咯烷-1-基)氧基-2-氧代-乙氧基]乙氧基]乙基氨基甲酰基氨基]丁基氨基]-4-氧代-丁基]氨基]-18-氧代-十八酸(部分c-osu)如图2中示意性表示的,使用2-氯三苯甲基氯树脂,使用固相合成来制备活化的脂肪酸侧链部分c-osu。在dipea的存在下,将2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸连接至2-氯三苯甲基氯树脂,以产生2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶选择性去封闭氨基,来去除fmoc保护基,然后使用在thf和dipea中的对硝基苯基氯甲酸酯活化游离氨基,随后与在thf:dmac和dipea中的fmoc-氨基丁基胺盐酸盐反应,其产生2-[2-[2-(4-fmoc-氨基丁基氨基甲酰基氨基)乙氧基]乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶的选择性去封闭来去除fmoc基团,然后使用hobt和dipc,将游离氨基偶联至fmoc-glu-otbu,其产生2-[2-[2-[4-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]丁基氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。使用哌啶将所得的2-[2-[2-[4-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]-丁基氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂选择性地去封闭,然后与十八烷二酸单叔丁酯偶联,以得到中间体2-[2-[2-[4-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]丁基氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。然后使用三氟乙醇:dcm(1:1),从2-cl-trt-树脂中切割中间体,以获得2-[2-[2-[4-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]丁基氨基甲酰基氨基]乙氧基]乙氧基]乙酸(lcms=m/z:814.56(m+h+))。然后在二环己基碳二亚胺(dcc)的存在下,使所得的化合物与hosu反应,以产生琥珀酰亚胺保护的中间体,用三氟乙酸将其脱保护,以产生标题化合物(部分c-osu)。4.制备18-[[(1s)-1-羧基-4-[[2-[2-[2-[2-(2,5-二氧代吡咯烷-1-基)氧基-2-氧代-乙氧基]乙氧基]乙基氨基]-1,1-二甲基-2-氧代-乙基]氨基]-4-氧代-丁基]氨基]-18-氧代-十八酸(部分d-osu)如图3中示意性表示的,使用2-氯三苯甲基氯树脂,使用固相合成来制备脂肪酸侧链。在dipea的存在下,将2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸连接至2-氯三苯甲基氯树脂,以产生2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶选择性去封闭氨基,来去除fmoc保护基,随后使用dipc和hobt,与在thf:dmac中的fmoc-aib-oh偶联,其产生2-[2-[2-[(2-fmoc-氨基-2-甲基-丙酰基)氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶的选择性去封闭来去除fmoc基团,然后使用hobt和dipc,将游离氨基与fmoc-glu-otbu偶联,以产生2-[2-[2-[[2-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]-2-甲基-丙酰基]氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。使用哌啶将所得的化合物的fmoc基团选择性地去封闭,然后将游离氨基与十八烷二酸单叔丁酯偶联,以得到2-[2-[2-[[2-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]-2-甲基-丙酰基]-氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。然后使用三氟乙醇:dcm(1:1),从2-cl-trt-树脂中切割中间体,以获得2-[2-[2-[[2-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]-2-甲基-丙酰基]氨基]乙氧基]乙氧基]乙酸(lcms=m/z:786.39(m+h+))。然后在dcc的存在下,使所得的化合物与hosu反应,以产生琥珀酰亚胺保护的中间体,用三氟乙酸将其脱保护,以产生标题化合物(部分d-osu)。5.制备18-[[(1s)-1-羧基-4-[3-[2-[2-[2-(2,5-二氧代吡咯烷-1-基)氧基-2-氧代-乙氧基]乙氧基]乙基氨基甲酰基氨基]丙基氨基]-4-氧代-丁基]氨基]-18-氧代-十八酸(部分e-osu)如图4中示意性表示的,使用2-氯三苯甲基氯树脂,使用固相合成来制备脂肪酸侧链。在dipea的存在下,将2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸连接至2-氯三苯甲基氯树脂,以产生2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶选择性去封闭氨基,来去除fmoc保护基,然后使用在thf和dipea中的对硝基苯基氯甲酸酯活化游离氨基,随后在dipea的存在下,使用hobt与在thf:dmac中的1,3-二氨基丙烷反应,以形成nh2-(ch2)3-nh-c(o)-{(2-(2-氨基-乙氧基)-乙氧基}-乙酸-2-cl-trt-树脂。然后使用hobt和dipc,将游离氨基偶联至fmoc-glu-otbu,其产生2-[2-[2-[3-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]丙基氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。使用哌啶将所得的2-[2-[2-[3-[[(4s)-4-fmoc-氨基-5-叔丁氧基-5-氧代-戊酰基]氨基]丙基氨基甲酰基氨基]乙氧基]-乙氧基]乙酸-2-cl-trt-树脂选择性地去封闭,然后与十八烷二酸单叔丁酯偶联,以得到2-[2-[2-[3-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]-丙基氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。然后使用三氟乙醇:dcm(1:1),从2-cl-trt-树脂中切割中间体,以获得2-[2-[2-[3-[[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]氨基]-丙基氨基甲酰基氨基]乙氧基]乙氧基]乙酸(lcms=m/z:801.41(m+h+))。然后在二环己基碳二亚胺(dcc)的存在下,使所得的化合物与hosu反应,以产生琥珀酰亚胺保护的中间体,用三氟乙酸将其脱保护,以产生标题化合物(部分e-osu)。6.制备18-[[(1s)-1-羧基-4-[4-[2-[2-[2-(2,5-二氧代吡咯烷-1-基)氧基-2-氧代-乙氧基]乙氧基]乙基氨基甲酰基氨基]-1-哌啶基]-4-氧代-丁基]氨基]-18-氧代-十八酸(部分f-osu)如图5中示意性表示的,使用2-氯三苯甲基氯树脂,使用固相合成来制备脂肪酸侧链。在dipea的存在下,将2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸连接至2-氯三苯甲基氯树脂,以产生2-[2-(2-fmoc-氨基乙氧基)乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶选择性去封闭氨基,来去除fmoc保护基,然后使用在thf和dipea中的对硝基苯基氯甲酸酯活化游离氨基,随后在dipea的存在下,使用hobt与在thf:dmac中的4-氨基-boc-哌啶反应,其产生(2-[2-[2-(4-boc-哌啶基氨基甲酰基氨基)乙氧基]乙氧基]乙酸-2-cl-trt-树脂。使用三氟乙酸切割所得的化合物,产生2-[2-[2-(4-哌啶基氨基甲酰基氨基)乙氧基]乙氧基]乙酸,其在三乙胺(tea)的存在下,与fmoc-osu进一步反应,产生2-[2-[2-(4-fmoc-哌啶基氨基甲酰基氨基)乙氧基]乙氧基]乙酸。然后在dipea的存在下,将所获得的化合物进一步连接至2-氯三苯甲基氯树脂,以产生2-[2-[2-(4-fmoc-哌啶基氨基甲酰基氨基)乙氧基]乙氧基]乙酸-2-cl-trt-树脂。通过使用哌啶的选择性去封闭来去除fmoc基团,然后使用hobt和dipc,将游离氨基与fmoc-glu-otbu偶联,其产生2-[2-[2-[[1-[(4s)-4-氨基-5-叔丁氧基-5-氧代-戊酰基]-4-哌啶基]氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。使用哌啶将所得的化合物选择性地去封闭,然后与十八烷二酸单叔丁酯偶联,以得到2-[2-[2-[[1-[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]-4-哌啶基]氨基甲酰基氨基]乙氧基]乙氧基]乙酸-2-cl-trt-树脂。然后使用三氟乙醇:dcm(1:1),从2-cl-trt-树脂中切割中间体,以获得2-[2-[2-[[1-[(4s)-5-叔丁氧基-4-[(18-叔丁氧基-18-氧代-十八酰基)氨基]-5-氧代-戊酰基]-4-哌啶基]氨基甲酰基氨基]乙氧基]乙氧基]乙酸(lcms=m/z:827.40(m+h+))。然后在dcc的存在下,使所得的化合物与hosu反应,以产生琥珀酰亚胺保护的中间体,使用三氟乙酸将其脱保护,以产生标题化合物部分f-osu。实施例2:合成化合物1:n-ε26-[2-(2-[2-(2-[2-(2-[4-(17-羧基十七酰基氨基)-4(s)羧基丁酰基氨基]乙氧基)乙氧基]乙酰基氨基)乙氧基]乙氧基)乙酰基][(aib8,arg34,leu38glp-1(7-38)肽部分a.合成亲本线性肽aib8,arg34,leu38glp-1(7-38)亲本肽通过固相方法合成。用于合成的起始树脂是wang树脂。fmoc保护的亮氨酸用于与wang树脂偶联。在4-二甲基氨基吡啶(dmap)的存在下,通过使用二异丙基碳二亚胺、n-羟基苯并三唑(dic-hobt)作为偶联试剂来进行偶联,其产生fmoc-leu-wang树脂。使用哌啶选择性去封闭fmoc-leu-wang树脂的氨基,随后使用hobt和dipc与fmoc-gly-oh偶联,产生fmoc-gly-leu-wang树脂。这完成了一个循环。乙酸酐和二异丙基乙基胺/吡啶用于在每个氨基酸偶联处封端未偶联的氨基。对于剩余的30个氨基酸残基,重复上述2个步骤,即连接至树脂的氨基酸的fmoc-保护的选择性去封闭,以及序列中的下一个氨基酸残基与fmoc保护的氨基偶联。使用哌啶完成选择性去封闭,即fmoc基团的脱保护,并且使用hobt/dipc完成与下一个fmoc保护的氨基酸的偶联。fmoc保护的氨基酸的侧链受正交保护,例如丝氨酸、酪氨酸或苏氨酸的羟基由叔丁基(-tbu)保护,赖氨酸和精氨酸的氨基和胍基分别由叔丁氧基羰基(-boc)和2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基(-pbf)保护,组氨酸的咪唑由三苯甲基(-trt)保护,天冬氨酸或谷氨酸的羧酸基团由-tbu基团保护。进行上文提到的两个步骤,即选择性去封闭以及随后与下一个fmoc保护的氨基酸偶联,以获得fmoc-his(trt)-aib-glu(otbu)-gly-thr(tbu)-phe-thr(tbu)-ser(tbu)-asp(otbu)-val-ser(tbu)-ser(tbu)-tyr(tbu)-leu-glu(otbu)-gly-gln-ala-ala-lys(boc)-glu(otbu)-phe-ile-ala-trp-leu-val-arg(pbf)-gly-arg(pbf)-gly-leu-树脂。fmoc-his(trt)-aib-glu(otbu)-gly-thr(tbu)-phe-thr(tbu)-ser(tbu)-asp(otbu)-val-ser(tbu)-ser(tbu)-tyr(tbu)-leu-glu(otbu)-gly-gln-ala-ala-lys(boc)-glu(otbu)-phe-ile-ala-trp-leu-val-arg(pbf)-gly-arg(pbf)-gly-leu-树脂使用哌啶去封闭,随后使用三氟乙酸与乙烷-1,2-二硫醇的切割和脱保护,得到粗制h-his-aib-glu-gly-thr-phe-thr-ser-asp-val-ser-ser-tyr-leu-glu-gly-gln-ala-ala-lys-glu-phe-ile-ala-trp-leu-val-arg-gly-arg-gly-leu-oh(aib8,arg34,leu38glp-1(7-38)肽),其通过hplc进行纯化。部分b:在乙腈中在ph约10下,在部分a中获得的纯化的(线性肽)h-his-aib-glu-gly-thr-phe-thr-ser-asp-val-ser-ser-tyr-leu-glu-gly-gln-ala-ala-lys-glu-phe-ile-ala-trp-leu-val-arg-gly-arg-gly-leu-oh上接枝活化的脂肪酸链部分a-osu,得到粗制的标题肽,其通过制备型hplc进行纯化。表3中提供了化合物的表征。实施例3:制备化合物2、3、5、9、10和12按照关于实施例1部分a给出的类似方法,通过固相方法制备化合物2、3、5、9、10和12的线性肽。通过按照实施例1部分b的方法,在相应的线性肽上接枝活化的脂肪酸链部分a-osu,提供了化合物2、3、5、9、10和12。实施例4:制备化合物4和11:按照关于实施例2部分a给出的类似方法,通过固相方法制备化合物4和11的线性肽,除了此处首先将fmoc保护的d-亮氨酸与wang树脂偶联,然后按顺序偶联其它氨基酸之外。通过按照实施例2部分b的方法,在相应的线性肽上接枝活化的脂肪酸链部分a-osu,提供了化合物4和11。实施例5:制备化合物8按照关于实施例2部分a给出的类似方法,通过固相方法制备线性肽,除了此处首先将fmoc保护的异亮氨酸与wang树脂偶联,然后按顺序偶联其它氨基酸之外。通过按照实施例2部分b的方法,在线性肽上接枝活化的脂肪酸链部分a-osu,提供了化合物8。实施例6:制备化合物6按照关于实施例2部分a给出的类似方法,通过固相方法制备线性肽。通过按照实施例2部分b的类似方法,在线性肽上接枝活化的脂肪酸链部分b-osu,提供了化合物6。实施例7:制备化合物7通过按照实施例2部分b的类似方法,在实施例2部分a的线性肽上接枝活化的脂肪酸链部分b-osu,提供了化合物7。实施例8:制备化合物13通过按照实施例1部分b的类似方法,在实施例1部分a的线性肽上接枝活化的脂肪酸链部分c-osu,提供了化合物13。实施例9:制备化合物14按照关于实施例2部分a给出的类似方法,通过固相方法制备线性肽。通过按照实施例2部分b的类似方法,在线性肽上接枝活化的脂肪酸链部分c-osu,提供了化合物14。实施例10:制备化合物15按照关于实施例2部分a给出的类似方法,通过固相方法制备线性肽,起始于首先将fmoc保护的异亮氨酸与wang树脂偶联,然后按顺序偶联其它氨基酸。通过按照实施例2部分b的类似方法,在线性肽上接枝活化的脂肪酸链部分c-osu,提供了化合物15。实施例11:制备化合物16通过按照实施例2部分b的类似方法,在实施例2部分a的线性肽上接枝活化的脂肪酸链部分d-osu,提供了化合物16。实施例12:制备化合物17通过按照实施例2部分b的类似方法,在实施例2部分a的线性肽上接枝活化的脂肪酸链部分e-osu,提供了化合物17。实施例13:制备化合物18通过按照实施例2部分b的类似方法,在实施例2部分a的线性肽上接枝活化的脂肪酸链部分f-osu,提供了化合物18。下文在下表3中提供了本公开内容的合成化合物的表征数据。表3:本公开内容的代表性化合物的表征数据化合物#lcms数据hplc纯度1m/z=1057.52(mh44+),计算的质量=4226.0598.32%(方法b2),rt=24.85分钟。2m/z=1061.74(mh44+),计算的质量=4242.9399.02%(方法b1),rt=18.53分钟。3m/z=1087.65(m-4h)-4,计算的质量=4354.6398.12%(方法b1),rt=18.48分钟。4m/z=1055.68(m-4h)-4,计算的质量=4226.7598.97%(方法b1),rt=18.32分钟。5m/z=1057.88(mh44+),计算的质量=4227.4996.75%(方法b1),rt=17.09分钟。6m/z=967.26(mh44+),计算的质量:3865.0198.68%(方法b3),rt=44.04分钟。7m/z=968.53(m-4h)-4,计算的质量=3878.1597.39%(方法b3),rt=27.79分钟。8m/z=1057.72(mh44+),计算的质量=4226.8595.70%(方法b1),rt=16.62分钟。9m/z=1061.67(mh44+),计算的质量=4242.6595.15%(方法b1),rt=16.48分钟。10m/z=1058.18(mh44+),计算的质量=4228.6993.66%(方法b1),rt=16.13分钟。11m/z=1056.95(mh44+),计算的质量:4223.7795.70%(方法b2),rt=24.46分钟12m/z=1405.12(mh33+),计算的质量:4212.3497.51%(方法b1),rt=19.06分钟。13m/z=1049.59(mh44+),计算的质量=4194.3396.01%(方法b2),rt=25.16分钟。14m/z=1050.13(mh44+),计算的质量=4196.4992.06%(方法b2),rt=24.55分钟。15m/z=1049.61(mh44+),计算的质量=4194.4194.41%(方法b2),rt=24.82分钟。16m/z=1042.34(mh44+),计算的质量=4165.3294.56%(方法b2),rt=25.26分钟。17m/z=1046.18(mh44+),计算的质量=4180.7294.33%(方法b2),rt=25.17分钟。18m/z=1052.77(mh44+),计算的质量=4207.0893.12%(方法b2),rt=24.92分钟。实施例14:大鼠中的口服葡萄糖耐量测试(ogtt);单次注射;1mg/kg将动物分成三组-正常对照组、测试组和第三个索马鲁肽组,每组中具有4只动物。在ogtt开始之前,将动物禁食12小时。对于测试组动物,化合物1以1mg/kg的剂量进行皮下注射。对于索马鲁肽组,皮下注射1mg/kg的剂量。在皮下注射测试药物或索马鲁肽22小时、166小时和334小时后,用血糖仪测量血糖(时间0测量)。然后,向所有动物口服给予2g/kg的葡萄糖溶液。在葡萄糖攻击后20、40、60、90和120分钟时测量血糖。记录体重和食物摄入。使用双因素anova,随后为使用prism(graphpad版本5.03)的邦弗朗尼事后检验,来分析血糖数据。使用t检验分析血糖auc0-120分钟的数据。当在大鼠中的口服葡萄糖耐量测试(ogtt)中研究时,与对照组相比,本公开内容的多肽已显示了显著的葡萄糖降低作用。例如,图6提供了在施用化合物1的测试组和索马鲁肽治疗组中,在22小时和46小时后,从时间0到120分钟的血糖水平的变化。在单次给药后22小时,在anova,随后为邦弗朗尼事后检验中,相对于正常对照,化合物1显示了血糖水平统计学显著降低,具有p<0.001。化合物1的葡萄糖降低作用优于用索马鲁肽观察到的葡萄糖降低作用(参见图6a)。即使在皮下施用46小时后,也观察到化合物1的葡萄糖降低作用的优越性(图6b)。此外,当在第2天以及第4天进行观察时,与对照相比,化合物1和索马鲁肽两者均显示了食物摄入的统计学显著降低(参见表4和5)。在第4天化合物1显示的食物摄入降低大于索马鲁肽(参见表5)。在体重降低方面,仅测试化合物在第4天时显示了体重的显著降低。表4:在第2天时治疗对食物摄入和体重的作用相对于正常对照*p<0.05,**p<0.01,***p<0.001;单因素anova,随后为邦弗朗尼事后检验表5:在第4天时治疗对食物摄入和体重的作用相对于正常对照*p<0.05,**p<0.01,***p<0.001;单因素anova,随后为邦弗朗尼事后检验相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验令人惊讶地发现,在给定的研究中,具有为leu和ile的x33的化合物显示了血糖的显著降低,而具有除leu和ile外的氨基酸的化合物在降低血糖中具有显著更小的作用。与对照组相比,本公开内容的多肽已显示了血糖的显著降低。还测试了在x33位处具有除leu或ile外的氨基酸的化合物。例如,用lys和ser替换在化合物1(seqidno:05)中的第32位处的leu,以分别获得化合物std-1和std-2。std-1和std-2仅显示了血糖auc0-120分钟约35%和15%的降低(表6)。表6:在24小时后,在ogtt测试中,在1mg/kg剂量下,血糖auc0-120分钟的降低百分比。类似地,在第32位处具有另外的leu而与利拉鲁肽不同的化合物6,以及通过将第2个氨基酸ala替换为aib并且具有leu作为另外的第32个氨基酸而与利拉鲁肽不同的化合物7,在24小时显示了显著高于利拉鲁肽的血糖降低作用(表6)。一旦确定化合物1在葡萄糖降低、食物摄入和体重降低方面显著更好,就进行试验以确定本发明化合物的作用持续时间。研究了在166小时(7天)和334小时(14天)之后,本发明的代表性化合物(化合物1、13和16)的作用,并且与索马鲁肽的作用进行比较。按照下文提供的方法来测试化合物:将动物分成三组-正常对照组、测试组和第三个索马鲁肽组,每组中具有四只动物。在ogtt开始之前,将动物禁食12小时。对于测试组动物,化合物1、化合物13和化合物16以1mg/kg的剂量进行皮下注射。对于索马鲁肽组,皮下注射1mg/kg的剂量。在皮下注射测试化合物或索马鲁肽22小时、166小时和334小时后,用血糖仪测量血糖(时间0测量)。然后,向所有动物口服给予2g/kg的葡萄糖溶液。在葡萄糖攻击后20、40、60、90和120分钟时测量血糖。记录体重和食物摄入。使用双因素anova,随后为使用prism(graphpad版本5.03)的邦弗朗尼事后检验,来分析血糖数据。使用t检验分析血糖auc0-120分钟的数据。表7提供了在施用1天、7天和14天后,与对照组相比,本发明的代表性化合物(化合物1、13和16)的血糖auc的降低。表7:在ogtt测试中,在1mg/kg剂量下,血糖auc0-120分钟的降低百分比。化合物1和13在一个试验(试验1)中进行研究并且与索马鲁肽进行比较,化合物16在分开的试验(试验2)中进行研究并且与索马鲁肽进行比较。在注射168小时后,当与时间零血糖水平相比较时,本发明的化合物1、13和16显示了血糖auc约60%的降低。另一方面,相对于时间零血糖水平,索马鲁肽仅显示了血糖水平约25%的降低。在消耗食物的量和体重变化方面也有类似的观察。如下表8中可见,当与施用索马鲁肽的动物相比较时,施用代表性化合物(化合物1、13和16)的动物消耗显著更少的食物。化合物16显示了体重的显著降低,证实用于治疗肥胖的潜在效用。表8:在ogtt测试中,在1mg/kg剂量下,对食物消耗和体重的作用实施例15:在长期治疗后db/db2型糖尿病小鼠中的hba1c降低这项研究在糖尿病小鼠模型中完成。将动物分成三个治疗组-糖尿病对照组、测试组和索马鲁肽治疗组。本公开内容的化合物1每天一次以0.3mg/kg剂量皮下注射3天(qd×3),随后为每隔一天的0.1mg/kg剂量共7个剂量(q2d×7),随后为每四天一次的0.1mg/kg剂量共2个剂量周期(q4d×2)。索马鲁肽治疗组施用相同的剂量方案。每天进行血糖水平和体重的测量。在第0天、第7天、第14天和第27天时,通过柱色谱测量%hba1c。在第27天计算累积食物摄入。通过双因素anova,随后为使用prism(graphpad版本5.03)的邦弗朗尼事后检验,分析了%hba1c数据。与糖尿病对照组相比,施用化合物1的测试组动物显示了血糖水平的统计学显著降低(参见图7),并且作用在研究的后期优于索马鲁肽治疗组。如图8中提供的结果可见,施用化合物1的测试组动物显示了食物摄入的显著降低。图8提供了对照和用测试化合物治疗的db/db小鼠从第0天到第27天的累积食物摄入。与糖尿病对照组相比,测试化合物和索马鲁肽两者均显示了食物摄入的统计学显著降低。此外,与索马鲁肽相比,测试化合物显示了显著更低的食物摄入。在同一项研究中,当与糖尿病对照组相比较时,化合物1还已显示了体重的显著降低。图9提供了从第0天到第27天,对照组和测试组体重的变化%结果。与如在索马鲁肽治疗组中观察到的-8%相比,测试化合物1显示了-16%的显著降低(参见图09)。在糖尿病中,指示血糖水平的较差控制的更高量的hba1c,已与心血管疾病、肾病、神经病和视网膜病变有关。在27天的研究中,化合物1显示了在长期治疗后,db/db2型糖尿病小鼠的hba1c水平的统计学显著降低。下表9和图10提供了在糖尿病对照组和用化合物1长期治疗后的组中,在0和27天时的hba1c水平。即使当与索马鲁肽相比较时,该作用也是统计学显著的。表9:治疗对db/db小鼠中的%hba1c水平的作用相对于糖尿病对照*p<0.05,**p<0.01,***p<0.001;双因素anova,随后为邦弗朗尼事后检验相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验在分开的研究中,就其对hba1c和胰岛素水平以及累积食物消耗、体重变化和血糖auc的作用,研究了测试化合物1、13和16并且与索马鲁肽进行了比较。该研究以与上文相似的方式对糖尿病小鼠模型进行。将动物分成三个治疗组-糖尿病对照组、测试组和索马鲁肽治疗组。本公开内容的代表性化合物化合物1、化合物13和化合物16,以3.04或6.078nm剂量进行皮下注射(每隔一天直到第28天(q2d×15)。索马鲁肽治疗组中施用相同的剂量方案。每天进行血糖水平和体重的测量。在第0天、第14天和第29天时,测量%hba1c、胰岛素。在第14天和第29天时,计算累积食物摄入和体重变化。通过双因素anova,随后为使用prism(graphpad版本5.03)的邦弗朗尼事后检验,分析了%hba1c、胰岛素数据。而通过单因素anova,随后为使用prism(graphpad版本5.03)的邦弗朗尼事后检验,分析了血糖auc、体重变化和累积食物摄入数据。从第29天到第45天,使动物保持在恢复期,在此期间不给予药物治疗。在此期间测量血糖和体重。在第45天时,测量体重变化、%hba1c、胰岛素。结果在下表10、11和12中提供。表10:hba1c(%):化合物1(6.078nm),化合物13(3.04&6.078nm),化合物16(3.04&6.078nm);(q2d×15)(n=7)相对于糖尿病对照*=p<0.05,**=p<0.01,***=p<0.001,相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验表11:胰岛素(ng/ml):化合物1(6.078nm),化合物13(3.04&6.078nm),化合物16(3.04&6.078nm);(q2d×15)(n=7)相对于糖尿病对照*=p<0.05,**=p<0.01,***=p<0.001,相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验表12:累积食物消耗、血糖auc(mg/dl×天)和体重变化:化合物1(6.078nm)、化合物13(3.04&6.078nm)、化合物16(3.04&6.078nm);(q2d×15)相对于糖尿病对照*=p<0.05,**=p<0.01,***=p<0.001,相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验当与对照相比较时,以约3nm和6nm剂量的本公开内容的代表性化合物(化合物1、13和16),显示了hba1c、血糖、食物消耗和体重的显著降低(表12)。该降低与由以约12nm剂量的索马鲁肽显示的降低可比较。此外,甚至在29天后也可见该作用(表13和14),其证实了本发明化合物用于开发长效药物的潜力,所述长效药物不需要频繁施用,并且因此增加了患者依从性。表13:恢复研究-血糖auc(mg/dl×天)相对于糖尿病对照*p<0.05,**p<0.01,***p<0.001,并且相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验表14:恢复研究-%hba1c和胰岛素(ng/ml)相对于糖尿病对照*p<0.05,**p<0.01,***p<0.001,并且相对于索马鲁肽#p<0.05,##p<0.01,###p<0.001;单因素anova,随后为邦弗朗尼事后检验这些结果证实,本发明化合物可以发现用于治疗糖尿病和肥胖的潜在用途。当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



