拟南芥高温诱导启动子pHTG1及其重组载体的制作方法
 2021-02-02 10:02:10|
2021-02-02 10:02:10| 362|
362| 起点商标网
起点商标网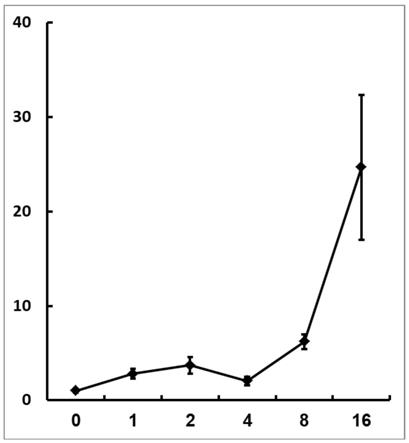
拟南芥高温诱导启动子phtg1及其重组载体
技术领域
[0001]
本发明涉及植物基因工程技术领域。具体而言,本发明涉及一种拟南芥高温诱导启动子phtg1及其重组载体。
背景技术:
[0002]
植物在生长发育过程中会受到各种非生物胁迫的影响,其中温度对植物生长发育的影响尤其严重。由于气候改变,地球的平均温度正在上升,这意味着在很长一段时期内位于不同地域的植物将遭受高温胁迫(grover et al.,2013)。高温是植物经常遭受的主要环境胁迫之一,会影响植物的各种生理生化过程,如作物吸水量降低、蒸腾量减少,作物含水量降低而发生萎蔫,易早衰,抵抗病虫害侵染的能力下降,花粉活力降低,授粉受精不正常,易产生落花落果等。因此,解析植物耐高温的分子机制,培育高产、抗逆农作物新品种成为高度紧迫的重大问题。
[0003]
传统育种方法在耐高温育种中的作用十分有限,主要原因在于:(1)耐非生物胁迫一般由多基因控制,利用传统育种方法获得复杂性状和基因的组合比较困难;(2)相兼容品种间已知的抗性相关基因较少,且已知基因间也存在复杂的连锁关系(grover et al.,2013)。因此,利用转基因技术提高植物的耐热能力成为较为有效的手段。近年来,利用转基因方法提高植物耐高温能力的研究主要通过以下四种途径:
[0004]
1.改变热激蛋白的表达水平
[0005]
过量表达hsp17.7可以增加转基因胡萝卜(吴莹等,2005)和水稻(murakami et al.,2004)的耐高温能力。转lehsp基因的烟草在48℃时的耐热能力高于转反义构建的转化植株(黄冰艳等,2005)。queitsch等在拟南芥中过量表达athsp100,使转基因植株可在45℃热处理1h后恢复正常状态,而转化空载体的对照植株在热处理后不能正常生长。转athsp100基因能够提高水稻热处理后的恢复能力(katiyar-agarwaletal.,2003)。
[0006]
2.改变细胞渗透性
[0007]
梁峥等(1997)在烟草中过表达菠菜甜菜碱脱氢酶,提高了甜菜碱含量,从而提高了转基因烟草幼苗对高温的耐受性。高银(2007)将微生物中的胆碱氧化酶蛋白coda基因导入拟南芥,可以提高转化植株在种子吸胀和发芽阶段的耐热能力(wang et al.,2010)。
[0008]
3.改变细胞膜流动性
[0009]
细胞膜脂饱和度的上升可提高细胞膜的热稳定性。murakami等(2000)通过沉默烟草的叶绿体脂肪酸去饱和酶降低了三烯脂肪酸含量,从而提高了转基因烟草在42℃下的存活率。
[0010]
4.提高细胞排毒、解毒能力。
[0011]
在多种胁迫条件下,植物细胞中会过量积累活性氧ros(alscher et al.,2002)。研究表明,通过在植物中过量表达活性氧清除组分,可以提高植物耐热能力。shi等(2001)在拟南芥中过量表达大麦apx1基因,提高了转化株的耐热能力。chen等(2004)在烟草中过表达番茄的谷胱甘肽过氧化物酶,使转基因烟草获得了更高的耐盐碱和耐热能力。过表达
锌铜超氧化物酶也可以提高植物耐热能力(tang等,2006;jiang等,2009)。
[0012]
然而,当前植物抗逆基因工程多采用组成型强启动子启动抗逆基因过量表达的方式,虽然使转基因植物的抗逆性得以提高,但对植物的一些生理代谢活动却有抑制作用。例如:据kasuga等报道,组成型启动子camv35s启动dreb基因在拟南芥中表达,虽提高了抗逆性,但植株矮化、生长畸形、籽粒数减少;由诱导型启动子rd29a启动的dreb基因在拟南芥中的表达,不仅提高了植株的抗逆性,而且避免了对生长的负面影响。因此鉴定和克隆诱导型启动子,对于植物抗逆基因工程的研究是十分必要的。
技术实现要素:
[0013]
本发明克服了上述现有技术的不足,提供了一拟南芥高温诱导启动子phtg1及其重组载体。本发明利用rnaseq技术筛选出受高温高效诱导表达的基因htg1,用qrt-pcr方法验证基因表达结果。克隆该基因的启动子序列,将启动子序列连接gus标签后转化拟南芥,在转基因植株中用gus染色方法证明其确实可以受高温高效诱导表达。因此,该启动子序列可作为高温诱导型启动子用于作物遗传改良,对于克服现有的遗传改良技术的缺陷和基因调控序列资源的不足,丰富基因序列资源和提高植物耐高温能力具有重要意义。
[0014]
为达到上述目的,本发明采用如下技术方案:
[0015]
本发明的第一个目的是提供一种拟南芥高温诱导启动子phtg1,其核苷酸序列如seq id no.1所示。
[0016]
拟南芥高温诱导启动子phtg1序列(seq id no.1):
[0017]
agcaatcttcgcctaaccattgcagtgtttttggccgctcttgtcttcactgcgacttagcttgtacttagttttttcttttaatctcaaattgaatttctttattgtttcttatacaagaactgtgttttgaataaacttttttattggcagtttcaaactctgtggtggaagccaaggggaaagaggccacaatcaaattttcatgcaaaaagaattcggactgttttacaaacattgcttgttatgctttgtactgattaccgatgtgataaaggattatgtaaatgccatggttttggtggagaaaaggaaaatcccacagctgcgccattaactgcttaatttctccatttcttttttaaatttatcttttgttttcttgtaatgcaaatggataattaaaaagatttcagatcaaattatatcctattaattattttaaatcattatattttatctcatctctgcttgatccttttacataaaaatataataatcacatcatccatattttttttctgcatttgtacgtgttaaaaactgccactagtgattaaatccggaagttaatttcaggcaaagttaatttagttttttccaccaattttttaattattaaattgtgtttggttatatgaataatactaggaaaaagtatgagatatttttgcccttaataagtgtcttttttaaaaaaacagcttattaattaatgacatttaatgtaaatcttaacacgtccataactatttacttaaaaatgttcctcaataagtagtattagatattagcagtcaacttttcacaaaaaaaaaaaaaaaaaaagatattattagtcaacaaaataaaagatttgtttagtcaaaaacaaaactccatattattagtcaacaaaaattatgatattttcatttatgtttactattaatgtatacagatttatagttccaaacattaaaaaacagataaaaaccactctctacttaaccatcatgcccctatatatatatgttttgttctgtcttttgtgtatactatacactaatttcattacaaaccaaactaaaataatatacatcgttcatttcatattcaacagaaggaatcggttttaaaactcaaagagaaaa。
[0018]
本发明的第二个目的是提供一种含有拟南芥高温诱导启动子phtg1的重组载体。在本发明的一个实施方式中,其重组载体的构建方法为:以htg1_prof和htg1_pror为引物扩增如seq id no.1所示启动子的全长序列,将克隆到的启动子序列连接入下游含有β-葡萄糖苷酸酶基因gus标签的pmdc163载体中,得到pat1g13609::gus重组载体。
[0019]
本发明的第三个目的是提供拟南芥高温诱导启动子phtg1在启动受高温诱导的目的基因表达中的应用。在一种实施方式中,所述目标植物以pmdc163为载体,由热响应启动子驱动目的基因的β-葡萄糖苷酸酶基因gus表达。在本发明的一个实施方式中,所述高温诱导指在38℃诱导。
[0020]
本发明的第四个目的是提供拟南芥高温诱导启动子phtg1在耐高温植物学研究或植物遗传改良中的应用。
[0021]
本发明将如seq id no.1所示的拟南芥高温诱导启动子phtg1序列和下游gus标签的pmdc163载体转化至eha105宿主农杆菌;通过农杆菌介导的拟南芥遗传转化将其导入到拟南芥哥伦比亚型中,得到转基因拟南芥植株。t3代纯合的转基因株系中gus染色验证,结果表明pat1g13609::gus在子叶中表达,高温处理2h后表达开始被增强,在高温处理8h时,莲座叶及根毛区gus染色程度增加。
[0022]
本发明的技术效果是:本发明将启动子序列连接gus标签后转化拟南芥,在转基因植株中用gus染色方法证明其确实可以受38℃高温高效诱导表达。从而可作为高温诱导型启动子用于作物遗传改良,对于克服现有的遗传改良技术的缺陷和基因调控序列资源的不足,丰富基因序列资源和提高植物耐高温能力具有重要意义。
附图说明
[0023]
图1为高温处理下htg1的相对表达量(qrt-pcr结果);
[0024]
图2为高温处理下标记基因的表达分析(gus染色结果)。
具体实施方式
[0025]
以下结合实施例来进一步说明本发明。下述实施例的方法,如无特殊说明,均为常规方法。下述实施例中的试剂如无特殊说明,均为市售产品。
[0026]
实施例1:筛选拟南芥高温诱导基因
[0027]
将野生型哥伦比亚拟南芥种子消毒后播在ms培养基上,4℃下避光春化2天,然后转到18℃正常生长条件下,以16小时光照/8小时黑暗培养7天。将生长的拟南芥植株转到28℃高温下,分别处理0、3、12、48h后,用植物总rna提取试剂盒(tiangen,rnaprep pure)提取对照组(正常温度)和处理组植株的总rna,利用rnaseq技术(深圳华大基因)筛选到一个高温诱导下显著高表达的基因,将其命名为htg1(high-temperature induced gene 1)。如表1所示,其表达可被高温高效诱导。
[0028]
表1高温处理下htg1的相对表达量(rnaseq结果)
[0029][0030]
实施例2:高温诱导基因htg1表达量的验证
[0031]
将野生型哥伦比亚拟南芥种子消毒后播在ms培养基上,4℃下避光春化2天,然后转到18℃条件下,以16小时光照/8小时黑暗培养7天。将生长的拟南芥植株转到38℃高温
下,分别处理0、1、2、4、8、16h后,用植物总rna提取试剂盒(tiangen,rnaprep pure)提取植株的总rna。以rna为模板进行反转录(takara,primescript
tm
ii 1st strand cdna synthesis kit),然后以合成的cdna为模板,以内源看家基因actin2为内参进行qrt-pcr,以分析htg1的表达量。如图1所示,其在高温诱导1、2、4、8和16h后,其表达量分别为正常温度下的2.8、3.7、2.0、6.2和24.7倍,证明该基因确实可被高温高效诱导。
[0032]
实施例3:高温诱导基因htg1的启动子序列的分析和克隆
[0033]
在拟南芥相关公共数据库(https://www.arabidopsis.org/)上查找到htg1基因,其基因座号为at1g13609。选取该基因翻译起始密码子位点上游1133个碱基作为启动子区域(序列如seq id no:1)。
[0034]
以htg1_prof(5
’-
agcaatcttcgcctaacc-3
’
,seq id no:2)和htg1_pror(5
’-
ttttctcttt gagttttaa-3
’
,seq id no:3)为引物扩增该启动子的全长序列,将克隆到的启动子序列连接入下游含有β-葡萄糖苷酸酶基因(gus)标签的pmdc163载体中。
[0035]
实施例4:含启动子序列载体的遗传转化
[0036]
将含有启动子序列和下游gus标签的pmdc163载体转化至eha105宿主农杆菌。
[0037]
通过农杆菌介导的拟南芥遗传转化将其导入到拟南芥哥伦比亚型中,转化共获得30株独立的转基因拟南芥植株。具体步骤:将抽薹的植物上已开的花和角果剪掉,保留未开放的花蕾;将要转化植物的农杆菌接种到含有卡那霉素50mg/l的lb(luria-bertani)液体培养基中,28℃ 220rpm过夜培养至od
600
约为1.6;室温下6000rpm离心10min收集菌体;倒掉上清,加入等体积浸染液(5.0%蔗糖溶液+0.025%(v/v)silwet-l77)重悬菌体;重悬好的菌液放入培养皿中,将拟南芥的花茎在浸染液中充分浸泡;转化完毕的植株浇水并用塑料袋罩住保湿暗培养,约12h后去掉塑料袋正常培养;转化3周后收取转基因材料种子,在含潮霉素20mg/l的1/2ms培养基上筛选获得的t1代转基因阳性苗,t1代植株自交一代收取t2代种子,通过t2代抗性分离比可以确定各株系转基因插入的拷贝数;自交一代收取t3代种子,通过抗性分离比选择纯合的t3代转基因株系。
[0038]
实施例5:gus染色验证启动子能被高温诱导
[0039]
为进一步验证上述启动子能被高温诱导,我们将t3代纯合的转基因株系在1/2ms培养基上于22℃光照培养10天,然后转到38℃下高温处理转基因材料0、1、2、4、8、16h后,对植株进行gus染色。具体步骤为:将植物材料放置于90%的丙酮中固定20min,用漂洗液漂洗3次,加入gus染液进行染色处理。染色结束后,用70%乙醇脱色完全后,用显微镜记录结果。如图2所示,pat1g13609::gus在子叶中表达,高温处理2h后表达开始被增强,在高温处理8h时,莲座叶及根毛区gus染色程度增加。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



