一种神经束膜细胞的体外培养及纯化方法与流程
 2021-02-02 10:02:33|
2021-02-02 10:02:33| 323|
323| 起点商标网
起点商标网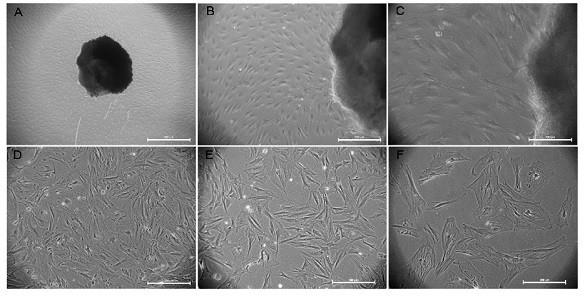
[0001]
本发明涉及生物医学技术领域,具体地说,是一种神经束膜细胞的体外培养及纯化方法。
[0002]
背景技术:
[0003]
周围神经损伤修复的研究比较广泛,但目前对于长距离周围神经缺损的治疗亟需攻克。周围神经由若干神经纤维束组成,神经表面有神经外膜包裹,而在神经纤维束的表面包有神经束膜;在神经纤维束内的每条神经纤维表面有神经内膜包绕;神经外膜、神经束膜和神经内膜内均有成纤维细胞分布,施万细胞形成髓鞘包绕轴突。神经束膜参与组成血-神经屏障[morris ad, lewis gm, kucenas s. perineurial glial plasticity and the role of tgf-β in the development of the blood-nerve barrier. j neurosci, 2017, 37(18):4790-4807.],分为外层和内层,外层为结缔组织,内层为7-8层神经束膜细胞通过紧密连接构成,对进入神经纤维束的大分子物质起屏障作用。可见,周围神经内除了神经元的轴突外,还包含有成纤维细胞、神经束膜细胞和施万细胞等多种细胞。近年来对于神经束膜细胞的研究显示,其除了形成血-神经屏障,还对周围神经损伤的修复有重要作用,如在受损区域形成神经束膜桥、吞噬细胞碎片、与施万细胞相互作用等[kucenas s. perineurial glia. cold spring harb perspect biol, 2015, 7(6):a020511.]。在周围神经受损后,神经束膜细胞率先向受损处迁移并吞噬细胞碎片,早于施万细胞的启动,形成细胞桥以桥接神经缺损处;而施万细胞的迁移和轴突的再生则在此之后发生[schr
ö
der j, may r, weis j. perineurial cells are the first to traverse gaps of peripheral nerves in silicone tubes. clin neurol neurosurg, 1993, 95[suppl]:s78-s83. lewis gm, kucenas s. perineurial glia are essential for motor axon regrowth following nerve injury. j neurosci, 2014, 34(38):12762-12777.]。因此,神经束膜细胞有希望成为多细胞动员治疗长距离神经缺损的关键细胞,值得深入研究。
[0004]
体外培养纯度高活性强的神经束膜细胞对于研究周围神经损伤修复的相关机制十分关键。目前关于神经束膜细胞的体外培养国内尚未见报道,国外少有报道,且国外的报道仅采用反复贴块的方法[peltonen j, jaakkola s, virtanen i,pelliniemi l. perineurial cells in culture. an immunocytochemical and electron microscopic study. lab invest, 1987, 57(5):480-488.],该方法采用含10%血清的dulbecco改良eagle培养基(dulbecco's modified eagle media, dmem)培养神经段,经过1~10次反复贴块,90%以上的组织块迁出的细胞为混和细胞,其中包括神经束膜细胞、成纤维细胞及施万细胞;仅有1%~5%的组织块迁出较纯的神经束膜细胞。该方法耗时久且细胞纯度不高。
技术实现要素:
[0005]
本发明的目的在于提供一种神经束膜细胞的体外培养及纯化方法,能快速高效地
在体外纯化培养神经束膜细胞,同时保证神经束膜细胞生长状态良好,为深入研究周围神经损伤修复的机制提供稳定的细胞来源。
[0006]
神经束膜细胞的培养难点在于其增殖及迁出缓慢,而且容易受到成纤维细胞及施万细胞的污染。针对神经束膜细胞迁出困难的问题,本发明人曾先将神经束膜的组织块剪碎,进而采用酶反复消化法处理组织块(0.2%胶原酶+0.05%胰酶混合液于饱和湿度、5%co
2
、37℃培养箱中处理剪碎的组织块,5~10min后用玻璃吸管吸取呈黏稠状的神经束膜组织于离心管内吹打,获取细胞悬液),但此方法对神经束膜细胞伤害较大,镜下观察细胞不贴壁,且有较多悬浮碎屑。因此本发明仍选择原代贴块培养的方法,但将神经束膜从神经段上剥离下来进行贴块,以减少施万细胞的污染;同时对培养基进行改进,添加2 μmol/l 毛喉素(forskolin)和 12.5 ng/ml神经调节蛋白-beta 1(heregulin-β1)以促进原代组织块中细胞的增殖和迁移能力,6天左右组织块周围有较多细胞爬出,且细胞生长状态良好。针对成纤维细胞和施万细胞污染的技术难点,本发明采用“限时消化-差速贴壁-化学药物”的纯化方案,价廉高效且简易可行。目前文献报道较多的是关于施万细胞的纯化,采用差速贴壁30min或者10~15min连续两次以及化学纯化(培养基内添加10μmol/l或1 nmol/l阿糖胞苷)的方法去除成纤维细胞[张雪宝,曾园山,陈穗君. 一种快速、经济、省时的施万细胞体外培养和纯化方法. 解剖学报,2007,38(5):628-630. 严广斌,卢永辉,钱东阳,白波. 施万细胞从兔变性坐骨神经中的分离、纯化和培养. 广东医学,2013,34(20):3108-3110. wei y, zhou j, zheng z, wang a, ao q, gong y, zhang x.an improved method for isolating schwann cells from postnatal rat sciatic nerves. cell tissue res, 2009, 337(3):361-369.],施万细胞的纯化过程主要是解决成纤维细胞的污染问题,而神经束膜细胞的培养同时存在成纤维细胞和施万细胞两种细胞的污染。本发明通过胰酶限时消化10s去除施万细胞,差速贴壁30min初步去除成纤维细胞,并对化学药物阿糖胞苷的作用浓度进行了筛选。实验结果显示,阿糖胞苷的浓度提升至100μmol/l时可以最大程度地去除成纤维细胞而不影响神经束膜细胞的生长状态。本发明的方法可以成功去除在神经束膜细胞培养过程中成纤维细胞和施万细胞的污染,并可以在两周左右获得纯度高达97.66%、生长状态良好的神经束膜细胞,可为研究周围神经损伤修复的作用机制提供稳定的细胞来源。
[0007]
为了实现上述目的,本发明采用以下技术方案:本发明提供一种神经束膜细胞的体外培养及纯化方法,包括如下步骤:(a)取sprague dawley( sd)大鼠坐骨神经,分离获得神经束膜,将其贴块培养得到混合生长的神经束膜细胞、成纤维细胞和施万细胞;(b)先运用限时消化法去除施万细胞,然后用差速贴壁法初步去除成纤维细胞;(c)重复上述操作1次;(d)运用化学药物阿糖胞苷进一步去除成纤维细胞。
[0008]
进一步的,所述的步骤(a)中神经束膜细胞完全培养基以富含营养因子复合物f-12的dmem(dmem/f12)为基础,内含10% v/v 胎牛血清、2μmol/l 毛喉素(forskolin,sigma)和12.5ng/ml神经调节蛋白-beta 1( heregulin-β1,peprotech),1% v/v 青霉素-链霉素(penicillin-streptomycin,corning)。神经束膜细胞增殖迁移缓慢,本发明为促进其从组织块迁出及增殖,提高细胞培养效率,在培养基内加入适宜浓度的细胞因子forskolin和
heregulin-β1。forskolin作用为通过激活细胞内腺苷酸环化酶来促进神经束膜细胞增殖。heregulin-β1可促进神经束膜细胞的迁移能力。
[0009]
进一步的,所述的步骤(a)中将分离获得的神经束膜,预冷的无菌磷酸盐缓冲溶液(phosphate buffered solution, pbs)清洗,迅速将其置于细胞培养板中,在饱和湿度、5%co
2
、37℃培养箱中培养;此后每3天换液,培养10天左右。
[0010]
更进一步的,所述的步骤(a)中分离获得神经束膜的方法为:取sd大鼠坐骨神经,在解剖显微镜下仔细剥除神经外膜,将神经束剪成约1mm节段并纵切成两半,从切面尽量剔除神经纤维,分离获得片状的神经束膜。
[0011]
进一步的,所述的步骤(b)中限时消化法去除施万细胞的方法为:在细胞培养板中加入0.25%胰酶停留10s后迅速加入神经束膜细胞的完全培养基终止消化,此时施万细胞变圆,轻轻摇晃细胞培养板,施万细胞脱落,而神经束膜细胞和成纤维细胞仍然紧贴板底。
[0012]
进一步的,所述的步骤(b)中差速贴壁法初步去除成纤维细胞的方法为:将上述步骤中剩余的细胞用0.25%胰酶消化2min,离心获得细胞,用神经束膜细胞的完全培养基重悬细胞并接种于t75培养瓶内;将培养瓶移入培养箱内,37℃、5% co
2
孵育30min;30min后吸出悬液重新接种;培养3天。
[0013]
进一步的,所述的步骤(d)具体为:选择关键时间点,用适宜浓度的阿糖胞苷进一步去除生长迅速的成纤维细胞。更进一步的,将前述步骤获得的细胞重新接种24小时后,向神经束膜细胞完全培养基中加入100μmol/l的阿糖胞苷作用24h,之后更换为完全培养基继续培养2天。
[0014]
本发明优点在于:1、培养基的优化:神经束膜细胞增殖迁移缓慢,本发明为促进其从组织块迁出及增殖,提高细胞培养效率,10天左右可以将原代组织块迁出的细胞进行传代培养。神经束膜细胞完全培养基以dmem/f12为基础,内含10%胎牛血清、2 μmol/l forskolin(sigma)和 12.5 ng/ml heregulin-β1(peprotech),1% penicillin-streptomycin(corning)。本发明添加细胞因子量与其他文献不同。forskolin作用为通过激活细胞内腺苷酸环化酶来促进神经束膜细胞增殖。heregulin-β1可促进神经束膜细胞的迁移能力。而国外有关神经束膜细胞培养的已有文献中仅采用含10%血清的dmem培养基[peltonen j,jaakkola s,virtanen i,pelliniemi l.perineurial cells in culture. an immunocytochemical and electron microscopic study. lab invest, 1987, 57(5):480-488.]。
[0015]
2、取材的优化:本发明原代操作尽可能准确获取神经束膜组织,原代细胞较国外采用神经段贴块的方法纯度高。
[0016]
3、培养时间短,细胞纯度高:采用“限时消化-差速贴壁-化学药物”的纯化方式,与国外反复贴块法相比极大地缩短了神经束膜细胞的培养时间,共为两周左右,其中细胞纯化的时间约为6天,且细胞纯度(达97.66%)及生长状态得以提升。国外方法经过1~10次反复贴块,1次贴块培养约10天,从90%以上的组织块内迁出的均为混合细胞,包括神经束膜细胞、成纤维细胞及施万细胞,仅有1%~5%的组织块内迁出较纯的神经束膜细胞。
[0017]
4、化学药物浓度的筛选:在“限时消化-差速贴壁”之后,选择合适的药物浓度,在较为彻底地去除成纤维细胞的同时,最大程度地减少对神经束膜细胞的影响,保证神经束膜细胞生长状态良好。
[0018]
本发明建立了一种快速高效的体外纯化培养神经束膜细胞的方法,为深入研究神经束膜细胞在周围神经损伤修复中的作用及机制提供了稳定细胞来源。
附图说明
[0019]
图1. 神经束膜细胞的原代及纯化培养;a. b. c. 神经束膜细胞原代培养9天。a:标尺=500
µ
m;b:标尺=200
µ
m;c:标尺=100
µ
m;d. 未经纯化的神经束膜细胞传代培养,标尺=200
µ
m;e. 经“限时消化-差速贴壁”纯化的神经束膜细胞,标尺=200
µ
m;f. 经“限时消化-差速贴壁-化学药物”纯化的神经束膜细胞,标尺=200
µ
m。
[0020]
图2. 不同筛选方法下的细胞免疫细胞化学鉴定,标尺=100
µ
m;a. claudin-1免疫荧光染色;b. vimentin免疫荧光染色;c. s100免疫荧光染色;其中:1. 未经纯化的细胞;2. 经“限时消化-差速贴壁”纯化的细胞;3. 经“限时消化-差速贴壁-化学药物”纯化的细胞。
[0021]
图3. 不同筛选方法下的细胞免疫细胞化学染色阳性率统计图;
*
p<0.05 vs 未纯化组;
#
p<0.05 vs
ꢀ“
限时消化-差速贴壁”纯化组。
[0022]
图4. 不同药物浓度对细胞纯化的影响,标尺=200
µ
m;a. 经“限时消化-差速贴壁”纯化的细胞,无药物处理;b. 经“限时消化-差速贴壁”纯化+10μmol/l药物纯化的细胞;c. 经“限时消化-差速贴壁”纯化+100μmol/l药物纯化的细胞。
[0023]
图5. 不同药物浓度对细胞纯化的影响,免疫细胞化学鉴定,标尺=100
µ
m;a.claudin-1免疫荧光染色;b.vimentin免疫荧光染色;c.s100免疫荧光染色;其中:1. 经“限时消化-差速贴壁”纯化的细胞,无药物处理;2. 经“限时消化-差速贴壁”纯化+10μmol/l药物纯化的细胞;3. 经“限时消化-差速贴壁”纯化+100μmol/l药物纯化的细胞。
[0024]
图6. 不同药物浓度对细胞纯化影响的免疫细胞化学染色阳性率统计图;
*
p<0.05 vs 0μmol/l药物组;
#
p<0.05 vs 10μmol/l 药物组。
[0025]
具体实施方式
[0026]
下面结合实施例对本发明提供的具体实施方式作详细说明。
[0027]
实施例1:神经束膜细胞的分离、培养、纯化及鉴定步骤:取100g左右的sd大鼠,取其坐骨神经,在解剖显微镜下仔细剥除神经外膜,将神经束剪成约1mm节段并纵切成两半,从切面尽量剔除神经纤维,分离获得片状的神经束膜,预冷的无菌pbs清洗,迅速将其置于细胞培养板中,在饱和湿度、5%co
2
、37℃培养箱中培养。此后每3天换液,培养10天左右,当组织块周围有较多细胞爬出时,传代,倒置相差显微镜下观察,记录其生长、增殖情况。
[0028]
神经束膜细胞完全培养基为dmem/f12,内含10%胎牛血清、2μmol/l forskolin(sigma)和12.5ng/ml heregulin-β1(peprotech),1% penicillin streptomycin
(corning)。神经束膜细胞增殖迁移缓慢,本发明为促进其从组织块迁出及增殖,提高细胞培养效率,在培养基内加入适宜浓度的细胞因子forskolin和heregulin-β1。forskolin作用为通过激活细胞内腺苷酸环化酶来促进神经束膜细胞增殖。heregulin-β1可促进神经束膜细胞的迁移能力。
[0029]
神经束膜细胞形态大而宽扁,增殖较慢。成纤维细胞形态不规则,呈梭形、多角形和扁平星形等,增殖迅速。施万细胞形态较小,大多呈双极梭形,有两个细长突起,少数呈多个细胞突起。原代培养过程中,细胞从组织块迁出,镜下可见3种形态的细胞均有分布(图1中的a~c)。未经纯化的传代培养细胞中,3种细胞也均有分布(图1中的d,图2中的a1、b1、c1)。
[0030]
神经束膜细胞标记物为claudin-1,成纤维细胞标记物为vimentin,施万细胞标记物为s100。对免疫细胞化学染色结果阳性率的统计分析显示(图3),未经纯化的传代培养细胞中,claudin-1阳性率为42.33%,vimentin阳性率为50.33%,s100阳性率为15%。因此,未经纯化的细胞中,3种细胞均有分布。
[0031]
实施例2:神经束膜细胞的“限时消化-差速贴壁”纯化及鉴定1. 限时消化去除施万细胞原理:细胞生长至融合时,根据细胞对胰酶的反应时间存在差异,采用限时消化法分离施万细胞与神经束膜细胞、成纤维细胞。施万细胞对胰酶的反应敏感,约10秒,而胰酶消化神经束膜细胞和成纤维细胞的时间较长,约需2-3分钟。
[0032]
步骤:在培养板中加入0.25%胰酶停留10s后迅速加入神经束膜细胞的完全培养基终止消化,此时施万细胞变圆,轻轻摇晃细胞板,施万细胞脱落,而神经束膜细胞和成纤维细胞仍然紧贴板底。
[0033]
2. 差速贴壁初步去除成纤维细胞原理:根据不同细胞贴壁速度存在差异,成纤维细胞贴壁速度较快,约为10~15min,而神经束膜细胞贴壁较慢,超过30min。因此可应用差速贴壁法初步去除混合生长于神经束膜细胞中的成纤维细胞。
[0034]
步骤:将剩余的细胞用0.25%胰酶消化2min,离心获得细胞沉淀,用神经束膜细胞的完全培养基重悬细胞接种于t75培养瓶内。将培养瓶移入培养箱内,37℃、5% co
2
孵育30 min。30 min后吸出悬液重新接种;此时成纤维细胞初步去除,3天后重复上述两步操作。
[0035]
镜下观察可见,经“限时消化-差速贴壁”纯化后的细胞中未见施万细胞,大部分为大而宽扁的神经束膜细胞,但仍有成纤维细胞分布(图1中的e,图2中的a2、b2、c2)。对免疫细胞化学染色结果的统计分析显示(图3),claudin-1阳性率为65%,vimentin阳性率为37.66%,s100为阴性。因此经过“限时消化-差速贴壁”纯化后,可成功去除施万细胞,但此时神经束膜细胞内仍夹杂部分成纤维细胞。
[0036]
实施例3:神经束膜细胞的“限时消化-差速贴壁-化学药物”纯化及鉴定原理:阿糖胞苷是一种通过抑制dna多聚酶来影响dna的合成与复制的嘧啶类抗代谢药物,主要作用于细胞s增殖期。它可以抑制增殖迅速的细胞(如成纤维细胞)的生长,而对增殖缓慢的细胞(如神经束膜细胞)影响不大。根据成纤维细胞贴壁及分裂增殖的速度快,通常在接种24h后开始增殖,早于神经束膜细胞分裂增殖速度。因此选择在重新接种细胞培养24h后,向其中加入适宜浓度的阿糖胞苷作用于剩余的成纤维细胞,可充分提高神经束膜细
胞的纯度,且对神经束膜细胞的生长状态影响较小。
[0037]
步骤:为了筛选适宜的药物浓度,重新接种细胞培养24h后,向神经束膜细胞完全培养基中分别加入浓度梯度为0μmol/l(control)、10μmol/l、100μmol/l的阿糖胞苷作用于细胞24h,其后换液,培养细胞2天后效果明显,做细胞鉴定。
[0038]
结果:镜下观察可见,经“限时消化-差速贴壁-化学药物”纯化后,随着阿糖胞苷浓度的提高,成纤维细胞的数量明显下降,神经束膜细胞的纯度显著提高(图4,图5)。当阿糖胞苷浓度达到100μmol/l时,可见较纯的大而宽扁的神经束膜细胞,且细胞生长状态较好(图1中的f,图2中的a3、b3、c3)。不同阿糖胞苷浓度对细胞纯化影响的免疫细胞化学染色结果统计分析显示(图6),经过“限时消化-差速贴壁”纯化的细胞中,claudin-1阳性率为65%,vimentin阳性率为37.66%,s100为阴性;经过“限时消化-差速贴壁”+10μmol/l阿糖胞苷纯化的细胞,claudin-1阳性率为82.33%,vimentin阳性率为23%,s100为阴性;经过“限时消化-差速贴壁”+100μmol/l阿糖胞苷纯化的细胞,claudin-1阳性率为97.66%,vimentin阳性率为5.66%,s100为阴性;因此,经“限时消化-差速贴壁”+100μmol/l阿糖胞苷纯化后的细胞,较“限时消化-差速贴壁”纯化组及“限时消化-差速贴壁”+10μmol/l阿糖胞苷纯化组效果好,且差异有统计学意义(p<0.05)。对不同筛选条件下的细胞免疫细胞化学鉴定结果统计分析(图3),经“限时消化-差速贴壁”+100μmol/l阿糖胞苷纯化后的细胞,较未纯化组及“限时消化-差速贴壁”纯化组的效果好,且差异有统计学意义(p<0.05)。因此经过“限时消化-差速贴壁”+100μmol/l阿糖胞苷纯化后可获得纯度较高且生长状态良好的神经束膜细胞。
[0039]
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



