四苯乙烯型化合物及其应用和使用其的电子器件的制作方法
 2021-02-02 10:02:09|
2021-02-02 10:02:09| 344|
344| 起点商标网
起点商标网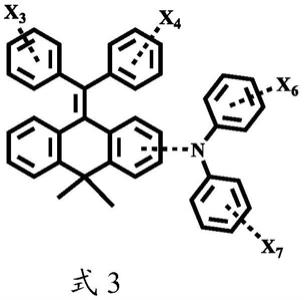
[0001]
本发明涉及有机光电材料技术领域,更为具体来说,本发明涉及一种四苯乙烯型化合物及其应用和使用其的电子器件。
背景技术:
[0002]
有机电子器件是指由阳极、阴极及夹在阳极和阴极之间的有机层构成的器件,包括有机发光二极管、有机太阳能电池、有机半导体、有机晶体等。其工作原理为在电极上施加外加电压,将空穴和电子注入有机层中形成激子,从而辐射发光,比如有机发光二极管;或外部光源被有机材料吸收形成激子,而激子分离成空穴、电子被传递至电极而储存,比如有机太阳能电池。以下主要描述有机发光二极管。
[0003]
有机发光二极管是将电能转化为光能的器件,其结构通常包括阳极、阴极及置于其之间的一层或多层有机材料层。有机材料层根据功能分为空穴注入材料层、空穴传输材料层、电子注入材料层、电子传输材料层和发光材料层。此外,发光材料根据发光颜色又分为蓝色、天蓝色、绿色、黄色、红色和深红色等发光材料。
[0004]
有机发光二极管的评价指标主要为电压、效率和寿命,如何开发低电压、高效率和长寿命的有机发光二极管器件一直是研发界和商业界追求的目标,这需要高迁移率的电子/空穴注入和传输材料,还需要高效率的发光材料以及器件中电子和空穴的有效平衡。另外,从有机材料的可量产性角度出发,也必须考虑材料的蒸镀类型(升华型或熔融型)、分解温度、玻璃化转变温度和放气现象等。特别是量产中需要蒸镀较厚的空穴传输材料,这种材料中的升华型材料会严重影响量产膜厚的均匀性,所以开发熔融型的空穴传输材料也成为一个重要方向。
技术实现要素:
[0005]
本发明创新地提供了一种四苯乙烯型化合物及其应用和使用其的电子器件,有机材料包含芳胺和刚性四苯乙烯结构,其芳胺能够有效提高有机材料的空穴注入和传输性能,刚性的四苯乙烯结构有利于形成熔融型蒸镀材料。
[0006]
为实现上述的技术目的,一方面,本发明公开了一种四苯乙烯型化合物。所述四苯乙烯型化合物的结构通式如下述式1所示:
[0007]
[0008]
式中,x
1
选自o、n-x
11
或s;
[0009]
x
2
、x
3
、x
4
和x
5
相互独立地选自结构通式如下式2所示的芳胺、氢、碳数为1~22的烷基、碳数为1~22的烷氧基或碳数为1~22的杂烷基、单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,其中,所述杂烷基的杂原子为o、n、f、s或si,所述杂芳基的杂原子为si、ge、n、p、o、s或se,而且x
2
、x
3
、x
4
和x
5
中至少有一个为结构通式如下
[0010]
式2所示的芳胺:
[0011][0012]
x
6
、x
7
、x
8
、x
9
、x
10
和x
11
相互独立地选自氢、碳数为1~22的烷基、碳数为1~22的烷氧基或碳数为1~22的杂烷基、单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,其中,所述杂烷基的杂原子为o、n、f、s或si,所述杂芳基的杂原子为si、ge、n、p、o、s或se,或者x
2
、x
3
、x
4
、x
5
、x
6
、x
7
、x
8
、x
9
、x
10
和x
11
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环;
[0013]
表述为“取代或未取代”时的所述芳基和杂芳基各自的任选取代基相互独立地选自h、卤素、-oh、-sh、-cn、-no
2
、碳数为1~15的烷硫基、碳数为1~40的烷基或碳数为1~40的取代烷基。
[0014]
进一步地,对于所述四苯乙烯型化合物,x
1
的结构通式为所述四苯乙烯型化合物的结构通式如下述式3所示:
[0015][0016]
式中,x
3
、x
4
、x
6
和x
7
相互独立地选自单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,或者x
3
、x
4
、x
6
和x
7
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环。
[0017]
进一步地,对于所述四苯乙烯型化合物,所述四苯乙烯型化合物的结构由下述通式301-式320中的任一式表示:
[0018][0019]
进一步地,对于所述四苯乙烯型化合物,x
1
的结构通式为o,所述化合物的结构通式如下述式4所示:
[0020][0021][0022]
式中,x
3
、x
4
、x
6
和x
7
相互独立地选自单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,或者x
3
、x
4
、x
6
和x
7
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环。
[0023]
进一步地,对于所述四苯乙烯型化合物,所述四苯乙烯型化合物的结构由下述通式401-式420中的任一式表示:
[0024][0025]
进一步地,对于所述四苯乙烯型化合物,x
1
的结构通式为n-ph,所述四苯乙烯型化合物的结构通式如下述式5所示:
[0026]
[0027]
式中,x
3
、x
4
、x
6
和x
7
相互独立地选自单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,或者x
3
、x
4
、x
6
和x
7
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环。
[0028]
进一步地,对于所述四苯乙烯型化合物,所述四苯乙烯型化合物的结构由下述通式501-式520中的任一式表示:
[0029][0030]
为实现上述的技术目的,另一方面,本发明公开了一种上述四苯乙烯型化合物在电子器件中作为电致发光有机材料的应用。
[0031]
为实现上述的技术目的,又一方面,本发明公开了一种电子器件。所述电子器件包括基底、阳极、阴极和置于所述阳极和所述阴极之间的一个或多个有机材料层,所述一个或多个有机材料层中至少一层包含上述四苯乙烯型化合物。
[0032]
进一步地,对于所述电子器件,所述有机材料层包括空穴注入层、空穴传输层、电子注入层、以及电子传输层和发光层。
[0033]
本发明的有益效果为:
[0034]
本发明实施例提供的四苯乙烯型化合物及其应用和使用其的电子器件,四苯乙烯型化合物包含芳胺和刚性四苯乙烯结构,其芳胺能够有效提高有机材料的空穴注入和传输性能,从而改善有机发光二极管的电子和空穴平衡,达到较低的电压和较高的效率;而刚性的四苯乙烯结构有利于形成熔融型蒸镀材料,从而有利于量产蒸镀的稳定性。这类材料能够实现高效率的电致发光器件制备,该材料可用于显示设备的制造。
具体实施方式
[0035]
下面对本发明提供的四苯乙烯型化合物及使用其的电子器件进行详细的解释和说明。
[0036]
本发明一个实施例提供的四苯乙烯型化合物的结构通式如下述式1所示:
[0037][0038]
式1中,x
1
选自o、n-x
11
或s;x
2
、x
3
、x
4
和x
5
相互独立地选自结构通式如下式2所示的芳胺、氢、碳数为1~22的烷基、碳数为1~22的烷氧基或碳数为1~22的杂烷基、单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,其中,杂烷基的杂原子为o、n、f、s或si,杂芳基的杂原子为si、ge、n、p、o、s或se,而且x
2
、x
3
、x
4
和x
5
中至少有一个为结构通式如下式2所示的芳胺:
[0039][0040]
上述各式中,x
6
、x
7
、x
8
、x
9
、x
10
和x
11
相互独立地选自氢、c1~c22的烷基、c1~c22的烷氧基或c1~c22的杂烷基、单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,其中,杂烷基的杂原子为o、n、f、s或si,杂芳基的杂原子为si、ge、n、p、o、s或se,或者x
2
、x
3
、x
4
、x
5
、x
6
、x
7
、x
8
、x
9
、x
10
和x
11
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环。
[0041]
其中,表述为“取代或未取代”时的芳基和杂芳基各自的任选取代基相互独立地选自h、卤素、-oh、-sh、-cn、-no
2
、c1~c15的烷硫基、c1~c40的烷基或c1~c40的取代烷基。
[0042]
可见,上述实施例的四苯乙烯型化合物包含刚性四苯乙烯结构和芳胺,其芳胺能够有效提高有机材料的空穴注入和传输性能,从而改善有机发光二极管的电子和空穴平衡,达到较低的电压和较高的效率;而刚性的四苯乙烯结构有利于形成熔融型蒸镀材料,从而有利于量产蒸镀的稳定性。
[0043]
作为本发明的一个优选方案,x
1
的结构通式可以为四苯乙烯型化合物的结构通式可以如下述式3所示:
[0044][0045][0046]
式中,x
3
、x
4
、x
6
和x
7
相互独立地选自单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,或者x
3
、x
4
、x
6
和x
7
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环。
[0047]
进一步来说,四苯乙烯型化合物的结构可以由下述通式301-式320中的任一式表示:
[0048][0049]
作为本发明的另一个优选方案,x
1
的结构通式可以为o,四苯乙烯型化合物的结构通式可以如下述式4所示:
[0050][0051]
式中,x
3
、x
4
、x
6
和x
7
相互独立地选自单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,或者x
3
、x
4
、x
6
和x
7
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环
或杂环的单环或稠环。
[0052]
进一步来说,四苯乙烯型化合物的结构可以由下述通式401-式420中的任一式表示:
[0053][0054]
作为本发明的又一个优选方案,x
1
的结构通式为n-ph,四苯乙烯型化合物的结构通式如下述式5所示:
[0055][0056]
式中,x
3
、x
4
、x
6
和x
7
相互独立地选自单个或多个取代或未取代的芳基、或者取代或未取代的杂芳基,或者x
3
、x
4
、x
6
和x
7
中至少2个为相邻的芳基或杂芳基时相互连接形成芳环或杂环的单环或稠环。
[0057]
进一步来说,四苯乙烯型化合物的结构由下述通式501-式520中的任一式表示:
[0058][0059]
本发明的另一个实施例提供上述四苯乙烯型化合物在电子器件中作为电致发光有机材料的应用。
[0060]
本发明的又一个实施例提供一种电子器件,该电子器件包括基底、阳极、阴极和置于阳极和阴极之间的一个或多个有机材料层,一个或多个有机材料层中至少一层包含上述实施例的四苯乙烯型化合物。其中,有机材料层可以包括空穴注入层、空穴传输层、电子注入层、以及电子传输层和发光层。在此,电子器件可以为电致发光器件,例如有机发光二极管器件。
[0061]
下面,对本发明上述实施例提供的四苯乙烯型化合物的制备方法进行说明。
[0062]
实施例1
[0063]
目标结构1的四苯乙烯型化合物的合成如过程式6所示:
[0064][0065]
实施例1提供的目标结构1的四苯乙烯型化合物的制备方法如下:
[0066]
在100ml的两口瓶中加入化合物(1)(6mmol,1.02g)、化合物(2)(5mmol,1.37g)、cui(0.3mmol,0.06g)、碳酸钾(k
2
co
3
,5mmol,0.69g)和50ml的1,4-二氧六环,在氩气氛围下,搅拌升温至100℃,反应12h。用二氯甲烷(300ml)溶解并加入饱和nh
4
cl(200ml)溶液,二氯甲烷萃取,有机相无水硫酸钠干燥,浓缩后进行柱分离,以200-300目的硅胶为固定相,二氯甲烷为淋洗剂,得到中间体1.64g的化合物(3),产率91%。
[0067]
在100ml的两口瓶中加入上步产物——化合物(3)(4.6mmol,1.64g)、化合物(4)(5.0mmol,2.26g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.15g的白色粉末状目标结构1,产率64%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,731.98;实测值m/z,731.12。元素分析法(ea):计算值碳c,91.89;氢h,6.20;氮n,1.91;实测值c,91.79;h,6.43;n,1.78。
[0068]
实施例2
[0069]
目标结构2的四苯乙烯型化合物的合成如过程式7所示:
[0070][0071]
实施例2提供的目标结构2的四苯乙烯型化合物的制备方法如下:
[0072]
100ml的两口瓶中加入化合物(5)(6mmol,1.02g)、化合物(6)(5mmol,1.45g)、cui(0.3mmol,0.06g)、碳酸钾(k
2
co
3
,5mmol,0.69g)和50ml的1,4-二氧六环,在氩气氛围下,搅拌升温至100℃,反应12h。用二氯甲烷(300ml)溶解并加入饱和nh
4
cl(200ml)溶液,二氯甲烷萃取,有机相无水硫酸钠干燥,浓缩后进行柱分离,以200-300目的硅胶为固定相,二氯甲烷为淋洗剂,得到中间体1.67g的化合物(7),产率85%。
[0073]
在100ml的两口瓶中加入上步产物——化合物(7)(4.3mmol,1.67g)、化合物(4)
(5.0mmol,2.26g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.41g的白色粉末状目标结构2,产率75%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,748.03;实测值m/z,748.57。元素分析法(ea):计算值碳c,91.52;氢h,6.60;氮n,1.87;实测值c,91.74;h,6.53;n,1.73。
[0074]
实施例3
[0075]
目标结构3的四苯乙烯型化合物的合成如过程式8所示:
[0076][0077]
实施例3提供的目标结构3的四苯乙烯型化合物的制备方法如下:
[0078]
在100ml的两口瓶中加入化合物(8)(5mmol,1.60g)、化合物(4)(5.5mmol,2.48g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.70g的白色粉末状目标结构3,产率80%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,674.87;实测值m/z,674.35。元素分析法(ea):计算值碳c,92.55;氢h,5.38;氮n,2.08;实测值c,92.10;h,5.56;n,2.34。
[0079]
实施例4
[0080]
目标结构4的四苯乙烯型化合物的合成如过程式9所示:
[0081][0082]
实施例4提供的目标结构4的四苯乙烯型化合物的制备方法如下:
[0083]
在100ml的两口瓶中加入化合物(9)(5mmol,1.70g)、化合物(4)(5.5mmol,2.48g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.55g
的白色粉末状目标结构4,产率72%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,709.38;实测值m/z,709.11。元素分析法(ea):计算值碳c,91.35;氢h,6.67;氮n,1.97;实测值c,91.57;h,6.03;n,2.40。
[0084]
实施例5
[0085]
目标结构5的四苯乙烯型化合物的合成如过程式10所示:
[0086][0087]
实施例5提供的目标结构5的四苯乙烯型化合物的制备方法如下:
[0088]
在100ml的两口瓶中加入化合物(9)(5mmol,1.70g)、化合物(10)(5.5mmol,2.48g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.31g的白色粉末状目标结构5,产率65%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,709.38;实测值m/z,709.15。元素分析法(ea):计算值碳c,91.35;氢h,6.67;氮n,1.97;实测值c,91.41;h,6.53;n,2.06。
[0089]
实施例6
[0090]
目标结构6的四苯乙烯型化合物的合成如过程式11所示:
[0091][0092][0093]
实施例6提供的目标结构6的四苯乙烯型化合物的制备方法如下:
[0094]
在100ml的两口瓶中加入化合物(3)(4.0mmol,1.45g)、化合物(11)(5.0mmol,2.13g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.20g的白色粉末状目标结构6,产率78%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,705.94;实测值m/z,705.19。元素分析法(ea):计算值碳c,91.18;氢h,5.57;氮n,1.98;实测值c,91.32;h,5.71;n,1.84。
[0095]
实施例7
[0096]
目标结构7的四苯乙烯型化合物的合成如过程式12所示:
[0097][0098]
实施例7提供的目标结构7的四苯乙烯型化合物的制备方法如下:
[0099]
在100ml的两口瓶中加入化合物(7)(4.0mmol,1.57g)、化合物(11)(5.0mmol,2.13g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得1.99g的白色粉末状目标结构7,产率69%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,721.94;实测值m/z,721.87。元素分析法(ea):计算值碳c,89.84;氢h,6.00;氮n,1.94;实测值c,90.05;h,5.92;n,1.99。
[0100]
实施例8
[0101]
目标结构8的四苯乙烯型化合物的合成如过程式13所示:
[0102][0103]
实施例8提供的目标结构8的四苯乙烯型化合物的制备方法如下:
[0104]
在100ml的两口瓶中加入化合物(8)(4.0mmol,1.28g)、化合物(11)(5.0mmol,2.13g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得1.86g的白色粉末状目标结构8,产率70%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,663.82;实测值m/z,663.19。元素分析法(ea):计算值碳c,90.47;氢h,5.01;氮n,2.11;实测值c,90.13;h,5.32;n,2.01。
[0105]
实施例9
[0106]
目标结构9的四苯乙烯型化合物的合成如过程式14所示:
[0107][0108]
实施例9提供的目标结构9的四苯乙烯型化合物的制备方法如下:
[0109]
在100ml的两口瓶中加入化合物(12)(4.0mmol,1.30g)、化合物(11)(5.0mmol,2.13g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.00g的白色粉末状目标结构9,产率73%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,683.9;实测值m/z,683.53。元素分析法(ea):计算值碳c,89.57;氢h,6.04;氮n,2.05;实测值c,89.37;h,6.21;n,1.86。
[0110]
实施例10
[0111]
目标结构10的四苯乙烯型化合物的合成如过程式15所示:
[0112][0113]
实施例10提供的目标结构10的四苯乙烯型化合物的制备方法如下:
[0114]
在100ml的两口瓶中加入化合物(12)(4.0mmol,1.30g)、化合物(13)(5.0mmol,2.13g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得1.67g的白色粉末状目标结构10,产率61%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,683.9;实测值m/z,683.64。元素分析法(ea):计算值碳c,89.57;氢h,6.04;氮n,2.05;实测值c,89.45;h,6.09;n,2.14。
[0115]
实施例11
[0116]
目标结构11的四苯乙烯型化合物的合成如过程式16所示:
[0117][0118]
实施例11提供的目标结构11的四苯乙烯型化合物的制备方法如下:
[0119]
在100ml的两口瓶中加入化合物(3)(4.6mmol,1.64g)、化合物(14)(5.0mmol,2.50g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.28g的白色粉末状目标结构11,产率73%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,781.02;实测值m/z,780.93。元素分析法(ea):计算值碳c,90.73;氢h,5.68;氮n,3.59;实测值c,90.85;h,5.72;n,3.43。
[0120]
实施例12
[0121]
目标结构12的四苯乙烯型化合物的合成如过程式17所示:
[0122][0123]
实施例12提供的目标结构12的四苯乙烯型化合物的制备方法如下:
[0124]
在100ml的两口瓶中加入化合物(7)(4.0mmol,1.57g)、化合物(14)(5.0mmol,2.50g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.07g的白色粉末状目标结构12,产率65%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,797.06;实测值m/z,797.53。元素分析法(ea):计算值碳c,90.42;氢h,6.07;氮n,3.51;实测值c,90.35;h,5.98;n,3.67。
[0125]
实施例13
[0126]
目标结构13的四苯乙烯型化合物的合成如过程式18所示:
[0127][0128]
实施例13提供的目标结构13的四苯乙烯型化合物的制备方法如下:
[0129]
在100ml的两口瓶中加入化合物(8)(4.0mmol,1.28g)、化合物(14)(5.0mmol,2.50g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得2.13g的白色粉末状目标结构13,产率72%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,738.93;实测值m/z,738.69。元素分析法(ea):计算值碳c,91.03;氢h,5.18;氮n,3.79;实测值c,91.48;h,5.21;n,3.31。
[0130]
实施例14
[0131]
目标结构14的四苯乙烯型化合物的合成如过程式19所示:
[0132][0133]
实施例13提供的目标结构13的四苯乙烯型化合物的制备方法如下:
[0134]
在100ml的两口瓶中加入化合物(12)(4.0mmol,1.30g)、化合物(14)(5.0mmol,2.50g)、t-buona(8mmol,0.76g)、pd
2
(dba)
3
(0.09mmol,81mg)、p(t-bu)
3
/hbf
4
(0.92mmol,0.24g)和50ml除水除氧的甲苯,98℃反应过夜。降温至室温,反应液浓缩,柱层析分离纯化,得1.88g的白色粉末状目标结构14,产率62%。基质辅助激光解析电离飞行时间质谱仪(maldi-tof):计算值m/z,759.01;实测值m/z,759.25。元素分析法(ea):计算值碳c,90.20;氢h,6.11;氮n,3.69;实测值c,90.37;h,6.35;n,3.28。
[0135]
检测和实验验证
[0136]
经检测和实验验证,上述各个目标结构1-14的四苯乙烯型化合物的能级如下表1所示:
[0137]
表1
[0138][0139][0140]
按本领域已知方法制作本发明实施例提供的电子器件,以电子器件是电致发光器件为例,器件结构具体可以依次包括ito层、hat-cn层(比如厚度为5nm)、包含上述任一目标结构(比如厚度为30nm)的四苯乙烯型化合物的有机材料层、firpic:b3pypb层(12%,10nm)、tpbi层(比如厚度为40nm)、lif层(比如厚度为2nm)、以及铝al层(比如厚度为100nm)。经检测和实验验证,对于上述各个目标结构1-14的四苯乙烯型化合物,有机材料层包含该目标结构的四苯乙烯型化合物的该电致发光器件的性能数据如下表2所示:
[0141]
表2
[0142][0143][0144]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明实质内容上所作的任何修改、等同替换和简单改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签: 柱层析
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



