靶向SARS-CoV-2冠状病毒的抗体及其诊断和检测用途的制作方法
 2021-02-02 10:02:20|
2021-02-02 10:02:20| 348|
348| 起点商标网
起点商标网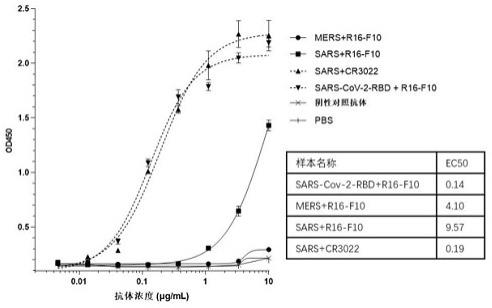
靶向sars-cov-2冠状病毒的抗体及其诊断和检测用途
技术领域
[0001]
本公开一般地涉及抗体及其用途。更具体地,本公开涉及特异性识别冠状病毒sars-cov-2刺突蛋白的抗体、其制备方法及用途。
背景技术:
[0002]
目前针对严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,sars-cov-2)临床上以对症支持治疗为主。考虑到此类冠状病毒持续危及人类健康,且具有高传播性和致死率等特点,很有可能引起更多的公共卫生问题,因此需要针对此类冠状病毒的致病机制开发出具有抑制或阻断病毒感染的预防和治疗性抗病毒剂以及开发快速筛查病毒感染的诊断试剂盒,为未来在人群中出现流行或甚至大范围地出现此类冠状病毒感染时提供针对它们的预防以及早期诊断和治疗,尤其是需要能够快速、高灵敏度和高特异性检测sars-cov-2病毒的检测产品。
技术实现要素:
[0003]
在一个方面,本公开提供了一种抗体对,其用于检测sars-cov-2病毒,所述抗体对包括部分i和部分ii,所述部分i包括如(a)、(b)和(c)所描述的一种或多种抗体或抗原结合片段;所述部分ii包括如(d)和(e)所描述的一种或多种抗体或抗原结合片段;其中,(a)包含如下的抗体:包含seq id no:5的氨基酸序列的重链cdr1(hcdr1)或其不超过2个氨基酸变化的变体;包含seq id no:6的氨基酸序列的重链cdr2(hcdr2)或其不超过2个氨基酸变化的变体;包含seq id no:7的氨基酸序列的重链cdr3(hcdr3)或其不超过2个氨基酸变化的变体;包含seq id no:8的氨基酸序列的轻链cdr1(lcdr1)或其不超过2个氨基酸变化的变体;包含seq id no:9的氨基酸序列的轻链cdr2(lcdr2)或其不超过2个氨基酸变化的变体;和包含seq id no:10的氨基酸序列的轻链cdr3(lcdr3)或其不超过2个氨基酸变化的变体;(b) 包含如下的抗体:seq id no: 3所示的重链可变区氨基酸序列中的hcdr1或其不超过2个氨基酸变化的变体;seq id no: 3所示的重链可变区氨基酸序列中的hcdr2或其不超过2个氨基酸变化的变体;seq id no: 3所示的重链可变区氨基酸序列中的hcdr3或其不超过2个氨基酸变化的变体;seq id no: 4所示的轻链可变区氨基酸序列中的lcdr1或其不超过2个氨基酸变化的变体;seq id no: 4所示的轻链可变区氨基酸序列中的lcdr2或其不超过2个氨基酸变化的变体;和seq id no: 4所示的轻链可变区氨基酸序列中的lcdr3或其不超过2个氨基酸变化的变体;(c) 包含如下的抗体:包含seq id no: 3所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链可变区;和包含seq id no: 4所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链可变区;(d) 包含如下的抗体:seq id no: 11所示的重链可变区氨基酸序列中的hcdr1或其不
超过2个氨基酸变化的变体;seq id no: 11所示的重链可变区氨基酸序列中的hcdr2或其不超过2个氨基酸变化的变体;seq id no: 11所示的重链可变区氨基酸序列中的hcdr3或其不超过2个氨基酸变化的变体;seq id no: 12所示的轻链可变区氨基酸序列中的lcdr1或其不超过2个氨基酸变化的变体;seq id no: 12所示的轻链可变区氨基酸序列中的lcdr2或其不超过2个氨基酸变化的变体;和seq id no: 12所示的轻链可变区氨基酸序列中的lcdr3或其不超过2个氨基酸变化的变体;(e) 包含如下的抗体:包含seq id no: 11所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链可变区;和包含seq id no: 12所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链可变区。
[0004]
在一些实施方案中,组(a)、(b)或(c)中的所述抗体还包含:igg1重链和/或kappa轻链。
[0005]
在一些实施方案中,组(a)、(b)或(c)中的所述抗体还包含:包含seq id no: 1所示氨基酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链恒定区和包含seq id no: 2所示氨基酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链恒定区;优选包含seq id no: 13所示核苷酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链恒定区和包含seq id no: 14所示核苷酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链恒定区。
[0006]
在一个方面,本公开提供了一种分离的抗体或其抗原结合片段,其特异性结合冠状病毒s蛋白,其中所述抗体是选自以下的至少一种抗体:(a) 包含如下的抗体:包含seq id no:5的氨基酸序列的重链cdr1(hcdr1)或其不超过2个氨基酸变化的变体;包含seq id no:6的氨基酸序列的重链cdr2(hcdr2)或其不超过2个氨基酸变化的变体;包含seq id no:7的氨基酸序列的重链cdr3(hcdr3)或其不超过2个氨基酸变化的变体;包含seq id no:8的氨基酸序列的轻链cdr1(lcdr1)或其不超过2个氨基酸变化的变体;包含seq id no:9的氨基酸序列的轻链cdr2(lcdr2)或其不超过2个氨基酸变化的变体;和包含seq id no:10的氨基酸序列的轻链cdr3(lcdr3)或其不超过2个氨基酸变化的变体;(b) 包含如下的抗体:seq id no: 3所示的重链可变区氨基酸序列中的hcdr1或其不超过2个氨基酸变化的变体;seq id no: 3所示的重链可变区氨基酸序列中的hcdr2或其不超过2个氨基酸变化的变体;seq id no: 3所示的重链可变区氨基酸序列中的hcdr3或其不超过2个氨基酸变化的变体;seq id no: 4所示的轻链可变区氨基酸序列中的lcdr1或其不超过2个氨基酸变化的变体;seq id no: 4所示的轻链可变区氨基酸序列中的lcdr2或其不超过2个氨基酸变化的变体;和seq id no: 4所示的轻链可变区氨基酸序列中的lcdr3或其不超过2个氨基酸变化的变体;(c) 包含如下的抗体:包含seq id no: 3所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链可变区;和包含seq id no: 4所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链可变区;
(d) 包含如下的抗体:seq id no: 11所示的重链可变区氨基酸序列中的hcdr1或其不超过2个氨基酸变化的变体;seq id no: 11所示的重链可变区氨基酸序列中的hcdr2或其不超过2个氨基酸变化的变体;seq id no: 11所示的重链可变区氨基酸序列中的hcdr3或其不超过2个氨基酸变化的变体;seq id no: 12所示的轻链可变区氨基酸序列中的lcdr1或其不超过2个氨基酸变化的变体;seq id no: 12所示的轻链可变区氨基酸序列中的lcdr2或其不超过2个氨基酸变化的变体;和seq id no: 12所示的轻链可变区氨基酸序列中的lcdr3或其不超过2个氨基酸变化的变体;或(e) 包含如下的抗体:包含seq id no: 11所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链可变区;和包含seq id no: 12所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链可变区。
[0007]
在一些实施方案中,组(a)、(b)或(c)中的所述抗体还包含:igg1重链和/或kappa轻链。
[0008]
在一些实施方案中,组(a)、(b)或(c)中的所述抗体还包含:包含seq id no: 1所示氨基酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链恒定区和包含seq id no: 2所示氨基酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链恒定区;优选包含seq id no: 13所示核苷酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链恒定区和包含seq id no: 14所示核苷酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链恒定区。
[0009]
在一些实施方案中,本公开的抗体表现出以下生物学活性中的至少一种:(a) 特异性结合sars-cov-2冠状病毒s蛋白rbd结构域,但不与sars-cov和mers冠状病毒交叉结合;(b) 特异性结合sars-cov-2冠状病毒s蛋白rbd结构域的ec50小于约0.05 μg/ml;或(c) 检测sars-cov-2冠状病毒s蛋白的灵敏度为最高可达1 ng/ml。
[0010]
在一个方面,本公开提供了一种分离的多核苷酸,其编码根据本公开的抗体或其抗原结合片段。
[0011]
在一个方面,本公开提供了一种分离的载体,其包含根据本公开的多核苷酸。
[0012]
在一个方面,本公开提供了一种宿主细胞,其包含根据本公开的多核苷酸或载体。
[0013]
在一个方面,本公开提供了一种表达本公开的抗体或其抗原结合片段的方法,所述方法包括在适于表达所述抗体或其抗原结合片段的条件下培养根据本公开的宿主细胞,以及任选地从所述宿主细胞或从培养基回收本公开的抗体或其抗原结合片段。
[0014]
在一个方面,本公开提供了一种检测sars-cov-2病毒的产品,其包括根据本公开的抗体对,优选地,所述产品是检测试纸或检测试剂盒。
[0015]
在一些实施方案中,组(a)、(b)和(c)所描述的一种或多种抗体或其抗原结合片段具有显色标记并且被用作标记抗体;并且组(d)和(e)所描述的一种或多种抗体或其抗原结合片段被固定并且被用作捕获抗体。
[0016]
在一些实施方案中,所述产品包括基底、样品区、结合区和反应区,其中沿着待测样品流动方向,所述样品区、结合区和反应区依次设置在所述基底上;所述反应区设置有检测区,所述检测区负载有组(d)和(e)中所描述的一种或多种抗体或其抗原结合片段;所述
结合区负载有具有显色标记的组(a)、(b)和(c) 中所描述的一种或多种抗体或其抗原结合片段。
[0017]
在一些实施方案中,所述反应区还设置有质控区,所述质控区负载有针对组(a)、(b)和(c)所描述的一种或多种抗体或其抗原结合片段的二级抗体,例如抗人fc二抗。
[0018]
在一些实施方案中,所述产品在所述反应区远离所述样品区的一侧还包括吸收区。
[0019]
在一些实施方案中,所述显色标记是胶体金标记或荧光标记。
[0020]
在一个方面,本公开提供了根据本文所述的抗体对在制备用于检测sars-cov-2病毒的产品中的用途。
[0021]
在一个方面,本公开提供了根据本文所述的在制备用于诊断sars-cov-2病毒感染的诊断剂中的用途。
[0022]
在一个方面,本公开提供了一种非诊断目的的检测sars-cov-2病毒的方法,其包括:提供样品,以及使用根据本公开的产品检测所述样品中的sars-cov-2病毒的存在,优选通过双抗体夹心法进行。在一些实施方案中,所述样品是环境样品。在另外一些实施方案中,所述样品是生物样品。
[0023]
该检测sars-cov-2病毒的方法包括诊断目的的检测方法和非诊断目的的检测方法。诊断目的的检测方法可以检测患者治疗前、后新冠病毒数量、活力的变化。非诊断目的的方法包括例如:1. 预防医学研究和公共卫生规定的制定:本领域技术人员知晓,现代医学分为两部分:预防医学和临床医学。本发明“非诊断目的的检测
……
方法”,在预防医学中可以对环境中采集的样本(包括人体分泌物)进行检测,对环境是否被污染进行判断,从而决策是否对该环境进行封锁、暂停营业、消杀等处置方式,并决策是否对这一地区、城市甚至更高层面升级传染病防控措施。从公共卫生角度出发对传染病进行预防,避免该环境残留的病毒成为传染源。
[0024]
2. 科学研究领域:(1)基础医学和生态学:例如,本领域技术人员可以对水样进行检测,以判断病毒的传播时间和广泛度。(2)病毒学方面产品的研发:本领域技术人员知晓,当多种病毒在同一宿主体内同时感染,可能产生病毒突变,包括病毒自身核酸的重组,或来自不同病毒的核酸的重组。若出现病毒的突变,尤其当其发生在秋冬流感季,则情况更为严重。利用本发明的抗体进行检测,可用于病毒学的研究,检测是否产生了病毒核酸的整合,可从预防医学的角度对病毒是否产生整合进行监测和及时预警。
[0025]
在一个方面,本公开提供了根据本文所述的抗体或其抗原结合片段在用于检测、诊断、预防和/或治疗sars-cov-2感染的产品中的用途。
附图说明
[0026]
图1显示靶向sars-cov-2冠状病毒s蛋白的全人源抗体产生的过程。
[0027]
图2a显示重组蛋白刺突蛋白(spike) rbd-his和spike rbd-mfc与人ace2-hufc的结合活性测定。
[0028]
图2b显示重组蛋白刺突蛋白(spike) rbd-his和spike rbd-mfc与人ace2-his的结合活性测定。
[0029]
图3a显示各轮海选输出的富集效果,其显示抗体海选过程中每一轮输出的噬菌体在elisa水平与spike rbd-mfc蛋白的结合能力。
[0030]
图3b显示各轮海选输出的富集效果,其显示抗体海选过程中每一轮输出的噬菌体在elisa水平与spike rbd-mfc蛋白的结合能力。
[0031]
图4显示基于elisa检测候选抗体结合spike rbd mfc的亲和活性。
[0032]
图5a显示利用elisa的双抗体夹心法对候选抗体的表位进行分组,其为r16-f10处于液相时,对候选抗体的表位分组。
[0033]
图5b显示利用elisa的双抗体夹心法对候选抗体的表位进行分组,其为p16-a3处于液相时,对候选抗体的表位分组。
[0034]
图6显示在使用结合表位一的r16-f10抗体和结合表位二的p16-a3抗体制备的胶体金检测卡检测s蛋白标准品的灵敏度,在图6中从上往下每行分别为2 μg/ml、1 μg/ml、500 ng/ml、250 ng/ml、125 ng/ml、62.5 ng/ml、31 ng/ml、15.6 ng/ml、7.8 ng/ml、3.9 ng/ml、1.95 ng/ml、650 pg/ml、0 pg/ml(空白对照1)、0 pg/ml(空白对照2)、0 pg/ml(空白对照3)。
[0035]
图7显示利用elisa检测抗体r16-f10与sars-cov-2冠状病毒s蛋白、sars-cov (sars)重组蛋白、mers重组蛋白的交叉结合;其中cr3022(能够结合sars-cov的单克隆抗体,参见jan ter meulen, human monoclonal antibody combination against sars coronavirus: synergy and coverage of escape mutants,plos med. 2006 jul; 3(7): e237, cr3022 抗体可变区的genbank编号分别为dq168569和dq168570)与sars-cov重组蛋白的结合作为阳性对照。
具体实施方式
[0036]
以下提供对可用于检测、诊断、预防和治疗sars-cov-2冠状病毒感染的抗体或其抗原结合部分、抗体对、检测产品、方法和用途的描述。这些抗体、抗体对、产品、方法和用途至少在一定程度上满足了本领域中存在的至少一项需求。
[0037]
虽然本公开可以以许多不同的形式来实施,但在此公开的是验证本公开原理的其具体的举例说明性实施方式。应该强调的是,本公开不限于所举例说明的具体实施方式。此外,本文使用的任何章节标题仅用于组织目的,并不被解释为限制所描述的主题。
[0038]
i. 定义除非另有定义,否则本文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。为了本公开的目的,下文定义了以下术语。
[0039]
术语“约”在与数字数值联合使用时意为涵盖具有比指定数字数值小10%的下限和比指定数字数值大10%的上限的范围内的数字数值。
[0040]
术语“和/或”当用于连接两个或多个可选项时,应理解为意指可选项中的任一项或可选项中的任意两项或更多项。
[0041]
如本文中所用,术语“包含”或“包括”意指包括所述的要素、整数或步骤,但是不排除任意其他要素、整数或步骤。在本文中,当使用术语“包含”或“包括”时,除非另有指明,否则也涵盖由所述及的要素、整数或步骤组成的情形。例如,当提及“包含”某个具体序列的抗体可变区时,也旨在涵盖由该具体序列组成的抗体可变区。
scfv、(scfv)2、微型抗体、双功能抗体、三功能抗体、四功能抗体、二硫键稳定的fv蛋白(“dsfv”)。所述术语还包括经遗传工程改造的形式,例如嵌合抗体(例如人类化鼠抗体)、杂结合抗体(例如双特异性抗体)和其抗原结合片段。更详细的描述也请参见:皮尔斯目录与手册(pierce catalog and handbook), 1994-1995(皮尔斯化学公司(piercechemical co.), 罗克福德(rockford), 伊利诺伊州(il);kuby, 免疫学杂志, 第3版, w.h.弗里曼公司(w.h.freeman&co.), 纽约, 1997。
[0048]
术语“全抗体”、“全长抗体”、“完全抗体”和“完整抗体”在本文中可互换地用来指包含由二硫键相互连接的至少两条重链(hc)和两条轻链(lc)的糖蛋白。每条重链由重链可变区(本文中缩写为vh)和重链恒定区组成。重链恒定区由3个结构域ch1、ch2和ch3组成。每条轻链由轻链可变区(本文中缩写为vl)和轻链恒定区(本文中缩写为cl)组成。轻链恒定区由一个结构域cl组成。哺乳动物重链分类为α、δ、ε、γ和μ。哺乳动物轻链分类为λ或κ。包含α、δ、ε、γ和μ重链的免疫球蛋白分类为免疫球蛋白(ig)a、igd、ige、igg和igm。完全抗体形成“y”形状。y的茎由两条重链的第二和第三恒定区(并且对于ige和igm,第四恒定区)结合在一起组成,并且二硫键(链间)在铰链中形成。重链γ、α和δ具有由三个串联(成一行)ig结构域构成的恒定区,和用于增加柔性的铰链区;重链μ和ε具有由四个免疫球蛋白结构域构成的恒定区。第二和第三恒定区分别称为“ch2结构域”和“ch3结构域”。y的每个臂包括结合到单个轻链的可变和恒定区的单个重链的可变区和第一恒定区。轻链和重链的可变区负责抗原结合。
[0049]
轻链可变区和重链可变区分别包含间插有三个高变区(也称为“互补决定区”或“cdr”)的“构架”区。“互补决定区”或“cdr区”或“cdr”或“高变区”(在本文中与超变区“hvr”可以互换使用),是抗体可变结构域中在序列上高变并且形成在结构上确定的环(“超变环”)和/或含有抗原接触残基(“抗原接触点”)的区域。cdr主要负责与抗原表位结合。重链和轻链的cdr通常被称作cdr1、cdr2和cdr3,从n-端开始顺序编号。位于抗体重链可变结构域内的cdr被称作hcdr1、hcdr2和hcdr3,而位于抗体轻链可变结构域内的cdr被称作lcdr1、lcdr2和lcdr3。在一个给定的轻链可变区或重链可变区氨基酸序列中,各cdr的精确氨基酸序列边界可以使用许多公知的抗体cdr指派系统的任一种或其组合确定,所述指派系统包括例如:基于抗体的三维结构和cdr环的拓扑学的chothia (chothia 等人. (1989) nature 342: 877-883,al-lazikani 等人,
ꢀ“
standard conformations for the canonical structures of immunoglobulins”, journal of molecular biology,273, 927-948 (1997))、基于抗体序列可变性的kabat (kabat 等人, sequences of proteins of immunological interest, 第4 版, u.s. department of health and human services, national institutes of health (1987))、abm (university of bath)、contact (university college london)、国际immunogenetics database (imgt) (www.imgt.cines.fr/)、以及基于利用大量晶体结构的近邻传播聚类(affinity propagation clustering)的north cdr定义。本公开中所列举的具体cdr序列一般是根据abm定义所得的序列,但本领域技术人员应当知晓的是,根据其他cdr的定义规则所对应的氨基酸序列也应当落在本发明的保护范围中。
[0050]
然而,应该注意,基于不同的指派系统获得的同一抗体的可变区的cdr的边界可能有所差异。即不同指派系统下定义的同一抗体可变区的cdr序列有所不同。例如,对使用
kabat 和chothia编号的cdr区域在不同指派系统定义下的残基范围如下表a所示。
[0051]
表a. 不同指派系统定义下的cdr残基范围因此,在涉及用本公开定义的具体cdr序列限定抗体时,所述抗体的范围还涵盖了这样的抗体,其可变区序列包含所述的具体cdr序列,但是由于应用了不同的方案(例如不同的指派系统规则或组合)而导致其所声称的cdr边界与本公开所定义的具体cdr边界不同。
[0052]
本公开抗体的cdr可以根据本领域的任何方案或其组合人工地评估确定边界。除非另有说明,否则在本公开中,术语“cdr”或“cdr序列”涵盖以上述任一种方式确定的cdr序列。
[0053]
不同轻链或重链的构架区的序列在物种(例如人类)内具有相对保存性。抗体的构架区(其是成分轻链和重链的组合构架区)用以在三维空间中定位和比对cdr。cdr主要负责结合到抗原的表位。具有不同特异性(即针对不同抗原有不同组合位点)的抗体具有不同cdr。尽管抗体与抗体之间的cdr不同,但cdr内仅有限数目的氨基酸位置直接参与抗原结合。cdr内的这些位置称为特异性决定残基(sdr)。
[0054]“单克隆抗体”是由b淋巴细胞的单个克隆或由其中已经转染单个抗体的轻链和重链基因的细胞产生的抗体。单克隆抗体通过本领域的技术人员已知的方法产生,例如通过由骨髓瘤细胞与免疫脾细胞的融合体制备杂交抗体形成细胞。单克隆抗体包括人源化单克隆抗体。
[0055]“fv”是含有完全抗原结合位点的最小抗体片段。在一个实例中,双链fv种类由一个重链可变结构域和一个轻链可变结构域呈紧密非共价缔合的二聚体组成。在单链fv(scfv)种类中,一个重链可变结构域与一个轻链可变结构域可以通过柔性肽连接子共价连接,使得轻链和重链可以按类似于双链fv种类的“二聚”结构缔合。在这一配置中,每个可变结构域的三个高变区(hvr)相互作用以定义vh-vl二聚体的表面上的抗原结合位点。六个hvr共同地赋予对抗体的抗原结合特异性。然而,即使单个可变结构域(或包含仅三个对抗原具有特异性的hvr的fv的一半)也具有识别和结合抗原的能力,但亲和力低于完整结合位点。
[0056]
fab片段含有重链可变结构域和轻链可变结构域并且还含有轻链的恒定结构域和重链的第一恒定结构域(ch1)。fab
′
片段与fab片段不同之处在于,重链ch1结构域的羧基末端增添了几个残基,包括一个或多个来自抗体铰链区的半胱氨酸。fab
′-
sh是本文关于fab
′
的名称,其中恒定结构域的半胱氨酸残基携有游离硫醇基。f(ab
′
)2抗体片段最初是作为其间具有铰链半胱氨酸的fab
′
片段对产生。还已知抗体片段的其它化学偶合。
[0057]
当谈及抗原/表位和抗体时使用的术语“特异性结合”或“结合”意指抗体与生理条件下相对稳定的抗原形成复合物。用于确定抗体是否与抗原/表位特异性结合的方法是本领域熟知的并且例如包括表面等离振子共振测定法、msd测定法(estep, p.等人, high through put solution-based measurement of antibody-antigen affinity and epitope binning, mabs, 2013. 5(2):p. 270-278)、fortebio亲和力测定法(estep, p 等人,high through put solution based measurement of antibody-antigen affinity and epitope binning. mabs, 2013.5(2): p. 270-8)等。
[0058]
在一个实施方案中,本公开的“特异性结合”冠状病毒s蛋白的抗体例如如fortebio亲和力测定法中测量,以至少约10-8 m,优选10-9 m;更优选10-10 m,进一步优选10-11 m,更优选10-12 m 的kd与s蛋白结合,由此阻断或抑制冠状病毒s蛋白与其受体ace2结合以及随后的膜融合,以及由此用于检测和诊断冠状病毒感染。
[0059]“亲和力”是指分子(例如抗体)的单一结合位点与其结合配偶体(例如抗原)之间全部非共价相互作用总和的强度。除非另有说明,在用于本文时,“结合亲和力”指反映结合对的成员(例如抗体与抗原)之间1∶1相互作用的内在结合亲和力。分子x对其配偶体y的亲和力通常可用结合解离平衡常数(kd)来表述。亲和力可通过本领域已知的常用方法来测量,包括现有技术已知以及本文中所描述的那些。
[0060]
如本文所用,术语“变体”是指具有至少一个,例如1、2或3个氨基酸变化例如氨基酸取代、缺失或添加的多肽或片段如重链可变区或轻链可变区。包含重链或轻链变体的经修饰的抗体或其抗原结合片段基本上保留修饰前抗体或其抗原结合片段的生物学特征。在一个实施方案中,含有变体重链可变区或轻链可变区序列的抗体或其抗原结合片段保留修饰前抗体或其抗原结合片段的60%、70%、80%、90%、100%或以上的生物学特征。应当理解,可以单独或在与另一个重链可变区或轻链可变区组合修饰每个重链可变区或轻链可变区。在一个实施方案中,本公开的抗体或其抗原结合片段包含与本文描述的重链可变区氨基酸序列至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%同源的重链可变区氨基酸序列。在一个实施方案中,本公开的抗体或其抗原结合片段包含与本文描述的轻链可变区氨基酸序列至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%同源的轻链可变区氨基酸序列。同源性百分比可以在整个重链可变区和/或整个轻链可变区上,或者百分比同源性可以限于构架区,而对应于cdr的序列与重链可变区和/或轻链可变区内本文中公开的cdr具有100%同一性。
[0061]
如本文所用,术语“cdr变体”是指具有至少一个,例如1、2或3个氨基酸变化例如取代、缺失或添加的cdr,其中包含cdr变体的经修饰的抗体或其抗原结合片段基本上保留修饰前抗体或其抗原结合片段的生物学特征。在一个实施方案中,含有变体cdr的抗体或其抗原结合片段保留修饰前抗体或其抗原结合片段的至少60%、70%、80%、90%、100%或以上的生物学特征。应当理解,可以修饰的每个cdr可以单独或与另一个cdr组合修饰。在一个实施方
案中,修饰或变化是取代,特别是保守取代。
[0062]“人源化抗体”是指一类工程化抗体,其具有源自非人供体免疫球蛋白的cdr,而该人源化抗体的剩余免疫球蛋白部分来源自一种(或多种)人免疫球蛋白。此外,构架支持残基可以改变以保留结合亲和力(参见例如queen等, proc. natl. acad. sci. usa, 86:10029-10032(1989), hodgson 等, bio/technology, 9:421 (1991))。合适的人接受抗体可以是通过与供体抗体的核苷酸和氨基酸序列的同源性从常规数据库例如los alamos数据库和swiss蛋白质数据库选择的抗体。以与供体抗体的构架区的同源性(基于氨基酸)表征的人抗体可以适合于提供用于插入供体cdr的重链恒定区和/或重链可变构架区。可以以类似的方式选择能够提供轻链恒定或可变构架区的合适受体抗体。应当注意的是,受体抗体重链和轻链不需要来源于相同的受体抗体。
[0063]“人抗体”是指具有对应于由人产生的抗体的氨基酸序列和/或使用如本文公开的用于制备人抗体的技术中的任一种所制备的抗体。人抗体的该定义明确地排除了包含非人抗原结合残基的人源化抗体。可使用本领域已知的多种技术,包括噬菌体展示文库来制备人抗体。
[0064]
如本领域已知,在本文中可交换使用的“多核苷酸”或“核酸”是指任何长度的核苷酸链,并且包括dna和rna。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基、和/或它们的类似物、或者能够通过dna或rna聚合酶掺入链的任何底物。
[0065]
如下进行序列之间序列同一性的计算。为确定两个氨基酸序列或两个核酸序列的同一性百分数,将所述序列出于最佳比较目的比对(例如,可以为了最佳比对而在第一和第二氨基酸序列或核酸序列之一或二者中引入空位或可以为比较目的而抛弃非同源序列)。在一个优选实施方案中,为比较目的,所比对的参考序列的长度是至少30%、优选地至少40%、更优选地至少50%、60%和甚至更优选地至少70%、80%、90%、100%的参考序列长度。随后比较在对应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的位置由第二序列中对应位置处的相同氨基酸残基或核苷酸占据时,则所述分子在这个位置处是相同的。可以利用数学算法实现两个序列间的序列比较和同一性百分数的计算。在一个优选实施方案中,使用已经集成至gcg软件包的gap程序中的needlema和wunsch ((1970) j. mol.biol. 48:444-453)算法(在http://www.gcg.com可获得),使用blossum 62矩阵或pam250矩阵和空位权重16、14、12、10、8、6 或4和长度权重1、2、3、4、5或6,确定两个氨基酸序列之间的同一性百分数。在又一个优选的实施方案中,使用gcg软件包中的gap程序(在http://www.gcg.com可获得),使用nwsgapdna.cmp矩阵和空位权重40、50、60、70或80和长度权重1、2、3、4、5或6,确定两个核苷酸序列之间的同一性百分数。特别优选的参数集合(和除非另外说明否则应当使用的一个参数集合)是采用空位罚分12、空位延伸罚分4和移码空位罚分5的blossum 62评分矩阵。还可以使用pam120加权余数表、空位长度罚分12、空位罚分4),利用已经并入align程序(2.0 版)的e. meyers和w. miller算法, ((1989) cabios, 4:11-17)确定两个氨基酸序列或核苷酸序列之间的同一性百分数。额外地或备选地,可以进一步使用本文所述的核酸序列和蛋白质序列作为“查询序列”以针对公共数据库执行检索,以例如鉴定其他家族成员序列或相关序列。
[0066]
如本文所用,“载体”表示构建体,其能够将一种或多种所关注的基因或序列递送入宿主细胞并且优选在宿主细胞中表达所述基因或序列。载体的实例包括但不限于病毒载
体、裸dna或rna表达载体、质粒、粘粒或噬菌体载体、与阳离子凝聚剂相关的dna或rna表达载体、包囊化于脂质体中的dna或rna表达载体以及某些真核细胞,例如生产细胞。
[0067]
在本公开中术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且可包括已经引入外源性核酸的细胞,包括这些细胞的子代。宿主细胞包括“转化子”和“转化的细胞”,其包括原代转化细胞以及由此来源的子代,而不考虑传代次数。子代在核酸含量上与亲代细胞可能不完全相同,但可能含有突变。本文包括与在初始转化的细胞中筛选或选择的细胞具有相同功能或生物学活性的突变子代。
[0068]
在本文中,“受试者”、“个体”或“对象”指需要检测、诊断、缓解、预防和/或治疗疾病或病症如病毒感染的动物,优选哺乳动物,更优选是人。哺乳动物还包括但不限于农场动物、竞赛动物、宠物、灵长类、马、犬、猫、小鼠和大鼠。该术语包括具有冠状病毒感染或处于具有冠状病毒感染风险的人受试者。本公开所述的抗体或其抗原结合部分和抗体对可用于检测或诊断人受试者中的冠状病毒感染,尤其是sars-cov-2病毒感染。在本公开中,向有此需要的受试者施用本公开所述的抗体或其抗原结合部分是指给予有效量的所述抗体或其抗原结合部分等。
[0069]
如本公开所用,术语“有效量”表示引发例如研究者或临床医师所追求的组织、系统、动物或人的生物学或药学响应的药物或药剂的量。此外,术语“治疗有效量”表示,与没有接受该量的相应受试者相比,引起疾病、病症或副作用的改进治疗、治愈、预防或减轻的量,或者使疾病或病况的进展速率降低的量。该术语在其范围内还包括有效增强正常生理功能的量。
[0070]
ii. 冠状病毒冠状病毒是球形单股正链rna病毒,其特征是,具有从病毒体表面突出的刺突蛋白(barcena, m.等人,cryo-electron tomography of mouse hepatitis virus: insights into the structure of the coronavirion. proc.natl. acad. sci. usa2009, 106, 582
–
587)。病毒颗粒的球形形态以及刺突突起使得冠状病毒在电子显微镜下看起来像冠冕而被命名为冠状病毒。
[0071]
冠状病毒是被包膜的病毒(所被包膜衍生自宿主细胞膜的脂质双层),具有主要由病毒结构蛋白(例如刺突蛋白(spike,s)、膜蛋白(membrane,m)、包膜蛋白(envelope,e)和核衣壳蛋白(nucleocapsid,n))形成的病毒结构,其中s蛋白、m蛋白和e蛋白均嵌入在病毒包膜中,n蛋白与病毒rna相互作用,位于病毒颗粒的核心,形成核衣壳(fehr,a.r.等人,coronaviruses: an overview of their replication and pathogenesis. methods mol.biol.2015, 1282, 1
–
23)。s蛋白是一种高度糖基化的蛋白,可在病毒颗粒表面形成同源三聚体的刺突,并介导病毒进入宿主细胞。sars-cov-2是具有膜结构的、大小为80
−
120 nm的单股正链rna病毒,基因组长度约为29.9 kb,该病毒与同属于冠状病毒科β冠状病毒属的sars-cov的基因组序列之间的同源性为80%。病毒基因组的可读框(open reading frame,orf) orf1a和orf1b占基因组的2/3,表达水解酶以及与复制、转录相关的酶,例如,半胱氨酸蛋白酶(plpro)和丝氨酸蛋白酶(3clpro)、rna 依赖rna 聚合酶(rdrp)和解旋酶(hel);后面的基因组1/3 区域主要负责编码结构蛋白,包括刺突蛋白(s)、包膜蛋白(e)、膜蛋白(m)、核衣壳蛋白(n)等主要结构蛋白,其中n 蛋白包裹病毒基因组形成核蛋白复合体,e蛋白和m蛋白主要参与病毒的装配过程,s蛋白则主要通过与宿主细胞受体结合介导病毒
的入侵并决定病毒的宿主特异性。经序列比对,发现sars-cov-2病毒和sars-cov病毒的s蛋白具有75%的相似度,据报道称多株sars-cov冠状病毒分离株中位于s蛋白与ace2受体(在人体中主要分布于呼吸道上皮细胞、肺脏、心脏、肾脏和消化道等位置)复合物界面的442、472、479、487和491位点的氨基酸残基是高度保守的。与sars-cov的s蛋白相比较,在所述5个位点处,sars-cov-2蛋白仅第491位氨基酸相同,其它4处氨基酸都发生了突变(xu x 等人, sci china life sci., 2020年3月; 63(3): 457-460)。尽管如此,通过蛋白质3d 结构模拟预测发现,虽然sars-cov-2的s蛋白与ace2 受体结合的所述4个关键氨基酸都发生了替换,但是相对于sars-cov的s蛋白,sars-cov-2的s蛋白中的受体结合结构域(receptor binding domain,rbd)的三维结构几乎不变,由此sars-cov-2的s蛋白与人体ace2仍然具有较高的亲和力。最近的文章(wrappd等人,cryo-em structure of the 2019-ncov spike in the prefusion conformation,science, 2020年2月19日,网上公开,pii: eabb2507. doi: 10.1126/science.abb2507)以及(xiaolong tian 等人,potent binding of 2019 novel coronavirus spike protein by a sars coronavirus-specific human monoclonal antibody, emerging microbes & infections,2020,9:1,p382-385, doi: 10.1080/22221751.2020.1729069)通过fortebio检测发现,sars-cov-2的s蛋白结合人类ace2的亲和力(kd)约为15 nm,与sars-cov 的s蛋白结合人类ace2的亲和力相当,由此可见,ace2也是sars-cov-2感染人体进入细胞内部的受体蛋白。预期针对冠状病毒s蛋白并且阻断其与ace2受体结合的高亲和力中和抗体,能够有效预防和治疗冠状病毒(例如,sars-cov-2、sars-cov)感染。
[0072]
此外,鉴于sars-cov与sars-cov-2的s蛋白在序列和结构上的相似性,能够区分两者的检测抗体将是尤其有益的。
[0073]
iii. 针对冠状病毒s蛋白的抗体术语“针对冠状病毒s蛋白的抗体”、“抗冠状病毒s蛋白的抗体”、“抗s蛋白抗体”、“冠状病毒s蛋白抗体”、“s蛋白抗体”或“结合s蛋白的抗体”在本文中可互换地使用,是指这样的本公开的抗体,所述抗体能够以足够的亲和力结合冠状病毒s蛋白(例如,sars-cov-2 s蛋白),由此所述抗体可以用作靶向冠状病毒s蛋白的检测剂、诊断剂、预防剂和/或治疗剂。
[0074]
抗体及其抗原结合部分在一个方面,本公开提供了分离的抗体或其抗原结合片段,其特异性结合冠状病毒(尤其是sars-cov-2)s蛋白。
[0075]
在一些实施方案中,本公开提供的抗体针对sars-cov-2冠状病毒s蛋白的不同表位。在一些实施方案中,本公开提供了针对sars-cov-2冠状病毒s蛋白表位1的下列抗体:组(a)-包含如下的抗体:包含seq id no:5的氨基酸序列的hcdr1或其不超过2个氨基酸变化的变体;包含seq id no:6的氨基酸序列的hcdr2或其不超过2个氨基酸变化的变体;包含seq id no:7的氨基酸序列的hcdr3或其不超过2个氨基酸变化的变体;包含seq id no:8的氨基酸序列的lcdr1或其不超过2个氨基酸变化的变体;包含seq id no:9的氨基酸序列的lcdr2或其不超过2个氨基酸变化的变体;和/或包含seq id no:10的氨基酸序列的lcdr3或其不超过2个氨基酸变化的变体;组(b)-包含如下的抗体:seq id no: 3所示的重链可变区氨基酸序列中的hcdr1或其不超过2个氨基酸变化的变体;seq id no: 3所示的重链可变区氨基酸序列中的hcdr2或其
不超过2个氨基酸变化的变体;seq id no: 3所示的重链可变区氨基酸序列中的hcdr3或其不超过2个氨基酸变化的变体;seq id no: 4所示的轻链可变区氨基酸序列中的lcdr1或其不超过2个氨基酸变化的变体;seq id no: 4所示的轻链可变区氨基酸序列中的lcdr2或其不超过2个氨基酸变化的变体;和/或seq id no: 4所示的轻链可变区氨基酸序列中的lcdr3或其不超过2个氨基酸变化的变体;或组(c)-包含如下的抗体:包含seq id no: 3所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链可变区;和/或包含seq id no: 4所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链可变区。
[0076]
在一些实施方案中,在组(a)、(b)或(c)中的抗体中,hcdr1包含或由seq id no: 5所示的氨基酸序列组成;hcdr2包含或由seq id no: 6所示的氨基酸序列组成;和/或hcdr3包含或由seq id no: 7所示的氨基酸序列组成。
[0077]
在一些实施方案中,在组(a)、(b)或(c)中的抗体中,lcdr1包含或由seq id no: 8所示的氨基酸序列组成;lcdr2包含或由seq id no: 9所示的氨基酸序列组成;和/或lcdr3包含或由seq id no: 10所示的氨基酸序列组成。
[0078]
在一些实施方案中,组(a)、(b)或(c)中的抗体包含igg重链(例如igg1、igg2、igg3或igg4重链,尤其是igg1或igg4重链)和/或kappa轻链。在一些实施方案中,组(a)、(b)或(c)中的抗体还包含:包含seq id no: 1所示氨基酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链恒定区;和/或包含seq id no: 2所示氨基酸序列或与其具有至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链恒定区。
[0079]
在一些实施方案中,组(a)、(b)或(c)中的抗体是全人源抗体。
[0080]
在一些实施方案中,本公开提供了针对sars-cov-2冠状病毒s蛋白表位2的下列抗体:组(d)-包含如下的抗体:seq id no: 11所示的重链可变区氨基酸序列中的hcdr1或其不超过2个氨基酸变化的变体;seq id no: 11所示的重链可变区氨基酸序列中的hcdr2或其不超过2个氨基酸变化的变体;seq id no: 11所示的重链可变区氨基酸序列中的hcdr3或其不超过2个氨基酸变化的变体;seq id no: 12所示的轻链可变区氨基酸序列中的lcdr1或其不超过2个氨基酸变化的变体;seq id no: 12所示的轻链可变区氨基酸序列中的lcdr2或其不超过2个氨基酸变化的变体;和/或seq id no: 12所示的轻链可变区氨基酸序列中的lcdr3或其不超过2个氨基酸变化的变体;或组(e)-包含如下的抗体:包含seq id no: 11所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的重链可变区;和/或包含seq id no: 12所示氨基酸序列或与其具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列的轻链可变区。
[0081]
在一些实施方案中,组(d)或(e)中的抗体包含igg重链(例如igg1、igg2、igg3或igg4重链,尤其是igg1或igg4重链)和/或kappa轻链。在一些实施方案中,组(d)或(e)中的抗体是全人源抗体。
[0082]
在一些实施方案中,表位1和表位2位于sars-cov-2冠状病毒s蛋白rbd结构域的不
同位置。
[0083]
在一些实施方案中,氨基酸变化可以是氨基酸的添加、缺失或取代,例如,氨基酸变化是保守氨基酸取代。在一些实施方案中,氨基酸变化不发生在cdr区中。
[0084]
在本公开的一些实施方案中,本文所述的氨基酸变化包括氨基酸的取代、插入或缺失。在一些实施方案中,本文所述的氨基酸变化为氨基酸取代,优选地保守取代。保守取代是指一个氨基酸经相同类别内的另一氨基酸取代,例如一个酸性氨基酸经另一酸性氨基酸取代,一个碱性氨基酸经另一碱性氨基酸取代,或一个中性氨基酸经另一中性氨基酸取代。示例性的取代如下表b所示;表b. 示例的氨基酸取代在一些实施方案中,本公开所述的氨基酸变化发生在cdr外的区域(例如在fr中)。在一些实施方案中,本公开所述的氨基酸变化发生在fc区。在一些实施方案中,提供了包含含有一个或多个突变的fc结构域的抗体或其抗原结合部分,该突变增强或减弱抗体或其抗原结合部分例如与中性ph相比在酸性ph下与fcrn受体的结合。例如,本公开包括在fc结构域的ch2或ch3区中含有突变的抗冠状病毒s蛋白抗体或结合冠状病毒s蛋白表位的抗原结合部分,其中该一个或多个突变提高fc结构域在酸性环境(例如在ph在约5.5至约6.0 范围内的
2)s蛋白的rbd区上的不同表位。有益的配体抗体或抗体对将能够显著提高检测的灵敏度和/或特异性。
[0088]
如本文所使用,术语“双抗体夹心法”是一种非竞争结合测定,可用于检测分子中具有至少两个抗原决定簇的多价抗原。该检测法可利用负载于固相载体上的捕获抗体和标记抗体分别与样品中被检测抗原分子上两个抗原决定簇结合,形成固相抗体-抗原-标记抗体免疫复合物。在一些实施方案中,由于反应系统中固相捕获抗体和标记抗体的量相对于待测抗原是过量的,因此复合物的形成量与待测抗原的含量在可检测范围内成正比。采用“双抗体夹心法”检测抗原的一般性步骤和程序是本领域熟知的,如在methods in enzymology, 1980, v.70, 166-198页中综述的。
[0089]
在一些实施方案中,用一对均特异于冠状病毒(尤其是sars-cov-2)s蛋白的抗体确定冠状病毒(尤其是sars-cov-2)s蛋白的存在。所述抗体对中的一个在此称为“标记抗体”,而所述抗体对中的另一个在此称为“捕获抗体”。本公开的抗体或其结合片段可以用做捕获或标记抗体。本公开的抗体或其结合片段也能够既用作捕获抗体又用作标记抗体。本公开的一些实施方案因此应用双抗体夹心法在生物或环境样品中检测冠状病毒(尤其是sars-cov-2)s蛋白。在此方法中,待分析物(冠状病毒(尤其是sars-cov-2)s蛋白)被夹在标记抗体和捕获抗体之间,其中捕获抗体不可逆地固定在固相支持物上。标记抗体包含可检测的标记,以鉴定抗体-分析物夹心的存在并且因此鉴定分析物的存在。
[0090]
在一些实施方案中,本公开的组(a)、(b)或(c)中的一种或多种抗体或其抗原结合部分被标记并作为检测抗体,而本公开的组(d)或(e)中的一种或多种抗体或其抗原结合部分被连接于固相载体或支持物上作为捕获抗体。
[0091]
iv. 用于诊断和检测冠状病毒的方法和组合物在一些实施方案中,本文中提供的任何抗体或其抗原结合部分或配对抗体可以用于检测冠状病毒在或环境生物样品中的存在。术语“检测”用于本文中时,包括定量或定性检测。示例性的检测方法可以涉及免疫组织化学、免疫细胞化学、流式细胞术(例如,facs)、抗体分子复合的磁珠、elisa测定法。
[0092]
在一个实施方案中,提供了用于诊断或检测方法中的特异性结合冠状病毒s蛋白的抗体或其抗原结合部分或配对抗体。在另一个方面中,提供检测冠状病毒在生物样品中的存在或环境中冠状病毒污染的方法。在某些实施方案中,所述方法包括检测冠状病毒s蛋白在生物样品或环境中的存在。在某些实施方案中,所述方法包括将生物样品或环境样品与如本文所述的抗体或其抗原结合部分或配对抗体在允许所述抗体或其抗原结合部分或配对抗体与冠状病毒s蛋白结合的条件下接触,并检测在抗体或其抗原结合部分或配对抗体和冠状病毒s蛋白之间是否形成复合体。复合体的形成表示存在冠状病毒。该方法可以是体外或体内方法。
[0093]
用于冠状病毒的示例性诊断测定包括例如使用本公开的抗体或其抗原结合部分或配对抗体接触从患者获得的样品,其中使用可检测的标记或报告分子标记本公开的抗体或其抗原结合部分或配或用作捕获配体以选择性地从患者样品分离冠状病毒。可选地,未标记的本公开的抗体或其抗原结合部分可与本身被可检测地标记的第二抗体组合在诊断应用中使用。可检测的标记或报告分子可以是放射性同位素、如3h、14c、32p、35s 或125i;荧光或化学发光的部分如荧光素异硫氰酸酯或罗丹明,或酶如碱性磷酸酶、β-半乳糖苷酶、
辣根过氧化物酶或荧光素酶。可用于检测或测量样品中冠状病毒的具体的示例性测定包括酶连接的免疫吸附测定(elisa)、放射免疫测定(ria)和荧光活化细胞分选(facs)。
[0094]
可在根据本公开的冠状病毒诊断测定中使用的样品包括从患者可获得的任何生物样品,其包含在正常或生理条件下可检测量的冠状病毒刺突蛋白或其片段。在一些实施方案中,生物样品是血液、血清、咽拭子、下呼吸道样本(如气管分泌物、气管吸取物、肺泡灌洗液)或生物来源的其他样品。一般而言,将测量从健康患者获得的特定样品中的冠状病毒刺突蛋白水平(例如未受与冠状病毒相关的疾病所扰的患者)以初始性地建立基线或标准冠状病毒水平。该冠状病毒基线水平可随后与从疑似具有冠状病毒相关病况或与该病况相关的症状的个体获得的样品中测量的冠状病毒水平进行比较。特异性针对冠状病毒刺突蛋白的抗体或其抗原结合部分可不包含其他标记物,或其可包含n-末端或c末端的标记物。在一个实施方案中,标记物是生物素。在结合测定中,标记物(如果存在的话)的位置可确定肽相对于所结合的表面的方向。例如,如果表面以抗生物素蛋白包被,包含n末端生物素的肽将被定向,使得肽的c末端部分远离表面。
[0095]
在一个方面,本公开提供了一种用于检测冠状病毒(尤其是sars-cov-2)和/或诊断冠状病毒(尤其是sars-cov-2)感染的方法和产品如检测或诊断试纸或检测或诊断试剂盒。这些方法包括常用于在生物或环境样品中检测或定量物质的公知免疫学方法。术语“检测或诊断试纸”、“检测或诊断试剂盒”指本领域公知的任何检测/诊断试纸或试剂盒,例如可以指如zrein等人(1998)描述的诊断试剂盒。
[0096]
在一些实施方案中,检测试剂盒可包括容纳一种或多种根据本公开的抗体或其结合部分的容器,以及有关使用抗体或其抗原结合部分结合冠状病毒(尤其是sars-cov-2)s蛋白而形成免疫复合物和检测免疫复合物的形成、从而使免疫复合物的存在或不存在与冠状病毒(尤其是sars-cov-2)s蛋白的存在或不存在相关联的说明书。
[0097]
冠状病毒(尤其是sars-cov-2)的诊断和检测可以通过检测抗体或其抗原结合片段与样品中的冠状病毒(尤其是sars-cov-2)s蛋白的表位的免疫特异性结合来完成,这包括使怀疑含有冠状病毒(尤其是sars-cov-2)的样品或特定身体部分或身体区域与结合该冠状病毒(尤其是sars-cov-2)s蛋白的表位的抗体接触,允许抗体与冠状病毒(尤其是sars-cov-2)s蛋白结合以形成免疫复合物,检测免疫复合物的形成,并将免疫复合物的存在或不存在与样品中或特定身体部分或区域中冠状病毒(尤其是sars-cov-2)s蛋白的存在或不存在相关联。
[0098]
可以用于检测或诊断冠状病毒(尤其是sars-cov-2)的生物样品可包括例如体液,诸如咽拭子,鼻拭子、下呼吸道样本(如气管分泌物、气管吸取物、肺泡灌洗液)等;或从生物体获得的组织或细胞样品,诸如神经、脑、心脏或血管组织等。为确定样品中冠状病毒(尤其是sars-cov-2)的存在或不存在,可以使用本领域普通技术人员已知的任何免疫测定法(参见harlow和lane,antibodies:a laboratory manual (cold spring harbor laboratory,new york 1988 555-612)),例如,利用借助二级试剂进行检测的间接检测方法的测定法、elisa和免疫沉淀及凝集测定法。例如maertens和stuyver的wo96/13590、zrein等人(1998)和wo96/29605给出了这些测定法的详细描述。
[0099]
用于诊断应用的免疫测定法通常依赖于标记的抗原、抗体或二级试剂进行检测。这些蛋白或试剂可用本领域技术人员已知的化合物标记,包括酶、放射性同位素、以及荧
光、发光以及显色物质,包括有色粒子,诸如胶体金和乳胶珠。其中,放射性标记能够应用于几乎所有类型的测定法以及大多数变型形式。在必须避免放射性或需要快速结果时,酶缀合的标记物特别有用。尽管荧光染料在使用中需要昂贵的设备,但荧光染料提供了非常灵敏的检测方法。用于这些测定的抗体可包括单克隆抗体、多克隆抗体和经亲和纯化的多克隆抗体。
[0100]
可选地,抗体可以通过与对免疫球蛋白具有亲和力的经标记的物质(诸如蛋白质a或蛋白质g或第二抗体)进行反应来间接地标记。抗体可以与第二物质缀合,并用对与抗体缀合的第二物质具有亲和力的标记的第三物质检测。例如,抗体可以缀合生物素,并用标记的亲和素或链霉亲和素来检测抗体-生物素缀合物。与之类似,抗体可以缀合半抗原,并用标记的抗半抗原抗体来检测抗体-半抗原缀合物。
[0101]
本领域技术人员公知这些和其它根据本公开可采用的适宜标记物。可以应用本领域普通技术人员普遍公知的标准技术完成这些标记物与抗体或其片段的结合。kennedy,j.h.等人,1976(clin.chim.acta 70:1-31),和schurs,a.h.w.m.等人,1977(clin.chim acta 81:1-40)描述了典型的技术。后者提到的偶联技术是戊二醛法、高碘酸盐法、双马来酰亚胺法等等。所有的这些公开内容都并入本文作为参考。
[0102]
在一些实施方案中,本公开的免疫测定法包括利用双抗体方法检测分析物的存在。在一些实施方案中,本公开提供了一种双抗体系统,其适用于快速确定分析物的存在。这样的快速检测系统通常需要抗体与分析物之间的高亲和力。在一些实施方案中,用一对均特异于冠状病毒(尤其是sars-cov-2)s蛋白的抗体确定冠状病毒(尤其是sars-cov-2)s蛋白的存在。本公开的抗体或其结合片段可以用做捕获或标记抗体。本公开的抗体或其结合片段也能够既用作捕获抗体又用作标记抗体。本公开的一些实施方案因此应用双抗体夹心法在生物或环境样品中检测冠状病毒(尤其是sars-cov-2)s蛋白。在此方法中,待分析物(冠状病毒(尤其是sars-cov-2)s蛋白)被夹在标记抗体和捕获抗体之间,其中捕获抗体不可逆地固定在固相支持物上。标记抗体包含可检测的标记,以鉴定抗体-分析物夹心的存在并且因此鉴定分析物的存在。在一些实施方案中,本公开的组(a)、(b)或(c)中的一种或多种抗体或其抗原结合部分被标记并作为标记抗体,而本公开的组(d)或(e)中的一种或多种抗体或其抗原结合部分被连接于固相载体或支持物上作为捕获抗体。
[0103]
示例性固相物质包括但不限于在免疫测定领域中公知的微量滴定板、聚苯乙烯试管、磁性、塑料或玻璃珠和载片。用于将抗体偶联到固相支持物的方法也是本领域技术人员公知的。多孔材料诸如尼龙、硝化纤维素、醋酸纤维素、玻璃纤维和其它的多孔聚合物也可用作固相支持物。
[0104]
在一些实施方案中,本公开的检测产品包括基底、样品区、结合区和反应区,其中沿着待测样品流动方向,所述样品区、结合区和反应区依次设置在所述基底上。在一些实施方案中,所述结合区负载有标记抗体。在一些实施方案中,所述反应区设置有检测区,以及在进一步的实施方案中,所述反应区还设置有质控区。在一些实施方案中,本文的检测产品在所述反应区远离所述样品区的一侧还包括吸收区。
[0105]
在一些实施方案中,本公开的检测产品包括基底。本公开对基底的材质、尺寸和来源没有特殊的限制,采用本领域技术人员熟知的用于免疫测得的基底即可。在一些实施方案中,基底的材质为塑料材料例如pvc板,其是市售可得的商品。
[0106]
在一些实施方案中,本公开的检测产品包括设置在所述基底上的样品区。在一些实施方案中,样品区的材料为玻璃纤维。本公开对玻璃纤维的来源没有任何限制,本领域技术人员所熟知的玻璃纤维即可。在一些实施方案中,所述样品区吸收的样品为咽拭子或鼻拭子样本。
[0107]
在一些实施方案中,本公开的检测产品包括设置在所述基底上的结合区,该结合区负载有标记抗体。所述结合区与样品区邻接或可部分重叠例如重叠1-2 mm,如约1.5 mm。本公开对该结合区的材料也没有任何限制,并且在一些实施方案中可以为玻璃纤维。在一些实施方案中,所述结合区负载有具有显色标记并被用作标记抗体的本公开的组(a)、(b)和(c)中所描述的一种或多种抗体或其抗原结合片段。在一些实施方案中,显色标记是胶体金标记例如胶体金颗粒或荧光标记。
[0108]
在一些实施方案中,本公开的检测产品包括设置在所述基底上的反应区。所述反应区紧邻所述结合区并且可与所述结合区重叠例如重叠1-2 mm,如约1.5 mm。本公开对该反应区的材料也没有任何限制,并且在一些实施方案中可以为硝酸纤维素膜。在一些实施方案中,所述反应区设置有检测区或检测线t和质控区或质控线c。在一些实施方案中,沿着样品流动方向,所述检测区或检测线t位于质控区或质控线c的上游,所述检测区或检测线t靠近结合区,而质控区或质控线c靠近吸收区。
[0109]
在一些实施方案中,所述检测区或检测线t负载有本公开的组(d)和(e)中所描述的一种或多种抗体或其抗原结合片段,其被固定在所述检测区并被用作捕获抗体。在一些实施方案中,所述质控区或质控线c负载有针对本公开的组(a)、(b)和(c)所描述的一种或多种抗体或其结合片段的二级抗体,例如抗人fc二抗。在一些实施方案中,检测区或检测线t的显色情况用肉眼观察得到定性结果或根据读数器测定的数据得到定量检测结果,或者以对照区质控线c的强度为对照,得到半定量检测结果。
[0110]
在一些实施方案中,本公开提供了一个抗体对,其包括本文的抗体r16-f10和p16-a3。在进一步的实施方案中,抗体p16-a3是捕获抗体,而抗体r16-f10是标记抗体,例如胶体金标记抗体。在一些实施方案中,本公开的抗体的包被浓度可以为约1-10 mg/ml,例如1.5-5 mg/ml或2~3 mg/ml。
[0111]
在一些实施方案中,本公开的检测产品包括设置在所述基底上的吸收区。在一些实施方案中,所述吸收区紧邻反应区,并沿着样品流动的方向设置在所述质控区的下游。本公开对所述吸收区的来源和材料没有任何限制,只要能够吸收水性液体从而使得样品流动的材料例如本领域技术人员所熟知的吸水纸均可用于本公开。
[0112]
在一些实施方案中,本公开的检测产品还可包括容纳检测条、棒或试纸的外壳,例如塑料壳。在一些采用塑料壳的实施方案中,所述塑料壳可包括底盖和与所述底盖配合的顶盖,所述底盖具有宽度和长度与检测条、棒或试纸对应的凹槽。所述顶盖上可设置有与样品区和反应区大小相同的孔洞,以便操作者添加样品和观察检测结果。
[0113]
不受限于理论的束缚,本公开的基于双抗夹心法检测冠状病毒(尤其是sars-cov-2)的检测产品或装置可基于以下原理:首先将本公开的捕获抗体固定于检测区/线(t线)上,并将本公开的标记抗体负载于结合区上。结合区上的标记抗体带有显色标记(例如荧光标记或胶体金标记)。在滴加样品例如呼吸道或咽拭子类样本后,样品会向另一端流动,并且当流动至结合区时,样品中的抗原
例如冠状病毒(尤其是sars-cov-2)s蛋白会与结合区上的标记抗体结合,形成“标记抗体-抗原”复合物;当样品继续流动至检测线时,抗原会被t线上的捕获抗体捕获,形成“标记抗体-抗原-捕获抗体”复合物。随着t线上所捕获的抗原的不断增加,t线会出现愈加明显的颜色变化。质控区c线处固定了二抗(例如抗人fc抗体),以确保无论样品中是否含有待测抗原c线都会显色。在显色时间达到15-20 min后,如果t线出现颜色变化,则说明待测样本中含有待测抗原。该沉淀线的颜色强度将与样品中抗原浓度成正比例。
[0114]
本公开的检测产品可采用本领域已知的一般性程序进行制备。在一个实施方案中,本公开的检测产品可按照如下示例性方法进行制备,其包括下列步骤:1) 将标记抗体溶解于缓冲液中,将稀释的标记抗体涂布例如喷涂在结合区如玻璃纤维纸,然后干燥;2) 将捕获抗体溶液划线于反应区上形成检测线t线,将二级抗体(例如抗人fc二抗)溶液划线于反应区上形成质控线c线,并干燥划线的反应区,如在25-37 ℃环境下干燥约10-20 min;和3) 将样品区、结合区、反应区和吸收区依次固定在基底上,并任选地切割成条,得到免疫检测条。
[0115]
本发明对反应区划线的方式并没有限制,采用本领域技术人员熟知的抗体喷涂方式即可。在一个实施方案中,本公开可以采用划线仪进行划线,例如biodot zx-1000ca, usa。
[0116]
本公开的方法和产品可用于新冠病毒poct快检。基于互补表位的双抗体夹心法原理,检测针对新冠病毒表面高表达特异性的spike蛋白rbd结构域,能够有效地区分新冠病毒和sars以及mers病毒。本公开所提供的抗体对还具有高的灵敏度,其检测灵敏度可以达到1 ng/ml、0.9 ng/ml、0.8 ng/ml 0.5 ng/ml、0.3 ng/ml、0.1 ng/ml或更低。相较于常规的igg/igm检测,本公开的检测方法和产品可直接检测样本中病毒的rbd蛋白,从而可以有效避免样本中可能的无关细胞因子类物质对于检测的干扰,有效提高检测的灵敏度和准确性。而且,由于人体产生igg/igm需要一段时间,本公开的针对新冠病毒抗原的双抗体夹心法检测可使得检测窗口显著提前,从而可用于筛查处于潜伏期的个体。
[0117]
此外,本公开的基于双抗体夹心法的产品例如胶体金检测试纸或试剂盒,便于携带和保存,操作简单,方法稳定、可在短时间例如20分钟内完成测试,并且具有可定量和半定量测定的特点。从而,相比于核酸检测,具有检测时间更短,成本更低的特性,特别适合大量样本的筛查。
[0118]
v. 本公开的核酸以及包含其的宿主细胞在一方面,本公开提供了编码本文的特异性结合冠状病毒s蛋白的抗体或其抗原结合片段的核酸。在一个实施方案中,提供包含所述核酸的载体。在一个实施方案中,载体是表达载体。在一个实施方案中,提供包含所述核酸或所述载体的宿主细胞。在一个实施方案中,宿主细胞是真核的。在另一个实施方案中,宿主细胞选自酵母细胞、哺乳动物细胞(例如cho细胞或293细胞)或适用于制备抗体或其抗原结合片段的其它细胞。在另一个实施方案中,宿主细胞是原核的。例如,本公开的核酸包含编码选自seq id no: 1-4和11-12中任一项所示氨基酸序列的核酸,或编码与选自seq id no: 1-4和11-12中任一项所示的氨基酸序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的氨基酸
序列的核酸。在一些实施方案中,本公开的核酸包含seq id no: 13-14中任一项所示的序列或与其具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的序列。
[0119]
本公开还涵盖与下述核酸在严格性条件下杂交的核酸或与下述核酸相比编码具有一个或多个氨基酸取代(例如保守性取代)、缺失或插入的多肽序列的核酸:包含编码选自seq id no: 1-4和11-12中任一项所示氨基酸序列的核酸序列的核酸;或包含编码与选自seq id no: 1-4和11-12中任一项所示的氨基酸序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的氨基酸序列的核酸序列的核酸。
[0120]
本公开还涵盖与下述核酸在严格性条件下杂交的核酸或与下述核酸相比编码具有一个或多个氨基酸取代(例如保守性取代)、缺失或插入的多肽序列的核酸:包含编码选自seq id no: 1-4和11-12中任一项所示氨基酸序列的核酸序列的核酸;或包含编码与选自seq id no: 1-4和11-12中任一项所示的氨基酸序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的氨基酸序列的核酸序列的核酸。
[0121]
在一个实施方案中,提供包含本公开的核酸或多核苷酸的一个或多个载体。在一个实施方案中,载体是表达载体,例如真核表达载体。载体包括但不限于病毒、质粒、粘粒、λ噬菌体或酵母人工染色体(yac)。在一些实施方案中,提供了包含本公开的表达载体的宿主细胞。在一些实施方案中,宿主细胞选自酵母细胞、哺乳动物细胞或适用于制备抗体的其它细胞。合适的宿主细胞包括原核微生物,如大肠杆菌。宿主细胞还可以是真核微生物如丝状真菌或酵母,或各种真核细胞,例如昆虫细胞等。也可以将脊椎动物细胞用作宿主。例如,可以使用被改造以适合于悬浮生长的哺乳动物细胞系。有用的哺乳动物宿主细胞系的例子包括sv40 转化的猴肾cv1 系(cos-7);人胚肾系(hek 293 或293f 细胞)、293 细胞、幼仓鼠肾细胞(bhk)、猴肾细胞(cv1)、非洲绿猴肾细胞(vero-76)、人宫颈癌细胞(hela)、犬肾细胞(mdck)、布法罗大鼠肝脏细胞(brl 3a)、人肺细胞(w138)、人肝脏细胞(hep g2)、中国仓鼠卵巢细胞(cho 细胞)、chos 细胞、nso 细胞、骨髓瘤细胞系如y0、ns0、p3x63 和sp2/0 等。适于产生蛋白质的哺乳动物宿主细胞系的综述参见例如yazaki 和wu,methods in molecular biology,第248 卷(b.k.c. lo编著,humana press,totowa,nj),第255-268 页(2003)。在一个优选的实施方案中,所述宿主细胞是cho细胞或293细胞。一旦已经制备了用于表达的表达载体或dna序列,则可以将表达载体转染或引入适宜的宿主细胞中。多种技术可以用来实现这个目的,例如,原生质体融合、磷酸钙沉淀、电穿孔、逆转录病毒的转导、病毒转染、基因枪、基于脂质的转染或其他常规技术。在原生质体融合的情况下,将细胞在培养基中培育并且筛选适宜的活性。用于培养所产生的转染细胞和用于回收产生的抗体分子的方法和条件是本领域技术人员已知的并且可以基于本说明书和现有技术已知的方法,根据使用的特定表达载体和哺乳动物宿主细胞变动或优化。另外,可以通过引入允许选择已转染的宿主细胞的一个或多个标记物,选出已经稳定将dna掺入至其染色体中的细胞。标记物可以例如向营养缺陷型宿主提供原养型、杀生物抗性(例如,抗生素)或重金属(如铜)抗性等。可选择标记基因可以与待表达的dna 序列直接连接或通过共转化引入相同的细胞中。也可能需要额外元件以便最佳合成mrna。这些元件可以包括剪接信号,以及转录启动子、增强子和终止信号。
[0122]
vi. 本公开的抗体的生产和纯化
在一个实施方案中,本公开提供了制备本公开的抗体或方法,其中所述方法包括在适于表达所述抗体或其抗原结合部分的条件下培养包含编码所述抗体或其抗原结合部分的核酸或包含所述核酸的表达载体的宿主细胞,以及任选地分离所述抗体或其抗原结合部分。在一些实施方案中,所述方法还包括从所述宿主细胞(或宿主细胞培养基)回收所述抗体或其抗原结合部分。
[0123]
为了重组产生本公开的抗体或其抗原结合部分,首先获得本编码公开的抗体或其抗原结合部分的核酸,并将所述核酸插入载体,用于在宿主细胞中进一步克隆和/或表达。此类核酸易于使用常规规程分离和测序,例如通过使用能够与编码本公开的抗体或其抗原结合部分的核酸特异性结合的寡核苷酸探针进行。
[0124]
如本文所述制备的本公开的抗体或其抗原结合部分可以通过已知的现有技术如高效液相色谱、离子交换层析、凝胶电泳、亲和层析、大小排阻层析等纯化。用来纯化特定蛋白质的实际条件还取决于净电荷、疏水性、亲水性等因素,并且这些对本领域技术人员是显而易见的。可以通过多种熟知分析方法中的任一种方法确定本公开的抗体或其抗原结合片段的纯度,包括大小排阻层析、凝胶电泳、高效液相色谱等。
[0125]
vii. 本公开的抗体或其抗原结合部分的活性测定法可以通过本领域中已知的多种测定法对本文中提供的抗体或其抗原结合部分进行鉴定、筛选、或表征其物理/化学特性和/或生物学活性。一方面,对本公开的抗体或其抗原结合部分测试其抗原结合活性,例如通过已知的方法诸如elisa、western印迹等来进行。可使用本领域已知方法来测定对冠状病毒s蛋白的结合。在一些实施方案中,使用spr或生物膜层干涉测定本公开的抗体或其抗原结合部分对冠状病毒s蛋白的结合。本公开还提供了用于鉴定具有生物学活性的抗体或其抗原结合部分的测定法。生物学活性可以包括例如阻断对细胞表面ace2的结合。
[0126]
viii. 药物组合和药物制剂本领域技术人员将理解,由于本公开的抗体可特异性结合冠状病毒s蛋白rbd区,其也可以用作阻断抗体或中和抗体用于预防或治疗冠状病毒感染、尤其是sars-cov-2感染。
[0127]
在一些实施方案中,本公开提供包含本文所述的任何抗体或其抗原结合部分的组合物,优选地组合物为药物组合物。在一个实施方案中,所述组合物还包含药学上可接受的载体例如药用辅料。在一个实施方案中,组合物(例如,药物组合物)包含本公开的药学上可接受的载体,以及一种或多种其它治疗剂(例如抗感染活性剂、小分子药物)的组合。适合于本公开的抗感染活性剂、小分子药物可以是用来治疗、预防或缓解受试者中冠状病毒感染的任何抗感染活性剂、小分子药物,包括但不限于瑞德西韦、利巴韦林、奥司他韦、扎那米韦、羟氯喹、干扰素-α2b、镇痛药、阿奇霉素和皮质类固醇。在本公开的上下文中,冠状病毒感染包括由冠状病毒(尤其是sars-cov-2)引起的感染。
[0128]
在一些实施方案中,本公开的药物组合物或药物制剂包含合适的药学上可接受的载体例如药用辅料,如本领域中已知的药用载体、药用赋形剂,包括缓冲剂。如本文所用,“药学上可接受的载体”或“药用载体”包括生理上相容的任何和全部溶剂、分散介质、等渗剂和吸收延迟剂等。适用于本公开的药用载体可以是无菌液体,如水和油,包括那些石油、动物、植物或合成来源的,如花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组合物时,水是优选的载体。还可以将盐水溶液和水性右旋糖以及甘油溶液用作液体载体,特别是
用于可注射溶液。合适的赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米、面粉、白垩、硅胶、硬脂酸钠、甘油单硬脂酸酯、滑石、氯化钠、干燥的脱脂乳、甘油、丙烯、二醇、水、乙醇等。对于赋形剂的使用及其用途,亦参见“handbook of pharmaceuticalexcipients”, 第五版, r.c.rowe, p.j.seskey 和s.c.owen, pharmaceutical press, london,chicago。若期望的话,所述组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂。这些组合物可以采用溶液、悬浮液、乳剂、片剂、丸剂、胶囊剂、粉末、持续释放配制剂等的形式。口服配制剂可以包含标准药用载体和/或赋形剂,如药用级甘露醇、乳糖、淀粉、硬脂酸镁、糖精。可以通过将具有所需纯度的本公开的抗体或其抗原结合片段与一种或多种任选的药用辅料(remington
’
s pharmaceutical sciences,第16 版,osol,a. 编(1980))混合来制备包含本文所述的药物制剂或药物组合物,优选地以冻干制剂或水溶液的形式。本公开的药物组合物或制剂还可以包含超过一种活性成分,所述活性成分是被治疗的特定适应症所需的,优选具有不会不利地彼此影响的互补活性的那些活性成分。例如,理想的是还提供其它抗感染活性成分,例如其它抗体、抗感染活性剂、小分子药物或免疫调节剂等。所述活性成分以对于目的用途有效的量合适地组合存在。可制备持续释放制剂。持续释放制剂的合适实例包括含有本公开的抗体或其抗原结合片段的固体疏水聚合物的半渗透基质,所述基质呈成形物品,例如薄膜或微囊形式。
[0129]
ix. 组合产品或试剂盒在一些实施方案中,本公开还提供了组合产品,其包含至少一种本公开的抗体或其抗原结合部分,或者还包含一种或多种其它治疗剂(例如,抗感染活性剂、小分子药物或免疫调节剂等)。
[0130]
在一些实施方案中,本公开的组合产品中的两种或多种成分可以依次、分开或同时联合施用给受试者。
[0131]
在一些实施方案中,本公开还提供了包含本公开的抗体或其抗原结合部分、药物组合物或组合产品的试剂盒,以及任选的指导施用的包装插页。在一些实施方案中,本公开还提供了包含本公开的抗体或其抗原结合部分、药物组合物、组合产品的药物制品,任选地,所述药物制品还包括指导施用的包装插页。
[0132]
x. 本公开的抗体或其抗原结合部分的预防和/或治疗用途本公开提供了一种用于预防受试者中冠状病毒相关疾病或病患例如冠状病毒感染(尤其是covid-19)的方法,其包括向受试者施用本公开的抗体或其抗原结合部分。具有冠状病毒相关疾病风险的受试者包括与感染者接触的受试者或以一些其他方式暴露于冠状病毒的受试者。预防剂的施用可以在表现出冠状病毒相关疾病的症状特征之前施用,以便阻止疾病,或可选择地延迟疾病的进展。
[0133]
本公开还提供了治疗患者中冠状病毒相关疾病例如冠状病毒感染(优选covid-19)的方法。在一个实施方案中,该方法涉及将中和冠状病毒的本公开的抗体或其抗原结合部分或者抗体组合施用至患所述疾病的患者。
[0134]
在一些实施方案中,提供了治疗患者中冠状病毒感染的方法,所述方法包括施用本公开的抗体或其抗原结合部分。在一个优选的实施方案中,将本公开的抗体或其抗原结合部分的两种一起施用给所述患者。在一些实施方案中,本公开的抗体或其抗原结合部分可以交叉中和人和动物传染性冠状病毒分离株。在一些实施方案中,本公开的抗体或其抗
原结合部分在冠状病毒感染后的最初24小时内施用。
[0135]
本公开的药物组合物可以通过各种途径体内施用至有需要的受试者,所述途径包括但不限于口服、静脉内、动脉内、皮下、肠胃外、鼻内、肌内、气管内、口腔、腹膜内、皮内、局部、经皮和鞘内或者通过吸入。本公开的药物组合物可以配制成固体、半固体、液体或气体形式的制剂;包括但不限于片剂、胶囊剂、粉剂、颗粒剂、软膏剂、溶液剂、注射剂、吸入剂和气雾剂。根据预期的应用和治疗方案可以选择合适的制剂和施用途径。施用频率可以在治疗过程中确定和调整。在一些实施方案中,施用的剂量可以被调节或减少以控制潜在的副作用和/或毒性。或者,本公开的用于治疗的药物组合物的持续连续释放制剂可能是合适的。本领域技术人员将会理解,合适的剂量可因患者而异。确定最佳剂量通常涉及治疗益处水平与任何风险或有害副作用的平衡。所选择的剂量水平将取决于多种因素,包括但不限于特定抗体或其抗原结合部分的活性、施用途径、施用时间、清除速率、治疗持续时间、其他联合使用的药物、病症的严重程度、以及物种,患者的性别、年龄、体重、病情、一般健康状况和以前的病史等。抗体或其抗原结合部分的量和施用途径最终由医生、兽医或临床医师决定,但通常选择剂量以达到实现所需效果的作用部位处的局部浓度,而不会导致实质性的有害或不利副作用。通常,本公开的抗体或其抗原结合部分可以以各种剂量范围施用。在一些实施方案中,本文提供的抗体或其抗原结合部分可以以约0.01 mg/kg 至约100 mg/kg(例如约0.01 mg/kg, 约0.5 mg/kg, 约1 mg/kg, 约2 mg/kg, 约5 mg/kg, 约10 mg/kg, 约15 mg/kg, 约20 mg/kg, 约25 mg/kg, 约30 mg/kg,约35 mg/kg, 约40 mg/kg, 约45 mg/kg, 约50 mg/kg, 约55 mg/kg, 约60 mg/kg, 约65 mg/kg, 约70 mg/kg, 约75 mg/kg, 约80 mg/kg, 约85 mg/kg,约90 mg/kg, 约95 mg/kg, 或约100 mg/kg)的治疗有效剂量施用。在这些实施方案的某些中,抗体或其抗原结合部分以约50 mg/kg 或更低的剂量施用,并且在这些实施方案中的某些中,剂量为10 mg/kg 或更低,5 mg/kg 或更低,1 mg/kg 或更低,0.5 mg/kg 或更低,或者0.1 mg/kg 或更低。在某些实施方案中,施用剂量可以在治疗过程中改变。例如,在某些实施方案中,初始施用剂量可以高于后续施用剂量。在某些实施方案中,取决于受试者的反应,施用剂量可以在治疗过程中变化。本领域技术人员可以确定施用频率,例如主治医生基于所治疗病症、所治疗受试者的年龄、所治疗病症的严重程度、所治疗受试者的一般健康状况等的考虑。在某些优选的实施方案中,涉及本公开的抗体或其抗原结合部分的治疗过程将包含在数周或数月的时间内施用的多剂量的所选药物。更具体地说,本公开的抗体或其抗原结合部分可以每天、每两天、每四天、每周、每十天、每两周、每三周或更长间隔施用。就此而言,可以理解的是,可以基于患者响应和临床实践来改变剂量或者调整间隔。
[0136]
实施例通过参考以下实施例将更容易地理解本文一般地描述的本公开,这些实施例是以举例说明的方式提供的,并且不旨在限制本公开的范围。这些实施例并不旨在表示下面的实验是全部或仅进行的实验。
[0137]
其中,靶向sars-cov-2冠状病毒s蛋白的全人源抗体产生的过程如图1所示。
[0138]
实施例1 冠状病毒s蛋白抗原的制备和检测用ace2的制备实施例中共用到如下抗原和ace2蛋白:s蛋白rbd-his(319arg-532asn)、人ace2-hufc(18gln-740ser)、人ace2-his(18gln-740ser)、s蛋白rbd-mfc(购自sinobio,40592-v05h),
ml离心管中。将离心管倾斜并分批次沿管壁缓慢加入15 ml采集的正常人血液,使得ficoll-paque密度梯度分离液与正常人血液保持清晰的分离界面。将装有所述血液和分离液的50 ml离心管于15℃左右离心20 min,其中将离心机设置为400 g,加速度为3,减速为0的参数。离心之后,整个液面分为四层,上层为血浆混合物,下层为红细胞和粒细胞,中层为ficoll-paque液体。在上、中层交界处有以pbmc为主的白色云雾层狭窄带,即pbmc细胞层。用无菌巴氏吸管小心地吸去上层的血浆混合物,然后再用新的无菌巴氏吸管吸取pbmc,获得分离的pbmc。将分离的pbmc先用pbs润洗两遍,再在4℃下以1500 rpm的转速离心10 min,最后用1.5 ml的pbs重悬,并通过细胞计数仪(countstar,countstar altair)计数。
[0146]
通过常规方法自分离的pbmc细胞提取总rna。使用反转录试剂盒(购自takara公司,目录号:6210a)将提取的总rna反转录成cdna。基于重链和轻链种系基因的序列相似度,分别在重链和轻链的v区前端和第一个恒定区后端设计简并引物(李晓琳,大容量非免疫人源性fab噬菌体抗体库的构建及初步筛选,《中国协和医科大学》硕士学位论文,2007年6月),pcr后得到抗体的重链可变区基因片段和轻链可变区基因片段。回收抗体的重链可变区基因片段和轻链可变区基因片段后,通过融合pcr方法扩增得到含有抗体的轻重链可变区的片段,接着,对该pcr产物和噬菌体展示用载体进行酶切、回收和连接,连接产物通过回收试剂盒(omega,目录号:d6492-02)回收,具体材料和方法参见上文李晓琳的论文。最后,通过电转仪(bio-rad,micropulser)转化至感受态大肠杆菌ss320(lucigen,mc1061 f)中,并将经转化的大肠杆菌ss320菌液涂布于具有氨苄青霉素抗性的2-yt固体平板(固体平板由1.5%的胰蛋白胨,1%的酵母提取物,0.5%的nacl,1.5%的琼脂,按质量体积g/ml配制而成)。
[0147]
2.2 抗体基因库容的计算取经转化的大肠杆菌ss320菌液用无抗生素的2yt培养液以1:50的体积进行接菌,37℃,220 rpm培养1.5-2 h至od600达到0.5-0.6后取出至室温。将菌液按照90 μl/孔添加到96孔圆底稀释板中。每个菌液样品进行10倍梯度稀释,共12个稀释梯度。将稀释好的样品使用8道10 μl量程移液器,吸取2 μl的液体按照稀释梯度从低到高的顺序加到羧苄青霉素和四环素浓度分别为50μg/ml和50μg/ml的2yt (下文中也简称为c+/t+ 2yt)平板上,正置5 min后倒置放在37℃培养过夜。第二天观察克隆生长的情况,并计算库容。库容的计算方法如下,从a行开始,依次标记为1、2、3、4、5、6、7、8到x行。首先选择计数孔,先将克隆数目在3-20个克隆的计数孔选出,得出行数x,并数出对应孔中的克隆数n,计算公式为5
×
100
×
10x
×
n,经计算,获得了每毫升菌液库容大小为3
×
10
11
cfu,即3
×
10
11
个抗体基因的抗体基因库。
[0148]
2.3抗体基因噬菌体展示文库的制备基于抗体基因库容容量,吸取50个od(1 个od为5
×
10
8 cfu)的全人抗体基因库的菌液加入到新鲜的2-yt液体培养基中,使得初始od值为0.1。将所得物置于37℃,220 rpm的摇床中培养至对数生长期(od600=0.6左右),再以50倍于细菌数的数量(即,感染复数(moi)为大约50)加入vscm13辅助噬菌体(购自stratagene),充分混匀,静置30 min后在220 rpm的摇床中继续培养1 h。随后,将培养物以10000 rpm的转速离心5 min后,弃上清,将培养液替换为羧苄青霉素50 μg/ml /卡那霉素40 μg/ml双抗性的2-yt培养基(下文也称为c+/k+ 2-yt培养基),并于30℃,220 rpm继续培养过夜。次日,菌液于13000g离心10 min,收集上清后加
入20% peg/nacl(由体积浓度为 20%的peg6000和2.5 m nacl配制而成)使得peg/nacl最终浓度为4%,混匀,并置于冰上1 h,再以13000 g的转速离心10 min,将沉淀的噬菌体用pbs润洗后保存并用于后续噬菌体筛选。
[0149]
2.4 抗体基因噬菌体展示文库的筛选2.4.1磁珠法筛选抗体基因噬菌体展示文库磁珠法筛选是基于将抗原蛋白(spike-rbd-mfc,sinobio,40592-v05h)进行生物素标记后,再与偶联有链霉亲和素的磁珠结合,通过将结合抗原的磁珠和抗体基因噬菌体展示文库进行孵育、洗涤和洗脱的淘选过程,通常经历3-4轮的淘选,由此针对抗原的特异性单克隆抗体可以大量富集。本实施例中,将生物素标记的sars-cov-2冠状病毒rbd蛋白用于噬菌体展示文库筛选,经过3轮淘选后进行针对rbd蛋白的单克隆抗体初筛。
[0150]
抗体筛选的具体实施方法如下:首先用生物素标记的sars-cov-2冠状病毒rbd蛋白(spike-rbd-mfc,sinobio,40592-v05h)与链霉亲和素偶联的磁珠孵育,使得生物素标记的rbd蛋白结合到磁珠上。将结合rbd蛋白的磁珠和构建的噬菌体库室温下孵育2 h。经pbst洗涤6-8次后,去除非特异性吸附的噬菌体,加入trypsin(gibco,25200072)轻轻混匀并反应20 min,以洗脱特异性结合的抗体展示噬菌体。随后,用洗脱下来的噬菌体侵染对数期的ss320菌体(lucigen, mc1061 f)并静置30 min,然后在220 rpm条件下培养1 h,再加入vscm13辅助噬菌体并静置30 min,继续在220 rpm条件下培养1 h,离心并置换至c+/k+ 2-yt培养基中,最终得到的噬菌体继续用于下一轮的淘选。
[0151]
2.4.2免疫管法筛选抗体基因噬菌体展示文库免疫管法和磁珠法的目的均为富集针对抗原的特异性抗体,为两个相互补充和验证的实验方法。
[0152]
免疫管法筛选的原理是将sars-cov-2冠状病毒rbd蛋白(spike-rbd-mfc,sinobio,40592-v05h)包被在具有高吸附力的免疫管表面,通过将噬菌体展示抗体文库加入免疫管中并和吸附于免疫管表面的抗原蛋白进行孵育、洗涤和洗脱的淘选过程,经历2-4轮淘选,最终将针对抗原的特异性单克隆抗体富集下来。
[0153]
具体实施方法如下:第一轮筛选时,在免疫管中加入1 ml 100 μg/ml的rbd-mfc,4℃包被过夜。第二天弃去包被液,加入5%牛奶的pbs封闭2 h,pbs润洗两次后加入构建的总量为1014个全人抗体基因的噬菌体库,孵育2 h。用pbs润洗8遍,然后用pbst润洗2遍,以去除非特异性结合的噬菌体,然后向免疫管中加入0.8 ml 含0.05% edta的胰酶消化液,用于洗脱特异性结合目标抗原的噬菌体。接着将其侵染对数期的ss320菌体(lucigen,60512-1),37℃静置30 min,然后220 rpm条件下培养1 h,再加入vscm13辅助噬菌体,静置30 min。继续在220 rpm条件下培养1 h,离心并置换至c+/k+ 2-yt培养基中,并于30℃,220 rpm环境下继续培养过夜。第二天沉淀噬菌体,用于后续2-4轮的筛选。通常用于第二轮、第三轮和第四轮噬菌体筛选的抗原包被浓度依次递减,分别为30μg/ml,10μg/ml和3 μg/ml;除此之外,pbs润洗强度也逐渐加大,pbs洗脱次数依次为12次,16次和20次。
[0154]
对每轮洗脱下来的噬菌体池进行elisa检测来评价富集的效果,并从每轮筛选的噬菌体池中随机挑选10个克隆进行序列分析,结果显示在图3a和图3b中,结果显示每一轮
都有更好的富集,其中富集最好的是3rd-1。
[0155]
结果表明,第三轮筛选后抗体序列富集明显,因此,选择第三轮所得的克隆进行elisa的阳性克隆筛选。
[0156]
2.5单克隆的挑选在共四轮筛选后,选择第三轮所得的克隆进行elisa的阳性克隆elisa筛选。最终,在2304个克隆中共筛选到88个能够与rbd蛋白结合的阳性克隆,经测序分析、elisa结合和fab水平的facs阻断检测后,最终选取了10个克隆的序列构建全长抗体以进行进一步的实验。具体实施方法如下。
[0157]
2.5.1 阳性克隆测序与分析在完成初筛工作后,对88个能够与rbd蛋白结合的阳性克隆进行编号,吸取2 μl菌液到2 ml的2 yt培养基中,37℃,220 rpm 培养过夜,提取质粒进行二代测序。测序结果通过seqman将原始的ab1文件整合、比对、去掉非抗体基因序列,生成抗体基因整合版的fasta文件。随后将dna序列通过mega6翻译为氨基酸序列,并通过氨基酸序列找出含有终止子、非常规序列等,导出氨基酸序列的fasta文件。
[0158]
2.5.2 elisa测定法检测fab形式抗体的亲和效果首先挑取第三轮筛选的克隆于含有300 μl 2-yt 培养基的96孔深孔板中,37℃培养过夜,上清即含有表达的fab,取上清,梯度稀释后加入到包被2 μg/ml rbd-mfc的elisa板中,然后用hrp标记的山羊抗人fab作为二抗(goat anti-human fab-hrp, thermofisher, 31482, 1:6000稀释)进行检测,信号值越高,表明亲和力越强。结果表明,在elisa测定法中,9个抗体的fab均表现出了较好的亲和活性。
[0159]
实施例3 全长抗体的构建、表达和纯化在本实施例中,将实施例2中获得的9个对结合s-rbd蛋白活性较好的fab抗体构建为人igg1型,其中轻链均为κ型,抗体类型为全人抗体,其中以抗体r14-f8、r16-f10为例进行过程描述。
[0160]
3.1 质粒构建从筛选获得的含有fab抗体菌株中,pcr扩增获取抗体轻、重链可变区片段,通过同源重组方法,分别构建至经过改造的含有轻、重链恒定区片段的真核表达载体质粒pcdna3.3-topo(invitrogen)上)。
[0161]
3.2 质粒准备将构建好的含抗体轻重链全长基因的载体分别转化到大肠杆菌ss320中,37℃过夜培养,利用无内毒素质粒提取试剂盒(omega,d6950-01)进行质粒提取,得到无内毒素的抗体轻重链质粒以供真核表达使用。
[0162]
3.3 抗体的表达纯化候选抗体r14-f8、r16-f10是通过expicho瞬转表达系统(thermo fisher,a29133)表达的,具体方法如下:转染当天,确认细胞密度为7
×
10
6
至1
×
10
7
个活细胞/ml左右,细胞存活率>98%。此时,用37 ℃预温的新鲜expi cho 表达培养基将细胞调整到终浓度为6
×
10
6
个细胞/ml。用4℃预冷的optiprotm sfm稀释目的质粒(向1 ml所述培养基中加入1 μg质粒)。同时,用optiprotm sfm稀释 expifectaminetm cho,再将两者等体积混合并轻轻吹打混匀制备成
expifectaminetm cho/质粒dna混合液,室温孵育1-5 min,缓慢加入到准备好的细胞悬液中,并同时轻轻摇晃,最后置于细胞培养摇床中,在37℃,8% co
2
条件下培养。
[0163]
在转染后18-22 h,向培养液中添加expichotmenhancer和expichotmfeed,摇瓶放置于32℃摇床和5% co
2
条件下继续培养。在转染后的第5天,添加相同体积的expichotmfeed,缓慢加入的同时轻轻混匀细胞混悬液。在转染7-15天后,将表达有目的蛋白的细胞培养上清于15000 g高速离心10 min,所得上清用mabselect sure lx(ge,17547403) 进行亲和纯化,然后用100 mm 乙酸钠(ph 3.0)洗脱目的蛋白,接着用1 m tris-hcl中和,最后通过超滤浓缩管(millipore,ufc901096)将所得蛋白置换至pbs缓冲液中。
[0164]
3.4 抗体的浓度测定将经纯化的抗体蛋白用经验证过的超微量分光光度计(杭州奥盛仪器有限公司,nano-300)进行浓度测定,将经测定的a280数值除以抗体理论消光系数后的数值作为后续研究的抗体浓度值,质检合格后,分装并保存于-80℃。
[0165]
实施例4 蛋白水平候选抗体的亲和活性在本实施例中,挑选检测了其中的3个候选抗体验证全长抗体对sars-cov-2冠状病毒s蛋白的亲和活性。
[0166]
4.1 基于elisa检测候选抗体的亲和活性在96孔elisa板上,包被重组的sars-cov-2冠状病毒spike-rbd-his,2 μg/ml,30 μl/孔,4℃过夜。次日,将孔板用pbst洗3次后用5%脱脂牛奶封闭2 h,用pbst洗板3次后,加入梯度稀释(梯度浓度见图4)的3个候选抗体,并孵育1 h。之后,用pbst清洗3次后以1:5000加入hrp标记的抗人fc二抗(abcam,ab98624)并孵育1 h。 孵育完成后,pbst洗板六次,加tmb (surmodics,tmbs-1000-01)显色。根据显色结果,加入2m 的hcl终止反应,通过酶标仪(molecular devices,spectermax 190)在od450下读板,结果显示在图4中,结果表明,3个候选抗体(分别命名为r14-f8抗体、r16-f10抗体、p16-a3抗体)具有优异的对s蛋白的亲和活性。说明经过全长构建后的抗体具有同样对rbd结构域结合的亲和力。
[0167]
实施例5 蛋白水平对候选抗体的结合表位进行分组在本实施例中,挑选了9个候选抗体对结合sars-cov-2冠状病毒s蛋白的表位进行了分组。
[0168]
5.1 双抗体夹心法对候选抗体的表位进行分组在本实施例中,双抗体夹心法包含前期方法开发的过程,根据开发结果,确定实际使用的兼具灵敏度及稳定性的参数。
[0169]
对9个候选抗体进行包被,2 μg/ml,30 μl/孔,4℃过夜。次日,将孔板用pbst洗3次后用5%脱脂牛奶封闭2 h。然后,加入spike rbd-his,2 μg/ml,30 μl/孔,孵育1 h。之后,用pbst清洗3次后分别加入梯度稀释的9个生物素化的候选抗体(棋盘法),30 μl/孔,孵育1 h。之后,用pbst清洗3次后加入二抗neutravidin-hrp(thermofisher,31001)并孵育1 h。孵育完成后,pbst洗板六次,加tmb(surmodics,tmbs-1000-01)显色。根据显色结果,加入2m hcl终止反应,通过酶标仪(molecular devices,spectermax 190)在od450下读板。抗体间的表位分组结果显示在下表中。结果显示,在结合sars-cov-2冠状病毒s蛋白的rbd域上,9个候选抗体可以分成两组表位,即表c中的表位1和表位2。
[0170]
表c5.2 双抗体夹心法下检测spike rbd蛋白的效果在本实施例中,因为使用相同浓度的spike rbd蛋白,因此对其检测效果的评价主要来自od450和ec50。图5a和图5b的结果显示,在双抗体夹心法下,p16-a3和r16-f10这对配对抗体检测sars-cov-2冠状病毒s蛋白的rbd效果更加优异。图5a中将不同的候选抗体包被在elisa板上,液相使用r16-f10进行生物素标记,由图中可以看出,当p16-a3包被在elisa板上,r16-f10进行生物素标记时,其ec50为0.05 μg/ml。图5b中将不同的候选抗体包被在elisa板上,液相使用p16-a3进行生物素标记,由图中可以看出,当r16-f10包被在elisa板上,p16-a3进行生物素标记时几乎没有上平台,检测效果较差。因此,对于这2个候选抗体而言,当r16-f10处于液相,p16-a3处于固相时,对sars-cov-2冠状病毒s蛋白的结合能力将更高。
[0171]
实施例6 胶体金检测卡检测sars-cov-2冠状病毒spike rbd蛋白在本实施例中,将结合表位1的抗体r16-f10和结合表位2的抗体p16-a3用于制备胶体金检测卡,测试其检测sars-cov-2冠状病毒s蛋白的灵敏度。
[0172]
6.1 胶体金检测卡的制备在本实施例中,按照中国专利申请cn102747040a中实施例中所描述的方法,采用上述配对抗体,制备胶体金检测卡,并通过了各项质量检测。在该检测卡中,抗体p16-a3用作捕获抗体,抗体r16-f10用作标记抗体。
[0173]
6.2 灵敏度测定在本实施例中,将sars-cov-2冠状病毒spike rbd蛋白从2 μg/ml开始进行2倍梯度稀释至650 pg/ml。将梯度稀释的spike rbd蛋白,分别以每孔120 μl的体积加入胶体金检测卡的加样孔内(卡片左泳道),显色20min,其中,c线为质控线,t线为检测线,设置3个平行组,设置9个空白对照(只加稀释液)。如图6所示,检测卡对于sars-cov-2冠状病毒spike rbd蛋白的检测灵敏度可达1 ng/ml。注:卡片右泳道为其它方案,本公开不做阐述。
[0174]
实施例7 基于elisa检测抗体r16-f10与sars和mers重组蛋白的交叉结合特性在本实施例中,评价抗体r16-f10与sars-cov-2冠状病毒s蛋白、sars重组蛋白、mers重组蛋白的交叉结合。
[0175]
基于elisa检测候选抗体的交叉结合活性在96孔elisa板上,分别包被重组的sars-cov-2冠状病毒spike-rbd-his、sars-his和mers-his,2 μg/ml,30 μl/孔,4℃过夜。次日,将孔板用pbst洗3次后用5%脱脂牛奶封闭2 h,用pbst洗板3次后,分别加入梯度稀释(梯度浓度见图7)的r16-f10和cr3022抗体,并孵育1 h。之后,用pbst清洗3次后以1:5000加入hrp标记的抗人fc二抗(abcam,ab98624)并孵育1 h。孵育完成后,pbst洗板六次,加tmb (surmodics,tmbs-1000-01)显色。根据显色结果,加入2m的hcl终止反应,通过酶标仪(molecular devices,spectermax 190)在od450下读板,结果显示在图7中。结果表明,r16-f10具有优异的对spike rbd蛋白的亲和活性,r16-f10仅
与sars重组蛋白具有较弱的交叉结合,而与mers重组蛋白无交叉结合。
[0176]
序列表概述
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



