一种产L-氨基酸的重组菌株及其构建方法与应用与流程
 2021-02-02 08:02:40|
2021-02-02 08:02:40| 323|
323| 起点商标网
起点商标网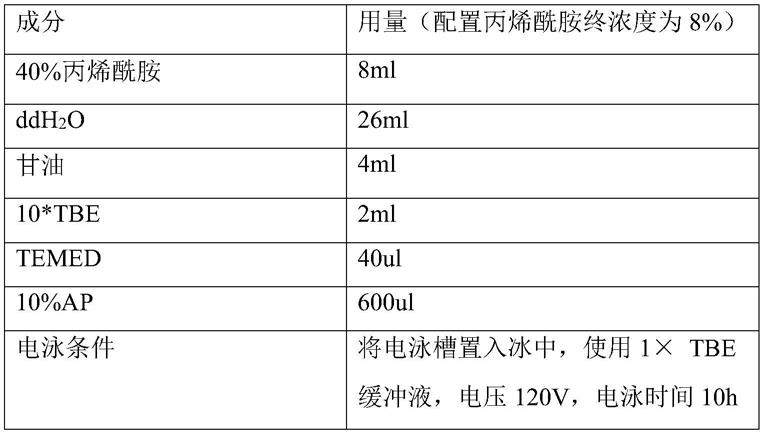
一种产l-氨基酸的重组菌株及其构建方法与应用
技术领域
[0001]
本发明属于基因工程和微生物技术领域,具体涉及一种产l-氨基酸的重组菌株及其构建方法与应用。
背景技术:
[0002]
l-赖氨酸(l-lysine)应用范围广泛,包括医药、食品、饲料等各方面,其中被应用于饲料添加剂的l-赖氨酸占总量的90%以上。当前,我国是l-赖氨酸第二大消费市场,第一大l-赖氨酸生产国。
[0003]
目前l-赖氨酸主要采用直接发酵法生产,直接发酵法利用具备完整l-赖氨酸生物合成途径的菌株,以废糖蜜、淀粉水解液等为底物,通过好氧发酵生产。该方法占当今世界l-赖氨酸生产的2/3,工艺已十分成熟,该方法主要存在于酵母、细菌、霉菌之中,在微生物中广泛存在。目前,工业上用于l-赖氨酸发酵的生产菌种主要是棒状杆菌和短杆菌属的诱变育种突变株。随着代谢工程和基因工程的发展,使得基因突变可控,因此在利用代谢工程改造出发菌株的过程中,能够精确找到代谢过程中l-赖氨酸生产的关键酶基因,然后提高关键酶基因的表达,l-赖氨酸产量的提高才有可能实现。
[0004]
l-谷氨酸主要用于生产味精、香料,以及用作代盐剂、营养增补剂和生化试剂等。l-谷氨酸本身可用作药物,参与脑内蛋白质和糖的代谢,促进氧化过程,该品在体内与氨结合成无毒的谷酰胺,使血氨下降,减轻肝昏迷症状。过去生产味精主要用小麦面筋(谷蛋白)水解法进行,现改用微生物发酵法来进行大规模生产。
技术实现要素:
[0005]
本发明的目的是开发具有l-氨基酸生产能力的新菌株,从而提供一种有效生产l-氨基酸的方法。
[0006]
为了实现上述目的,本发明的发明人通过研究发现,现有技术未知具有发酵氨基酸生产能力的ncgl0609基因通过修饰该基因或改善其表达,能够具备高效的l-氨基酸生产能力。基于这些发现,完成了本发明。
[0007]
本发明提供了生成l-氨基酸的细菌,其中编码seq id no:3的氨基酸序列的多核苷酸的表达被改善。本发明还提供了通过使用所述微生物生产l-氨基酸的方法。
[0008]
本发明的第一个方面提供了生成l-氨基酸的细菌,其中编码seq id no:3的氨基酸序列的多核苷酸的表达改善。根据本发明,所述表达改善是所述多核苷酸表达增强,或者编码seq id no:3的氨基酸序列的多核苷酸具有点突变,或者编码seq id no:3的氨基酸序列的多核苷酸具有点突变且表达是增强的。
[0009]
所述seq id no:3的氨基酸序列是基因ncgl0609编码的蛋白。
[0010]
所述细菌具有增强的l-氨基酸生产能力。
[0011]
具有l-氨基酸生产能力的细菌可以是能够在培养基中以优选0.5g/l以上,更优选1.0g/l以上的量积累目标l-氨基酸的细菌。
[0012]
所述多核苷酸可以编码与seq id no:3的氨基酸序列具有约90%或更高、约92%或更高、约95%或更高、约97%或更高、约98%或更高、或约99%或更高的序列同源性的氨基酸序列。
[0013]
可以通过如下手段增强多核苷酸的表达:通过取代或突变表达调节序列、对多核苷酸序列引入突变、通过经由染色体插入或载体导入的多核苷酸拷贝数的增加、或其组合等。
[0014]
可以修饰多核苷酸的表达调节序列。表达调节序列控制与其可操作连接的多核苷酸的表达,并且例如可以包括启动子、终止子、增强子、沉默子等。多核苷酸可以具有起始密码子的变化。可以将多核苷酸掺入染色体的特定位点中,从而增加拷贝数。在本文,特定的位点可以包括例如转座子位点或基因间位点。另外,可以将多核苷酸掺入表达载体中,将所述表达载体导入宿主细胞中,从而增加拷贝数。
[0015]
在本发明的一种实施方式中,通过将多核苷酸或者具有点突变的多核苷酸掺入微生物染色体的特定位点中,从而增加拷贝数。
[0016]
在本发明的一种实施方式中,通过将带有启动子序列的多核苷酸或者带有启动子序列的具有点突变的多核苷酸掺入微生物染色体的特定位点中,从而过表达所述核酸序列。
[0017]
在本发明的一种实施方式中,将多核苷酸或者具有点突变的多核苷酸掺入表达载体中,将所述表达载体导入宿主细胞中,从而增加拷贝数。
[0018]
在本发明的一种实施方式中,将带有启动子序列的多核苷酸或者带有启动子序列的具有点突变的多核苷酸掺入表达载体中,将所述表达载体导入宿主细胞中,从而过表达所述氨基酸序列。
[0019]
在本发明的一个具体实施方式中,所述被改善表达的多核苷酸包含seq id no:1的核苷酸序列。
[0020]
在本发明的一种实施方式中,所述表达改善是指编码seq id no:3的氨基酸序列的多核苷酸具有点突变,使得seq id no:3的氨基酸序列的第334位精氨酸替换为终止子。
[0021]
根据本发明,seq id no:3所示的氨基酸序列,其中第334位精氨酸被终止子取代后的氨基酸序列如seq id no:4所示。
[0022]
在本发明的一个实施方式中,所述具有点突变的多核苷酸序列是由seq id no:1所示的多核苷酸序列第1000位碱基发生突变而形成的。
[0023]
根据本发明,所述突变包括seq id no:1所示多核苷酸序列第1000位碱基由胞嘧啶(c)突变为胸腺嘧啶(t)。
[0024]
在本发明的一个实施方式中,所述具有点突变的多核苷酸序列包括seq id no:2所示的多核苷酸序列。
[0025]
如本文中使用的,术语“可操作连接”指调节序列和多核苷酸序列之间的功能性连接,由此调节序列控制多核苷酸序列的转录和/或翻译。调节序列可以是能提高多核苷酸的表达水平的强启动子。调节序列可以是源自属于棒杆菌属的微生物的启动子或者可以是源自其它微生物的启动子。例如,启动子可以是trc启动子、gap启动子、tac启动子、t7启动子、lac启动子、trp启动子、arabad启动子或cj7启动子。
[0026]
在本发明的一个具体实施方式中,所述启动子是编码seq id no:3的氨基酸序列
的多核苷酸(ncgl0609基因)的启动子。
[0027]
如本文中使用的,术语“载体”指含有基因的调节序列和基因序列并且配置为在合适的宿主细胞中表达靶基因的多核苷酸构建体。或者,载体又可以指多核苷酸构建体,其含有可用于同源重组的序列,从而由于对宿主细胞导入的载体,可以改变宿主细胞的基因组中的内源基因的调节序列,或者可以将可以表达的靶基因插入宿主的基因组的特定位点中。在这点上,本发明中使用的载体可以进一步包含选择标志物以确定载体对宿主细胞的导入或者载体对宿主细胞的染色体的插入。选择标志物可以包含赋予可选择表型,诸如药物抗性、营养缺陷型、针对细胞毒剂的抗性、或表面蛋白的表达的标志物。在用此类选择剂处理的环境中,由于仅表达选择标志物的细胞可以存活或者显示不同表型性状,可以选择经转化的细胞。
[0028]
在本发明的一些具体实施方式中,使用的载体是pk18mobsacb质粒,pxmj19质粒。
[0029]
根据本发明,所述细菌可以是属于棒杆菌属的微生物,例如谷氨酸棒杆菌(corynebacterium glutamicum)、黄色短杆菌(brevibacterium flavum)、乳糖发酵短杆菌(brevibacterium lactofermentum)、产氨棒杆菌(corynebacterium ammoniagenes)、北京棒杆菌(corynebacterium pekinense)。
[0030]
在本发明的一个实施方案中,所述属于棒杆菌属的微生物是谷氨酸棒杆菌yp97158,保藏编号:cgmcc no.12856,保藏日期:2016年8月16日,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,北京市朝阳区北辰西路1号院3号,电话:010-64807355。
[0031]
在本发明的一个实施方案中,所述属于棒杆菌属的微生物是谷氨酸棒杆菌atcc 13869。
[0032]
根据本发明,所述细菌还可以具有与提高l-氨基酸产量有关的其他改进。
[0033]
本发明的第二个方面,提供一种多核苷酸序列,由该多核苷酸序列编码的氨基酸序列,包括所述多核苷酸序列的重组载体,含有所述多核苷酸序列的重组菌株。
[0034]
根据本发明,所述多核苷酸序列具有改善的表达,所述改善包括编码含有seq id no:3所示的氨基酸序列的多肽的多核苷酸发生点突变,使得所述氨基酸序列第334位精氨酸被终止子所取代。
[0035]
根据本发明,seq id no:3所示的氨基酸序列,其中第334位精氨酸被终止子所取代后的氨基酸序列如seq id no:4所示。
[0036]
根据本发明,所述编码含有seq id no:3所示的氨基酸序列的多肽的多核苷酸序列含有如seq id no:1所示的多核苷酸序列。
[0037]
在本发明的一个实施方式中,本发明提供的突变后的多核苷酸序列是由seq id no:1所示多核苷酸序列第1000位碱基发生突变而形成的。
[0038]
根据本发明,所述突变是指所述位点的碱基/核苷酸发生变化,所述突变方法可以选自诱变、pcr定点突变法、和/或同源重组等方法中的至少一种。在本发明中,优选采用pcr定点突变法和/或同源重组。
[0039]
根据本发明,所述突变包括seq id no:1所示的多核苷酸序列第1000位碱基由胞嘧啶(c)突变为胸腺嘧啶(t)。
[0040]
在本发明的一个实施方式中,所述突变后的多核苷酸序列包括seq id no:2所示
的多核苷酸序列。
[0041]
根据本发明,所述取代后的氨基酸序列包括如seq id no:4所示的氨基酸序列。
[0042]
根据本发明,所述重组载体是将所述多核苷酸序列导入质粒构建而成。
[0043]
在本发明的一个实施方式中,所述质粒为pk18mobsacb质粒。
[0044]
在本发明的另一个实施方式中,所述质粒为pxmj19质粒。
[0045]
具体地,可以将所述多核苷酸序列和所述质粒通过nebuider重组系统构建成重组载体。
[0046]
根据本发明,所述重组菌株含有所述的多核苷酸序列。
[0047]
作为本发明的一个实施方案,所述重组菌株的出发菌为yp97158。
[0048]
作为本发明的一个实施方案,所述重组菌株的出发菌为atcc 13869。
[0049]
本发明的第三个方面,还提供一种生成l-氨基酸的重组菌株的构建方法。
[0050]
根据本发明,所述构建方法包括如下步骤:
[0051]
改造宿主菌株中如seq id no:1所示的野生型ncgl0609的多核苷酸序列,使其第1000位碱基发生突变,得到包含突变ncgl0609编码基因的重组菌株。
[0052]
根据本发明的构建方法,所述改造包括诱变、pcr定点突变法、和/或同源重组等方法中的至少一种。
[0053]
根据本发明的构建方法,所述突变是指seq id no:1中第1000位碱基由胞嘧啶(c)突变为胸腺嘧啶(t);具体地,所述包含突变ncgl0609编码基因的多核苷酸序列如seq id no:2所示。
[0054]
进一步地,所述构建方法包括如下步骤:
[0055]
(1)改造如seq id no:1所示的野生型ncgl0609基因的核苷酸序列,使其第1000位碱基发生突变,得到突变的ncgl0609基因多核苷酸序列;
[0056]
(2)将所述突变的多核酸序列与质粒连接,构建重组载体;
[0057]
(3)将所述重组载体导入宿主菌株,得到所述包含突变ncgl0609编码基因的重组菌株。
[0058]
根据本发明的构建方法,所述步骤(1)包括:点突变的ncgl0609基因构建:根据未修饰菌株的基因组序列,合成两对扩增ncgl0609基因片段的引物p1和p2,p3和p4,通过pcr定点突变法在野生型ncgl0609基因seq id no:1中引入点突变,得到点突变的ncgl0609基因核苷酸序列seq id no:2,记为ncgl0609
c1000t
。
[0059]
在本发明的一个实施方式中,所述未修饰菌株基因组可以来源于atcc13032菌株,其基因组序列可以从ncbi网站获取。
[0060]
在本发明的一个实施方案中,所述步骤(1)中,所述引物为:
[0061]
p1:5'cagtgccaagcttgcatgcctgcaggtcgactctagggacggcaacgtacataac3'(seq id no:5)
[0062]
p2:5'gttgccggtgagtcaaacagtcattttgc 3'(seq id no:6)
[0063]
p3:5'gcaaaatgactgtttgactcaccggcaac 3'(seq id no:7)
[0064]
p4:5'cagctatgaccatgattacgaattcgagctcggtacccgcggctg gaaatgtggag3'(se q id no:8)
[0065]
在本发明的一个实施方案中,所述pcr扩增按如下方式进行:94℃预变性5min,94
℃变性30s,52℃退火30s,72℃延伸40s(30个循环),72℃过度延伸10min。
[0066]
在本发明的一个实施方案中,所述重叠pcr扩增按如下方式进行:94℃预变性5min,94℃变性30s,52℃退火30s,以及72℃延伸60s(30个循环),72℃过度延伸10min。
[0067]
根据本发明的构建方法,所述步骤(2)包括重组质粒的构建,包括:将分离纯化后的ncgl0609
c1000t
和pk18mobsacb质粒,通过nebuider重组系统组装,获得重组质粒。
[0068]
根据本发明的构建方法,所述步骤(3)包括重组菌株的构建,将重组质粒转化至宿主菌株,得到重组菌株。
[0069]
在本发明的一个实施方案中,所述步骤(3)的转化为电转化法。
[0070]
在本发明的一个实施方式中,所述宿主菌株是yp97158。
[0071]
在本发明的一个实施方式中,所述重组是通过同源重组实现的。
[0072]
本发明的第四个方面,还提供一种生成l-氨基酸的重组菌株的构建方法。
[0073]
根据本发明,所述构建方法包括如下步骤:
[0074]
扩增ncgl0609基因的上下游同源臂片段、ncgl0609基因编码区及其启动子区序列,或者,扩增ncgl0609或ncgl0609
r334*
基因编码区及其启动子区序列,再以同源重组的方式在宿主菌株的基因组中引入ncgl0609或ncgl0609
r334*
基因,以获得所述菌株过表达ncgl0609或ncgl0609
r334*
基因。
[0075]
在本发明的一个实施方式中,扩增上游同源臂片段的引物是:
[0076]
p7:5'cagtgccaagcttgcatgcctgcaggtcgactctagaatgcgttctg gactgagg3'(seq id no:11)
[0077]
p8:5'gagatgatcctcgcagctggtgcaccgagaacagatg 3'(seq id no:12)
[0078]
在本发明的一个实施方式中,扩增下游同源臂片段的引物是:
[0079]
p11:5'ggtcaaggaaggagttgttgccagaatcagatggcgcaatta aatc aag 3'(seq id no:15)
[0080]
p12:5'cagctatgaccatgattacgaattcgagctcggtacccgctatgac accttcaacggatc 3'(seq id no:16)
[0081]
在本发明的一个实施方式中,扩增所述基因编码区及其启动子区序列的引物是:
[0082]
p9:5'catctgttctcggtgcaccagctgcgaggatcatctc 3'(seq id no:13)
[0083]
p10:5'gatttaattgcgccatctgattctggcaacaactccttccttgacc 3'(seq id no:14)。
[0084]
在本发明的一个实施方式中,以前述p7-p12为引物,以扩增获得的上游同源片段、下游同源片段和带有自身启动子的ncgl0609或ncgl0609
r334*
三个片段混合为模板进行扩增,获得整合同源臂片段。
[0085]
在本发明的一个实施方式中,所采用的pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl;pcr扩增按如下方式进行:94℃预变性5min,94℃变性30s、52℃退火30s、72℃延伸60s(30个循环),72℃过度延伸10min。
[0086]
在本发明的一个实施方式中,采用nebuider重组系统,将穿梭质粒pk18mobsacb和上下同源臂片段、基因编码区及启动子区片段组装,获得整合质粒。
[0087]
在本发明的一个实施方式中,将整合质粒转染宿主菌株,以同源重组的方式在宿
主菌株的基因组中引入ncgl0609或ncgl0609
r334*
基因。
[0088]
在本发明的一个实施方式中,所述宿主菌株是yp97158。
[0089]
在本发明的一个实施方式中,所述宿主菌株是携带有seq id no:2所示多核苷酸序列的菌株。
[0090]
本发明的第五个方面,还提供一种生产l-氨基酸的重组菌株的构建方法。
[0091]
根据本发明,所述构建方法包括如下步骤:
[0092]
扩增ncgl0609基因编码区及启动子区序列,或ncgl0609
r334*
基因编码区及启动子区序列,构建过表达质粒载体,将所述载体转入宿主菌株中,以实现所述菌株过表达ncgl0609或ncgl0609
r334*
基因。
[0093]
在本发明的一个实施方式中,扩增所述基因编码区及其启动子区序列的引物是:
[0094]
p17:5'gcttgcatgcctgcaggtcgactctagaggatcccccagctgcgagg a tcatctc3'(seq id no:21)
[0095]
p18:5'atcaggctgaaaatcttctctcatccgccaaaaccaacaactccttccttgacc3'(seq id no:22)
[0096]
在本发明的一个实施方式中,所述pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl;所述pcr扩增按如下方式进行:94℃预变性5min,94℃变性30s、52℃退火30s、72℃延伸60s(30个循环),72℃过度延伸10min。
[0097]
在本发明的一个实施方式中,采用nebuider重组系统,将穿梭质粒pxmj19和带有自身启动子的ncgl0609和ncgl0609
r334*
片段组装,获得过表达质粒。
[0098]
在本发明的一个实施方式中,所述宿主菌株是yp97158。
[0099]
在本发明的一个实施方式中,所述宿主菌株是atcc 13869。
[0100]
在本发明的一个实施方式中,所述宿主菌株是携带有seq id no:2所示多核苷酸序列的菌株。
[0101]
本发明获得重组菌株可以单独应用于发酵生产l-氨基酸中,也可以和其他产l-氨基酸的细菌混合发酵生产l-氨基酸。
[0102]
本发明的另一个方面提供了生产l-氨基酸的方法,该方法包括培养所述细菌;并且从培养物中获得l-氨基酸。
[0103]
可以在本领域中已知的培养条件下在合适的培养基中进行细菌的培养。培养基可以包含:碳源、氮源、微量元素、及其组合。在培养中,可以调节培养物的ph。此外,培养时可以包括防止气泡产生,例如通过使用消泡剂进行气泡产生的防止。此外,培养时可以包括将气体注射入培养物中。气体可以包括能够维持培养物的需氧条件的任何气体。在培养中,培养物的温度可以是20至45℃。可以从培养物回收生成的l-氨基酸,即用硫酸或氢氯酸等处理培养物,接着进行诸如阴离子交换层析、浓缩、结晶和等电点沉淀的方法的组合。
[0104]
术语定义:
[0105]
在本发明中,术语“具有l-氨基酸生产能力的细菌”是指具有在培养基和/或细菌的细胞中以下述程度产生并累积目的l-氨基酸的能力,使得当细菌在培养基中培养时可以收集生产l-氨基酸的细菌。具有l-氨基酸生产能力的细菌可以是能够以比未修饰菌株可获得的量更大的量在培养基和/或细菌的细胞中积累目的l-氨基酸的细菌。
[0106]
l-氨基酸的实例包括碱性氨基酸,如l-赖氨酸、l-鸟氨酸、l-精氨酸、l-组氨酸和l-瓜氨酸;脂肪族氨基酸,如l-异亮氨酸、l-丙氨酸、l-缬氨酸、l-亮氨酸和甘氨酸;作为羟基-单氨基羧酸的氨基酸,如l-苏氨酸和l-丝氨酸;环状氨基酸,如l-脯氨酸;芳香族氨基酸,如l-苯丙氨酸、l-酪氨酸和l-色氨酸;含硫氨基酸,如l-半胱氨酸、l-胱氨酸和l-甲硫氨酸;酸性氨基酸,如l-谷氨酸和l-天冬氨酸;和侧链具有酰胺基的氨基酸,如l-谷氨酰胺和l-天冬酰胺。
[0107]
l-氨基酸的具体实例包括l-谷氨酸、l-赖氨酸、l-苏氨酸、l-精氨酸、l-组氨酸、l-异亮氨酸、l-缬氨酸、l-亮氨酸、l-苯丙氨酸、l-酪氨酸、l-色氨酸和l-半胱氨酸。
[0108]
l-氨基酸的更具体的实例包括l-谷氨酸、l-赖氨酸、l-苏氨酸和l-色氨酸。l-氨基酸的更具体实例包括l-谷氨酸、l-赖氨酸。
[0109]
在本发明中,除非另有说明,术语“氨基酸”是指l-氨基酸。在本发明中,除非另有说明,术语“l-氨基酸”是指游离形式的l-氨基酸、其盐或其混合物。
[0110]
术语“未修饰菌株”是指尚未以使得具有特定特征的方式进行修饰的对照菌株。即,未修饰菌株的实例包括野生型菌株和亲本菌株。
[0111]
术语“同源性”指两种多核苷酸或两种多肽模块之间的百分比同一性。可以通过使用本领域中已知的方法测定一种模块和另一种模块之间的序列同源性。例如,可以通过blast算法测定此类序列同源性。
[0112]
术语“可操作连接”指调节序列和多核苷酸序列之间的功能性连接,由此调节序列控制多核苷酸序列的转录和/或翻译。调节序列可以是能提高多核苷酸的表达水平的强启动子。调节序列可以是源自属于棒杆菌属的微生物的启动子或者可以是源自其它微生物的启动子。例如,启动子可以是trc启动子、gap启动子、tac启动子、t7启动子、lac启动子、trp启动子、arabad启动子或cj7启动子。
[0113]
术语“载体”指含有基因的调节序列和基因序列并且配置为在合适的宿主细胞中表达靶基因的多核苷酸构建体。或者,载体又可以指多核苷酸构建体,其含有可用于同源重组的序列,从而由于对宿主细胞导入的载体,可以改变宿主细胞的基因组中的内源基因的调节序列,或者可以将可以表达的靶基因插入宿主的基因组的特定位点中。在这点上,本发明中使用的载体可以进一步包含选择标志物以确定载体对宿主细胞的导入或者载体对宿主细胞的染色体的插入。选择标志物可以包含赋予可选择表型,诸如药物抗性、营养缺陷型、针对细胞毒剂的抗性、或表面蛋白的表达的标志物。在用此类选择剂处理的环境中,由于仅表达选择标志物的细胞可以存活或者显示不同表型性状,可以选择经转化的细胞。
[0114]
如本文中使用的,术语“转化”指将多核苷酸导入宿主细胞中,从而多核苷酸可以作为基因组外元件或者以插入宿主细胞的基因组中能复制。转化本发明中使用的载体的方法可以包括将核酸导入细胞的方法。另外,如相关技术中公开的,可以根据宿主细胞实施电脉冲方法。
[0115]
有益效果
[0116]
本发明通过对ncgl0609基因的弱化或敲除,发现该基因编码的产物对氨基酸生产能力产生影响,通过在编码序列引入点突变,或者增加该基因的拷贝数或过表达获得重组菌株,所获得的菌株与野生型菌株相比,有利于生产高浓度的氨基酸。
具体实施方式
[0117]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备;所进行的操作都是本领域已知的,或者按照市售商品的用户手册进行。
[0118]
以下实施例中培养所述菌株使用的基础培养基组成相同,在此基础培养基组成上添加相应需要的蔗糖、卡那霉素或氯霉素等,基础培养基组成如下:
[0119]
成分配方蔗糖10g/l多聚蛋白胨10g/l牛肉膏10g/l酵母粉5g/l尿素2g/l氯化钠2.5g/l琼脂粉20g/lph7.0培养温度32℃
[0120]
实施例1构建包含点突变的ncgl0609基因编码区的转化载体pk18-ncgl0609
r334*
[0121]
依据ncbi公布的谷氨酸棒杆菌atcc13032基因组序列,设计并合成两对扩增ncgl0609基因编码区序列的引物,以等位基因置换的方式在菌株yp97158【保藏编号:cgmcc no.12856,保藏日期:2016年8月16日,保藏单位:中国科学院微生物研究所,北京市朝阳区北辰西路1号院3号,电话:010-64807355,记载于中国专利申请cn106367432a中(申请日2016年9月1日,公开日2017年2月1日)】背景中的ncgl0609基因编码区(seq id no:1,对应编码蛋白的氨基酸序列为seq id no:3)中引入点突变,ncgl0609基因的核苷酸序列第1000位c变为t(seq id no:2),对应编码蛋白的氨基酸序列第334位精氨酸变为终止子(seq id no:4:ncgl0609
r334*
)。引物设计如下(上海invitrogen公司合成):
[0122]
p1:5'cagtgccaagcttgcatgcctgcaggtcgactctagggacggcaacgtacataac3'(seq id no:5)
[0123]
p2:5'gttgccggtgagtcaaacagtcattttgc 3'(seq id no:6)
[0124]
p3:5'gcaaaatgactgtttgactcaccggcaac 3'(seq id no:7)
[0125]
p4:5'cagctatgaccatgattacgaattcgagctcggtacccgcggctg gaaatgtggag3'(seq id no:8)
[0126]
构建方法:以谷氨酸棒杆菌atcc13032为模板,分别以引物p1和p2,p3和p4,进行pcr扩增,pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl,所述pcr扩增按如下方式进行:94℃预变性5min,(94℃变性30s、52℃退火30s、72℃延伸40s,30个循环),72℃过度延伸10min,获得两条大小分别为698bp和648bp,含有ncgl0609基因编码区的dna片段(ncgl0609 up和ncgl0609 down)。将上述两条dna片段经琼脂糖凝胶电泳分离纯化后,再以上述两条dna片
段为模板,以p1和p4为引物,通过overlap pcr扩增长为1317bp的片段。
[0127]
pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl,所述pcr扩增按如下方式进行:94℃预变性5min,(94℃变性30s、52℃退火30s、72℃延伸60s,30个循环),72℃过度延伸10min。此dna片段导致yp97158 ncgl0609基因编码区的第1000位的胞嘧啶(c)变为胸腺嘧啶(t),最终导致编码蛋白的第334位氨基酸由精氨酸(r)变为终止子。将此dna片段经琼脂糖凝胶电泳后进行纯化,与经过双酶切后纯化的pk18mobsacb质粒(购至addgene公司,分别用xbal i/bamh i双酶切)用nebuilder酶(购至neb公司)50℃连接30min,连接产物转化后长出的单克隆经pcr鉴定获得阳性载体pk18-ncgl0609
r334*
,该质粒上含有卡那霉素抗性标记。将酶切正确的载体pk18-ncgl0609
r334*
送测序公司测序鉴定,并将含有正确点突变(c-t)的载体pk18-ncgl0609
r334*
保存备用。
[0128]
实施例2构建包含点突变的ncgl0609
r334*
的工程菌株
[0129]
构建方法:将等位替换质粒pk18-ncgl0609
r334*
通过电击转化入l-赖氨酸生产菌专利菌株yp97158中(其构建方法可参见wo2014121669a1;经测序确认该菌株染色体上保留有野生型的ncgl0609基因编码区),对培养产生的单菌落分别通过引物p1和通用引物m13r进行鉴定,能扩增出1375bp大小条带的菌株为阳性菌株。将阳性菌株在含15%蔗糖的培养基上培养,对培养产生的单菌落分别在含有卡那霉素和不含卡那霉素的培养基上培养,在不含卡那霉素的培养基上生长,而在含卡那霉素的培养基上不生长的菌株进一步采用如下引物(上海invitrogen公司合成)进行pcr鉴定:
[0130]
p5:5'ctagccggttccagtcag 3'(seq id no:9)
[0131]
p6:5'ggacgtctgttcaccattg 3'(seq id no:10)
[0132]
上述pcr扩增产物264bp通过95℃高温变性10min、冰浴5min后进行sscp电泳(以质粒pk18-ncgl0609
r334*
扩增片段为阳性对照,yp97158扩增片段为阴性对照,水作为空白对照),由于片段结构不同,电泳位置不同,因此片段电泳位置与阴性对照片段位置不一致且与阳性对照片段位置一致的菌株为等位替换成功的菌株。再次通过引物p5/p6 pcr扩增阳性菌株ncgl0609片段,并连接到pmd19-t载体进行测序,通过序列比对,碱基序列发生突变(c-t)的菌株为等位替换成功的阳性菌株,并被命名为ypl-4-041。
[0133]
sscp电泳page的制备及条件
[0134][0135]
实施例3构建基因组上过表达ncgl0609和ncgl0609
r334*
基因的工程菌株
[0136]
依据ncbi公布的野生型谷氨酸棒杆菌atcc13032基因组序列,设计并合成三对扩增上下游同源臂片段及ncgl0609或ncgl0609
r334*
基因编码区及启动子区序列的引物,以同源重组的方式在菌株yp97158中引入ncgl0609或ncgl0609
r334*
基因。
[0137]
引物设计如下(上海invitrogen公司合成):
[0138]
p7:5'cagtgccaagcttgcatgcctgcaggtcgactctagaatgcgttctg gactgagg3'(seq id no:11)
[0139]
p8:5'cagtgccaagcttgcatgcctgcaggtcgactctagaatgcgttctg gactgagg3'(seq id no:12)
[0140]
p9:5'catctgttctcggtgcaccagctgcgaggatcatctc 3'(seq id no:13)
[0141]
p10:5'gatttaattgcgccatctgattctggcaacaactccttccttgacc 3'(seq id no:14)
[0142]
p11:5'ggtcaaggaaggagttgttgccagaatcagatggcgcaatta aatc aag 3'(seq id no:15)
[0143]
p12:5'cagctatgaccatgattacgaattcgagctcggtacccgctatgacaccttcaacggatc 3'(seq id no:16)
[0144]
构建方法:分别以谷氨酸棒杆菌atcc13032或ypl-4-041为模板,分别以引物p7/p8,p9/p10,p11/p12,进行pcr扩增,获得上游同源臂片段768bp,ncgl0609或ncgl0609
r334*
基因及其启动子片段1626bp及下游同源臂片段623bp。pcr反应结束后,对扩增的3个片段采用柱式dna凝胶回收试剂盒分别进行电泳回收。回收后的3个片段与经过双酶切后纯化的pk18mobsacb质粒(购至addgene公司,分别用xbal i/bamh i双酶切)用nebuilder酶(购至neb公司)50℃连接30min,连接产物转化后长出的单克隆经pcr鉴定获得阳性整合质粒。该质粒上含有卡那霉素抗性标记,可以通过卡那霉素筛选获得质粒整合到基因组上的重组子。
[0145]
pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg2+(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。所述pcr扩增按如下方式进行:94℃预变性5min,94℃变性30s、52℃退火30s、72℃延伸60s(30个循环),72℃过度延伸10min。将测序正确的整合质粒电转化入l-赖氨酸生产菌专利菌株yp97158中,对培养产生的单菌落
通过p13/p14引物进行pcr鉴定,pcr扩增出含有大小1317bp的片段的为阳性菌株,扩增不到片段的为原菌。将阳性菌株在含15%蔗糖的培养基上培养,对培养产生的单菌落进一步采用p15/p16引物进行pcr鉴定,扩增出大小为1352bp的菌为ncgl0609或ncgl0609
r334*
基因整合到yp97158基因组上的阳性菌株,其被命名为ypl-4-042(不含突变点)和ypl-4-043(含突变点)。
[0146]
p13:5'tccaaggaagatacacgcc 3'(seq id no:17)
[0147]
p14:5'cgaaatggaagttgtgcg 3'(seq id no:18)
[0148]
p15:5'cgatgatgccgattacctc 3'(seq id no:19)
[0149]
p16:5'cgttggaatcttgcgttg 3'(seq id no:20)
[0150]
实施例4构建质粒上过表达ncgl0609或ncgl0609 r334*
基因的工程菌株
[0151]
依据ncbi公布的野生型谷氨酸棒杆菌atcc13032基因组序列,设计并合成一对扩增ncgl0609或ncgl0609
r334*
基因编码区及启动子区序列的引物,引物设计如下(上海invitrogen公司合成):
[0152]
p17:5'gcttgcatgcctgcaggtcgactctagaggatcccccagctgcgagg a tcatctc3'(seq id no:21)
[0153]
p18:5'atcaggctgaaaatcttctctcatccgccaaaaccaacaactccttccttgacc3'(seq id no:22)
[0154]
构建方法:分别以谷氨酸棒杆菌atcc13032和ypl-4-041为模板,以引物p17/p18进行pcr扩增,获得ncgl0609和ncgl0609
r334*
基因及其启动子片段1582bp,对扩增产物进行电泳并采用柱式dna凝胶回收试剂盒进行纯化,回收的dna片段与经ecor i酶切回收的穿梭质粒pxmj19用nebuilder酶(购至neb公司)50℃连接30min,连接产物转化后长出的单克隆用m13引物经pcr鉴定获得阳性过表达质粒pxmj19-ncgl0609和pxmj19-ncgl0609
r334*
,将该质粒送测序。因质粒上含有氯霉素抗性标记,可以通过氯霉素来筛选质粒是否转化到菌株中。
[0155]
pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg2+(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
[0156]
所述pcr扩增按如下方式进行:94℃预变性5min,94℃变性30s、52℃退火30s、72℃延伸60s(30个循环),72℃过度延伸10min。
[0157]
将测序正确的pxmj19-ncgl0609和pxmj19-ncgl0609
r334*
质粒分别电转化入l-赖氨酸生产菌专利菌株yp97158中,对培养产生的单菌落通过引物m13f/p18进行pcr鉴定,pcr扩增出含有大小1585bp片段的为阳性菌株,其被命名为ypl-4-044(不含突变点)和ypl-4-045(含突变点)。
[0158]
实施例5构建基因组上缺失ncgl0609基因的工程菌株
[0159]
根据ncbi公布的谷氨酸棒杆菌atcc13032的基因组序列,合成两对扩增ncgl0609基因编码区两端片段的引物,作为上下游同源臂片段。引物设计如下(上海英俊公司合成):p19:5'cagtgccaagcttgcatgcctgcaggtcgactctagaatgaa tgg gatgggtcg3'(seq id no:23)
[0160]
p20:5'catcatcggttactctggccgaaatggaagttgtgcg 3'(seq id no:24)
[0161]
p21:5'cgcacaacttccatttcggccagagtaaccgatgatg 3'(seq id no:25)
[0162]
p22:5'cagctatgaccatgattacgaattcgagctcggtaccccaacaactccttccttgacc3'
(seq id no:26)
[0163]
构建方法:以谷氨酸棒杆菌atcc13032为模板,分别以引物p19/p20和p21/p22进行pcr扩增,获得上游同源臂片段661bp及下游同源臂片段692bp。再用引物p19/p22进行overlap pcr得到整个同源臂片段1334bp。对扩增的产物进行电泳并采用柱式dna凝胶回收试剂盒进行纯化,回收的dna片段与经过双酶切后纯化的pk18mobsacb质粒(购至addgene公司,分别用xbal i/bamh i双酶切)用nebuilder酶(购至neb公司)50℃连接30min,连接产物转化后长出的单克隆用m13引物经pcr鉴定获得阳性敲除载体pk18-δncgl0609,将该质粒送测序。该质粒上含有卡那霉素抗性来作为筛选标记。
[0164]
pcr体系:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg2+(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
[0165]
所述pcr扩增按如下方式进行:94℃预变性5min,94℃变性30s、52℃退火30s、72℃延伸90s(30个循环),72℃过度延伸10min。
[0166]
将测序正确的敲除质粒pk18-δncgl0609电转化入赖氨酸生产专利菌株yp97158(其构建方法可参见wo2014121669a1;经测序确认该菌株染色体上保留有野生型的ncgl0609基因),对培养产生的单菌落通过如下引物(上海英俊公司合成)进行pcr鉴定:
[0167]
p23:5'aatgaatgg gatgggtcg 3'(seq id no:27)
[0168]
p24:5'caacaact cct tccttgacc 3'(seq id no:28)
[0169]
上述pcr同时扩增出大小1334bp及1788bp的条带的菌株为阳性菌株,只扩增出1788bp条带的菌株为原菌。阳性菌株在15%蔗糖培养基上筛选后分别在含有卡那霉素和不含卡那霉素的培养基上培养,在不含卡那霉素的培养基上生长,而在含卡那霉素的培养基上不生长的菌株进一步采用p23/p24引物进行pcr鉴定,扩增出大小为1334bp条带的菌株为ncgl0609基因编码区被敲除的阳性菌株。再次通过p23/p24引物pcr扩增阳性菌株ncgl0609片段,并连接到pmd19-t载体进行测序,将测序正确的菌株命名为ypl-4-046。
[0170]
实施例6 l-赖氨酸发酵实验
[0171]
将实施例构建的菌株和原始菌株yp97158在blbio-5gc-4-h型号的发酵罐(购自上海百仑生物科技有限公司)中以表1所示的培养基和表2所示的控制工艺进行发酵实验。每个菌株重复三次,结果如表3所示。
[0172]
表1发酵培养基配方
[0173]
成分配方淀粉水解糖30g/l硫酸铵12g/l硫酸镁0.87g/l糖蜜20g/l酸化玉米浆3ml/l磷酸0.4ml/l氯化钾0.53g/l消泡剂(2%泡敌)4ml/l硫酸亚铁120mg/l硫酸锰120mg/l
烟酰胺42mg/l泛酸钙6.3mg/l维生素b16.3mg/l铜、锌盐溶液0.6g/l生物素0.88mg/l
[0174]
表1发酵控制工艺
[0175][0176]
表2l-赖氨酸发酵实验结果
[0177]
菌株l-赖氨酸产量(g/100ml)od(660nm)yp9715818.937.3ypl-4-04119.338.1ypl-4-04219.237.8ypl-4-04319.538.4ypl-4-04419.437.7ypl-4-04519.738.3ypl-4-04618.036.8
[0178]
结果如表3所示,在谷氨酸棒杆菌中对ncgl0609基因编码区进行点突变ncgl0609
r334*
及过表达,有助于l-赖氨酸产量及生长速率的提高,而对基因进行弱化或敲除,不利于l-赖氨酸的积累,同时会降低菌株的生长速率。
[0179]
实施例7在谷氨酸生产菌株中引入ncgl0609基因过表达,或者对ncgl0609基因编码区进行点突变ncgl0609
r334*
及过表达,并进行发酵实验
[0180]
按照实施例1-5的方法,采用相同的引物和实验条件,以棒杆菌atcc13869为出发菌,以atcc 13869的菌为表达菌,获得包含点突变的ncgl0609
r334*
的谷氨酸生产工程菌株、基因组上过表达ncgl0609和ncgl0609
r334*
基因的谷氨酸生产工程菌株、质粒上过表达ncgl0609和ncgl0609
r334*
基因的谷氨酸生产工程菌株,和基因组上缺失ncgl0609基因的谷氨酸生产工程菌株。
[0181]
将实施例构建的菌株和原始菌株以atcc 13869的菌为表达菌在blbio-5gc-4-h型号的发酵罐(购自上海百仑生物科技有限公司)中以表4所示的培养基和表5所示的控制工
艺进行发酵实验。每个菌株重复三次,结果如表6所示。
[0182]
表4发酵培养基配方
[0183]
试剂名称配比葡萄糖5.0g/l磷酸0.38g/l硫酸镁1.85g/l氯化钾1.6g/l生物素550μg/l维生物素b1300μg/l硫酸亚铁10mg/l硫酸锰10g/dlkh2po42.8g/l维生素c0.75mg/l维生素b122.5μg/l对氨基苯甲酸0.75mg/l消泡剂0.0015ml/dl甜菜碱1.5g/l甘蔗糖蜜7ml/l玉米浆77ml/l天冬氨酸1.7g/l毛发粉2g/l
[0184]
表5发酵控制工艺
[0185][0186]
表6 l-谷氨酸发酵实验结果
[0187]
菌株l-谷氨酸产量(g/l)od(660nm)atcc13869101.042.3ypg-013103.543.4ypg-014103.942.8ypg-015103.243.7ypg-016103.642.6ypg-017103.843.6ypg-01898.540.5
[0188]
结果如表6所示,在谷氨酸棒杆菌中对ncgl0609基因编码区进行点突变
ncgl0609
r334*
及过表达,有助于l-谷氨酸产量及生长速率的提高,而对基因进行弱化或敲除,不利于l谷氨酸的积累,同时会降低菌株的生长速率。
[0189]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



