CHAF1A作为HIV-1潜伏感染激活靶点的应用的制作方法
 2021-02-02 08:02:26|
2021-02-02 08:02:26| 400|
400| 起点商标网
起点商标网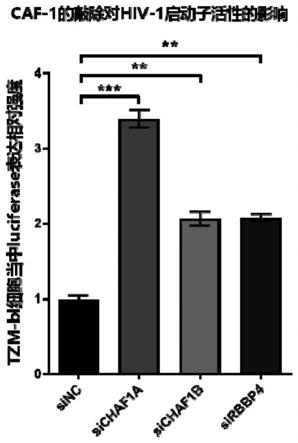
chaf1a作为hiv-1潜伏感染激活靶点的应用
技术领域
[0001]
本发明涉及hiv-1病毒技术领域,更具体地,涉及一种chaf1a作为hiv-1潜伏感染激活靶点的应用。
背景技术:
[0002]
hiv-1/aids到目前为止无法被彻底治愈的根本原因是hiv-1的潜伏感染,即hiv-1暂时性沉默于宿主细胞特别是cd4
+ t细胞中,并随着细胞的激活而再次激活。尽管当前目前已经有联合抗病毒疗法(combined antiretroviral therapy,cart)可以有效的压制病毒,但这种治疗方式并不彻底,并不能永久清除病毒,因此导致病人必须终身服药。彻底将病毒从人体中清除成为了当前治愈hiv-1/a ids的重难点。近年来科学家们相继提出了多种新型的治疗策略,包括了“shoc k and kill”、“block and lock”等功能性治愈方案,旨在不彻底根除hiv-1,实现hiv-1/aids的撤药不反弹目标。
[0003]
要实现功能性治愈hiv-1/aids,将不得不对hiv-1的潜伏感染有一个综合全面的了解。目前认为hiv-1的潜伏感染由以下几个方面介导:hiv-1整合于一些易发生克隆扩增且暂时性表达的基因内含子中;宿主和病毒转录促进因子的缺失和转录抑制因子的富集;抑制性表观遗传学修饰蛋白在hiv-1启动子附近读写抑制性表观遗传学修饰,激活性表观遗传学修饰被特定蛋白移除;非编码rna介导的转录后调控等。通过操控特定的潜伏感染促进因子,可以实现对hiv-1潜伏感染的再激活,从而将被感染的细胞进行杀灭清除。这种先激活再清除的手段即为“shock and kill”功能性治疗策略。目前已经有众多潜伏激活药物被发现,比如hdac抑制剂saha、dnmt1抑制剂5-aza-dc、brd4抑制剂jq-1等(pmid:29099677;pmid:19239360;pmid:26681773;pmid:23087374)。然而,目前尚未有一款潜伏感染激活药物在临床病人身上表现良好并成功缩小病毒储藏库。因此,寻找新的潜伏感染促进因子以及对应的潜伏感染激活药物,成为了当前功能性治愈hiv-1/aids的一个重要方向。
[0004]
染色质组装蛋白caf-1(chromatin assembly factor 1)由三个主要亚基构成:chaf1a、chaf1b和rbbp4。其中chaf1a是caf-1最主要的亚基。c haf1a不仅可以将新合成的组蛋白h3-h4呈递到正在复制中的dna复制叉附近,还可以募集众多的表观遗传学修饰因子,介导内源性逆转录病毒的转录抑制。然而,chaf1a在人的成体细胞如人原代cd4
+ t细胞中是否能够抑制潜伏的h iv-1的表达,尚无报道。当前亦没有针对chaf1a来激活hiv-1潜伏感染的药物报道。
技术实现要素:
[0005]
本发明的目的是为了克服现有技术的不足,提供一种从牛血清中分离高纯度牛血清白蛋白的方法。
[0006]
本发明的第一个目的是提供chaf1a作为hiv-1潜伏感染激活靶点的应用。
[0007]
本发明的第二个目的是提供chaf1a在筛选hiv-1潜伏感染激活剂中的应用。
[0008]
本发明的第三个目的是提供抑制或敲除chaf1a的物质在制备hiv-1潜伏感染激活
剂的应用。
[0009]
本发明的第四个目的是提供一种hiv-1潜伏感染激活剂。
[0010]
本发明的第五个目的是提供抑制或敲除chaf1a的物质在制备延迟被hiv-1感染的细胞进入潜伏感染状态的药物中的应用。
[0011]
本发明的第六个目的是提供抑制或敲除chaf1a的物质在制备提高激活出的病毒的遗传多样性的药物中的应用。
[0012]
本发明的第七个目的是提供抑制或敲除chaf1a的物质在制备提高病毒r na的含量的药物中的应用。
[0013]
本发明的第八个目的是提供所述的hiv-1潜伏感染激活剂在制备提高病毒r na的含量的药物中的应用。
[0014]
为了实现上述目的,本发明是通过以下技术方案予以实现的:
[0015]
本发明发现染色质组装因子的三个亚基chaf1a、chaf1b和rbbp4均可以介导hiv-1表达抑制,其中caf-1的最大亚基chaf1a可以显著压制hiv-1的表达,并且促进hiv-1的潜伏感染。chaf1a的移除可以使得潜伏的hiv-1再次表达,并且和常规潜伏感染激活剂tnfα、saha、jq-1等叠加激活病毒潜伏库。
[0016]
因此本发明要求保护chaf1a作为hiv-1潜伏感染激活靶点的应用。
[0017]
还要求保护chaf1a在筛选hiv-1潜伏感染激活剂中的应用,抑制或敲除chaf1a的物质具有hiv-1潜伏感染激活剂的作用。
[0018]
进一步本发明要求保护抑制或敲除chaf1a的物质在制备hiv-1潜伏感染激活剂的应用。
[0019]
本法还要求保护一种hiv-1潜伏感染激活剂,包括抑制或敲除chaf1a的物质。
[0020]
优选地,所述抑制或敲除chaf1a的物质为sirna,用脂质体转染sirna靶向敲除内源性chaf1a。
[0021]
更优选地,所述sirna为5
’-
gcacagtcatcattgattt-3
’
、5
’-
ccataaggtccgccagaaa-3
’
、和5
’-
gcaggacagttggagtgaa-3
’
的一种或几种。
[0022]
优选地,所述抑制或敲除chaf1a的物质为sgrna。
[0023]
更优选地,所述sgrna为5
’-
caccgctcgggccactcgtcagctc-3
’
。
[0024]
优选地,还包括tnfα、saha、或jq-1中的一种或几种。
[0025]
更优选地,还包括saha。
[0026]
本发明还要求保护以下内容:
[0027]
抑制或敲除chaf1a的物质在制备延迟被hiv-1感染的细胞进入潜伏感染状态的药物中的应用。
[0028]
抑制或敲除chaf1a的物质在制备提高激活出的病毒的遗传多样性的药物中的应用。
[0029]
抑制或敲除chaf1a的物质在制备提高病毒rna的含量的药物中的应用。
[0030]
所述的包括抑制或敲除chaf1a的物质,以及tnfα、saha、或jq-1中的一种或几种的hiv-1潜伏感染激活剂在制备提高病毒rna的含量的药物中的应用。
[0031]
与现有技术相比,本发明具有如下有益效果:
[0032]
本发明发现染色质组装因子caf-1的最大亚基chaf1a可以显著压制hiv-1的表达,
并且促进hiv-1的潜伏感染。chaf1a的移除可以使得潜伏的hiv-1再次表达,并且能够和常规潜伏感染激活剂tnfα、saha、jq-1等叠加激活病毒潜伏库。开发新型潜伏感染激活药物靶向chaf1a,有望更加充分的激活潜伏病毒并利用人体免疫系统所杀灭,从而缩小病人体内病毒潜伏库甚至清除。
附图说明
[0033]
图1为用sirna敲除caf-1三个亚基chaf1a、chaf1b和rbbp4后hiv-1表达细胞系tzm-bl中hiv-1的表达再激活。
[0034]
图2为chaf1a的敲除在潜伏感染细胞系中对病毒的再激活作用。
[0035]
图3为chaf1a的敲除对hiv-1感染的cd4+ t细胞进入潜伏的延迟作用。
[0036]
图4为chaf1a的敲除激活出的hiv-1病毒rna的遗传多样性指数。
[0037]
图5为chaf1a的敲除在hiv-1感染者临床样本中对潜伏病毒的激活作用。
具体实施方式
[0038]
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0039]
实施例1 chaf1a对hiv-1表达的抑制作用
[0040]
一、实验方法
[0041]
1、将感染tzm-bl的hiv-1表达细胞系均匀铺于24孔板当中,培养条件为:在dmem、10%fbs、1%双抗、37℃、5%co2条件下培养24小时;
[0042]
2、细胞培养24小时后,用脂质体转染sirna至各孔,分别靶向敲除内源性chaf1a、chaf1b和rbbp4,以抑制其的表达;
[0043]
其中靶向chaf1a的sirna有三条,共转至一个孔:
[0044]
(1)5
’-
gcacagtcatcattgattt-3
’
,
[0045]
(2)5
’-
ccataaggtccgccagaaa-3
’
,
[0046]
(3)5
’-
gcaggacagttggagtgaa-3
’
;
[0047]
靶向chaf1b的sirna有三条,共转至一个孔:
[0048]
(1)5
’-
gacggatctttgcttctca-3
’
,
[0049]
(2)5
’-
gcaagaagctaccggatgt-3
’
,
[0050]
(3)5
’-
gtccaatcttgctcgtcat-3
’
;
[0051]
靶向rbbp4的sirna有三条,共转至一个孔:
[0052]
(1)5
’-
ccttgtatcatcgcaacaaag-3
’
,
[0053]
(2)5
’-
atttgggatactcgttcaaac-3
’
,
[0054]
(3)5
’-
cctcttggtttcttcagttaa-3
’
;
[0055]
3、sirna转染12小时后,将上清去除并加入等体积的新鲜的dmem培养基,并用脂质体再次转染tat表达质粒;
[0056]
4、细胞培养12小时后,将上清去除并加入等体积的新鲜的dmem培养基;
[0057]
5、细胞再次培养24小时后,将培养基移除,并用pbs在孔内清洗两遍,彻底去除pbs残留;
[0058]
6、在每个孔中加入100μl的细胞裂解液,在220rpm下,室温振荡裂解30分钟;
[0059]
7、将裂解上清转移至新的1.5ml管中,12000rpm离心3分钟,再次将上清转移至新的1.5ml管中;
[0060]
8、取20μl的细胞裂解上清至96孔白底板中,用荧光素酶检测系统测定各孔中的luciferase的含量,各组含量以吸光度值表示。
[0061]
二、实验结果
[0062]
实验结果如图1所示。用sirna靶向caf-1的三个亚基即chaf1a、chaf1b和rbbp4均能够显著的促进hiv-1的表达,特别是chaf1a的缺失能够极大的激活hiv-1的表达。表明内源性chaf1a能够显著的抑制hiv-1病毒表达蛋白。
[0063]
实施例2 chaf1a对hiv-1潜伏感染的促进作用
[0064]
一、实验方法
[0065]
1、用sgrna(序列:5
’-
caccgctcgggccactcgtcagctc-3
’
)靶向chaf1a敲除hiv-1潜伏感染细胞系j-lat 10.6当中的内源性chaf1a,其中对照组用sgnt(序列:5
’-
acggaggctaagcgtcgcaa-3
’
)处理,不靶向任何基因,成功敲除的细胞系用单克隆技术筛选并扩增出来;
[0066]
2、将生长状态良好的sgnt和sgchaf1a靶向敲除的j-lat 10.6细胞系分别均匀铺于96孔板中,两组分别用潜伏感染激活剂肿瘤坏死因子α(tnfα)、伏立诺他(saha)和三苯甲烷三异氰酸酯(jq-1)处理;
[0067]
3、细胞培养48小时后,将细胞从96孔中转移至1.5ml管,并用500g室温离心5分钟,去除培养基,用500μl的pbs将细胞重悬;
[0068]
4、再次500g离心5分钟,去除上清,用200μl的pbs将细胞再次重悬;
[0069]
5、用流式细胞仪对每一组的样品进行流式分析,其中细胞理化性质前向角散射光(fsc)和侧向角散射光(ssc)用于圈出有效的活细胞,hiv-1潜伏感染细胞系j-lat 10.6含有一个整合型的缺陷型hiv-1基因组,该假病毒不会再次扩增产生新的病毒颗粒,在该模型hiv-1病毒蛋白nef位置融合有绿色荧光蛋白gfp,因此gfp的表达情况也就反映了hiv-1假病毒的表达情况,即gfp的表达百分比代表了被激活的hiv-1假病毒的比例。
[0070]
二、实验结果
[0071]
实验结果如图2所示。用sgrna靶向敲除潜伏感染细胞系中的chaf1a能够显著的促进hiv-1的再次表达,并且这样一种对hiv-1潜伏感染的激活作用可和常规潜伏感染激活剂tnfα、saha和jq-1介导的激活相叠加。
[0072]
实施例3 chaf1a对hiv-1进入潜伏的延迟作用
[0073]
一、实验方法
[0074]
1、准备shluc和shchaf1a慢病毒:本部分实验以慢病毒骨架plko.3g-rfp为质粒模板,构建相应的靶向基因慢病毒,其中载体中rfp的表达可以指示细胞的感染效率,并由cmv启动子驱动,可持续性表达;u6启动子驱动shrna表达干扰rna部分,对照组shrna为shluc,为靶向萤火虫荧光素酶luciferase的shrna,在人类细胞中不靶向任何人源基因,不会对人体基因的表达造成干扰,因此可作为本实验的对照靶标;实验组shrna为shchaf1a,为靶向
人源chaf1a基因mrna编码区域的shrna,可特异性干扰内源性chaf1a的表达,降低chaf1a表达量;包装体系为:将3μg的vsvg、6μg的pspax2、6μg的shluc骨架用lipo2000转染进入10cm dish的hek293t细胞当中,用于产生shluc慢病毒;将3μg的vsvg、6μg的pspax2、6μg的shchaf1a骨架用lipo2000转染进入10cm dish的hek293t细胞当中,用于产生shchaf1a慢病毒;转染48h后,将上清转移至新的50ml管中,离心去除细胞残渣,所得上清液即为shluc和shchaf1a慢病毒;
[0075]
2、用蔗糖密度梯度离心法和磁珠分选,从健康人外周血单核细胞pbmc中分离cd4
+ t细胞,并用植物凝集素(pha)和cd4
+ t细胞共孵育,通过激活tcr信号通路以激活细胞;
[0076]
3、激活两天后,激活的cd4
+ t细胞用hiv-1假病毒进行感染,感染12小时后换成新鲜的rpmi 1640培养基;
[0077]
4、感染两天后,细胞分成两组,分别感染shluc(靶标序列:5
’-
accgcctgaagtctctgattaa-3
’
)和shchaf1a(靶标序列:5
’-
ccgactcaattcctgtgtaaa-3
’
)慢病毒,其中shluc为对照组,shchaf1a用于靶向敲除内源性chaf1a;慢病毒感染12小时后,将培养上清换成新鲜的rpmi 1640培养基;
[0078]
5、每隔两天,用流式细胞仪分析两组细胞,前向角散射光(fsc)和侧向角散射光(ssc)用于圈出有效的活细胞,由于所感染的hiv-1假病毒的病毒蛋白nef位置融合有绿色荧光蛋白gfp,因此gfp阳性的细胞比例即代表了hiv-1病毒蛋白表达的细胞比例,此处用488nm激光激发gfp表达的细胞,gfp表达的细胞比例即代表了hiv-1假病毒表达的比例;
[0079]
6、慢病毒感染16天后,汇总所有感染天数下监测的hiv-1表达细胞的比例,该实验在至少三个健康人cd4+ t细胞中进行了实验。
[0080]
二、实验结果
[0081]
实验结果如图3所示。shrna靶向敲除chaf1a的原代cd4
+ t细胞当被hiv-1感染后,能够延迟进入潜伏,表明chaf1a介导了hiv-1潜伏感染的建立。
[0082]
实施例4 chaf1a缺失对原代cd4+ t细胞中病毒的激活作用
[0083]
一、实验方法
[0084]
1、从hiv-1感染者pbmc中分离cd4
+ t细胞,并用pha对细胞进行激活处理;
[0085]
2、pha激活两天后,用shluc和shchaf1a慢病毒分别感染激活的cd4+ t细胞,感染12小时后,将感染上清换成新鲜的rpmi 1640培养基;
[0086]
3、感染的cd4+ t细胞静息14天后,将分别用shluc和shchaf1a感染的细胞再次分为两组,其中一组加入潜伏感染激活剂saha,另一组不做任何处理,初始未感染的cd4+ t细胞用anti-cd3/anti-cd28/il-2处理,作为实验阳性对照,初始未做感染处理且未做激活处理的cd4+ t细胞作为阴性对照;
[0087]
4、saha和anti-cd3/anti-cd28/il-2处理2天后,离心收集细胞沉淀,并用trizol提取其中的病毒rna;
[0088]
5、各组中的病毒rna用hiv-1特异性反向引物反转录成cdna并克隆至t载体,用单基因组测序法确定每组当中的hiv-1病毒rna的序列多样性,并根据标准序列计算各组样本的遗传多样性指数(genetic diversity index);
[0089]
6、各组中的病毒rna反转录成cdna,并用hiv-1特异性引物对各组cdna当中的病毒rna进行荧光定量pcr,以确定各组处理下的病毒rna含量。
[0090]
二、实验结果
[0091]
实验结果如图4和图5所示。在hiv-1感染者临床样本中用shrna靶向敲除chaf1a能够激活出大量的具有广泛的遗传多样性的病毒rna,这样一种激活作用可以和常规潜伏感染激活剂saha相叠加。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



