引物探针组合、检测试剂盒及其应用的制作方法
 2021-02-02 08:02:22|
2021-02-02 08:02:22| 311|
311| 起点商标网
起点商标网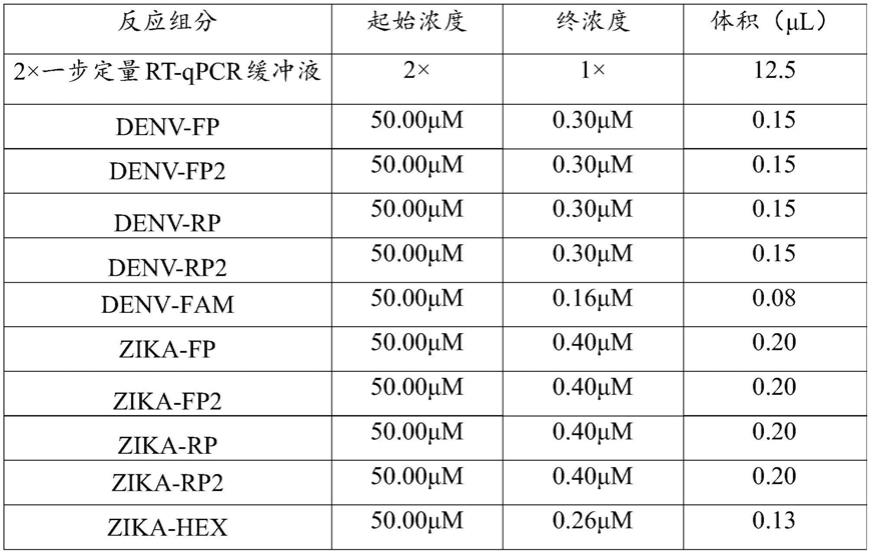
[0001]
本发明属于核酸检测技术领域,具体涉及一种引物探针组合,一种检测试剂盒及其应用,以及一种登革病毒和/或寨卡病毒的检测方法。
背景技术:
[0002]
登革热病毒(dengue virus)属黄病毒科黄病毒属,为单正链rna病毒,寨卡病毒(zika virus)属黄病毒科黄病毒属,有包膜,基因组为单股正链rna。
[0003]
目前,国内外对登革病毒和寨卡病毒的诊断方法,主要是血清学试验、病毒培养和pcr。其中,血清学试验、病毒培养具有灵敏度低、免疫交叉反应以及周期长等缺点;现有的登革病毒和寨卡病毒的体外诊断试剂盒大多采用单重rt-pcr反应的方式,面对虫媒病毒流行季节的大规模样本检测时,存在检测通量低、耗时长的问题。此外,常规的多重实时荧光pcr技术是将pcr技术和多色荧光标记探针相结合的技术,可以在同一个pcr反应管中对多个病毒同时进行快速扩增,大大提高了检测效率。虽然该方法具有快速、灵敏、自动化程度高等特点,但是对于属间相似性高的病原体,如用于检测基因组序列相似性较高的登革病毒和寨卡病毒时,也存在特异性不足、容易出现交叉反应的问题,进而影响试剂盒检测的特异性和准确性。因此,需要建立一种更加准确、高效的、能够同时检测登革病毒和寨卡病毒的双重检测方法。
技术实现要素:
[0004]
本发明的目的是提供一种引物探针组合,一种检测试剂盒及其应用,以及一种登革病毒和/或寨卡病毒的检测方法,旨在解决现有登革病毒和寨卡病毒检测过程中存在的特异性和准确性较低的技术问题。
[0005]
为了实现上述发明目的,本发明一方面,提供了一种引物探针组合,其包括第一类引物探针组和第二类引物探针组,所述第一类引物探针组包括登革病毒特异性引物、第一类y引物和第一类荧光探针,所述第一类y引物包括第一类第一y引物、第一类第二y引物中的至少一种;所述第二类引物探针组包括寨卡病毒特异性引物、第二类y引物和第二类荧光探针,所述第二类y引物包括第二类第一y引物、第二类第二y引物中的至少一种;
[0006]
其中,所述登革病毒特异性引物的核苷酸序列为seq id no:1-2所示的核苷酸序列,或由所述seq id no:1-2所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0007]
所述第一类第一y引物的核苷酸序列为seq id no:3所示的核苷酸序列,或由所述seq id no:3所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0008]
所述第一类第二y引物的核苷酸序列为seq id no:4所示的核苷酸序列,或由所述seq id no:4所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0009]
所述第一类荧光探针的核苷酸序列为seq id no:5所示的核苷酸序列,或由所述seq id no:5所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0010]
所述寨卡病毒特异性引物的核苷酸序列为seq id no:6-7所示的核苷酸序列,或由所述seq id no:6-7所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0011]
所述第二类第一y引物的核苷酸序列为seq id no:8所示的核苷酸序列,或由所述seq id no:8所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0012]
所述第二类第二y引物的核苷酸序列为seq id no:9所示的核苷酸序列,或由所述seq id no:9所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0013]
所述第二类荧光探针的核苷酸序列为seq id no:10所示的核苷酸序列,或由所述seq id no:10所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0014]
所述第一类荧光探针上的荧光基团与所述第二类荧光探针上的荧光基团不同。
[0015]
本发明另一方面,提供了一种检测试剂盒,其包括本发明提供的所述引物探针组合。
[0016]
本发明再一方面,提供了上述检测试剂盒在检测登革病毒和/或寨卡病毒中的应用。
[0017]
本发明提供的引物探针组合,通过设计第一类y引物和第二类y引物,其中,第一类y引物可以与登革病毒的特异性引物部分互补,第二类y引物可以与寨卡病毒的特异性引物部分互补,形成“y”型结构。当登革病毒和/或寨卡病毒的特异性引物的3
’
端与靶序列识别杂交时,其5
’
端与第一类y引物和/或第二类y引物分开,启动延伸反应;当没有靶序列存在,或待检测样本的序列与5
’
端序列不完全匹配时,则第一类y引物与登革病毒的特异性引物,以及第二类y引物与寨卡病毒的特异性引物继续保持“y”型结构,不会启动延伸反应。通过本发明提供的该引物探针组合可以避免因登革病毒和寨卡病毒基因组序列相似性较高而导致的检测特异性不足的问题,避免非特异性扩增,从而提高登革病毒和/或寨卡病毒检测过程中的特异性和准确性。
[0018]
本发明提供的检测试剂盒,由于包括本发明提供的引物探针组合,因此在检测中对登革病毒和/或寨卡病毒具有较高的特异性、准确性和灵敏度,检测结果可用于登革病毒和/或寨卡病毒的常规监测等领域研究。同时,本发明提供的检测试剂盒只需对一份待检测样本进行一次检测,即可鉴别该待检测样本对登革病毒和寨卡病毒的感染情况,其检测过程仅需1.5小时,可节约检测时间、减少取材数量,显著提高了检测效率。
[0019]
本发明提供的检测试剂盒由于包括本发明提供的引物探针组合,因此在检测时,既可以用于单独快速检测登革病毒或寨卡病毒,还可以避免因登革病毒和寨卡病毒基因组序列相似性较高而导致的检测特异性不足的问题,实现对登革病毒和寨卡病毒的双重快速检测,具有特异性强、准确性好、灵敏度高的优点。本发明提供的检测试剂盒的检测过程仅需1.5小时,可显著缩短检测时间,提高检测效率,具有良好的应用前景和市场价值。
附图说明
[0020]
图1为本发明提供的第一类第一y引物和登革病毒特异性引物与靶序列的序列进行匹配扩增的过程示意图;
[0021]
图2为本发明提供的第一类第一y引物和登革病毒特异性引物与待检测样本(非靶序列)无法进行匹配扩增的过程示意图;
no:5所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0037]
寨卡病毒特异性引物的核苷酸序列为seq id no:6-7所示的核苷酸序列,或由seq id no:6-7所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0038]
第二类第一y引物的核苷酸序列为seq id no:8所示的核苷酸序列,或由seq id no:8所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0039]
第二类第二y引物的核苷酸序列为seq id no:9所示的核苷酸序列,或由seq id no:9所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0040]
第二类荧光探针的核苷酸序列为seq id no:10所示的核苷酸序列,或由seq id no:10所示的核苷酸序列经缺失、插入或替换所得具有相同功能的核苷酸序列;
[0041]
第一类荧光探针上的荧光基团与第二类荧光探针上的荧光基团不同。
[0042]
登革病毒特异性引物(den-fp和den-rp)的核苷酸序列(seq id no:1-2):
[0043]
den-fp:gactagaggttagaggagac
[0044]
den-rp:agacagcaggatctctggt
[0045]
第一类第一y引物den-fp2的核苷酸序列(seq id no:3):
[0046]
den-fp2:actgttccgaacctctagtc-p(“p”表示以磷酸盐封闭其3
’
端)
[0047]
第一类第二y引物den-rp2的核苷酸序列(seq id no:4):
[0048]
den-rp2:gttgactgtactgctgtct-p(“p”表示以磷酸盐封闭其3
’
端)
[0049]
第一类荧光探针的核苷酸序列(seq id no:5):
[0050]
ctytcccagcgtcaatatgctgtttgt
[0051]
寨卡病毒特异性引物(zika-fp和zika-rp)的核苷酸序列(seq id no:6-7):
[0052]
zika-fp:tggagatgaytgcgttgtgaar
[0053]
zika-rp:ttcctaacttttcccatrtcattcaa
[0054]
第二类第一y引物zika-fp2的核苷酸序列(seq id no:8):
[0055]
zika-fp2:gccacacccgcartcatctcca-p(“p”表示以磷酸盐封闭其3
’
端)
[0056]
第二类第二y引物zika-rp2的核苷酸序列(seq id no:9):
[0057]
zika-rp2:ccacccacyatgggaaaagttaggaa-p(“p”表示以磷酸盐封闭其3
’
端)
[0058]
第二类荧光探针的核苷酸序列(seq id no:10):
[0059]
caatygatgataggtttgcacatgccctc
[0060]
本发明实施例提供的引物探针组合,通过设计第一类y引物和第二类y引物,其中,第一类y引物可以与登革病毒的特异性引物部分互补,第二类y引物可以与寨卡病毒的特异性引物部分互补,形成“y”型结构。当登革病毒和/或寨卡病毒的特异性引物的3
’
端与靶序列识别杂交时,其5
’
端与第一类y引物和/或第二类y引物分开,启动延伸反应;当没有靶序列存在,或待检测样本的序列与5
’
端序列不完全匹配时,则第一类y引物与登革病毒的特异性引物,以及第二类y引物与寨卡病毒的特异性引物继续保持“y”型结构,不会启动延伸反应。通过本发明实施例提供的该引物探针组合可以避免因登革病毒和寨卡病毒基因组序列相似性较高而导致的检测特异性不足的问题,避免非特异性扩增,从而提高登革病毒和/或寨卡病毒检测过程中的特异性和准确性。
[0061]
具体地,第一类引物探针组中,第一类第一y引物可以与登革病毒特异性引物den-fp的5
’
端部分互补,形成“y”型结构;第一类第二y引物可以与登革病毒特异性引物den-rp
的5
’
端部分互补,形成“y”型结构。其中,第一类荧光探针可以与登革病毒靶序列的正义链或者反义链的其中一条相结合。以第一类第一y引物为例,以下结合图1和图2对y引物与特异性引物之间的匹配过程进行具体说明:图1中,第一类第一y引物与登革病毒特异性引物den-fp的5
’
端部分互补,形成“y”型结构,在检测过程中,当den-fp的3
’
端与靶序列识别杂交时,其5
’
端即与第一类第一y引物分开,此时将启动延伸反应,使第一类荧光探针上的荧光基团和淬灭基团发生分离,从而荧光检测系统可接收到荧光基团发出的荧光信号,实现对靶序列的检测,靶序列为登革病毒阳性序列;图2中,当没有靶序列存在,或待测样本的序列与den-fp不完全匹配时,则den-fp的5
’
端与第一类第一y引物继续保持“y”型结构,此时无法启动延伸反应,第一类荧光探针上的荧光基团所发射的荧光信号持续被淬灭基团所吸收,荧光检测系统无法接收到荧光基团发出的荧光信号,待测样本为登革病毒阴性。类似地,第一类第二y引物与登革病毒特异性引物den-rp的5
’
端部分互补,形成“y”型结构,在检测过程中,当den-rp的3
’
端与靶序列识别杂交时,其5
’
端即与第一类第二y引物分开,此时将启动延伸反应,使第一类荧光探针上的荧光基团和淬灭基团发生分离,从而荧光检测系统可接收到荧光基团发出的荧光信号,实现对靶序列的检测,靶序列为登革病毒阳性序列;当没有靶序列存在,或待测样本的序列与den-rp不完全匹配时,则den-rp的5
’
端与第一类第二y引物继续保持“y”型结构,此时无法启动延伸反应,第一类荧光探针上的荧光基团所发射的荧光信号持续被淬灭基团所吸收,荧光检测系统无法接收到荧光基团发出的荧光信号,待测样本为登革病毒阴性。在一些实施例中,优选将第一类第一y引物和第一类第二y引物分别与登革病毒特异性引物形成“y”型结构,此时的第一类引物探针组用于检测登革病毒时,其检测特异性可进一步得到提高。
[0062]
相应地,第二类引物探针组中,第二类第一y引物可以与寨卡病毒特异性引物zika-fp的5
’
端部分互补,形成“y”型结构;第二类第二y引物可以与寨卡病毒特异性引物zika-rp的5
’
端部分互补,形成“y”型结构。其中,第二类荧光探针可以与寨卡病毒靶序列的正义链或者反义链的其中一条相结合。第二类第一y引物与寨卡病毒特异性引物zika-fp、第二类第二y引物与寨卡病毒特异性引物zika-rp在检测过程中的识别过程,以及第二类荧光探针的荧光响应过程均与第一类引物探针组的过程类似,此处不再赘述。在一些实施例中,优选将第二类第一y引物和第二类第二y引物分别与寨卡病毒特异性引物形成“y”型结构,此时的第二类引物探针组用于检测寨卡病毒时,其检测特异性可进一步得到提高。
[0063]
可以理解的是,为了实现登革病毒和寨卡病毒的同时检测,需对第一类荧光探针与第二类荧光探针的荧光形态加以区分,因此第一类荧光探针上的荧光基团与第二类荧光探针上的荧光基团应不同。在一些具体实施例中,第一类荧光探针的5
’
端设有荧光基团fam,3
’
端设有淬灭基团bhq1,第二类荧光探针的5
’
端设有荧光基团hex,3
’
端设有淬灭基团bhq2。此时,将第一类荧光探针命名为denv-fam,将第二类荧光探针命名为zika-hex,其序列分别为:
[0064]
fam-ctytcccagcgtcaatatgctgtttgt-bhq1
[0065]
hex-caatygatgataggtttgcacatgccctc-bhq2
[0066]
本发明实施例还提供了一种检测试剂盒,其包括本发明实施例提供的上述引物探针组合。
[0067]
本发明实施例提供的检测试剂盒,由于包括本发明实施例提供的引物探针组合,
因此在检测中对登革病毒和/或寨卡病毒具有较高的特异性、准确性和灵敏度,检测结果可用于登革病毒和/或寨卡病毒的常规监测等领域研究。同时,本发明实施例提供的检测试剂盒只需对一份待检测样本进行一次检测,即可鉴别该待检测样本对登革病毒和寨卡病毒的感染情况,其检测过程仅需1.5小时,可节约检测时间、减少取材数量,显著提高了检测效率。
[0068]
在一些实施例中,登革病毒特异性引物的终浓度为0.50μm-1.0μm(den-fp和den-rp各0.25μm-0.50μm),第一类y引物的终浓度为0.50μm-1.0μm(den-fp2和den-rp2各0.25μm-0.50μm),第一类探针的终浓度为0.10μm-0.30μm;寨卡病毒特异性引物的终浓度为0.50μm-1.0μm(zika-fp和zika-rp各0.25μm-0.50μm),第二类y引物的终浓度为0.50μm-1.0μm(zika-fp2和zika-rp2各0.25μm-0.50μm),第二类探针的终浓度为0.10μm-0.30μm。
[0069]
在一些实施例中,检测试剂盒还包括反应缓冲液、酶混合液、质控品中的至少一种。在一些具体实施例中,检测试剂盒的反应体系为25μl反应体系,其组分如表1所示。可以理解的是,检测试剂盒的反应体系的总体积数也可根据实际情况进行调整,相应地,其中各组分的浓度也按照比例进行调整。
[0070]
表1 25μl反应体系的反应液组成
[0071][0072][0073]
本发明实施例还提供了上述检测试剂盒在检测登革病毒和/或寨卡病毒中的应用。
[0074]
本发明实施例提供的检测试剂盒由于包括本发明实施例提供的引物探针组合,因此在检测时,既可以用于单独快速检测登革病毒或寨卡病毒,还可以避免因登革病毒和寨
卡病毒基因组序列相似性较高而导致的检测特异性不足的问题,实现对登革病毒和寨卡病毒的双重快速检测,具有特异性强、准确性好、灵敏度高的优点。本发明实施例提供的检测试剂盒的检测过程仅需1.5小时,可显著缩短检测时间,提高检测效率,具有良好的应用前景和市场价值。
[0075]
具体地,将本发明实施例提供的检测试剂盒用于检测登革病毒和/或寨卡病毒时,包括如下步骤:
[0076]
s1、提供待测样本的总rna;
[0077]
s2、以检测试剂盒对总rna进行rt-qpcr扩增,得到荧光曲线;
[0078]
s3、当荧光曲线呈s型,且ct值≤38时为阳性结果;当荧光曲线呈s型,且38<ct值<40时为可疑结果,重新对总rna进行rt-qpcr扩增;当荧光曲线为非s型,且ct值=40或无ct值时为阴性结果。
[0079]
具体地,s1中,对待测样本进行总rna提取的方法可采用本领域的常规方法。
[0080]
s2中,对待测样本的总rna进行rt-qpcr扩增的方法可采用本领域的常规方法。在一些实施例中,对25μl反应体系下rt-qpcr扩增的反应程序进行了优化,以提高扩增效率和检测效率,具体包括逆转录、变性和扩增三个步骤,各步骤的反应条件如表2所示。
[0081]
表2 rt-qpcr的反应程序
[0082][0083]
s3中,根据所得荧光曲线的不同,结合ct值的范围,可知待测样本的检测结果。ct值中,c代表cycle,t代表threshold,其含义是:每个反应管内的荧光信号到达设定的阈值时所经历的循环数。其中,当荧光曲线呈s型,且ct值≤38时,该待测样本为阳性,根据其所发荧光来源,即可确定该待测样本为登革病毒/寨卡病毒阳性。例如,当第一类荧光探针上的荧光基团为fam,第二类荧光探针上的荧光基团为hex时,当检测结果所发荧光信号为fam,则为登革病毒阳性;当检测结果所发荧光信号为hex,则为寨卡病毒阳性;当检测结果所发荧光信号为fam和hex的混合,则提示登革病毒和寨卡病毒均为阳性。
[0084]
当荧光曲线呈s型,且38<ct值<40时为可疑结果,应重新对总rna进行rt-qpcr扩增,如果复核结果显示ct值<40、且荧光曲线呈s型,则该待测样本为阳性,然后再根据其所发荧光信号确认具体是登革病毒阳性和/或寨卡病毒阳性;如果复核结果显示ct值≥40,或荧光曲线为非s型,则该待测样本为阴性。
[0085]
当荧光曲线为非s型,且ct值=40或无ct值时,该待测样本为阴性。
[0086]
通过上述的检测步骤,不仅可以用于单独检测登革病毒、寨卡病毒,还可以实现登革病毒和寨卡病毒的双重检测,同时在第一类引物探针组和第二类引物探针组的存在下,可避免登革病毒和寨卡病毒基因组序列相似性较高而导致的特异性不足的问题。
[0087]
为使本发明上述实施细节和操作能清楚地被本领域技术人员理解,以及本发明实
施例引物探针组合、检测试剂盒及其应用的进步性能显著的体现,以下通过多个实施例来举例说明上述技术方案。
[0088]
实施例1
[0089]
本实施例提供了一种检测试剂盒,其包括rt-pcr反应液、rt-pcr酶混合液、阳性质控品和阴性质控品。
[0090]
其中,rt-pcr反应液包含2
×
one-step rt-qpcr buffer及登革病毒特异性引物(denv-fp、denv-rp)、第一类y引物(denv-fp2、denv-rp2)及第一类荧光探针(denv-fam)、寨卡病毒特异性引物(zika-fp、zika-rp)、第二类y引物(zika-fp2、zika-rp2)和第二类荧光探针(zika-hex),其中,各引物、荧光探针的获取方法是:从ncbi上下载所有已知的登革病毒和寨卡病毒全基因组序列,使用clone manager软件进行序列比对,寻找各型别序列的特异性保守区、然后使用primer express 3.0软件设计登革病毒特异性引物(denv-fp、denv-rp)、第一类y引物y引物(denv-fp2、denv-rp2)及第一类荧光探针(denv-fam)、寨卡病毒特异性引物(zika-fp、zika-rp)、第二类y引物(zika-fp2、zika-rp2)和第二类荧光探针(zika-hex)。所有引物、探针在生工生物(上海)股份有限公司合成;2
×
one-step rt-qpcr buffer和酶混合液均来源于quanti probe one-step rt-qpcr kit(深圳联合医学科技有限公司)。
[0091]
阳性质控品为含有登革病毒和寨卡病毒目的基因片段的合成质粒混合物,阴性质控品为depc水。
[0092]
本实施例提供的检测试剂盒的反应体系为25μl,其组成如表1所示。
[0093]
表1 25μl反应体系的反应液组成
[0094]
[0095][0096]
实施例2
[0097]
本实施例以实施例1所得检测试剂盒,对阳性质控品进行检测,包括如下步骤:
[0098]
(11)阳性质控品验证:取试剂盒内阳性质控品进行验证;以abi 7500型全自动荧光定量pcr检测仪进行程序设置,荧光报告基团为:fam,vic通道,passive reference:none,反应程序如表2所示;
[0099]
(12)扩增结束后,所得荧光曲线如图3所示。
[0100]
通过图3可以看出,两条荧光曲线均呈s型,ct值均≤38,且第一类荧光探针和第二类荧光探针均发光,说明实施例1所得检测试剂盒可以同时检测出登革病毒(den)和寨卡病毒(zika)。
[0101]
表2 rt-qpcr的反应程序
[0102][0103][0104]
实施例3
[0105]
本实施例以实施例1所得检测试剂盒,对阴性质控品进行检测,包括如下步骤:
[0106]
(21)阴性质控品验证:取depc水进行阴性质控品验证;以abi 7500型全自动荧光定量pcr检测仪进行程序设置,荧光报告基团为:fam,vic通道,passive reference:none,反应程序如表2所示;
[0107]
(22)扩增结束后,所得荧光曲线如图4所示。
[0108]
通过图4可以看出,实施例1所得检测试剂盒对阴性质控品进行检测时,所得荧光
曲线非s型且无ct值,提示不存在登革病毒和寨卡病毒,检测结果准确,不会出现假阳性。
[0109]
实施例4
[0110]
(31)样本准备:收集登革病毒1株;
[0111]
(32)样本核酸提取:按照病毒rna提取试剂盒qiaamp viral rna kit方法对样本进行核酸提取。阳性质控品和阴性质控品无需提取,可直接使用;
[0112]
(33)以abi 7500型全自动荧光定量pcr检测仪进行程序设置,荧光报告基团为:fam,vic通道,passive reference:none,反应程序如表2所示;
[0113]
(34)扩增结束后,所得荧光曲线如图5所示。
[0114]
通过图5可以看出,实施例1所得检测试剂盒对登革病毒样本进行检测时,所得荧光曲线呈s型,ct值≤38,且只收集到第一类荧光探针denv-fam的荧光信号,提示登革病毒阳性、寨卡病毒阴性。
[0115]
实施例5
[0116]
(41)样本准备:收集寨卡病毒1株;
[0117]
(42)样本核酸提取:按照病毒rna提取试剂盒qiaamp viral rna kit方法对样本进行核酸提取。阳性质控品和阴性质控品无需提取,可直接使用;
[0118]
(43)以abi 7500型全自动荧光定量pcr检测仪进行程序设置,荧光报告基团为:fam,vic通道,passive reference:none,反应程序如表2所示;
[0119]
(44)扩增结束后,所得荧光曲线如图6所示。
[0120]
通过图6可以看出,实施例1所得检测试剂盒对寨卡病毒样本进行检测时,所得荧光曲线呈s型,ct值≤38,且只收集到第二类荧光探针zika-hex的荧光信号,提示登革病毒阴性、寨卡病毒阳性。
[0121]
实施例6
[0122]
(51)样本准备:收集登革病毒和寨卡病毒各1株;
[0123]
(52)样本核酸提取:按照病毒rna提取试剂盒qiaamp viral rna kit方法对样本进行核酸提取。阳性质控品和阴性质控品无需提取,可直接使用;
[0124]
(53)以abi 7500型全自动荧光定量pcr检测仪进行程序设置,荧光报告基团为:fam,vic通道,passive reference:none,反应程序如表2所示;
[0125]
(54)扩增结束后,所得荧光曲线如图7所示。
[0126]
通过图7可以看出,实施例1所得检测试剂盒对登革病毒和寨卡病毒混合样本进行检测时,得到两条荧光曲线,均呈s型,ct值均≤38,且可以同时收集到第一类荧光探针denv-fam和第二类荧光探针zika-hex的荧光信号,提示登革病毒、寨卡病毒均为阳性。
[0127]
实施例7
[0128]
使用实施例1所得检测试剂盒对登革病毒中浓度样本(1
×
104copies/ml)、登革病毒低浓度样本(1
×
103copies/ml)、寨卡病毒中浓度样本(1
×
[0129]
104copies/ml)、寨卡病毒低浓度样本(1
×
103copies/ml)进行检测,每个样本重复检测10次,使用abi7500荧光pcr进行检测,荧光报告基团为:fam,vic通道,passive reference:none,反应程序如表2所示,计算ct值的变异系数,结果如表3所示。
[0130]
表3重复性实验结果
[0131][0132]
通过表3可以看出,本发明实施例1所得检测试剂盒对不同浓度的登革病毒样本和寨卡病毒样本进行10次重复检测,阳性样本的批内ct值变异系数≤5%,说明本发明实施例1所得检测试剂盒的检测重复性好,准确性高。
[0133]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



