靶向miR-29b的gRNA、AAV8-CRISPR/Cas9系统及其应用的制作方法
 2021-02-02 08:02:36|
2021-02-02 08:02:36| 347|
347| 起点商标网
起点商标网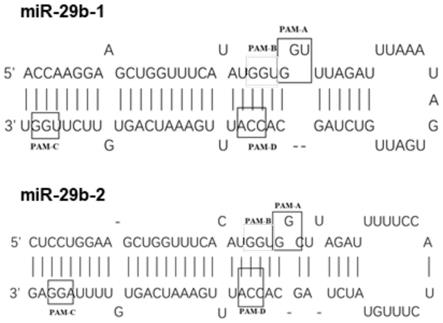
靶向mir-29b的grna、aav8-crispr/cas9系统及其应用
技术领域
[0001]
本发明属于基因工程技术领域,具体涉及靶向mir-29b的grna、aav8-crispr/cas9系统及其应用。
背景技术:
[0002]
骨骼肌是人体最大的器官,其作为神经系统支配的靶器官在人体运动过程中起到重要作用。肌肉萎缩症是一种进行性骨骼肌细胞退化疾病,肌肉萎缩的主要表现为肌肉质量的减少。在患者出现行动受限或残疾时常伴有肌肉萎缩症的发生,例如败血症,癌症,艾滋病,充血性心力衰竭,慢性阻塞性肺病,肾功能衰竭,严重烧伤以及库欣氏病等疾病都会引起肌肉萎缩。目前临床上对于肌肉萎缩的治疗仍然以运动康复为主,遗憾的是运动康复并不适用于瘫痪、残疾、心力衰竭末期以及严重烧伤等疾病患者,而对于癌症、肾功能衰竭等疾病患者即便是增加运动也不能完全逆转肌肉萎缩的发生。
[0003]
腺相关病毒(adeno-associated virus,aav)属于细小病毒科依赖性病毒属,目前已有40多种不同的血清型被鉴别出来,aav病毒的血清型通过其蛋白衣壳的差异进行区分,目前已知的aav病毒种类包括aav1-9、avian aav、bovine aav和canine aav等。aav病毒作为基因治疗载体具有诸多优点,例如低致病性,能够侵袭感染处于分裂期及静止期的细胞,且在宿主细胞内能够稳定存在并长期表达目的基因。
[0004]
crispr/cas9系统最早在细菌中发现,当细菌受到噬菌体侵袭感染时crispr/cas9系统能够有效识别并剪切外源dna,基于其识别并对目标dna的剪切作用。crispr/cas9提供了一种简洁高效的遗传物质编辑的方法,该技术很快被开发用于遗传性疾病、癌症、病毒感染性疾病以及多种与基因突变相关疾病的治疗。
[0005]
mirna是内源性短非编码rna,通常为18~25个核苷酸,其通过与mrna的3'utr结合并抑制其翻译来调节靶基因的表达。mirna的前体首先在细胞核中被转录并随后通过几个酶促反应成熟并转移到细胞质中以发挥其生物学功能。mirna通过募集特异性沉默蛋白形成rna诱导的沉默复合物(risc)来发挥其调节功能。据推测,在人类中,约60%的mrna是mirna的靶标,而一个mirna可能靶向超过100个mrna。之前的研究表明,在肌肉萎缩的发生发展中,非编码rna在其中发挥着重要的作用,研究表明,mir-1,mir-29b,mir-133,mir-23a,mir-21,mir-27,mir-628,mir-431和mir-206等多种小rna在肌肉萎缩发生中起到调节作用。但目前还没有一种针对肌肉萎缩的长效安全的基因治疗手段。
技术实现要素:
[0006]
有鉴于此,本发明的目的在于提供靶向mir-29b的grna、aav8-crispr/cas9系统及其应用,所述grna能有效抑制mir-29b表达。
[0007]
本发明的目的在于提供靶向mir-29b的aav8-crispr/cas9系统及其应用,所述系统能在骨骼肌细胞中长效安全的靶向mir-29b,并通过抑制mir-29b的表达,实现制备基因治疗肌肉萎缩用药物的目的。
[0008]
本发明提供了靶向mir-29b的grna,所述grna的核苷酸序列如seq id no.1所示。
[0009]
优选的,所述mir-29b的核苷酸序列如seq id no.2所示。
[0010]
本发明提供了靶向mir-29b的aav8-crispr/cas9系统,包含所述的grna。
[0011]
优选的,所述aav8-crispr/cas9系统以dmck启动子启动表达所述grna。
[0012]
本发明提供了所述aav8-crispr/cas9系统的构建方法,包括以下步骤:
[0013]
采用限制性内切酶酶切腺相关病毒质粒,得到线性腺相关病毒质粒;
[0014]
将所述grna插入线性腺相关病毒质粒中,得到aav8-crispr/cas9系统。
[0015]
优选的,所述腺相关病毒质粒为paav-dmck-sacas9-pa-grna。
[0016]
优选的,所述限制性内切酶为bbsi。
[0017]
本发明提供了所述grna、所述aav8-crispr/cas9系统或所述方法构建得到的aav8-crispr/cas9系统在制备治疗肌肉萎缩的药物中的应用。
[0018]
优选的,所述肌肉萎缩包括肌源性肌萎缩、废弃性肌萎缩或慢性疾病心衰诱发的肌萎缩。
[0019]
本发明提供了靶向mir-29b的grna,所述grna的核苷酸序列如seq id no.1所示。与设计的其他grna相比,本发明提供的grna在细胞水平上对mir-29b具有较强的特异性结合能力,且具有更强的编辑效率,能有效抑制mir-29b的表达,且仅对mir-29b具有靶向编辑作用,对于同家族的mir-29a和mir-29c没有影响。t7酶切验证试验结果表明,本发明提供的grna不存在脱靶效应。
[0020]
本发明提供了靶向mir-29b的aav8-crispr/cas9系统,包含所述的grna。针对在多种肌肉萎缩中均呈现高表达的mir-29b为靶点,通过aav8病毒载体将crispr-cas9(由肌肉特异性启动子dmck启动)递送至骨骼肌细胞中对骨骼肌细胞中mir-29b进行基因编辑,特异性降低骨骼肌中mir-29b的表达,实现对肌肉萎缩的治疗。小鼠抓力试验表明,angii诱导小鼠腓肠肌肌萎缩,小鼠抓力降低,而aav8-crispr-cas9-29b-d病毒能够有效逆转肌萎缩,并使恢复部分抓力。小鼠肌管直径方面的影响,angii诱导小鼠腓肠肌肌萎缩,腓肠肌肌管直径显著降低,而aav8-crispr-cas9-29b-d病毒能够有效逆转肌萎缩,并使肌管直径恢复。
[0021]
进一步的,本发明具体限定了所述aav8-crispr/cas9系统是以dmck启动子启动表达所述grna,保证此系统仅仅在骨骼肌细胞内发挥作用,对其他的类型的细胞和组织没有影响,具有很好的靶向性和安全性。
附图说明
[0022]
图1为细胞水平实验筛选最佳grna,其中图1a为针对mir-29b设计编辑位点的示意图;图1b为不同grna对mir-29b表达的影响;图1c为t7酶切验证grna-mir-29b-d以及grna-29b-c的编辑效率;图1d为在细胞水平验证grna-mir-29b-d对mir-29b的特异性;图1e为验证grna-mir-29b-d是否存在脱靶效应;*,p<0.05,**,p<0.01;
[0023]
图2为腺相关病毒aav8递送的crispr/cas9系统对ang ii诱导的肌肉萎缩的治疗作用,图2a为aav8病毒携带目的基因示意图,图2b为经过aav8递送的crispr-cas9系统对ang ii诱导的肌肉萎缩模型小鼠的后肢抓力有恢复作用,图2c为经过aav8递送的crispr-cas9系统对ang ii诱导的肌肉萎缩模型中小鼠腓肠肌中mir-29b的表达有抑制作用,图2d为ang ii诱导的肌肉萎缩模型中,aav8-crispr-mir-29b-d处理后对腓肠肌肌肉重量的影
响,图2e为ang ii诱导的肌肉萎缩模型中,aav8-crispr-mir-29b-d处理后对肌管直径的影响;*,p<0.05,**,p<0.01;
[0024]
图3为aav8载体质粒paav-dmck-sacas9-pa-grna结构图;
[0025]
图4为病毒的标准曲线。
具体实施方式
[0026]
本发明提供了靶向mir-29b的grna,所述grna的核苷酸序列如seq id no.1所示(cctaaaacactgatttcaaa)。
[0027]
在本发明中,所述mir-29b的核苷酸序列优选如seq id no.2所示(uagcaccauuugaaaucaguguu)。本发明对mir-29b进行基因编辑的选择从pre-mir-29b序列中进行设计,其核苷酸序列如seq id no.3所示:(aggaagcugguuucauauggugguuuagauuuaaauagugauugucuagcaccauuugaaaucaguguucu)。本发明对grna的设计方法没有特殊限制,采用本领域所熟知的设计方案即可。本发明对靶向mir-29b的grna的来源没有特殊限制,采用本领域所熟知的grna的合成方法即可。
[0028]
在本发明中,与设计的其他grna相比,本发明提供的grna在细胞水平上对mir-29b具有较强的特异性结合能力,且具有更强的编辑效率,能有效抑制mir-29b的表达,且仅对mir-29b具有靶向编辑作用,对于同家族的mir-29a和mir-29c没有影响。
[0029]
本发明提供了靶向mir-29b的aav8-crispr/cas9系统,包含所述的grna。
[0030]
在本发明中,所述aav8-crispr/cas9系统优选以dmck启动子启动表达所述grna。与慢病毒系统的通用的u6启动子发挥效果没有选择性,且可能进入其他类型的细胞后产生副作用相比,dmck启动子是保证此系统仅仅在骨骼肌细胞内发挥作用,对其他的类型的细胞和组织没有影响,具有很好的靶向性。
[0031]
在本发明中,aav8病毒携带目的基因示意图见图2a。
[0032]
在本发明中,以过慢病毒介导crispr-cas9-grna基因片段进入宿主细胞中作为对照,结果发现对mir-29b表达的抑制效果也是可以的,但是因为慢病毒作用机制会将基因片段整合到宿主的基因组中,做为基因治疗的话安全性不佳,仅仅适合实验研究,此外,慢病毒发挥效应时间短。而aav8不会进行整合,游离在细胞质中,保存时间长,可以被去除等特点,更适合做基因治疗的药物。
[0033]
本发明提供了所述aav8-crispr/cas9系统的构建方法,包括以下步骤:
[0034]
采用限制性内切酶酶切腺相关病毒质粒,得到线性腺相关病毒质粒;
[0035]
将所述grna插入线性腺相关病毒质粒中,得到aav8-crispr/cas9系统。
[0036]
在本发明中,所述腺相关病毒质粒优选为paav-dmck-sacas9-pa-grna。所述腺相关病毒质粒的结构示意图见图3。paav-dmck-sacas9-pa-grna的制备方法为以paav-lp1-sacas9-pa-grna为基础,将质粒上的lp1启动子替换为dmck启动子,具体dmck启动子片段从paav-dmck-gfp上使用限制性内切酶nhei和ecori酶切得到,使用限制性内切酶nhei和ecori切除paav-lp1-sacas9-pa-grna上的lp1,将得到的dmck启动子片段连接至线性化载体上,得到paav-dmck-sacas9-pa-grna。其中,所述paav-lp1-sacas9-pa-grna和paav-dmck-gfp中在现有技术有中报道(参见prevention of muscle wasting by crispr/cas9-mediated disruption of myostatin in vivo;doi:10.1038/mt.2016.192)。
[0037]
在本发明中,所述限制性内切酶优选为bbsi。本发明对所涉及的酶的来源不做具体限定,采用本领域所熟知的生物试剂的常规购买途径获得即可。
[0038]
在本发明中,优选将插入有所述grna的线性腺相关病毒质粒在aav8衣壳质粒和helper质粒的辅助下包装成为重组aav8病毒。本发明包装的方法没有特殊限制,采用本领域所熟知的包装方法即可。采用所述重组aav8病毒注射肌肉萎缩部位,实现肌肉萎缩的基因治疗。
[0039]
本发明提供了所述grna、所述aav8-crispr/cas9系统或所述方法构建得到的aav8-crispr/cas9系统在制备治疗肌肉萎缩的药物中的应用。
[0040]
在本发明中,所述肌肉萎缩优选包括肌源性肌萎缩、废弃性肌萎缩或慢性疾病心衰诱发的肌萎缩。
[0041]
在本发明中,所述药物包括含所述重组aav8病毒的试剂。所述药物的注射剂量为10
11
vg/只小鼠。
[0042]
下面结合实施例对本发明提供的靶向mir-29b的grna、aav8-crispr/cas9系统及其应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0043]
实施例1
[0044]
1、grna的设计及合成:针对mir-29b的不同编辑位点设计grna(见图1a),mir-29b-1和mir-29b-2指示分别处于6号染色体和1号染色体上的两段基因序列,这两段序列均可以形成成熟的mir-29b。pam全称为protospacer-adjacent motif(原间隔序列毗邻基序),pam是cas9酶识别的位点。方框中标识的pam-a、pam-b、pam-c和pam-d是在该段序列中存在的cas9酶识别位点。
[0045]
设计得到以下四种不同grna:grna-mir-29b-a、grna-mir-29b-b、grna-mir-29b-c和grna-mir-29b-d的核苷酸序列分别为:aggaagctggtttcatatgg(seq id no.4)、ttcaggaagctggtttcata(seq id no.5)、ccatttgaaatcagtgtttt(seq id no.6)、cctaaaacactgatttcaaa(seq id no.1)。
[0046]
2、c2c12细胞培养:细胞培养基选用含有10%fbs,1%p/s的dmem完全培养基,诱导细胞进行分化的培养基为含有2%马血清,1%p/s的dmem完全培养基,分化时间一般为4天。
[0047]
3、不同grna对mir-29b表达的影响
[0048]
将上述设计合成的4种grna插入lenti-crisprv2载体(购自addgene)中,形成lenti-crispr/cas9-grna-mir-29b-a、lenti-crispr/cas9-grna-mir-29b-b、lenti-crispr/cas9-grna-mir-29b-c和lenti-crispr/cas9-grna-mir-29b-d,通过慢病毒将四种重组质粒及lenti-crisprv2载体转染至c2c12细胞中,采用实时荧光定量pcr法对c2c12细胞中mir-29b表达进行检测,以5s作为内参,采用法进行计算。具体方法如下:首先使用trizol reagent提取细胞内总rna,取400ng rna加入特定rt引物(从锐博公司购买),并使用bio-rad公司逆转录试剂盒进行逆转录实验:逆转录反应体系如下:
[0049]
400ng rna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5.5μl
[0050]
mir-29b rt primer(5nm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μl
[0051]
5s rt引物(5nm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μl
[0052]
混合物体积为7.5μl,随后70℃,10min充分打开rt引物颈环结构,4℃,5min退火,使mirna与特异性rt引物充分结合。
[0053]
随后加入:5
×
iscript反应混合液2μl,iscript反转录酶0.5μl,随后进行如下程序:
[0054]
priming
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
25℃
ꢀꢀꢀꢀꢀꢀ
5min
[0055]
reverse transcription
ꢀꢀꢀꢀꢀ
46℃
ꢀꢀꢀꢀꢀꢀ
20min
[0056]
rt inactivation
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
95℃
ꢀꢀꢀꢀꢀꢀ
1min
[0057]
得到rt产物后,稀释400倍,采用qpcr法检测mir-29b的表达,具体方法如下。
[0058]
配制qpcr反应体系,反应体系为10μl:
[0059]
sybr green
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5μl
[0060]
primer mix f+r(5nm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μl
[0061]
cdna(diluted)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4μl
[0062]
其中,mir-29b以及内参5s的上下游引物均购自锐博公司。
[0063]
qpcr反应程序如下:
[0064][0065]
结果见图1b。由图1b可知,与对照相比,grna-mir-29b-a、grna-mir-29b-b处理组mir-29b的表达量增高,而grna-mir-29b-c和grna-mir-29b-d处理组显著性降低。因此,以grna-mir-29b-c和grna-mir-29b-d进行后续试验。
[0066]
4、t7酶切验证grna-mir-29b-d以及grna-mir-29b-c的编辑效率
[0067]
基因编辑原理:grna与cas9结合并靶向形成mir-29b的dna片段,grna-cas9进入细胞核并识别pam序列和靶序列后,在其后方3个碱基的地方切断dna,并产生平末端切口。断裂的dna分子在随后的非同源末端连接途径修复过程中发生突变失去活性,从而实现对目的基因的沉默。此处的grna-mir-29b-d以及grna-mir-29b-c即为不同的grna引导cas9对目的基因的切割。
[0068]
使用100ng小鼠dna(使用组织genomic dna提取试剂盒从小鼠成肌细胞c2c12中提取)作为模板扩增靶向的mir-29b-1和mir-29b-2基因组dna片段。分别以100ng的mir-29b-1或mir-29b-2基因片段为模板,使用如下引物扩增:mir-29b-1 f 5
’-
gctgcaccgtgaatgtgtaa-3
’
(seq id no.7),r 5
’-
aggtcttcatccgagcatgg-3
’
(seq id no.8),;mir-29b-2,f 5
’-
tgtacatatgttgaatggatttggt-3
’
(seq id no.9),r5
’-
tgctgcaaccaggactgaat-3
’
(seq id no.10)。
[0069]
将纯化的pcr产物变性并在20μl体积的neb buffer 2中在以下条件进行退火:95
℃,5min;95℃~75℃,0.1℃/循环,200次;75℃~15℃,0.1℃/循环,600次;4℃保温。1u t7en1酶添加到杂交的pcr产物中,并将反应混合物在37℃下孵育1小时。用2%琼脂糖分离产物,用gelred染色。得到图1c。结果显示,grna-mir-29b-d的编辑效率明显高于grna-mir-29b-c。
[0070]
5、grna-mir-29b-d对mir-29b的特异性试验
[0071]
使用慢病毒将lenti-crispr/cas9-grna-mir-29b-d病毒转染至c2c12细胞中,以crisprv2为对照,转染72h后检测mir-29家族中mir-29a、mir-29b、mir-29c的表达,具体方法如下:
[0072]
将转染72h的c2c12细胞提取rna,反转录得到cdna,经过核酸定量检测其浓度后,稀释至200~400ng/μl后进行如下qpcr反应。
[0073]
qpcr反应体系为:
[0074]
sybr green
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5μl
[0075]
primer mix f+r(各5nm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μl
[0076]
cdna(稀释后)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4μl
[0077]
qpcr反应程序如下:
[0078]
95℃预变性5min;95℃变性10s,60℃退火15s,72℃延伸10s,40个循环;95℃ 15s,60℃ 60s,95℃ 15s,溶解曲线。三种微小rna特异性引物及特异性逆转录引物均购自广州市锐博生物科技有限公司,该公司不提供具体引物序列。qpcr反应以5s作为内参,同样购自广州市锐博生物科技有限公司。
[0079]
qpcr的结果见图1d。由图1d可知,grna-mir-29b-d仅对mir-29b具有靶向编辑作用,对于同家族的mir-29a和mir-29c没有影响。
[0080]
6、验证grna-mir-29b-d是否存在脱靶效应
[0081]
1)检测grna-mir-29b-d可能脱靶的top10位置是否发生脱靶;
[0082]
使用100ng小鼠gdna作为模板扩增,dna片段。使用引物如表1所示。
[0083]
表1检测grna-mir-29b-d可能脱靶的top10位置的引物信息
[0084][0085]
将纯化的pcr产物变性并在20μl体积的neb buffer 2中在以下条件进行退火:95℃,5min;95℃~75℃,0.1℃/循环,200次;75℃~15℃,0.1℃/循环,600次;4℃保温。1u t7en1酶添加到杂交的pcr产物中,并将反应混合物在37℃下孵育1小时。用2%琼脂糖分离产物,用gelred染色。得到图1e。
[0086]
结果见图1e。由图1e可知,由图1e可知,所有10个可能脱靶的dna片段均没有出现被t7en1酶剪切的片段,这说明,grna-mir-29b-d没有脱靶。
[0087]
2)检测mir-29b同家族的成员mir-29a和mir-29c是否受到影响,具体方法参见上述步骤5的方法,结果参见图1d的结果。
[0088]
实施例2
[0089]
重组病毒的构建方法
[0090]
重组质粒的构建:使用bbsi限制性内切酶将质粒paav-dmck-sacas9-pa-grna酶切,将上述四种设计好的grna序列分别插入其中,将质粒转化至感受态细胞中,挑选单克隆测序后得到四种含grna的目标质粒。
[0091]
aav8-crispr-cas9-mir-29b-grna病毒包装:将293t细胞以每培养皿400万个细胞的密度接种在10cm细胞培养皿中。24小时后,向每个培养皿中加入1ml不含血清、含有10μg aav8、10μg paav-dmck-sacas9-pa-grna、10μg helper、90μg pei max的dmem培养基进行转染。转染12小时后,更换新鲜的dmem完全培养基,并在48小时后收集细胞和培养物中的病毒。收集培养基中的病毒:每100ml培养基中添加25ml 40% peg-8000溶液,在4℃搅拌过夜,2800g,15℃离心15分钟。向病毒沉淀中加入1ml细胞裂解缓冲液重悬。细胞中病毒的收集:将细胞沉淀重悬于5ml细胞裂解缓冲液中,并将细胞在-80℃冰箱和37℃水浴中反复融化3次。将培养基中的病毒悬浮液与冻融的细胞悬浮液混合,添加1m mgcl2至终浓度1mm,添加benzonase至终浓度250u/ml,并在37℃下孵育45分钟在4℃以4000rpm离心4分钟后,取上
清液。使用碘克沙醇梯度密度离心纯化病毒。纯化病毒的aav8病毒携带目的基因示意图见图2a。
[0092]
病毒滴度的检测方法:将病毒载体质粒paav-dmck-sacas9-pa-grna稀释至1ng/μl,经计算得知此时质粒拷贝数浓度为:1.36
×
10
11 vg/ml。将质粒两倍梯度稀释13次得到标准品1~14,以2倍稀释的standard dna dilution用来制备标准曲线。
[0093]
取5μl上述制备的纯化病毒aav8-crispr-cas9-mir-29b-grna,使用组织genomic dna提取试剂盒按说明书中的指导提取病毒gdna,gdna最终被50μl ddh2o洗脱,随后将病毒gdna再稀释100倍后采用qpcr法检测病毒滴度。qpcr反应体系如下:
[0094][0095]
qpcr反应用上游引物f和下游引物r的序列如下:
[0096]
上游引物f:tacaacgccctgaatgacct(seq id no.11);
[0097]
下游引物r:gtcctcttcgttgaccagga(seq id no.12)。
[0098]
qpcr反应程序如下:95℃预变性10min;95℃变性15sec,60℃退火30sec,40个循环。
[0099]
由于循环数和standard dna dilution浓度的对数成线性关系,通过线性拟合求得病毒滴度。
[0100]
标准曲线见图4。病毒样品cq值为:11.71、11.74、11.76(三个重复样品),由此求得病毒滴度为:2.36
×
10
13 vg/ml。
[0101]
滴度测定后的aav8病毒可直接用于动物实验或冷冻于-80℃。
[0102]
实施例3
[0103]
试验分组为对照组病毒(不包含grna的病毒)+肌萎缩模型对照组,对照组病毒+肌萎缩模型组,aav8-crispr-cas9-29b-d病毒组+肌萎缩模型对照组,aav8-crispr-cas9-29b-d病毒组+肌萎缩模型组。
[0104]
以1
×
10
11 vg/只的剂量将病毒(或不包含grna的病毒)直接注射入小鼠的腓肠肌中,三周后进行肌萎缩模型的构建。其中vg表示vector genome。ang ii诱导的肌肉萎缩模型建立方法如下:c57bl/6j小鼠在背部包埋含有ang ii(1.5μg/kg/min)的缓释泵(alzet2001),对照组小鼠背部包埋的缓释泵中装填pbs。埋泵后一周,处死小鼠,取腓肠肌进行检测。
[0105]
实验结束后,采用抓力仪检测小鼠后肢抓力,然后处死小鼠,解剖得到小鼠腓肠肌,使用分析天平称量小鼠腓肠肌重量。然后对肌肉样本进行冰冻组织切片,wga染色,统计肌纤维横切面积的变化。同时取腓肠肌组织样本,提取腓肠肌组织的总rna,采用实施例1的步骤2的荧光定量pcr的技术检测mir-29b的变化。
[0106]
结果:
[0107]
1、小鼠mir-29b表达
[0108]
如图2b所示,angii诱导小鼠腓肠肌肌萎缩时mir-29b明显升高。aav8-crispr-cas9-29b-d病毒能够有效逆转mir-29b升高。
[0109]
2、小鼠抓力检测
[0110]
如图2c所示,angii诱导小鼠腓肠肌肌萎缩,小鼠抓力降低。aav8-crispr-cas9-29b-d病毒能够有效逆转肌萎缩,并使恢复部分抓力。
[0111]
3、腓肠肌肌肉重量
[0112]
如图2d所示,angii诱导小鼠腓肠肌肌萎缩,aav8-crispr-cas9-29b-d病毒能够有效逆转肌萎缩。
[0113]
4、肌管直径
[0114]
如图2e所示,angii诱导小鼠腓肠肌肌萎缩,腓肠肌肌管直径显著降低。aav8-crispr-cas9-29b-d病毒能够有效逆转肌萎缩,并使肌管直径恢复。
[0115]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



