一株解淀粉芽胞杆菌及其在防治苹果重茬障碍中的应用的制作方法
 2021-02-02 07:02:02|
2021-02-02 07:02:02| 392|
392| 起点商标网
起点商标网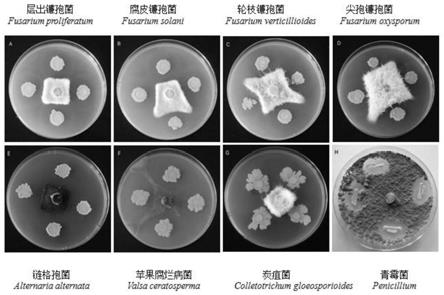
[0001]
本发明涉及农业微生物技术领域,具体涉及一株解淀粉芽胞杆菌及其在防治苹果重茬障碍中的应用。
背景技术:
[0002]
我国苹果栽培面积、总产量、人均占有量与出口量均居世界第一,已经成为世界上最大的苹果生产和消费国。目前,我国苹果栽培面积有3700万亩,苹果产量约为4380万吨,但这些传统优势栽培地区的苹果园主要是上个世纪80年代与90年代初建立的,大部分已进入衰老期,其中仅山东省在今后5年就有近6.7~10万hm2苹果园面临更新。由于土地资源有限,在对老果园更新时,苹果树重茬栽培无法避免,导致重茬障碍的发生具有普遍性。与正常果园相比,重茬障碍可导致苹果亩产量降低20~50%,给果园经营者带来巨大损失,严重制约了果树产业的可持续发展。如何有效缓解或克服重茬障碍已成为我国苹果产业可持续发展亟待解决的一项重要工作。
[0003]
苹果重茬障碍的致病因素非常复杂,包括生物和非生物因素两大类,且以有害真菌为主的生物因素占主导地位。不同地区、不同果园重茬土壤中的有害真菌不同。已报道与苹果重茬障碍有关的主要有害真菌属有柱孢属、镰孢属、丝核属、疫霉属和腐霉属等。franke-whittle等研究认为柱孢属和镰孢属是引起苹果重茬障碍的主要有害菌。tewoldemedhin等研究发现腐霉属真菌是引起苹果重茬障碍的主要有害真菌。van schoor等调查南非地区重茬苹果园时,发现镰孢属、柱孢属以及腐霉属是引起重茬障碍的主要原因。kelderer等研究表明,腐皮镰孢菌、尖孢镰孢菌、柱孢属真菌和双核丝核菌是引起意大利地区苹果重茬障碍的主要病原。非生物因素包括土壤酚酸类物质积累、土壤理化性质恶化和土壤养分失衡等。前人研究认为,酚酸类物质在苹果重茬障碍中发挥重要作用,且在重茬土壤环境中,根皮苷和串珠镰孢菌共同作用加重了苹果重茬障碍,进一步研究表明根皮苷能促进串珠镰孢菌数量的急剧增长,并且促使其菌丝分裂速度加快。目前,对苹果重茬病害的控制主要依赖于土壤熏蒸,如溴甲烷、氯化苦、棉隆、威百亩和福尔马林等土壤消毒。虽然化学消毒可以有效地控制土传病害,但使用这些化学消毒方法有几个缺点,包括应用困难、成本高,以及一些化学消毒剂会污染环境和危害人类健康。生物防治由于其绿色、环保、低成本、可持续发展等特点,已广泛应用于各种农林业防治。因此,选择生物替代化学消毒来控制苹果的重茬病害,以达到控制病害的发生和化学消毒的效果是非常重要的。
[0004]
芽胞杆菌作为一类新的生物防治剂,其功能之一是防治植物的各种疾病。属于芽胞杆菌属的细菌被认为是安全的微生物,并具有满足农业和工业需求来合成大量有益物质的显著能力。解淀粉芽胞杆菌是一种非致病性细菌,可合成具有抵抗植物病原体活性的各种代谢物,而且大量研究发现它可诱导系统性免疫,产生具有抗性的内生孢子,在实际生产中具有广泛的应用。但目前还很少见有用于防治苹果重茬障碍的解淀粉芽胞杆菌的报道。
技术实现要素:
[0005]
针对上述现有技术,本发明从老龄苹果园健康果树根际土中分离得到一株解淀粉芽胞杆菌qsb-6,该菌株对尖孢镰孢菌、轮枝镰孢菌、层出镰孢菌和腐皮镰孢菌均具有显著的拮抗作用;对导致苹果重茬障碍的酚酸类物质具有降解效果;还能够促进重茬苹果树的生长;可有效防控和缓解苹果重茬问题。
[0006]
具体的,本发明涉及以下技术方案:
[0007]
本发明的第一方面,提供了一株解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6,该菌株已于2018年1月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),其生物保藏号为:cgmcc no.15307。
[0008]
所述解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6分离自老龄苹果园健康果树根际土壤,具有如下特征:
[0009]
在lb平板培养基上36℃培养48h,菌落表面不透明和微黄色,表面粗糙,边缘不规则。当在液体培养基中生长时经常形成褶皱和好氧细菌。革兰氏染色后细菌表现出蓝紫色,为革兰氏阳性细菌,扫描电镜下,qsb-6菌体呈杆状,两端钝圆,无鞭毛,大小为(0.6-0.8)μm
×
(1.5-2.8)μm。荧光显微镜100
×
/1.30油镜下观察,细胞呈短杆状。
[0010]
本发明的第二方面,提供解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的发酵液、菌悬液和/或上清液。
[0011]
所述发酵液具体可为如下方法制备的发酵液:将解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6接种到发酵培养基中,30℃,200r
·
min-1
摇床发酵培养24h;
[0012]
所述发酵培养基的组成为:蔗糖20.0g,酵母膏15.0g,mnso
4 1.0g,nah2po4·
2h2o 2.0g,na2hpo4·
2h2o 4.0g,蒸馏水1000ml。
[0013]
所述菌悬液具体可为如下方法制备的菌悬液:将发酵液离心后,菌体沉淀用无菌水重悬,获得菌悬液。
[0014]
所述上清液具体可为如下方法制备的上清液:将发酵液离心后,取上清,过滤,获得上清液。
[0015]
本发明的第三方面,提供上述解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6或者解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的发酵液、菌悬液和/或上清液在如下(1)-(6)至少一项中的应用:
[0016]
(1)抑制植物病原菌;
[0017]
(2)制备用于抑制植物病原菌的产品;
[0018]
(3)防治由植物病原菌所致病害;
[0019]
(4)制备用于防治由植物病原菌所致病害的产品;
[0020]
(5)降解酚酸类物质;
[0021]
(6)制备用于降解酚酸类物质的产品。
[0022]
优选的,所述植物病原菌为尖孢镰孢菌、轮枝镰孢菌、层出镰孢菌、腐皮镰孢菌、柑橘青霉病菌、葡萄炭疽病菌、玉米链格孢病菌和苹果树腐烂病菌中的一种或多种。
[0023]
优选的,所述酚酸类物质为根皮苷、苯甲酸、阿魏酸、香草酸、没食子酸、根皮素中的一种或多种。
[0024]
本发明的第四方面,提供上述解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6或者解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的发酵液、菌悬液和/或上清液在促进重茬土壤果树生长中的应用。
[0025]
本发明的第五方面,提供上述解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6或者解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的发酵液、菌悬液和/或上清液在如下(1)或(2)任一项中的应用:
[0026]
(1)减轻苹果树重茬障碍;
[0027]
(2)制备减轻苹果树重茬障碍的生防制剂或菌肥。
[0028]
本发明的第六方面,提供一种减轻苹果树重茬障碍的生防制剂,所述生防制剂以解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6或者解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的发酵液、菌悬液和/或上清液为活性成分。
[0029]
作为优选,生防制剂的剂型为可湿性粉剂、水分散剂、水悬浮剂或可分散油悬浮剂。
[0030]
作为优选,生防制剂中还包括农药学上可接受的辅料,所述农药学上可接受的辅料选自分散剂、润湿剂、崩解剂、粘结剂、消泡剂中的一种或多种。本发明对于所述农药学上可接受的辅料的来源没有特殊限制,一般采用市售产品即可。
[0031]
本发明的第七方面,提供一种含有解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的菌肥,由如下方法制备而成:
[0032]
将解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6接种到发酵培养基中,所述发酵培养基的组成为:蔗糖20.0g,酵母膏15.0g,mnso
4 1.0g,nah2po4·
2h2o 2.0g,na2hpo4·
2h2o 4.0g,蒸馏水1000ml;30℃,200r
·
min-1
摇床发酵培养24h,得到液体菌剂;
[0033]
将液体菌剂与灭菌后的载体按1ml:(8-12)g混合均匀,35-38℃静置12-24h;然后再装入密闭容器中,发酵14-16天。
[0034]
优选的,所述载体为牛粪和农作物秸秆按重量比3:1混合而成。
[0035]
本发明的第八方面,提供上述生防制剂或菌肥在如下(1)-(4)至少一项中的应用:
[0036]
(1)促进重茬苹果幼苗地上部及地下部的生长;
[0037]
(2)抑制土壤中引起苹果重茬障碍的病原菌的生长;
[0038]
(3)提高土壤中细菌含量,提高细菌/真菌的比值;
[0039]
(4)提高苹果重茬土壤中土壤脲酶、磷酸酶、蔗糖酶和过氧化氢酶的活性。
[0040]
本发明的第九方面,提供一种减轻苹果树重茬障碍的方法,包括如下步骤:
[0041]
将解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6或者解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6的发酵液、菌悬液和/或上清液施于苹果树植株的根际土壤。
[0042]
本发明的有益效果:
[0043]
本发明首次从老龄苹果园健康果树根际土中分离得到一株解淀粉芽胞杆菌(bacillus amyloliquefaciens)qsb-6,该菌株对多种病原菌有抑制作用,特别是对引起苹果重茬障碍的尖孢镰孢菌、轮枝镰孢菌、层出镰孢菌和腐皮镰孢菌具有极强的拮抗效果;该菌株对导致苹果重茬障碍的酚酸类物质具有降解效果。该菌株还能促进重茬苹果树幼苗地上部及地下部的生长;提高土壤中细菌含量,提高细菌真菌比值;提高苹果重茬土壤中土壤
脲酶、磷酸酶、蔗糖酶和过氧化氢酶的活性;在减轻苹果重茬障碍方面具有优异的效果,可用于苹果重茬障碍的防治。
附图说明
[0044]
图1:菌株qsb-6的形态;其中,a:在lb平板培养基上36℃培养48h后的菌落形态;b:扫描电镜图;c:革兰氏染色后的荧光显微镜下的形态。
[0045]
图2:菌株qsb-6与八种病原菌的对峙试验(pda培养基)。
[0046]
图3:菌株qsb-6的16s rdna序列的系统发育树。
[0047]
图4:菌株qsb-6的gyra序列的系统发育树。
[0048]
图5:菌株qsb-6的gyrb序列的系统发育树。
[0049]
图6:菌株qsb-6的rpob序列的系统发育树。
[0050]
图7:qsb-6菌株的biolog生理生化鉴定结果。
[0051]
图8:菌株qsb-6对酚酸类物质降解能力的测定(液相色谱法)。
[0052]
图9:qsb-6菌株对土壤微生物的影响。
[0053]
图10:不同处理对土壤4种镰孢菌基因拷贝数的影响。
[0054]
图11:不同处理对平邑甜茶根系呼吸速率的影响。
[0055]
图12:不同处理对平邑甜茶根系保护性酶活性的影响。
[0056]
图13:不同处理对大田土壤保护性酶活性的影响。
具体实施方式
[0057]
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
[0058]
正如背景技术部分所介绍的,由于土地资源有限,在对老果园更新时,苹果树重茬栽培无法避免,导致重茬障碍的发生具有普遍性。与正常果园相比,重茬障碍可导致苹果亩产量降低20~50%,给果园经营者带来巨大损失,严重制约了果树产业的可持续发展。
[0059]
发明人前期通过构建分析环渤海湾和西北黄土高原两大产区重茬苹果园土壤真菌克隆文库,采用相关性分析和接种验证相结合的方法,明确了引起我国苹果重茬障碍的主要有害真菌是镰孢菌属,致病性试验结果表明尖孢、串珠、腐皮和层出镰孢菌为主要病原种。
[0060]
针对我国的苹果重茬问题,本发明用稀释平板法从15年生苹果园健康果树根际土中分离得到细菌qsb-6。通过biolog微生物鉴定系统结合16s rdna、gyra基因序列分析,生化生理特征及形态学特征鉴定该细菌,并利用mega 7.0.26软件构建qsb-6菌株的进化树,将菌株鉴定为解淀粉芽胞杆菌。在马铃薯培养基上分别将解淀粉芽胞杆菌qsb-6与尖孢镰孢菌,层出镰孢菌,轮枝镰孢菌,腐皮镰孢菌,柑橘青霉病菌,葡萄炭疽病菌,玉米链格孢病菌和苹果树腐烂病菌进行对峙实验,结果显示,解淀粉芽胞杆菌qsb-6对苹果重茬镰孢病菌具有较好的抑制作用,并具有广谱抑菌特征。盆栽试验结果表明,与重茬土对照相比,qsb-6菌肥显著促进了平邑甜茶幼苗的株高和干重,分别增加1.74和5.93倍,经过qsb-6肥料处理后增加了土壤细菌的数量,抑制了土壤中有害真菌的繁殖,使用实时荧光定量pcr技术对土
壤中的四种镰孢菌基因拷贝数进行检测,发现qsb-6菌肥处理的土壤中层出镰孢菌的基因拷贝数量显著下降,说明解淀粉芽胞杆菌qsb-6可以显著抑制其生长。土壤酚酸数据表明,与空白载体t1相比,9月qsb-6菌肥处理的土壤中根皮苷、根皮素、肉桂酸、对羟基苯甲酸和苯甲酸含量降低最显著,分别降低了49.17%、41.26%、25.34%、65.89%和49.80%,高效液相色谱法测定菌株qsb-6在15d的降解率为90.20%。大田试验数据表明菌株qsb-6可以显著提高富士/m9t337的生物量和土壤酶活性。综上所述,qsb-6菌株可以在一定程度上减轻苹果重茬病害,具有良好的田间开发潜力。
[0061]
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。如果实施例中未注明的实验具体条件,通常按照常规条件,或者按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可通过商业途径获得。其中:
[0062]
酵母膏蛋白胨琼脂培养基lb:胰蛋白胨10.0g,酵母提取物5.0g,nacl 10.0g,琼脂15.0g,ph 7。
[0063]
发酵培养基:蔗糖20.0g,酵母膏15.0g,mnso
4 1.0g,nah2po4·
2h2o 2.0g,na2hpo4·
2h2o 4.0g,蒸馏水1000ml。
[0064]
改良pda培养基:马铃薯200.0g,牛肉膏5.0g,葡萄糖20.0g,琼脂20.0g,蒸馏水1000ml。
[0065]
需氧性测定培养基、葡萄糖氧化发酵培养基、淀粉水解培养基、硝酸盐还原培养基、v-p培养基、m.r.培养基,均按《常见细菌系统鉴定手册》(东秀珠,蔡妙英编著)的方法配制。
[0066]
无机盐培养基:nh4cl 0.5g/l,nacl 1.0g/l,k2hpo4·
3h2o 1.3g/l,mgso4·
7h2o 0.4g/l。
[0067]
实施例1:菌株的分离和鉴定
[0068]
1.菌株的分离纯化:
[0069]
采用改良的稀释涂布平板法分离根际细菌。新鲜土样过直径3~4mm的筛子,去除土壤中的杂质。称取5g根际土壤,加入盛有45ml无菌水的三角瓶中(带玻璃珠),180rpm振荡30min,静置5min后,用无菌水系列稀释至1
×
10-4
,将梯度稀释的上清液取100μl涂布于lb平板上,重复三次,于28℃恒温培养箱中倒置培养。待平板内长出单菌落后,挑取不同形态的单菌落于新的lb平板上划线纯化。同时,将纯化的菌株接种于液体lb培养基中,在28℃下以180rpm恒定振荡12h,4℃下以10000r离心10min后倒掉上清液加入15%的甘油,-80℃储存。
[0070]
2.菌株的筛选及其抑菌作用:
[0071]
采用平板对峙法测定分离出的菌株对四种镰孢菌(尖孢镰孢菌、轮枝镰孢菌、层出镰孢菌和腐皮镰孢菌)的拮抗作用,即先将细菌划线接种于lb平板上,挑取单菌落接种于发酵培养基中(250ml锥形瓶中装100ml),在28℃下以180rpm恒定振荡培养48h,然后以10000r离心20min获得细菌菌体,将细菌重新悬浮于pbs缓冲液(ph 7.0,1/25体积,10mmol
·
l-1
))中,调节浓度至1
×
109cfu
·
ml-1
。在pda平板中央接种一块直径5mm的镰孢菌菌饼,然后将4个无菌滤纸片(直径6mm)等距离置于菌饼四周,每个滤纸片滴10μl细菌悬浮液,用无菌蒸馏水(sdw)作为对照,试验重复三次。所有平板在28℃下孵育7天,测量抑菌带的宽度并计算抑菌率。计算公式为:抑制率=(对照菌落半径-处理菌落半径)/对照菌落半径
×
100%。
pcr buffer 5μl,taq dna聚合酶0.6μl,ddh2o 38.4μl(weisburg et al.,1991)。pcr扩增反应程序:94℃预变性4min;94℃变性1.5min;55℃退火1min;72℃延伸1.5min;共30个循环,总延伸72℃,10min,4℃保温。
[0084]
gyra基因扩增选用引物42f:5
’-
cagtcaggaaatgcgtacgtcctt-3
’
和1066r:5
’-
caaggtaatgctccaggcattgct-3
’
。pcr反应体系(30μl):taq pcr master mix15μl,ddh2o 12μl,引物各1μl,dna模板1μl。pcr反应体系:95℃预变性5min;94℃变性1min;62℃退火1min;72℃延伸2min;共30个循环,总延伸72℃,10min,4℃保温。
[0085]
gyrb基因扩增选用引物up1f:gaagtcatcatgaccgttctgcaygcnggnggnaarttyga和up2r:agcagggtacggatgtgcgagccrtcnacrtcngcrtcngtcat。pcr反应体系(30μl):taq pcr master mix 15μl,ddh2o 12μl,引物各1μl,dna模板1μl。pcr扩增反应程序:94℃预变性5min;94℃变性30s;60℃退火30s;72℃延伸1min;共30个循环,总延伸72℃,10min,4℃保温。
[0086]
rpob基因扩增选用引物2292f:aggtcaactagttcagtatggac和3354r:aagaaccgtaaccggcaactt。pcr反应体系(50μl):5
×
primestar buffer(mg
2+
plus)10μl,dntp mixture(2.5mm each)4μl,primestar hs dna polymerase(2.5u/ul)0.5μl,ddh2o 31.5μl,引物各1μl,dna模板2μl。pcr扩增反应程序:95℃预变性5min;95℃变性15s;56℃退火30s;72℃延伸30s;共30个循环,总延伸72℃,10min,4℃保温。
[0087]
将测序结果提交美国国立生物技术信息中心(ncbi)的genbank,通过blast程序进行同源性比对,并利用mega 7.0.26软件构建系统发育树,自展值(bootstrap value)1000次重复检验。
[0088]
qsb-6菌株16s rdna基因序列长度为1452bp,其16s rdna序列如seq id no.1所示。将此序列在nbci的genbank数据库中进行blast比对,结果表明qsb-6菌株的16s rdna基因序列与解淀粉芽胞杆菌b.amyloliquefaciens(ky685066.1)的相似性为99%。结合mega 7.0.26,利用16s rdna、gyra、gyrb和rpob基因序列构建系统进化树(图3、图4、图5和图6),结果表明,菌株qsb-6的16s rdna基因序列和解淀粉芽胞杆菌b.amyloliquefaciens(mh188056.1)16s rdna基因序列属于进化树内同一分支上,同源性最高(100%);菌株qsb-6的gyra基因序列和解淀粉芽胞杆菌b.amyloliquefaciens(kf803276.1)gyra基因序列属于进化树内同一分支上,同源性最高(100%);菌株qsb-6的gyrb基因序列和解淀粉芽胞杆菌b.amyloliquefaciens(ab972386.1)gyrb基因序列属于进化树内同一分支上,同源性最(100%);菌株qsb-6的rpob基因序列和解淀粉芽胞杆菌b.amyloliquefaciens(kf803276.1)rpob基因序列属于进化树内同一分支上,同源性最(100%)。结合以上分析表明qsb-6菌株为解淀粉芽胞杆菌b.amyloliquefaciens。
[0089]
3.3biolog微生物自动分析系统:
[0090]
biolog gen iii系统是一种通过检测细菌利用微孔板上95种碳源进行有氧代谢活动产生的氧化还原产物与显色物质结合而导致吸光度变化以及由于微生物自身生长造成的浊度差异,生成特征指纹图谱,与标准菌株图谱数据库进行比对鉴定菌株。当细菌培养16~24h时,sim值≥0.50,系统自动给出鉴定结果,sim值越接近1.00,鉴定结果越准确。
[0091]
biolog微生物鉴定系统通过细菌对不同碳源的利用进行菌株鉴定。基于碳利用分析菌株的biolog微生物鉴定系统方法,prob值为0.522,sim值为0.522,dist值为7.148,表
明识别结果是比较可靠的匹配结果。图7鉴定结果确定菌株qsb-6为解淀粉芽胞杆菌。
[0092]
综上,将分离得到的菌株qsb-6鉴定为解淀粉芽胞杆菌(bacillus amyloliquefaciens)。并于2018年1月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号:cgmcc no.15307。
[0093]
实施例2:菌株qsb-6的广谱抑菌效果
[0094]
为了进一步验证qsb-6菌株是否对植物源性疾病具有广谱抑菌作用,选择另外4种常见病原真菌进一步进行抗菌试验。结果如表2所示。
[0095]
对峙试验结果表明,qsb-6菌株对4种病原镰孢菌菌丝的生长有极强的抑制作用。对柑橘青霉病菌、葡萄炭疽病菌,玉米链格孢病菌和苹果树腐烂病菌也均有很强的抑制作用。因此,菌株qsb-6在体外培养皿试验条件下对植物病原菌具有广谱抑菌作用。
[0096]
表2:菌株qsb-6对8种病原菌的抑制效果
[0097][0098]
注:
–
,没有抑菌圈;+,抑菌圈<5mm,抑制作用较弱,菌丝在细菌边缘处停止生长;++,中度抑制,抑菌圈5~10mm;+++,抑制作用较强,抑菌圈>10mm。不同小写字母表示在0.05水平差异显著(duncan
’
s检测)。
[0099]
实施例3:菌株qsb-6发酵条件的优选
[0100]
1.试验方法:
[0101]
将保存菌种转接至lb固体培养基上,37℃培养至24h。挑取已活化的单菌落接种到含50ml lb液体培养基的三角瓶中,160r
·
min-1
、37℃摇床振荡培养至od600=1左右时待用。种子液按2%的接种量接至含培养基的三角瓶中;在200r
·
min-1
、37℃摇床中培养24h。
[0102]
进行单因素试验的发酵培养研究。
[0103]
1.1碳源:分别用20g
·
l-1
的蔗糖、麦芽糖、葡萄糖、乳糖和可溶性淀粉等量取代基础培养液的碳源。在筛选不同浓度0.1%、0.5%、1%、1.5%和2%,使用摇瓶发酵培养,24h后通过测定发酵液的活菌数来确定最佳碳源。
[0104]
1.2.氮源:依次用20g
·
l-1
的酵母膏、蛋白胨、硫酸铵、牛肉膏、硝酸铵、尿素和氯化铵替代基础发酵液的氮源。在筛选不同浓度0.1%、0.5%、1%、1.5%和2%,使用摇瓶发酵培养,24h后通过测定发酵液的活菌数来确定最佳氮源。
[0105]
1.3无机盐:依次用0.5g
·
l-1
的nacl、cacl2·
2h2o、mgso4·
7h2o、硫酸锰和kcl等量替代基础发酵液的无机盐。在筛选不同浓度0.01%、0.03%、0.05%、0.07%和0.09%采用摇瓶发酵培养,24h后通过测定发酵液的活菌数来确定最佳无机盐种类。每个处理3次重复。
[0106]
1.4培养条件优化设计:
[0107]
使用筛选出的最佳培养基配方,先固定摇瓶培养的其他发酵条件,对初始ph、装液
量、温度、接菌量、发酵时间等发酵条件进行优化。初始ph值依次调为5.5、6.0、6.5、7.0、7.5、8.5和9.5;接种量分别调为装液量的2%、3%、4%、5%、6%、7%、8%、9%和10%;在250m l三角瓶中分别装入25ml、50ml、75ml、100ml、125ml和150ml发酵培养液;发酵时间分别设为12h、24h、48h和60h;温度分别设为25℃、30℃、35℃、37℃、40℃和50℃;转速分别设为100r
·
min-1
、150r
·
min-1
、200r
·
min-1
、220r
·
min-1
和250r
·
min-1
。每处理3次重复。
[0108]
1.5测定方法:以空白培养基为对照,菌体发酵液的测定采用比浊法,即发酵液10~15ml在2 000r
·
min-1下离心2min,测定菌液的od600值(溶液在600nm波长处的吸光值),ph计测定菌液ph。
[0109]
2.实验结果:
[0110]
分别对不同条件进行筛选,其他组分均相同进行发酵。通过试验可知,菌株qsb-6生长的最佳碳源是蔗糖(浓度20g
·
l-1
),最佳氮源是酵母膏(浓度15g
·
l-1
),最佳无机盐是硫酸锰(浓度1g
·
l-1
),ph 7.5,最适接种量5%,装液量100ml,发酵时间24h,温度30℃,转速200r
·
min-1
。
[0111]
实施例4:菌株qsb-6对酚酸类物质的降解效果
[0112]
1.试验方法:
[0113]
1.1根皮苷培养基(0~10mmol/l)的制备(根皮苷购于上海源叶生物科技有限公司,避光保存):称取一定量的根皮苷,放入烧杯中,加入10倍比例的无水乙醇使之溶解;加入适量的去离子水并加热至沸腾,以使乙醇全部挥发;按比例称取氯化铵、氯化钠、磷酸氢二钾和硫酸镁加入根皮苷溶液中溶解;分出一部分按照2%的比例加入琼脂粉作为根皮苷固体培养基,操作尽可能快速,过程避光。
[0114]
1.2高效液相色谱法测定降解率
[0115]
1.2.1高压液相样品准备:取摇床培养3d、5d和15d后培养液50ml,9000r/min离心10min,去除菌体,取等量二氯甲烷反复萃取3次,有机层合并,以备用来平行化学定量浓缩使用。
[0116]
高效液相色谱法降解率计算方法:降解率=(未接菌培养液的自毒物质含量-接菌培养液自毒物质含量)/未接菌培养液的自毒物质含量
×
100%。
[0117]
1.2.2萃取液浓缩:平行化学定量浓缩蒸干,在24个浓缩工位上,最终达到真空度63mbar,水浴温度60℃,用2ml甲醇分3次溶解。然后用0.22μm有机滤器过滤,装于2ml离心管中备用。
[0118]
1.2.3液相色谱条件:流动相a:乙腈,流动相b:水(用乙酸调节ph 2.6),色谱柱:acclaim 120c18(3μm
×
150mm
×
3mm),柱温30℃,流速0.5ml/min。
[0119]
进样方式及进样体积:自动进样10μl;检测波长280nm。
[0120]
2.试验结果:
[0121]
2.1高效液相色谱法(hplc)测定菌株降解率
[0122]
如图8所示,通过对菌株qsb-6摇床培养后3、5和15d培养液进行高效液相色谱分析得出,随着培养时间的增加,根皮苷、苯甲酸、阿魏酸、香草酸、没食子酸、根皮素含量降低,其中根皮苷3、5、15d的降解率分别为42.89%、62.49%和90.20%,水杨酸含量先升高后降低,在第五天降解率达到44.91%。已报道的根皮苷、水杨酸和苯甲酸可被降解为对羟基苯甲酸,苯甲酸、阿魏酸和对羟基苯甲酸可被降解为表儿茶素,进而降解为儿茶素,导致试验
结果儿茶素和对羟基苯甲酸含量升高。
[0123]
实施例5:盆栽试验
[0124]
1.试验设计:
[0125]
在山东农业大学园艺科学与工程学院国家苹果工程实验中心和农作物生物学国家重点实验室进行盆栽试验。盆栽试验供试植株为平邑甜茶(malus hupeheusis rehd.)幼苗。
[0126]
2017年3月,将幼苗移栽到苗圃中,当幼苗长到第三真叶时,选取具有相同生长势的幼苗移栽到上口径38cm,下口径28cm,高26cm的泥瓦盆中进行盆栽试验。每盆装约7.543kg土壤,每盆3株平邑甜茶幼苗,每个处理设置20盆重复。当幼苗长到20-30cm时,每盆留两株长势相似的幼苗。盆栽土壤分为以下处理:老果园土壤(ck1),老果园土壤溴甲烷熏蒸(ck2),菌肥载体处理(t1),解淀粉芽胞杆菌qsb-6菌肥处理(t2);各处理组统一正常水肥管理,解淀粉芽胞杆菌qsb-6的细菌肥料和菌肥载体按照土壤质量的1%进行施用。
[0127]
盆栽试验所用解淀粉芽胞杆菌qsb-6菌肥,由中国德州创迪微生物资源有限公司负责制作,制作方法为:先将qsb-6菌株进行液体发酵(发酵培养基:蔗糖20.0g,酵母膏15.0g,mnso
4 1.0g,nah2po4·
2h2o 2.0g,na2hpo4·
2h2o 4.0g,蒸馏水1000ml)得到液体菌剂;然后将液体菌剂与灭菌的菌肥载体按1ml:10g混合均匀,使液体菌剂与载体的混合物充分潮湿(45%的湿度最好),以手握不留水印为宜;搅拌均匀后放在遮阳处盖上塑料布静置24小时,温度保持在35-38℃最佳;24小时后,再把液体菌剂与载体的混合物装入密封容器内,发酵15天后即可使用。
[0128]
所制备的解淀粉芽胞杆菌qsb-6菌肥中,活菌数为2
×
108cfu/g。
[0129]
菌肥载体具体为牛粪和玉米秸秆的混合物(牛粪:秸秆=1:3,重量比),由中国德州创迪微生物资源有限公司提供。
[0130]
于2017年8月15日进行取样,每个处理随机选择三盆长势一致的幼苗,去除表层及盆周围土壤,用直径2mm的筛过滤土壤杂质,并将土壤样品装于无菌塑料密封袋中,带回放于-80℃,以提取土壤dna用于进一步的实时荧光定量pcr分析,对土壤中的镰孢菌基因拷贝数进行检测,验证菌株qsb-6在土壤中对镰孢菌的抑制效果。幼苗洗涤干净并运回实验室进行生物量等指标的测定。
[0131]
2.测定指标:
[0132]
用卷尺、游标卡尺和电子秤分别测定幼苗株高、地径和干鲜重。
[0133]
用专业版win rhizo(2007年版)根系分析系统分析处理样品图像,记录根系总长度、根系表面积、分叉数和根尖数。
[0134]
土壤微生物的测定:土壤中细菌、真菌、放线菌的数量均采用平板稀释涂布法测定。细菌采用酵母膏蛋白胨培养基,真菌采用马铃薯葡萄糖培养基,放线菌采用高氏一号培养基。
[0135]
呼吸速率的测定:参照毛志泉等和bouma的方法进行测定。取直径基本一致的未变色白色根系,迅速称取0.05g左右,用双面刀将根切成2mm左右根段,放入反应杯,加盖并启动测量程序。反应杯中液体温度用恒温浴控制在25℃。仪器采用英国hansatech公司生产的液相oxy-lab氧电极。
[0136]
保护酶的提取。取新鲜白根1.0g,加入8ml磷酸缓冲溶液,加入少量石英砂研磨成
匀浆,4℃12000rpm/min离心20min,上清液为需要测定的酶液,所有测定在2-4℃条件下进行(赵世杰等,2002)。
[0137]
超氧化物歧化酶(sod)、过氧化物酶(pod)、过氧化氢酶(cat)活性的测定均参照赵世杰等(2002)的方法。
[0138]
mda含量的测定采用硫代巴比妥酸法,以mmol/g fw表示(赵世杰,2002)。
[0139]
取0.5g过筛的新鲜土壤,按土壤dna提取试剂盒操作步骤提取dna,采用cfx96tmthermal cycler(bio-rad)对土壤中尖孢镰孢菌的基因拷贝数进行实时荧光定量分析,验证qsb-6菌株在土壤中对尖孢镰孢菌抑制效果,特异性引物及反应步骤参考李家家的方法(李家家,相立,潘凤兵,陈学森,沈向,尹承苗,毛志泉.2016.平邑甜茶幼苗与葱混作对苹果连作土壤环境的影响.园艺学报,43(10):1853
–
1862.)。
[0140]
土壤酚酸类物质的测定:准确称取过12目筛的各处理风干土壤80g,加入适量石英砂,于大研钵中混合均匀,每处理重复3次。在100ml萃取池底部垫上1片纤维素膜,装入混合均匀的样品,按ase萃取条件萃取,即:在ase的两个萃取瓶中分别加入分析纯无水甲醇和无水乙醇,设置仪器萃取温度120℃,压强10.3mpa,静态萃取5min,吹扫体积60%,吹扫时间90s,如此循环次数2次。萃取结束后,萃取液在45℃减压旋转蒸发近干,加入3ml甲醇复溶,过0.22μm有机相滤膜,待hplc分析测定,具体方法参照尹承苗(2014)。
[0141]
3.qsb-6菌株对平邑甜茶幼苗的促进生长作用(表3):
[0142]
表3:qsb-6菌株对平邑甜茶幼苗生物量的影响
[0143][0144]
注:不同小写字母表示在0.05水平差异显著(duncan
’
s检测)。
[0145]
由表3可以看出,溴甲烷灭菌、菌肥载体处理和细菌肥料处理均可提高平邑甜茶幼苗的生物量。表现为ck2>t2>t1>ck1,t2处理的平邑甜茶幼苗株高,地上直径,地上重新重量,地下鲜重,地上干重和地下干重分别为t1的1.5倍1.32倍、1.56倍、1.53倍、2.21倍和2.27倍。可见qsb-6菌株的处理可显著促进平邑甜茶幼苗的生长。效果略低于溴甲烷灭菌处理。
[0146]
4.qsb-6菌株对土壤可培养微生物的影响:
[0147]
从图9可以看出,7、8、9月份t2处理后土壤中细菌含量与ck1相比显著增加,分别是对照的2.22倍、3.21倍和4.62倍;土壤真菌的总含量在不同处理中表现出不同的表现,九月份表现最显著,ck2和t2与ck1相比分别降低了75.36%和85.51%;t1处理九月份相比七月
份显著增加了40.43%。从土壤放线菌的数量可以看出,t2>t1>ck2>ck1,都显著高于对照。其中,t2处理显著增加了土壤细菌/真菌的比值,表现为t2>ck2>t1>ck1。
[0148]
5.qsb-6菌株对四种镰孢菌的抑制效果:
[0149]
从图10可以看出,与连作土壤相比,七月和八月溴甲烷熏蒸和qsb-6菌肥处理后尖孢镰孢菌的基因拷贝数显著降低,分别下降了67.12%和68.78%、33.96%和60.02%,层出镰孢菌的基因拷贝数也显著降低,分别下降了72.82%和77.58%、67.36%和72.00%。与qsb-6菌肥相比,七月和八月菌肥载体处理后腐皮镰孢菌基因拷贝数分别增加了31.33%和34.02%,轮枝镰孢菌基因拷贝数分别增加了11.59%和36.64%。结果表明,在土壤中解淀粉芽胞杆菌qsb-6对镰孢病菌具有良好的抑制作用。
[0150]
6.qsb-6菌株对根系形态的影响:
[0151]
如表4所示,菌株qsb-6处理(t1)后根系总长度、根系表面积、根系总体积、根尖数和分叉数分别是老果园土壤处理(ck1)的3.71倍、6.13倍、10.28倍、2.45倍和6.19倍,但效果仍不及溴甲烷熏蒸处理(ck2);与菌肥载体处理(t2)相比,菌株qsb-6处理后根系总长度、根系表面积、根系总体积、根尖数和分叉数分别增加了36.99%、103.44%、201.11%、3.11%和92.11%,可见,施加qsb-6菌肥可显著促进平邑甜茶幼苗根系的生长。
[0152]
表4:qsb-6菌肥对平邑甜茶幼苗根系生长的影响
[0153][0154]
注:不同小写字母表示在0.05水平差异显著(duncan
’
s检测)。
[0155]
7.qsb-6菌株对根系呼吸速率的影响:
[0156]
如图11所示,测定期(7、8、9月份)内各处理平邑甜茶幼苗根系呼吸速率总体呈上升趋势,经qsb-6菌肥处理后呼吸速率上升趋势明显强于对照,接近溴甲烷熏蒸处理。在九月份时ck2、t2为1114.38μmolo2·
g-1fw
·
min-1
和1000.81μmolo2·
g-1fw
·
min-1
,均显著高于对照,而t1仅为对照的9.10%。
[0157]
8.qsb-6菌株对根系保护性酶活性的影响:
[0158]
如图12所示,与对照相比,不同处理7、8、9月sod、pod和cat活性均稳定增加,其中以ck1和qsb-6菌肥处理增加最显著,7、8、9月t2处理sod活性是对照处理的2.06倍、3.53倍和3.22倍;pod活性是对照的1.56倍、1.82倍和2.36倍;cat活性是对照的1.44倍、1.85倍和2.24倍;mda活性表现与上述呈相反趋势,与对照和菌肥载体空白相比较,ck1和qsb-6菌肥处理7、8、9月呈现下降趋势,与对照相比,7、8、9月qsb-6菌肥处理分别下降了0.31%、0.45%和0.60%,下降比例呈现增加趋势。
[0159]
9.qsb-6菌株对土壤酚酸类物质的影响:
[0160]
由表5可以看出,7、8、9月对照ck1的几种主要酚酸类物质含量是最高的,溴甲烷熏
蒸处理酚酸总量最低,7、8、9月各酚酸含量变化不明显,qsb-6菌肥和空白载体处理可降低土壤中酚酸类物质的含量,以t2处理降低最显著。与t1相比,7月qsb-6菌肥处理的土壤中根皮素、根皮苷、肉桂酸、对羟基苯甲酸和苯甲酸含量分别降低了32.00%、36.26%、17.95%、57.24%和35.21%;8月qsb-6菌肥处理的土壤中根皮苷、根皮素、肉桂酸、对羟基苯甲酸和苯甲酸含量分别降低了40.20%、35.35%、25.46%、61.69%和49.19%;9月qsb-6菌肥处理的土壤中根皮苷、根皮素、肉桂酸、对羟基苯甲酸和苯甲酸含量分别降低了49.17%、41.26%、25.34%、65.89%和49.80%。
[0161]
表5:qsb-6菌肥处理对土壤酚酸类物质的影响
[0162][0163][0164]
注:表中不同小写字母表示不同处理间的差异显著(p<0.05)。
[0165]
实施例6:大田试验
[0166]
1、试验材料
[0167]
试验用苹果苗木为2年生嫁接苗,砧穗组合为烟富3号/m9t337,购自莱州大自然园艺科技有限公司。栽植株行距为1.5m
×
4m。qsb-6菌肥制作同实施例5。
[0168]
2、试验设计
[0169]
各试验地均设置4个处理,分别为:
①
连作土对照,ck1。
②
溴甲烷熏蒸处理,ck2。
③
qsb-6菌肥处理,t1。
④
菌肥载体处理,t2。
[0170]
2017年3月20-23日进行处理,按株行距挖80cm见方的栽植穴,分别将菌肥载体和qsb-6菌肥与土拌匀后回填,栽植时挖一小坑栽植苗木,将苗木根系舒展,扶正,填土至苗木原栽植深度,踏实,浇透水。幼树每棵施用量控制在200g,在萌芽期可进行追施一次,追施量为200g;每个处理15株树。
[0171]
3、取样方法
[0172]
土样采集。采用棋盘式五点取样,分别在距苹果树30cm左右取根区土,将所取土样混匀后带回实验室。
[0173]
4、测定指标
[0174]
树体指标测定:株高,使用植物株高测量尺测定;地径,采用游标卡尺测量树体离地面20cm处的直径;新梢生长量,每处理选择3株树,每株树选择3个粗度相近的枝条使用软米尺测量长度;百叶重,每处理树种随机抽取5株树,每株树随机采集20片正常叶,共100片称百叶重。
[0175]
土壤酶的提取及活性测定:土壤脲酶、蔗糖酶、磷酸酶、过氧化氢酶的测定采用微量法。
[0176]
5、qsb-6菌肥处理对大田连作富士/m9t337树体生长指标的影响
[0177]
从表6可以看出,各试验点qsb-6菌肥处理均能促进连作条件下富士/m9t337的生长。连作对照的当年生新梢48-65cm,百叶重112-143g。溴甲烷处理的长势最好,株高最高,地径最大,树体健壮,当年生新梢长度74-97cm,百叶重138-150g。大沙岭、凤毛寨和湾头村均以t1处理的效果最好,株高分别比连作对照增加26.40%、15.90%和1.85%,地径增加12.13%、29.11%和9.98%,新梢生长量增加21.25%、31.01%和39.92%,百叶重增加5.56%、8.54%和1.90%。
[0178]
表6:不同处理对大田连作富士/m9t337树体生长的影响
[0179][0180]
6、qsb-6菌肥处理对大田连作富士/m9t337土壤酶活性的影响
[0181]
如图13所示,与对照相比,大沙岭、凤毛寨和湾头村均以t1处理的效果最好,其中大沙岭地区,土壤脲酶、磷酸酶、蔗糖酶和过氧化氢酶分别提高了86.15%、100.02%、194.22%和89.88%,凤毛寨地区分别提高了74.17%、95.99%、284.02%和84.74%,湾头村分别提高了54.93%、83.76%、278.99%和73.14%。空白菌肥载体也提高了土壤酶活性,
效果次于qsb-6菌肥处理。
[0182]
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



