一种嵌合抗原受体及其应用的制作方法
 2021-02-02 03:02:06|
2021-02-02 03:02:06| 274|
274| 起点商标网
起点商标网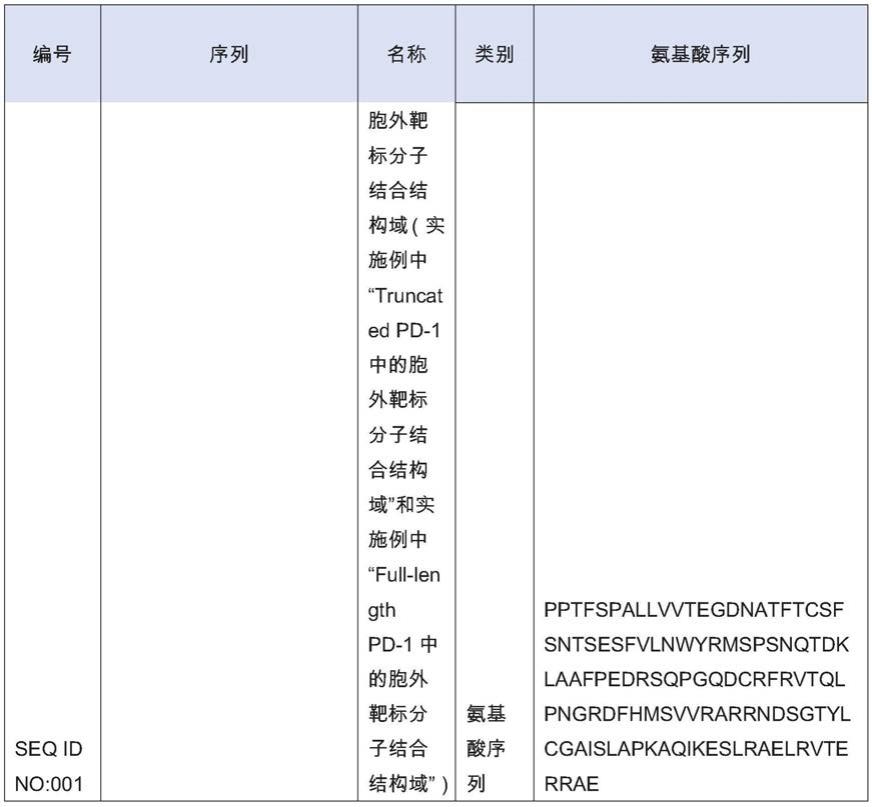
[0001]
本申请涉及一种嵌合抗原受体,属于生物医药领域。
背景技术:
[0002]
癌症是全球最主要公共健康卫生负担之一,其在全球每6个死亡例数中约占1例,且大多数癌症类型尤其是生 存率低的恶性肿瘤频发于年长人群(world health organization,who report on cancer,2020)。例如,在美国,癌 症是2019年死亡的第二大原因,仅次于心脏病,由于许多不同的原因导致了超过一百种类型的癌症,并且确诊的 癌症患者中55岁以上人群占比高达80%(siegel rl等,ca:a cancer journal for clinicians.2020jan;70(1):7-30.)。在 中国,随着中国人口老龄化加剧、工业城镇化加快以及不健康生活方式广泛流行等所引发的更多公共健康问题出现, 癌症已经成为危害中国居民公众健康的主要疾病之一(曹毛毛等,中国肿瘤临床,2019,46,145-149;bray f等, ca:a cancer journal for clinicians.2018nov;68(6):394-424.)。由此可见,如何克服癌症的低生存率已成为现阶段人类 社会对癌症防控的重点内容。
[0003]
癌症非常致命的原因之一是因为癌细胞生长和分裂非常迅速,在癌症晚期变为恶性肿瘤,癌细胞的恶性增殖得 不到有效控制会导致患者的死亡。此外,癌细胞可以通过血流循环系统或淋巴系统突破正常组织的边界从而侵入邻 近组织甚至扩散到身体各个部分,这个过程被称为癌症转移与扩散,而该过程进一步降低了治疗和根除肿瘤细胞的 几率(gupta gp等,cell.2006nov 17;127(4):679-95.)。此外,实体肿瘤与血液癌症不同,其具有复杂的肿瘤微环 境与高度的肿瘤异质性等特点,进一步增加了治疗实体瘤的难度。
[0004]
虽然免疫系统不断地保护人们免受各种疾病的侵害,但是有些时候它无法提供我们身体所需的保护,比如当免 疫系统与癌症作斗争时。目前已知的一个主要原因是肿瘤可以逃避免疫系统的监视以实现提高其存活率的目的—— 即肿瘤免疫逃逸,通过干扰人体免疫细胞的抗癌免疫反应来抑制免疫系统的相关功能,例如利用肿瘤微环境中某些 免疫检查点信号通路抑制和关闭针对肿瘤细胞的免疫细胞功能,尤其是t淋巴细胞功能,导致肿瘤细胞产生对免疫 识别和杀伤的抗性,进而使t淋巴细胞不再能正常发挥作用(pardoll dm,nature reviews cancer.2012 apr;12(4):252-64.;pardoll dm,nature immunology.2012dec;13(12):1129-32.)。另一方面,从基础免疫学研究的角 度来看,人们开始发现t淋巴细胞——作为适应性免疫系统的主要组成之一,在适应性免疫反应中发挥的重要作用 以及t细胞的功能和行为如何被系统性地调控。通过共刺激和共抑制受体调节的t细胞受体信号传导控制t细胞命 运决定,例如激活、增殖、分化、效能与存活等(smith-garvin je等,annual review of immunology.2009apr23;27:591-619.)。故而人们越来越迫切地意识到去更好地利用免疫系统的强大去对抗疾病的重要性。近些年间,随 着现代科学对癌症和免疫系统越来越深入的理解与认识,作为引领着全球生物医药行业的风向标之一的癌症免疫疗 法发展迅猛,并取得突破性进展,为下一代癌症免疫治疗开辟了一条新途径。癌症免疫疗法,使患者自身免疫系统 重新获得对抗癌症的能力,同免疫系统对抗致
病病毒或细菌的方式有一定相似性。这样的治疗方式可以调动病人自 身免疫系统的能力,并且提高疗法的持久性。当然,不同的癌症免疫疗法作用在患者免疫系统上的方式不同。比如, 某些疗法会促进并增强针对癌症的免疫反应,而某些疗法则可让免疫系统更佳地识别、靶向针对并杀伤癌细胞。
[0005]
最具革命性的癌症免疫疗法之一是免疫检查点调节剂,尤其是免疫检查点抑制剂。人体免疫系统需要许多的制 衡机制,从而实现保护自身免于病原体侵袭的同时又避免出现攻击自身正常细胞的情况。为此,免疫系统采用称为
ꢀ“
免疫检查点”(如pd-1)的蛋白质去抑制免疫反应。意外的是,多年研究表明某些肿瘤会大量表达免疫检查点相 关信号分子配体(如pd-l1)去抑制甚至阻止免疫反应,从而免于受到免疫系统的攻击,就好像肿瘤细胞对免疫系 统踩下了刹车一样,达到免疫逃逸的目的。已发现的免疫检查点抑制剂中,尤以靶向免疫检查点pd-1及其配体pd-l1 的抑制剂最为有代表性与治疗前景,该类抑制剂可以靶向肿瘤分子标记物pd-l1及其受体pd-1,阻断肿瘤细胞对 于免疫细胞的抑制,如同松开了肿瘤细胞对免疫系统踩下的刹车,使得免疫系统重新识别并杀伤相应的肿瘤。2014 年,fda提前批准了史上首个肿瘤免疫药物——默沙东的pd-1单抗抑制剂keytruda。2016年公开的长期数据显示, keytruda显著提高了晚期黑色素瘤患者的存活时间:40%接受治疗患者(共计655人)存活时间超过3年,与之鲜 明对比的是免疫疗法问世之前的治疗方式仅能让患者存活几个月。现年95岁高龄的美国前总统吉米
·
卡特便是该 药物的长期使用者。2017年5月,keytruda再次获得了fda的快速批准,成为首例fda批准的基于肿瘤生物标志 物而不区分肿瘤来源的抗癌药物,堪称针对多种类型实体瘤的广谱抗癌药。2018年末及2019年上半年,中国药企 君实生物、信达生物与恒瑞医药的国产pd-1抗体药也先后获批上市。
[0006]
另一个极有前景的癌症免疫疗法是细胞疗法,尤其是嵌合抗原受体(chimeric antigen receptor,car)t细胞 疗法,即car-t细胞疗法,通过基因工程与合成生物学手段对t细胞进行改造从而实现对特定肿瘤细胞的识别与 杀伤。该类疗法的成功问世具有里程碑意义,代表了新的癌症治疗范式的转变,大大增加了人类治疗肿瘤的选择与 把握。近些年间,car-t细胞疗法于血液癌症(包括淋巴瘤和淋巴细胞白血病)的临床治疗上取得了不错的成绩, 尤其以靶向cd19的car-t细胞疗法最为成功。目前,car分子的组成主要包括:来自抗原特异性的单链抗体片 段的胞外抗原识别区域,来自igg家族蛋白等分子铰链片段的抗原识别区域与跨膜区域之间的间隔区域,来自cd28 或cd8等分子跨膜片段的跨膜区域,胞内共刺激信号区域以及胞内激活信号区域。基于上述设计的car分子可以 使被改造的t细胞实现不依赖于经典hla方式识别特定肿瘤细胞并激活其胞内t细胞信号的功能。2017年获得fda 全票批准上市的诺华car-t细胞疗法kymriah,是人类史上首个得到fda批准的基因疗法,用于治疗b细胞前体 急性淋巴性白血病。2017年公布的数据表明接受该疗法的患者可以达到高达83%的整体缓解率,这样的疗效是史无 前例的。
[0007]
尽管car-t细胞疗法在血液癌症治疗上取得了令人振奋的成绩,但是在实体瘤治疗中car-t细胞疗法面临着 诸多挑战,比如实体肿瘤具有复杂的免疫抑制性肿瘤微环境以及高度的肿瘤异质性等等,仍有待进一步探索与研究。 故而,在面对治疗癌症及感染、炎症疾病、免疫疾病、神经系统疾病等疾病的新方法和新组合物存在长期的持续性 需求。
[0008]
另外已知,免疫抑制性信号高度参与到感染、炎症疾病、免疫疾病、神经系统疾病
等疾病,所以本申请的发明 基于免疫抑制性信号改造的细胞疗法同样适用于感染、炎症疾病、免疫疾病、神经系统疾病等疾病的治疗。
[0009]
本申请公开的方法和组合物通过在治疗各种癌症、感染、炎症疾病、免疫疾病、神经系统疾病等疾病中实现通 过强化机体清除相应疾病病灶等,尤其是面对实体肿瘤时实现更有效地杀伤清除实体肿瘤细胞,来满足这些需求。
技术实现要素:
[0010]
根据本申请的一个方面,提供了一种嵌合抗原受体,该技术结合肿瘤免疫学、合成生物学、分子工程与细胞工 程等多种手段,建立调控免疫细胞功能的人工分子机器,兼具免疫检查点抑制剂与car-t细胞疗法两者优势,为 克服肿瘤微环境的免疫抑制和改善实体肿瘤治疗提供解决方案。
[0011]
所述嵌合抗原受体,包括:
[0012]
a)胞外靶标分子结合结构域,用于特异性结合靶标分子;
[0013]
b)胞内信号传导结构域,包括至少一个胞内激活信号结构域;胞内激活信号结构域的激活至少依赖于所述胞 外靶标分子结合结构域与所述靶标分子的结合;所述胞内激活信号结构域含有具有催化功能基团的分子;和
[0014]
c)跨膜区结构域,用于连接所述胞外靶标分子结合结构域和所述胞内信号传导结构域,并将二者固定在细胞 膜上。
[0015]
可选地,所述胞内激活信号结构域包括受体型络氨酸激酶、非受体型酪氨酸激酶、受体型络氨酸激酶片段、非 受体型络氨酸激酶片段中的至少一种。
[0016]
可选地,所述络氨酸激酶选自包含syk、zap70、abl1、arg、ack1、tnk1、csk、matk、fak、pyk2、 fes、fer、frk、brk、srms、jak1、jak2、jak3、tyk2、src、fgr、fyn、yes1、blk、hck、lck、 lyn、tec、bmx、btk、itk、txk、aatk、aatyk、aatyk2、aatyk3、ach、alk、ark、axl、bek、 bfgfr、brt、bsk、c-fms、cak、cck4、cd115、cd135、cdw135、cek1、cek10、cek11、cek2、cek3、cek5、 cek6、cek7、cfd1、ckit、csf1r、dalk、ddr1、ddr2、dek、dkfzp434c1418、drt、dtk、ebk、eck、 eddr1、eek、egfr、ehk2、ehk3、elk、eph、epha1、epha2、epha6、epha7、epha8、ephb1、ephb2、 ephb3、ephb4、ephb5、ephrin-b3、epht、epht2、epht3、ephx、erbb、erbb1、erbb2、erbb3、erbb4、 erk、eyk、fgfr1、fgfr2、fgfr3、fgfr4、flg、flk1、flk2、flt1、flt2、flt3、flt4、fms、fv2、 hbgfr、hek11、hek2、hek3、hek5、hek6、hep、her2、her3、her4、hgfr、hscr1、htk、igf1r、 insr、insrr、ir、irr、jtk12、jtk13、jtk14、jws、k-sam、kdr、kgfr、kia0641、kiaa1079、kiaa1459、 kil、kin15、kin16、kit、klg、ltk、mcf3、mdk1、mdk2、mdk5、mehk1、men2a/b、mep、mer、mertk、 met、mlk1、mlk2、mrk、mst1r、mtc1、musk、myk1、n-sam、nep、net、neu、ngl、nok、nork、nsk2、 ntrk1、ntrk2、ntrk3、ntrk4、ntrkr、ntrkr2、ntrkr3、nuk、nyk、pcl、pdgfr、pdgfra、pdgfrb、 phb6、ptk、ptk3、ptk7、ret、ron、ror1、ror2、ros1、rse、rtk、ryk、sea、sek2、sek3、sek4、 sfr、sky、stk、stk1、tek、tie、tie1、tie2、tif、tkt、trk、trka、trkb、trkc、trke、tyk1、 tyro10、tyro11、tyro3、tyro5、tyro6、tyro7、ufo、vegfr1、vegfr2、vegfr3、vik、yk1、yrk中的 至少一种。
[0017]
可选地,所述胞内激活信号传导结构域包含含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸 序列、含有seq id no:046的氨基酸序列、含有seq id no:048
的氨基酸序列、含有seq id no:050的氨基酸序 列、含有seq id no:052的氨基酸序列。
[0018]
可选地,所述嵌合抗原受体识别的靶标分子可以是免疫抑制信号相关分子或肿瘤表面抗原分子标志物等靶标分 子中的至少一种。
[0019]
可选地,细胞外结合结构域选自可识别结合免疫抑制信号相关分子或肿瘤表面抗原分子标志物等靶标分子的分 子中的至少一种,也可以为现有嵌合抗原受体中常用的单克隆抗体或单链可变片段及其抗原识别结合片段、抗免疫 抑制信号相关分子单克隆抗体及其抗原识别结合片段、抗肿瘤表面抗原分子标志物的单克隆抗体及其抗原识别结合 片段。优选为可识别结合免疫抑制信号相关分子或肿瘤表面抗原分子标志物的分子中的至少一种。
[0020]
可选地,所述胞外靶标分子结合结构域选自pd-1、pd-1截短体、pd-1蛋白突变体、结合pd-l1之单克隆抗体、 多克隆抗体、合成抗体、人抗体、人源化抗体、单域抗体、纳米抗体、单链可变片段和其结合片段的抗体中的至少 一种。
[0021]
可选地,所述胞外靶标分子结合结构域包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seqid no:007、所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的 氨基酸序列。
[0022]
可选地,所述跨膜区结构域选自一种跨膜蛋白的跨膜结构域,包含pd-1、pd-l1、pd-l2、4-1bb、4-1bbl、 icos、gitr、gitrl、ox40、ox40l、cd40、cd40l、cd86、cd80、cd2、cd28、b7-dc、b7-h2、b7-h3、 b7-h4、b7-h5、b7-h6、b7-h7、vsig-3、vista、sirpα、siglec-1、siglec-2、siglec-3、siglec-4、siglec-5、siglec-6、 siglec-7、siglec-8、siglec-9、siglec-10、siglec-11、siglec-12、siglec-14、siglec-15、siglec-16、dap10、dap12、 nkg2a、nkg2c、nkg2d、lir1、kir、kir2dl1、kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5、 kir2dl5b、kir2ds1、kir2ds3、kir2ds4、kir2ds5、kir3dl1、kir3dl2、kir3dl3、kir3ds1、klrg1、 klrg2、lair1、lair2、lilra3、lilra4、lilra5、lilrb1、lilrb2、lilrb3、lilrb4、lilrb5、2b4、 btla、cd160、lag-3、ctla-4、cd155、cd112、cd113、tigit、cd96、cd226、tim-1、tim-3、tim-4、 galectin-9、ceacam-1、cd8a、cd8b、cd4、mertk、ax1、tyro3、bai1、dap12、mrc1、fcγr1、fcγr2a、 fcγr2b1、fcγr2b2、fcγr3a、fcγr3b、fcεr2、fcεr1、fcrn、fcα/μr或fcαr1中的至少一种。
[0023]
可选地,所述跨膜区结构域包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列。
[0024]
可选地,所述胞外靶标分子结合结构域与所述跨膜区结构域之间还包括胞外间隔区结构域。
[0025]
可选地,所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列。
[0026]
可选地,所述嵌合抗原受体还包括胞内检测信号结构域;所述胞内信号检测结构域与所述胞内激活信号结构域 连接。
[0027]
可选地,所述胞内检测信号传导结构域包含至少一个基于免疫受体酪氨酸的活化基序(itam)。
[0028]
可选地,所述胞内检测信号传导结构域包含选自下组的分子的信号传导结构域的
至少一种:cd244、blame、 btla、cd36、cd3γ、cd3ε、cd3ζ、cd5、cd6、cd23、cd28、cd31、cd72、cd84、cd229、cd300a、cd300b、 cd300c2、cd300d、cd300e、cd300f、ceacam-1、ceacam-3、ceacam-2、clec-1、clec-2、clec4b2、 clec-2a、clec2l、cracc、ctla-4、dap10、dap12、dcar、dcir、dcir4、dectin-1、dnam-1、fcα、 fcεriα、fcεriβ、fcγrib、fcγriii、fcμr/faim3、fcar、fcγri、fcγrii、fcγriii、fcγriia、fcγriib、fcγriic、 fcγriiia、fcγriiib、fcrl1、fcrl2、fcrl3、fcrl4、fcrl5、fcrl5、fcrl6、g6b、integrin α2bβ3、integrin β3、kir、kir2dl1、kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5、kir2dl5b、kir2ds1、kir2ds3、 kir2ds4、kir2ds5、kir3dl1、kir3dl2、kir3dl3、kir3ds1、klrg1、klrg2、lair1、lair2、lilra3、 lilra4、lilra5、lilrb1、lilrb2、lilrb3、lilrb4、lilrb5、mdl-1、micl、nfam1、nkp30、nkp44、 nkp46、nkp80、ntb-a、pd-1、pdcd6、pilr-α、siglec-2、siglec-3、siglec-5、siglec-14、siglec-6、siglec-7、 siglec-8、siglec-9、siglec-10、siglec-11、siglec-12、siglec-14、siglec-15、siglec-16、siglec-e、siglec-f、siglec-g、 siglec-h、sirpβ1、sirpβ1/γ、sirpβ1a、sirpβ1b、sirpβ2、slam、tigit、trem-3、trem-4、treml1、 treml2中的至少一种。
[0029]
可选地,所述胞内检测信号传导结构域包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸 序列、含有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序 列、含有seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、 含有seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列。
[0030]
可选地,所述嵌合抗原受体还包括胞内间隔区结构域;所述胞内间隔区结构域位于所述跨膜区结构域和所述胞 内信号传导结构域之间并将这两者连接在一起。
[0031]
可选地,所述胞内间隔区结构域为跨膜区结构域之延伸,选自包含pd-1、pd-l1、pd-l2、4-1bb、4-1bbl、 icos、gitr、gitrl、ox40、ox40l、cd40、cd40l、cd86、cd80、cd2、cd28、b7-dc、b7-h2、b7-h3、 b7-h4、b7-h5、b7-h6、b7-h7、vsig-3、vista、sirpα、siglec-1、siglec-2、siglec-3、siglec-4、siglec-5、siglec-6、 siglec-7、siglec-8、siglec-9、siglec-10、siglec-11、siglec-12、siglec-14、siglec-15、siglec-16、dap10、dap12、 nkg2a、nkg2c、nkg2d、lir1、kir、kir2dl1、kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5、 kir2dl5b、kir2ds1、kir2ds3、kir2ds4、kir2ds5、kir3dl1、kir3dl2、kir3dl3、kir3ds1、klrg1、 klrg2、lair1、lair2、lilra3、lilra4、lilra5、lilrb1、lilrb2、lilrb3、lilrb4、lilrb5、2b4、 btla、cd160、lag-3、ctla-4、cd155、cd112、cd113、tigit、cd96、cd226、tim-1、tim-3、tim-4、 galectin-9、ceacam-1、cd8a、cd8b、cd4、mertk、ax1、tyro3、bai1、dap12、mrc1、fcγr1、fcγr2a、 fcγr2b1、fcγr2b2、fcγr3a、fcγr3b、fcεr2、fcεr1、fcrn、fcα/μr或fcαr1中的至少一种。
[0032]
可选地,所述胞内间隔区结构域包含含有seq id no:054的氨基酸序列、含有seq id no:056的氨基酸序列。
[0033]
可选地,所述嵌合抗原受体还包括胞内铰链结构域;所述胞内检测信号结构域和所述胞内激活信号结构域通过 所述胞内铰链结构域连接。
[0034]
可选地,所述胞内铰链结构域可提供所需的灵活性,以允许所需的嵌合抗原受体的表达、活性和/或构象定位。 胞内铰链结构域可以具有任何合适的长度以连接至少两个
感兴趣的结构域,并且优选设计为足够柔性以便允许其连 接的一个或两个结构域的正确折叠和/或功能和/或活性。胞内铰链结构域的长度至少为3、5、10、15、20、25、30、 35、40、45、50、55、60、65、70、75、80、85、90、95、90、95或100个氨基酸。在一些实施方式中,肽接头 的长度约0至200个氨基酸,约10至190个氨基酸,约20至180个氨基酸,约30至170个氨基酸,约40至160 个氨基酸,约50至150个氨基酸,约60至140个氨基酸,约70至130个氨基酸,约80至120个氨基酸,约90 至110个氨基酸。在一些实施方式中,胞内铰链结构域可以包含内源性蛋白序列。在一些实施方式中,胞内铰链结 构域包含甘氨酸、丙氨酸和/或丝氨酸残基。在一些实施方式中,接头可以含基序,例如gs,ggs,ggggs,ggsg 或sggg的多个或重复基序。胞内铰链结构域可以包括任何天然存在的氨基酸、非天然存在的氨基酸或其组合。
[0035]
可选的,所述胞内铰链结构域包含含有seq id no:058的氨基酸序列、seq id no:060的氨基酸序列、seq idno:062的氨基酸序列、seq id no:064的氨基酸序列、seq id no:066的氨基酸序列。
[0036]
可选地,所述嵌合抗原受体为t细胞嵌合抗原受体。
[0037]
可选地,所述嵌合抗原受体包括:
[0038]
a)胞外靶标分子结合结构域,包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003 的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、 所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨基酸序列;
[0039]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0040]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列;和
[0041]
d)细胞内信号传导结构域,包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸序列、含 有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序列、含有 seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、含有seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列、含有seq idno:042的氨基酸序列、含有seq id no:044的氨基酸序列、含有seq id no:046的氨基酸序列、含有seq id no:048 的氨基酸序列、含有seq id no:050的氨基酸序列、含有seq id no:052的氨基酸序列。
[0042]
可选地,所述嵌合抗原受体包括:
[0043]
a)胞外靶标分子结合结构域,包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003 的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、 所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨基酸序列;
[0044]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0045]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所
述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列;
[0046]
d)胞内检测信号传导结构域,包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸序列、 含有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序列、含 有seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、含有 seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列;和
[0047]
e)胞内激活信号传导结构域,包含含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸序列、 含有seq id no:046的氨基酸序列、含有seq id no:048的氨基酸序列、含有seq id no:050的氨基酸序列、含 有seq id no:052的氨基酸序列。
[0048]
可选地,所述嵌合抗原受体包括:
[0049]
a)胞外靶标分子结合结构域,包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003 的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、 所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨基酸序列;
[0050]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0051]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列;
[0052]
d)胞内检测信号传导结构域,包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸序列、 含有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序列、含 有seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、含有 seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列;
[0053]
e)胞内激活信号传导结构域,包含含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸序列、 含有seq id no:046的氨基酸序列、含有seq id no:048的氨基酸序列、含有seq id no:050的氨基酸序列、含 有seq id no:052的氨基酸序列;和
[0054]
f)胞内铰链结构域,所述细胞内检测信号传导结构域和所述细胞内激活信号传导结构域通过所述铰链结构域连 接;所述铰链结构域包含含有seq id no:058的氨基酸序列、seq id no:060的氨基酸序列、seq id no:062的氨 基酸序列、seq id no:064的氨基酸序列、seq id no:066的氨基酸序列。
[0055]
可选地,所述嵌合抗原受体包括:
[0056]
a)胞外靶标分子结合结构域,包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003 的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、 所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨基酸序列;
[0057]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0058]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列;
[0059]
d)细胞内信号传导结构域,包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸序列、含 有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序列、含有 seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、含有seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列、含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸序列、含有seq id no:046的氨基酸序列、含有seq id no:048 的氨基酸序列、含有seq id no:050的氨基酸序列、含有seq id no:052的氨基酸序列;和
[0060]
e)胞内间隔区结构域,所述跨膜区结构域和所述细胞内信号传导结构域通过所述胞内间隔区结构域连接;所 述胞内间隔区结构域包含含有seq id no:054的氨基酸序列、含有seq id no:056的氨基酸序列。
[0061]
可选地,,所述嵌合抗原受体包括:
[0062]
a)胞外靶标分子结合结构域,包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003 的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、 所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨基酸序列;
[0063]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0064]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列;和
[0065]
d)胞内激活信号传导结构域,包含含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸序列、 含有seq id no:046的氨基酸序列、含有seq id no:048的氨基酸序列、含有seq id no:050的氨基酸序列、含 有seq id no:052的氨基酸序列;和
[0066]
e)胞内间隔区结构域,所述跨膜区结构域和所述细胞内激活信号传导结构域通过所述胞内间隔区结构域连接; 所述胞内间隔区结构域包含含有seq id no:054的氨基酸序列、含有seq id no:056的氨基酸序列。
[0067]
可选地,所述嵌合抗原受体包括:
[0068]
a)胞外靶标分子结合结构域,包含包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨 基酸序列;
[0069]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0070]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序
列、含有seq id no:018的氨基酸序列;
[0071]
d)胞内检测信号传导结构域,包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸序列、 含有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序列、含 有seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、含有 seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列;
[0072]
e)胞内激活信号传导结构域,包含含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸序列、 含有seq id no:046的氨基酸序列、含有seq id no:048的氨基酸序列、含有seq id no:050的氨基酸序列、含 有seq id no:052的氨基酸序列;和
[0073]
f)胞内间隔区结构域,所述跨膜区结构域和所述细胞内检测信号传导结构域通过所述胞内间隔区结构域连接; 所述胞内间隔区结构域包含含有seq id no:054的氨基酸序列、含有seq id no:056的氨基酸序列。
[0074]
可选地,所述嵌合抗原受体包括:
[0075]
a)胞外靶标分子结合结构域,包含包含含有seq id no:001的氨基酸序列、所述胞外结构域包含含有seq id no:003的氨基酸序列、所述胞外结构域包含含有seq id no:005的氨基酸序列、所述胞外结构域包含含有seq id no:007、所述胞外结构域包含含有seq id no:009的氨基酸序列、所述胞外结构域包含含有seq id no:011的氨 基酸序列;
[0076]
b)跨膜区结构域,包含含有seq id no:012的氨基酸序列、含有seq id no:014的氨基酸序列;
[0077]
c)胞外间隔区结构域,所述胞外靶标分子结合结构域和所述跨膜区结构域通过所述胞外间隔区结构域连接; 所述胞外间隔区结构域包含含有seq id no:016的氨基酸序列、含有seq id no:018的氨基酸序列;
[0078]
d)胞内检测信号传导结构域,包含含有seq id no:020的氨基酸序列、含有seq id no:022的氨基酸序列、 含有seq id no:024的氨基酸序列、含有seq id no:026的氨基酸序列、含有seq id no:028的氨基酸序列、含 有seq id no:030的氨基酸序列、含有seq id no:032的氨基酸序列、含有seq id no:034的氨基酸序列、含有 seq id no:036的氨基酸序列、含有seq id no:038的氨基酸序列、含有seq id no:040的氨基酸序列;
[0079]
e)胞内激活信号传导结构域,包含含有seq id no:042的氨基酸序列、含有seq id no:044的氨基酸序列、 含有seq id no:046的氨基酸序列、含有seq id no:048的氨基酸序列、含有seq id no:050的氨基酸序列、含 有seq id no:052的氨基酸序列;
[0080]
f)胞内间隔区结构域,所述跨膜区结构域和所述细胞内检测信号传导结构域通过所述胞内间隔区结构域连接; 所述胞内间隔区结构域包含含有seq id no:054的氨基酸序列、含有seq id no:056的氨基酸序列;和
[0081]
g)胞内铰链结构域,所述细胞内检测信号传导结构域和所述细胞内激活信号传导结构域通过所述铰链结构域 连接;所述铰链结构域包含seq id no:058的氨基酸序列、seq id no:060的氨基酸序列、seq id no:062的氨基 酸序列、seq id no:064的氨基酸序列、seq id no:066的氨基酸序列。
[0082]
作为一种实施方式,所述嵌合抗原受体,包括:
[0083]
a)胞外靶标分子结合结构域,用于特异性结合靶标分子;
[0084]
b)胞内检测信号传导结构域;所述胞内检测信号传导结构域选自cd3 ζ itam1片段、cd3 ζ itam2片段、 cd3 ζ itam3片段、fcriia itam片段、fcrγ itam片段、dap12 itam片段、cd3 ε itam片段中的至少一 种;
[0085]
c)胞内信号传导结构域;所述胞内信号传导结构域与所述胞内检测信号传导结构域连接;和
[0086]
d)跨膜区结构域,用于连接所述胞外靶标分子结合结构域和所述胞内信号传导结构域,并将二者固定在细胞 膜上。
[0087]
可选地,胞内信号传导结构域包括至少一个胞内激活信号结构域;所述胞内激活信号结构域的激活至少依赖于 所述胞外靶标分子结合结构域与所述靶标分子的结合;所述胞内激活信号结构域含有具有催化功能基团的分子。
[0088]
关于本申请中的序列,同源序列均在本申请的保护范围内。
[0089]
序列同源性:将在本申请中所使用的术语“序列同源性”定义为两个或多个核酸分子之间、两个或多个蛋白质 序列之间具有明显的编码序列上的相似性,例如具有至少80%、至少81%、至少82%、至少83%、至少84%、至 少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、 至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或至少100%序列编码的同一性。
[0090]
表1为氨基酸序列和核酸序列
[0091]
表1
[0092]
[0093]
[0094]
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101]
[0102]
[0103]
[0104]
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126][0127]
根据本申请的另一个方面,提供一种核酸分子,所述核酸分子编码上述任一项所述的嵌合抗原受体。
[0128]
优选地,所述核酸分子包含胞外靶标分子结合结构域核酸片段、跨膜区结构域核酸片段、胞内激活信号传导结 构域核酸片段、胞外间隔区结构域核酸片段、胞内检测信号传导结构域核酸片段、胞内间隔区结构域核酸片段、胞 内铰链结构域片段。
[0129]
优选地,所述胞外靶标分子结合结构域核酸片段包含含有seq id no:002的核酸序列、含有seq id no:004 的核酸序列、含有seq id no:006的核酸序列、含有seq id no:008的核酸序列、含有seq id no:010的核酸序 列。
[0130]
优选地,所述跨膜区结构域核酸片段包含含有seq id no:013的核酸序列、含有seq id no:015的核酸序列。
[0131]
优选地,所述胞内激活信号传导结构域核酸片段包含含有seq id no:043的核酸序列、含有seq id no:045 的核酸序列、含有seq id no:047的核酸序列、含有seq id no:049的核酸序列、含有seq id no:051的核酸序 列、含有seq id no:053的核酸序列。
[0132]
优选地,所述胞外间隔区结构域核酸片段包含含有seq id no:017的核酸序列、含有seq id no:019的核酸序 列。
[0133]
优选地,所述胞内检测信号传导结构域核酸片段包含含有seq id no:021的核酸序列、含有seq id no:023 的核酸序列、含有seq id no:025的核酸序列、含有seq id no:027的核酸序列、含有seq id no:029的核酸序 列、含有seq id no:031的核酸序列、含有seq id no:033的核酸序列、含有seq id no:035的核酸序列、含有 seq id no:037的核酸序列、含有seq id no:039的核酸序列、含有seq id no:041的核酸序列。
[0134]
优选地,所述胞内间隔区结构域核酸片段包含含有seq id no:055的核酸序列、含有seq id no:057的核酸序 列。
[0135]
优选地,所述胞内铰链结构域片段包含含有seq id no:059的核酸序列、含有seq id no:061的核酸序列、含 有seq id no:063的核酸序列、含有seq id no:065的核酸序列。
[0136]
根据本申请的另一个方面,提供一种载体,所述载体包含上述的核酸分子。
[0137]
可选地,所述载体为病毒载体、经修饰的mrna载体或转座子介导的基因转移载体。
[0138]
根据本申请的另一个方面,提供一种宿主细胞,所述宿主细胞包含上述任一项所述的嵌合抗原受体、上述的核 酸分子或上述的载体中的至少一种。
[0139]
根据本申请的另一个方面,提供一种宿主细胞群,包含上述的宿主细胞。
[0140]
根据本申请的另一个方面,提供一种药物组合物,所述药物组合物包含上述任一项所述的抗原嵌合受体、上述 的核酸分子、上述的载体、上述的宿主细胞、上述的宿主细胞群中的至少一种。
[0141]
可选地,所述药物组合物还包括细胞因子;
[0142]
所述细胞因子选自γ干扰素、白细胞介素中的至少一种。
[0143]
可选地,所述药物组合物还包括单克隆抗体;
[0144]
所述单克隆抗体选自西妥昔单抗、阿仑单抗、伊匹单抗、奥法木单抗中的至少一种中的至少一种。
[0145]
根据本申请的另一个方面,提供上述任一项所述的药物组合物的使用方法,包括以下步骤:
[0146]
1)获得人的免疫细胞;
[0147]
2)对所述人的免疫细胞进行改造,以获得改造后的免疫细胞;
[0148]
所述改造后的免疫细胞含有上述任一项所述的嵌合抗原受体的免疫细胞、所述的核酸分子、所述的载体、所述 的宿主细胞、所述的宿主细胞群中的至少一种;
[0149]
3)将所述改造后的免疫细胞回输至人体内。
[0150]
可选地,步骤3)还包括:
[0151]
3-1)对人体的整体或者部分施加细胞因子、单克隆抗体中的至少一种;
[0152]
3-2)将所述改造后的免疫细胞回输至人体内。
[0153]
根据本申请的另一个方面,提供上述任一项所述的抗原嵌合受体、上述的核酸分子、上述的载体、上述的宿主 细胞、上述的宿主细胞群、上述任一项所述的药物组合物中的至少一种在制备治疗pd-l1阳性或响应γ干扰素上调 pd-l1表达水平的肿瘤的药物中的应用。
[0154]
根据本申请的另一个方面,提供上述任一项所述的抗原嵌合受体、上述的核酸分子、上述的载体、上述的宿主 细胞、上述的宿主细胞群、上述任一项所述的药物组合物中的至少一种在治疗pd-l1阳性或响应γ干扰素上调pd-l1 表达水平的肿瘤中的应用。
[0155]
根据本申请的另一个方面,提供上述任一项所述的抗原嵌合受体、上述的核酸分子、上述的载体、上述的宿主 细胞、上述的宿主细胞群、上述任一项所述的药物组合物中的至少一种在制备治疗以下肿瘤的药物中的应用:
[0156]
乳腺癌、直肠癌、皮肤癌、结肠癌、胰腺癌、肝癌、卵巢癌、前列腺癌、脑癌、肾癌、肺癌、淋巴瘤、黑色素 瘤。
[0157]
根据本申请的另一个方面,提供上述任一项所述的抗原嵌合受体、上述的核酸分子、上述的载体、上述的宿主 细胞、上述的宿主细胞群、上述任一项所述的药物组合物中的至少一种在治疗以下肿瘤中的应用:
[0158]
乳腺癌、直肠癌、皮肤癌、结肠癌、胰腺癌、肝癌、卵巢癌、前列腺癌、脑癌、肾癌、肺癌、淋巴瘤、黑色素 瘤。
[0159]
本申请能产生的有益效果包括:
[0160]
1)本申请所提供的嵌合抗原受体,其细胞内信号传导结构域的设计加强了对宿主免疫细胞的活化作用以及对肿 瘤细胞的杀伤作用,且扩大了嵌合抗原受体对不同的免疫细胞的改造的适应性。
[0161]
2)本申请所提供的嵌合抗原受体,优选基于改造免疫检查点pd-1/pd-l1信号通路,重新编码改造免疫t细胞去 更好地识别杀伤特定的肿瘤细胞,当表达免疫检查点抑制性信号pd-1分子配体pd-l1的肿瘤细胞通过pd-1/pd-l1 免疫检查点信号通路以同样的对免疫t细胞刹车阻断机制去尝试抑制免疫t细胞功能时,经过该新一代基于免疫检 查点pd-1的嵌合抗原受体分子机器重新编码改造的免疫t细胞,非但不会被肿瘤细胞所抑制,反而会被进一步激 活,产生针对相应肿瘤细胞的特异性免疫反应,从而识别并杀伤相应的肿瘤细胞。
[0162]
3)本申请所提供嵌合抗原受体,能够更好地识别杀伤特定的肿瘤细胞,包括乳腺癌、直肠癌、皮肤癌、结肠 癌、胰腺癌、肝癌、卵巢癌、前列腺癌、脑癌、肾癌、肺癌、淋巴瘤、黑色素瘤等。
附图说明
[0163]
图1(a)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域与胞内信号传导结构域的嵌合抗原受体人工分子机器的构建示意图简图。
[0164]
图1(b)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域与胞内激活信号传导结构域(属于激活模块)的嵌合抗原受体人工分子机器的构建示意图简图。
[0165]
图1(c)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域、胞内检测信号传导结构域(属于检测模块)与胞内激活信号传导结构域(属于激活模块)的嵌合抗 原受体人工分子机器的构建示意图简图。
[0166]
图1(d)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域、胞内检测信号传导结构域(属于检测模块)、胞内铰链结构域与胞内激活信号传导结构域(属于激 活模块)的嵌合抗原受体人工分子机器
的构建示意图简图。
[0167]
图1(e)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域、胞内间隔区结构域与胞内信号传导结构域的嵌合抗原受体人工分子机器的构建示意图简图。
[0168]
图1(f)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域、胞内间隔区结构域与胞内激活信号传导结构域(属于激活模块)的嵌合抗原受体人工分子机器的构 建示意图简图。
[0169]
图1(g)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域、胞内间隔区结构域、胞内检测信号传导结构域(属于检测模块)与胞内激活信号传导结构域(属于 激活模块)的嵌合抗原受体人工分子机器的构建示意图简图。
[0170]
图1(h)显示了本申请基于胞外靶标分子结合结构域(如pd-1胞外片段或者靶向scfv)、胞外间隔区结构域、 跨膜区结构域、胞内间隔区结构域、胞内检测信号传导结构域(属于检测模块)、胞内铰链结构域与胞内激活信号 传导结构域(属于激活模块)的嵌合抗原受体人工分子机器的构建示意图简图。
[0171]
图2显示了含有胞外靶标分子结合结构域的嵌合抗原受体人工分子机器的信号激活示意图简图且(a)为在酪 氨酸激酶活化信号输入的情况下人工分子机器的信号激活示意图,(b)为在靶分子识别结合信号输入(如pd-l1) 的情况下含有胞外靶标分子结合结构域(如pd-1胞外部分)的嵌合抗原受体人工分子机器的信号激活示意图。
[0172]
图3显示了对内源性天然淋巴细胞和具有本公开内容的嵌合抗原受体修饰的淋巴细胞的比较。其中,图3(a) 显示了内源性的天然淋巴细胞面对肿瘤细胞的表现。图3(b)显示了具有本公开内容的嵌合抗原受体修饰的淋巴细 胞面对肿瘤细胞的表现。其中,淋巴细胞的灰度大小对应淋巴细胞的肿瘤杀伤能力强弱。
[0173]
图4显示了施用本公开内容的嵌合抗原受体的示例性方法。
[0174]
图5显示了在src家族蛋白非受体型蛋白酪氨酸激酶lck(lymphocyte-specific protein tyrosine kinase,淋巴细 胞特异的蛋白酪氨酸激酶)提供激活蛋白酪氨酸磷酸化信号的条件下,不同的人工分子机器在纯化蛋白的状态下表 现结果的直方图(数据显示为平均值
±
标准差,c#9(+)组n=3,c#10(+)组n=3),成像读数指标代表量化后 人工分子机器对刺激信号的响应能力的程度以及响应刺激信号同时引发的人工分子机器基于分子构象改变的对其 自身激活元件的释放与激活的程度。在此,非受体型蛋白酪氨酸激酶lck可以促进蛋白酪氨酸磷酸化信号的激活, 起到提供特异性的蛋白酪氨酸磷酸化信号输入的作用。
[0175]
图6(a)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的条件下,不同的人工分子机器在 人源hela细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#9组至c#16组均为n=5),成像读数指标代 表量化后人工分子机器对刺激信号的响应能力的程度以及响应刺激信号同时引发的人工分子机器基于分子构象改 变的对其自身激活元件的释放与激活的程度。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋白去磷酸化作 用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用。
[0176]
图6(b)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的a条件或在表皮生长因子(egf) 激活信号的b条件下,不同的人工分子机器在人源hela细胞中表现结果的直方图(数据显示为平均值
±
标准差, c#9-a组和c#15-a组均为n=5,c#9-b组和c#15-b组均为n=3),成像读数指标代表量化后人工分子机器对刺 激信号的响应能力的程度以及响应刺激信号同时引发的人工分子机器基于分子构象改变的对其自身激活元件的释 放与激活的程度。
[0177]
图6(c)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的a条件或在血小板源生长因子 (pdgf)激活信号的b条件下,不同的人工分子机器在小鼠胚胎成纤维细胞(mef)中表现结果的直方图(c#9-a 组、c#9-b组、c#15-a组和c#15-b组均为n=5),成像读数指标代表量化后人工分子机器对刺激信号的响应能力 的程度以及响应刺激信号同时引发的人工分子机器基于分子构象改变的对其自身激活元件的释放与激活的程度
[0178]
图7(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中的表达分 布及在酪氨酸磷酸酶抑制剂过钒酸钠刺激下响应蛋白酪氨酸磷酸化信号能力的检测结果。其中,实验组为具有本公 开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#17版本修饰的人源hela细胞,对照组为具有本公开内容的 基于免疫检查点pd-1融合的嵌合抗原受体c#18版本修饰的人源hela细胞,图片下方的色彩条热图由左至右依次 代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子构象改 变的对其自身激活元件的释放与激活程度的由低到高。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋白去 磷酸化作用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用。
[0179]
图7(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中的表达分 布及在酪氨酸磷酸酶抑制剂过钒酸钠刺激下响应蛋白酪氨酸磷酸化信号能力的检测结果。其中,实验组为具有本公 开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源hela细胞,对照组为具有本公开内容的 基于免疫检查点pd-1融合的嵌合抗原受体c#20版本修饰的人源hela细胞,图片下方的色彩条热图由左至右依次 代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子构象改 变的对其自身激活元件的释放与激活程度的由低到高。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋白去 磷酸化作用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用。
[0180]
图7(c)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的条件下,不同的基于免疫检查点 pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#17 组至c#20组均为n=10),成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号 同时引发的嵌合抗原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。
[0181]
图8(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源jurkat e6-1细胞中的表 达分布及在酪氨酸磷酸酶抑制剂过钒酸钠刺激下响应蛋白酪氨酸磷酸化信号能力的检测结果。其中,实验组为具有 本公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源jurkat e6-1细胞,对照组为具有本 公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#20版本修饰的人源jurkat e6-1细胞,图
片下方的色彩条 热图由左至右依次代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受 体基于分子构象改变的对其自身激活元件的释放与激活程度的由低到高。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以 抑制细胞内蛋白去磷酸化作用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作 用。
[0182]
图8(b)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的条件下,不同的基于免疫检查点 pd-1融合的嵌合抗原受体人工分子机器在人源jurkat e6-1细胞中表现结果的直方图(数据显示为平均值
±
标准差, c#19组和c#20组均为n=10),成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺 激信号同时引发的嵌合抗原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。
[0183]
图9(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中的表达分 布及在人源pd-l1修饰的微球刺激下响应人源pd-l1信号的检测结果。其中,实验组为具有本公开内容的基于免 疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源hela细胞,对照组为具有本公开内容的基于免疫检查点 pd-1融合的嵌合抗原受体c#20版本修饰的人源hela细胞,图片下方的色彩条热图由左至右依次代表嵌合抗原受 体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子构象改变的对其自身激 活元件的释放与激活程度的由低到高,所提供的相位对比成像实验图片提供了细胞与微球相互作用的图像信息。在 此,人源pd-l1修饰的微球起到提供人源pd-l1信号输入的作用。
[0184]
图9(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源jurkat e6-1细胞中的表 达分布及在人源pd-l1修饰的微球刺激下响应人源pd-l1信号的检测结果。其中,实验组为具有本公开内容的基 于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源jurkat e6-1细胞,对照组为具有本公开内容的基于 免疫检查点pd-1融合的嵌合抗原受体c#20版本修饰的人源jurkat e6-1细胞,图片下方的色彩条热图由左至右依 次代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子构象 改变的对其自身激活元件的释放与激活程度的由低到高,所提供的相位对比成像实验图片提供了细胞与微球相互作 用的图像信息。在此,人源pd-l1修饰的微球起到提供人源pd-l1信号输入的作用。
[0185]
图9(c)显示了在人源pd-l1修饰的微球刺激信号的条件下,不同的基于免疫检查点pd-1融合的嵌合抗原受 体人工分子机器在人源hela细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#17组至c#20组均为n=10), 成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号同时引发的嵌合抗原受体 基于分子构象改变的对其自身激活元件的释放与激活的程度。
[0186]
图9(d)显示了在人源pd-l1修饰的微球刺激信号的条件下,不同的基于免疫检查点pd-1融合的嵌合抗原受 体人工分子机器在人源jurkat e6-1细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#19组和c#20组均为 n=10),成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号同时引发的嵌合抗 原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。
[0187]
图10显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰
的jurkat e6-1细胞面对与γ干 扰素预处理的pd-l1高表达人源乳腺癌细胞mda-mb-231共培养条件下的t细胞活化能力表现的直方图(数据显 示为平均值
±
标准差,c#19(+)组为n=4,其它组均为n=6),(+)代表jurket e6-1细胞与γ干扰素预处理的人 源乳腺癌细胞共培养的条件,(-)代表仅有jurket e6-1细胞单独培养的条件,t细胞活化读数指标代表t淋巴细胞 表面活化分子cd69的相对表达水平。
[0188]
图11显示了含有不同长度的胞内铰链结构域的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰的 jurkat e6-1细胞面对与γ干扰素预处理的pd-l1高表达人源乳腺癌细胞mda-mb-231共培养条件下的t细胞活化 能力表现的直方图(c#19(+)组和c#19(-)组数据显示为平均值
±
标准差,c#19(+)组为n=4,c#19(-)组 为n=6;其它组数据显示为平均值,均为n=1),(+)代表jurket e6-1细胞与γ干扰素预处理的人源乳腺癌细胞共 培养的条件,(-)代表仅有jurket e6-1细胞单独培养的条件,t细胞活化读数指标代表t淋巴细胞表面活化分子 cd69的相对表达水平。
[0189]
图12显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体在人源免疫原代t细胞中的表达水平(数据显示 为几何平均均值,均为n=1)。基于免疫检查点pd-1融合的嵌合抗原受体c#1、c#2、c#3、c#4与c#5版本所包 含的各组成部分信息请见图28以及本申请相关内容。
[0190]
图13(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源直肠癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0191]
图13(b)显示了pd-1免疫检查点抑制剂存在下人源免疫原代t细胞与pd-l1阳性的人源直肠癌肿瘤细胞dld1 细胞改造株的体外共培养细胞毒性效果的定量分析结果(数据显示为平均值
±
标准差,均为n=3)。其中,对照组 中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改造的人源免疫原代t细胞,靶细胞存活指数代表细胞 培养体系中表达报告基因萤火虫荧光素酶的人源直肠癌肿瘤细胞的相对细胞数量,pd-1免疫检查点抑制剂为纳武 利尤单抗或派姆单抗。
[0192]
图13(c)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源直肠癌肿瘤细胞dld1细胞改造株的体外共培养细胞毒性效果的定量分析结果(数据显示 为平均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#1、c#2、c#4、c#3和c#5版本所 包含的各组成部分信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受 体人工分子机器改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的 人源直肠癌肿瘤细胞的相对细胞数量。
[0193]
图14(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源乳腺癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0194]
图14(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源乳腺癌肿瘤细胞mda-mb-231细胞的体外共培养细胞毒性效果的定量分析结果(数据显 示为平均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各 组成部分信息请见图28以及本申请相关内容。其中,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧 光素酶的人源乳腺癌肿瘤细胞的相对细胞数量。
[0195]
图15(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源乳腺癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0196]
图15(b)显示了pd-1免疫检查点抑制剂存在下人源免疫原代t细胞与pd-l1阳性的人源乳腺癌肿瘤细胞 mda-mb-231细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平均值
±
标准差,均为n=3)。其中, 对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改造的人源免疫原代t细胞,靶细胞存活指数代 表细胞培养体系中表达报告基因萤火虫荧光素酶的人源乳腺癌肿瘤细胞的相对细胞数量,pd-1免疫检查点抑制剂 为纳武利尤单抗或派姆单抗。
[0197]
图15(c)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源乳腺癌肿瘤细胞mda-mb-231细胞的体外共培养细胞毒性效果的定量分析结果(数据显 示为平均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#1、c#2、c#3、c#4和c#5版本 所包含的各组成部分信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原 受体人工分子机器改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶 的人源乳腺癌肿瘤细胞的相对细胞数量。
[0198]
图16(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源肝癌肿瘤细胞的体外共培养细胞毒性实验模型建 立与分析测试流程。
[0199]
图16(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源肝癌肿瘤细胞ha22t细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平均 值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部分 信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改 造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源肝癌肿瘤细胞 的相对细胞数量。
[0200]
图17(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源脑癌肿瘤细胞的体外共培养细胞毒性实验模型建 立与分析测试流程。
[0201]
图17(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源脑癌肿瘤细胞u87-mg细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平 均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部 分信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器 改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源脑癌肿瘤细 胞的相对细胞数量。
[0202]
图18(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源皮肤癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0203]
图18(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源皮肤癌肿瘤细胞a2058细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平 均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部 分信息请见图28以及本
申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器 改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源皮肤癌肿瘤 细胞的相对细胞数量。
[0204]
图19(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源卵巢癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0205]
图19(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源卵巢癌肿瘤细胞es-2细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平均 值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部分 信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改 造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源卵巢癌肿瘤细 胞的相对细胞数量。
[0206]
图20(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源前列腺癌肿瘤细胞的体外共培养细胞毒性实验模 型建立与分析测试流程。
[0207]
图20(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源前列腺癌肿瘤细胞pc-3细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平 均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部 分信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器 改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源前列腺癌肿 瘤细胞的相对细胞数量。
[0208]
图21(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源胰腺癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0209]
图21(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源胰腺癌肿瘤细胞aspc1细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平 均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部 分信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器 改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源胰腺癌肿瘤 细胞的相对细胞数量。
[0210]
图22(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源结肠癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0211]
图22(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源结肠癌肿瘤细胞colo205细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为 平均值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成 部分信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机 器改造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源结肠癌肿 瘤细胞的相对细胞数量。
[0212]
图23(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源肾癌肿瘤细胞的体外共培养细胞毒性实验模型建 立与分析测试流程。
[0213]
图23(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源肾癌肿瘤细胞786-o细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平均值
ꢀ±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部分信 息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改造 的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源肾癌肿瘤细胞的 相对细胞数量。
[0214]
图24(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源肺癌肿瘤细胞的体外共培养细胞毒性实验模型建 立与分析测试流程。
[0215]
图24(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源肺癌肿瘤细胞h441细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平均值
ꢀ±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部分信 息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改造 的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源肺癌肿瘤细胞的 相对细胞数量。
[0216]
图25(a)显示了本申请所涉及的t细胞与pd-l1阳性的人源淋巴癌肿瘤细胞的体外共培养细胞毒性实验模型 建立与分析测试流程。
[0217]
图25(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t 细胞与pd-l1阳性的人源淋巴癌肿瘤细胞u937细胞的体外共培养细胞毒性效果的定量分析结果(数据显示为平均 值
±
标准差,均为n=3)。基于免疫检查点pd-1融合的嵌合抗原受体c#2、c#3和c#5版本所包含的各组成部分 信息请见图28以及本申请相关内容。其中,对照组中的人源免疫原代t细胞为未经嵌合抗原受体人工分子机器改 造的人源免疫原代t细胞,靶细胞存活指数代表细胞培养体系中表达报告基因萤火虫荧光素酶的人源淋巴癌肿瘤细 胞的相对细胞数量。
[0218]
图26(a)显示了本申请所涉及使用的供体小鼠淋巴t细胞体外分离、感染与扩增流程。
[0219]
图26(b)显示了本申请所涉及使用的受试小鼠同源实体肿瘤模型建立、监测与分析流程及治疗方案。
[0220]
图27(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的t细胞疗法在免 疫系统完善的pd-l1阳性黑色素瘤实体瘤小鼠动物模型中治疗效果的定量分析(数据显示为平均值
±
标准差,均为 n=6)。基于免疫检查点pd-1融合的嵌合抗原受体c#2和c#3版本所包含的各组成部分信息请见图28以及本申请 相关内容。其中,对照组中的t细胞疗法为使用未经嵌合抗原受体人工分子机器修饰改造的鼠源免疫原代t细胞, 肿瘤体积代表小鼠皮下实体肿瘤模型中实体肿瘤定量的体积大小,小鼠肿瘤模型为皮下b16黑色素瘤实体瘤模型。 具体治疗方案流程信息请见图26。
[0221]
图27(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修
饰改造的t细胞疗法在免 疫系统完善的pd-l1阳性黑色素瘤实体瘤小鼠动物模型中治疗效果的定量分析(数据显示为平均值
±
标准差,均为 n=6)。基于免疫检查点pd-1融合的嵌合抗原受体c#2和c#3版本所包含的各组成部分信息请见图28以及本申请 相关内容。其中,对照组中的t细胞疗法为使用未经嵌合抗原受体人工分子机器修饰改造的鼠源免疫原代t细胞, 肿瘤体积代表小鼠皮下实体肿瘤模型中实体肿瘤定量的体积大小,小鼠肿瘤模型为皮下b16黑色素瘤实体瘤模型。 具体治疗方案流程信息请见图26。
[0222]
图27(c)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的t细胞疗法在免 疫系统完善的pd-l1阳性结肠癌实体瘤小鼠动物模型中治疗效果的定量分析(数据显示为平均值
±
标准差,均为n =6)。基于免疫检查点pd-1融合的嵌合抗原受体c#2和c#3版本所包含的各组成部分信息请见图28以及本申请相 关内容。其中,肿瘤体积代表小鼠皮下实体肿瘤模型中实体肿瘤定量的体积大小,小鼠肿瘤模型为皮下mc38结肠 癌实体瘤模型。具体治疗方案流程信息请见图26。
[0223]
图28显示了表1,包含不同版本的嵌合蛋白构建体,其示出了根据本公开内容的嵌合蛋白的实例,包括基于免 疫检查点pd-1融合的嵌合抗原受体。
[0224]
图29显示了慢病毒载体的载体图谱,其中包含有具有代表性的两个版本:(a)基于免疫检查点pd-1融合的嵌 合抗原受体c#3版本和(b)基于免疫检查点pd-1融合的嵌合抗原受体c#5版本。基于免疫检查点pd-1融合的嵌 合抗原受体c#3和c#5版本所包含的各组成部分信息请见图28以及本申请相关内容。
具体实施方式
[0225]
下面结合实施例详述本申请,但本申请并不局限于这些实施例。本发明决不应被解释为受限于以下实施例,而 是应被解释为涵盖由于本文提供的教导而显而易见的任何和所有改动。
[0226]
无进一步描述时,认为本领域的普通技术人员能够利用前文描述和下文示例性实施历来制备和应用本发明的化 合物以及实践请求保护的方法。因此,下文工作实施例具体地指出了本发明的优选实施方式,而不被解释为以任何 方式限制本公开的其余部分。
[0227]
如无特别说明,本申请的实施例中的原料均通过商业途径购买。
[0228]
现对这些实验中的使用的材料和方法进行描述。
[0229]
本申请描述了嵌合蛋白,其包含(a)细胞外结构域,包含用于特异性结合靶标分子的结合结构域和任选的胞 外间隔区结构域,(b)胞内信号传导结构域,包括至少一个免疫细胞激活信号通路元件,和(c)跨膜区结构域, 以及编码所述嵌合蛋白的核酸分子。此外,本申请提供了经修饰以表达这些嵌合蛋白的细胞以及用于向需要其的对 象递送此类经修饰的细胞的方法和组合物。
[0230]
本申请实施例中,“分子机器”、“嵌合抗原受体”均为嵌合蛋白,为本发明的示范例,部分或全部呈现于图28 的图表中,包含不同版本的嵌合抗原受体构建体。
[0231]
根据本申请的一个方面,构建嵌合抗原受体(分子机器),包括:
[0232]
a)细胞外结构域,用于特异性结合靶标分子;
[0233]
b)细胞内信号传导结构域,包括至少一个免疫细胞激活信号通路元件;所述免疫细胞激活信号通路元件的激 活至少依赖于所述细胞外结构域与所述靶标分子的结合;所
述免疫细胞激活信号通路元件含有具有催化功能基团的 分子:和
[0234]
c)跨膜区结构域,用于连接所述细胞外结构域和所述细胞内信号传导结构域,并将二者固定在细胞膜上。
[0235]
嵌合抗原受体识别的靶标分子可以是免疫抑制信号相关分子或肿瘤表面抗原分子标志物等靶标分子中的至少 一种。细胞外结合结构域选自可识别结合免疫抑制信号相关分子或肿瘤表面抗原分子标志物等靶标分子的分子中的 至少一种,也可以为现有嵌合抗原受体中常用的单克隆抗体或单链可变片段及其抗原识别结合片段、抗免疫抑制信 号相关分子单克隆抗体及其抗原识别结合片段、抗肿瘤表面抗原分子标志物的单克隆抗体及其抗原识别结合片段。 优选为可识别结合免疫抑制信号相关分子或肿瘤表面抗原分子标志物的分子中的至少一种。
[0236]
细胞内信号传导结构域,包括至少一个胞内激活信号结构域,优选为免疫细胞激活信号通路元件;所述胞内激 活信号结构域的激活至少依赖于所述胞外靶标分子结合结构域与所述靶标分子的结合;所述胞内激活信号结构域含 有具有催化功能基团的分子或其片段。细胞内信号传导结构域含有具有催化功能基团的分子或其片段,能够使得嵌 合抗原受体脱离对特定细胞类型的限制,扩展到对具有催化功能基团的分子具备适用性的细胞类型中,即拓展了本 申请所述的嵌合抗原受体能够赋予经基因修饰以表达所述嵌合抗原受体的宿主细胞类型的范围。
[0237]
在某些此类实施方式中,如本申请所述的嵌合抗原受体的表达赋予了未天然地显示出免疫功能激活表型的宿主 细胞免疫功能激活表型。在其它此类实施方式中,宿主细胞表达如本申请所述的嵌合抗原受体赋予了对宿主细胞不 天然靶向的抗原标记物具有特异性的免疫功能激活表型。在另外其它的此类实施方式中,宿主细胞表达如本申请所 述的嵌合抗原受体赋予了对宿主细胞天然靶向的抗原标记物具有特异性的免疫功能激活表型,并且宿主细胞表达嵌 合抗原受体增强了宿主细胞对显示出抗原标记物的细胞、微生物或颗粒的免疫活化与识别杀伤作用。
[0238]
跨膜区结构域,现有的跨膜蛋白均可以用于该技术,没有其它要求。
[0239]
基于pd-1/pd-l1免疫抑制性信号相关的应用场景,验证该嵌合抗原受体分子机器的设想。综合考虑背景技术 中car-t细胞疗法的优缺点,尤其是在实体瘤治疗方面面对的挑战,比如实体肿瘤具有复杂的免疫抑制性肿瘤微 环境等,提出并开发新一代的基于免疫检查点pd-1信号通路的嵌合抗原受体的实体肿瘤细胞疗法。该技术结合肿 瘤免疫学、合成生物学、分子工程与细胞工程等多种手段,建立并应用基于免疫检查点pd-1的具备编码调控免疫 细胞功能的嵌合抗原受体人工分子机器,兼具免疫检查点抑制剂与car-t细胞疗法两者优势,为克服肿瘤微环境 的免疫抑制和改善实体肿瘤治疗提供解决方案。
[0240]
当表达pd-1分子配体pd-l1的肿瘤细胞尝试通过pd-1/pd-l1免疫检查点信号通路以同样的对免疫t细胞的 刹车阻断机制去抑制免疫t细胞功能时,经过该新一代基于pd-1的嵌合抗原受体人工分子机器重新编码修饰改造 的免疫t细胞,非但不会被pd-l1阳性的肿瘤细胞所抑制,反而会特异性地识别pd-l1阳性的肿瘤细胞并被进一 步激活,产生针对相应肿瘤细胞的免疫功能激活表型及特异性免疫反应,从而极其有效地识别并杀伤相应的肿瘤细 胞。
[0241]
定义
[0242]
在更详细地阐述本公开内容之前,提供在本申请中使用的某些术语的定义,可能有助于理解本公开内容。
[0243]
胞外靶标分子结构域:将在本申请中所使用的术语“靶标分子结构域”定义为具有特异性地和非共价地结合、 缔合、联合(unite)、或识别靶分子(例如,pd-1、igg抗体、ige抗体、iga抗体、cd138、cd38、cd33、cd123、 cd79b、间皮素、psma、bcma、ror1、muc-16、l1cam、cd22、cd19、egfrviii、vegfr-2或gd2)能力 的分子(如肽、寡肽、多肽或蛋白)。靶标分子结合结构域包括任何天然存在的、合成的、半合成或重组产生的针对 目标生物分子或其他靶点的结合配偶体。在一些实施方式中,靶标分子结构域是抗原结合结构域,如抗体或者其有 功能的结合结构域或抗原结合部分。示例性结合结构域包括单链抗体可变区(例如,结构域抗体、sfv、scfv、fab)、 受体胞外域(例如,pd-1)、配体(例如,细胞因子、趋化因子)或者因具有与生物分子的特异性结合能力而选择的合 成多肽。
[0244]
胞内信号传导结构域:将在本申请中所使用的术语“胞内信号传导结构域”定义为胞内效应结构域,当免疫细 胞表面的嵌合抗原受体分子机器的胞外靶标分子结合结构域识别并结合靶分子,从而通过该识别结合提供靶分子识 别结合信号输入,然后胞内部分的分子构象会发生改变从而将其激活信号传导结构域从自抑制的分子构象状态下解 开,最终在响应上游的靶分子识别结合信号输入下胞内的激活信号传导结构域得到充分的基于嵌合抗原受体分子机 器分子构象变化的激活信号传导结构域的释放与激活,且激活状态下的激活信号传导结构域可以进一步激活其下游 的多种信号通路,从而是嵌合抗原受体修饰改造的免疫细胞对靶细胞行使特定的功能,比如免疫t细胞对肿瘤细胞 的杀伤功能或吞噬细胞对肿瘤细胞的吞噬杀伤功能。在某些实施方式中,信号传导结构域激活导致宿主细胞对靶细 胞、微生物或颗粒的杀伤作用的一个或多个信号传导通路。在某些实施方式中,信号传导结构域包含至少一个胞内 激活信号传导结构域。在某些其他实施方式中,信号传导结构域包含至少一个胞内检测信号传导结构域与至少一个 胞内激活信号传导结构域。在某些其他实施方式中,信号传导结构域包含至少一个胞内检测信号传导结构域、胞内 铰链结构域与至少一个胞内激活信号传导结构域。
[0245]
胞内激活信号传导结构域:将在本申请中所使用的术语“胞内激活信号传导结构域”定义为选自具有催化功能 的非受体型络氨酸激酶或受体型络氨酸激酶分子或片段,当接受适宜信号时,在表达激活信号传导结构域的细胞中 其能够直接或间接地促进生物或生理应答。在某些实施方式中,激活信号传导结构域是结合时接收信号的蛋白或 蛋白复合物的一部分。例如,对pd-1融合的嵌合抗原受体与靶分子pd-l1的结合产生应答,激活信号传导结构域 可以向宿主细胞的内部传导信号,激发效应功能,例如t细胞有效杀伤肿瘤细胞、吞噬细胞对肿瘤细胞的吞噬作用、 吞噬溶酶体成熟、分泌抗炎性和/或免疫抑制性细胞因子、分泌炎性细胞因子和/或趋化因子。在其他实施方式中, 激活信号传导结构域将通过与一个或多个直接促进细胞应答的其他蛋白结合来间接促进细胞应答。
[0246]
检测信号传导结构域:将在本申请中所使用的术语“检测信号传导结构域”定义为免疫受体酪氨酸激活基序 (immunoreceptor tyrosine-based activation motif,itam)是一个由十多个氨基酸构成的保守序列。当酪氨酸激酶活 化信号输入时,嵌合抗原受体分子机器的检测信号传导结构域会响应信号输入并发生磷酸化修饰,进而磷酸化修饰 后的检测信号传导结构域会与激活信号传导结构域发生基于磷酸化位点修饰的相互作用,从而
将其激活信号传导结 构域从自抑制的分子构象状态下解开,释放激活信号传导结构域,在激活信号传导结构域得到释放后的分子构象下 的分子机器的激活信号传导结构域处于开放的激活状态。初级检测信号转导序列可包括已知为免疫受体酪氨酸激活 基序(itam)的信号基序。itam是在各种受体的胞质内尾中发现的良好定义的信号基序,其用作酪氨酸激酶的结合 位点。在本发明中使用的itam的实例可以包括衍生自以下各项的那些作为非限制性的实例cd244、blame、btla、 cd3δ、cd3γ、cd3ε、cd3ζ、cd5、cd6、cd23、cd28、cd31、cd72、cd84、cd229、cd300a、cd300b、 cd300c2、cd300d、cd300e、cd300f、ceacam-1、ceacam-3、ceacam-2、clec-1、clec-2、clec4b2、 clec-2a、clec2l、cracc、ctla-4、dap10、dap12、dcar、dcir、dcir4、dectin-1、dnam-1、fcα、 fcεriα、fcεriβ、fcγrib、fcγriii、fcμr/faim3、fcar、fcγri、fcγrii、fcγriii、fcγriia、fcγ riib、fcγriic、fcγriiia、fcγriiib、fcrl1、fcrl2、fcrl3、fcrl4、fcrl5、fcrl5、fcrl6、g6b、integrin α2bβ3、integrinβ3、kir、kir2dl1、kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5、kir2dl5b、 kir2ds1、kir2ds3、kir2ds4、kir2ds5、kir3dl1、kir3dl2、kir3dl3、kir3ds1、klrg1、klrg2、lair1、 lair2、lilra3、lilra4、lilra5、lilrb1、lilrb2、lilrb3、lilrb4、lilrb5、mdl-1、micl、nfam1、 nkp30、nkp44、nkp46、nkp80、ntb-a、pd-1、pdcd6、pilr-α、siglec-2、siglec-3、siglec-5、siglec-14、 siglec-6、siglec-7、siglec-8、siglec-9、siglec-10、siglec-11、siglec-12、siglec-14、siglec-15、siglec-16、siglec-e、 siglec-f、siglec-g、siglec-h、sirpβ1、sirpβ1/γ、sirpβ1a、sirpβ1b、sirpβ2、slam、tigit、 trem-3、trem-4、treml1、treml2。
[0247]
胞内间隔区结构域:位于跨膜区结构域和胞内信号传导结构域之间并将这两者连接在一起,可为跨膜区结构域 之延伸。
[0248]
跨膜区结构域:将在本申请中所使用的术语“跨膜区结构域”定义为一种跨越整个生物膜一次的多肽,用于连 接胞外靶标分子结合结构域和胞内信号传导结构域,并将二者固定在细胞膜上。
[0249]
胞内铰链结构域:将在本申请中所使用的术语“胞内铰链结构域”定义为连接检测信号传导结构域与胞内激活 信号传导结构域,可选为柔性连接肽片段。铰链结构域可提供所需的灵活性,以允许所需的嵌合多肽的表达、活性 和/或构象定位。铰链结构域可以具有任何合适的长度以连接至少两个感兴趣的结构域,并且优选设计为足够柔性以 便允许其连接的一个或两个结构域的正确折叠和/或功能和/或活性。铰链结构域的长度至少为3、5、10、15、20、 25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、90、95或100个氨基酸。在一些实施方式中, 铰链结构域的长度约0至200个氨基酸,约10至190个氨基酸,约20至180个氨基酸,约30至170个氨基酸, 约40至160个氨基酸,约50至150个氨基酸,约60至140个氨基酸,约70至130个氨基酸,约80至120个氨 基酸,约90至110个氨基酸。在一些实施方式中,铰链结构域序列可以包含内源性蛋白序列。在一些实施方式中, 铰链结构域序列包含甘氨酸、丙氨酸和/或丝氨酸残基。在一些实施方式中,铰链结构域可以含基序,例如gs,ggs, ggggs,ggsg或sggg的多个或重复基序。铰链结构域序列可以包括任何天然存在的氨基酸、非天然存在的氨 基酸或其组合。
[0250]
序列同源性:将在本申请中所使用的术语“序列同源性”定义为两个或多个核酸分子之间、两个或多个蛋白质 序列之间具有明显的编码序列上的相似性,例如具有至少80%、至少81%、至少82%、至少83%、至少84%、至 少85%、至少86%、至少87%、至少
88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、 至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或至少100%序列编码的同一性。
[0251]
宿主细胞:将在本申请中所使用的术语“宿主细胞”定义为能够接收和容纳重组分子的细胞,是重组基因扩增 表达的场所,如淋巴细胞等。
[0252]
相位对比成像:为一种基于相位对比法进行成像的技术。
[0253]
pd-l1结合片段:将在本申请中所使用的术语“pd-l1结合片段”定义为具备特异性结合pd-l1能力的分子或 分子片段,比如抗体片段等。
[0254]
肿瘤微环境(tumor microenvironment):是指肿瘤细胞存在的周围微环境,包括周围的血管、免疫细胞、成纤 维细胞、骨髓源性炎性细胞、各种信号分子和细胞外基质。肿瘤和周围环境密切相关,不断进行交互作用,肿瘤可 以通过释放细胞信号分子影响其微环境环境,促进肿瘤的血管生成和诱导免疫耐受,而微环境中的免疫细胞可影响 癌细胞增长和发育。肿瘤微环境有助于肿瘤异质性的形成。
[0255]
催化功能:机体内许多化学反应都依赖酶来进行,酶作为催化剂,以加快化学反应的速度,即具有催化功能。 其中,酪氨酸激酶(tyrosine kinase)是在细胞中催化磷酸基团从atp中转移到蛋白质的酪氨酸残基上的酶,起到调 控细胞中信号通路的“开”与“关”。如在本申请中的所使用的酪氨酸激酶,包括zap70及syk等。
[0256]
构象:指一个分子中,不改变共价键结构,仅单键周围的原子放置所产生的空间排布。不同的构象之间可以相 互转变,在各种构象形式中,势能最低、最稳定的构象是优势构象。一种构象改变为另一种构象时,不要求共价键的 断裂和重新形成。分子的构象不仅影响化合物的物理和化学性质,而且还对一些生物大分子(如蛋白质、酶、核酸) 的结构和性能产生影响。
[0257]
免疫抑制性信号相关分子:免疫检查点可以是刺激性或抑制性的信号相关分子,共刺激蛋白会传导信号促进对 病原体的免疫反应,抑制性则相反。举例说明,抑制性信号相关分子可为细胞毒性t淋巴细胞相关抗原4(ctla-4) 和程序性细胞死亡受体1(pd-1)及其配体pd-l1,是目前研究的最多的几个免疫抑制性信号相关分子。
[0258]
细胞表面特定的抗原肽-组织相容性复合体分子:在抗原呈现途径中,这些抗原决定位胜肽必须先由蛋白酶体切 割后,再与抗原加工相关传递蛋白(tap)结合,最后才能在内质网与主要组织相容性复合体(mhc)分子结合,并成 功运送到抗原呈现分子表面,即为特定的抗原肽-组织相容性复合体分子,之后于细胞表面呈递特定的抗原肽,由相 关的免疫细胞识别。
[0259]
截短体:将在本申请中所使用的术语“截短体”定义为一段序列被删除而变短的片段。
[0260]
蛋白突变体:将在本申请中所使用的术语“蛋白突变体”定义为改变原有蛋白的氨基酸序列,以期获得具有功 能或者失去功能的突变蛋白。
[0261]
免疫检查点:免疫检查点是指免疫系统的内在调控机制相关分子,可保持自身耐受性,并有助于避免在生理性 免疫应答期间的附带损伤,比如免疫检查点pd-1和ctla-4。如今,显而易见的是,肿瘤会建造微环境以逃避免疫 监视和攻击,特别是通过调节某些免疫检查点通路来进行的情况。
[0262]
免疫抑制:是指对于免疫应答的抑制作用,即机体可能会对自身组织成分不产生
免疫应答以保持自身耐受性, 也是指免疫系统对特定抗原的特异性无应答状态。
[0263]
纳武利尤单抗:(nivolumab,商品名opdivo,中文商品名欧狄沃)能抑制pd-1,阻止pd-l1与pd-1结合,提 高了肿瘤细胞的免疫原性,使t细胞发挥免疫监视的作用来清除癌细胞。其作为临床用途的一线药物,是第一个被 纳入世界卫生组织基本药物标准清单中的pd-1抑制剂。
[0264]
帕博利珠单抗:(pembrolizumab,商品名keytruda,中文商品名为可瑞达、吉舒达)是一种人源化单克隆抗体, 可结合并阻断位于淋巴细胞上的免疫检查点pd-1。该药于2014年在美国被fda批准其用于任何不可切除或转移 性实体瘤。
[0265]
嵌合:将在本申请中所使用的术语“嵌合”定义为非内源性的并且包含结合或连接在一起的序列(在自然界中通 常不会结合或连接在一起)的任何核酸分子或蛋白。例如,嵌合核酸分子可以包含来自不同来源的调控序列和编码序 列,或者来自相同来源但是以不同于天然存在的方式排列的调控序列和编码序列。
[0266]
细胞过继疗法:将在本申请中所使用的术语“细胞过继疗法”定义为一种利用患者自身免疫细胞去攻击其特定 癌细胞的个体化治疗方法。嵌合抗原受体t细胞(car-t)细胞疗法是细胞过继疗法的一种,使用经过基因修饰的 t细胞对抗癌症。通过单采淋巴细胞的方式分离和收集患者的t细胞,并对其进行修饰使其表面产生嵌合抗原受体 的特殊抗体结构,之后回输患者本体。修饰后的car-t细胞可以靶向癌细胞表面的特异性抗原,从而杀死癌细胞。
[0267]
辐照:将在本申请中所使用的术语“辐照”定义为利用放射性元素的辐射去改变分子结构的一种化工技术。
[0268]“核酸分子”和“多核苷酸”:将在本申请中所使用的术语“核酸分子”和“多核苷酸”定义为rna或dna 形式,其包括cdna、基因组dna和合成dna。核酸分子可以是双链的或单链的,如果是单链的,可以是编码链 或非编码链(反义链)。编码分子可以具有与本领域公知的编码序列相同的编码序列,或者可以具有不同的编码序列, 但是由于遗传密码的冗余性或简并性其能够编码相同多肽。
[0269]“阳性”:将在本申请中所使用的术语“阳性”定义为特定细胞有一定水平的特定分子标记物表达。比如,pd-l1 阳性肿瘤细胞指肿瘤细胞有一定水平的pd-l1蛋白分子的表达。
[0270]“高表达”:将在本申请中所使用的术语“高表达”定义为特定细胞有高水平的特定分子标记物表达。比如, pd-l1高表达的肿瘤细胞指肿瘤细胞有高水平的pd-l1蛋白分子的表达。高表达的肿瘤细胞标记物通常与疾病状态 相关,如在恶性血液病和在对象的特定组织或器官内形成实体瘤的细胞中。可以通过本领域公知的标准测定确定由 肿瘤标记物高表达表征的恶性血液病或实体瘤。
[0271]
癌症:将在本申请中所使用的术语“癌症”定义为以异常细胞的快速和失控生长为特征的疾病。异常细胞可以 形成实体瘤或构成恶性血液病。癌细胞可以局部扩散或通过血流和淋巴系统扩散到身体的其他部位。各种癌症的实 例包括但不限于乳腺癌、前列腺癌、卵巢癌、宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、脑癌、淋巴瘤、 白血病、肺癌等。
[0272]
治疗:将在本申请中所使用的术语“治疗”定义为获得有益或期望的临床效果的方法。出于本发明的目的,有 益或期望的临床效果包括但不限于如下的一种或多种:减少肿
瘤或癌细胞的增殖(或破坏肿瘤或癌细胞),抑制肿瘤 细胞转移,使表达pd-l1的肿瘤收缩或减小其尺寸,使pd-l1相关疾病(例如癌症)消退,减轻因pd-l1相关疾病(例 如癌症)导致的症状,提高患有pd-l1相关疾病(例如癌症)的那些患者的生活质量,降低治疗pd-l1相关疾病(例如 癌症)所需其它药物的剂量,延迟pd-l1相关疾病(例如癌症)进展,治愈pd-l1相关疾病(例如癌症),和/或延长患 有pd-l1相关疾病(例如癌症)的患者的存活期。
[0273]
载体:将在本申请中所使用的术语“载体”定义为能够转运另一核酸的核酸分子。载体可以是例如质粒、粘粒、 病毒或噬菌体。还应将该术语解释为包括促进核酸转移至细胞中的非质粒和非病毒化合物。“表达载体”指当其存 在于适宜环境中时能够指引由载体携带的一个或多个基因编码的蛋白表达的载体。在某些实施方式中,载体是病毒 载体。病毒载体的实例包括但不限于腺病毒载体、腺相关病毒载体、逆转录病毒载体、γ逆转录病毒载体和慢病毒 载体。“逆转录病毒”是具有rna基因组的病毒。“γ逆转录病毒”指逆转录病毒科的一个属。γ逆转录病毒的实 例包括小鼠干细胞病毒、小鼠白血病病毒、猫白血病病毒、猫肉瘤病毒和禽类网状内皮细胞增生病毒。“慢病毒
”ꢀ
指能够感染分裂和非分裂细胞的逆转录病毒的一个属。慢病毒的实例包括但不限于hiv(人类免疫缺陷病毒,包括1 型hiv和2型hiv)、马感染性贫血病毒、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)和猿猴免疫缺陷病毒(siv)。 在其他实施方式中,载体是非病毒载体。非病毒载体的实例包括基于脂质的dna载体、经修饰的mrna(modrna)、 自身扩增mrna、封闭式线形双链体(celid)dna和转座子介导的基因转移(piggybac,sleeping beauty)。当使用非 病毒递送系统时,递送载剂可以是脂质体。可以使用脂质制剂在体外、离体或体内将核酸引入宿主细胞。核酸可以 包封在脂质体内部,散布在脂质体的脂质双层内、通过将脂质体与核酸结合在一起的连接分子附接至脂质体,包含 在胶束内或与之复合或者以其他方式与脂质结合。
[0274]
其它定义贯穿于本公开内容通篇之中。
[0275]
实施例1嵌合抗原受体的构建与表达
[0276]
构建免疫检查点pd-1融合的嵌合抗原受体分子机器及载体。
[0277]
(1)将嵌合抗原受体的胞内部分的胞内信号传导结构域(包括作为激活元件的胞内激活信号传导结构域、作 为检测元件的胞内检测信号传导结构域及作为连接元件的胞内铰链结构域)与作为胞外识别元件的胞外靶标分子结 合结构域、跨膜区结构域以及胞外间隔区结构域、胞内间隔区结构域(请见图1)通过基因工程手段,使用gibsonassembly无缝克隆连接进行连接融合,并最终克隆到特定的基因表达载体(如psin慢病毒载体或pmscv逆转录 病毒载体或pcag或pcdna3等)上进行后续体外与体内研究。其中如图1(h),胞外靶标分子结合结构域可选为 pd-l1受体pd-1的配体识别结合部分,胞外间隔区结构域可选为pd-1的跨膜区部分的胞外延伸片段(即胞外靶标 分子pd-l1结合结构域与pd-1的跨膜区之间),跨膜区结构域可选为pd-1的跨膜区部分,胞内间隔区结构域可选 为pd-1的跨膜区部分的胞内延伸片段(即图28中full-length pd-1或truncated pd-1的胞内部分),胞内检测信号 传导结构域可选为cd3ζ、cd3ε、fcriia、fcrγ、dap12等分子的免疫受体酪氨酸活化基序片段部分(即图28中 sub1~sub7:cd3ζitam1~3、cd3ε itam、fcriia itam、fcrγ itam、dap12 itam),胞内激活信号传导结构域 可选为syk/zap70家族成员等的酪氨酸激酶部分,连接胞内检测信号传导结构域与胞内激活信号传导结构域的胞 内铰链结构域可选为柔性连接肽片段(即图28中的不同长度连接肽:sl、ml、ll1、ll2),请见图1和图28。 分别构建了
图28中所列举的多种不同版本的嵌合抗原受体分子机器,包括基于免疫检查点pd-1融合的嵌合抗原受 体:c#1 full-length pd-1、c#2 truncated pd-1、c#3 truncated pd-1-sub1-ll1-zap70、c#4 truncatedpd-1-sub1-ll1-zap70-δkd、c#5 truncated pd-1-sub5-ll1-syk、c#6 truncated pd-1-sub6-ll1-syk、c#7 truncatedpd-1-sub7-ll1-syk、c#8 truncated pd-1-sub4-ll1-syk、c#9 sub1-ll2-zap70、c#10 sublff-ll2-zap70、c#11sub2-ll2-zap70、c#12 sub2ff-ll2-zap70、c#13 sub3-ll2-zap70、c#14 sub3ff-ll2-zap70、c#15 sub4-ll2-syk、 c#16 sub4ff-ll2-syk、c#17 full-length pd-1-sub1-ll2-zap70、c#18 full-length pd-1-sub1ff-ll2-zap70、c#19 truncated pd-1-sub1-ll2-zap70、c#20 truncated pd-1-sub1ff-ll2-zap70、c#21 truncated pd-1-sub4-ll2-syk、 c#22 truncated pd-1-sub4ff-ll2-syk、c#23 truncated pd-1-sub1-ll2-zap70-δkd、c#24 truncatedpd-1-sub1-ml-zap70、c#25 truncated pd-1-sub1ff-ml-zap70、c#26 truncated pd-1-sub1-sl-zap70以及c#27truncated pd-1-sub1ff-sl-zap70。
[0278]
(2)通过dna脂质体转染或dna电穿孔转染的方法,实现特定细胞中表达不同的基于免疫检查点pd-1融 合的嵌合抗原受体人工分子机器。然后,使用荧光显微镜成像方法去检测不同设计的基于免疫检查点pd-1融合的 嵌合抗原受体人工分子机器在人源hela细胞、小鼠胚胎成纤维细胞mef和人源jurkat e6-1细胞内的表达分布及 响应多种不同外界刺激性输入信号的表现,请见图2以及图6至图11。人源hela细胞和小鼠胚胎成纤维细胞mef 使用含10%胎牛血清的dmem培养基培养,人源jurkat e6-1细胞使用含10%胎牛血清的rpmi培养基培养。
[0279]
另一方面,通过dna脂质体转染,实现在人源293t细胞中表达不同的嵌合抗原受体蛋白并分离纯化,然后使 用纯化后的蛋白进行细胞外功能性测试与验证,尤其是比较不同的胞内检测信号传导结构域和胞内激活信号传导结 构域对特异性的蛋白酪氨酸磷酸化信号输入的影响,请见图2(a)与图5。人源293t细胞使用含10%胎牛血清的 dmem培养基培养。
[0280]
实施例2嵌合抗原受体的检测与表征
[0281]
结合图1和图2所提供信息,设定多种人工分子机器的检测与表征方案,包括但不限于,通过不同手段来检测 并表征嵌合抗原受体在真核细胞内的功能表现,以及通过纯化蛋白的形式检测并表征嵌合抗原受体在细胞外的功能 表现。
[0282]
其中,图2显示了含有胞外靶标分子结合结构域的嵌合抗原受体人工分子机器的信号激活示意图简图且(a) 为在酪氨酸激酶活化信号输入的情况下人工分子机器的信号激活示意图,(b)为在靶分子识别结合信号输入(如 pd-l1)的情况下含有胞外靶标分子结合结构域(如pd-1胞外部分)的嵌合抗原受体人工分子机器的信号激活示意 图。
[0283]
图2(a)的分子机器工作模型为简化模型,即仅包含三部分:检测信号传导结构域、铰链结构域及激活信号传 导结构域。其中检测信号传导结构域可选为cd3ζ、cd3ε、fcriia、fcrγ、dap12等分子的免疫受体酪氨酸活化基 序片段部分(即图28中sub1~sub7:cd3ζ itam1~3、cd3ε itam、fcriia itam、fcrγ itam、dap12 itam), 激活信号传导结构域可选为syk/zap70家族成员等的酪氨酸激酶部分,连接检测信号传导结构域与胞内激活信号 传导结构域的铰链结构域可选为柔性连接肽片段。
[0284]
基于syk/zap70家族成员的分子构象的特点,在其没有激活的状态下,syk或zap70会处于自抑制的分子构 象状态(yan q等,molecular and cellular biology.2013jun 1;
33(11):2188-201.),此构象下分子机器的激活信号传导 结构域处于关闭的非激活状态;当酪氨酸激酶活化信号输入时,尤其是免疫受体酪氨酸激活基序的磷酸化信号输入, 分子机器的检测信号传导结构域会响应信号输入并发生磷酸化修饰,进而磷酸化修饰后的检测信号传导结构域会与 syk或zap70发生基于磷酸化位点修饰的相互作用,尤其是在铰链结构域的柔性连接肽片段提供充足的分子机器 构象改变灵活度的情况下,从而将其激活信号传导结构域从自抑制的分子构象状态下解开,释放激活信号传导结构 域,在激活信号传导结构域得到释放后的分子构象下的分子机器的激活信号传导结构域处于开放的激活状态,即图 2(a)所示的在酪氨酸激酶活化信号输入的情况下人工分子机器的信号激活示意图,且激活状态下的激活信号传导 结构域可以进一步激活其下游的多种信号通路。基于该工作原理,使用荧光能量共振转移的显微镜成像方法 (ishikawa-ankerhold hc等,molecules.2012apr;17(4):4047-132.)去检测不同设计的嵌合抗原受体人工分子机器在 响应不同外界刺激性输入信号时相应的检测信号传导结构域磷酸化表现和激活信号传导结构域部分分子构象的状 态变化以及相应的激活状态表现。
[0285]
图2(b)的分子机器工作模型为与图2(a)工作原理相似的模型,包括七部分:胞外的靶分子结合结构域、 胞外间隔区结构域、跨膜区结构域、胞内间隔区结构域、胞内检测信号传导结构域、胞内铰链结构域及胞内激活信 号传导结构域。如图1(h)所示,胞外靶标分子结合结构域可选为pd-l1受体pd-1的配体识别结合部分,胞外间 隔区结构域可选为pd-1的跨膜区部分的胞外延伸片段(即胞外靶标分子pd-l1结合结构域与pd-1的跨膜区之间), 跨膜区结构域可选为pd-1的跨膜区部分,胞内间隔区结构域可选为pd-1的跨膜区部分的胞内延伸片段(即图28 中truncated pd-1的胞内部分),胞内检测信号传导结构域可选为cd3ζ、cd3ε、fcriia、fcrγ、dap12等分子的 免疫受体酪氨酸活化基序片段部分(即图28中sub1~sub7:cd3ζ itam1~3、cd3ε itam、fcriia itam、fcrγ itam、 dap12 itam),胞内激活信号传导结构域可选为syk/zap70家族成员等的酪氨酸激酶部分,连接胞内检测信号传 导结构域与胞内激活信号传导结构域的胞内铰链结构域可选为柔性连接肽片段(即图28中的不同长度连接肽:sl、 ml、ll1、ll2),请见图1(h)和图28。
[0286]
再次地,基于syk/zap70家族成员的分子构象的特点,在其没有激活的状态下,syk或zap70会处于自抑制 的分子构象状态,此构象下分子机器的胞内激活信号传导结构域处于关闭的非激活状态;当靶细胞的靶分子存在时, 免疫细胞表面的嵌合抗原受体分子机器的胞外靶分子结合结构域会识别并结合靶分子,从而通过该识别结合提供靶 分子识别结合信号输入,然后胞内部分的分子构象会发生与上述图2(a)所述类似的变化,最终在响应上游的靶分 子识别结合信号输入下胞内的激活信号传导结构域得到充分的基于嵌合抗原受体分子机器分子构象变化的激活信 号传导结构域的释放与激活,且激活状态下的激活信号传导结构域可以进一步激活其下游的多种信号通路,从而是 嵌合抗原受体修饰改造的免疫细胞对靶细胞行使特定的功能,如免疫t细胞对肿瘤细胞的杀伤功能等。故,图2(b) 为所示的在靶分子识别结合信号输入的情况下嵌合抗原受体人工分子机器的信号激活示意图。同样地,类比上述图 2(a)部分,基于该工作原理,使用荧光能量共振转移的显微镜成像方法去检测不同设计的嵌合抗原受体人工分子 机器在响应不同外界刺激性输入信号时相应的检测信号传导结构域磷酸化表现和激活信号传导结构域部分分子构 象的状态变化以及相应的激活状态表现。
[0287]
综上,基于显微镜成像方法去检测不同设计的嵌合抗原受体人工分子机器在响应不同外界刺激性输入信号。此 外,为了量化分析的便利,采用成像读数指标来代表嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号 同时引发的嵌合抗原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。
[0288]
利用色谱纯化技术和4℃蛋白质透析从转染的293t细胞中纯化蛋白质c#9和c#10,然后将纯化后的分子机器 蛋白质溶解于激酶缓冲溶液(ph为8左右的50mm tris盐酸盐溶液,100mm氯化钠,10mm氯化镁,2mm二硫 苏糖醇)浓度可为50nm,加入提供磷酸化所需底物1mm atp和100nm活化状态的非受体型蛋白酪氨酸激酶lck 蛋白。这里,lck蛋白可以提供免疫受体酪氨酸激活基序的磷酸化信号输入。检测加入atp与lck前后的光学信号 并进行量化分析,见图2(a)中人工分子机器的信号激活模式。
[0289]
图5的直方图的c#9(+)组(n=3)证明了实验组的嵌合抗原受体c#9版本中所包含的胞内检测信号传导结 构域sub1对蛋白酪氨酸磷酸化信号非常出色的响应能力(c#9(+)组平均值为0.8)以及嵌合抗原受体c#9版本 相应的非常明显分子构象的改变并对其自身激活元件——胞内激活信号传导结构域zap70的非常充分显著释放与 激活。此外,c#10(+)组(n=3)证明了,在自身检测元件被失能的情况下(失活性突变体sub1ff),对照组的 嵌合抗原受体c#10版本较实验组的嵌合抗原受体c#9版本具有统计分析后显著差异的更弱的对蛋白酪氨酸磷酸化 信号的响应能力(c#10(+)组平均值为0.078),证明嵌合抗原受体c#9版本所包含的胞内检测信号传导结构域对 蛋白酪氨酸磷酸化信号出色响应能力的重要性且嵌合抗原受体c#9版本具有极佳的对蛋白酪氨酸磷酸化信号响应 的特异性。其中,嵌合抗原受体c#9和c#10版本所包含的各组成部分信息请见图28以及本申请相关内容。在此, 非受体型蛋白酪氨酸激酶lck可以促进蛋白酪氨酸磷酸化信号的激活,起到提供特异性的蛋白酪氨酸磷酸化信号输 入的作用。
[0290]
利用脂质体转染方式来实现在人源细胞中表达不同的分子机器蛋白,从而使用荧光显微镜成像方法去检测并表 征不同人工分子机器在人源hela细胞与小鼠胚胎成纤维细胞mef内响应多种不同外界刺激性输入信号的表现。
[0291]
图6(a)的直方图证明了在人源hela细胞中实验组的人工分子机器c#9版本和c#15版本中所包含的胞内检 测信号传导结构域sub1和sub4对蛋白酪氨酸磷酸化信号非常出色的响应能力以及人工分子机器c#9版本和c#15 版本相应的非常明显分子构象的改变并对其自身激活元件——胞内激活信号传导结构域(zap70和syk)的非常 充分显著释放与激活,且显著优于实验组的人工分子机器c#11版本和c#13版本。此外,在自身激活元件被失能的 情况下(失活性突变体sub1ff~sub4ff),对照组的人工分子机器c#10、c#12、c#14、c#16版本分别较相对应实 验组的人工分子机器c#9、c#11、c#13、c#15版本具有统计分析后显著差异的更弱的近乎为零的对蛋白酪氨酸磷 酸化信号的响应能力,证明人工分子机器c#9、c#11、c#13和c#15版本所包含的胞内检测信号传导结构域 (sub1~sub4)对蛋白酪氨酸磷酸化信号出色响应能力的重要性且人工分子机器c#9版本(subl)和c#15版本(sub4) 较人工分子机器c#11版本(sub2)和c#13版本(sub3)具有统计分析后显著差异的更佳的对蛋白酪氨酸磷酸化 信号响应能力及敏感性。人工分子机器c#9至c#16版本所包含的各组成部分信息请见图28以及本申请相关内容。 在此,酪氨酸磷酸酶抑制剂过钒酸钠(20um)可以抑制细胞内蛋白去磷酸化作用,从而促进蛋白酪氨酸磷酸化信 号的激活,起到提供蛋白酪氨酸
磷酸化信号输入的作用。
[0292]
图6(b)显示了在20um酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的a条件或在50ng/ml表 皮生长因子(egf)激活信号的b条件下,不同的人工分子机器在人源hela细胞中表现结果的直方图(数据显示 为平均值
±
标准差,c#9-a组和c#15-a组均为n=5,c#9-b组和c#15-b组均为n=3),成像读数指标代表量化 后人工分子机器对刺激信号的响应能力的程度以及响应刺激信号同时引发的人工分子机器基于分子构象改变的对 其自身激活元件的释放与激活的程度。而且,图6(b)的直方图证明了在人源hela细胞中实验组的人工分子机器 c#9版本和c#15版本中所包含的胞内检测信号传导结构域(sub1和sub4)对蛋白酪氨酸磷酸化信号非常出色的响 应能力以及人工分子机器c#9版本和c#15版本相应的非常明显分子构象的改变并对其自身激活元件——胞内激活 信号传导结构域(zap70和syk)的非常充分显著释放与激活。此外,在表皮生长因子激活信号的条件下,实验 组的人工分子机器c#9版本和c#15版本具有统计分析后显著差异的更弱的近乎为零的对该信号的响应能力,证明 人工分子机器c#9版本和c#15版本所包含的胞内检测信号传导结构域(sub1和sub4)对蛋白酪氨酸磷酸化信号 出色响应能力的重要性且保证了人工分子机器对特定的蛋白酪氨酸磷酸化信号的特异性响应,而不会响应不相关的 信号输入,比如表皮生长因子激活信号。人工分子机器c#9版本和c#15版本所包含的各组成部分信息请见图28 以及本申请相关内容。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋白去磷酸化作用,从而促进蛋白酪氨 酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用;表皮生长因子可以结合hela细胞表面的表皮 生长因子受体从而提供表皮生长因子激活信号,该信号不参与免疫受体酪氨酸激活基序的磷酸化,故无法特异性地 被人工分子机器c#9版本和c#15版本所包含的胞内检测信号传导结构域所检测到。
[0293]
图6(c)显示了在20um酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的a条件或在50ng/ml血 小板源生长因子(pdgf)激活信号的b条件下,不同的人工分子机器在小鼠胚胎成纤维细胞(mef)中表现结果 的直方图(c#9-a组、c#9-b组、c#15-a组和c#15-b组均为n=5),成像读数指标代表量化后人工分子机器对刺 激信号的响应能力的程度以及响应刺激信号同时引发的人工分子机器基于分子构象改变的对其自身激活元件的释 放与激活的程度。而且,图6(c)的直方图证明了在小鼠胚胎成纤维细胞中实验组的人工分子机器c#9版本和c#15 版本中所包含的胞内检测信号传导结构域(sub1和sub4)对蛋白酪氨酸磷酸化信号非常出色的响应能力以及人工 分子机器c#9版本和c#15版本相应的非常明显分子构象的改变并对其自身激活元件——胞内激活信号传导结构域 (zap70和syk)的非常充分显著释放与激活。此外,在血小板源生长因子激活信号的条件下,实验组的人工分 子机器c#9版本和c#15版本具有统计分析后显著差异的更弱的近乎为零的对该信号的响应能力,证明人工分子机 器c#9版本和c#15版本所包含的胞内检测信号传导结构域(sub1和sub4)对蛋白酪氨酸磷酸化信号出色响应能 力的重要性且保证了人工分子机器对特定的蛋白酪氨酸磷酸化信号的特异性响应,而不会响应不相关的信号输入, 比如血小板源生长因子激活信号。人工分子机器c#9版本和c#15版本所包含的各组成部分信息请见图28以及本申 请相关内容。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋白去磷酸化作用,从而促进蛋白酪氨酸磷酸化 信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用;血小板源生长因子可以结合小鼠胚胎成纤维细胞表面的 血小板源生长因子受体从而
提供血小板源生长因子激活信号,该信号不参与免疫受体酪氨酸激活基序的磷酸化,故 无法特异性地被人工分子机器c#9版本和c#15版本所包含的胞内检测信号传导结构域所检测到。
[0294]
利用脂质体转染方式来实现在人源细胞中表达不同的嵌合抗原受体蛋白,从而使用荧光显微镜成像方法去检测 并表征不同的基于免疫检查点pd-1融合的嵌合抗原受体在人源hela细胞内的表达分布及响应多种不同外界刺激性 输入信号的表现。
[0295]
图7(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中的表达分 布及在20um酪氨酸磷酸酶抑制剂过钒酸钠刺激下响应蛋白酪氨酸磷酸化信号能力的检测结果。其中,实验组为具 有本公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#17版本修饰的人源hela细胞,对照组为具有本公开 内容的基于免疫检查点pd-1融合的嵌合抗原受体c#18版本修饰的人源hela细胞,图片下方的色彩条热图由左至 右依次代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子 构象改变的对其自身激活元件——胞内激活信号传导结构域的释放与激活程度的由低到高。首先,如图7(a)所示 pd-1融合的嵌合抗原受体c#17版本和c#18版本均在人源hela细胞的表面展示出正确的膜定位表达分布,未有 任何其它错误的蛋白定位。另外,实验组c#17版本修饰的人源hela细胞显示出快速且显著的对酪氨酸磷酸酶抑 制剂过钒酸钠刺激的蛋白酪氨酸磷酸化信号的响应能力,在刺激后的半小时左右时间内展现出了极为显著的对刺激 信号响应能力及基于分子构象改变的对其自身胞内激活信号传导结构域的释放与激活;而对照组c#18版本修饰的 人源hela细胞显示出显著较弱的对酪氨酸磷酸酶抑制剂过钒酸钠刺激的蛋白酪氨酸磷酸化信号的响应能力,在刺 激后无法展现出有效的对刺激信号响应能力及基于分子构象改变的对其自身胞内激活信号传导结构域的释放与激 活。以上结果充分证明了图2所示的人工分子机器的信号在人源细胞中的激活模式。
[0296]
图7(a)证明了在人源hela细胞中嵌合抗原受体c#17版本中所包含的胞内检测信号传导结构域(sub1)对 蛋白酪氨酸磷酸化信号出色的响应能力以及嵌合抗原受体c#17版本相应的明显分子构象的改变并对其自身激活元 件——胞内激活信号传导结构域zap70的充分显著释放与激活。此外,在自身激活元件被失能的情况下(失活性 突变体sub1ff),对照组的人工分子机器c#18版本较相实验组的人工分子机器c#17版本具有显著更弱的近乎为零 的对蛋白酪氨酸磷酸化信号的响应能力,证明人工分子机器c#17版本所包含的胞内检测信号传导结构域(sub1) 对蛋白酪氨酸磷酸化信号出色响应能力的重要性及特异性。基于免疫检查点pd-1融合的嵌合抗原受体c#17和c#18 版本所包含的各组成部分信息请见图28以及本申请相关内容。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞 内蛋白去磷酸化作用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用。
[0297]
图7(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中的表达分 布及在20um酪氨酸磷酸酶抑制剂过钒酸钠刺激下响应蛋白酪氨酸磷酸化信号能力的检测结果。其中,实验组为具 有本公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源hela细胞,对照组为具有本公开 内容的基于免疫检查点pd-1融合的嵌合抗原受体c#20版本修饰的人源hela细胞,图片下方的色彩条热图由
左至 右依次代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子 构象改变的对其自身激活元件——胞内激活信号传导结构域的释放与激活程度的由低到高。首先,如图7(b)所示 pd-1融合的嵌合抗原受体c#19版本和c#20版本均在人源hela细胞的表面展示出正确的膜定位表达分布,未有 任何其它错误的蛋白定位。另外,实验组c#19版本修饰的人源hela细胞显示出快速且显著的对酪氨酸磷酸酶抑 制剂过钒酸钠刺激的蛋白酪氨酸磷酸化信号的响应能力,在刺激后的半小时左右时间内展现出了极为显著的对刺激 信号响应能力及基于分子构象改变的对其自身胞内激活信号传导结构域的释放与激活;而对照组c#20版本修饰的 人源hela细胞显示出近乎为零的极弱的对酪氨酸磷酸酶抑制剂过钒酸钠刺激的蛋白酪氨酸磷酸化信号的响应能力, 在刺激后无法展现出有效的对刺激信号响应能力及基于分子构象改变的对其自身胞内激活信号传导结构域的释放 与激活。以上结果充分证明了图2所示的人工分子机器在人源细胞中的信号激活模式。
[0298]
图7(b)证明了在人源hela细胞中嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对 蛋白酪氨酸磷酸化信号出色的响应能力以及嵌合抗原受体c#19版本相应的明显分子构象的改变并对其自身激活元 件——胞内激活信号传导结构域的充分显著释放与激活。此外,在自身激活元件被失能的情况下(失活性突变体 sub1ff),对照组的人工分子机器c#20版本较相实验组的人工分子机器c#19版本具有显著更弱的近乎为零的对蛋 白酪氨酸磷酸化信号的响应能力,证明人工分子机器c#19版本所包含的胞内检测信号传导结构域(sub1)对蛋白 酪氨酸磷酸化信号出色响应能力的重要性及特异性。基于免疫检查点pd-1融合的嵌合抗原受体c#19和c#20版本 所包含的各组成部分信息请见图28以及本申请相关内容。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋 白去磷酸化作用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用。
[0299]
图7(c)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的条件下,不同的基于免疫检查点 pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#17 组至c#20组均为n=10),成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号 同时引发的嵌合抗原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。而且,图7(c)的直方图证 明了在人源hela细胞中实验组的嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对蛋白酪 氨酸磷酸化信号非常出色的响应能力(c#19组平均值为2.841)以及嵌合抗原受体c#19版本相应的非常明显分子 构象的改变并对其自身激活元件——胞内激活信号传导结构域的非常充分显著释放与激活,且统计分析后显著差异 的优于实验组的嵌合抗原受体c#17版本(c#17组平均值为2.484)。此外,在自身激活元件被失能的情况下(失活 性突变体sub1ff),对照组的嵌合抗原受体c#20版本较对照组的嵌合抗原受体c#18版本具有统计分析后显著差异 的更弱的对蛋白酪氨酸磷酸化信号的响应能力(c#20组平均值为0.0549,c#18组平均值为0.344),证明嵌合抗原 受体c#19版本和c#17版本所包含的胞内检测信号传导结构域对蛋白酪氨酸磷酸化信号出色响应能力的重要性且嵌 合抗原受体c#19版本较嵌合抗原受体c#17版本具有显著更佳的对蛋白酪氨酸磷酸化信号响应的特异性,说明c#19 版本所采用的胞内间隔区结构域较c#17版本的胞内间隔区
结构域具备更优异的功能表现。
[0300]
利用dna电穿孔转染方式来实现在人源细胞中表达不同的嵌合抗原受体蛋白,从而使用荧光显微镜成像方法 去检测并表征不同的基于免疫检查点pd-1融合的嵌合抗原受体在人源jurkat e6-1 t淋巴细胞内的表达分布及响应 多种不同外界刺激性输入信号的表现。
[0301]
图8(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源jurkat e6-1 t淋巴细胞 中的表达分布及在20um酪氨酸磷酸酶抑制剂过钒酸钠刺激下响应蛋白酪氨酸磷酸化信号能力的检测结果。其中, 实验组为具有本公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源jurkat e6-1 t淋巴细胞, 对照组为具有本公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#20版本修饰的人源jurkat e6-1 t淋巴细胞, 图片下方的色彩条热图由左至右依次代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时 引发的嵌合抗原受体基于分子构象改变的对其自身激活元件——胞内激活信号传导结构域的释放与激活程度的由 低到高。首先,如图8(a)所示pd-1融合的嵌合抗原受体c#19版本和c#20版本均在人源jurkat e6-1 t淋巴细胞 的表面展示出正确的膜定位表达分布,未有任何其它错误的蛋白定位。另外,实验组c#19版本修饰的人源jurkat e6-1t淋巴细胞显示出快速且显著的对酪氨酸磷酸酶抑制剂过钒酸钠刺激的蛋白酪氨酸磷酸化信号的响应能力,在刺激 后的半小时左右起开始展现出了极为显著的对刺激信号响应能力及基于分子构象改变的对其自身胞内激活信号传 导结构域的释放与激活;而对照组c#20版本修饰的人源jurkat e6-1 t淋巴细胞显示出近乎为零的极弱的对酪氨酸 磷酸酶抑制剂过钒酸钠刺激的蛋白酪氨酸磷酸化信号的响应能力,在刺激后无法展现出有效的对刺激信号响应能力 及基于分子构象改变的对其自身胞内激活信号传导结构域的释放与激活。以上结果充分证明了图2所示的人工分子 机器在人源淋巴细胞中的信号激活模式。
[0302]
图8(a)证明了在人源淋巴细胞中嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对蛋 白酪氨酸磷酸化信号出色的响应能力以及嵌合抗原受体c#19版本相应的明显分子构象的改变并对其自身激活元件 ——胞内激活信号传导结构域的充分显著释放与激活。此外,在自身激活元件被失能的情况下(失活性突变体 sub1ff),对照组的人工分子机器c#20版本较相实验组的人工分子机器c#19版本具有显著更弱的近乎为零的对蛋 白酪氨酸磷酸化信号的响应能力,证明人工分子机器c#19版本所包含的胞内检测信号传导结构域(sub1)对蛋白 酪氨酸磷酸化信号出色响应能力的重要性及特异性。基于免疫检查点pd-1融合的嵌合抗原受体c#19和c#20版本 所包含的各组成部分信息请见图28以及本申请相关内容。在此,酪氨酸磷酸酶抑制剂过钒酸钠可以抑制细胞内蛋 白去磷酸化作用,从而促进蛋白酪氨酸磷酸化信号的激活,起到提供蛋白酪氨酸磷酸化信号输入的作用。
[0303]
图8(b)显示了在酪氨酸磷酸酶抑制剂过钒酸钠激活蛋白酪氨酸磷酸化信号的条件下,不同的基于免疫检查点 pd-1融合的嵌合抗原受体人工分子机器在人源jurkat e6-1细胞中表现结果的直方图(数据显示为平均值
±
标准差, c#19组和c#20组均为n=10),成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺 激信号同时引发的嵌合抗原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。而
且,图8(b)的直 方图证明了在人源淋巴细胞中实验组的嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对蛋 白酪氨酸磷酸化信号非常出色的响应能力(c#19组平均值为0.815)以及嵌合抗原受体c#19版本相应的非常明显 分子构象的改变并对其自身激活元件——胞内激活信号传导结构域的非常充分显著释放与激活。此外,在自身激活 元件被失能的情况下(失活性突变体sub1ff),对照组的嵌合抗原受体c#20版本较实验组的嵌合抗原受体c#19 版本具有统计分析后显著差异的更弱的对蛋白酪氨酸磷酸化信号的响应能力(c#20组平均值为0.0409),证明嵌合 抗原受体c#19版本所包含的胞内检测信号传导结构域对蛋白酪氨酸磷酸化信号出色响应能力的重要性且嵌合抗原 受体c#19版本具有极佳的对蛋白酪氨酸磷酸化信号响应的特异性,说明c#19版本所采用的胞内间隔区结构域具备 非常优异的功能表现。
[0304]
利用脂质体转染或dna电穿孔转染方式来实现在人源细胞中表达不同的嵌合抗原受体蛋白,从而使用荧光显 微镜成像方法去检测并表征不同的基于免疫检查点pd-1融合的嵌合抗原受体在人源hela细胞核人源jurkat e6-1 t 淋巴细胞内的表达分布及响应生理特异性人源pd-l1信号输入的表现,所使用的生理特异性人源pd-l1信号为人 源pd-l1修饰的微球(human pd-l1-coated bead particles)。
[0305]
图9(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源hela细胞中的表达分 布及在人源pd-l1修饰的微球刺激下响应人源pd-l1信号能力的检测结果。其中,实验组为具有本公开内容的基 于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源hela细胞,对照组为具有本公开内容的基于免疫检 查点pd-1融合的嵌合抗原受体c#20版本修饰的人源hela细胞,图片右方的色彩条热图由左至右依次代表嵌合抗 原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗原受体基于分子构象改变的对其自 身激活元件——胞内激活信号传导结构域zap70的释放与激活程度的由低到高,所提供的相位对比成像实验图片 提供了细胞与微球相互作用的图像信息。
[0306]
首先,如图9(a)所示pd-1融合的嵌合抗原受体c#19版本和c#20版本均在人源hela细胞的表面展示出正 确的膜定位表达分布,未有任何其它错误的蛋白定位。另外,实验组c#19版本修饰的人源hela细胞显示出快速 且显著的对人源pd-l1修饰的微球刺激信号的响应能力,在刺激后的10分钟左右起开始展现出了极为显著的对刺 激信号响应能力及基于分子构象改变的对其自身胞内激活信号传导结构域的释放与激活,且所示的对人源pd-l1 修饰的微球刺激信号的响应具有高度特异性的空间特点,即仅局部地在相位对比成像实验图片中细胞与微球相互作 用的位置展示出响应能力;而对照组c#20版本修饰的人源hela细胞显示出显著较弱的对人源pd-l1修饰的微球 刺激信号的响应能力,在刺激后无法展现出有效的对刺激信号响应能力及基于分子构象改变的对其自身胞内激活信 号传导结构域的释放与激活。以上结果充分证明了图2(b)所示的人工分子机器在人源细胞中的信号激活模式。
[0307]
图9(a)证明了在人源hela细胞中嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对 人源pd-l1信号出色的响应能力以及嵌合抗原受体c#19版本相应的明显分子构象的改变并对其自身激活元件—— 胞内激活信号传导结构域zap70的充分显著释放与激活。此外,在自身激活元件被失能的情况下(失活性突变体 sub1ff),对照组
的人工分子机器c#20版本较相实验组的人工分子机器c#19版本具有显著更弱的对人源pd-l1 信号的响应能力,证明人工分子机器c#19版本所包含的胞内检测信号传导结构域(sub1)对人源pd-l1信号出色 响应能力的重要性及特异性。基于免疫检查点pd-1融合的嵌合抗原受体c#19和c#20版本所包含的各组成部分信 息请见图28以及本申请相关内容。在此,人源pd-l1修饰的微球起到提供人源pd-l1信号输入的作用。
[0308]
图9(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器在人源jurkat e6-1 t淋巴细胞 中的表达分布及在人源pd-l1修饰的微球刺激下响应人源pd-l1信号能力的检测结果。其中,实验组为具有本公 开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#19版本修饰的人源jurkat e6-1 t淋巴细胞,对照组为具有本 公开内容的基于免疫检查点pd-1融合的嵌合抗原受体c#20版本修饰的人源jurkat e6-1 t淋巴细胞,图片右方的色 彩条热图由左至右依次代表嵌合抗原受体对刺激信号的响应能力的由低到高以及响应刺激信号同时引发的嵌合抗 原受体基于分子构象改变的对其自身激活元件——胞内激活信号传导结构域zap70的释放与激活程度的由低到高, 所提供的相位对比成像实验图片提供了细胞与微球相互作用的图像信息。
[0309]
首先,如图9(b)所示pd-1融合的嵌合抗原受体c#19版本和c#20版本均在人源jurkat e6-1 t淋巴细胞的表 面展示出正确的膜定位表达分布,未有任何其它错误的蛋白定位。另外,实验组c#19版本修饰的人源jurkat e6-1 t 淋巴细胞显示出快速且显著的对人源pd-l1修饰的微球刺激信号的响应能力,在刺激后的25分钟左右起开始展现 出了极为显著的对刺激信号响应能力及基于分子构象改变的对其自身胞内激活信号传导结构域的释放与激活,且所 示的对人源pd-l1修饰的微球刺激信号的响应具有高度特异性的空间特点,即仅局部地在相位对比成像实验图片中 细胞与微球相互作用的位置展示出响应能力;而对照组c#20版本修饰的人源jurkat e6-1 t淋巴细胞显示出近乎为 零的对人源pd-l1修饰的微球刺激信号的响应能力,在刺激后无法展现出有效的对刺激信号响应能力及基于分子构 象改变的对其自身胞内激活信号传导结构域的释放与激活。以上结果充分证明了图2(b)所示的人工分子机器在人 源淋巴细胞中的信号激活模式。
[0310]
图9(b)证明了在人源jurkat e6-1 t淋巴细胞中嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域 (sub1)对人源pd-l1信号出色的响应能力以及嵌合抗原受体c#19版本相应的明显分子构象的改变并对其自身激 活元件——胞内激活信号传导结构域zap70的充分显著释放与激活。此外,在自身激活元件被失能的情况下(失 活性突变体sub1ff),对照组的人工分子机器c#20版本较相实验组的人工分子机器c#19版本具有显著更弱的对人 源pd-l1信号的响应能力,证明人工分子机器c#19版本所包含的胞内检测信号传导结构域(sub1)对人源pd-l1 信号出色响应能力的重要性及特异性。基于免疫检查点pd-1融合的嵌合抗原受体c#19和c#20版本所包含的各组 成部分信息请见图28以及本申请相关内容。在此,人源pd-l1修饰的微球起到提供人源pd-l1信号输入的作用。
[0311]
图9(c)显示了在人源pd-l1修饰的微球刺激信号的条件下,不同的基于免疫检查点pd-1融合的嵌合抗原受 体人工分子机器在人源hela细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#17组至c#20组均为n=10), 成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号同时引发的嵌合抗原受体 基于分子构象改变的对其自身激活元件的释放与激活的程度。而且,图9(c)的直方图证明了在人源
hela细胞中 实验组的嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对蛋白酪氨酸磷酸化信号非常出色 的响应能力(c#19组平均值为0.458)以及嵌合抗原受体c#19版本相应的非常明显分子构象的改变并对其自身激 活元件——胞内激活信号传导结构域zap70的非常充分显著释放与激活,且统计分析后显著差异的优于实验组的 嵌合抗原受体c#17版本(c#17组平均值为0.232)。此外,在自身激活元件被失能的情况下(失活性突变体sub1ff), 对照组的嵌合抗原受体c#20版本较对照组的嵌合抗原受体c#18版本具有统计分析后显著差异的更弱的对蛋白酪氨 酸磷酸化信号的响应能力(c#20组平均值为0.0445,c#18组平均值为0.127),证明嵌合抗原受体c#19版本和c#17 版本所包含的胞内检测信号传导结构域对人源pd-l1信号出色响应能力的重要性且嵌合抗原受体c#19版本较嵌合 抗原受体c#17版本具有显著更佳的对人源pd-l1信号响应的特异性,说明c#19版本所采用的胞内间隔区结构域 较c#17版本的胞内间隔区结构域具备更优异的功能表现。
[0312]
图9(d)显示了在人源pd-l1修饰的微球刺激信号的条件下,不同的基于免疫检查点pd-1融合的嵌合抗原受 体人工分子机器在人源jurkat e6-1 t淋巴细胞中表现结果的直方图(数据显示为平均值
±
标准差,c#19组和c#20 组均为n=10),成像读数指标代表量化后嵌合抗原受体对刺激信号的响应能力的程度以及响应刺激信号同时引发的 嵌合抗原受体基于分子构象改变的对其自身激活元件的释放与激活的程度。而且,图9(d)的直方图证明了在人源 jurkat e6-1 t淋巴细胞中实验组的嵌合抗原受体c#19版本中所包含的胞内检测信号传导结构域(sub1)对人源 pd-l1信号非常出色的响应能力(c#19组平均值为0.326)以及嵌合抗原受体c#19版本相应的非常明显分子构象 的改变并对其自身激活元件——胞内激活信号传导结构域zap70的非常充分显著释放与激活。此外,在自身激活 元件被失能的情况下(失活性突变体sub1ff),对照组的嵌合抗原受体c#20版本较实验组的嵌合抗原受体c#19 版本具有统计分析后显著差异的更弱的近乎为零的对人源pd-l1信号的响应能力(c#20组平均值为0.0412),证明 嵌合抗原受体c#19版本所包含的胞内检测信号传导结构域对人源pd-l1信号出色响应能力的重要性且嵌合抗原受 体c#19版本具有极佳的对人源pd-l1信号响应的特异性,说明c#19版本所采用的胞内间隔区结构域具备非常优 异的功能表现。
[0313]
利用dna电穿孔转染方式来实现在人源淋巴细胞中表达不同的嵌合抗原受体蛋白,然后将基于免疫检查点 pd-1融合的嵌合抗原受体分子机器修饰改造的人源jurkat e6-1 t淋巴细胞与γ干扰素预处理的pd-l1阳性人源乳 腺癌细胞mda-mb-231于二氧化碳细胞培养箱中共培养至少24小时。开始共培养实验前,使用25ng/ml人源γ 干扰素对细胞培养皿中的mda-mb-231细胞进行24小时预处理。1天后,向12孔板培养皿的1个孔中铺种人源γ 干扰素预处理的2~5x 105个mda-mb-231细胞并加入相同数量的2~5x 105个嵌合抗原受体修饰改造后的jurkate6-1细胞,开始共培养,24小时共培养结束后,收集修饰改造的jurkat e6-1 t淋巴细胞并进行抗体染色和流式细 胞仪的信号检测,所检测的信号为t淋巴细胞表面早期活化分子cd69(simms pe等,1996may 1;3(3):301-4.),该 cd69可以直接反映出t淋巴细胞在与肿瘤细胞共培养情况下的免疫活化水平。依据cd69的检测水平高低来直接 表征修饰改造的人源淋巴细胞中嵌合抗原受体蛋白的胞内激活信号传导结构域在相应靶细胞pd-l1分子信号输入 下对淋巴细胞的活化能力强弱。该指标作为直接衡量基于免疫检查点pd-1融合的嵌合抗原受体与靶分子pd-l1的 结合产生应答的效果,胞内激活
信号传导结构域可以向宿主细胞的内部传导信号至下游,激发宿主细胞的效应功能 等。
[0314]
图10显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰的jurkat e6-1细胞面对与γ干 扰素预处理的pd-l1高表达人源乳腺癌细胞mda-mb-231共培养条件下的t细胞活化能力表现的直方图(数据显 示为平均值
±
标准差,c#19(+)组为n=4,其它组均为n=6),(+)代表jurket e6-1细胞与γ干扰素预处理的人 源乳腺癌细胞共培养的条件,(-)代表仅有jurket e6-1细胞单独培养的条件,t细胞活化读数指标代表t淋巴细胞 表面活化分子cd69的相对表达水平。
[0315]
图10的直方图证明了嵌合抗原受体c#19版本修饰的t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下 具有极佳的t细胞活化能力水平(c#19(+)组平均值为17.19),而其它实验组与对照组中的t细胞面对pd-l1阳 性的人源肿瘤细胞共培养条件下则不能有效地显示出t细胞活化能力水平,均与c#19(+)组的t细胞活化程度有 统计分析后显著差异。其中,实验组c#19(-)中嵌合抗原受体c#19版本修饰的t细胞在没有pd-l1阳性的人源 肿瘤细胞提供pd-l1信号输入的情况下显示出统计分析后显著差异的较弱的t细胞活化水平(c#19(-)组平均值 为1.003),证明嵌合抗原受体c#19版本具有极佳的对pd-l1阳性的人源肿瘤细胞响应的特异性。另一方面,对照 组(+)、c#1(+)组和c#2(+)组均不能有效显示出t细胞活化,说明嵌合抗原受体c#19版本的胞内信号传导 结构域,尤其胞内激活信号传导结构域,对修饰改造的t细胞面对pd-l1阳性的肿瘤细胞情况时产生特异性的t 细胞活化的重要性。其中,对照组(+)和对照组(-)中的jurket e6-1细胞均为未经改造的野生型jurket e6-1细胞, t细胞活化读数指标为t淋巴细胞表面活化分子cd69的相对表达水平。基于免疫检查点pd-1融合的嵌合抗原受 体c#1、c#2和c#19版本所包含的各组成部分信息请见图28以及本申请相关内容。
[0316]
图11显示了含有不同长度的胞内铰链结构域的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰的 jurkat e6-1细胞面对与γ干扰素预处理的pd-l1高表达人源乳腺癌细胞mda-mb-231共培养条件下的t细胞活化 能力表现的直方图(c#19(+)组和c#19(-)组数据显示为平均值
±
标准差,c#19(+)组为n=4,c#19(-)组 为n=6;其它组数据显示为平均值,均为n=1),(+)代表jurket e6-1细胞与γ干扰素预处理的人源乳腺癌细胞共 培养的条件,(-)代表仅有jurket e6-1细胞单独培养的条件,t细胞活化读数指标代表t淋巴细胞表面活化分子 cd69的相对表达水平。
[0317]
图11的直方图证明了嵌合抗原受体c#19版本、c#24版本和c#26版本修饰的t细胞在与pd-l1阳性的人源 肿瘤细胞共同培养情况下具有极佳的t细胞活化能力水平(c#19(+)组平均值为17.19,c#24(+)组平均值为10.08, c#26(+)组平均值为9.44),嵌合抗原受体c#20版本、c#25版本和c#27版本修饰的t细胞在与pd-l1阳性的人 源肿瘤细胞共同培养情况下具有相对弱一些的t细胞活化能力水平(c#20(+)组平均值为7.70,c#25(+)组平 均值为8.78,c#27(+)组平均值为7.36),。此外,各个实验组(-)中相应嵌合抗原受体版本(尤其是c#19版本、 c#24版本和c#26版本)修饰的t细胞在没有pd-l1阳性的人源肿瘤细胞提供pd-l1信号输入的情况下显示出显 著较弱的t细胞活化水平(c#19(-)组平均值为1.003,c#24(-)组平均值为1.04,c#26(-)组平均值为1.01), 证明相应嵌合抗原受体版本具有极佳的对pd-l1阳性的人源肿瘤细胞响应的特异性。其中,对照组(+)和对照组 (-)中的jurket e6-1细胞均为未经改造的野生型jurket e6-1细胞,t细胞活化读数指标为t淋巴细胞表面
基于免疫检查点pd-1融合的嵌合抗原受体c#1、c#2、c#3、c#4与c#5版本所包含的各组成部分信息请见图28 以及本申请相关内容。
[0323]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源直肠癌肿瘤细胞dld1的肿瘤杀伤检测:
[0324]
表达报告基因萤火虫荧光素酶的人源直肠癌肿瘤细胞dld1先经500u/ml γ干扰素预处理24小时以增加其 细胞表面pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细 胞/靶细胞)比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小 时、72小时三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合 的嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图3及图13。图13(c) 显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳 性的人源肿瘤细胞的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为0.384,c#5 组平均值为0.144,对照组平均值为1.687,c#1组平均值为2.011,c#2组平均值为2.174,c#4平均值为1.237), 相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的嵌合抗原受体c#3、c#5修饰改造后人源免疫原 代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细胞数量分别为相对于对照组中的22%和8%。定 量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、c#5版本修饰的免疫原代t细胞在与pd-l1阳 性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的识别杀伤肿瘤细胞的能力,而其它实验组c#1、 c#2、c#4与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞共培养条件下则未能显示出有效的识 别杀伤肿瘤细胞的能力。
[0325]
pd-1免疫检查点抑制剂对pd-l1阳性的人源直肠癌肿瘤细胞dld1的肿瘤杀伤检测:
[0326]
表达报告基因萤火虫荧光素酶的人源直肠癌肿瘤细胞dld1先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达,并于实验当日将其接种于适当的培养皿中,再将人源免疫原代t细胞及一种抗pd-1单克隆抗体的 免疫检查点抑制剂共同加入已接种人源直肠癌肿瘤细胞的培养皿,此时记为第0天,之后分别于孵育后24小时、 48小时、72小时三个共培养时间点上检测细胞培养体系中肿瘤细胞的荧光素酶活性,进而量化人源直肠癌肿瘤细 胞数量并计算人源免疫原代t细胞对人源直肠癌肿瘤细胞的细胞毒性。请见图13。图13(b)的定量分析线图显示, 于孵育后72小时(对照组/纳武利尤单抗组平均值为1.184,对照组/派姆单抗组平均值为1.314,对照组平均值为 1.687),pd-1免疫检查点抑制剂纳武利尤单抗或派姆单抗与人源免疫原代t细胞为有限的肿瘤细胞清除能力,人源 肿瘤细胞的细胞数量分别为相对于对照组中的70%和78%,证明了pd-1免疫检查点抑制剂对pd-1/pd-l1信号通 路的阻断可以一定程度上提高人源免疫原代t细胞对pd-l1阳性的人源直肠癌肿瘤细胞dld1细胞的细胞毒性效 果,但效果显著地不及本申请中基于c#3和c#5的细胞疗法。
[0327]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源乳腺癌肿瘤细胞mda-mb-231的肿瘤杀伤检测:
[0328]
下面的肿瘤杀伤实验使用的人源乳腺癌肿瘤细胞mda-mb-231分别为未经γ干扰素预处理的和经γ干扰素预 处理的肿瘤细胞。mda-mb-231肿瘤细胞属于可响应γ干扰素
刺激并大幅上调表面pd-l1表达水平的肿瘤细胞类 型(soliman h等,plos one.2014feb 14;9(2):e88557.),所以未经γ干扰素预处理的细胞表面的pd-l1表达水平显 著不及经γ干扰素预处理后的细胞表面的pd-l1表达水平。在此,采用未经γ干扰素预处理的肿瘤细胞与经γ干扰 素预处理的肿瘤细胞作对比进行肿瘤杀伤实验,从而充分检测表征嵌合抗原受体修饰改造的免疫原代t细胞对于相 应肿瘤细胞杀伤能力对pd-l1表达水平高低的依赖性。
[0329]
未经γ干扰素预处理的表达报告基因萤火虫荧光素酶的人源乳腺癌肿瘤细胞mda-mb-231作为肿瘤靶细胞, 检测免疫检查点pd-1融合的嵌合抗原受体修饰改造后人源免疫原代t细胞对相应肿瘤细胞的杀伤能力。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞)比例在24孔板中共培养 24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时三个共培养时间点上,利 用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原受体c#3、c#5修饰改造 后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图14。图14(b)显示了不同的基于免疫检查点pd-1融合的 嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞的体外共培养细胞毒性效 果的定量分析结果,于孵育后72小时时(c#3组平均值为0.233,c#5组平均值为0.278,c#2组平均值为0.928), 相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的嵌合抗原受体c#3、c#5修饰改造后人源免疫原 代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细胞数量分别为相对于对照组中的25%和30%。定 量分析线图证明了,未经γ干扰素预处理增强肿瘤细胞表面pd-l1的表达情况下,基于免疫检查点pd-1融合的嵌 合抗原受体c#3、c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下仍然具有统计分 析后显著差异的卓越的识别杀伤肿瘤细胞的能力,而其它实验组c#2中的人源免疫原代t细胞面对同样pd-l1阳 性的人源肿瘤细胞共培养条件下的识别杀伤肿瘤细胞的能力则显著的偏弱。
[0330]
下面实验使用的人源乳腺癌肿瘤细胞mda-mb-231为经γ干扰素预处理24小时的,故肿瘤细胞表面的pd-l1 表达水平高于未经γ干扰素预处理后的细胞表面的pd-l1表达水平(soliman h等,plos one.2014feb14;9(2):e88557.)。
[0331]
表达报告基因萤火虫荧光素酶的人源乳腺癌肿瘤细胞mda-mb-231先经500u/ml γ干扰素预处理24小时以 增加其细胞表面pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效 应细胞/靶细胞)比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48 小时、72小时三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融 合的嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图15。图15(c)显示 了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的 人源肿瘤细胞的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为0.843,c#5组平 均值为0.389,对照组平均值为4.657,c#1组平均值为3.487,c#2组平均值为3.934,c#4平均值为2.855),相较 于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t 细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细胞数量分别为
相对于对照组中的18%和8%。定量分 析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、c#5版本修饰的免疫原代t细胞在与pd-l1阳性的 人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的识别杀伤肿瘤细胞的能力,而其它实验组c#1、c#2、 c#4与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞共培养条件下则未能显示出有效的识别杀伤 肿瘤细胞的能力。
[0332]
pd-1免疫检查点抑制剂对pd-l1阳性的人源乳腺癌肿瘤细胞mda-mb-231的肿瘤杀伤检测:
[0333]
表达报告基因萤火虫荧光素酶的人源乳腺癌肿瘤细胞mda-mb-231先经γ干扰素预处理24小时以增加其细胞 表面pd-l1的表达,并于实验当日将其接种于适当的培养皿中,再将人源免疫原代t细胞及一种抗pd-1单克隆抗 体的免疫检查点抑制剂共同加入已接种人源乳腺癌肿瘤细胞的培养皿,此时记为第0天,之后分别于孵育后24小 时、48小时、72小时三个共培养时间点上检测细胞培养体系中荧光素酶活性,进而量化人源乳腺癌肿瘤细胞数量 并计算人源免疫原代t细胞对人源乳腺癌肿瘤细胞的细胞毒性。请见图15。图15(b)的定量分析线图显示,于孵 育后72小时时(对照组/纳武利尤单抗组平均值为4.215,对照组/派姆单抗组平均值为4.180,对照组平均值为5.010), pd-1免疫检查点抑制剂纳武利尤单抗或派姆单抗与人源免疫原代t细胞为有限的肿瘤细胞清除能力,人源肿瘤细 胞的细胞数量分别为相对于对照组中的87%和86%,证明了pd-1免疫检查点抑制剂对pd-1/pd-l1信号通路的阻 断可以一定程度上提高人源免疫原代t细胞对pd-l1阳性的人源直肠癌肿瘤细胞dld1细胞的细胞毒性效果,但 效果显著地不及本申请中基于c#3和c#5的细胞疗法。
[0334]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源肝癌肿瘤细胞ha22t的肿瘤杀伤检测:
[0335]
表达报告基因萤火虫荧光素酶的人源肝癌肿瘤细胞ha22t先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图16。图16(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为0.953,c#5组平均值为1.153, 对照组平均值为3.665,c#2组平均值为3.143),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的26%和31%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0336]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源脑癌肿瘤细胞u87-mg的肿瘤杀伤检测:
[0337]
表达报告基因萤火虫荧光素酶的人源脑癌肿瘤细胞u87-mg先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图17。图17(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为4.258,c#5组平均值为4.300, 对照组平均值为7.885,c#2组平均值为7.558),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的54%和55%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0338]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源皮肤癌肿瘤细胞a2058的肿瘤杀伤检测:
[0339]
表达报告基因萤火虫荧光素酶的人源皮肤癌肿瘤细胞a2058先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图18。图18(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为5.773,c#5组平均值为5.670, 对照组平均值为10.920,c#2组平均值为9.513),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合 的嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的 细胞数量分别为相对于对照组中的53%和52%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0340]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源卵巢癌肿瘤细胞es-2的肿瘤杀伤检测:
[0341]
表达报告基因萤火虫荧光素酶的人源卵巢癌肿瘤细胞es-2先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共
培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图19。图19(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为4.480,c#5组平均值为5.008, 对照组平均值为11.720,c#2组平均值为6.210),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合 的嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的 细胞数量分别为相对于对照组中的40%和46%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0342]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源前列腺癌肿瘤细胞pc-3的肿瘤杀伤检测:
[0343]
表达报告基因萤火虫荧光素酶的人源前列腺癌肿瘤细胞pc-3先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图20。图20(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为0.270,c#5组平均值为0.105, 对照组平均值为0.925,c#2组平均值为0.615),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的29%和11%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0344]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源胰腺癌肿瘤细胞aspc1的肿瘤杀伤检测:
[0345]
表达报告基因萤火虫荧光素酶的人源胰腺癌肿瘤细胞aspc1先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图21。图21(b)显
示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为1.653,c#5组平均值为1.495, 对照组平均值为2.765,c#2组平均值为2.398),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的60%和54%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0346]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源结肠癌肿瘤细胞colo205的肿瘤杀伤检测:
[0347]
表达报告基因萤火虫荧光素酶的人源结肠癌肿瘤细胞colo205先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图22。图22(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为0.663,c#5组平均值为0.840, 对照组平均值为1.288,c#2组平均值为1.648),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的51%和65%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0348]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源肾癌肿瘤细胞786-o的肿瘤杀伤检测:
[0349]
表达报告基因萤火虫荧光素酶的人源肾癌肿瘤细胞786-o先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图23。图23(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为1.035,c#5组平均值为1.095, 对照组平均值为4.878,c#2
组平均值为4.418),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的21%和22%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0350]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源肺癌肿瘤细胞h441的肿瘤杀伤检测
[0351]
表达报告基因萤火虫荧光素酶的人源肺癌肿瘤细胞h441先经γ干扰素预处理24小时以增加其细胞表面pd-l1 的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞)比例 在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时三个 共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原受体 c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图24。图24(b)显示了不同的基于免疫 检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞的体 外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为1.095,c#5组平均值为1.143,对照 组平均值为1.868,c#2组平均值为1.878),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的嵌合 抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细胞数 量分别为相对于对照组中的59%和61%。定量分析线图证明了基于免疫检查点pd-1融合的嵌合抗原受体c#3、c#5 版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的识别 杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞共培 养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0352]
基于免疫检查点pd-1融合的嵌合抗原受体c#3版本、c#5版本修饰改造后人源免疫原代t细胞对pd-l1阳性 的人源淋巴癌肿瘤细胞u937的肿瘤杀伤检测:
[0353]
表达报告基因萤火虫荧光素酶的人源淋巴癌肿瘤细胞u937先经γ干扰素预处理24小时以增加其细胞表面 pd-l1的表达。将1 x 104的修饰改造后人源免疫原代t细胞与1 x 103肿瘤细胞按照10∶1的e/t(效应细胞/靶细胞) 比例在24孔板中共培养24~72小时,共培养的时间开始即为第0天。然后,于孵育后24小时、48小时、72小时 三个共培养时间点上,利用荧光分光光度计测量相应的荧光素酶活性,从而定量免疫检查点pd-1融合的嵌合抗原 受体c#3、c#5修饰改造后人源免疫原代t细胞对肿瘤细胞的杀伤程度。请见图25。图25(b)显示了不同的基于 免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的人源免疫原代t细胞与pd-l1阳性的人源肿瘤细胞 的体外共培养细胞毒性效果的定量分析结果,于孵育后72小时时(c#3组平均值为1.548,c#5组平均值为0.518, 对照组平均值为2.595,c#2组平均值为2.190),相较于对照组中的人源免疫原代t细胞,免疫检查点pd-1融合的 嵌合抗原受体c#3、c#5修饰改造后人源免疫原代t细胞分别显示最大量的肿瘤细胞清除能力,人源肿瘤细胞的细 胞数量分别为相对于对照组中的59%和20%。定量分析线图证明了基于
免疫检查点pd-1融合的嵌合抗原受体c#3、 c#5版本修饰的免疫原代t细胞在与pd-l1阳性的人源肿瘤细胞共同培养情况下具有统计分析后显著差异的卓越的 识别杀伤肿瘤细胞的能力,而其它实验组c#2与对照组中的人源免疫原代t细胞面对pd-l1阳性的人源肿瘤细胞 共培养条件下则未能显示出有效的识别杀伤肿瘤细胞的能力。
[0354]
综上,通过多种肿瘤细胞毒性杀伤实验的验证,基于免疫检查点pd-1融合的嵌合抗原受体改造的人源免疫原 代t细胞展现出如图3所示的对肿瘤细胞优异的杀伤能力,尤其是对pd-l1阳性的人源肿瘤细胞。在pd-1融合的 嵌合抗原受体改造的人源免疫原代t细胞更能进一步增强对肿瘤细胞的杀伤效果。其中,c#3与c#5版本的功能性 尤为突出,分别是truncated pd-1-sub1-ll2-zap70版本与truncated pd-1-sub1-ll2-syk版本。另外,c#4版本是 c#3版本的胞内激活信号结构域突变体(zap70 δkd),即c#4版本的胞内激活信号传导结构域为失灵状态。在多 种肿瘤细胞毒性杀伤实验的验证中,c#4版本改造的免疫吞噬细胞未能有效杀伤肿瘤细胞,证明了嵌合抗原受体的 胞内激活信号结构域对于嵌合抗原受体充分行使功能的必要性与重要性。最后,图14和图15证明了本申请的c#3 与c#5版本的细胞疗法对pd-l1阳性的肿瘤细胞以及响应γ干扰素上调pd-l1表达水平的肿瘤细胞均具有非常优 异的肿瘤杀伤能力,尤其响应γ干扰素上调pd-l1表达水平的肿瘤细胞一定程度上模拟了真实患者体内的免疫抑制 性肿瘤微环境,为本申请中的细胞疗法于将来临床治疗中应用提供了更多前瞻性的支持数据。
[0355]
实施例4pd-l1阳性动物肿瘤模型实验
[0356]
利用人源pd-1与鼠源pd-l1存在交叉反应(l
á
z
á
r-moln
á
r e等,ebiomedicine.2017mar 1;17:30-44.)的特点, 选择使用鼠源高表达pd-l1阳性的免疫系统完善小鼠实体肿瘤模型,对本申请中基于人源免疫检查点pd-1融合的 嵌合抗原受体t细胞疗法的抗肿瘤能力进行检测与表征。
[0357]
构建免疫系统完善的pd-l1阳性的实体瘤小鼠动物模型及检测基于免疫检查点pd-1融合的嵌合抗原受体人工 分子机器修饰改造的t细胞疗法肿瘤杀伤治疗效果。
[0358]
(1)肿瘤靶点的选择及免疫细胞的感染表达鉴定:为开发并检测基于免疫检查点(pd-1为主)的细胞疗法的 治疗效果,故选择肿瘤靶点为pd-l1,从而在免疫系统完善的pd-l1阳性的实体瘤小鼠动物模型中检测靶向pd-l1 为靶分子的嵌合抗原受体修饰改造的免疫t细胞的免疫疗法。
[0359]
(2)小鼠实体肿瘤模型的选择与建立:b16或mc38是表达pd-l1的相应黑素瘤或结肠癌肿瘤细胞系,能够 在同源野生型c57bl/6受试小鼠皮下生长成为实体瘤,是广泛使用的小鼠pd-l1实体肿瘤模型,且b16和mc38 均为响应γ干扰素上调pd-l1表达水平的pd-l1高表达肿瘤细胞(juneja vr等,journal of experimental medicine. 2017apr 3;214(4):895-904.)。本申请将使用该两种皮下接种到野生型小鼠体内建立表达pd-l1的实体瘤模型,进行 靶向pd-l1为抗原的嵌合抗原受体修饰改造的免疫t细胞的免疫疗法的检测。从而,pd-l1阳性的实体肿瘤细胞可 以被嵌合抗原受体修饰改造后的免疫t细胞识别,这样可以直接地检测细胞疗法的效果。请见图26。图26(b)显 示了本申请所涉及使用的受试小鼠同源实体肿瘤模型建立、监测与分析流程及治疗方案。
[0360]
(3)包装逆转录病毒、感染免疫t细胞与验证嵌合抗原受体分子机器在免疫t淋巴细胞的表达:使用逆转录 病毒包装以制备不同免疫检查点pd-1融合的嵌合抗原受体人工
分子机器的病毒颗粒并用于后续分离的免疫t淋巴 细胞感染。将携有不同免疫检查点pd-1融合的嵌合抗原受体人工分子机器的逆转录病毒表达载体(如pmscv载 体)和包装质粒(如pcl-eco病毒包装质粒)转染293t细胞,收获病毒上清,过滤后分装冻存,测定病毒滴度。 从野生型供体小鼠体内利用商业化的小鼠t淋巴细胞分离试剂盒(如德国美天旎小鼠t淋巴细胞分选磁珠试剂盒) 分离外周淋巴结及脾脏的小鼠原代t淋巴细胞,然后用anti-cd3/anti-cd28包被的多孔板培养皿进行培养刺激24 小时,之后加入一定量的病毒进行感染,感染后24~72小时利用抗体的流式染色检测嵌合抗原受体在所修饰改造的 原代t细胞表面表达水平,同时继续体外培养扩增原代t细胞供动物实验使用。另外,可以优化相应的逆转录病毒 感染复数(moi),从而为后续实验提供支持。在病毒感染过程中,需要及时补充新鲜培养基。请见图26(a)。图26(a)显示了本申请所涉及使用的供体小鼠淋巴t细胞体外分离、感染与扩增流程。
[0361]
(4)嵌合抗原受体分子机器修饰改造后的t细胞疗法在动物实体肿瘤模型上的抗肿瘤效果实验:
[0362]
于皮下注射肿瘤细胞的2天前(记为第0天)进行对受试小鼠的辐照(非致死剂量,3~5gy的辐照剂量)以实 现对受试小鼠外周血淋巴细胞的清除。然后,在第2天将2~20x 105个pd-l1阳性的b16或mc38细胞接种到受试 小鼠的后背部皮下,建立免疫系统完善的pd-l1阳性的实体瘤小鼠动物模型。受试小鼠皮下接种肿瘤细胞后的第5 天起持续测量肿瘤生长大小,将荷瘤小鼠分组并通过尾静脉注射方式过继性输入不同的t细胞亚群(如包括基于免 疫检查点pd-1融合的嵌合抗原受体修饰改造以及未经嵌合抗原受体修饰改造的免疫原代cd8阳性t淋巴细胞), 并定期检测肿瘤大小和小鼠的存活率。请见图26(b)以及图27。图26(b)显示了本申请所涉及使用的受试小鼠 同源实体肿瘤模型建立、监测与分析流程及治疗方案。图27(a)显示了不同的基于免疫检查点pd-1融合的嵌合抗 原受体人工分子机器修饰改造的t细胞疗法在免疫系统完善的pd-l1阳性黑色素瘤实体瘤小鼠动物模型中治疗效果 的定量分析。
[0363]
图27(a)的定量分析线图证明了嵌合抗原受体c#3版本修饰改造的t细胞在pd-l1阳性的鼠源黑色素瘤实体 瘤小鼠动物模型中具有统计分析后显著差异的卓越的识别杀伤肿瘤细胞的抗癌能力,而实验组c#2与对照组中的t 细胞在pd-l1阳性的鼠源黑色素瘤实体瘤小鼠动物模型中则未能显示出有效的识别杀伤肿瘤细胞的抗癌能力。基于 免疫检查点pd-1融合的嵌合抗原受体c#2和c#3版本所包含的各组成部分信息请见图28以及本申请相关内容。 其中,对照组中的t细胞疗法为使用未经嵌合抗原受体人工分子机器修饰改造的鼠源免疫原代t细胞,肿瘤体积代 表小鼠皮下实体肿瘤模型中实体肿瘤定量的体积大小,小鼠肿瘤模型为皮下b16黑色素瘤实体瘤模型。具体治疗方 案流程信息请见图26。
[0364]
图27(b)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的t细胞疗法在免 疫系统完善的pd-l1阳性黑色素瘤实体瘤小鼠动物模型中治疗效果的定量分析。
[0365]
图27(b)的定量分析线图证明了嵌合抗原受体c#3版本修饰改造的t细胞在pd-l1阳性的鼠源黑色素瘤实体 瘤小鼠动物模型中具有统计分析后显著差异的卓越的延长荷瘤小鼠生存周期并提高荷瘤小鼠存活率的抗癌效果,而 实验组c#2与对照组中的t细胞在pd-l1阳性的鼠源黑色素瘤实体瘤小鼠动物模型中则未能显示出有效的延长荷 瘤小鼠生存周
期并提高荷瘤小鼠存活率的抗癌能力。基于免疫检查点pd-1融合的嵌合抗原受体c#2和c#3版本所 包含的各组成部分信息请见图28以及本申请相关内容。其中,对照组中的t细胞疗法为使用未经嵌合抗原受体人 工分子机器修饰改造的鼠源免疫原代t细胞,肿瘤体积代表小鼠皮下实体肿瘤模型中实体肿瘤定量的体积大小,小 鼠肿瘤模型为皮下b16黑色素瘤实体瘤模型。具体治疗方案流程信息请见图26。
[0366]
图27(c)显示了不同的基于免疫检查点pd-1融合的嵌合抗原受体人工分子机器修饰改造的t细胞疗法在免 疫系统完善的pd-l1阳性结肠癌实体瘤小鼠动物模型中治疗效果的定量分析。
[0367]
图27(c)的定量分析线图证明了嵌合抗原受体c#3版本修饰改造的t细胞在pd-l1阳性的鼠源结肠癌实体瘤 小鼠动物模型中具有统计分析后显著差异的卓越的识别杀伤肿瘤细胞的抗癌能力,而实验组c#2中的t细胞在 pd-l1阳性的鼠源结肠癌实体瘤小鼠动物模型中则未能显示出有效的识别杀伤肿瘤细胞的抗癌能力。基于免疫检查 点pd-1融合的嵌合抗原受体c#2和c#3版本所包含的各组成部分信息请见图20以及本申请相关内容。其中,肿 瘤体积代表小鼠皮下实体肿瘤模型中实体肿瘤定量的体积大小,小鼠肿瘤模型为皮下mc38结肠癌实体瘤模型。具 体治疗方案流程信息请见图26。
[0368]
综上,实体瘤小鼠动物模型实验结果表明,基于c#3版本的t淋巴细胞过继疗法表现出明显的抑制pd-l1肿 瘤生长的效果,而其它对照组没有能够显现出抗肿瘤效果,说明版本c#3修饰改造后的t细胞过继疗法具有良好的 抗表达pd-l1肿瘤效果,且显著提升了相应荷瘤小鼠的存活率。
[0369]
最后,如前所述免疫检查点阻断剂与car-t细胞疗法是最近以来肿瘤免疫领域取得重大突破的方向。虽然, car-t在血液癌症治疗上取得了令人振奋的成绩,但是其在实体瘤治疗上的作用仍有待进一步探索。综合考虑 pd-1/pd-l1抗体类药物和car-t细胞疗法类药物的优缺点,本申请结合肿瘤免疫学、合成生物学、分子工程与细 胞工程等多种手段开发新一代的基于免疫检查点pd-1/pd-l1信号通路的实体肿瘤细胞疗法,兼具两者优势。该细 胞疗法应用基于免疫检查点pd-1的具备编码调控免疫细胞功能的嵌合抗原受体分子机器,当表达免疫检查点抑制 性信号pd-1分子配体pd-l1的肿瘤细胞通过pd-1/pd-l1免疫检查点信号通路以同样的对免疫t细胞刹车阻断机 制去尝试抑制免疫t细胞功能时,经过该新一代基于pd-1的嵌合抗原受体分子机器重新编码改造的免疫t细胞, 非但不会被肿瘤细胞所抑制,反而会被进一步激活,产生针对相应肿瘤细胞的特异性免疫反应,从而识别并杀伤相 应的肿瘤细胞。
[0370]
嵌合抗原受体分子机器改造后免疫细胞,尤其免疫t细胞,通过细胞外实验、细胞内实验与免疫系统完善的动 物肿瘤模型实验等证明可以更好地呈现相应免疫细胞的活化能力以及实现杀伤清除多种pd-l1高表达的肿瘤,如乳 腺癌、直肠癌、皮肤癌、结肠癌、胰腺癌、肝癌、卵巢癌、前列腺癌、脑癌、肾癌、肺癌、淋巴瘤、黑色素瘤等。 该嵌合抗原受体改造后免疫细胞清除实体瘤的效力远高于现行fda授权使用的pd-1免疫检查点抑制剂——欧狄沃 (即opdivo,纳武利尤单抗(nivolumab))及可瑞达(即keytruda,派姆单抗(pembrolizumab)),同时也克服实 体肿瘤微环境中的免疫抑制,即解决实体肿瘤免疫治疗中的关键问题,相信这类工具可为实体肿瘤治疗开辟新的途 径,并为人类癌症治疗提供创新和精确的治疗方法。
[0371]
以上所述,仅是本申请的几个实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上, 然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术 内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



