从微生物发酵获得的碳水化合物中纯化乳-N-新四糖(LNnT)的简单方法与流程
 2021-01-07 10:01:41|
2021-01-07 10:01:41| 415|
415| 起点商标网
起点商标网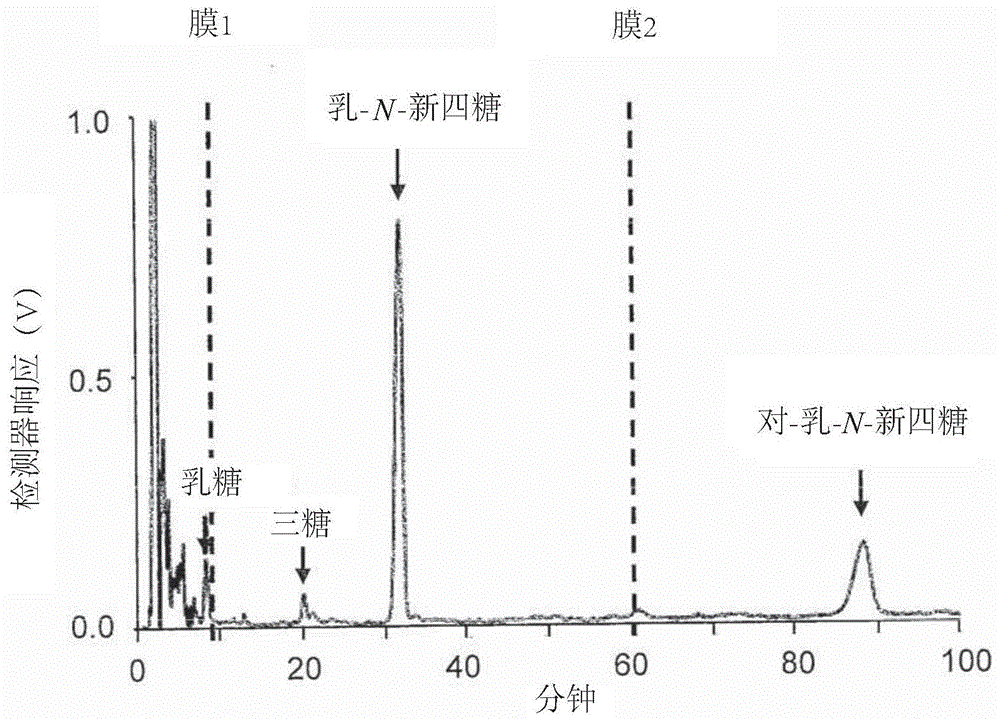
本发明涉及纯化乳-n-新四糖(gal(β1-4)glcnac(β1-3)gal(β1-4)glc)的方法。更具体地,本发明涉及一种用于从其它碳水化合物中分离乳-n-新四糖的简单且经济的方法,这些碳水化合物为例如乳-n-三糖、乳糖和单糖以及较大的寡糖例如对-乳-n-新六糖,对于通过微生物发酵来制备乳-n-新四糖来说,这些碳水化合物被认为是发酵液中的杂质碳水化合物。
背景技术:
人乳被认为是婴儿发育的最佳饮食。它由脂肪、蛋白质、维生素、矿物质、微量元素和复合寡糖组成。除乳糖外,人乳以及其它哺乳动物的乳还含有各种结构各异的寡糖,它们被称为人乳寡糖(hmo)(usashimat.等,(2011)milkoligosaccharides,novabiomedicalbooks,newyorkisbn978-1-61122-831-1)。
由于hmo对胃肠道菌群发育的有益特性,通过化学方法或基于生物技术的方法来制备hmo的努力引起了广泛关注,因此提倡将其用于营养产品(尤其是婴幼儿营养产品以及医疗和成人营养产品)。
除了这些益生菌特性外,迄今为止还观察到hmo的许多其它有益效果,扩大了其应用领域(morrowa.l.&yu,y.(2017)potentialpublichealthimpactofhumanmilkoligosaccharides.in:prebioticsandprobioticsinhumanmilk.mcguire,m.,mcguire,m.&bode,l.(eds.)academicpress,london,pp207-222)。
有限的供应以及获得单个人乳寡糖纯级分的难度,导致这些复杂分子中的一些分子的化学合成方法得到发展。然而,通过化学合成、酶促合成或发酵来合成人乳寡糖,仍然具有挑战性。时至今日,对于大规模量的生产制造,以及制造对于食品应用而言是足够量的人乳寡糖,仍然是有难度的。
由于化学合成人乳寡糖过程中带来的诸多挑战,现已发展几种酶促方法和发酵方法。特别地,发酵方法需要从含有几百种不同分子的高度复杂的发酵液中纯化目标寡糖。发酵液中碳水化合物级分由单糖以及寡糖的复杂混合物组成,包括底物(例如乳糖以及作为碳源的其它糖类)、生物合成中间体、各类单糖、代谢副产物以及由微生物合成的其它多糖。此外,发酵液中出现的许多寡糖的结构是未知的(例如,由合成宿主天然产生的寡糖,譬如细胞表面糖基化结构)。因此,在很多情况下,生物技术产品的纯化比其发酵生产要昂贵得多。特别地,乳-n-新四糖的发酵通常会伴随有乳-n-三糖ii的过量合成,它是乳-n-新四糖的生物合成过程的生物合成中间体,通常由细胞输出至介质中。可以通过糖苷酶处理或纯化过程中的色谱分离步骤除去发酵液中的乳-n-三糖ii。由于乳-n-新四糖的非还原端有β-1,4-连接的半乳糖残基,非还原端十分类似于乳糖,其通常通过微生物发酵菌株中存在的糖基转移酶或生物催化反应中使用的糖基转移酶引起进一步的糖基化反应。这导致生成戊糖、己糖、庚糖以及甚至更大的寡糖(目标乳-n-新四糖产物的过糖基化)。此外,碳水化合物(例如乳糖)的高压灭菌(热处理)会导致生成不希望的副产物例如羟醛或mayard产物,或重排反应(例如乳糖转化为乳果糖)。最终产物中此类杂质的存在(特别是大量存在)是不想要的或者是不可接受的。
从发酵液中纯化单个寡糖的“现有技术”方法,从技术层面而言是复杂的而且通常是不经济的,尤其是当所述寡糖用于食品时。对于从复杂混合物例如乳清或糖浆中纯化二糖乳糖或蔗糖而言,已经开发了涉及多个结晶步骤的工业规模方法。然而,所述方法需要精细操作,并且仅导致低产率。此外,这些方法不适用于使糖适合用于食品工业,因为乳清和糖浆已经是食品。
然而,过滤方法例如超滤、微滤和纳滤在技术上很容易进行,如果所有的工艺参数都是已知和已优化的。渗滤是另一种合适的方法,其涉及向溶液中添加新鲜的水以除去膜可渗透的组分。超滤和微滤通常用于从发酵液或水溶液中分离更大的分子,例如蛋白质或细胞。此外,通过纳滤除去水、矿物质和非常小的分子是众所周知的,并且在乳制品行业中使用纳滤来进行乳清的浓缩和去矿化。在大多数情况下,用于纳滤和超滤的膜材料基于例如哌嗪、聚酰胺、聚醚砜、聚乙二醇和陶瓷等材料。可以将膜组装成例如中空纤维组件、螺旋缠绕组件和平板膜,不同的组装方式会导致不同的分离性能。通常,纳滤膜的截留分子量为150-300道尔顿。截留分子量为400-600道尔顿的膜非常罕见,特别是对于大规模工业生产。这使得寡糖的分离仍然很复杂,因为需要其它分离技术,例如分批或连续的色谱法。
为了通过微生物发酵生产人乳寡糖,需要使用重组微生物(重组细菌或酵母菌株)。它们的使用会导致发酵液被来源于微生物的重组材料例如核酸分子或多肽所污染。然而,监管机构或当今的消费者都无法接受重组dna和蛋白质对人类食用产品的污染。因此,任何来源于重组微生物的核酸和蛋白质都需要从目标人乳寡糖中除去。如今,重组dna分子的检测限非常低,因此需要详尽彻底的纯化方案。对于基于qpcr的dna检测而言,甚至一个dna分子也可以从样品中检测出来。
使用色谱法纯化乳-n-新四糖以及紧密相关的人乳寡糖乳-n-四糖(galβ1-3glcnacβ1-3-galβ1-4glu),特别是凝胶过滤色谱法(dumon等,(2001)invivofucosylationoflacto-n-neotetraoseandlacto-n-neohexaosebyheterologousexpressionofhelicobacterpyloriα1,3-fucosyltransferaseinengineeredescherichiacoli.glycoconj.j.18,465-474;priem等,(2002)anewfermentationprocessallowslarge-scaleproductionofhumanmilkoligosaccharidesbymetabolicallyengineeredbacteria.glycobiology12,235-240;baumgartner等(2014)synthesisofthehumanmilkoligosaccharidelacto-n-tetraoseinmetabolicallyengineered,plasmid-freee.coli.chembiochem15,1896-1900)。鉴于凝胶过滤色谱法是一种方便的实验室规模方法,只有模拟移动床色谱法代表一种与食品生产兼容的规模纯化lnnt的合适方法。然而,所有其它公开的方法都存在以下问题:不能有效从目标产物中除去杂质碳水化合物,尤其是与过度糖基化有关的碳水化合物。
因此,本发明的目的是提供一种从微生物发酵液中纯化乳-n-新四糖的简单且具有成本效益的方法,其中除了从目标寡糖中移除所述其它碳水化合物外,还移除来源于重组微生物的核酸与多肽。
已经开发几种使用工程微生物例如大肠杆菌菌株的发酵方法来用于结构更为简单的hmo例如乳-n-新四糖的生产(例如ep3141610a1;wo2001/004341a1;bode,l.等,(2017)makinghumanmilkoligosaccharidesavailableforresearchandapplication-approaches,challenges,andfutureopportunities.in:prebioticsandprobioticsinhumanmilk.mcguire,m.,mcguire,m.&bode,l.(eds.)academicpress,london,pp251-293)。
然而,其它微生物发酵方法也可用于生产寡糖。除了细菌体系之外,还可以使用真核生产菌株,例如酵母,尤其是酿酒酵母或它的任何近亲。与许多其它推定的生产用微生物相反,酿酒酵母是被批准用于食品生产的微生物。
本质上,必须对微生物进行基因工程改造,以摄取乳糖,或通过易获得碳源(例如葡萄糖、半乳糖、蔗糖、果糖、木糖、甘油等)进行内源性乳糖生物合成。关于乳糖代谢以及副产物生成的活性必须被灭活或减少到可以实现乳-n-新四糖生产的程度。然后通过两种糖基转移酶,一种是β-1,3-n-乙酰葡萄糖氨基转移酶,另一种是β-1,4-半乳糖转移酶的酶促活性来合成乳-n-新四糖。已知几种用于合成乳-n-新四糖的糖基转移酶,例如由igta基因编码的脑膜炎双球菌的β-1,3-n-乙酰葡萄糖氨基转移酶和通过galt基因编码的幽门螺杆菌的β-1,4-半乳糖基转移酶。优选在重组微生物中表达外向转运蛋白(exporter),以将目标寡糖输出至发酵介质,然后从所述发酵介质中纯化所述寡糖。
技术实现要素:
提供了一种纯化乳-n-新四糖的方法,该方法简单、成本有效且可扩展。可以在不使用有机溶剂使所述乳-n-新四糖结晶的情况下进行所述纯化乳-n-新四糖的方法。另外,可以在没有非连续色谱分离步骤的情况下进行所述纯化乳-n-新四糖的方法。
乳-n-新四糖(gal(β1-4)glcnac(β1-3)gal(β1-4)glc)代表人乳寡糖,将其加入至婴儿配方食品和医疗食品中是十分有必要的。乳-n-新四糖的高成本阻止了它的广泛使用,尤其是婴儿配方食品。特别地,纯化微生物发酵的产物通常是复杂且昂贵的。另外,有机溶剂的使用和非连续色谱步骤也使乳-n-新四糖和其它中性寡糖变得非常昂贵。而且,某些宗教食品标准(例如清真食品)不接受使用乙醇。因此,本发明涉及一种使用重组加工助剂从微生物发酵中纯化乳-n-新四糖的简单、成本有效的方法,得到一种适用于人体摄入、尤其是适用于婴儿食品和医疗营养产品的乳-n-新四糖产品。
所述纯化过程基于用于从杂质碳水化合物中纯化/分离乳-n-新四糖(gal(β1-4)glcnac(β1-3)gal(β1-4)glc)的膜。所开发的方法代表了一种针对色谱或结晶等纯化方法而言的经济高效的替代方法。本发明特别涉及通过使用细菌或酵母作为生产宿主的微生物发酵获得的乳-n-新四糖的纯化以及使用粗制或纯化的酶的生物催化方法。纯化乳-n-新四糖的方法包括两个膜过滤步骤,其中一个膜的截留分子量在约300至约500道尔顿之间,另一个膜的截留分子量在约600至约800道尔顿之间。
在本发明的一个方面,两个膜过滤步骤中的任何一个都可以通过连续色谱法步骤代替,例如模拟床色谱法(smb)。
附图简要说明
图1显示了包含几种糖的组合物的hplc分析结果,并说明了使用两个膜过滤步骤来纯化乳-n-新四糖的原理。
图2显示了对用于生产乳-n-新四糖的微生物发酵后的发酵液进行离子交换处理后的洗脱液的hplc分析结果。
图3显示了对用于生产乳-n-新四糖的微生物发酵后的发酵液进行离子交换处理后的洗脱液经历两次膜过滤步骤后的hplc分析结果。
图4显示了smb注入液的hplc分析结果
图5显示了smb提取液的hplc分析结果。
图6显示了smb提余液的hplc分析结果。
具体实施方式
提供了一种从其它碳水化合物中纯化乳-n-新四糖的方法,其中该方法包含使用不同的膜将含有乳-n-新四糖和所述其它碳水化合物的水溶液进行两次膜过滤的步骤,其中一个膜的截留分子量在约300至约500道尔顿之间,另一个膜的截留分子量在约600至约800道尔顿之间。
截留分子量在约300至约500道尔顿之间的膜会除去分子量小于lnnt的大部分碳水化合物。过滤后,lnnt和分子量大于lnnt的碳水化合物保留在渗余物中。
在另外的和/或替代的实施方案中,截留分子量在约300至约500道尔顿之间的膜的孔径为1-2nm。
去除分子量小于lnnt的大部分碳水化合物的合适的膜为例如,trisepxn-45(trisepcorporation,usa)、dairydk(suezwatertechnologies,formelyge)和filmtechnf270(dow,midland,mi,usa)。
截留分子量在约600至约800之间的膜对乳-n-新四糖和分子量低于lnnt的碳水化合物有渗透性,过滤后,lnnt存在于滤液中,而分子量大于lnnt的碳水化合物则保留在渗余物中。
在另外的和/或替代的实施方案中,截留分子量在约600至约800道尔顿之间的膜的孔径为2.5至3nm。
对lnnt具有渗透性并能将分子量大于lnnt的碳水化合物保留在渗余物中的合适的膜为例如,tangenxsiustff0.65kdamembrane(repligencorporation)、zirkoniamodules3nm(pervatechbv)和s-cutysnf-ys600(cut/burkert)。
该方法避免了使用昂贵的非连续色谱步骤,并且也不需要使用有机溶剂进行沉淀或结晶步骤。因此,在另外的和/或替代的实施方案中,该方法不包括一个或多个非连续色谱步骤和/或通过使用有机溶剂使lnnt沉淀和/或结晶的一个或多个步骤。
在该方法的一个另外和/或替代实施方案中,两个膜过滤步骤中的任何一个都可以用连续色谱法例如模拟移动床(smb)色谱法代替。
在一个另外的和/或替代的实施方案中,用于从其它碳水化合物中纯化乳-n-新四糖的方法的特征在于,该方法包括将含有乳-n-新四糖的水溶液进行膜过滤的步骤和将水溶液进行连续色谱法处理以从水溶液中除去分子量大于lnnt的碳水化合物的步骤,膜过滤的步骤使用截留分子量在约300至约500道尔顿之间的膜。
优选地,膜过滤步骤在连续色谱法步骤之前进行,将膜过滤步骤后的渗余物进行连续色谱法处理。
在一个另外的和/或替代的实施方案中,用于从其它碳水化合物中纯化乳-n-新四糖的方法的特征在于,该方法包括将含有乳-n-新四糖的水溶液进行膜过滤的步骤和将水溶液进行连续色谱法处理以从水溶液中除去分子量小于lnnt的碳水化合物的步骤,膜过滤的步骤使用截留分子量在约600至约800道尔顿之间的膜。优选地,连续色谱法步骤在膜过滤步骤之前进行,将连续色谱法步骤得到的洗脱液进行膜过滤步骤。
在一个另外的和/或替代的实施方案中,水溶液是从用于生产乳-n-新四糖的发酵或酶促方法中得到的。
本文描述的方法适用于从微生物发酵或生物催化反应中以数-吨计纯化人乳寡糖乳-n-新四糖,因为它在经济上可行且可扩展。
在一个另外的和/或替代的实施方案中,通过发酵从发酵液中分离生物质获得水溶液。优选地,从发酵液中分离生物质包含至少一个超滤步骤,优选两个超滤步骤,更优选地,使用具有截留分子量为约500kda的膜进行第一次超滤且使用具有截留分子量为约150kda的膜进行第二次超滤。
在一个另外的和/或替代的实施方案中,使用优选为h+形式的阳离子交换树脂和优选为cl-形式的阴离子交换树脂处理水溶液,更优选在将水溶液进行膜过滤步骤之前进行。
在一个另外的和/或替代的实施方案中,该方法还包括渗析步骤,优选电渗析步骤,以去除离子。
该产品可以最方便地以无菌浓缩物或喷雾干燥产品的形式提供。
该方法允许纯化乳-n-新四糖,即从其它碳水化合物中分离出lnnt,其中在纯化之前,水溶液中乳-n-新四糖的纯度为≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤10%或≤5%,和/或,在纯化后,水溶液含有≥80%,优选≥85%或更优选≥90%的乳-n-新四糖。
在一个另外的和/或替代的实施方案中,纯化包括以下步骤:
i.)从发酵液中分离生物质;
ii.)将无细胞发酵液用离子交换树脂处理以除去带电物质;
iii.)对步骤ii中获得的水溶液进行膜过滤步骤以除去分子量小于乳-n-新四糖的碳水化合物;
iv.)对步骤iii中获得的渗余物进行膜过滤步骤以除去分子量比乳-n-新四糖大的碳水化合物;
v.)增加步骤iv的滤液中存在的乳-n-新四糖的浓度。
用于纯化乳-n-新四糖的其他程序相当复杂因而较为昂贵,而在上文中介绍的方法主要依靠于两个膜过滤步骤的使用。在一个膜过滤步骤中过滤除去比目标乳-n-新四糖小的杂质。在第二个过滤步骤中过滤除去比目标产物大的分子。
在另一个实施方案中,膜过滤步骤之一可以由模拟移动床色谱法代替。模拟移动床色谱法代表——与其它色谱法相比——一种连续的色谱方法,并可以将其应用于多-吨级别的生产制造,它与其它非连续色谱法相比,具有极高的成本效益。
在一个另外的和/或替代的实施方案中,用于纯化lnnt的方法包括如下步骤:
i.)从发酵液中分离生物质;
ii.)将无细胞发酵液用离子交换树脂处理以除去带电物质;
iii.)对步骤ii中获得的水溶液进行膜过滤步骤以除去分子量小于乳-n-新四糖的碳水化合物;
iv.)对步骤iii中获得的渗余物进行连续色谱法处理以除去分子量大于乳-n-新四糖的碳水化合物;以及比乳-n-新四糖大的材料;
v.)增加步骤iv的洗脱液中存在的乳-n-新四糖的浓度。
根据本发明的另一个实施方案,可以通过模拟移动床色谱法除去分子量小于lnnt的碳水化合物(特别是较小的寡糖和单糖),并通过膜过滤步骤除去比lnnt更大的碳水化合物。
在一个另外的和/或替代的实施方案中,该方法包括以下步骤:
i.)从发酵液中分离生物质;
ii.)将无细胞发酵液用离子交换树脂处理以除去带电物质;
iii.)对步骤ii中获得的水溶液进行连续色谱法处理以除去分子量小于乳-n-新四糖的碳水化合物;
iv.)对步骤iii中获得的洗脱液进行膜过滤步骤以除去分子量大于乳-n-新四糖的碳水化合物;
v.)增加步骤iv获得的滤液中的乳-n-新四糖的浓度。
根据本发明的另一个实施方案,在纯化lnnt的方法中使用一种或多种糖苷酶以将某些寡糖水解成更小的寡糖或单糖。例如,副产物乳-n-三糖ii(glcnac(β1-3)gal(β1-4)glc)可以通过由两岐双岐杆菌的bbhl基因编码的n-乙酰己糖胺酶降解为n-乙酰氨基葡萄糖和乳糖(gal(β1-4)glc)。乳糖又进一步可以通过β-半乳糖苷酶降解为单糖葡萄糖和半乳糖(例如可以使用通过lacz基因编码的大肠杆菌β-半乳糖苷酶,可以很容易地过表达)。两歧双歧杆菌的bbh1基因也可以通过在大肠杆菌中过表达而获得。
在一个另外的和/或替代的实施方案中,该方法包括以下步骤:
i.)从发酵液中分离生物质;
ii.)向发酵液中添加一种或多种糖苷酶,其中所述糖苷酶不水解lnnt,例如-两歧双歧杆菌的bbhl的n-乙酰己糖胺酶;
iii.)将无细胞发酵液用离子交换树脂处理以除去带电物质;
iv.)对步骤iii获得的水溶液进行膜过滤步骤以除去分子量小于乳-n-新四糖的碳水化合物;
v.)对步骤iv的渗余物进行膜过滤步骤以除去分子量比乳-n-新四糖大的碳水化合物。
vi.)增加步骤v的滤液中存在的乳-n-新四糖的浓度。
在一个另外的和/或替代的实施方案中,两个膜过滤步骤中的任何一个都可以由本文之前所述的连续色谱法代替。
在一个优选的实施方案中,在发酵过程结束时,将重组微生物(更优选基因工程大肠杆菌)添加到发酵液中,其中所述重组微生物表达两歧双歧杆菌的bbhl基因,且/或表达或过表达β-半乳糖苷酶,优选由大肠杆菌lacz基因编码的β-半乳糖苷酶。
在一个另外的和/或替代的实施方案中,该方法包括以下步骤:
i.)向发酵液中加入表达两岐双岐杆菌bbhl基因和/或大肠杆菌lacz基因的重组微生物;
ii.)从发酵液中分离生物质;
iii.)将无细胞发酵液用离子交换树脂处理以除去带电物质;
iv.)对步骤ii获得的水溶液进行膜过滤步骤以除去分子量小于乳-n-新四糖的碳水化合物;
v.)对步骤iii获得的渗余物进行膜过滤步骤以除去分子量比乳-n-新四糖大的碳水化合物。
vi.)增加步骤iv的滤液中存在的乳-n-新四糖的浓度。
在一个另外的和/或替代的实施方案中,两个膜过滤步骤中的任何一个都可以由本文之前所述的连续色谱法代替。
本发明的某些实施方案包含一个或多个其它可选步骤,例如渗析步骤(用于去除盐)、电渗析(用于去除带电分子)、活性炭处理(用于产物溶液的脱色)和/或其它过滤过程(例如内毒素去除和/或无菌过滤)。尽管不是必要的,本发明的方法可以包括使用有机溶剂(例如短链醇如甲醇)处理含有lnnt的水溶液,用来沉淀杂质寡糖或使用短链醇和水的混合物进行吸附于活性炭之后的洗脱,和/或用于乳-n-新四糖的结晶。
通过特定的实施方案,并且根据附图来描述本发明,但是本发明不限于此,而是仅由权利要求限定。此外,说明书以及权利要求书中的术语“第一”、“第二”等用于区分相似的元素,而不一定用于描述时间、空间、等级或任何其他方面的顺序。应理解,如此使用的术语在合适的条件下是可以互换的,而且本文描述的本发明的实施方案可以通过不同于本文描述的或展示的顺序来操作。
应注意,权利要求书中使用的术语“包括”不应解释为限于其后列出的方式;其不排除其他元素或步骤。因此,应将其解释为具体指明所提及的所述特征、整数、步骤或组件的存在,但并不排除存在或增加一个或多个其他特征、整数、步骤或组件或其组合。因此,表述“包括组件a和b的装置”的范围不应限于仅由组件a和b组成的装置。这意指就本发明而言,所述装置的相关组件仅为a和b。
在整个说明书中,提及“一个(one或a)实施方案”意指关于该实施方案描述的具体特征、结构或特性包括在本发明的至少一个实施方案中。因此,贯穿本说明书在各处出现的短语“在一个实施方案中”并不一定总是指相同的实施方案,而是可以。此外,在一个或多个实施方案中,具体特征、结构或特性可以以任何合适的方式组合,这对于本领域普通技术人员从本公开内容是显而易见的。
类似地,应理解,在本发明的代表性实施方案的描述中,有时将本发明的各特征在单个实施方案、其附图或描述中组合在一起,以精简公开内容并促进对各个发明方面中的一个或多个的理解。本公开内容的方法不应解释为反映了以下意图:与各权利要求中明确列出的特征相比,所要求保护的发明需要更多的特征。而是,如所附权利要求所反映的,发明方面可需要比任何前文公开的单个实施方案的所有特征更少的特征。因此,将详尽说明书后面的权利要求在此明确地纳入该详尽说明书中,其中每个权利要求自身而言就是本发明一个独立的的实施方案。
此外,尽管本文所描述的一些实施方案包括一些特征,而不包括其他实施方案中所包括的其他特征,但是不同实施方案的特征的组合意欲落入本发明的范围内,并且形成不同的实施方案,如熟悉本领域的技术人员所理解的那样。例如,在以下的权利要求中,任何要求保护的实施例都可以以任意组合使用。
此外,本文中,一些实施方案被描述为可由计算机系统的处理器或通过执行功能的其他工具来执行的方法或方法的元素的组合。因此,具有用于执行所述方法或方法的元素的必要指令的处理器形成用于执行所述方法或方法的元素的工具。此外,本文描述的设备实施方案的元件为用于执行这样的功能的工具的示例,所述功能由用于实现本发明的目的的元件执行。
在本文提供的描述和附图中,阐述了许多具体细节。然而,应理解,可在没有这些具体细节的情况下实践本发明的实施方案。在其他情况下,未详细示出众所周知的方法、结构和技术,以免混淆对本说明书的理解。
现将通过对本发明的几个实施方案的详细描述来描述本发明。显然,在不脱离本发明的真实精神或技术教导的情况下,可根据本领域技术人员的知识来配置本发明的其他实施方案,本发明仅由所附各项权利要求来限制。
实施例
实施例1:发酵生产乳-n-新四糖
大肠杆菌bl21(de3)被用作宿主,用于开发适合lnnt发酵合成的菌株。以下基因在宿主菌株中失活:lacz(编码β-半乳糖苷酶,araa(编码l-阿拉伯糖异构酶),wcaj(可能编码udp-葡萄糖:十一碳二烯磷酸酯葡萄糖-1磷酸转移酶),wzxc(推定编码荚膜异多糖酸外向转运蛋白),fucl(编码l-岩藻糖异构酶),fuck(编码l-墨角藻糖激酶)。
对lnnt生产菌株进行工程改造,此外,删除了分别编码n-乙酰基-葡萄糖胺-6-磷酸脱乙酰酶和葡萄糖胺-6-磷酸脱氨酶的基因naga和nagb。为了使该菌株能够生产lnnt,将来自脑膜炎奈瑟氏球菌的lgta基因(编码β-1,3-n-乙酰葡萄糖氨基转移酶)和来自嗜沫凝聚杆菌(aggregatibacteraphrophilus)的lex-1(编码β-1,4-半乳糖基转移酶)通过转座引入bl21基因组中。来自大肠杆菌的编码乳糖通透酶的lacy也在染色体上整合。所有外源基因都是组成性转录的。为了增强在半乳糖基转移酶反应中作为供体底物的udp-半乳糖的形成,均起源于大肠杆菌k12的基因gale和galu,通过在启动子t5的控制下引入这些基因进行过表达。
除lnnt外,三糖lntii由生产菌株生产,并排至发酵液中。使用大肠杆菌bl21(de3)δlaczgal+ara-δwzxy-wcajδfuclk将在组成型启动子控制下的lacz基因和失调的乳糖通透酶基因(lacy6his)引入基因组,以构建lntii降解菌株。为了降解副产物lnt-ii,将来自两歧双歧杆菌的编码n-乙酰己糖胺酶bbhl的密码子优化基因通过染色体导入。为了更快的降解单糖n-乙酰葡萄糖胺,分别编码n-乙酰基葡萄糖胺-6-磷酸脱乙酰酶、葡萄糖胺-6-磷酸脱氨酶和pts系统n-乙酰基葡萄糖胺-专属eiicba成分的起源于宿主菌株的基因naga、nagb和nage,通过在ptet启动子和由启动子t5转录的nage的控制下引入nagab操纵子过表达。在最后一步,通过插入来自大肠杆菌k12的galetkm操纵子来改善该菌株中的半乳糖代谢。
生产菌株在化学成分明确的无机盐培养基中培养,该培养基含有7g/lnh4h2po4、7g/lk2hpo4、2g/lkoh、0.3g/l柠檬酸、2g/lmgso4x7h2o和0.015g/lcacl2x6h2o,补充1ml/l微量元素溶液(54.4g/l柠檬酸铁铵、9.8g/lmncl2x4h2o、1.6g/lcocl2x6h2o、1g/lcucl2x2h2o、1.9g/lh3bo3、9g/lznso4x7h2o、1.1g/lna2moo4x2h2o、1.5g/lna2seo3、1.5g/lniso4x6h2o),并含有葡萄糖作为碳源和能源。加入乳糖作为lnnt合成的底物。发酵以分批补料形式进行。添加氨来进行ph控制。
将用于细胞内副产物降解的第二种微生物菌株在以葡萄糖为碳源的相同培养基中培养。在lnnt生产过程结束时,将两种菌株合并在一个发酵容器中。通过hplc进行分析,当检测不到杂质性单糖、二糖和lntii时,停止该进程。
实施例2:无细胞发酵液的制备
先通过超滤(截留值为0.05μm)(cutmembranetechnology,erkrath,germany),然后通过截留分子量为150kda的错流过滤器(microdyn-nadir,wiesbaden,germany),将细胞生物质从培养基中分离(约占发酵液的13%)。根据hplc色谱图的峰面积,无细胞发酵液含有53.9%的lnnt、19.4%的glcnac、16.5%的plnnh、3.9%的三糖、4.8%的乳糖和1.5%的二糖。
实施例3:含有乳-n-新四糖的无细胞发酵液的离子交换树脂处理
将所获得的纯度为29%(按干重计)的含有8.9千克乳-n-新四糖的无细胞发酵液以500升的体积通过强阳离子交换器(从lanxess公司得到的lewatits2568),强阳离子交换器为h+形式,以除去带正电荷杂质(离子交换器床体积为200l)。使用去离子水继续进行离子交换器中的lnnt的洗脱。然后通过添加氢氧化钠溶液将所得溶液的ph调节至7。然后将溶液(无延迟)通过阴离子交换器柱(离子交换器的床体积为200l)。所用的强阴离子交换器为lewatits6368a(lanxess),其为cl-形式。使用去离子水继续进行lnnt的洗脱。将所得溶液的ph再次调节至7。
实施例4:用于除去较小的分子/碳水化合物的第一次膜处理
将通过离子交换器处理后得到的溶液使用trisepxn-45(trisepcorporation,usa)纳滤膜和800l去离子水进行渗滤。所得溶液使用纳滤膜(re8040-be,csm-saehan)进一步浓缩,获得了纯度为36.2%(以干重计)的和电导率为8ms/cm的乳-n-新四糖溶液。
实施例5:用于除去较大的分子/碳水化合物的第二次膜处理
在第二次膜处理之前,获得了通过hplc测定的纯度为57%的包含乳-n-新四糖的溶液。使用tangenxsiustff0.65kda膜(repligencorporation)进行过滤,在此过滤过程中,除去了主要的发酵副产物对-乳-n-新己糖(附图3)。
实施例6:电渗析处理
然后使用配备有pc-celled1000h膜叠层的pc-cell15电渗析设备(pc-cell,heusweiler,germany)将溶液电渗析至0.4ms/cm。此膜叠层配备有以下膜:阳离子交换膜cem:pksk以及阴离子交换膜aem:pcacid60,尺寸排阻极限60da。在电渗析过程中,使用0.025m的氨基磺酸(氨基磺酸)溶液作为电解质。作为电渗析处理的替代方法,可以采用渗滤方法。
实施例7:浓缩和活性炭处理
使用反渗透过滤器并且在45℃条件下旋转蒸发,从水溶液中除去一些水,以获得25%(m/v)的乳-n-新四糖溶液。然后将所得水溶液用活性炭(noritsa2)处理。125g活性炭用于1l的25%(m/v)乳-n-新四糖溶液。
实施例8:无菌过滤以及内毒素除去
随后,将溶液通过3kda过滤器(pallmicroza超滤中空纤维组件sep-2013,pallcorporation,dreieich,germany)进行无菌过滤。然后将无菌溶液在室温下保存直至喷雾干燥。
实施例9:乳-n-新四糖的喷雾干燥
随后使用nubilosaltc-gmp喷雾干燥器(nubilosa,konstanz,germany)将如上(实施例8)获得的无菌乳-n-新四糖进行喷雾干燥。为了乳-n-新四糖的喷雾干燥,使溶液在3.5bar的压力下通过设定为130℃的喷雾干燥器喷嘴,并调节流量以维持排气温度在67℃至69℃之间。使用这些设置,可以获得水分含量低于9%的喷雾干燥粉末。水分含量通过karl-fischer滴定法测定。
实施例10:使用na+形式的模拟移动床色谱法分离乳-n-新四糖和对-乳-n-新六糖
在使用smb分离之前,使用pc-cell电渗析设备将来自细菌发酵获得的含乳-n-新四糖的无颗粒透明溶液(20g/l)电渗析至电导率为0.5ms/cm。除了乳-n-新四糖(占碳水化合物总量的66.23%)之外,该溶液还含有作为发酵主要副产物的对-乳-n-新六糖(占碳水化合物总量的18.58%)。对于使用钠作为抗衡离子的smb色谱法,在40℃的真空下将乳-n-新四糖溶液浓缩至200g/l(20%w/v)。或者,可以通过使用纳滤膜(来自trisep的xn45)浓缩乳-n-新四糖溶液。
对于smb色谱法,使用了一个密闭的smb系统,该系统配有12个色谱柱(尺寸为40mmx740mm的
该系统在30℃下使用以下参数设置进行操作:区域i的流速设定为30.00ml/min,区域ii的流速设定为21.60ml/min,区域iv的流速设定为20.54ml/min。进料保持在1.5ml/min,洗脱流速设定在4.46ml/min,切换时间为13.35min。将蒸馏水用作洗脱液。
在这些参数下,将乳-n-新四糖和较小的中性寡糖(如三糖)(糖基化或半乳糖基化的乳糖)分离至提取液中,而对-n-新己糖则在剩余液中洗脱。乳-n-新四糖的纯度为87.3%,而不是smb进料时的66.23%,并且对-乳-n-新己糖的含量降低至1.08%(附图4至6)。
实施例11:乳-n-新四糖的hplc分析
用于分析包含lnnt的溶液的hplc系统,由系统控制器scl-10avp、两个泵lc-10avp、柱温箱cto-10avp、自动进样器sil-hta和折射率检测器rid-10a组成。所有模块都采购于shimadzu(kyoto.japan)。此外,此系统使用前置柱xbridgebehamidevangd,3.5μm,3.9x5mm(waters,eschborn,germany)以及hplc柱xbridgebehamide,3.5μm,4.6x250mm(waters,eschborn,germany)。溶剂包含71%的乙腈、28.9%的h2o和0.1%的nh4oh。流速设定为1.4ml/min。所有hplc测量均在35℃下使用溶剂等度进行,并对数据进行定性分析。
实施例12:乳-n-新四糖的lc-ms/ms分析
为了lc-ms分析确定lnnt相对于干物质的纯度,使用nexerax2lc系统(shimadzu,kyoto,japan),其包含lc-30ad泵、自动进样器sil-30ac、lcms-8050质谱仪(esi-ms检测器)、xbridgebehamide3.5μm,50x2.1mm柱(waters,eschborn,germany)以及xbridgebehamide3.5μm前置柱(waters,eschborn,germany)。溶剂包含60%乙腈、39.9%ddh2o和0.1%nh4oh,并且流速设定在0.3ml/min。所有分析均在35℃下使用溶剂等度进行。乳-n-新四糖采购于oligotech(crolles,france)并作为内标。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



