人参枸杞发酵液及其制备方法与流程
 2021-01-07 10:01:47|
2021-01-07 10:01:47| 418|
418| 起点商标网
起点商标网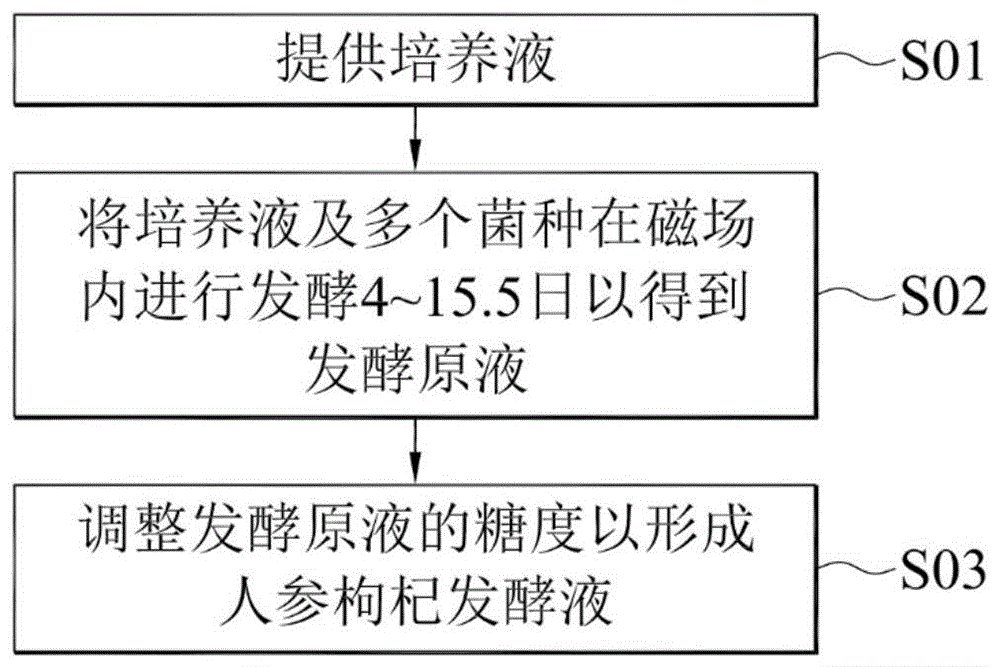
本发明关于一种发酵液饮品,更具体的涉及一种人参枸杞发酵液饮品及其制法。
背景技术:
由微生物发酵的食品具有更易于消化、香味增加、储藏时间提升等优势。例如:泡菜、纳豆、水果醋等等都是广受欢迎的发酵类食品。
在饮品界中,发酵饮品也愈来愈受到消费者的喜爱。发酵饮品常以乳品、蔬菜、水果、豆类等为原料基底,再经由不同种类的微生物作用而制得。
技术实现要素:
有鉴于此,本发明提供一种人参枸杞发酵液及其制法,其能进一步提升发酵饮品的机能。于此,以中药材为基底,精选高效能的菌种,并且经由磁场发酵过程以制得人参枸杞发酵液。
在一实施例中,人参枸杞发酵液的制备方法包括:提供培养液;将培养液及复数菌种在磁场内进行发酵4~15.5日以得到发酵原液;调整发酵原液的糖度以形成人参枸杞发酵液。其中,培养液包括由1重量份的人参、1重量份的枸杞及50重量份的水所形成的人参枸杞溶液及人参枸杞溶液总重的10%的葡萄糖,复数菌种包括相对于培养液为0.01%~0.5%的酵母菌、相对于培养液为0.01%~0.25%的乳酸菌及相对于培养液为3~10%的醋酸菌。
在一实施例中,将培养液及菌种在磁场内进行发酵的步骤包括:将酵母菌在磁场内进行发酵1~2.5日后形成第一初发酵液;添加乳酸菌于第一初发酵液内并在磁场内发酵1~3日后形成第二初发酵液;添加醋酸菌于第二初发酵液内并于磁场内发酵3~10日后形成初发酵液;过滤初发酵液以得到发酵原液。
在一实施例中,过滤初发酵液的步骤包括在60℃下减压浓缩及以200mesh过滤初发酵液。
在一实施例中,发酵原液的糖度小于等于4°bx。
在一实施例中,提供培养液的步骤包括:混合人参枸杞溶液及葡萄糖形成混合液;将混合液于50-100℃下提取0.5-1.5小时以得到培养液。
在一实施例中,酵母菌为saccharomycescerevisiae,乳酸菌为lactobacillusplantarum,醋酸菌为acetobacteraceti。
在一实施例中,调整发酵原液的糖度的步骤包括:添加寡糖至发酵原液以使发酵原液的糖度达到40°bx以形成人参枸杞发酵液。
在一实施例中,本发明提供一种人参枸杞发酵液,系经由上述的人参枸杞发酵液的制备方法所制得。
在一实施例中,人参枸杞发酵液的总多酚含量为436μg/ml以上。
在一实施例中,人参枸杞发酵液的黄酮含量为12703μg/ml以上。
综上,根据任一实施例的人参枸杞发酵液的制备方法,其能增添人参枸杞发酵液的机能性,缩短发酵时间,并提升人参枸杞发酵液内的多酚及黄酮含量。在一实施例中,在发酵过程中分次依序加入复数菌种并且控制使用各菌种的发酵时间,以使得菌种能有最佳的生长,并且进一步提升人参枸杞发酵液的有效成分浓度。在一实施例中,藉由浓缩初发酵液以利后续进行人参枸杞发酵液的风味及口感的调整。在一实施例中,藉由监控发酵过程中的ph值及糖度来确保发酵过程顺利完成。在一实施例中,藉由将葡萄糖与人参枸杞溶液一起加热有助于溶解葡萄糖,并且避免培养液受到污染。在一实施例中,利用寡糖调整甜度口感,以降低热量。
附图说明
图1是本发明一实施例的发酵液的制法的流程图。
图2是图1步骤s02的细部的流程图。
图3是总多酚含量测试结果数据图。
图4是总黄酮含量测试结果数据图。
图5是相对粒线体活性检测结果数据图。
图6是相对丙酮酸盐含量结果数据图。
图7是il-1b引子的基因的相对表现率数据图。
图8是il-10引子的基因的相对表现率数据图。。
其中,附图标记:
步骤s01、s02、s03、s21、s22、s23、s24
生物材料的保藏
啤酒酵母tci028,于2019年5月2日提交到dsmz德国微生物与细胞搜集中心保藏,地址:德国布伦瑞克市因霍芬大街7b,邮编d-31824(inhoffenstr7b,d-38124braunschweig),保藏号为:dsm33108;
胚芽乳酸杆菌tci378,于2017年3月13日提交到dsmz德国微生物与细胞搜集中心保藏,地址:德国布伦瑞克市因霍芬大街7b,邮编d-31824(inhoffenstr7b,d-38124braunschweig),保藏号为:dsm32451;
嗜热链球菌tci633,于2013年12月02日提交到dsmz德国微生物与细胞搜集中心保藏,地址:德国布伦瑞克市因霍芬大街7b,邮编d-31824(inhoffenstr7b,d-38124braunschweig),保藏号为:dsm28121。
具体实施方式
以下通过具体实施方式对本发明进一步的描述。本发明的各附图仅为示意以更容易了解本发明,其具体比例可依照设计需求进行调整。文中所描述的图形中相对元件的上下关系,在本领域技术人员应能理解是指构件的相对位置而言,对应的,以元件在上一面为正面、在下一面为背面以便于理解,因此皆可以翻转而呈现相同的构件,此皆应同属本说明书所揭露的范围。
于下列实施方式的说明中,除非另有相关说明,则「%」符号是指重量百分比。
参考图1。在一实施例中,人参枸杞发酵液的制备方法包括下列步骤:提供培养液(步骤s01)、将培养液及复数菌种在磁场内进行发酵4~15.5日以得到发酵原液(步骤s02)、以及调整发酵原液的糖度(degreesbrix,°bx)以完成人参枸杞发酵液(步骤s03)。
在步骤s01中,培养液包括由1重量份的人参、1重量份的枸杞及50重量份的水所形成的人参枸杞溶液及人参枸杞溶液总重的10%的葡萄糖。在一些实施例中,人参(panaxginseng)系采用无炮制过的干燥白蔘根部。枸杞(lyciumchinense)系采用干燥枸杞果实。
在一实施例中,步骤s01可包括:依上述比例混合人参、枸杞及葡萄糖形成混合液;以及将混合液于50-100℃下提取0.5-1.5小时以得到培养液。于此,将葡萄糖与人参枸杞溶液一并进行提取程序,藉以助于葡萄糖溶解并且还可以避免污染。
在另一个实施例中,步骤s01包括:将人参、枸杞及水于50-100℃下提取0.5-1.5小时形成水萃液;以及将葡萄糖加入水萃液以得到培养液。于此,将人参和枸杞单独进行提取程序,以利于人参及/或枸杞内有效成分的确实地释出。
在一些实施例中,提取系指将混合液维持在50-100℃并静置0.5-1.5小时。在一实施例中,提取系指将混合液维持在95℃并静置1小时。
在一实施例中,培养液的糖度为9°bx~10°bx。于此,足够的糖度可以确保后续发酵的顺利进行,菌种可以有足够的养份。
后续,将培养液及复数菌种在磁场内进行发酵4~15.5日以得到发酵原液(步骤s02)。其中,复数菌种包括相对于培养液为0.01%~0.5%的酵母菌、相对于培养液为0.01%~0.25%的乳酸菌及相对于培养液为3~10%的醋酸菌(acetobacteraceti)。在一实施例中,培养液不另滤除其内部的固形物(提取后的人参和/或枸杞)直接加入菌种进行发酵,藉以利用菌种进一步提取固形物中的活性成分。
在一实施例中,酵母菌可以是啤酒酵母(saccharomycescerevisiae)。举例而言,采用寄存编号atcc26602的啤酒酵母tci028。但本发明不以此为限,酵母菌可以为市售啤酒酵母。
在一实施例中,乳酸菌可以是为胚芽乳酸杆菌(lactobacillusplantarum)、嗜热链球菌(streptococcusthermophiles)或植物乳杆菌。举例而言,采用寄存编号dsm33108胚芽乳酸杆菌菌株或寄存编号dsm32451菌株的胚芽乳酸杆菌tci378。再举例而言,采用的寄存编号dsm28121的嗜热链球菌tci633。本发明不以此为限,可以为其它市售乳酸菌。
在一实施例中,采用寄存编号atcc15973菌株的醋酸菌(acetobacteraceti(pasteur)beijerinck)。
参考图2。在一实施例中,步骤02可包括:将酵母菌在磁场内进行发酵1~2.5日后形成第一初发酵液(步骤s21);添加乳酸菌于第一初发酵液内并在磁场内发酵1~3日后形成第二初发酵液(步骤s22);添加醋酸菌于第二初发酵液内并于磁场内发酵3~10日后形成初发酵液(步骤s23);以及过滤初发酵液以得到发酵原液(步骤s24)。
在步骤s21中,透过先添加酵母菌可以使培养液发酵以产生酒精;于此,酒精有利提取出人参与枸杞内不同的有效成份。在一些实施例中,第一初发酵液的ph值小于4,且其糖度约为9°bx。
在步骤s22中,透过添加乳酸菌可以使得第一初发酵液内的葡萄糖被进一步消耗而降低糖度并且产生乳酸,以降低第一初发酵液的ph值;于此,降低第一初发酵液的ph值有利于进一步提取人参与枸杞内其他不同有效成分。在一些实施例中,第二初发酵液的ph值小于3.5,且其糖度约为6°bx。
在步骤s23中,透过添加醋酸菌可以使得第二初发酵液内的酒精被消耗,而进一步再降低葡萄糖的含量。在一些实施例中,初发酵液的ph值小于3.5,且其糖度为约为3°bx。
在步骤s24的一实施例中,可以是过滤并浓缩初发酵液以得到发酵原液。在一示范例中,浓缩方式可以采取在60℃下的减压浓缩,以及过滤方式可以是以200mesh过滤。在一些实施例中,发酵原液的糖度约为2°bx。在一些实施例中,发酵原液的ph值小于3.5。
在步骤s03的一实施例中,可以是添加寡糖至发酵原液以使发酵原液的糖度达到40°bx以形成人参枸杞发酵液。于此,寡糖系指由3~10个单醣分子聚合而成的低聚糖。其中,寡糖可为果寡糖、半乳寡糖、木寡糖、异麦芽寡糖等等。在一实施例中,所添加的寡糖可为含40%~70%异麦芽寡糖的寡糖溶液。
在一实施例中,步骤s03所得的人参枸杞发酵液的总多酚含量为436.33μg/ml。在一实施例中,人参枸杞发酵液的黄酮含量为12703μg/ml。
示范例一:人参枸杞发酵液的制备
将人参、枸杞、水与葡萄糖混合成为混合液。在混合液中,人参为1重量份、枸杞为1重量份以及水为50重量份,并且葡萄糖为人参、枸杞与水所形成的人参枸杞溶液总重的10%。接着,将混合液于95℃下提取1小时以得到培养液。待培养液冷却之后置入其外围设置有磁铁的发酵桶内。添加相对于培养液为0.01%的啤酒酵母于发酵桶中的培养液内,然后于30℃下进行发酵1天以形成第一初发酵液。再添加相对于培养液为0.05%的dsm33108菌株的胚芽乳酸杆菌于发酵桶中的第一初发酵液内,然后进行发酵1天以形成第二初发酵液。最后添加相对于培养液为5%的atcc15973菌株的醋酸菌于发酵桶中的第二初发酵液内,然后进行发酵5天以得到发酵原液。于得到发酵原液后,在60℃下减压浓缩及以200mesh过滤初发酵液以得到发酵原液。然后,以异麦芽寡糖60%及发酵原液40%之比例进行混合以使发酵原液的糖度达到40°bx而形成a组人参枸杞发酵液。于此,发酵桶外围设置的磁铁能在发酵桶内形成磁场,以致前述于发酵桶内的溶液在磁场内进行各阶段的发酵。
另外,采用与a组人参枸杞发酵液相同的原料比例与发酵程序,但其发酵桶外围并未设置磁铁,来制得b组人参枸杞发酵液。
实验一:发酵阶段ph值及糖度数值的测定结果
在制备过程中各阶段形成的溶液的ph值及糖度数值测定如下。
由上述可见,a组人参枸杞发酵液在各阶段的ph值及糖度都比b组人参枸杞发酵液更低;其代表相较于b组人参枸杞发酵液,a组人参枸杞发酵液的发酵作用的进行更为顺利,其菌种的活性较佳,代谢产物较多,且葡萄糖的被利用率较佳。换句话说,在磁场内发酵可以明显提升发酵的效率。
实验二:总多酚含量测试
分别以前述示范例一所得的a组人参枸杞发酵液及b组人参枸杞发酵液为样本。将各样本以水稀释10倍后取100ml到离心管中。接着,加入500μl的folin-ciocalteu酚试剂至离心管中与稀释后的样本混合并静置3分钟后,再加入400μl的7.5%碳酸钠混匀静置30分钟后以得到待测反应溶液。于二次静置后,取200μl的待测反应溶液至96孔板中,并测量待测反应溶液于750nm下的吸光值。
并且,以没食子酸(gallicacid)作为标准品制作标准曲线。于此,配置0μl/ml、20μl/ml、40μl/ml、60μl/ml、80μl/ml、及100μl/ml的没食子酸的标准溶液,并分别取100μl的各浓度的标准溶液至10ml离心管中。加入500μl的folin-ciocalteu酚试剂至离心管内与标准溶液混合并静置3分钟后,再加入400μl的7.5%碳酸钠混匀静置30分钟后以得到标准反应溶液。取200μl的标准反应溶液96孔板中,并测量其在750nm下的吸光值,以获得标准曲线。
接着,利用标准曲线将待测反应溶液的吸光值换算成总多酚含量。于此,可得到a组人参枸杞发酵液总多酚含量为436.33μg/ml及b组人参枸杞发酵液中总多酚含量202μg/ml,如图3所示。
由实验结果可知,a组人参枸杞发酵液总多酚含量较b组人参枸杞发酵液总多酚含量提升21%;基此可知在磁场内进行发酵更有利于有效成份的提取。
实验三:总黄酮含量测试
分别以前述示范例一所得的a组人参枸杞发酵液及b组人参枸杞发酵液为样本。将各样品以水稀释20倍至1200ul,并分别加入200μl的5%亚硝酸钠并混合后静置6分钟后,再加入200μl的10%硝酸铝并混合后静置6分钟,接着加入2ml的4%氧氧化钠并混合,最后再加入1.4ml的水并混合以得到待测反应溶液。将待测反应溶液至96孔板中,并以分光光度计测量待测反应溶液在500nm下的吸光值。
并且,以芸香苷(rutin)作为标准品以制作标准曲线。于此,配置0μg/ml、400μg/ml、600μg/ml、1000μg/ml及1200μg/ml之没芸香苷的标准溶液。将各标准溶液分别加入200μl的5%亚硝酸钠并混合后静置6分钟后,再加入200μl的10%硝酸铝并混合后静置6分钟,接着加入2ml的4%氧氧化钠并混合,最后再加入1.4ml的水并混合以得到待测标准品溶液。将200μl的待测标准品溶液移至96孔板中,并以分光光度计测量待测反应溶液在500nm下的吸光值分别为0μg/ml的吸光值为0.035、400μg/ml的吸光值为0.13、600μg/ml的吸光值为0.183、1000μg/ml的吸光值为0.273及1200μg/ml的吸光值为0.335,并以上述结果依线性回归计算以获得标准曲线。
接着,利用标准曲线将待测反应溶液的吸光值换算成总黄酮含量。于此,可得到a组人参枸杞发酵液的总黄酮含量为12703μg/ml及b组人参枸杞发酵液的总黄酮含量8315μg/ml,如图4所示。
由实验结果可知,a组人参枸杞发酵液的总黄酮含量较b人参枸杞发酵液的总黄酮含量提升52%;基此可知在磁场内进行发酵能大幅提升有效成份的提取量。
实验四:粒线体活性实验
此实验采用小鼠骨胳肌肉细胞(c2c12,
将细胞分为四组进行,第一组到第三组包括2ml上述培养基并接种1×105的细胞及样本,第一组样本为前述示范例一所得的a组人参枸杞发酵液,第二组样本为b组人参枸杞发酵液、第三组样本为示范例一的制备过程中所形成的培养液,第四组细胞未作施加任何溶液处理(即空白对照组)。上述各组在37℃下培养24小时。于此,第一组到第三组的培养基内样本浓度为0.03125%。
于24小时后,采用bdtm,mitoscreen,(jc-1)染剂对空白及处理后的各组细胞进行染色15min,再以jc-1分析缓冲液清洗二次,然后采用bdaccuric6plus流式细胞仪量测pbmc粒线体的膜电位,以得到粒线体的膜电位的活性数据。为避免实验操作误差,各组以相同步骤操作三次,实验数据如下表一所示:
表一
依上述三组实验数据之平均值绘制图5。由图5可见,分析换算之后得到第一组相对活性为47.2%,第二组相对活性为40.1%,第三组相对活性为38.0%,第四组相对活性为38.92;基此可知,a组人参枸杞发酵液及b组人参枸杞发酵液皆可以提升骨骼肌细胞中粒线体的活性,其中a组人参枸杞发酵液提升幅度最明显。
实验五:基础代谢率提升实验
此实验采用小鼠骨胳肌肉细胞(c2c12,atcccrl-1772)。于此,培养基包括dmem细胞培养液(dulbecco’smodifiedeagle’smedium)、3.7g/l碳酸氢钠、100i.u.青霉素、100μg/ml链霉素(penicillin-streptomycin,gibco)以及10%胎牛血清(fbs,gibco)。
将细胞分为四组进行,第一组到第三组包括2ml上述培养基并接种1×105的细胞及样本,第一组样本为前述示范例一所得的a组人参枸杞发酵液,第二组样本为b组人参枸杞发酵液、第三组样本为示范例一的制备过程中所形成的培养液,第四组细胞未作施加任何溶液处理(即空白对照组)。于此,第一组到第三组的培养基内样本浓度为0.03125%。
接下来,依下述程序处理各组细胞。将细胞以条件培养基(含有1%fbs及1%马血清的dmem)进行培育以分化出粒线体,添加上述样本处理细胞48小时,以100μl丙酮酸缓冲液裂解细胞,将细胞在4℃下以10000g离心10分钟并收集上清液,在上清液内添加20μl溶液液(lysates)并添加丙酮酸测定缓冲液至总体积50μl,混入反应混合物(丙酮酸测定缓冲液46μl、丙酮酸探针2μl及酶混合液2μl)并培育30分钟,并以分光光度计测量待测反应溶液在570nm下的吸光值。
并且,以丙酮酸作为标准品以制作标准曲线。于此,配置0、2、4、6、8及10nmol/μl之丙酮酸的标准溶液。依上述结果与标准曲线依线性回归计算以获得丙酮酸盐的含量,以来确认细胞的代谢状态。于此,所测得丙酮酸盐相对含量如图6所示。
由图6可见,相较于空白对照组(即以第四组细胞的相对表现率为1的情况),第一组细胞的相对表现率为3.23,第二组细胞的相对表现率为2.39,第三组细胞的相对表现率为2.34。可知,b组人参枸杞发酵液可以提升细胞的基础代谢率达239%,而a组人参枸杞发酵液更能提升细胞的基础代谢率达320%。
实验六:提升免疫力基因表现实验
此实验采用人类单核球细胞(thp-1细胞株,atcctib202)。于此,培养基包括培养液(rpmi-1640,gibco)为基底,添加有10%胎牛血清(gibco)、0.05mm二硫基乙醇、100units/ml青霉素和100μg/ml链霉素。
实验共分四组进行,第一组到第三组为实验组,第一组样本为前述示范例一所得的a组人参枸杞发酵液,第二组样本为b组人参枸杞发酵液、第三组样本为示范例一的制备过程中所形成的培养液,第四组细胞未作施加任何溶液处理(即空白对照组)。
接下来,依下述程序处理细胞。提取2ml上述培养基并接种1×105的细胞,添加上述样本以处理细胞持续24小时,利用rna提取试剂(geneaid)提取rna,用逆转录酶(
采用下表二所式的引子(primer)以聚合酶连锁反应(pcr)仪观察thp-1细胞株的il-1β及il-10的基因表现率,其结果如图7及图8。
表二
*r为reverse反向,f为forward顺向。
由图7可见,相较于空白对照组(相对表现率为1的情况),第一组细胞的il-1β的相对表现率为1.53,第二组细胞的il-1β的相对表现率为0.41,而第三组细胞的il-1β的相对表现率为0.36。在由图8可见,相较于空白对照组(相对表现率为1的情况),第一组细胞的il-10的相对表现率为1.14,第二组细胞的il-10的相对表现率为0.87,而第三组细胞的il-10的相对表现率为0.6。可知,人参枸杞发酵液可以提升免疫力。
在一些实施例中,所得的人参枸杞发酵液可可进一步作为食品添加物(foodadditive),以致得含有人参枸杞发酵液的食品组合物。于此,能藉由习知方法于原料制备时添加任一实施例的人参枸杞发酵液,或是于食品的制作过程中添加任一实施例的人参枸杞发酵液,而与任一种可食性材料配制成供人类与非人类动物摄食的食品产品(即食品组合物)。
在一些实施例中,食品产品种类包括但不限于:饮料(beverages)、发酵食品(fermentedfoods)、烘培产品(bakeryproducts)、健康食品(healthfoods)以及膳食补充品(dietarysupplements)。
虽然本发明的技术内容已经以较佳实施例揭露如上,然其并非用以限定本发明,任何熟习此技艺者,在不脱离本发明的精神所作些许的更动与润饰,皆应涵盖于本发明的范畴内,因此本发明的保护范围当视后附的申请专利范围所界定者为准。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



