一种腐生型兰花的快繁和离体保存方法与流程
 2021-01-06 18:01:32|
2021-01-06 18:01:32| 460|
460| 起点商标网
起点商标网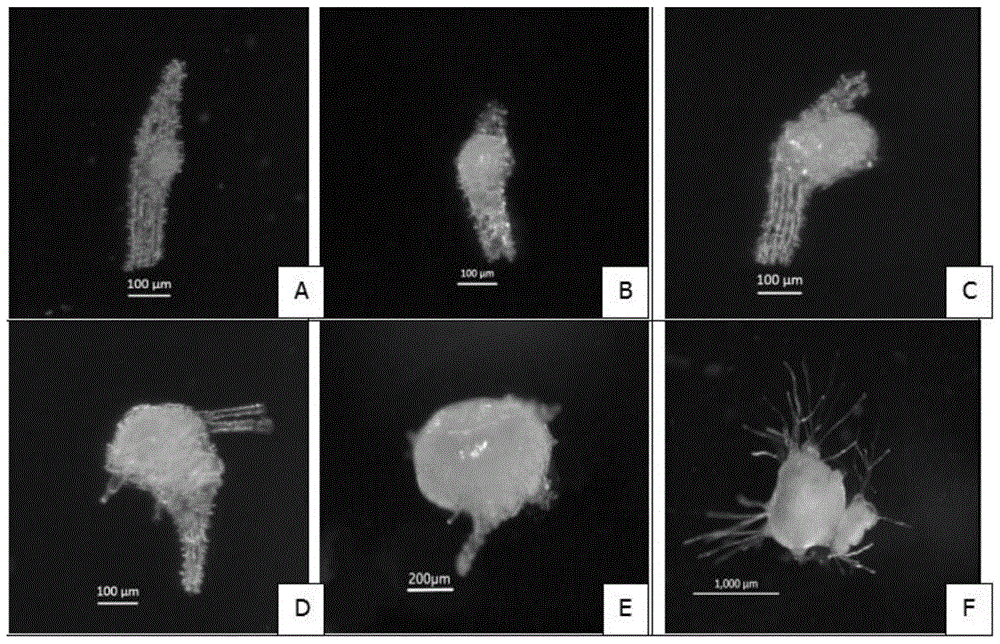
本发明属于植株繁育技术领域,具体涉及一种腐生型兰花的快繁和离体保存方法。
背景技术:
大根兰(cymbidiummacrorhizon)为兰科兰属植物,不具绿叶,是该属植物中唯一的腐生型物种,分布在我国的四川、云南、贵州和广西海拔400~2100米的林下或林缘。通常,兰花植物的种子极为细小,长约0.05~6.0mm,宽约0.01~0.9mm,每个果实所含种子数量从几千粒到几百万粒不等,但因其种子不含胚乳,在自然条件下萌发率却很低。传统上对兰科物种仍多采用分株方式进行繁殖,但效率不高。因腐生兰需要依靠与真菌共生获得养分生长,分株繁殖更是难上加难。腐生兰花具有重要的药用价值,但因其腐生的特性,野外资源储量不大。目前兰科的腐生型物种当中仅天麻实现了人工繁殖并创造了巨大价值,其他腐生兰的人工培养尚未见有成功。随着生态环境的改变和人为活动的干扰加剧,腐生兰生境极易遭到破坏,导致其处于极易灭绝的状态。“国兰”通常指的是兰属的物种,例如,春兰、寒兰和建兰等,大根兰是兰属中唯一的不能光合自养的腐生兰,对其开展相关研究,将对进一步深入研究该属的物种演化关系、基因功能缺位、新品种培育和资源利用具有重要意义。解决腐生型兰科植物的资源保护和利用等问题,关键的是先解决其种子非共生萌发、增殖培养和离体保存等问题。
技术实现要素:
有鉴于此,本发明的目的在于提供一种腐生型兰花的快繁和离体保存方法,实现人工组培快繁和种质资源的离体保存,为后续资源研究、开发、可持续利用和种质资源的交换等提供技术支持。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种腐生型兰花的快繁和离体保存方法,包括以下步骤:(1)对开花的腐生型兰花进行人工异株授粉,选择授粉后160~200d的未开裂果荚作为外植体;
(2)将清洗、消毒后的外植体剥开,使种子散布在无菌萌发培养基表面进行暗培养,长出假根后得萌发种子;所述无菌萌发培养基包括以下组分的水溶液:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l/、肌醇100mg/l、naa0.1~0.5mg/l、椰子汁50~100ml/l、蔗糖20g/l和琼脂5.6g/l;
(3)待所述萌发种子的根状茎长至0.8~1.2cm时,将所述根状茎转接至根状茎诱导和增殖培养基上进行暗培养,得快繁苗;所述根状茎诱导和增殖培养基包括以下组分的水溶液:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l、肌醇100mg/l、6-ba5~10mg/l、kt2~5mg/l、椰子汁100~200ml/l、蔗糖30g/l、琼脂5.6g/l和活性炭1g/l;
(4)将所述萌发种子的根状茎或所述快繁苗的根状茎移植于离体保存培养基中进行离体保存,所述离体保存培养基包括:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l、肌醇100mg/l、naa0.1~0.5mg/l、蔗糖20g/l和琼脂5.6g/l。
优选的,步骤(1)所述腐生型兰花包括大根兰(cymbidiummacrorhizon)。
优选的,步骤(2)所述清洗、消毒包括:用纱布擦洗所述外植体的表面,在无菌环境中用体积百分含量为75%的酒精浸泡1min,再用质量百分含量为0.2%的hgcl2水溶液浸泡10min,之后用无菌水冲洗5次。
优选的,步骤(2)所述暗培养的时间为50~120d。
优选的,步骤(2)和步骤(3)所述暗培养的温度均为25±2℃。
优选的,步骤(4)所述离体保存的温度为25±2℃。
本发明提供了一种腐生型兰花的快繁和离体保存方法,以人工授粉后获得的果荚为对象,通过消毒、种子无菌萌发获得原球茎,并对其进行诱导获得假根(根状茎),并以根状茎为对象进一步建立大根兰的离体保存体系,半年内的增殖系数达1:4,离体保存继代周期达2年左右。本发明所述快繁和离体保存方法有效地解决了腐生型兰花组培快繁问题,延长了其离体保存周期,有利于进一步对腐生型兰科种质资源的保存和开发利用,为今后的资源挖掘奠定基础。
附图说明
图1为大根兰种子无菌萌发过程,其中a表示大根兰种子;b表示培养26d时,大根兰种子的胚开始膨大;c表示培养43d时,胚突破种皮;d/e表示培养54d时,出现假根;f表示培养到120d时,分化出根状茎;
图2为经增殖诱导获得的大根兰无菌根状茎。
具体实施方式
本发明提供了一种腐生型兰花的快繁和离体保存方法,包括以下步骤:(1)对开花的腐生型兰花进行人工异株授粉,选择授粉后160~200d的未开裂果荚作为外植体;
(2)将清洗、消毒后的外植体剥开,使种子散布在无菌萌发培养基表面进行暗培养,长出假根后得萌发种子;所述无菌萌发培养基包括以下组分的水溶液:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l/、肌醇100mg/l、naa0.1~0.5mg/l、椰子汁50~100ml/l、蔗糖20g/l和琼脂5.6g/l;
(3)待所述萌发种子的根状茎长至0.8~1.2cm时,将所述根状茎转接至根状茎诱导和增殖培养基上进行暗培养,得快繁苗;所述根状茎诱导和增殖培养基包括以下组分的水溶液:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l、肌醇100mg/l、6-ba5~10mg/l、kt2~5mg/l、椰子汁100~200ml/l、蔗糖30g/l、琼脂5.6g/l和活性炭1g/l;
(4)将所述萌发种子的根状茎或所述快繁苗的根状茎移植于离体保存培养基中进行离体保存,所述离体保存培养基包括:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l、肌醇100mg/l、naa0.1~0.5mg/l、蔗糖20g/l和琼脂5.6g/l。
本发明对开花的腐生型兰花进行人工异株授粉,选择授粉后160~200d的未开裂果荚作为外植体。本发明所述腐生型兰花优选包括大根兰(cymbidiummacrorhizon)。本发明优选在野外选择生长健壮的大根兰(cymbidiummacrorhizon)开花植株进行人工异株授粉,更优选的选择完全展开1~2d的花朵进行授粉,采用消毒的竹牙签挑取花粉粒粘在另一株花的柱头上,然后做好标记。本发明在所述授粉后180d左右,大根兰的果荚变成淡黄绿色但未开裂,内含大量发育完整的种子,取该时期的果荚作为后续实验的外植体。
本发明将清洗、消毒后的外植体剥开,使种子散布在无菌萌发培养基表面进行暗培养,长出假根后得萌发种子;所述无菌萌发培养基包括以下组分的水溶液:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l/、肌醇100mg/l、naa0.1~0.5mg/l、椰子汁50~100ml/l、蔗糖20g/l和琼脂5.6g/l。本发明所述清洗、消毒优选包括:用纱布擦洗所述外植体的表面,在无菌环境中用体积百分含量为75%的酒精浸泡1min,再用质量百分含量为0.2%的hgcl2水溶液浸泡10min,之后用无菌水冲洗5次。本发明所述无菌环境优选为超净工作台。本发明优选利用滤纸吸干消毒后果荚的表面水分,用剪刀将果荚纵向剖开,抖动果壳使种子散布在预先配好的无菌萌发培养基表面。本发明所述无菌萌发培养基中,椰子汁含有兰花种子萌发所需的丰富营养,配合花宝1号等大量元素和所述浓度细胞生长素naa的使用,可进一步促进种子萌发及后续根状茎的生长。本发明在所述无菌萌发培养基上对种子进行暗培养,所述暗培养的温度为25±2℃,本发明实施例中以大根兰为例进行所述暗培养,当培养26d时,大根兰种子开始发育,但未破皮;培养43d时,大根兰种子开始破皮;培养54d时,破皮的大根兰种子开始长假根,萌发率60%左右,继续培养到120d时,原球茎逐步分化出根状茎。
待所述萌发种子的根状茎长至0.8~1.2cm时,本发明将所述根状茎转接至根状茎诱导和增殖培养基上进行暗培养,得快繁苗;所述根状茎诱导和增殖培养基包括以下组分的水溶液:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l、肌醇100mg/l、6-ba5~10mg/l、kt2~5mg/l、椰子汁100~200ml/l、蔗糖30g/l、琼脂5.6g/l和活性炭1g/l。本发明优选将长1cm的根状茎转接至根状茎诱导和增殖培养基上进行暗培养,所述暗培养的温度优选为25±2℃。本发明实施例中,将大根兰长1cm的根状茎转接至根状茎诱导和增殖培养基后1个月左右,即可观察到根状茎的明显伸长,并开始出现分叉状增殖生长,当培养6个月时,根状茎增殖倍数可达4倍以上,此时根状茎生长良好,没有褐化或者枯死现象。本发明所述根状茎诱导和增殖培养基中,两种较高浓度的细胞分裂素kt和6-ba的使用,并配以大量的椰子汁,为大根兰根状茎的增殖和伸长提供丰富的养分需求。
本发明将所述萌发种子的根状茎或所述快繁苗的根状茎移植于离体保存培养基中进行离体保存,所述离体保存培养基包括:花宝1号3g/l、维生素b60.5mg/l、维生素b10.1mg/l、烟酸0.5mg/l、甘氨酸2mg/l、肌醇100mg/l、naa0.1~0.5mg/l、蔗糖20g/l和琼脂5.6g/l。
本发明所述离体保存的温度为25±2℃,利用本发明所述方法进行离体保存,可保存2年之后,将存活的根状茎转至根状茎的诱导和增殖培养基中,又可获得大量根状茎材料。
下面结合实施例对本发明提供的一种腐生型兰花的快繁和离体保存方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
1、外植体的获得
在野外选择生长健壮的大根兰(cymbidiummacrorhizon)开花植株进行人工异株授粉。昆明地区大根兰的花期在7月中旬左右,选择完全展开1~2d的花朵进行授粉,采用消毒的竹牙签挑取花粉粒粘在另一株花的柱头上,然后做好标记。授粉后180d左右,大根兰的果荚变成淡黄绿色但未开裂,内含大量发育完整的种子,取该时期的果荚作为后续实验的外植体。
2、外植体的消毒和无菌萌发
先用干净纱布擦洗尚未开裂的大根兰果荚表面,移入超净工作台后再用75%酒精(体积分数)灭菌1分钟,再用0.2%(质量分数)hgcl2溶液浸泡10min,期间摇晃器皿使其消毒均匀,之后用无菌水冲洗5次,消毒后的果荚用滤纸吸干表面水分,最后用剪刀将果荚纵向剖开,抖动果壳使种子散布在预先配好的种子无菌萌发培养基(每升含花宝1号3g、维生素b60.5mg、维生素b10.1mg、烟酸0.5mg、甘氨酸2.0mg、肌醇100mg、naa0.5mg、椰子汁50ml、蔗糖20g、琼脂5.6g)表面。培养温度25±2℃,暗培养,当培养26d时,大根兰种子开始发育,但未破皮;培养43d时,大根兰种子开始破皮;培养54d时,破皮的大根兰种子开始长假根,萌发率60%左右。继续培养到120d时,原球茎逐步分化出根状茎(图1)。
3、根状茎的诱导和增殖
将经由种子无菌萌发生长获得的长约1cm左右的大根兰根状茎转接至根状茎诱导和增殖培养基(每升含花宝1号3.0g、维生素b60.5mg、维生素b10.1mg、烟酸0.5mg、甘氨酸2.0mg、肌醇100mg、6-ba8.0mg、kt2.0mg、100.0ml椰子汁、3%蔗糖、琼脂5.6g、活性炭1.0g)上。转入后1个月左右,即可观察到根状茎的明显伸长,并开始出现分叉状增殖生长(图2)。当培养6个月时,根状茎增殖倍数可达4倍以上,此时根状茎生长良好,没有褐化或者枯死现象。培养温度为25±2℃,暗培养。
4、离体保存
将长约0.5cm的根状茎接种到离体保存培养基(每升含花宝1号3.0g、维生素b60.5mg、维生素b10.1mg、烟酸0.5mg、甘氨酸2.0mg、肌醇100mg、naa0.5mg、蔗糖20g、琼脂5.6g)上,根状茎长的一端可以继续生长,但另一端会出现褐化。保存2年之后,将存活的根状茎转至根状茎的诱导和增殖培养基中,又可获得大量根状茎材料。培养温度为25±2℃,暗培养。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



