通过调控体内脂质平衡以治疗非病毒感染型肝细胞癌的方法与组成物与流程
 2021-01-08 11:01:29|
2021-01-08 11:01:29| 317|
317| 起点商标网
起点商标网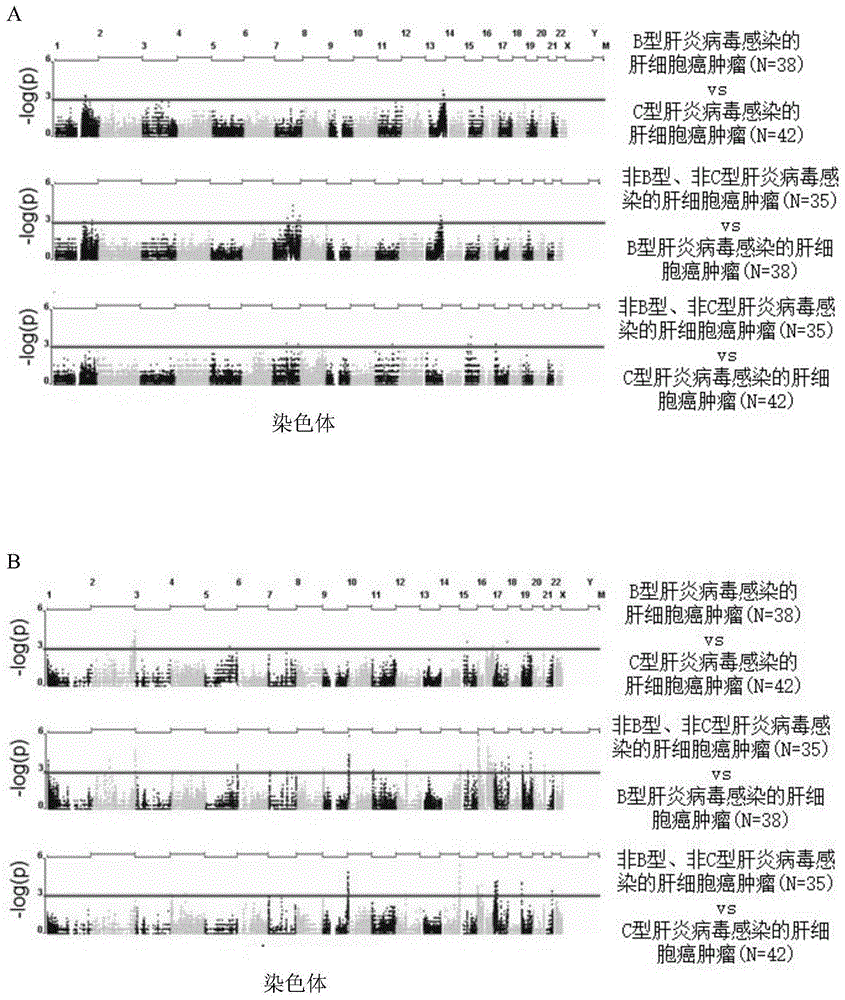
本发明关于一种用于无肝炎病毒感染病史的患者治疗肝细胞癌(hcc)的方法与组成物。更特别地,本发明关于一种通过改变体内与脂质平衡相关的基因表现,尤其是通过调控体内cd36基因增幅及/或abcg4基因缺失以治疗非b型/c型肝炎病毒感染型肝细胞癌(nbnc-hcc)的方法与组成物。
背景技术:
肝细胞癌(hepatocellularcarcinoma)是一种发生于肝脏的恶性肿瘤,为全球排名第五的高发生性癌症,全球每年约有66万人死于此疾病(jemal,a.etal.cacancerjclin.57,43-66,2007;el-serag,h.b.nengljmed.365,1118-1127,2011),已知肝细胞癌通常与b型肝炎病毒(hbv)或c型肝炎病毒(hcv)的感染有关(farazi,p.a.,depinho,r.a.natrevcancer6,674-687,2006)。然而,最近有相关文献指出由代谢失调所致的肝细胞癌的发生率有上升的情形(starley,b.q.etal.hepatology51,1820-1832,2010;fujiwara,netal.jhepatol.s0168-8278,32328-32340,2017),惟在此类缺乏肝炎病毒感染病史的患者中,导致hcc的相关分子机制仍不清楚。
目前,通过疫苗与抗病毒药物来控制肝炎病毒感染型肝细胞癌有很明显的成效,但除此之外,最近对肝细胞癌的致病原因却有了不一样的观点,在美国、日本、欧洲与澳洲,因为糖尿病与肥胖的盛行,非酒精性脂肪肝疾病(nonalcoholicfattyliverdisease)的普及率正逐渐上升,而因其中非酒精性脂肪性肝炎(nonalcoholicsteatohepatitis)所致的肝细胞癌的数量也随之上升。
基因组上的不稳定性是许多癌症共有的特点,包括肝细胞癌(niu,z.setal.worldjgastroenterol.22,9069-9095,2016),通过检测染色体上的异常,许多与癌症相关的基因变化也被确定与证实,但是这些相关研究尚无法解释基因上的改变与致肝细胞癌的危险因子间有特定关系。
本发明通过检测不同肝炎病毒感染史的肝细胞癌临床与基因组上的特征,发现两个与调控体内脂质平衡相关的基因:cd36与abcg4,在不具有b型肝炎病毒与c型肝炎病毒感染史的肝细胞癌病患者体内表现异常,通过统计公开的基因组数据库中可获得的信息,也能支持本发明所提出调控体内脂质平衡的基因在肝细胞癌肿瘤生成过程中扮演重要角色。
技术实现要素:
本发明取自于bgi数据组的肝细胞癌患者样本中,发现有25%的样本具有cd36基因增幅(amplification)的表现,并且相较于b型肝炎病毒感染的肝细胞癌样本,此增幅表现于非b型、非c型肝炎病毒感染的肝细胞癌样本中更为普遍。通过检测cd36与abcg4的拷贝数(copynumber),发现于国际肿瘤基因组联盟(icgc)肝细胞癌样本中,15.6%具有cd36基因增幅,10.3%具有abcg4基因缺失(deletion);癌症基因体图谱计划(tcga)的肝细胞癌样本中,15.3%具有cd36基因增幅,9.7%具有abcg4基因缺失。
因此,本发明提供一种用以预防或治疗非b型、非c型肝炎病毒感染的肝细胞癌(nbnc-hcc)的方法,其包含施以一用于调控体内脂质平衡相关基因变异的抑制剂。
在本发明的一实施例中,所述的基因变异为cd36基因增幅;在另一实施例中,所述的基因变异为abcg4基因缺失;又在一实施例中,所述的基因变异为cd36基因增幅与abcg4基因缺失。通过调控于hcc的cd36基因增幅与abcg4基因缺失可用来提升肝细胞癌患者的存活率。
于另一方面,本发明提供一种用以预防或治疗非b型、非c型肝炎病毒感染的肝细胞癌(nbnc-hcc)的组成物,其包含一用以调控体内脂质平衡相关的基因变异的调节剂。在本发明的一实施例中,所述的调节剂用于抑制cd36的过度表现;在另一实施例中,所述的调节剂用于阻断肝细胞癌细胞的脂质摄取;在一举例说明的实施例中,所述的调节剂可为一cd36抗体。
在一实施例中,所述的调节剂用于促使abcg4表现;在另一实施例中,所述的调节剂用于促进肝细胞癌细胞内的胆固醇运输;于一较佳实施例中,所述的调节剂可为一abcg4蛋白质。
附图说明
可通过结合说明书附图一起阅读的方式更加清楚地理解上述的发明内容与以下的实施方法,于图式中:
图1a与1b为不同肝炎病毒感染的肝细胞癌患者配对比较结果,通过penncnv软件进行其dna的拷贝数变化分析,并使用fisher’sexacttest进行统计分析。图1a为检测患者dna拷贝数增加的配对比较图;图1b为检测患者dna拷贝数缺失的配对比较图。图中红色水平线为显著差异性指示线(p<0.001),肝细胞癌患者配对比较其基因型的鉴测结果是根据患者的肝炎病毒感染史而使用snp芯片分析所得。
图2a至2d是针对cd36基因增幅与abcg4基因缺失所进行的snp基因型鉴测结果。图2a显示于肝细胞癌患者的肿瘤中,其7号染色体上拷贝数的增幅程度,并依颜色区分各种类型:蓝色为b型肝炎病毒感染的肝细胞癌肿瘤(hbv-hcc)、绿色为c型肝炎病毒感染的肝细胞癌肿瘤(hcv-hcc)、橘色为非b型、非c型肝炎病毒感染的肝细胞癌肿瘤(nbnc-hcc);图2b显示一处体细胞cd36基因增幅现象(7号染色体上80.23mb-80.30mb)与非b型、非c型肝炎病毒感染的肝细胞癌肿瘤(nbnc-hcc)的出现有相关性存在;图2c显示于肝细胞癌患者的肿瘤中,其11号染色体上拷贝数的缺失程度;图2d显示了一处体细胞abcg4基因缺失现象(11号染色体上119.02mb-119.03mb)与非b型、非c型肝炎病毒感染的肝细胞癌肿瘤(nbnc-hcc)的出现有相关性存在。*表示p值小于0.05。
图3a至3d显示了cd36基因于非b型、非c型肝炎病毒感染的肝细胞癌(nbnc-hcc)患者体内其rna与蛋白质表现情况。图3a为五组无b、c型肝炎病毒感染史的肝细胞癌样品的cd36基因拷贝数与mrna表现量的pcr定量图,其基因拷贝数的分析是使用cd36基因的5’端(5’cn)与3’端(3’cn)序列为pcr的引子,实验结果皆为三重复,以mean值±s.d.值表现;图3b为使用cd36抗体针对235号存样品内cd36蛋白质表现所进行的免疫化学染色图,通过10x光学显微镜观察,图中红色框示的为肿瘤细胞区域,图3c为其放大图,而蓝色框示则为非肿瘤细胞区域,图3d为其放大图。
图4为于88个从bgi数据组所得的肝细胞癌样本数中,具有cd36基因拷贝数增幅现象的样本比例,可见相较于b型肝炎病毒感染的肝细胞癌(hbv-hcc)肿瘤组织,非b型、非c型肝炎病毒感染的肝细胞癌(nbnc-hcc)肿瘤组织中具有显著性的cd36基因增幅现象。结果是使用fisher’sexacttest进行统计分析,**表示p值小于0.01。
图5为cd36基因增幅现象与abcg4基因缺失现象在国际肿瘤基因组联盟(icgc)与癌症基因体图谱计划(tcga)的肝细胞癌数据组中的表现比例值方图,可以看见在两组数据组中,这两种基因的表现变化具有一致性的趋势。
图6a与6b分别显示cd36基因增幅与abcg4基因缺失对于肝细胞癌患者的存活率与肿瘤大小的影响,相关数据皆选自经过基因型比对,确定具有cd36基因增幅与abcg4基因缺失的肝细胞癌患者。从图6a中可得知,在同时具有cd36基因增幅与abcg4基因缺失的肝细胞癌患者,其存活率中位数远低于只具有cd36基因增幅或abcg4基因缺失其中一种基因变异的肝细胞癌患者(p<0.0001),其数据是经由对数等级检定而得;图6b则显示在同时具有cd36基因增幅与abcg4基因缺失的肝细胞癌患者中,其肿瘤大小远高于只具有cd36基因增幅或abcg4基因缺失其中一种基因变异的肝细胞癌患者,以上数据皆经由mann-whitneyutest统计而得,图中的误差线标示出标准偏差,*表示p值小于0.05,**表示p值小于0.01。
图7a至7d显示于肝细胞癌细胞生长过程中,给予cd36抗体后的所造成的影响。图7a显示了给予三种肝细胞癌细胞株40μg/ml的cd36抗体处理72小时后的细胞存活率;图7b显示了肝细胞癌细胞株(huh-7)的存活率与所给cd36抗体的浓度之间具有剂量依赖性;图7c显示了给予huh-7细胞株20μg/ml的cd36抗体处理后,其存活率随着处理的时间增加而下降;图7d为给予huh-7细胞株40μg/ml的cd36抗体与用以当作对照组的igg抗体处理过后的存活率比较图,前者的细胞凋亡比例高于后者。所有图示中,皆用误差线标示出均值及标准偏差,*表示p值小于0.05,**表示p值小于0.01,***表示p值小于0.001,其数据结果是使用unpairedtwo-tailedt-tests所得。
具体实施方式
除非另有定义,本说明书所使用的所有技术以及科学术语与属于本发明所属领域的普通技术人员通常理解的含义相同。
如本文,单数形式的“一”与“该”包括其复数形式的所指物,除非内文另外明确定义。因此,举例说明,提及“一样品”时,本领域技术人员可知其包括复数个样品与其等同物。
本发明提供一种用以治疗或预防非b型、非c型肝炎病毒感染的肝细胞癌(nbnc-hcc)的方法,其包含施以一用于调控体内脂质平衡相关基因变异的抑制剂,尤其是针对cd36的基因增幅与/或abcg4的基因缺失。
此处的“基因变异”是指一基因其dna序列上出现改变,当此遗传密码被改变之后,可能会产生不正当活化或失去功能的蛋白质进而导致癌症的发生,这些不正当活化或失去功能的蛋白质可能会使正常细胞的生化途径失调而造成生长失衡,并产生癌化。目前可用来检测全基因组的基因变异的方法包含:通过分子细胞遗传学来评估染色体畸变或重排、通过dna多样性来分析其异型合子丧失(lossofheterozygosity,loh)或对偶基因不平衡、或是使用比较基因组杂交(comparativegenomichybridization,cgh)进行其区段[式]拷贝数变异的评估。
此处的“cd36的基因增幅”是指cd36的基因拷贝数在其其基因拷贝数无比例性增加时所出现的增幅现象,而是因为具cd36基因的dna于进行基因复制或修复机制时出现错误所致。
此处的“abcg4的基因缺失”,又称“abcg4的基因缺乏”或“abcg4的删除突变”,皆是指在dna复制过程中,有部分的染色体或dna序列缺失,可以是只有一个核苷酸缺失或是整个染色体的缺失,此现象在初生缺陷和癌症的生成中扮演很重要的角色。
本发明所使用的药物配方是使用常规方式,并使用生理可接受的药物载剂,此载剂是包含赋形剂与辅助剂可利于促进活性物质制备成药物的过程,药物配方可依给药途径而改变。
肠道外给药(非口服给药)方式较佳为注射给药,包含肌肉注射、静脉注射、腹腔注射与皮下注射,注射用的本发明的组成物配方以水溶液较佳,像是生理可接受的缓冲溶液如hank’s溶液、ringer’s溶液或生理食盐水,另外,其组成物的成分可经固体再溶解或是使用前震荡均匀的方式做为药物配方,其亦包括冻干的方式。
以口服方式给药,组成物的活性成分可通过已知的生理可接受的药物载剂来使用,此药物载剂可为片剂、丸剂、含片、糖衣锭、胶囊、液体、凝胶、糖浆、浆液、悬浮液或是通过患者口服摄入。口服药物可通过一固体赋形剂进行制药,并将此混合物磨碎成颗粒,加入需要的辅助剂后塑型成片剂或糖衣锭的核心,而此赋形剂可为糖类(如乳糖、蔗糖、甘露醇、山梨糖醇)、纤维素(如玉米淀粉、小麦淀粉、米淀粉、马铃薯淀粉)或是其他材料,像是明胶、阿拉伯胶、甲基纤维素、羟丙甲纤维素、羧甲基纤维素及/或聚乙烯吡咯烷酮(pvp),若有需要,也可加入崩散剂,如交联聚乙烯吡咯烷酮、琼脂或是海藻酸,也可加入盐类(如海藻酸钠)
本说明书的“有效剂量”为一经计算可达到预期效果的预定剂量,此预期效果为预防或治疗非b型、非b型肝炎病毒感染的肝细胞癌(nbnc-hcc)。在本发明的部分实施例中,此药物组成物包含一有效剂量的cd36抗体,以抑制具cd36基因增幅表现的肝细胞癌患者的癌细胞摄取脂质。
本发明可通过下列实施例来进一步阐明,实施例仅用来进一步说明而非限制本发明的应用与范围。
实施例
于以下的实施例中将进一步说明和描述本发明的其他特征和优点,于本文中所描述的实施方式是用于说明,而非限制本发明。
实施本发明,需应用包括细胞生物学、细胞培养与基因工程的相关技术,其皆属于本领域的通常技术的范围,于本文中会充分解释相关的技术内容。
coreexome-24snp生物芯片
使用infiniumcoreexome-24beadchip(illumina)来鉴测115对选定配对的肝细胞癌病患样本的基因型分型。使用步骤皆参照产品说明书,简言之,从肝细胞癌患者的肿瘤组织样本与非肿瘤组织样本中各抽大约200ng的基因组dna,进行增幅、片段化、沉淀、再悬浮于杂合缓冲液,再经dna变性后,将之与beadchips杂合于48℃并持续16小时;接着,将单一核苷酸放大(single-baseextension),之后芯片进行染色,并扫描至基因晶片扫描仪(illuminabeadarrayreader);这些影像信息可通过illuminagenomestudiov2软件进行基因型鉴测分析,原始数据将以文本文件方式输出,以利进行dna拷贝数改变的分析,其分析方式利用该软件提取b等位基因频率(ballelefrequency;baf)与logr比率(logrratio;lrr)等数据,通过penncnvv1.0.3软件分析并以wgaviewer将之形象化。为确定此dna拷贝数的生物芯片分析结果的可信度,另通过样品dna实时聚合酶链式反应进行比对。
cd36的dna拷贝数分析
使用定量实时聚合酶链式反应来检测并比较cd36基因及参考基因于肝细胞癌肿瘤组织样本中的dna拷贝数与邻近非肿瘤组织样品中的dna拷贝数。因此共设计了3组引子:(1)放大cd36的5’端,序列分别为:5’-ggctcattcaccaaggac(正向(forward),seqidno.1)和5’-gacttaatgagaaggaacaac(reverse,seqidno.2);(2)放大cd36的3’端,序列分别为:5’-gttactaccttctcttctg(正向(forward),seqidno.3)和5’-gtaaagtgaatccagttatc(反向(reverse),seqidno.4);(3)与该参考dna的序列,其序列分别为:5’-gaaactgttttccttgtctg(正向(forward),seqidno.5)和5’-gctttgtactgggaggag(反向(reverse),seqidno.6)。以上定量实时聚合酶链式反应皆使用sensifasttm
cd36表现量的定量分析
利用逆转录聚合酶链式反应测定肿瘤组织(t)与非肿瘤组织(n)样品的相对表现量。100对肝细胞癌患者样本的全rna皆通过逆转录方式(使用superscriptii,i)得到cdna,接着针对cd36与gapdh的定量实时聚合酶链式反应也皆使用实时聚合酶链式反应仪(abisteponereal-timepcrsystem)、sensifasttm
对公众领域数据库进行dna拷贝数分析
在国际肿瘤基因组联盟(icgc)与癌症基因体图谱计划(tcga)上的肝癌相关基因组资料皆从http://xena.ucsc.edu下载而得,并从ncbi公开的序列档案库(sequencereadarchive,sra)下载一登记号码为prjeb2869的88组配对的肝细胞癌案例全基因组序列(wholegenomesequencing;wgs)数据,通过基因变异辨认软件(isaacvariantcaller)将下载所得的原始读取数据与人类基因组gh19一起比对,并使用cnvseg进行dna拷贝数的分析。
统计分析
相关临床资料的统计结果,包括:年龄、肿瘤大小、肿瘤数目与甲型胎儿蛋白(afp)值,皆使用曼-惠特尼u检验(mann-whitneyutest)进行差异性计算;肝硬化程度、脂肪肝比例、dna拷贝数于肝细胞癌族群间的变异的显著性差异计算是由费舍尔精确检验(fisher’sexacttest)运算;肝细胞癌细胞株经cd36抗体或对照组的igg抗体处理的实验数据,包含肝细胞癌族群间的量的变化与其对肝细胞癌癌细胞生长抑制皆由未配对双尾学生t检验(two-tailedunpairedstudent’st-test)进行统计结果运算与比较;肝细胞癌患者的存活率由log-ranktest所估算。所有实验数据皆为三重复并使用prism(graphpad)进行统计后以mean值±s.d.值呈现。
实施例一、染色体7、11上的dna拷贝数变化与非b、c型肝炎病毒感染的肝细胞癌有关
样本挑选
为了检测非b型、非c型肝炎病毒感染的肝细胞癌患者(nbnc-hcc)的基因特征,本实施例试验了250件肝细胞癌患者的肝脏样本,样本皆取自于台湾肝癌网(tlcn),此生物知识库同意这些样本应用于临床与病理学相关研究(chang,i.c.etal.medicine(baltimore)95,e3284,2016)。
本实施例中,共有100件(50位男性、50位女性)b型肝炎病毒感染的肝细胞癌患者样本(hbv-hcc)、100件(50位男性、50位女性)c型肝炎病毒感染的肝细胞癌患者样本(hcv-hcc)与50件(25位男性、25位女性)非b型、非c型肝炎病毒感染的肝细胞癌患者样本(nbnc-hcc),此250件样本的相关临床数据如下表。
表1、肝细胞癌患者样本的临床数据
1p<0.0001,比较组间发病年龄(hbv-hccvs.hcv-hccornbnc-hcc)。
2p<0.0001,比较组间肿瘤大小(hcv-hccvs.hbv-hccornbnc-hcc)。
3p<0.05,比较组间afp值(hbv-hccvs.hcv-hccornbnc-hcc)。
4有一离群值的数值过高(380,000),导致平均值上升。
5p<0.01,比较组间肝硬化程度(nbnc-hccvs.hbv-hccorhcv-hcc)。
6p<0.01,比较组间脂肪肝比例(nbnc-hccvs.hbv-hccandhcv-hcc)。
另外,nbnc-hcc组的肝硬化程度明显低(8%)于另外两组(p<0.0001),且该组的男性患者的脂肪肝比例(52.4%)也明显的高于hbv-hcc、hcv-hcc的男性患者(分别为19.1%与20.9%)。
基因组分析
115个样本因具有tp53突变而被挑选出来进行基因组分析,其通过一检测平台进行dna质谱分析找出具tp53热点突变的样本,过程中皆使用基因试验设计软体(massarrayassaydesign3.1software(sequenom))设计聚合酶链式反应与延伸引子,115个样本中,其包含38名hbv-hcc患者、42名hcv-hcc患者与35名nbnc-hcc患者,详细的tp53突变统计如下表。
表2、250件肝细胞癌样本中tp53的突变频率
基因型分型使用infiniumcoreexome-24beadchip(illumina)来鉴测115个样品的基因型,试验步骤皆参照产品说明书,简言之,从肝细胞癌患者的肿瘤组织样本与非肿瘤组织样本各抽大约200ng的基因组dna,并进行增幅、片段化、沉淀再悬浮于杂合缓冲液,再dna变性后,将之与beadchips杂合于48℃持续16小时;下一步,单一核苷酸将被扩大(single-baseextension),之后芯片进行染色并扫描至illuminabeadarrayreader;接着这些影像信息可通过illuminagenomestudiov2软件进行基因型鉴测分析,原始数据将以文字方式输出,以利进行dna拷贝数改变的分析,其分析方式利用该软件提取b等位基因频率(ballelefrequency;baf)与logr比率(logrratio;lrr)等数据,通过penncnvv1.0.3软件分析并以wgaviewer将的形象化。为确定此dna拷贝数的生物芯片分析结果的可信度,另通过实时聚合酶链式反应进行比对。
通过penncnv软件,可以鉴定出能够侦测到肝细胞癌患者基因中dna拷贝数变化的探针,不同肝炎病毒感染的肝细胞癌患者的配对比较结果可见于图1,于鉴定dna拷贝数增加方面,在hbv-hcc的样品中发现在其13号染色体上有峰值的出现,另外在nbnc-hcc的样品中也发现在其7号染色体上也有一峰值的出现(如图1a);于鉴定dna拷贝数缺失方面,在hbv-hcc的样品中发现在其2号染色体上有峰值的出现,另外在nbnc-hcc的样品中也发现在其11号染色体上也有一峰值的出现(如图1b)。
因此,从本实施例中可得知,非b型、非c型肝炎病毒感染的肝细胞癌患者(nbnc-hcc)相较于b型或c型肝炎病毒感染的肝细胞癌患者(hbv-hcc、hcv-hcc),具有不同的临床表现及染色体谱。
实施例二、在非b型、非c型肝炎病毒感染的肝细胞癌患者(nbnc-hcc)样本中侦测到cd36的基因增幅与abcg4的基因缺失有较高频率的出现
于本实施例中,将对dna拷贝数变化的峰值做进一步试验。由于本发明着重于非b型、非c型肝炎病毒感染的肝细胞癌(nbnc-hcc),因此分析了染色体7号上的79.1mb至80.7mb片段,如同图2a所示,探针会标靶此片段并侦测dna拷贝数的变化,发现在80.3mb区域附近有cd36基因增幅的现象,cd36为一嵌入膜蛋白,为一种具多功能的清道夫蛋白(scavengerreceptor),其中一功能为促进脂肪酸的摄取。通过对此一dna的增幅现象加以分析,发现此cd36基因增幅只发生于肿瘤组织的样本中,且此现象在nbnc-hcc中更为显著(如图2b所示)。
近期有文献指出abc运输蛋白(atpbindingcassettetransporters)在控制细胞内与体内脂质平衡的过程中扮演一重要角色(baldán,a.etal.curropinlipidol.17,227-232,2006),在所有abc运输蛋白中,abcg1、abcg4二者可形成一异二聚体以调节运输胆固醇至细胞内并将其脂化为脂蛋白(hegyi,z.etal.plosone11,e0156516,2016)。当染色体11号上有dna缺失所影响的基因座被搜寻后,可鉴定出有基因缺失的区域,也就是abcg4的基因缺失(如图2c),并且约四成的nbnc-hcc样本中皆有出现此一基因缺失(如图2d所示)。将此发现与cd36的基因增幅现象整合后,更可以支持本发明的假设:体内脂质平衡有关的基因出现变异在不具肝炎病毒感染史的肝细胞癌的致病机制中扮演重要的角色。
实时聚合酶链式反应
为了进一步确定基因型分型的鉴测结果,进行实时聚合酶链式反应以研究cd36基因在肝细胞癌患者组织样本中的拷贝数与其mrna的表现量。如图3a所示,肝细胞癌样本编号235、243、247,其肿瘤组织皆有3或3以上的cd36拷贝数,相较于邻近非肿瘤组织,其cd36的mrna表现量也有上升,虽然cd36基因表现量在编号235、243、247的肿瘤组织中比邻近非肿瘤组织有较高表现量,但在编号241与242样本中,cd36拷贝数并未超过基因组二倍体的范围,且相较于邻近非肿瘤组织,其mrna表现量也接近一样。参照图3c的cd36抗体的免疫化学染色切片,可见肿瘤组织有明显的染色情形,因此可得知肝细胞癌肿瘤细胞表面上有大量表现cd36蛋白质,尤其是在肝窦内皮细胞上,但在良性的肝脏细胞上,表现量却很低(可见图3d),染色结果的判读以邻近非肿瘤组织中的肝窦内皮细胞为组内对照组。
如图4所示,可发现在约25%的肝细胞癌患者样本中,皆有cd36基因增幅现象的出现,尤其是在nbnc-hcc样本中,此现象更为显著。另外,从国际肿瘤基因组联盟(icgc)与癌症基因体图谱计划(tcga)所得的肝细胞癌患者的基因型数据中也可证实,在icgc数据库中,约15.6%与10.3%的患者样本数分别具有cd36基因增幅与abcg4基因缺失的异常现象;在tcga数据库中,约15.3%与9.7%的患者样本数分别具有cd36基因增幅与abcg4基因缺失的异常现象,综上所述,从公开领域的数据库中所提供的独立信息,经过统计所得到的结果也能支持本发明,即此两者与调节体内脂质平衡相关的基因在肝细胞癌的致病机制中扮演重要的角色。
基于先前文献已指出cd36蛋白质具有将脂质运输至肝细胞内的功能,以及cd36蛋白质参与了肿瘤转移的过程(nath,a.&chan,c.scirep.6,18669,2016),因此本实施例也再更进一步去探讨cd36基因增幅与abcg4基因缺失对于肝细胞癌患者在临床表征或临床结果上的影响。如图6a所示,同时具有cd36基因增幅与abcg4基因缺失两项变异的肝细胞癌患者其存活率中位数的天数为1385天,明显低于只具cd36基因增幅或abcg4基因缺失其中一项变异的患者(分别为2234天与2045天,p<0.0001),另外也发现cd36基因增幅与较高的甲型胎儿蛋白值(afp)是有相关性存在的(见表3),而且肿瘤大小在同时具有cd36基因增幅与abcg4基因缺失两项变异的肝细胞癌患者上,也有显著性的增加(见图6b)。
表三、在115件肝细胞癌样本中,甲型胎儿蛋白值(afp)和cd36基因增幅与/或abcg4基因缺失的关系
cd36与abcg4的基因变异影响了体内脂质的平衡,且有可能因此导致肝细胞癌的癌变,因此本发明提供了一以脂质代谢路径为标靶的药物开发方向,来治疗具有cd36或abcg4的基因变异的肝细胞癌患者。
实施例三、cd36抗体抑制肝细胞癌细胞株生长
近来有研究指出cd36可做为具转移能力细胞的生物标记,因此我们假设若给予肝细胞癌细胞cd36抗体,阻断其脂质摄取可抑制其细胞生长,基于此假设,本实施例使用培养的肝细胞癌细胞进行试验。
细胞增生试验
肝细胞癌细胞株培养于96孔盘(每孔细胞数为104个)24小时候,以含cd36抗体(cayman,cay-188150)及3%胎牛血清的dmem培养基处理72小时,接着以细胞增殖和细胞毒性检测试剂盒(alamarbluecellviabilityreagent(thermofisherscientific))进行细胞增生分析试验,过程皆以igg为对照组。
结果如图7,以浓度40μg/ml的cd36抗体处理三种肝细胞癌细胞株(huh-7、hepg2、hep3b)72小时后,细胞存活率皆下降(图7a),在huh-7细胞株中更发现其存活率随着cd36抗体的浓度上升与处理时间增加而下降(图7b、7c)。
细胞凋亡试验
将以cd36抗体处理过的huh-7细胞经由胰蛋白酶处理后悬浮于200μl的冰镇pbs中,取出100μl的细胞悬浮液等分至微量离心管并以300g离心5分钟以采集细胞,再将细胞悬浮于100μl的细胞凋亡检测试剂(annexinvfitcapoptosisdetectionkit(bdbiosciences))的培养液,并与1μl的annexinv与1μl的pi于室温培养15分钟,并在进行细胞凋亡检测前再加入500μl的培养液,检测结果使用流式细胞仪(bdfacscaliburflowcytometersystem(bdbiosciences))系统,并设定每件样本皆记录5000event,统计后结果如图7d,可见以cd36抗体处理过的细胞其细胞凋亡比例有明显上升,因此通过cd36抗体处理而细胞存活率下降的机制可能是通过细胞凋亡途径。
综合以上实施例,本发明发现肝细胞癌患者会因其不同的肝炎病毒感染史,而于临床上与基因组上的特征也有差异,特别值得注意的是其中两种基因的变异,也就是cd36与abcg4,两者皆与体内脂质平衡相关,并被鉴定出其变异在非b型、非c型肝炎病毒感染的肝细胞癌患者(nbnc-hcc)中更常被发现,另外也发现cd36基因增幅与/或abcg4基因缺失皆会降低肝细胞癌患者的存活率、增加甲型胎儿蛋白(afp)值、及增加肿瘤大小,因此cd36与abcg4的基因变异可提供一诊断依据,以诊断或预防肝细胞癌的生成。
sequencelisting
<110>财团法人卫生研究院
<120>通过调控体内脂质平衡以治疗非病毒感染型肝细胞癌的方法与组成物
<130>200589cn-fm
<150>62/568,452
<151>2017-10-05
<160>10
<170>patentinversion3.5
<210>1
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>1
ggctcattcaccaaggac18
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>2
gacttaatgagaaggaacaac21
<210>3
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>3
gttactaccttctcttctg19
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>4
gtaaagtgaatccagttatc20
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>5
gaaactgttttccttgtctg20
<210>6
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>6
gctttgtactgggaggag18
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>7
gaacctataactggattcac20
<210>8
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>8
gtcccagtctcattaagc18
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>9
gtgaagcaggcgtcggag18
<210>10
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<223>引物(primer)
<400>10
gttgtcataccaggaaatg19
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



