静脉注射用阿瑞匹坦胶束无菌冻干制剂及其制备方法与流程
 2021-01-08 11:01:50|
2021-01-08 11:01:50| 379|
379| 起点商标网
起点商标网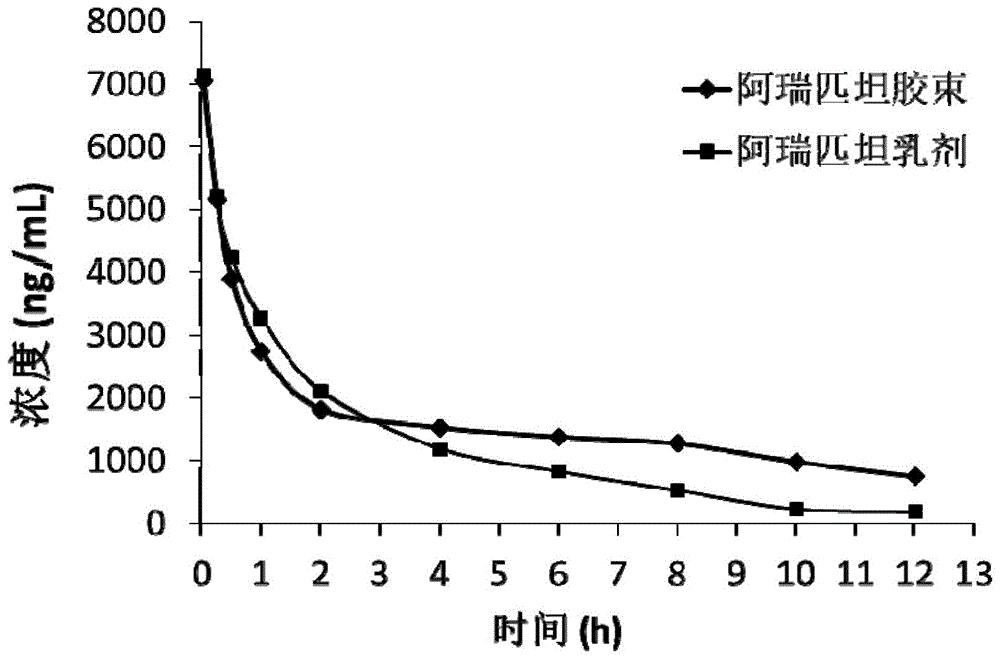
本发明专利涉及一种静脉注射用阿瑞匹坦制剂及其制备方法,是由阿瑞匹坦和甲氧基聚乙二醇衍生化磷脂组成,可提高阿瑞匹坦溶解度,延长消除半衰期,提高生物利用度,属于医药技术领域。
背景技术:
抗击肿瘤是一个综合治疗过程,不仅要杀死癌细胞,还要改善患者的恶病质状态,增强体质,关注患者的精神感受,以及对治疗的依从性。抗肿瘤药物引发的恶心和呕吐严重影响患者健康和治疗效果。文献报道,75%以上的化疗药物都有致吐性,而且呕吐发生率高达90%(annoncol,2015.26(6):1081-90.)。此外,部分小分子靶向药物也是中等强度的致吐剂,例如伊马替尼(临床肿瘤学杂志,2014.19(3):263-273.)。这些抗肿瘤药物引起的恶心和呕吐是最常见的不良反应。它可能导致代谢紊乱、机体功能受损、营养不良,严重影响患者的生活质量和化疗效果。
抗肿瘤药物引起的恶心和呕吐由两条关键通路调控。中枢(大脑)通路和外周(肠胃)通路。急性呕吐是在化疗0~24小时内发生的反应,主要由外周(肠胃)通路调控;迟发性呕吐发生在化疗后24~120小时内,主要由中枢通路调控。目前,虽然有很多药物可以抑制急性反应,例如5-羟色胺受体(5-ht3)拮抗剂等。但仍需要可以有效调控中枢通路的药物,抑制迟发性恶心呕吐。nk-1受体拮抗剂阿瑞匹坦穿过血脑屏障,高选择性、高亲和性地占领大脑中的nk-1受体,从而在中枢层面抑制化疗诱发的呕吐(药品评价,2016.13(10):21-52.)。
阿瑞匹坦是人p物质神经激肽1(nk-1)受体的高选择性拮抗剂,用于治疗化疗药物引起的(成人)急性和延迟性恶心呕吐。药理作用可分为以下两点。首先,阿瑞匹坦对nk-1受体选择性强,对现有药物靶点如5-ht3、多巴胺受体和糖皮质激素受体的亲和力低或无亲和力,方便联合用药。因此,国内外相关临床指南都推荐联合用药作为一线方案。其次,阿瑞匹坦可以跨越血脑屏障,作用于中枢nk-1受体,因此它对延迟性呕吐的疗效明显优于5-ht3拮抗剂(药品评价,2016.13(10):21-52.)。目前,阿瑞匹坦获批上市剂型为口服胶囊(商品名:emend)和静脉注射用乳剂(商品名:cinvanti)。
口服胶囊存在以下不足。首先,生物利用度不高,约为65%(internationaljournalofnanomedicine,2007.2(1):13-18.)。其次,胃肠道副作用较多。该药为nk-1受体高选择性拮抗剂,nk-1受体分布于中枢神经系统和外周(胃肠系统)。由于口服胶囊抑制胃肠的nk-1受体,所以导致呃逆和便秘等胃肠道副作用发生(临床药物治疗杂志,2018.16(9):14-28.)。第三、临床使用受限。部分肿瘤患者吞咽困难,例如国内高发的食道肿瘤。此外,晚期肿瘤患者多处于恶病质状态,胃肠道吸收能力差,而阿瑞匹坦恰恰是bcsiv的难吸收药物(intjpharm,2004.285(1-2):135-46.),导致其口服生物利用度不高。第四、儿童使用受限制。默克公司的三期临床研究表明,该药可以用于儿童,但需调整剂量(thelancetoncology,2015.16(4):385-394.)。目前的剂型规格只适用于成人。如果将阿瑞匹坦制备成注射用冻干粉,这将方便分剂量,适用于不同年龄段患者。
静脉注射用乳剂也存在一定的缺陷。第一、注射用乳剂易被网状内皮系统吞噬,富集于肝、脾等器官,降低了靶点部位药物浓度,导致生物利用度降低(中国专利cn102018670b)。第二、注射用阿瑞匹坦乳剂(商品名cinvanti)采用乙醇为助乳化剂。乙醇易挥发,导致降低油/水界面张力,影响乳剂稳定性。如果将该药开发为注射用冻干粉制剂,利于提高制剂稳定性,延长保存期。第三、注射乳剂使用乙醇为增溶剂。临床静脉注射乙醇可能会导致注射部位疼痛,神经炎等不良反应(中国专利cn109364023a)。
因此,本领域技术人员仍然期待开发一种注射用新剂型,惠及更多的患者,特别是吞咽困难或口服吸收差的人群,以及部分儿童患者。阿瑞匹坦为bcsiv(生物药剂学分类系统中的四类)药物,难溶难吸收,生物利用度低。所以解决问题的关键是选择安全的增溶剂,提高阿瑞匹坦的溶解度,同时避免网状内皮系统吞噬,提高生物利用度。聚乙二醇衍生化磷脂是一类由聚乙二醇(peg)修饰的磷脂化合物,在水溶液中磷脂分子定向排列,形成稳定的核-壳式胶束结构。peg外壳具有较好的亲水性,可以屏蔽网状内皮系统对药物的识别和摄取,延长体内循环时间,提高药物生物利用度(中国医药工业杂志.2011,42(7):535-537.)。注射剂多选择吐温类辅料作为增溶剂,但是这类辅料易导致局部和全身性过敏反应发生(advther,2018.35:754–767.)。与吐温相比,聚乙二醇衍生化磷脂具有更好的生物相容性。培化磷脂酰乙醇胺是这类衍生化磷脂的代表性物质。培化磷脂酰乙醇胺已分别在德国、中国、日本、美国和加拿大上市,注射用临床显示良好的安全性。本发明专利选择甲氧基聚乙二醇衍生化磷脂作为增溶剂。阿瑞匹坦的logp为5.2,具有脂溶性,甲氧基聚乙二醇衍生化磷脂的磷脂部分也具有脂溶性,两者通过相似相容的原理,经自组装形成胶束,胶束表面的peg可以防止res吞噬,延长消除半衰期,提高生物利用度。
技术实现要素:
本发明要解决的技术问题是提供一种增加阿瑞匹坦溶解度、提高生物利用度的静脉注射用剂型,以克服口服胶囊和静脉注射乳剂等现有剂型缺陷。本发明提供的静脉注射用阿瑞匹坦胶束无菌冻干制剂不含乙醇等刺激性成分,也不含吐温类致敏成分,提高临床使用安全性。
为解决本发明的技术问题,本发明采用如下技术方案。
本发明第一方面提供如下技术方案:选择甲氧基聚乙二醇衍生化磷脂作为增溶剂,制备一种静脉注射用阿瑞匹坦胶束无菌冻干制剂,所述静脉注射用阿瑞匹坦胶束无菌冻干制剂含有阿瑞匹坦和甲氧基聚乙二醇衍生化磷脂,以及冻干保护剂。
本发明所述静脉注射用阿瑞匹坦胶束无菌冻干制剂中阿瑞匹坦和甲氧基聚乙二醇衍生化磷脂的质量比为1:1至1:20。
本发明的甲氧基聚乙二醇衍生化磷脂为甲氧基聚乙二醇与磷脂经共价键连接形成,其磷脂部分可以是磷酯酰乙醇胺(pe)、二硬脂酰磷脂酰乙醇胺(dspe)、二棕榈酰磷脂酰乙醇胺、二油酰磷脂酰乙醇胺、磷脂酰胆碱(pc)、磷脂酰肌醇(pi)、磷脂酰丝胺酸(ps)、二磷脂酰甘油、缩酸磷脂、溶血磷脂胆碱(lpc)、溶血乙醇胺磷脂(lpe)。
本发明的甲氧基聚乙二醇衍生化磷脂中的磷脂优选为二硬脂酰磷脂酰乙醇胺。
本发明的甲氧基聚乙二醇衍生化磷脂中甲氧基聚乙二醇(mpeg)分子量范围为500~50000,优选分子量范围为1000~10000。
作为本发明的优选实施方案,甲氧基聚乙二醇衍生化磷脂为甲氧基聚乙二醇2000—二硬脂酰磷脂酰乙醇胺(mpeg2000-dspe),国内辅料备案系统的中文名称为培化磷脂酰乙醇胺。
作为本发明的优选实施方案,所述静脉注射用阿瑞匹坦胶束无菌冻干制剂中阿瑞匹坦和培化磷脂酰乙醇胺的质量比为1:1至1:20,优选1:5至1:15。
作为本发明的优选实施方案,所述冻干保护剂为甘露醇、葡萄糖、白蛋白、乳糖、果糖和蔗糖中的至少一种。
根据需要,本发明的阿瑞匹坦胶束无菌冻干制剂中还可以加入ph调节剂(盐酸、组氨酸或氢氧化钠),调节ph值至6.0~8.0。
根据需要,本发明的阿瑞匹坦胶束无菌冻干制剂中还可以加入渗透压调节剂(葡萄糖、甘露醇或蔗糖),调节渗透压至人体等渗。
根据需要,本发明的阿瑞匹坦胶束无菌冻干制剂中还可以加入其他药学上可接受的辅剂。
本发明的静脉注射用阿瑞匹坦胶束无菌冻干制剂,外观为白色疏松块状物或粉末。临床使用时,经葡萄糖注射液或氯化钠注射液稀释后静脉注射。稀释后,外观呈淡蓝色乳光液体;粒径范围为10~100nm,包封率大于90%,ph值为6.0~8.0,zeta电位为-40~-30mv,渗透压摩尔浓度为290~310mosmol/kg。
第二方面,本发明提供了上述静脉注射用阿瑞匹坦胶束无菌冻干制剂的制备方法,包括以下步骤:
(1)阿瑞匹坦和甲氧基聚乙二醇衍生化磷脂溶于适量有机溶剂;
(2)除去有机溶剂,形成阿瑞匹坦/甲氧基聚乙二醇衍生化磷脂复合膜;
(3)上述(2)制得的阿瑞匹坦/甲氧基聚乙二醇衍生化磷脂复合膜置于真空干燥箱中除去残留有机溶剂;
(4)向上述(3)干燥后的复合膜中加入水,经水化、涡旋振摇,得到包载阿瑞匹坦胶束溶液。
(5)向上述(4)制得的阿瑞匹坦胶束溶液中加入适量冻干保护剂和ph调节剂,并使其溶解;
(6)上述(5)制得的阿瑞匹坦胶束溶液于无菌条件下过0.22μm微孔滤膜除菌,冷冻干燥除去水,制得阿瑞匹坦胶束无菌冻干制剂。
本发明的方法步骤(1)所述有机溶剂为甲醇、乙醇、氯仿、或它们的混合物。
本发明的方法步骤(2)通过减压除去有机溶剂和/或在真空条件下除去有机溶剂。
本发明的方法步骤(3)所述阿瑞匹坦/甲氧基聚乙二醇衍生化磷脂复合膜于真空干燥箱中干燥12~24小时,在20℃~40℃条件下真空干燥除去残留有机溶剂。
本发明的方法步骤(4)中在20℃~60℃的水浴中水化1~2小时。
本发明的方法步骤(4)涡旋振摇时间1~5分钟。
本发明的方法步骤(4)制得的胶束溶液ph值调节至6.0~8.0。
本发明的阿瑞匹坦胶束无菌冻干制剂制备方法如下:在圆底烧瓶中,将甲氧基聚乙二醇衍生化磷脂与阿瑞匹坦溶于有机溶剂中,使用旋转蒸发仪将有机溶剂挥干,使甲氧基聚乙二醇衍生化磷脂与药物在器壁上形成一层均匀的薄膜,然后加入去离子水,经水化、涡旋振摇后,加入冻干保护剂,所得胶束溶液过0.22μm微孔滤膜除菌,经冻干除水后,最终制得阿瑞匹坦胶束无菌冻干粉。
本发明的任一方面的任一实施方案,可以与其它实施方案进行组合,只要它们不会出现矛盾。此外,在本发明的任一方面的任一实施方案中,任一技术特征可以适用于其它实施方案中的该技术特征,只要它们不会出现矛盾。
下面对本发明作进一步的描述。
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
有益技术效果
本发明主要提供了一种增加阿瑞匹坦溶解度、提高生物利用度的静脉注射用剂型,以克服口服胶囊和静脉注射乳剂等现有剂型缺陷。阿瑞匹坦为bcsiv药物,难溶难吸收,生物利用度低。已上市口服胶囊剂生物利用度低,胃肠道副作用较多,部分肿瘤患者吞咽困难患者无法使用,现有剂量规格儿童无法使用。同时,已上市的静脉注射乳剂易被网状内皮系统吞噬,降低生物利用度;注射部位存在疼痛和神经炎等不良反应。
为解决上述产品的不足,本发明选择甲氧基聚乙二醇衍生化磷脂作为增溶剂。甲氧基聚乙二醇衍生化磷脂是一类mpeg分子与磷脂分子通过共价键结合形成两亲性聚合物,在水溶液中磷脂分子定向排列,形成稳定的核—壳式胶束结构。mpeg外壳使粒子间产生斥力;mpeg在胶束表面形成“构象云”,产生“空间位阻效应”;亲水性mpeg在胶束粒子表面形成水化膜(中国医药工业杂志.2004,35(1):55-58.)。这三种效应的叠加可以屏蔽网状内皮系统对胶束粒子的识别和摄取,延长体内循环时间,提高药物生物利用度。聚乙二醇衍生化磷脂的磷脂部分含有非极性的脂肪酸,形成胶束的疏水内核。阿瑞匹坦的logp为5.2,具有疏水性,可以与磷脂的脂肪酸通过相似相容的原理,经自组装形成胶束,胶束表面的mpeg可以防止res吞噬,延长消除半衰期,提高生物利用度。本发明的静脉注射用阿瑞匹坦胶束无菌冻干制剂不含乙醇等刺激性成分,也不含吐温类致敏成分,提高临床使用安全性;粒径范围为10~100nm,包封率大于90%。
附图说明
图1为阿瑞匹坦胶束的大鼠药代动力学检测图。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。以下实施例进一步说明本发明,而不是限制本发明。
实施例1:
在圆底烧瓶中,将培化磷脂酰乙醇胺75mg与阿瑞匹坦15mg溶于乙醇2ml,在50℃水浴条件下使用旋转蒸发仪将乙醇蒸出,使聚合物与药物在器壁上形成一层均匀的薄膜,然后以5ml去离子水水化,静置30min,以充分自组装形成胶束,加入适量氢氧化钠溶液调整ph值至7.5,加入乳糖0.9g,溶解后经0.22μm微孔滤膜过滤除菌,滤液冻干72小时除水,最终制得阿瑞匹坦胶束无菌冻干制剂。
测定阿瑞匹坦胶束溶液的相关性质:
粒径:动态光散射法测定,为17nm;
药物包封率:经高效液相色谱法测定,为93.8%;
ph值:7.5。
实施例2:
在圆底烧瓶中,将培化磷脂酰乙醇胺150mg与阿瑞匹坦15mg溶于乙醇3ml,在50℃水浴条件下使用旋转蒸发仪将乙醇蒸出,使聚合物与药物在器壁上形成一层均匀的薄膜,然后以10ml去离子水水化,静置30min,以充分自组装形成胶束,加入适量氢氧化钠溶液调整ph值至7.5,加入乳糖1.65g,溶解后经0.22μm微孔滤膜过滤除菌,滤液冻干72小时除水,最终制得阿瑞匹坦胶束无菌冻干制剂。
测定阿瑞匹坦胶束溶液的相关性质:
粒径:动态光散射法测定,为25nm;
药物包封率:经高效液相色谱法测定,为94.5%;
ph值:7.4。
实施例3:
在圆底烧瓶中,将培化磷脂酰乙醇胺300mg与阿瑞匹坦15mg溶于乙醇5ml,在50℃水浴条件下使用旋转蒸发仪将乙醇蒸出,使聚合物与药物在器壁上形成一层均匀的薄膜,然后以15ml去离子水水化,静置30min,以充分自组装形成胶束,加入适量氢氧化钠溶液调整ph值至7.5,加入乳糖3.15g,溶解后经0.22μm微孔滤膜过滤除菌,滤液冻干72小时除水,最终制得阿瑞匹坦胶束无菌冻干制剂。
测定阿瑞匹坦胶束溶液的相关性质:
粒径:动态光散射法测定,为28nm;
药物包封率:经高效液相色谱法测定,为95.3%;
ph值:7.5。
实施例4:
将实施例1中制备的阿瑞匹坦胶束无菌冻干制剂置于温度25℃±2℃、相对湿度60%±5%的条件下进行三个月加速试验,结果如下表1所示。
表1.阿瑞匹坦胶束冻干粉加速试验
表1中相关检测结果显示,阿瑞匹坦胶束无菌冻干制剂在三个月的加速试验过程中各指标均无显著性变化,提示该制剂稳定性良好。
实施例5:
取sd大鼠12只,随机分为2组,每组6只,给药前禁食12小时,自由摄水。其中一组以14mg/kg的剂量尾静脉注射实施例1中制备的阿瑞匹坦胶束无菌冻干制剂,另一组以相同剂量注射市售阿瑞匹坦乳剂(商品明cinvanti),两组均采用葡萄糖注射液为溶媒,分别对制剂进行溶解和稀释。给药后分别于0.03、0.25、0.5、1、2、4、6、8、10和12小时采集大鼠血液。采样立即于13125×g离心10min,分离血浆。血浆样品以乙腈沉淀蛋白处理,cortexc18+色谱柱分离,以甲醇-10mmol·l-1醋酸铵为流动相,采用电喷雾离子源,以稳定同位素标记内标d4-阿瑞匹坦分别作为阿瑞匹坦的内标,通过lc-ms/ms分析血浆中阿瑞匹坦浓度,结果如图1所示。
图1显示,实施例1制备的阿瑞匹坦胶束与市售阿瑞匹坦乳剂具有相近的峰浓度,但阿瑞匹坦胶束的消除半衰期和auc显著增大,从而提高了药物生物利用度。
本发明专利尽管通过详细的一般性说明和多个实施例对发明内容进行了表述,但仍能够在此基础上对其修改、添加、置换和某些子组合。因此,在本发明专利核心内容基础上进行的修改、添加、置换和子组合,均属于本发明专利要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



