洋槐苷在制备治疗骨质疏松和/或骨丢失药物中的应用的制作方法
 2021-01-08 11:01:02|
2021-01-08 11:01:02| 325|
325| 起点商标网
起点商标网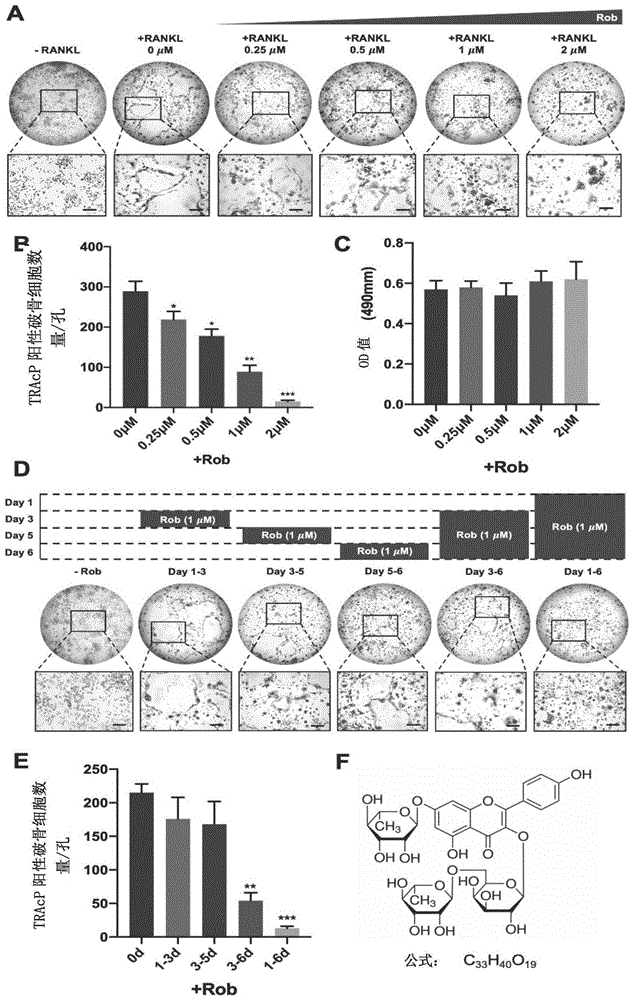
本发明属于药物领域,尤其涉及洋槐苷在制备治疗骨质疏松和/或骨丢失的药物中的应用。
背景技术:
成骨细胞主导的骨形成和破骨细胞主导的骨吸收是一个复杂的生物学过程。骨不断发生重塑,骨的形成和吸收需要保持平衡以维持骨内稳态。骨稳态的调控障碍通常造成骨质疏松主要原因。随着全球人口的老龄化,骨质疏松症正成为一个重大的经济和社会负担,对有效的防治策略的需求也日益增加。用于抑制破骨细胞活性和分化的治疗药物被认为是骨质疏松症的一线治疗选择。
在破骨细胞形成过程中,巨噬细胞祖细胞(单核细胞)融合形成破骨细胞,再吸收骨组织。这一过程主要受两种关键细胞因子的调节:m-csf和rankl。rankl与rank的相互作用直接激活一系列细胞内分子活动,主要涉及核因子nf-κb、mapk和ca2+信号转导,从而刺激nfatc1等破骨细胞相关下游因子的表达。nfatc1触发靶基因的表达,包括acp5,cathepsink,atp6v0d2,nfact1,c-fos和mmp9,从而激活破骨细胞前体的成熟,增加与破骨细胞功能相关的蛋白的表达水平。因此,nfatc1被认为是调控破骨细胞分化、细胞融合和骨吸收基因表达的关键转录因子。m-csf对破骨细胞祖细胞的增殖和存活也是必需的。
活性氧在破骨细胞形成和骨吸收中起着关键作用。rankl能促进活性氧的积累。ros在体内的破骨细胞前体中产生,处于traf6、rac1、nadph和nox1的信号通路的下游。nac和nox抑制剂dpi抑制rankl介导的ros生成,导致破骨细胞分化减少,提示ros是分化的重要因素。细胞对氧化应激(ros)的保护机制包括多种细胞保护酶和抗氧化酶,如ho-1、过氧化氢酶、gsr、nqo1和gcs。抗氧化剂通过增强细胞保护酶的表达抑制破骨细胞的形成和骨吸收。在rankl介导的信号转导中,ros的下游靶点尚不清楚,但ros的增加可能通过激活nf-κb和mapks促进破骨细胞的形成和功能。因此,抑制ros是治疗骨质疏松症的潜在策略。
天然化合物与目前的治疗骨质疏松药物(如双膦酸盐和激素替代治疗)相比有几个优点,包括低癌症风险和较少的胃肠道并发症。洋槐苷(robinin,rob)是一种黄酮苷类的天然化合物(kaempferol3-o-robinoside-7-o-rhamnoside),它可以从长春花(vincaerecta)或洋槐(robiniapseudoacacia)中分离出来。既往研究认为,rob能够抑制ox-ldl的途径,显示出良好的抗氧化性能。另外,rob可通过tlr/nf-kb信号通路对氧化低密度脂蛋白诱导的人外周血单核细胞发挥调节作用。
技术实现要素:
本发明的目的在于提供洋槐苷在制备治疗骨质疏松和/或骨丢失的药物中的应用。
本发明所采取的技术方案是:
本发明的第一个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备治疗、预防、缓解骨质疏松和/或骨丢失的药物中的应用。
优选的,上述的骨丢失为卵巢切除引起的骨丢失。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第二个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备破骨细胞分化和/或破骨细胞吸收抑制剂中的应用。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第三个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备rankl诱导的破骨细胞分化抑制剂中的应用。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第四个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备破骨细胞伪足小体形成抑制剂中的应用。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第五个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备rankl诱导的ros产生抑制剂中的应用。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第六个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备nf-κb和/或mapk和/或nfatc1转录活性抑制剂中的应用。
优选的,洋槐苷或其药学上可接受的衍生物在制备钙离子信号通路和/或nf-κb信号通路和/或mapk信号通路和/或nfatc1信号通路抑制剂中的应用。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第七个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备破骨细胞相关蛋白表达抑制剂中的应用,所述破骨细胞相关蛋白选自nfatc1、integrin-αv、cathepsink、v-atpase-d2、erk、p38、jnk、iκbα的至少一种。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第八个方面,提供:
洋槐苷或其药学上可接受的衍生物在制备破骨细胞相关基因表达抑制剂中的应用,所述破骨细胞相关基因选自acp5、cathepsink、atp6v0d2、nfact1、c-fos、mmp9的至少一种。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的第九个方面,提供:
一种治疗、预防、缓解骨质疏松和/或骨丢失的药物,包含洋槐苷或其药学上可接受的衍生物。
优选的,上述其药学上可接受的衍生物为其药学上可接受的盐或酯或醚或其立体异构体或其前药分子。
本发明的有益效果是:
1.洋槐苷在体外能抑制破骨细胞的形成和骨吸收功能,并能下调破骨细胞特异性基因acp5,cathepsink,atp6v0d2,nfact1,c-fos和mmp9等的表达。洋槐苷通过抑制rankl诱导的ros产生和增强ros清除酶,进而抑制mapk途径(erk、p38和jnk)和nf-κb途径,从而抑制nfatc1信号传导,从而抑制细胞内ros水平。
2.ct和病理组织学提示,卵巢切除手术导致了明显的骨质疏松,骨表面破骨细胞数量显著增加,而洋槐苷的补充能够有效地预防卵巢切除引起的骨丢失。
附图说明
图1为洋槐苷抑制rankl诱导的破骨细胞形成效果图,其中图1a为破骨细胞在不同浓度洋槐苷处理下的tracp染色图;图1b为在不同浓度洋槐苷处理下tracp阳性多核细胞的数量;图1c不同浓度的洋槐苷在bmms上培养48小时后细胞存活光密度值;图1d经洋槐苷干预的bmms后的tracp染色;图1e经洋槐苷干预的tracp阳性多核细胞的数量;图1f洋槐苷的化学结构和分子式。
图2为洋槐苷抑制破骨细胞伪足小体形成和吸收功能效果图,其中图2a为共聚焦显微镜观察破骨细胞的纽蛋白(绿色)、罗丹明标记鬼笔环肽(红色)和细胞核(蓝色)染色;图2b不同浓度洋槐苷处理下破骨细胞的细胞核数;图2c不同浓度洋槐苷处理下破骨细胞平均相对面积;图2d为在羟基磷灰石表面上的tracp染色和破骨细胞吸收后的代表性图像;图2e为不同浓度洋槐苷干预下每孔细胞羟基磷灰石吸收面积;图2f为不同浓度洋槐苷干预下平均每个破骨细胞吸收面积百分比。
图3为洋槐苷消除rankl引起的ca2+振荡,并抑制破骨细胞特异基因的表达效果图,其中图3a为ca2+振荡的荧光强度波检测;图3b为ca2+振荡的荧光强度波检测;图3c为ca2+振荡的荧光强度波检测;图3d每组ca2+振荡的平均强度变化;图3e~图3j分别对应为破骨细胞特异性基因acp5、cathepsink、atp6v0d2、nfact1、c-fos和mmp9在不同浓度洋槐苷干预下的rankl诱导bmms中的相对表达量。
图4为洋槐苷抑制rankl诱导的ros体外产生的效果图,其中图4a为dcf荧光检测的洋槐苷对破骨细胞内ros的影响和所对应的细胞数;图4b为dcf荧光浓度量化;图4c为dcf荧光与破骨细胞比率(ros阳性);图4d为rankl(50ng/ml)在无洋槐苷或有洋槐苷的情况下刺激bmms2天后洋槐苷对traf6和nox1表达影响的westernblot检测图;图4e为对照组与洋槐苷处理组traf6与时间关系的表达量;图4f为对照组与洋槐苷处理组nox-1与时间关系的表达量;图4g为对照组与洋槐苷处理组gtp-rac1在不同时间点的表达量的westernblot检测图;图4h为gtp-rac1相对于rac1强度比率;图4i为洋槐苷对ho-1、catalase、gsr表达影响的westernblot图像;图4j为对照组与洋槐苷处理组对ho-1表达影响的量化;图4k为对照组与洋槐苷处理组对catalase表达影响的量化;图4l为对照组与洋槐苷处理组对gsr表达影响的量化。
图5为洋槐苷抑制rankl诱导的nf-κb和nfatc1信号通路的效果图,其中图5a为nf-κb荧光素酶基因检测显示洋槐苷呈剂量依赖性抑制nf-κb转录活性;图5b为洋槐苷对rankl诱导的iκbα降解影响的westernblot图像;图5c为iκbα与β-actin条带强度比值的量化;图5d为洋槐苷对mapks途径影响的westernblot图像,包括p-erk、p-p38和p-jnk;图5e为p-erk与erk条带强度比值的量化;图5f为p-p38与p38条带强度比值的量化;图5g为p-jnk与jnk条带强度比值的量化;图5h为不同浓度洋槐苷抑制nfatc1转录活性的效果图;图5i为洋槐苷对nfatc1和破骨细胞相关蛋白在破骨细胞形成过程中表达量影响的westernblot图像,相关蛋白包括integrin-αv、cathepsink和v-atpase-d2;图5j为nfatc1条带强度与β-actin的比值的量化;图5k为integrin-αv条带强度与β-actin的比值的量化;图5l为cathepsink条带强度与β-actin的比值的量化;图5m为v-atpase-d2的条带强度与β-actin的比值的量化。
图6中,洋槐苷可预防ovx(卵巢切除术)小鼠模型的骨丢失;其中图6a为ovx手术后左侧股骨的micro-ct扫描图,包括2d图和3d图;图6b为左侧股骨的bv与tv比率图;图图6c为左侧股骨的tb.n图;图6d为左侧股骨的tb.th图;图6e为左侧股骨的tb.sp图;图6f为右侧股骨he和tracp染色图;图6g为右侧股骨的bv与tv比率图;图6h为右侧股骨的bs图;图6i为右侧股骨的n.oc/bs图;图6j为右侧股骨的oc.s/bs图。
具体实施方式
为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
以下实施例中涉及的附图中,*代表p<0.05;**代表p<0.01;***代表p<0.001;p为显著性。
实施例1:洋槐苷抑制rankl诱导的破骨细胞分化
实验方法:从c57bl/6小鼠的骨骼中分离出新鲜分离的骨髓巨噬细胞(bmm)进行破骨细胞培养,细胞在含有m-csf的a-mem中的股骨和胫骨骨髓腔中冲洗骨髓。将原始bmms以1×103个细胞/孔用a-mem和m-csf(25ng/ml)接种到96孔板中,并在37℃下保持体积浓度5%的co2过夜。每2天用重组鼠源srankl(rm-srankl,50ng/ml)和不同浓度的洋槐苷(0μm、0.25μm、0.5μm、1.0μm、2μm)刺激bmms直到形成破骨细胞。用4%多聚甲醛在磷酸盐缓冲盐水(pbs)在室温下固定10分钟,并用pbs洗涤4次。使用tracp阳性多核细胞数检测tracp活性。将具有三个或更多核的tracp阳性多核细胞作为破骨细胞样(ocl)细胞评分。
结果表明:从图1a~图1b可得出,洋槐苷诱导的rm-srankl诱导的破骨细胞发生抑制的剂量呈现依赖性方式。洋槐苷在高于0.25μm的剂量下显着减少破骨细胞形成。
实验方法:将bmms接种在96孔板中,在37℃下在体积浓度为5%的co2中孵育过夜。然后将不同浓度的洋槐苷(0μm、0.25μm、0.5μm、1.0μm、2μm)加入到bmms中,并将细胞在具有m-csf(25ng/ml)的a-mem培养基的化合物中培养48小时。然后向每个孔中加入20lmts溶液2小时。使用bmg读板器在490mm波长下评价光密度(od)。
结果表明:从图1c可得出,当洋槐苷浓度高至2μm仍然对bmms无细胞毒性作用,具有较为安全的生物活性。
实验方法:使用羟基磷灰石吸收测定法测定破骨细胞活性。将bmms接种到6孔胶原包被的培养板上。细胞在37℃下粘附过夜,并加入50ng/mlrankl和m-csf刺激,直到破骨细胞开始形成4天。一旦观察到成熟的破骨细胞,用细胞解离溶液轻轻收获细胞,计数,并将等量的多核细胞铺板在羟基磷灰石涂覆的平板。在接种到羟基磷灰石板上之后,在50ng/mlrm-srankl和m-csf存在下,用不同浓度(1μm和2μm)的洋槐苷处理细胞。48小时后,一半孔获得tracp染色,以评估每孔用于破骨细胞计数的多核细胞数。剩余孔经漂白并干燥,并分析羟基磷灰石吸收区的百分比。
结果表明:与阴性对照组相比,在洋槐苷1μm和2μm干预时,破骨细胞吸收面积的百分比减弱。如图1d~图1e可观察到破骨细胞数量小,并呈现非剂量依赖性降低,但相对于吸收面积则较小程度。这些结果表明,洋槐苷对成熟破骨细胞存活影响小;它更倾向于抑制破骨细胞的骨吸收。
实施例2:洋槐苷影响破骨细胞伪足小体的形成,并抑制破骨细胞的吸收功能
实验方法:为了观察伪足小体,bmms被接种到96孔板中的fbs涂层盖玻片上,并在不同浓度洋槐苷(0μm,1μm,2μm)存在下诱导形成破骨细胞,如上所述。将破骨细胞用体积分数为4%的多聚甲醛(pfa)固定10分钟,用0.1%(v/v)tritonx-100渗透10分钟,用3%牛血清白蛋白(bsa)封闭pbs中1小时,然后用纽蛋白染色(1:200)在4℃孵育过夜,然后在pbs中洗涤并用荧光二级抗鼠抗体(alexafluor488,绿色)孵育。f-肌动蛋白用罗丹明标记鬼笔环肽染色1小时。之后,用pbs清洗细胞,用dapi染色10分钟,再次清洗,并在使用nikona1si共焦显微镜进行可视化,得图2a。
结果表明:从图2a~图2c可得出,洋槐苷的干预抑制了破骨细胞中伪足小体的形成。伪足小体是破骨细胞附着于骨基质表面,实现骨吸收的重要生理功能结构。伪足小体的抑制可导致破骨细胞骨吸收功能下降。
实验方法:使用羟基磷灰石吸收测定法测定破骨细胞活性。将bmms接种到6孔胶原包被的培养板上。细胞在37℃下粘附过夜,并加入50ng/mlrm-srankl和m-csf刺激,直到破骨细胞开始形成4天。一旦观察到成熟的破骨细胞,用细胞解离溶液轻轻收获细胞,计数;并将等量的多核细胞铺板在羟基磷灰石涂覆的平板。在接种到羟基磷灰石板上之后,在50ng/mlrm-srankl和m-csf存在下,用不同浓度(1μm和2μm)的洋槐苷处理细胞。48小时后,一半孔获得tracp染色,以评估每孔用于破骨细胞计数的多核细胞数。剩余孔经漂白并干燥,并分析羟基磷灰石吸收区的百分比。
结果表明:与阴性对照组相比,在洋槐苷1μm和2μm干预时,破骨细胞吸收面积的百分比减弱。如图2c~图2f可观察到破骨细胞数量小,并呈现非剂量依赖性降低,但相对于吸收面积则较小程度。这些结果表明,洋槐苷对成熟破骨细胞存活影响小;它更倾向于抑制破骨细胞的骨吸收。
实施例3:洋槐苷消除rankl引起的ca2+振荡,并抑制破骨细胞特异基因的表达
实验方法:为了研究洋槐苷对rm-srankl诱导的ca2+通路的影响,在rm-srankl诱导的破骨细胞中检测细胞内ca2+通路变化。rm-srankl治疗诱导ca2+振荡,而在rm-srankl未治疗组中未观察到ca2+通量。
结果表明:从图3a~图3d可得出,用洋槐苷处理过的细胞显着抑制rankl诱导的ca2+振荡,洋槐苷抑制ca2+信号通路。
实验方法:rt-qpcr用于评估rm-srankl诱导的破骨细胞分化过程中的基因表达(acp5,cathepsink,atp6v0d2,nfact1,c-fos和mmp9)。将bmm以每孔1×105个细胞的密度用50ng/mlm-csf和50ng/ml的rm-srankl培养到六孔板中,并用rob(0μm,0.5μm,1μm和2μm)持续干预5天。采用
结果表明:从图3e~图3j中可得出,与破骨细胞形成和活性测定一致,破骨细胞标记的基因acp5,cathepsink,atp6v0d2,nfact1,c-fos和mmp9的基因表达在培养第5天以剂量依赖性方式显着降低。
实施例4:洋槐苷抑制rankl诱导的ros体外产生
实验方法:在特定浓度(1μm和2μm)的洋槐苷干预下,用rm-srankl(50ng/ml)刺激bmms后,bmms在含h2dcfda的hank平衡盐溶液中孵育1小时。氧化后,非荧光h2dcfda转化为dcf。用nikon-a1si共焦显微镜在488nm激发波长和515-540nm发射波长下测量了dcf的荧光。细胞图像由数字干扰对比(dic)捕获。用imagej软件分析每个细胞的平均荧光强度和每个视野内的ros阳性细胞数。使用荧光探针dcfh-da检测洋槐苷是否对rm-srankl诱导的ros产生影响。
结果表明:从图4a-4c可得出,与未治疗的基线对照组相比,rm-srankl治疗组的细胞内ros水平显著升高。洋槐苷处理后,每个阳性细胞的dcf荧光强度显著降低。
实验方法:在指定的时间点将bmms接种到含有rm-srankl(50ng/ml)和m-csf(50ng/ml)的完全培养基中,添加rob进行干预。未经处理的细胞用作阴性对照组。然后用含有蛋白酶和磷酸酶抑制剂混合物的放射免疫沉淀(ripa)裂解缓冲液(millipore,ma,us)裂解细胞。在gtp-rac1检测中,将细胞裂解液与结合gtp结合的rac1的gst-humanpak1-pbdfusionprotein一起培养。使用activerac1检测试剂盒分析细胞裂解液。使用10%十二烷基硫酸钠(sds)-聚丙烯酰胺凝胶分离细胞蛋白,然后将分离的蛋白转移到pvdf膜上。用5%脱脂奶粉(smp)阻断1小时。然后给予一抗,将膜在4℃印迹过夜,然后在洗涤后转移对应的二抗孵育1小时。最后,使用增强的ecl试剂观察反应性,并将膜暴露于image-quantlas4000。
采用westernblot研究浓度为0.5μm、1μm、2μm的洋槐苷干预traf6和nox1的表达水平;采用westernblot研究浓度为1μm和2μm的洋槐苷干预gtp-rac1和rac1在5和15分钟的表达水平;采用westernblot研究浓度为0.5μm、1μm、2μm的洋槐苷干预ho-1、catalase、gsr的表达水平。
结果表明:从图4d~图4h可得出,bmms在rm-srankl和不同浓度的洋槐苷干预的情况下孵育2天。rm-srankl显著上调了nox1的表达,但在浓度为0.5~2μm时,洋槐苷呈剂量依赖性抑制。rankl增加了traf6的表达,并且在高浓度(2μm)时呈下调趋势,这并不显著。在rankl刺激5分钟和15分钟后,gtp-rac1激活显著增强,但通过洋槐苷治疗后以剂量依赖性方式减弱。从图4i~图4l可得出,rm-srankl刺激降低了ho-1、catalase、gsr的表达,但通过洋槐苷治疗,ho-1、catalase、gsr的表达恢复和增强是独立的。
实施例5:洋槐苷抑制rankl诱导nf-κb和/或mapk和/或nfatc1转录活性
实验方法:运用luciferase报告基因报告(荧光素酶报告基因)系统测定nf-kb基因表达量。采用2μm洋槐苷干预nf-kb转染的raw264.7细胞1小时,并用与rm-srankl(50ng/ml)温箱孵育24小时,测定细胞的荧光素酶活性。加入2μm洋槐苷和rm-srankl后的bmm细胞,分别孵育0、10、20、30和60分钟用于westernblot测定。westernblot操作同前。
结果表明:从图5a可得出,洋槐苷从0.5μm至2μm浓度以剂量依赖形式抑制nf-kb活化;从图5b~图5g可得出,westernblot分析结果显示,浓度1μm时洋槐苷相对于阴性对照组显着降低了iκbα的降解,而且抑制了rm-srankl诱导的erk磷酸化。iκbα的谷值在第10分钟,而p-erk的谷值在第20分钟,p-p38的谷值在第10分钟,p-jnk的谷值在第20分钟。
实验方法:运用luciferase报告基因(荧光素酶报告基因)试验测定洋槐苷对nfat激活的影响。nfat荧光素酶报告基因构建体转染至raw264.7细胞,用浓度为1μm的洋槐苷干预1小时,随后用rm-srankl刺激24小时,测定细胞的荧光素酶活性;运用westernblot测定nfatc1、integrinαv、cathepsink、v-atpase-d2蛋白表达水平,bmms由rm-srankl(50ng/ml)刺激0、1、3和5天,同时以1μm洋槐苷干预。westernblot操作同前。
结果表明:从图5h可得出,洋槐苷从0.5μmol至2μmol浓度以剂量依赖形式抑制nfatc1活化;从图5i~图5m可得出,洋槐苷显着降低nfatc1、integrinαv、cathepsink、v-atpase-d2的蛋白表达水平,与破骨细胞分化减少一致。nfatc1、integrinαv、cathepsink、v-atpase-d2蛋白表达量的谷值发生于第3天或5天。
实施例6:洋槐苷预防卵巢切除引起的骨丢失
实验方法:将小鼠进行假手术或卵巢切除(ovx),术后用浓度为每6mg/kg的洋槐苷每2天注射。在ovx手术中和随后用洋槐苷治疗期间没有发现任何不良事件。术后6周处死实验小鼠组后,将左侧股骨用体积分数为4%pfa固定24小时,然后放入离心管中,然后使用micro-ct扫描仪进行扫描。测量骨体积/组织体积(bv/tv),骨小梁数(tb.n),骨小梁厚度(tb.th)和骨小梁分离度(tb.sp),并生成二维图像和三维图像。右侧股骨在37℃下于14%edta中脱钙7天。然后将股骨通过乙醇和二甲苯加工成蜡,嵌入石蜡块中,并在切片机上切成5μm的厚度。进行he和tracp染色。拍摄每个切片的图像,并使用bioquantosteo软件进行骨组织形态分析,测量分析骨体积/组织体积(bv/tv),骨面积(bs),破骨细胞数量与骨面积比率(n.oc/bs),破骨细胞面积与骨面积比率(oc.s/bs)。
结果表明:从图6a~图6e可得出,在micro-ct分析中,洋槐苷阻止了ovx小鼠模型中的大量骨质流失。结果证实,在洋槐苷治疗组中,包括bv/tv,tb.n和tb.sp在内的骨骼参数有所增加。从图6f~图6j可得出,组织病理学分析进一步证实,与未治疗组相比,洋槐苷治疗显着降低了ovx引起的骨量损失。he染色的结果表明,洋槐苷治疗组的骨表面和骨体积参数中保持良好。tracp染色显示,与未治疗组相比,洋槐苷治疗后单位骨表面的破骨细胞数量和单位骨表面的破骨细胞表面积均减少。
图6a~图6e分别对应为根据mircro-ct结果提示,与假手术小鼠相比,ovx小鼠的胫骨骨丢失明显,骨体积/总体积的比值下降,小梁骨结构恶化,即小梁数目减少和小梁间距增加。而洋槐苷的注射改善了ovx小鼠的骨丢失。图6f~图6j分别对应为为了研究rob对小鼠模型中破骨细胞形成的影响,我们在离体胫骨的骨切片上进行了he染色和tracp染色。结果表明,rob抑制了由ovx手术引起的破骨细胞表面/骨表面比率和破骨细胞/骨表面积比率的增加,表明rob可以降低体内的破骨细胞活性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



