度洛西汀药物组合物的制作方法
 2021-01-08 11:01:49|
2021-01-08 11:01:49| 325|
325| 起点商标网
起点商标网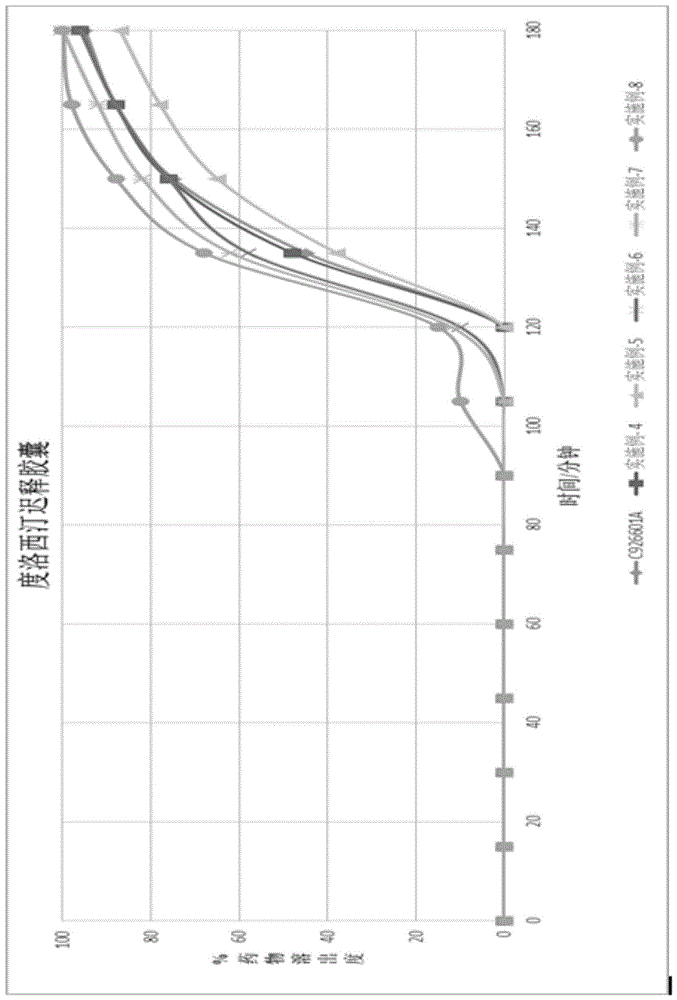
本发明涉及医药制剂技术领域,尤其涉及度洛西汀药物组合物。
背景技术:
度洛西汀(+)-(s)-n-甲基-y-(1-萘基)-2-噻吩丙胺盐酸盐是ssnri(以下称选择性血清素和去甲肾上腺素再摄取抑制剂)类知名药物,用于治疗重度抑郁症(mdd)和糖尿病周围神经病理性疼痛。它通常以其盐酸盐的形式使用,并且在下文中使用术语“度洛西汀”通常是指游离碱,但也指盐和度洛西汀的其他化合物,通常是指盐酸盐。
公认度洛西汀在酸性介质中不稳定。因此,需要保护度洛西汀免受胃的酸性条件的破坏,并使其在胃肠道(git)较高ph中释放,例如在小肠中。对酸敏感的特征活性化合物以肠溶衣制剂的形式给药,其中肠溶衣保护活性化合物免受胃的酸性条件的破坏,并在胃肠道较高ph中释放出活性药物。
然而,度洛西汀会与许多已知的肠溶包衣反应形成缓慢溶解或甚至不溶的包衣层,这降低了活性化合物的生物利用度。
度洛西汀的原研公司是礼来(lilly),商品名为欣百达。在美国专利no.5,508,276中公开了度洛西汀肠溶微丸中羟丙基甲基纤维素乙酸琥珀酸酯(以下称为hpmcas)被用作肠溶衣。为了减少度洛西汀活性物与hpmcas的酸性基团之间的反应,在将hpmcas用于微丸的包衣混合物之前,将其至少部分与氨先进行中和。中和的原因是度洛西汀在酸性基团的存在下会降解,所以肠溶包衣层中使用的聚合物必须选择为每单位重量或该聚合物的重复单元只含有少量的羧酸基团。原研药在配方中hpmcas用作肠溶性聚合物之前,已使用强碱氢氧化铵溶液与其中和,对此,需寻求途径,一方面减少制剂的工序,另一方面突破专利封锁。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明提供了度洛西汀药物组合物,包括:(1)载有一定量度洛西汀的丸芯;(2)两种不同ph溶解度的羟丙甲纤维素邻苯二甲酸酯组成的肠溶层,包覆在丸芯外。
本药物组合物通过使用不同等级的ph溶解度聚合物羟丙甲纤维素邻苯二甲酸酯(hpmcp),无需加氨中和,缩短工序,且大幅减少了肠溶层与丸芯上度洛西汀活性物质的反应,提高了稳定性,此外不同的hpmcp形成肠溶层,使度洛西汀免受胃的酸性条件的破坏,并使其在胃肠道(git)较高ph中释放,例如在小肠中,有助在目标部位精确释放药物,大幅降低在初始时间间隔内存在药物剂量倾泄的风险。
作为优选,以质量计,肠溶层内两种羟丙甲纤维素邻苯二甲酸酯分别为hp50、hp55,二者之间比例为1.5:1-2.5:1,优选为2:1。
进一步,以质量计,肠溶层占比度洛西汀药物组合物的20%-30%。
优选地,肠溶层中还包括抗粘结剂、增塑剂中之一或组合,提高稳定性。
进一步,在肠溶层与丸芯之间设置有隔离层,包括蔗糖、羟丙甲纤维素。
进一步,以质量计,隔离层占比度洛西汀药物组合物的2%-25%,优选10%-25%,蔗糖与低分子量羟丙甲纤维素邻苯二甲酸酯的比例为2:1-4:1,优选3:1。
进一步,隔离层中还包括抗粘结剂,如滑石粉,提高稳定性。
进一步,丸芯包括惰性丸芯及其上的度洛西汀,同时还包括崩解剂、粘合剂、抗粘结剂、增塑剂中之一或组合。
以崩解剂而言,其使药物从剂型中连贯而令人满意地溶出。
进一步,以质量计,丸芯占比度洛西汀药物组合物的58%-70%,崩解剂占比丸芯0-10%,粘合剂占比丸芯1-10%,抗粘结剂占比丸芯1-5%。
进一步,崩解剂选自交联聚维酮,改性淀粉,交联羧甲纤维素钠,羟乙酸淀粉钠,低取代的羟丙基纤维素和羧甲基纤维素钙中之一或组合。
进一步,度洛西汀药物组合物形成微丸或片剂,以抗粘结剂在微丸外形成包衣,有助微丸更好地装填在胶囊中。
与现有技术相比,本发明的有益效果:
1、本发明人突破常规思维,以两种不同的hpmcp形成肠溶层,有助在目标部位精确释放药物,可用于度洛西汀的延迟释放制剂。
2、在本发明人创造性想法下,经大量实验,得出在丸芯中添加崩解剂的方案,其使药物从剂型中连贯而令人满意地溶出。
附图说明
图1:原研药与本发明实施例4-8的溶出曲线比较;
图2:原研药与本发明实施例1-4的溶出曲线比较;
图3:原研药与本发明实施例1-3的溶出曲线比较。
具体实施方式
一、制备
以下实施例中,以盐酸度洛西汀药物组合物形成微丸并制成胶囊剂来具体展示。
其中,制药行业中使用的大多数胶囊均由明胶制成,即胶囊壳是明胶或包含明胶。然而,硬明胶胶囊通常具有相对较高的含水量(通常为13%-16%w/w),这可能导致微丸的稳定性下降。
因此在以下实施例中,胶囊选用hpmc胶囊,水分含量较低;与常规的明胶胶囊相比,通常为10%w/w或更小,典型值为4%-6%w/w,因此不太可能影响其中微丸的稳定性。本发明选用水分含量为10%w/w或更少的主要由hpmc组成的胶囊壳。
其中,粘合剂选用欧巴代ys-1-7006,当然也可需要选择其他类型粘合剂。
增塑剂选用邻苯二甲酸二乙酯,当然也可需要选择其他类型增塑剂。
抗粘结剂选用滑石粉,当然也可需要选择其他类型抗粘结剂。
崩解剂选用交联聚维酮,当然也可需要选择其他类型崩解剂。
至于惰性丸芯,采用常见的蔗糖制备。
以下实施例1-4中组分如下表所示:
表1
实施例5-8中组分如下表所示:
表2
实施例1-8的制备工艺如下:
步骤1:药物层–丸芯部分
将度洛西汀和欧巴代ys-1-7006(粘合剂),交联聚维酮和滑石粉溶解在纯化水中。在wurster流化床中将该溶液包衣在蔗糖丸芯上。
步骤2:隔离层
然后在wurster流化床中首先使用蔗糖,羟丙甲纤维素2910和纯化的滑石粉(助流剂)在纯化中的分散体对上述载药微丸进行包衣,以形成包裹的微丸。
步骤3:肠溶层
然后在wurster流化床中使用羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)50和羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)55,纯化滑石粉(助流剂)和邻苯二甲酸二乙酯(增塑剂)在纯化水和丙酮中的分散体对上述隔离层微丸进行包衣以形成肠溶层度洛西汀微丸。
步骤4:最外层
肠溶层微丸可选用助流剂润滑,或者可以用助流剂(如滑石粉)进行表面包衣,以实现良好的流动性并将其装填到胶囊中。
所有上述wurster包衣工艺步骤均采用常规条件和技术进行。
二、检测
根据fda溶出度方法对上述实施例1-8制备的胶囊,以及原研药欣百达,批号c926601a胶囊剂(缓释微丸)进行了检测:
篮法(100转)
[a]胃液挑战:0.1nhcl2小时
[b]缓冲液:ph6.8磷酸盐缓冲液(usp),取样点15、30、45、60和90分钟。
如图2、图3所示,上述实施例1-3中制得的制剂具有可接受的稳定性和溶出曲线;如图1所示,在实施例8配方中,我们只使用了一种聚合物而不是两种聚乙二醇聚合物,但溶出失败了,因为药物在120分钟前就释放了;实施例4的配方与原研药c926601a匹配;与原研药c926601a相比,实施例5的溶出速度较慢;与原研药相比,实施例6和7的配方溶出更快。
实例4在缓冲液中1小时内完全溶解,表明与知名品牌产品(欣百达,批号c926601a)的体外释放相似。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



