水凝胶搭载环孢素A在制备治疗心肌缺血再灌注损伤的药物中的应用的制作方法
 2021-01-08 11:01:24|
2021-01-08 11:01:24| 395|
395| 起点商标网
起点商标网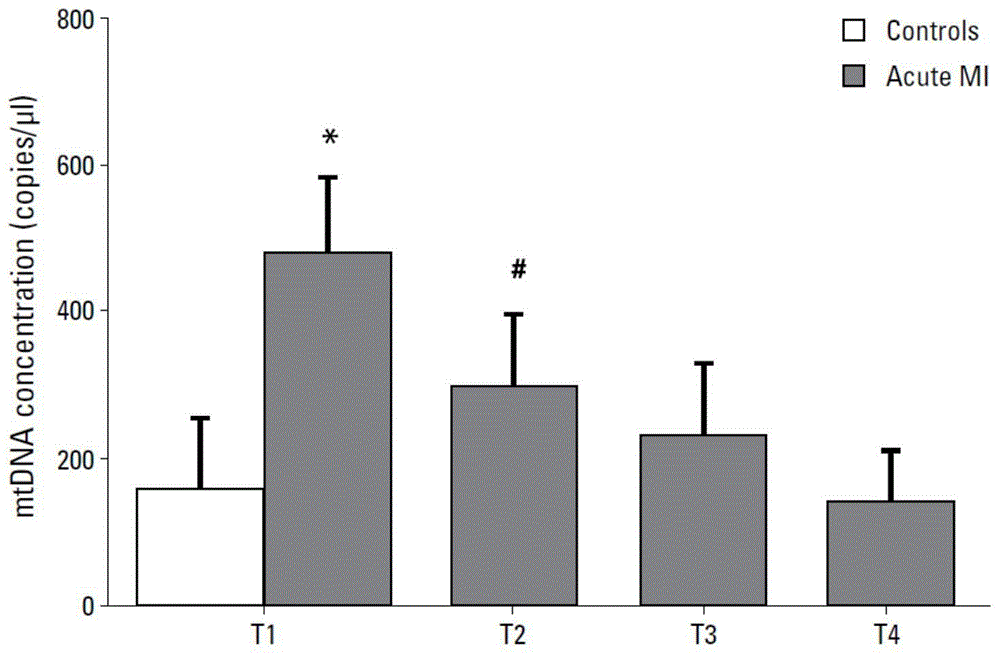
本发明涉及生物医药技术领域,具体涉及一种搭载环孢素a的水凝胶在制备治疗心肌缺血再灌注损伤的药物中的应用。
背景技术:
随着社会经济文化的迅猛发展、人口老龄化和城镇化进程的加快,我国心血管疾病的发病率在不断攀升,造成了极大的经济负担,目前已经成为我国重大的公共卫生问题。冠状动脉粥样硬化性心脏病(coronaryarterydisease,cad)的发病率和死亡率均不断上升,2017版中国心血管病报告指出,急性心肌梗死(acutemyocardialinfarction,ami)的死亡率仍呈现快速上升趋势,2005年至2015年城市ami死亡率自21.5%升至56.38%。随着介入心脏病学的飞速发展,及时、有效的介入治疗可以显著降低ami的死亡率并改善病人的预后。然而,ami后缺血缺氧损伤(ischemicinjury)以及冠状动脉血运重建后的再灌注损伤(myocardialischemia/reperfusioninjury,miri)带来的局部及全身损害也不容忽视。目前miri被认为是ami血运重建后病人死亡、各类并发症以及心衰的主要诱因。由于miri的具体损伤作用机制尚未阐明,miri导致的心肌细胞坏死和凋亡仍未得到有效的控制。因此,进一步寻找有效的干预药物并明确药物运送机制,仍然是目前心血管领域研究的重中之重。
心肌再灌注时,线粒体通透性转换孔(mitochondrialpermeabilitytransitpore,mptp)的持续性开放,在再灌注损伤中发挥着重要的作用。环孢素a(cyclosporinea,csa)是一种器官移植中常用的免疫抑制剂,许多动物实验及部分小规模临床研究表明,其可以通过抑制mptp而减少梗死面积。mptp是位于线粒体内膜上的非特异性孔道,正常生理情况下只允许相对分子质量<1.5kd的分子自由通过;但在损伤因素刺激下,mptp完全开放,直径可达到3.0nm,使相对分子质量>1.5kd的分子也能非选择性地自由通过。组织缺血再灌注后数分钟内,ph值迅速恢复、细胞内钙超载及活性氧的大量产生可引起mptp开放,从而使溶质和离子通过该通道进入线粒体,线粒体基质肿胀、电化学梯度消失、呼吸链解耦联、atp耗竭、线粒体外膜破裂、吡啶核苷酸丧失、促炎介质线粒体dna(mitochondrialdna,mtdna)释放及促凋亡因子细胞色素c(cytochromec,cytoc)释放入细胞浆,最终导致细胞凋亡和(或)坏死。发明人前期研究(qinc,guj,liur,etal.releaseofmitochondrialdnacorrelateswithpeakinflammatorycytokinesinpatientswithacutemyocardialinfarction[j].anatoljcardiol,2017,17(3):224-228)提示急性心肌梗死病人行经皮冠状动脉介入术后存在心肌细胞线粒体的损伤,mtdna的释放可能就是mptp开放导致线粒体内容物外逃导致(图1)。
通过对比分析csa对心肌保护作用的最新进展,发明人将动物实验与临床试验进行了比较,发现由于csa具有不可忽视的毒性作用,因此其应用在动物实验中的剂量远大于临床试验(5-10mg/kgvs.2.5mg/kg)。
技术实现要素:
本发明提供了一种水凝胶搭载环孢素a在制备治疗心肌缺血再灌注损伤的药物中的应用,解决了现有技术存在的环孢素a直接给药毒性过大问题。
为了解决该技术问题,本发明提供了如下技术方案:
一种治疗心肌缺血再灌注损伤的药物,包括:水凝胶和环孢素a。
本发明还提供了一种水凝胶搭载环孢素a在制备治疗心肌缺血再灌注损伤的药物中的应用。
所述水凝胶采用发明人前期的研究成果(acsnano,2017,11,11074-11081;acsappliedmaterials&interfaces,2017,9,9221-9225;advancedmaterials,2015,27,1294-1299;journalofamericanchemicalsociety,2012,134,16558-16561)中的方法制备,通过将儿茶酚基团引入到温敏性水凝胶体系中构建了一类贻贝仿生的可注射性水凝胶,该类水凝胶表现出良好的生物相容性,可以智能抵抗外界作用并且可以在收到破坏条件下自由修复维持系统的正常运行;同时得益于儿茶酚基团的存在,该水凝胶对生物组织有着贻贝仿生粘合力,其粘合强度可以根据实际情况引入不同儿茶酚含量进行调节。
然后将环孢素a搭载至水凝胶上。
水凝胶搭载环孢素a在构建大鼠心肌缺血再灌注损伤模型中的应用。
本发明还提供了水凝胶搭载环孢素a在构建大鼠心肌缺血再灌注损伤模型中的应用,所述大鼠心肌缺血再灌注损伤模型的构建方法包括以下步骤:
(1)将sd大鼠分为5组,分别为假手术组、模型组、csa腹腔注射组、水凝胶a组、含csa水凝胶a组,除假手术组外均进行lad结扎;
(2)分别在再灌注3h、24h、48h和7d,取大鼠静脉血,检测血液中炎症因子的表达、线粒体dna含量、促凋亡因子细胞色素c表达变化;
(3)采用小动物心脏彩超检测心脏收缩功能,包括左心室射血分数、左心室短轴缩短率;
(4)取大鼠心脏,采用ttc染色法检测大鼠的心梗面积,同时取部分心肌组织检测心肌细胞凋亡指标的表达变化、心肌细胞mptp的开放程度。
优选的,所述步骤(1)lad结扎时间为30min。
本发明和现有技术相比,具有以下优点:
针对目前csa临床应用失败的原因,在智能可控水凝胶研究基础上,创新性地搭载csa这一具有细胞毒性的药物,通过水凝胶的理化特性和给药途径,减少csa的用药量及副作用,为临床应用csa提供新的给药方式,通过此csa的给药方式,不仅可以局部增加csa药效而减少全身毒性作用,还可以通过具有局部电传导和粘合作用的水凝胶a心脏补片改善心梗后的心肌损伤。
附图说明
此处所说明的附图用来提供对本发明实施例的进一步理解,构成本申请的一部分,并不构成对本发明实施例的限定。在附图中:
图1为现有技术ami病人经皮冠状动脉介入围术期外周血mtdna的变化;
图2为大鼠miri后心肌细胞中cytochromec、c-caspase-3蛋白表达水平;
图3为大鼠miri后ttc染色检测心梗面积;
图4为大鼠miri后心脏功能的变化;
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
实施例1
本实施例提供了水凝胶的合成方法。首先,合成前驱三嵌段聚合物,在25ml的圆底烧瓶中分别加入raft-peg455-raft(0.518g,0.025mmol)、n-异丙基丙烯酰胺(1.130g,10mmol)、丙烯酸五氟苯酚酯(0.238g,1mmol)、偶氮二异丁腈(0.002g,0.0125mmol)、5ml1、4-二氧六环,通氮气15分钟后在70℃油浴条件下反应12h。反应结束后,在上述混合物中加入5ml四氢呋喃使聚合反应淬火,所得溶液滴加到大量的乙醚中沉淀三次,在真空下干燥过夜,得到前驱三嵌段聚合物。
然后,用3、4-二羟基苯乙胺和对苯二胺同时取代前驱三嵌段聚合物中的五氟苯酚得到三嵌段聚合物tnotn,大致方法如下:将前驱三嵌段聚合物1.50g、多巴胺盐酸盐(0.190g,1mmol)、对苯二胺(0.108g,1mmol)、20ml二氯甲烷加入50ml圆底烧瓶中,通氮气20分钟后加入三乙胺(0.202g,2mmol),整个混合溶液在50℃油浴下搅拌过夜,反应后的溶液在乙醚中沉淀两次,得到白色固体三嵌段聚合物tnotn。
最后,将苯胺在tnotn上原位聚合,简而言之,0.500gtnotn、10ml盐酸(0.1mol·l-1)水溶液、0.020g苯胺,苯胺溶解后加入0.050g过硫酸铵,室温搅拌24h,反应后溶液用1mol·l-1的氢氧化钠溶液中和,用大量的水清洗去除其中的未反应物,就得到最终的水凝胶产品。
实施例2
采用实施例1提供的一种水凝胶搭载环孢素a,并进行一下试验:
1.大鼠心肌缺血再灌注模型模型的建立及分组
模型组(miri):选取雄性sd(spraguedawley)大鼠,经戊巴比妥钠(30mg/kg)腹腔内注射麻醉,充分麻醉后行气管插管,连接小动物呼吸机hx-300(成都泰盟科技有限公司)进行机械通气。在胸骨左侧第3或4肋间纵向切开皮肤组织,钝性分离肌肉组织暴露出肋骨。用显微尖镊打开第3或4肋间隙,使用开胸器充分暴露心脏,打开心包后寻找lad。用7-0无创缝合针于左心耳根部下方2mm处结扎lad,打结时放入以长约0.5cm,直径约1.5mm的软塑料管。结扎后可观察心尖部组织明显变暗、变白,表明结扎lad成功,心肌组织出现缺血区域。缺血30min后送结扎线并取下软塑料管后重新开放lad灌注,可观察到缺血区域缓慢变红,表明再灌注过程开始。再灌注后逐层缝合肋骨、肌肉、皮肤。
假手术组(so):大鼠操作同模型组,开胸后寻找到lad不结扎,稳定30min后进行关胸。
腹腔注射csa组(miri+intraperitonealcsa):大鼠操作同模型组,关胸前腹腔注射2.5mg/kgcsa。
水凝胶a组(miri+hydrogel):大鼠操作同模型组,关胸前缺血心肌表面局部注射不含csa的水凝胶。
含csa水凝胶a组(miri+hydrogelcsa):大鼠操作同模型组,关胸前缺血心肌表面局部注射含2.5mg/kgcsa水凝胶。
2.实验
2.1westernblot
a.全细胞蛋白提取液
细胞或组织加入200μlripa裂解液(含1mmpmsf),置冰浴上裂解5min,然后转移至ep管中,4℃、12000g离心10min,收集上清液。bca蛋白定量试剂盒测定样品中蛋白质的含量,按照4:1比例将蛋白样品与5×上样缓冲液混合,95℃煮沸5min蛋白变性,蛋白样品置于-20℃保存。
b.sds-page凝胶电泳
根据目标蛋白的分子量配制4%sds-page浓缩胶以及合适浓度的sds-page分离胶(表1),蛋白样品上样量为20μg,sds-page检测。浓缩胶电压设置在80v,到分离胶的时候将电压调至120v,待指示剂溴酚蓝行至底端时,停止电泳。
c.转膜与封闭
电泳完毕后,将目标蛋白条带转膜至pvdf膜上。pvdf膜在甲醇中活化10s后,按照正极–滤纸–pvdf膜–凝胶–滤纸–负极的顺序制成电转膜“三明治”,恒流200ma下将胶上的蛋白转移至pvdf膜上,5%脱脂牛奶室温封闭1h。
d.免疫反应
封闭完成后,分别将膜与对应的一抗(按照适当比例用tbst稀释,表1)4℃孵育过夜;tbst洗膜3次,5min/次。加入对应的偶联辣根过氧化物酶的二抗溶液,室温孵育1h;tbst洗膜3次,5min/次。
表1.相关蛋白的分子量及凝胶电泳时的分离胶浓度、转膜时间和抗体稀释比例
f.ecl发光
将ecla和eclb等体积混合,滴在pvdf膜的蛋白面上,使用化学发光凝胶成像系统进行拍照,用imagelab对免疫印迹条带进行半定量分析蛋白表达差异。
2.2ttc染色心梗面积
大鼠缺血再灌注结束后,再次结扎阻断的左冠状动脉前降支,静脉注射2%evansblue1ml。待大鼠口唇变蓝后迅速取下心脏,剪去心房和右心室组织,于-20℃冰冻5-20min。垂直于心脏长轴讲左心室切成1.5-2mm左右的薄片,共5片。放入37℃的1%ttc染液中染5-20min。
2.3大鼠心脏彩超
使用gelogiq7彩色多普勒超声诊断仪,il2l,探头频率为12mhz。超声图像深度为2cm,增益固定为60db。待检测时,提前给予10%水合氯醛麻醉,使用脱毛剂褪净胸部皮毛,干净显露皮肤。将大鼠仰卧位固定,将探头放于左前胸,与前正中线呈30°夹角可显示左心室长轴切面;顺时针旋转90°可显示短轴切面。在二维引导下将取样线放在左心室腱索水平,取m型曲线进行心功能测量。所有测量均为3个心动周期的平均值。
2.4ros含量的测量
将冰冻的心肌组织进行冰冻切片;心肌细胞铺片培养、干预。配置浓度为2μm的dhe溶液(购自invitrogen公司)孵育切片(避光、湿润环境,37℃,30min)。采用荧光显微镜(observerd1,蔡司)检测dhe发射的红色荧光,信号强度采用axiovision软件进行定量分析。
2.5mtdna含量检测
使用dna提取试剂盒(#69504,qiagen,usa)提取血浆样本中的dna。首先取50μl血浆标本加入50μlpbs,充分混合均匀后在4℃离心机中以16100g离心15min,后取90μl上清液置于1.5mlep管中。严格按照试剂盒中的说明书获取血浆中dna:将血浆样本与裂解液、蛋白酶k混合,在56℃下放置15min。经多次dna层析柱过滤后,将dna溶解于200μldna溶解液中,用于下一步荧光定量聚合酶链式反应(pcr)。
血浆中mtdna浓度测定使用基于sybr-green染色的荧光定量pcr技术分析。荧光定量pcr检测mtdna浓度步骤为:初始阶段2min,50℃;第一步变性温度为95℃,3min;进行95℃10s、55℃15s和72℃10s的循环,共39个循环。
另制备标准曲线。标准曲线为携带有人类mtdna的质粒(sc101172,origene,usa)通过10倍梯度稀释获得。mtdna浓度使用标准的转换系统转换成拷贝数(copies)。
最后,血浆mtdna浓度的计算公式为:c=q*vdna/vpcr*1/vext。
其中c代表血浆中mtdna的浓度;q代表荧光定量pcr检测的样本中mtdna的拷贝数;vdna代表每个血浆样本中提取dna的总体积,本实验中为200μl;vpcr代表荧光定量pcr时加入dna的体积,本实验中为1μl;vext代表提取dna时使用的血浆的量,本实验中为50μl。
2.6mptp检测
采用商品化mptp检测试剂盒,特殊试剂进行细胞染色,稳定后使用流式细胞仪检测信号强度,反映mptp开放程度。
2.7elisa检测
采用商品化的elisa检测试剂盒,按照说明书要求分别检测tnf-α、il-6、cytochromec,采用多功能酶标仪检测96孔板吸光度(o.d.值)。
3.结果
3.1miri大鼠模型中ers和线粒体损伤指标以及c-caspase-3表达的动态变化
对miri大鼠动物模型组分别检测了线粒体损伤标志物cytochromec和细胞凋亡标志物的c-caspase-3蛋白的表达变化。采用免疫印迹上述相关蛋白表达情况,结果如图2所示,在缺血150min(再灌注120min)时才出现细胞质cytochromec和c-caspase-3的明显升高。
本研究结果提示心肌缺血再灌注大鼠模型中,再灌注120min开始即存在心肌细胞线粒体损伤和心肌细胞凋亡。
3.2心肌ttc染色明确心肌缺血面积
建立了miri模型后,取新鲜心肌组织进行ttc染色,红染区域为正常血供区域,白色区域为缺血区域。如图3所示,模型组大鼠左心室自由壁缺血区域明显,心尖区基本变白,说明结扎lad后其供血区域血供明显受到影响。
本研究结果提示心肌缺血再灌注大鼠模型成功建立,ttc染色明确心肌缺血面积。
3.3心脏超声明确心肌缺血再灌注模型建立效果
建立了miri模型后,采用小动物心脏彩超检测心肌缺血再灌注7天后心脏功能的变化,如图4所示,我们发现模型组大鼠的心脏功能(lvef、lvfs)明显降低,说明模型建立成功,可以用于进一步分析含有csa水凝胶a的心肌保护作用。
本前期研究提示心肌缺血再灌注大鼠模型7天后存在明显的心功能减弱。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



