一种开关型脂质体纳米荧光探针及其制备方法和用途与流程
 2021-01-08 11:01:42|
2021-01-08 11:01:42| 325|
325| 起点商标网
起点商标网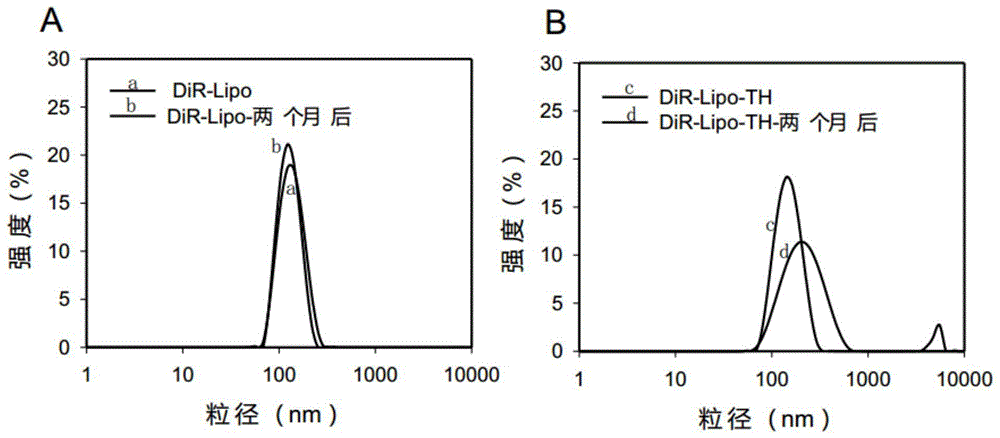
本发明属于纳米技术和荧光诊断研究领域,尤其涉及一种开关型脂质体纳米荧光探针及其制备方法和用途。
背景技术:
针对肿瘤的近红外荧光成像技术具有优异的分辨率和灵敏度,并且近红外荧光成像在生物组织中的穿透深度大,成像信号受组织的影响也比较少,是近几年发展起来的一种新型成像手段。荧光造影剂(如吲哚青绿(icg),亚甲蓝(mb)等)本身的肿瘤选择性差,造成肿瘤信号背景比(tbr)很低。而tbr被认为是评估和选择荧光造影剂的重要标准,所以提高荧光探针的tbr对肿瘤荧光成像非常重要。将染料包裹于纳米载体中,可以有效提高它的稳定性和特异性。
脂质体在包裹近红外荧光染料方面都具有广泛的应用,将荧光染料包裹在脂质体中,可以提高染料的特异性,提高荧光探针的tbr。比如,将常用的亲水染料icg和疏水染料ir780分别包裹于脂质体的亲水内腔和疏水夹层,得到常用的脂质体荧光探针icg脂质体和ir780脂质体。具有聚集诱导猝灭效应(acq)的适量荧光染料包裹于脂质体中可以还构成一种开关型荧光探针,其荧光成像背景干扰少,可以进一步提高荧光探针的tbr。但是,现有的acq-脂质体探针都是将高浓度亲水染料负载于亲水相,或是将高浓度的疏水染料包裹在疏水相来实现,它们的开关性能受限于包载率和染料分子间的距离。
技术实现要素:
为解决现有技术中存在的问题,本发明提供了一种将疏水染料通过主动负载的方式包裹于脂质体水相内核中的开关型脂质体纳米荧光探针及其制备方法和用途。
为了实现上述目的,本发明提供以下技术方案:
一种开关型脂质体纳米荧光探针,包括疏水近红外荧光染料和其外面包裹的脂质体磷脂膜;该脂质体磷脂膜由胆碱类衍生物、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000组成;脂质体的亲水空腔装载所述疏水近红外荧光染料;
所述疏水近红外荧光染料为dir(1,1'-双十八烷基-3,3,3',3'-四甲基吲哚三碳菁碘化物);
所述胆碱类衍生物选自相变温度高于室温的磷脂如二硬脂酰基磷脂酰胆碱、二棕榈酰磷脂酰胆碱中的至少一种。
根据本发明的实施方案,所述脂质体磷脂膜中胆碱类衍生物、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000与近红外荧光染料的摩尔比为45~65:30~50:1~10:1~10,优选为50~60:35~45:3~7:3~7,还优选为55:40:5:5。
根据本发明的实施方案,所述开关型脂质体纳米荧光探针的粒径为50~500nm,优选为100~400nm,还优选为120-200nm。
本发明还提供上述开关型脂质体纳米荧光探针的制备方法,包括以下步骤:
s1)将胆碱类衍生物、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000溶解于溶剂中,蒸发形成脂质膜;
s2)将硫酸铵水溶液加入到步骤s1)制备的脂质膜中进行水合后挤出,再用醋酸缓冲液进行透析,形成硫酸铵梯度,得到脂质体溶液;
s3)将疏水近红外荧光染料的dmso溶液与步骤s2)制备的脂质体溶液进行混合,得到疏水近红外荧光染料-脂质体混合液;
s4)将步骤s3)制备的混合液在磷酸盐缓冲液中进行透析,得到亲水空腔包裹疏水近红外荧光染料的开关型脂质体纳米荧光探针。
根据本发明的实施方案,所述胆碱类衍生物、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000和近红外荧光染料的摩尔比为45~65:30~50:1~10:1~10,优选为50~60:35~45:3~7:3~7,还优选为55:40:5:5。
根据本发明的实施方案,步骤s1)中使用的溶剂为卤代烷烃类溶剂或醇类溶剂,例如选自氯仿,甲醇中的至少一种。
根据本发明的实施方案,所述硫酸铵溶液的浓度为300~400mm,优选为325~375mm,例如为350mm。
根据本发明的实施方案,所述醋酸缓冲液的浓度为50~150mm,优选为75~125mm,例如为100mm。
根据本发明的实施方案,步骤s3)的操作在惰性气体氛围中进行,优选在氮气环境中进行。
根据本发明的实施方案,挤出选用50~200nm的聚碳酸酯膜,例如使用50nm、80nm、200nm或100nm的聚碳酸酯膜。
根据本发明的实施方案,挤出的次数为5~20次,例如10次。
根据本发明的实施方案,助溶剂dmso的体积占近红外荧光染料-脂质体混合液总体积的5~15%,例如10%。
本发明还提供如上所述开关型脂质体纳米荧光探针在标记肿瘤中的用途。
有益效果
1)本发明采用主动负载的方法,在脂质体亲水空腔内装载疏水染料,提高了染料的包封率,又减小了分子间的距离,提高了acq效率。将染料装载于脂质体亲水内核中,也提高了染料在体成像过程中的血液稳定性,减少了血液循环过程中脂质体中染料的释放,增强了其生物相容性。
2)本申请使用的红外荧光染料dir是一类具有聚集诱导猝灭效应的荧光染料,在水溶液中基本没有荧光信号,将疏水红外荧光染料包裹于脂质体亲水空腔中,会使得疏水红外荧光染料的荧光信号减弱,从而得到开关型荧光探针,可以减少在体成像过程中背景信号的干扰,提高荧光成像的信号背景比(tbr)。
3)本申请首次将疏水红外荧光染料包封于脂质体亲水内腔中。并且,发明人意外地发现,仅有dir疏水荧光染料可以采用本申请的方法制备开关型荧光探针(例如申请人发现采用icg或ir780作为荧光染料采用本申请的主动加载法制备开关型荧光探针时,制备过程会产生沉淀,难以将icg或ir780包封于亲水空腔中。
4)发明人还发现,由于不饱和脂质体(相变温度低于室温)与疏水红外荧光染料亲合性较强,难以制备开关型荧光探针,而本申请使用使用饱和脂质体(相变温度为55℃)则可以很好地克服这一问题。
5)本申请的开关型荧光探针制备方法使用设备简单,操作容易掌控,成本低,使用方便,并且体内成像效果好,为包裹具有acq效应的疏水性染料提供了一种新的装载方法。
附图说明
图1为实施例1制备的dir-lipo制备时及放置两个月后的粒径分布图(1a),及常规薄膜水化法制备的dir-lipo-th制备时及放置两个月后的粒径分布图(1b);
图2为实施例1制备的dir-lipo和dir-lipo-th的cryo-tem图像;
图3为实施例1制备的dir-lipo和dir-lipo-th破膜前后的荧光光谱图(其中2a为dir-lipo破膜前后的荧光光谱;2b为dir-lipo-th破膜前后的荧光光谱);
图4为实施例1制备的dir-lipo在小鼠体内的活体成像图(其中a为尾静脉注射dir-lipo后小鼠的全身荧光分布随时间的变化;b为肿瘤处的荧光强度随时间变化定量;c为肿瘤信号背景比随时间的变化)。
具体实施方式
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
以下实施例中,二硬脂酰基磷脂酰胆碱(dspc)、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg2000)均购自avanti。dir购自aatbioquest。
以下实施例中肿瘤信号背景比tbr的计算方法为:tbr=肿瘤处的荧光值/肿瘤旁边肌肉的荧光值。
实施例1
本实施例中所述的dir-lipo的制备方法如下:
将二硬脂酰基磷脂酰胆碱(dspc)、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg2000)以摩尔比为55:40:5(总的脂质摩尔浓度5mm)溶解在氯仿中,然后通过旋转蒸发除去氯仿,形成脂质膜;
将350mm的硫酸铵水溶液加入到脂质膜中,于60℃水浴锅中旋转,对脂质膜进行水合。待形成的脂质膜水合变成乳液状脂质体混悬液后,用挤出器在100nm的聚碳酸酯膜上挤出10次;
将挤出后的脂质体溶液用100mm的醋酸缓冲液透析3次,形成具有硫酸铵梯度的脂质体制剂(内:350mm的硫酸铵;外:100mm的醋酸缓冲液)
将上步所得脂质体溶液与dir的dmso溶液(dir占总脂质摩尔数的1%)混合,于60℃中孵育1h,后用磷酸盐缓冲液透析3次,除去dmso,得到亲水空腔装载疏水染料dir的脂质体纳米荧光探针(dir-lipo)。取少量所得的1%dir-lipo用0.05%tritonx-100进行破膜,测得dir,经检测包封率为60%。将dir-lipo稀释于pbs中测定其完成制备时,及放置两个月后的粒径分布,结果见图1a;由图1a可知dir-lipo粒径大小在140nm左右,两个月后脂质体粒径基本没有变化。
本实施例还制备了dir-lipo-th,其制备方法如下:
将二硬脂酰基磷脂酰胆碱(dspc)、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg2000)、dir以摩尔比为55:40:5:1.8(总的脂质摩尔浓度1mm)溶解在氯仿中,然后通过旋转蒸发除去氯仿,形成脂质膜;
将350mm的硫酸铵水溶液加入到脂质膜中,于60℃水浴锅中旋转,对脂质膜进行水合。待形成的脂质膜水合变成乳液状脂质体混悬液后,用挤出器在100nm的聚碳酸酯膜上挤出10次;
将挤出后的脂质体溶液用磷酸盐缓冲液透析3次,除去多余的硫酸铵水溶液和dir,得到脂质体夹层装载疏水染料dir的脂质体纳米荧光探针(dir-lipo-th)。取少量的dir-lipo-th用0.05%tritonx-100进行破膜,测得dir,经检测包封率为23%;将dir-lipo-th稀释于pbs中测定其制备时,及两个月后的粒径分布,结果见图1b;由图1b可知其粒径大小在150nm左右,并且两个月后粒径变大,在220nm左右。由此结果可以看出,将dir包裹在脂质体水相内核后,相对于包封在疏水腔中显著增加了其包封稳定性。
实施例2dir-lipo和dir-lipo-th的形态对比
为研究实施例1制备的dir-lipo确实是包裹在脂质体的水相内核中,使用冷冻透射电子显微镜(cryo-tem)表征dir-lipo和dir-lipo-th的形态,结果见图2。如图2a所示,dir-lipo核内显示出具有电子致密结构的双层构象,表明铵根离子与dir形成复合物并保留在脂质体的水相内核中。而dir-lipo-th的检测结果(2b)未显示双层结构,表明dir进入疏水相。
实施例3dir-lipo和dir-lipo-th破膜前后的荧光对比
为研究实施例1制备的dir-lipo确实是包裹在脂质体的水相内核中,并且具有体外荧光可激活特性,本实施例将用0.05%tritonx-100对dir-lipo和dir-lipo-th分别进行破膜。先用pbs分别稀释dir-lipo和dir-lipo-th,测定脂质体在完整状态下的荧光强度,后加入0.05%tritonx-100对脂质体破膜,测定染料dir在单体状态下的荧光强度,比较破膜前后的荧光强度,结果见图3。由图3a可知,dir-lipo破膜后(f)的荧光强度远大于破膜前(e)荧光强度,荧光增强倍数为70倍,表明dir-lipo在完整状态下荧光是猝灭的,被破裂后荧光可以得到恢复,可见dir-lipo具有体外荧光可激活特性(经检测,dir-lipo破膜后体系中dir的浓度为0.9μm)。由图3b可知,dir-lip-th破膜后的荧光强度(h)与破膜前(g)荧光强度相比,荧光仅增强了1.6倍,表明dir-lip-th将dir包裹在夹层中,dir荧光基本上没有猝灭(经检测dir-lipo-th破膜后体系中dir浓度为1.5μm)。从两种不同方法负载dir的脂质体破膜前后的荧光对比,间接证明了dir-lipo成功地将dir包裹到了水相内核中。
实施例4dir-lipo体内成像效果测试
取实施例1中得到的dir-lipo150μl尾静脉注射于经脱毛的bab/c小鼠体内(dir量:3.5nmol),使用ivis成像系统(perkinelmerivisluminaiii)在740nm的激发波长下,观察尾静脉注射5min、30min、1h、2h、4h、8h、12h、24h、36h、48h、72h后的体内成像效果,并定量肿瘤处的荧光强度值,计算荧光成像的肿瘤信号背景比tbr,结果分别见4a、4b、4c。可见肿瘤处的荧光强度随注射时间增强。计算得到注射36h后的tbr最高为7.1,表明dir-lipo有很好的体内成像效果。
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



