一种3D打印装置的制作方法
 2021-02-21 08:02:38|
2021-02-21 08:02:38| 397|
397| 起点商标网
起点商标网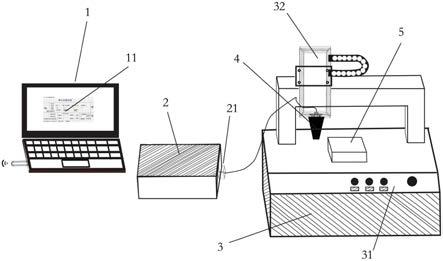
一种3d打印装置
技术领域
[0001]
本实用新型涉及3d打印技术领域,特别是涉及一种3d打印装置。
背景技术:
[0002]
3d打印技术出现于上世纪90年代,属于快速成型技术的一种。它与普通打印机工作原理基本相同,打印机的墨囊中装有液体或者固体粉末等经特殊方法处理得到的“墨水”。通过与计算机连接,以数字模型文件为基础,打印出层层叠加起来的图案模型,使构图转化为实物。这一技术如今在多个领域得到应用,如航空航天、建筑模型、模具制造、生物医学、服装设计等。与传统技术相比,3d打印技术最突出的优势就是不必使用机械加工或模具,能直接根据计算机中的模型图打印出任何形状的东西。这极大地节省了时间和金钱,使企业的生产率得到大幅提高并降低了生产成本,从根本上减少了材料的浪费,节省了劳动力。
[0003]
根据打印材料的成型方式,可将3d打印技术分为三大类型,即挤出成型、粉状物料成型、光聚合成型,每种类型中又包括了一种或多种技术路线。一般的打印装置以单个挤出型或双挤出型的打印模式为主,在打印模式上选择的可能性较小,且打印装置包含的结构复杂。若要实现多种物料的层层打印,则需要多个挤出机共同配合,打印难度大,打印效率较低,且需要设计出复杂的打印程序。此外,这种普通单一的打印模式无法满足大多数器件的打印。
技术实现要素:
[0004]
本实用新型的目的是提供一种3d打印装置,以解决上述现有技术存在的问题,使打印模式多样化,提高了打印效率。
[0005]
为实现上述目的,本实用新型提供了如下方案:
[0006]
本实用新型提供一种3d打印装置,包括三维移动平台,所述三维移动平台上安装有三轴机械臂,所述三轴机械臂电连接有控制器,所述三轴机械臂上安装有打印喷头,所述打印喷头电连接有驱动电源,所述驱动电源无线连接有计算机,所述计算机内置有控制软件;所述三维移动平台上固定设置有接收平台,所述接收平台位于所述打印喷头下方,所述打印喷头内装有打印墨水。
[0007]
可选的,所述打印喷头内均匀设置有多条打印通道,每条所述打印通道内均设置有墨囊,所述墨囊内盛装有所述打印墨水;所述墨囊底部开设有喷嘴,所述墨囊侧壁上安装有压电陶瓷片,所述打印通道与所述驱动电源通过导线电连接;所述压电陶瓷片外侧设置有隔膜。
[0008]
可选的,所述三轴机械臂包括水平固定设置于所述三维移动平台上的y轴,所述y轴上滑动设置有竖直安装的z轴,所述z轴顶部固定安装有水平设置的 x轴,且所述x轴的水平投影与所述y轴的水平投影垂直设置,所述x轴上通过链轮结构水平滑动设置有控制端,所述控制端侧壁上通过链轮结构竖直滑动设置有机械臂,所述机械臂末端固定安装有机械
手,所述打印喷头安装于所述机械手上。
[0009]
可选的,所述驱动电源上开设有连接端口,所述连接端口通过导线与所述打印通道连接。
[0010]
可选的,所述打印喷头内均匀设置有五条打印通道,每条所述打印通道内均设置有墨囊,五个所述墨囊内分别采用5ml注射器灌注有不同的打印墨水。
[0011]
可选的,所述驱动电源采用并联电路,所述并联电路采用控制信号驱动两个高压开关,将高压信号切成方波,实现对驱动电压大小的调节转换;并联电路中并联设置有多个开关,每个开关分别通过导线连接有一个所述打印通道。
[0012]
本实用新型还提供一种3d打印方法,包括对细胞进行打印和培养的方法,步骤如下:
[0013]
步骤一;打开计算机的控制软件,输入控制参数,在控制器中输入打印图案模型的坐标;
[0014]
步骤二;清洗打印通道;将细胞打印悬浮液注入墨囊,封闭墨囊入口,电压驱动喷墨打印头将细胞打印悬浮液喷涂于玻璃基底;细胞打印悬浮液包括 dmem完全培养基、质量百分含量为0.2%~1.2%的海藻酸钠水溶液和待打印细胞;所述dmem完全培养基和质量百分含量为0.2%~1.2%的海藻酸钠水溶液的体积比为1:1;细胞打印悬浮液中待打印细胞的浓度为1
×
106~9
×
106个/ml;在喷涂有细胞打印悬浮液的玻璃基底上覆盖聚二甲基硅氧烷通道,利用微量注射泵从进样孔依次通入0.2~0.3m的cacl2水溶液和dmem完全培养基,于 35~40℃、15%~25%的co2的条件下培养;
[0015]
步骤三;开始打印,控制器驱动三轴机械臂移动,从而带动打印喷头按预定图案坐标移动;驱动电源施加脉冲波形,脉冲电压上升和持续过程中,压电陶瓷片产生形变,利用压电陶瓷片的伸缩形变使墨囊中的打印墨水液滴从喷嘴喷射出去,进行打印;通过控制软件控制并切换打印通道电压的断连,设置打印时的工作电压为50~500v,打印间距为100~300μm,打印滴数为1~9滴;直至打印完成。得到的单个凝胶中细胞数目≤5,有利于进行单细胞分析。
[0016]
可选的,将玻璃和三氯硅烷混合,抽真空至-0.8mpa,在-0.8mpa条件下保持真空状态0.8~1.2h,得到玻璃基底;所述聚二甲基硅氧烷通道的高度为20~100 μm,宽度为0.6~1.2mm。
[0017]
本实用新型相对于现有技术取得了以下技术效果:
[0018]
本实用新型将液滴打印于接收平台上,从而实现液滴的精确控制和准确定位。根据各个元件的配合,能够高效地进行图案化打印操作,有效解决了打印装置结构复杂、打印模式单一等问题。此外,喷墨打印技术的液滴产生速率快,适于液滴的大规模生产,也满足了样品分析更高效、高灵敏、更快速的需求,在各领域中均有巨大的潜在优势。应用范围广泛,既可以用于打印材料或单液滴的研究,也能够用于组织工程中组织、器官的构建。
[0019]
本实用新型以海藻酸钠、dmem完全培养基与细胞的混合溶液为打印介质,将细胞分离、固定在培养装置上,并使细胞在培养装置中持续分裂生长。通过调整打印电压、滴数等参数,不仅能用于单细胞的分离研究,而且能实现单个凝胶中不同细胞个数的控制。本实用新型的方法具有操作简单、成本较、低、重复性高、分离效果好、所用材料生物兼容性好,且培养装置易于制备和操作。本实用新型的装置和方法能够实现细胞的长期培养,对于单
细胞和多个细胞的观察和研究具有重要意义。
附图说明
[0020]
为了更清楚地说明本实用新型实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本实用新型的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0021]
图1为本实用新型3d打印装置结构示意图;
[0022]
图2为本实用新型3d打印装置的墨囊工作状态示意图;
[0023]
图3为本实用新型3d打印装置的三轴机械臂结构示意图;
[0024]
附图标记说明:1.计算机;11.控制软件;2.驱动电源;21.连接端口;3.三维移动平台;31.控制器;32.三轴机械臂;4.打印喷头;41.墨囊;5.接收平台;6. 压电陶瓷片;7.隔膜;8.打印墨水;9.喷嘴;10.墨水颗粒;321.控制端;322.链轮结构;323.机械臂;324.机械手。
具体实施方式
[0025]
下面将结合本实用新型实施例中的附图,对本实用新型实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本实用新型一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本实用新型保护的范围。
[0026]
本实用新型的目的是提供一种3d打印装置,以解决上述现有技术存在的问题,使打印模式多样化,提高了打印效率。
[0027]
为使本实用新型的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本实用新型作进一步详细的说明。
[0028]
本实用新型提供了一种3d打印装置,如图1-图3所示,包括计算机1、驱动电源2、三维移动平台3、打印喷头4、接收平台5。计算机1与驱动电源2 之间通过无线连接,计算机1中安装有自主研发的控制软件11,该控制软件11 能控制切换打印通道电压的断连、设置打印时的工作电压和打印滴数。驱动电源2的连接端口21与打印喷头3通过导线连接,能直接控制打印喷头3的各个打印通道的断开与连接,为打印喷头3提供合适的工作电压。打印喷头3内含有5条独立的打印通道,相应的每条打印通道内均设置有一个墨囊41,每个墨囊41中可以用5ml注射器分别灌注不同的打印墨水8材料,随后排出墨囊41 中的气体,用封口机封装,该操作步骤能够实现多种材料的单独和同时打印。三维移动平台3包括控制器31和三轴机械臂32,其中,三轴机械臂32中,x 轴、y轴和z轴方向上的移动通过链轮结构322控制实现;x轴是机械臂323 的前进、后退轴。y轴为机械臂323的横入、横出轴。z轴是机械臂323的上升、下降轴。打印喷头4被固定于机械臂323的机械手324上,通过在控制器31中预先输入打印图案模型的坐标,达到对喷头运动轨迹的控制,进而实现液滴在接收平台5上的图案化过程。接收平台5的选择需要根据实际情况确定,包括但不限于以下材料,如玻璃/硅片/金属面板等。
[0029]
本实用新型打印装置使用时,打印过程中的电压与单次喷墨滴数是由计算机1中
的控制软件11控制。在三维移动平台3的控制器31中设置打印模型的x 轴、y轴、z轴坐标,即可实现细胞的图案化打印。
[0030]
本实用新型是基于压电式喷墨打印方法沉积细胞来实现细胞的图案化,该压电式喷墨打印的原理是:利用压电陶瓷片6的伸缩形变行为使墨囊41中的打印墨水8液滴从喷嘴9喷射出去,形成墨水颗粒10,压电陶瓷片6外侧设置有绝缘的隔膜7;具体过程如下:气压控制器产生的负压将喷射油墨平衡于喷嘴9 位置;驱动电源2施加脉冲波形,脉冲电压上升和持续过程中,压电陶瓷片6 产生微弱的形变,形变造成压电陶瓷片6接触附近墨囊41的玻璃毛细管壁,并形成一种“声波”,使得喷嘴9处的溶液被挤压而喷射出去;当电压下降时,压电陶瓷片6因形变减缓而放松,墨囊41的玻璃毛细管膨胀,喷嘴9处的墨水凹陷而“剪断”挤出的溶液,在墨水表面张力作用下,挤出的溶液将会逐渐聚集形成单一墨水颗粒10液滴,从而实现满足一定规律的喷射打印,该压电式喷墨打印装置的应用范围广、打印速度快。
[0031]
三轴机械臂32的运动形式为直角坐标型,臂部由三个相互正交的移动副组成。其中,x轴、z轴通过控制端321连接为一体,控制端321的另一端通过机械手324与打印喷头4固定在一起,三轴在电机驱动下由链轮结构322的链轮传动带控制做直线运动。通过在三维移动平台3的控制器31中准确输入x/z轴的坐标,可控制打印喷头的上下左右移动,而y轴则是控制着打印平台的前后移动,通过三轴的配合,达到对打印轨迹的控制和墨水的图案化。该部分结构简单,运动位置的精度高。
[0032]
驱动电源2的并联电路主要由控制信号驱动两个高压开关,然后将高压信号切成方波,实现对驱动电压大小的调节转换。另外,该并联电路中的5个开关分别与打印喷头尾部的5根导线相连,每根导线连接有一个打印通道,因此能实现每个打印通道独立或协同工作。
[0033]
本实用新型利用压电式喷墨打印技术将液滴打印于接收平台5上,从而实现液滴的精确控制和准确定位的装置。该方法操作简单、打印精度高、重复性好,且打印过程对样品污染概率小,有效解决了打印装置结构复杂、打印模式单一等问题。
[0034]
本实用新型基于上述方案所述装置提供了一种对细胞进行打印和培养的方法,包括以下步骤:
[0035]
清洗打印通道;将细胞打印悬浮液注入墨囊,封闭墨囊入口,电压驱动喷墨打印头将细胞打印悬浮液喷涂于玻璃基底;细胞打印悬浮液包括dmem完全培养基、质量百分含量为0.2%~1.2%的海藻酸钠水溶液和待打印细胞;所述dmem完全培养基和质量百分含量为0.2%~1.2%的海藻酸钠水溶液的体积比为 1:1;细胞打印悬浮液中待打印细胞的浓度为1
×
106~9
×
106个/ml。
[0036]
打印的电压为50~500v,打印间距为100~300μm,打印滴数为1~9滴;在喷涂有细胞打印悬浮液的玻璃基底上覆盖聚二甲基硅氧烷通道,利用微量注射泵从进样孔依次通入0.2~0.3m的cacl2水溶液和dmem完全培养基,于 35~40℃、15%~25%的co2的条件下培养。
[0037]
本实用新型首先清洗打印通道;在开始打印操作前,本实用新型在墨囊腔中依次加入去离子水、乙醇和pbs缓冲液,冲洗打印通道和去除气泡,防止打印时发生堵塞;加入的方式优选的采用注射器注入;pbs缓冲液优选为1
×
pbs 缓冲液;pbs缓冲液的ph值优选为7.4;pbs缓冲液的作用是冲洗除去打印通道中残留的乙醇。
[0038]
清洗打印通道,本实用新型将细胞打印悬浮液注入墨囊41,封闭墨囊41入口,电压驱动喷墨打印头将细胞打印悬浮液喷涂于玻璃基底;细胞打印悬浮液包括dmem完全培养基、质量百分含量为0.2%~1.2%的海藻酸钠水溶液和待打印细胞;dmem完全培养基和质量百分含量为0.2%~1.2%的海藻酸钠水溶液的体积比为1:1;所述细胞打印悬浮液中待打印细胞的浓度为1
×
106~9
×
106个 /ml;海藻酸钠水溶液的质量百分含量优选为0.6%~1%,更优选为0.8%;打印的电压为50~500v,优选为100~400v,更优选为200~300v,打印间距为100~300 μm,优选为200μm,打印滴数为1~9滴,优选为2~6滴,更优选为3~5滴。
[0039]
在本实用新型中,介质中添加有海藻酸钠水凝胶,由于凝胶颗粒中存在一定大小的孔径,所以允许细胞培养所需的营养物质通过,为细胞提供丰富的营养物和良好的生理环境。
[0040]
在本实用新型中,由于本实用新型中细胞的分离原理是基于压电喷墨打印,所以打印电压不同,海藻酸钠凝胶的直径大小不同。此外,打印的滴数不仅直接决定了单个海藻酸钠水凝胶的直径和体积,而且对细胞培养的环境和细胞的占有率也有很大影响。由于单个hela细胞的直径为10~20μm,单个凝胶颗粒直径过大,可能包含有多个细胞而不利于单细胞分离。因此需要考察不同电压下凝胶直径的大小,以便为后续实验的打印参数设定提供依据。
[0041]
在本实用新型中,待打印细胞优选的采用以下方法培养得到:待培养的细胞覆盖率达到80%以上后,使用胰蛋白酶水溶液将细胞从培养皿中酶解下来,用培养基清洗后离心收集,得到待打印细胞。
[0042]
在本实用新型中,玻璃基底的制备优选的包括:将玻璃和三氯硅烷混合,抽真空至-0.8mpa,在-0.8mpa条件下保持真空状态0.8~1.2h,优选为1h,得到玻璃基底。
[0043]
本实用新型在将玻璃和三氯硅烷混合前,优选的包括将玻璃依次用去离子水、酒精进行清洗,干燥处理;干燥的方式优选为用氮气吹干;玻璃和三氯硅烷混合的装置优选为玻璃干燥器;在-0.8mpa条件下保持真空状态0.8~1.2h的作用是除去表面的si-oh基团,降低其氢键结合能力使玻璃表面疏水,以确保海藻酸钠凝胶在玻璃基底上附着时形态立体,方便后续的单细胞研究。同时,在
ꢀ-
0.8mpa条件下保持真空状态0.8~1.2h能够使打印出来的海藻酸钠液滴的分辨率高,不容易发生位移,形成的凝胶液滴比较规整。
[0044]
本实用新型在喷涂有细胞打印悬浮液的玻璃基底上覆盖聚二甲基硅氧烷通道,利用微量注射泵从进样孔依次通入0.2~0.3m的cacl2水溶液和dmem完全培养基,于35~40℃、15%~25%的co2的条件下培养;聚二甲基硅氧烷通道的高度优选为20~100μm,更优选为35~50μm,宽度为0.6~1.2mm,优选为 0.8~1mm。
[0045]
本实用新型通过打印滴数等参数的调整,能控制打印的单个凝胶中细胞的个数。打印后的单细胞在培养装置中依然保持良好的细胞活力并持续生长。上述装置和细胞分离方法实现了单细胞的长期培养。海藻酸钠凝胶细胞培养腔室中,细胞被海藻酸钠凝胶包裹,也很好地模拟了细胞在体内被细胞外基质包裹的三维环境。
[0046]
本实用新型还提供了一种利用所述微流控芯片装置和发光探针测定细胞损伤修复的方法。本实用新型用发光探针检测细胞生殖率、细胞的凋亡和细胞内活性氧物质(ros)的变化;所述的发光探针是可分别特异性地识别细胞生殖、细胞凋亡细胞内活性氧物质的探针。其中活性氧的含量变化能够间接的说明细胞损伤和修复。细胞增殖、凋亡和细胞内活
性氧物质含量变化是检测细胞活性和药物毒性常用的几个指标,细胞内活性氧物质的减少表明细胞损伤的修复或者药物毒性的减少。
[0047]
细胞培养一段时间内细胞指标的检测,将乙二胺四乙酸二钠(edta-2na) 溶液通入通道中溶解海藻酸钠凝胶,将溶液收集并离心后获得细胞,对细胞进行染色,孵育一段时间后,利用酶标仪检测或者在荧光显微镜下成像、拍照,即可分析。
[0048]
本实用新型采用的喷墨打印头是通过电压驱动细胞液滴喷射在玻璃基底上。盖上pdms层后,在pdms的进样孔用微量注射泵依次缓慢注入0.2m的 cacl2溶液和细胞高糖培养基dmem以实现细胞的连续长时间培养。
[0049]
细胞培养装置包括两部分,即玻璃(或硅片)基底和pdms层。首先,利用化学方法处理得到疏水性适当的玻璃基底,主要步骤为:将未处理过的玻璃片用去离子水和乙醇清洗干净,随后用氮气吹干,置于玻璃干燥器中,加入20 μl的三氯硅烷,密封抽真空至约-0.8mpa,维持真空状态不同时间。比较了以上几种处理时间对凝胶的铺展和附着情况以及打印分辨率的影响。打印出来的海藻酸钠液滴的分辨率高,不容易发生位移,形成的凝胶液滴比较规整。
[0050]
由于本实用新型中细胞的分离原理是基于压电喷墨打印,所以打印电压不同,海藻酸钠凝胶的直径大小不同。此外,打印的滴数不仅直接决定了单个海藻酸钠水凝胶的直径和体积,而且对细胞培养的环境和细胞的占有率也有很大影响。由于单个hela细胞的直径为10~20μm,单个凝胶颗粒直径过大,可能包含有多个细胞而不利于单细胞分离。因此需要考察不同电压下凝胶直径的大小,以便为后续实验的打印参数设定提供依据。打印电压在50~500v,滴数在 10滴以下时,打印的单个凝胶的直径总体来说比较稳定,在300μm以内。
[0051]
将细胞培养瓶中长满的细胞用胰酶消解,加入新鲜培养液dmem,用移液枪吹打贴壁细胞,将细胞悬液在1000r/min条件下离心3min,弃上清液,用2 μm的calcein-am染色10min。最后将细胞用混合培养基质重新悬浮至浓度为106个/ml。混合培养基质由海藻酸钠溶液和细胞高糖培养基dmem等体积混合而成,海藻酸钠终浓度为0.4%。每次打印结束后将玻璃片置于荧光显微镜下观察、拍照,统计细胞占有率。
[0052]
hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,对细胞的毒性较低,一般常用于细胞凋亡检测。我们通过对细胞进行提前染色,用荧光显微镜观察打印后细胞的凋亡情况。结果表明,打印的细胞有蓝色荧光出现,表明细胞可能在打印过程中受损伤,有凋亡趋势。培养一段时间后,蓝色荧光发光值下降,说明细胞损伤得到一定程度的修复。
[0053]
分别培养6h、18h、24h时用cck-8细胞凋亡检测试剂盒对细胞增殖率进行检测,用酶标仪测量结果并分析。可以看出,细胞刚打印出来6h内,细胞有着良好的增殖活性。18h后细胞增殖率减小,而在24h时,细胞增殖率有很大地提高,说明在这过程中细胞活性逐步恢复,而且细胞对于环境的适应性提高,凋亡数减少,细胞的增殖率有所上升。
[0054]
刚打印出来的细胞活性氧荧光较强,说明此时细胞内的活性氧水平较高。分析其原因可能是打印过程给细胞带来一定的损伤,由于细胞内高浓度的活性氧导致了细胞的凋亡。这也与上述hoechst 33342染色结果一致。在经过12h培养后活性氧荧光大大减弱,说明经过培养后,由于细胞打印带来的损伤得到了修复,细胞恢复活性,因而细胞活性氧水平大大降低;24h后,活性氧检测荧光强度略有下降,说明细胞内的活性氧水平开始趋于稳定,即
细胞与周围环境相适应。我们分析此过程中的细胞损伤和修复研究表明,所述的方法可以用于膜电位变化引起细胞损伤的研究。电压的施加引起了细胞内线粒体外膜电位的改变,从而激活线粒体外膜上的电压依赖性阴离子通道,在膜上形成亲水性通道。打破了胞内代谢平衡和钙稳态,生成ros合成的前体物超氧阴离子(o2-),使细胞内ros含量急剧升高,促进了ca2+内流,从而上调了bax的表达、mptp的开放和caspase的激活,导致细胞凋亡。从而使细胞有凋亡趋势。而在后续的培养过程中,细胞启动自我修复机制,在良好的生长环境下逐渐恢复了胞内稳态,此时胞内ros含量下降,细胞逐渐恢复活性。
[0055]
本实用新型中应用了具体个例对本实用新型的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本实用新型的方法及其核心思想;同时,对于本领域的一般技术人员,依据本实用新型的思想,在具体实施方式及应用范围上均会有改变之处。综上所述,本说明书内容不应理解为对本实用新型的限制。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



