肿瘤特异靶向性基质的重组人血清白蛋白-胶原结合域融合蛋白和应用的制作方法
 2021-02-02 21:02:53|
2021-02-02 21:02:53| 752|
752| 起点商标网
起点商标网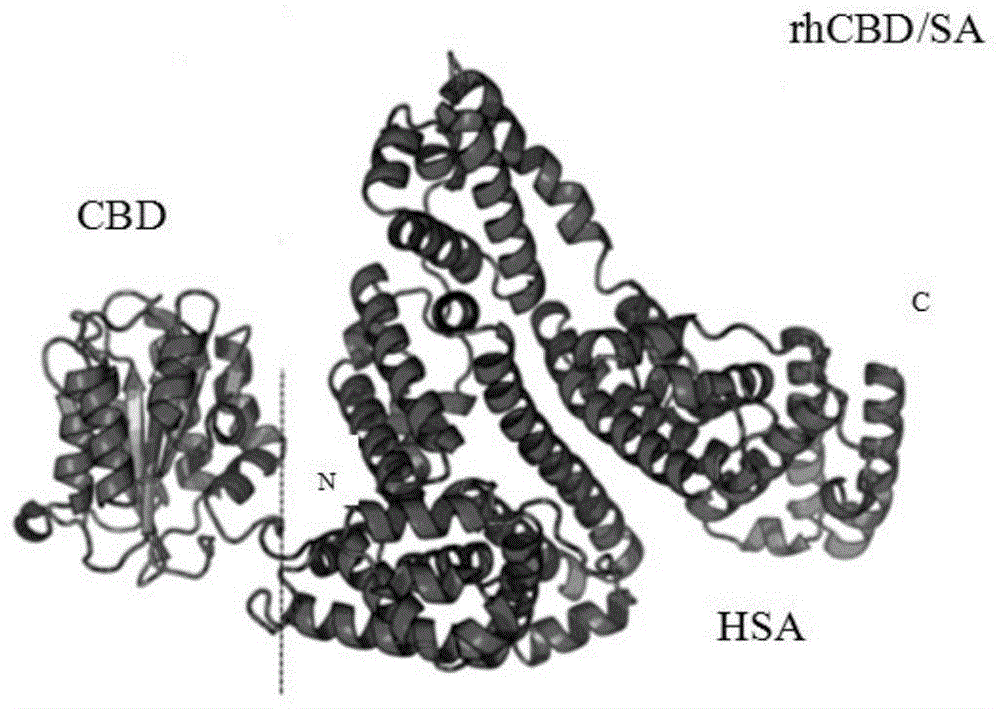
本发明属于生物医药技术领域,具体涉及肿瘤特异靶向性基质的重组人血清白蛋白-胶原结合域融合蛋白和应用。
背景技术:
人血清白蛋白(hsa)是一种可溶性单体蛋白质,构成血液中蛋白总量的一半。白蛋白是血液中的主要成分,在人体内含量为每升血液含40克,其半衰期寿命为14~20天。白蛋白作为一种基本载体,携带传递脂肪酸、类固醇和激素分子等,其稳定的惰性性质是维持血压的一个重要因素。血清白蛋白是一种球状非糖基化的、分子量为65千道尔顿、具有585个氨基酸的血清蛋白质。这一蛋白(白蛋白前体)再通过高尔基体的转化加工,去除引导多肽,而分泌到细胞外。血清白蛋白有35个半胱氨酸,在血液中,白蛋白是一个有17个二硫键的单体。当没有分泌多肽时,在酵母细胞内的白蛋白产物是错配状态,将失去90%的抗原性(与血浆中自然状态白蛋白相比),并且形成不溶性的白蛋白聚合体,不具有白蛋白的生物活性。现在用于临床的白蛋白均是从人血浆中提取的。利用微生物重组表达白蛋白(rhsa)的方法已在于在林、富岩中国授权专利zl2004010057313.7中公开。
在药物制剂组成中,白蛋白也常被用作药物的稳定剂,尤其是生物药和疫苗的制造。综上所述,利用基因工程技术,将人血清白蛋白与治疗性蛋白质基因融合在酵母菌或脊椎动物细胞中表达为重组融合蛋白后,该重组融合蛋白将具有极大的优势使之可抵御生物体内酶解作用,并可使治疗性蛋白质在体内体外的寿命大大提高,也就是可增加治疗性蛋白质在血清中和储存时的稳定性和较长的半衰期,达到蛋白药物的长效化,大大减少给药频率,在重大疾病临床治疗中获得更好的治疗效果。
人血清白蛋白还具有可非特异性地在实体肿瘤上聚集的功能。这是因为实体肿瘤为快速增生,肿瘤体就会大量增生微血管,来提供大量血液供应,白蛋白就造成在局部微血管中的聚集。利用白蛋白的这一特异功能,科学家研发出注射用紫杉醇(白蛋白结合型),商品名:
胶原结合域(collagenbindingdomain,cbd)是人血管a型血友病因子vonwillebrandfactor(vwf)的一部分。vwf介导血小板向血管纤维胶原蛋白的粘附,在止血过程中起到了非常重要的作用。成熟的vwf蛋白含有2050个氨基酸,具有多个结构域,其中介导血小板凝结的是a3结构域,也是与纤维胶原结合的关键蛋白。
vwf-a3结构域(也称为胶原结合域,cbd)是指成熟肽的920-1111之间的肽段,分子量20kda。《huizingaeg,martijnvdpr,kroonj,etal.crystalstructureofthea3domainofhumanvonwillebrandfactor:implicationsforcollagenbinding.[j].structure,1997,5(9):1147.》,《brondijkthc,bihand,farndalerw,etal.implicationsforcollagenichainregistryfromthestructureofthecollagenvonwillebrandfactora3domaincomplex.[j].proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2012,109(14):5253-8.》文章中详细讲述了vwfa3结构域与iii型同源三聚体多肽胶原蛋白结合形成的晶体结构,进一步推断vwfa3结构域与i型异源三聚体的结合位点。iii型同源三聚体胶原蛋白与vwfa3结构域结合位点和骨黏连蛋白及discodin结构域受体2部分重合。
实体肿瘤为快速增生,肿瘤体就会大量增生微血管,需要大量血液供应,白蛋白就会在肿瘤体局部微血管中的聚集。这些微血管内壁有特异增生的纤维胶原体,也导致大大增强血管胶原可与vwf的胶原结合域紧密结合的机会。sasaki等2019年8月[sasakietal.,sci.adv.2019;5:1-12]曾发表利用小鼠血清白蛋白与胶原结合域融合,胶原结合域(cbd)通过连接肽与小鼠血清白蛋白的n端融合,并在融合蛋白的鼠血清白蛋白c末端添加了his-tag(6-his),然后在脊椎动物细胞(hek293f)中表达这种融合蛋白。但是该融合蛋白中的血清白蛋白非人源,cbd的c末端与鼠白蛋白的n端连接之间还设有1个连接肽,且在融合蛋白中还含有6his-标签,同时,文献中公开的融合蛋白制备是使用hek293细胞,该表达细胞体系是非产业化用的细胞体系,且产量每l仅在μg-mg级间,如此获得的重组融合蛋白难于满足符合药用级/公斤(kg)级生产要求,且在生产成本上具相当显著的劣势。
化疗药物作为小分子药物和毒性蛋白都是抑制肿瘤细胞生长和肿瘤瘤体萎缩的关键性临床治疗用药物。临床上熟悉的小分子化疗药物主要有铂类、亚硝脲类、抗叶酸类、抗嘧啶类、长春碱类、紫衫类、喜树碱类、蒽环类以及破坏dna结构和功能的药物、嵌入dna中干扰转录dna的药物或影响蛋白质合成的药物等。临床上肿瘤细胞毒性蛋白优选包括有:蓖麻毒素、白喉毒素,天花粉蛋白凋亡素(apotin),又称vp3蛋白、铜绿假单胞菌外毒素、凋亡抑制家族蛋白(survivin)、人表皮生长因子(egf)、促性腺激素释放激素(gonadotrophinreleasinghormone,gnrh)以及脱氧核糖核苷酸酶ii(dnaseii)等,都没有药物靶向性,临床需要的剂量非常高,具有非常显著的因非靶向性造成的全身性毒副反应,如果由实体肿瘤特异靶向性基质载体来携带上述小分子药物,则在临床毒性小分子药物使用剂量可大大降低,全身性化疗药物带来的毒副反应也会显著大大下降,研发全新的肿瘤治疗特异靶向性药物是现今最受关注的肿瘤治疗研究方向。
蛋白质与小分子化合物化学偶联制备药物复合物的方法,是可用于本发明涉及到的重组融合蛋白与小分子化合物偶联目的,主要有直接偶联法。以白蛋白-紫杉醇结合(偶联)方法为例,将白蛋白储备液在室温条件下静置1h,取4ml的白蛋白储备液至离心管中,加入n1:n2=9:1(n1为紫杉醇物质的量,n2为白蛋白物质的量)的紫杉醇储备液于离心管中,静置过夜,静置过夜后在3000rpm条件下离心20min。取上清液,经0.22μm滤膜过滤。上清液中还有紫杉醇-白蛋白复合物。如果制备复合物的纳米颗粒,可采用龚光明等报道的方法(nanotechnology,22:295-603,2011;生物技术世界,2015,文章编号:1674-2060(2015)08-0164-01)来直接制备白蛋白药物化合物纳米颗粒,并与小分子化合物偶联。例如取100mg白蛋白,溶于10ml水后,37℃水浴,然后加入3-巯基-2-丁酮(终浓度为10μm),10min后,加入30mg紫杉醇继续搅拌10min。反应溶液经0.22μm膜透析,去除未发生偶联的紫杉醇,即可成为白蛋白-小分子化合物药物的纳米颗粒剂型。
关于重组融合蛋白偶联复合物在动物体肿瘤部位的检测方法,一般可采用常规的蛋白质标记法就可达到示踪偶联后的特异靶向实体瘤治疗用药物在体内的分布和检测。例如:
1)放射性125i标记重组融合蛋白偶联复合物,委托具资质单位采用氯铵t标记方法进行125i标记。对标记后的供试品进行纯化,经seec-hplc验证纯度,开展重组融合蛋白偶联复合物开展动物体内分布的测定。
2)pet-cd法,采用89zr放射性标记蛋白的方法,可直接用于重组融合蛋白与肿瘤治疗用药物(小分子药物或毒性蛋白)形成的重组融合蛋白偶联复合物进行放射性示踪标记。去铁胺(dfo)是最常见的89zr4+标记螯合剂。dfo是一种六配基铁螯合剂,可与金属生成稳定的络合物。采用na2co3或hepes缓冲液将草酸锆[89zr]溶液的ph调整到7,加入含dfo的cbd-hsa重组融合蛋白偶联复合物,室温下反应30~60min,最后经分子排阻填料或sec-hplc分离去除未发生标记的草酸锆[89zr],而获得纯化产物。该方法可获得标记得率为35~98%。
这些公知技术作为本发明实用支持性参考文献,均可用于本发明所获得的重组融合蛋白偶联小分子化合物制备药物复合物,并进一步制备成可用于临床上治疗用药物剂型。
技术实现要素:
有鉴于此,本发明的目的在于提供肿瘤特异靶向性基质载体的重组人血清白蛋白-胶原结合域融合蛋白和应用,所述重组融合蛋白当与任何肿瘤药物偶联时,都可形成一种崭新的生物创新靶向性药物复合物,该复合物具实体肿瘤特异靶向性,可使瘤体快速萎缩并杀死肿瘤细胞,达到靶向性临床治疗效果。本发明提供了使用毕赤酵母菌来生产所发明的融合蛋白,在表达水平具克(g)级,制备工艺具意想不到的生产成本优势。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种重组融合蛋白,所述重组融合蛋白为在人血清白蛋白(humanserumalbumin,hsa)的n端或c端连接人胶原结合域(collgenbindingdomain,cbd)。
优选的,所述重组融合蛋白为在所述人血清白蛋白的n端直接连接人胶原结合域,所形成的的重组融合蛋白的氨基酸序列如seqidno.1所示,编码所述重组融合蛋白的核苷酸序列如seqidno.2所示。
优选的,所述重组融合蛋白为在所述人血清白蛋白的c端通过连接肽(gggs)2与人胶原结合域连接,所形成的重组融合蛋白的氨基酸序列如seqidno.3所示,编码所述重组融合蛋白的核苷酸序列如seqidno.4所示。
优选的,所述重组融合蛋白为在人血清白蛋白的c端或n端通过连接肽(gggs)2~5与人胶原结合域连接。
优选的,所述人血清白蛋白的氨基酸序列还包括天然序列或发生氨基酸替换、变异后的序列或人血清白蛋白的片段。
本发明还提供了一种表达上述重组融合蛋白的重组工程宿主,所述重组工程宿主包括酵母菌、cho细胞、细菌、植物细胞、昆虫细胞或动物细胞;
优选的是酵母菌;更优选的是毕赤酵母菌。
本发明还提供了上述重组工程宿主的构建方法,包括以下步骤:将所述重组融合蛋白的编码基因通过基因表达载体表达、病毒载体表达或转基因方法转移至宿主中,所述宿主包括酵母菌、cho细胞、细菌、植物细胞、昆虫细胞或动物细胞;优选的是酵母菌;更优选的是毕赤酵母菌。
本发明还提供了一种基于上述重组融合蛋白的药物复合物,所述药物复合物以所述重组融合蛋白为基质,偶联化疗药物或肿瘤细胞毒性蛋白。
本发明还提供了上述药物复合物在制备特异性靶向治疗实体肿瘤的药物中的应用。
本发明还提供了一种特异性靶向治疗实体肿瘤的药物,所述药物的有效成分为上述药物复合物。
本发明还提供了一种实体肿瘤特异性靶向治疗的药物,所述药物的有效成分为上述药物复合物。
本发明提供了一种重组融合蛋白,所述重组融合蛋白为在人血清白蛋白c端或n端连接人胶原结合域。本发明所述重组融合蛋白可作为广谱性新实体肿瘤特异靶向药物基质,与任何肿瘤药物偶联,从而都可以形成一种崭新的生物创新靶向性药物复合物。采用该基质与肿瘤治疗药物,特别是小分子细胞毒性化合物、细胞毒性蛋白相偶联,还可解决单独应用小分子化合物(化疗药物)、细胞毒性蛋白需要的高剂量、高频次用药时所要面临的严重血液毒性,同时还可显著提高这些肿瘤药物在人体中的半衰期,并达到更好的肿瘤治疗效果。本发明同时公开了该长效广谱性肿瘤特异靶向药物基质的构建方法,由于该重组融合蛋白是分泌型的,其可与特异识别抗人血清白蛋白抗体相结合,也可与特异识别人胶原结合域的抗体相结合。本发明实施例中利用酵母菌来表达所述重组融合蛋白,尤其是建立了毕赤酵母工程菌的吨级规模化发酵工艺和重组融合蛋白分离纯化的方法,该蛋白在毕赤酵母菌在1000l发酵罐中的表达量不低于1g/l,纯化后的纯度可达99%,并且内毒素含量≤0.5eu/mg。本发明使用毕赤酵母菌表达系统制备长效广谱性肿瘤治疗靶向性基质的重组融合蛋白,经由这一系统制备的重组蛋白药物完全适合于临床应用,本发明研发的创新药原液中的宿主蛋白残留量也符合2015版中国药典三部的要求。
附图说明
图1为利用raptorx分析确认当cbd处于hsa成熟肽的n端,且不设连接肽时,rhcbd/sa分子结构分析结果显示,可完全不影响cbd的独立性,即其与血管胶原结合的能力;
图2为利用raptorx分析确认当cbd处于hsa的c端时,如果不设连接肽,rhsa/cbd分子结构分析结果显示,则会有可能影响cbd的独立性,即可能会影响其与血管胶原结合的能力;
图3为筛选长效广谱性肿瘤治疗靶向性基质的重组融合蛋白之一的重组人血清白蛋白/胶原结合域融合蛋白(rhsa/cbd,代码:9676,分子量:88kd)毕赤酵母工程菌表达工程株的一次实验筛选结果;图中的代码:9075为重组人血清白蛋白/生长激素融合蛋白(rhsa/gh,分子量:88.6kd)作为阳性对照;
图4为筛选长效广谱性肿瘤治疗靶向性基质的重组融合蛋白之一的重组人胶原结合域/血清白蛋白融合蛋白(rhcbd/sa,代码:9961,分子量:88.1kd)毕赤酵母工程菌表达工程株的一次实验筛选结果;图中的944为全人源单克隆抗体轻链在酵母工程菌中的表达(代码:944,分子量:23.7kd)和代码:9075为重组人血清白蛋白/生长激素融合蛋白(rhsa/gh,分子量:88.6kd)作为阳性对照;
图5为长效广谱性肿瘤治疗靶向性基质的重组融合蛋白毕赤酵母工程菌在500l发酵罐发酵,在不同时间的上清液中目的蛋白(rhsa/cbd)表达的结果;
图6为长效广谱性肿瘤治疗靶向性基质的重组融合蛋白中的cbd处于hsa的c端之间设有连接肽(a、c)或cbd处于hsa的n端(b、d)获得的精纯原液,在还原(reducing,样品a和b)和非还原(non-reducing,样品c和d)条件下的sds-page蛋白电泳图;标准分子量处于中间泳带(从上到下:97kd、66kd、45kd、35kd、24kd、14kd);
图7为长效广谱性肿瘤治疗靶向性基质重组融合蛋白(rhsa/cbd)原液(cbd位于hsa的c末端,之间设有连接肽)的凝胶高效液相色谱(sec-hplc)测量纯度图;
图8为长效广谱性肿瘤治疗靶向性基质重组融合蛋白(rhcbd/sa;cbd位于hsa成熟肽n端之间不设连接肽)原液的凝胶高效液相色谱(sec-hplc)测量纯度图;
图9为重组融合蛋白与egf偶联后形成的rhsa/cbd-egf蛋白(分子量约95kd)与rhsa/cbd(分子量约88.2kd)、rhsa/egf(分子量约72.5kd)和rhegf(6.2kd)的sds-page电泳图谱。
图10为重组融合蛋白与egf偶联后形成的药物复合物(rhsa/cbd-egf)在大鼠体内的半衰期测定结果。
具体实施方式
本发明提供了一种重组融合蛋白,所述重组融合蛋白为在人血清白蛋白的n端或c端连接人胶原结合域。
本发明所述人血清白蛋白(hsa)与人胶原结合域(cbd)的连接方式有多种,即可通过连接肽(gggs)2-5连接,也可直接连接:在所述人血清白蛋白的n端直接连接人胶原结合域所形成的重组融合蛋白的氨基酸序列优选如seqidno.1所示,编码所述重组融合蛋白的核苷酸序列优选如seqidno.2所示;在所述人血清白蛋白的c端通过连接肽(gggs)2与人胶原结合域连接,所形成的重组融合蛋白的氨基酸序列优选如seqidno.3所示,编码所述重组融合蛋白的核苷酸序列优选如seqidno.4所示;在人血清白蛋白的c端或n端均可通过连接肽(gggs)2~5与人胶原结合域连接。
本发明优选采用raptorx预测基因融合后的结构和功能:当cbd处于hsa的n端时,rhcbd/sa分子结构显示可完全不影响cbd的独立性,即与血管胶原结合的能力(图1)。由此,cbd可与hsa成熟肽的n端直接连接,可不设连接肽。当cbd处于hsa的c末端时,计算机模拟测定则显示cbd的部分区域与hsa的部分区域直接相连可能会有交互(图2),可能会影响到胶原结合域与血管胶原结合的能力。为此,本发明在构建cbd处于hsa的c末端时的重组融合蛋白,则需在hsa与cbd之间设有一个连接肽(gggs)2,以保证形成和构建分子结构中的胶原结合域蛋白,不会影响与肿瘤体血管内壁上的胶原相结合的能力和功能。
本发明所述hsa的基因dna序列为发明人登记在genebank,登记号为ay728024所示,其成熟肽氨基酸序列为在genebank的登记号ay728024所示。在本发明中,所述人血清白蛋白的氨基酸序列优选包括天然序列或发生氨基酸替换、变异后的序列或人血清白蛋白的片段。
本发明还提供了一种表达上述重组融合蛋白的重组工程宿主,所述重组工程宿主包括酵母菌、cho细胞、细菌、植物细胞、昆虫细胞或动物细胞。本发明所述重组工程宿主优选为酵母菌,更优选为毕赤酵母。
本发明还提供了上述重组工程宿主的构建方法,包括以下步骤:将所述重组融合蛋白的基因通过质粒dna载体表达、病毒载体表达或转基因方法转移至宿主中,所述宿主包括酵母菌、cho细胞、细菌、植物、昆虫或动物细胞。本发明优选通过基因工程技术重组,并在工程宿主细胞中表达;本发明实施例中,优选利用载体质粒,通过转化和转染或感染宿主细胞的方式来表达重组融合蛋白,更优选选用酵母表达载体来转化毕赤酵母,并使重组融合蛋白分泌到培养液中。在本发明中,所述酵母表达载体的宿主优选为毕赤酵母属巴斯德菌种。
本发明还提供了一种大规模高密度表达生产两种结构的重组融合蛋白(rhsa/cbd、rhcbd/sa)的方法,具体包括:a.两种载体质粒的构建及表达;b.毕赤酵母表达工程菌的转化和制备;c.重组酵母工程菌的筛选;d.大规模高密度表达生产两种分子结构的重组融合蛋白(处于n端时rhcbd/sa;处于c端时rhsa/cbd)。
本发明所述载体质粒的构建及表达优选包括:以人肝中提取的总rna为模板,利用反转录多聚酶链聚合反应来合成、扩增hsa基因;经电泳分离纯化hsadna片断,将其克隆至酵母表达表达载体,获得pyz-hsa重组质粒;采用dna全序列合成法来人工合成cbd核苷酸序列;用酶切合成的人胶原结合域和pyz-hsa重组质粒,并将二者进行连接,获得pyz-hcbd/sa和rhsa/cbd重组质粒。
本发明所述毕赤酵母表达工程菌的转化和制备优选包括:将pyz-hcbd/sa和rhsa/cbd重组质粒分别经pmei限制性内切酶处理后点转入毕赤酵母x33感受态细胞,转化后的酵母菌接种于含zeocin抗生素的ypd平板培养基上进行培养。
本发明对上述培养后得到的重组酵母工程菌进行筛选,所述筛选优选包括:将数个含有待表达基因的酵母菌落分别在含有zeocin抗生素,具有缓冲能力及甘油的基本培养液中培养;培养一段时候后离心收集菌体,菌体再重悬于不含甘油的同种基本培养液内,含0.5%甲醇;每24小时加入100%甲醇至最终浓度为0.5%,在不同的时间点分别收集培养上清液,筛选表达特异蛋白的重组酵母工程菌株。
本发明所述大规模高密度表达生产两种分子结构的重组融合蛋白优选包括:使用500l和1000l生物发酵罐系统,取一支工程菌种子库(筛选出的表达特异蛋白的重组酵母工程菌株),小规模摇床培养开始,然后扩增到一级种子罐、二级种子罐,进入生产发酵罐;经培养至罐内甘油消耗尽,溶氧随之回至底限再回升时,启动甘油流加;待流加结束,溶氧再回升时,启动甲醇流加,进入诱导和重组蛋白生产阶段,维持72小时甲醇流加;产量不低于3克/l发酵上清液。
本发明在得到所述重组融合蛋白后,优选还包括纯化,更优选包括将酵母工程菌高密度发酵,直接分泌到发酵上清液中的可溶性、具完整分子结构的重组融合蛋白,依次通过如下3步富集、纯化生产工艺:capto-mmc美国ge公司的capto-mmc填料介质启动第一级纯化;疏水介质层析柱:phenyle、butyle或oyctosepharosetmhighperformance;精纯可使用阴离子、阳离子交换层析或capto-deae纯化分离层析。
本发明第一步柱层析收集使用美国ge公司的复合式新型弱阳离子交换层析capto-mmc层析,因为表达的上清成分复杂,且有一定浓度的盐的存在,capto-mmc层析可以承受较高的流速,高结合载量,并对发酵上清液中的盐浓度要求不高。capto-mmc层析可选用10~100mmnaac-hac缓冲液,ph的范围4.5~6.5,洗脱缓冲液可以使用10~100mm的磷酸缓冲液,含有0.1~0.5m的nh4cl或其他高盐溶液,ph的范围4.5~8.5,也可以使用各种浓度的有机溶剂。也可在缓冲液中加入一定量的氨基酸,例如甘氨酸或半胱氨酸来保持cbd重组融合蛋白的稳定性。
经过上述纯化后,可获得的重组融合蛋白纯度不低于95%,符合药用级别的原料药(原液)。洗脱中的目的蛋白纯度高,并且回收率可观。在本发明中,所述纯化的方法优选还包括常规纯化方法,包括层析法(sephacryls-200hr)或膜透析法浓缩,获得高浓度原液,用于符合临床用药制剂成品的生产。
本发明还提供了一种基于上述重组融合蛋白的药物复合物,所述药物复合物以所述重组融合蛋白为基质,偶联化疗药物或肿瘤细胞毒性蛋白。本发明所述重组融合蛋白可与任何肿瘤药物偶联,包括与小分子化合物(化疗药物)或细胞毒性蛋白相偶联,而形成一种崭新的生物创新靶向性药物复合物。本发明对所述小分子化合物的种类和来源并没有特殊限定,优选的可以是铂类、亚硝脲类、抗叶酸类、抗嘧啶类、长春碱类、紫衫类、喜树碱类、蒽环类以及破坏dna结构和功能的药物、嵌入dna中干扰转录dna的药物或影响蛋白质合成的药物等。上述所有用于治疗肿瘤的药物均可利用所述重组融合蛋白作为基质偶联,而形成全新的肿瘤治疗特异靶向性药物。
在本发明中,所述肿瘤细胞毒性蛋白优选的可以是包括:蓖麻毒素、白喉毒素,天花粉蛋白凋亡素(apotin),又称vp3蛋白、铜绿假单胞菌外毒素、凋亡抑制家族蛋白(survivin)、人表皮生长因子(egf)、促性腺激素释放激素(gonadotrophinreleasinghormone,gnrh)以及脱氧核糖核苷酸酶ii(dnaseii)等。上述所有毒性蛋白,均可利用所述重组融合蛋白作为基质偶联,而形成全新的肿瘤治疗特异靶向性药物。
本发明所述药物复合物(以人表皮生长因子(egf)偶联到rhsa/cbd上为例)在动物或人体中的药物代谢半衰期较胶原结合域蛋白或化疗药物或毒性蛋白原有的体内半衰期更长,具长效性;其半衰期要较肿瘤化疗药物或细胞毒性蛋白的体内半衰期至少提高10倍以上。利用所述药物复合物制备得到的治疗肿瘤适应症药物时,其应可达到每1周、2周或3周、或4周给药一次或是比单独使用这些化疗药物或细胞毒性蛋白时有更少的给药频次。
本发明所述药物复合物进入人体血液后借助白蛋白的非特异性靶向肿瘤聚集功能,并再利用与白蛋白融合的胶原结合域来与瘤体微血管内的胶原相结合,特异靶向性固着在瘤体丰富的微血管内壁,借助偶联在重组融合蛋白上的肿瘤治疗化学药物、或细胞毒性蛋白达到特异靶向高效杀死肿瘤细胞,导致瘤体快速萎缩,抑制瘤体生长的临床疗效。
本发明还提供了所述药物复合物在制备特异性靶向治疗实体肿瘤的药物中的应用。
本发明还提供了一种特异性靶向治疗实体肿瘤的药物,所述药物的有效成分为上述药物复合物。
下面结合实施例对本发明提供的重组融合蛋白及其构建重组工程宿主和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1人血清白蛋白(hsa)基因表达及载体质粒的构建
以人肝中提取的总rna为模板,利用反转录多聚酶链聚合反应来合成、扩增hsa基因。5μg总rna在反转录酶(购自gibco/brl公司)的作用下,合成相对应的dna链,寡聚核苷酸引物为18个t+ln(n为随机核苷酸)。反应条件为45℃,20min,而后升温至55℃,继续保温40min。
其寡聚核苷酸引物序列为:5'-gaattcatgaagtgggtaacctttatttcc-3'(seqidno.5)和5'-gaattcttataagcctaaggcagcttgacttgc-3'(seqidno.6)。
两个ecorⅰ识别位点分别加在hsa基因的两端克隆入一表达载体。pcr反应条件为94℃,4min,编码hsa的dna进一步扩增35个循环反应:94℃,30s;58℃,30s;72'c,2min30s。循环反应结束时,再给予72℃,10min的延长反应。凝胶电泳显示pcr扩增产物长约1850bp。pcr产物利用ta克隆的方法插入pcrii载体(invitrogen公司)。所得质粒命名为pcr-hsa。dna测序结果表明其与发表的人血清白蛋白dna序列(发明人保存在美国genebank,注册号:ay728024)相同。
用ecorⅰ限制性酶消化pcr产物,经电泳分离纯化hsadna片断,将其克隆至酵母表达载体(pyz载体,来自天津溥瀛生物技术有限公司)。经转化dh5a感受态细胞,在含有抗生素zeocin的低盐lb-琼脂平板上筛选阳性单克隆,其经检定对hsa基因插入的质粒命名为pyz-hsa(见图1,pyz-hsa重组质粒ecorⅰ&xhoⅰ酶切鉴定,目的条带大小约1850bp,与预期目的条带大小一致。测序确认正反向)。
实施例2长效广谱性肿瘤治疗靶向性基质重组融合蛋白基因(rhcbd/sa)的表达及载体质粒的构建
根据已知文献分析及vwf完整氨基酸序列(vonwillebrandfactor[homosapiens]genbank#aab59458.1vonwillebrandfactor[homosapiens]),其中人vwfa3domain是cys1670-gly1874(人vwf成熟肽氨基酸的907-1111肽段),即为胶原结合域(cbd),其分子量20kda。
按照seqidno.1所示的氨基酸序列合成rhcbd/sa成熟肽:cbd成熟肽与人血清白蛋白的n端是直接连接,之间不设连接肽。
为此,按rhcbd/sa成熟肽氨基酸序列,采用dna序列合成法来人工合成cbd成熟肽的核苷酸序列。人工合成时可分别在其n端加上xhoⅰ酶切位点,在其c端加上人血清白蛋白序列至alei酶切位点。可用这两个酶分别酶切合成的目的基因cbd和pyz-hsa中的hsa基因序列形成重组质粒。分泌肽则可使用酵母菌的α-factor分泌目的基因cbd与hsa基因连接的重组序列。具体步骤:将酶切后的目的基因cbd与hsa重组dna质粒按一定比例混合,并加入连接buffer和连接酶,22℃连接1h;连接产物转化dh5α感受态细胞,具体步骤:将连接产物加入dh5α感受态细胞,冰浴30min,42℃热激90s,再冰浴2min,加入培养基置于摇床中,150rpm,45min,12000rpm离心1min,涂板。测序验证,具体步骤:挑取单克隆,扩大培养,小量提取质粒,酶切鉴定,挑选出酶切得到与目的片段大小一致的质粒,并进行测序确认,测序引物为正向p1和反向p9。将最终全测序确认的质粒命名为pyz-rhcbd/sa。
p1:5'-ctggttccaattgacaagc-3’(位于启动子序列,seqidno.7);
p9:5'-gactcatcagcaacacatg-3’(位于人血清白蛋白序列,seqidno.8)。基于此,合成rhcbd/sa的核苷酸dna序列(seqidno.2)。
实施例3长效广谱性肿瘤治疗靶向性基质的重组融合蛋白基因(rhsa/cbd)表达及载体质粒的构建
将胶原结合域(cbd)的n端与人血清白蛋白的c末端连接,之间设有一个刚性连接肽(gggsgggs),以保证融合的人血清白蛋白c末端的cbd不发生与重组融合蛋白蛋白之间不设连接肽的图2状态。为此,人工合成如seqidno.3所示的新肿瘤特异靶向性药物基质分子结构。基因合成方法参照实施例2,最终,得到的rhsa/cbd的核苷酸dna序列如seqidno.4所示。
实施例4毕赤酵母表达工程菌的转化和制备
将毕赤酵母菌菌株x33接种于含5mlypd培养液的50ml离心管中,以250rpm的速度于30℃下培养过夜。次日取0.2ml过夜培养物再转接入500mlypd的培养液中,置于2l的三角培养瓶中。在30℃下旋转培养2~3h,使细胞密度达到od600=1.3~1.5。酵母菌经离心方法收集,再重悬于500ml冰预冷的无菌水中洗涤两次。然后酵母菌悬于20ml冰预冷的1msortbitol溶液洗涤一次。
将实施例2和3分别构建的pyz-rhcbd/sa质粒dna或pyz-hsa/cbd经pmei限制性内切酶处理后,形成线性质粒分子。取5μg线性化后质粒dna与80μl处理后的酵母菌相混合并置于0.2cm厚的电极杯内,置于电转仪上。电脉冲条件为电压7500v/cm,电极间隔时间为5~10(ms)。电击处理后,立即加入1ml冰预冷的1msorbitol溶液于酵母菌中,然后转入15ml试管中。转化的酵母菌置于30℃培养箱中放置2h,然后接种涂布在含zeocin抗生素的ypd平板培养基上。经抗性选择而生长出的克隆,再用分子生物学方法鉴定其基因的插入。蛋白质的表达与分泌则以sds-page或用特异抗体做蛋白质免疫印迹检测。
实施例5表达重组融合蛋白基因的pichiapastoris酵母工程菌的筛选
将数个含有待表达基因的酵母菌落分别在含有zeocin抗生素,具有缓冲能力及甘油的基本培养液中培养。以300rpm的速度培养至菌体密度达到od600nm=2~6。培养物经1500rpm,15min条件下离心收集菌体,菌体再重悬于同种基本培养液但不含甘油,改含0.5%甲醇,细胞密度达到od600nm=1.0,继续培养。酵母菌在甲醇的诱导下,外源蛋白在启动子的作用下开始表达。其后,每24h加入100%甲醇至最终浓度为0.5%。在不同的时间点分别收集培养上清液。使用sds-page变性聚丙烯酰胺凝胶电泳初步测定筛选结果见图3重组人血清白蛋白/胶原结合域重组融合蛋白(rhsa/cbd,代码:9676,分子量:88)或和图4重组人胶原结合域/血清白蛋白重组融合蛋白(rhcbd/sa,代码:9961,分子量:88.1kd)的表达,筛选表达目的特异蛋白质的重组酵母工程菌株。其中的筛选阳性对照分别使用重组人血清白蛋白/生长激素融合蛋白(rhsa/gh,代码:9075;分子量:88.5kd)和酵母工程菌表达的全人源单克隆抗体轻链(代码:944,分子量:23.7kd)
实施例6大规模高密度发酵表达和生产重组融合蛋白工艺
本发明使用500l或1000l(吨级)生物发酵罐系统分别开展了rhcbd/sa和rhsa/cbd成熟肽氨基酸序列的表达。重组酵母工程菌按研发的工艺程序制备工程菌种子库。取一支工程菌工作种子库种子管接种到三角瓶中,从小规模摇床培养开始,然后扩增到一级种子罐、二级种子罐,进入生产发酵罐(1吨体积)。经培养至罐内甘油消耗尽,溶氧随之回至底限再回升时,启动甘油流加。待流加结束,溶氧再回升时,启动甲醇流加,进入诱导和重组蛋白生产阶段,维持72h甲醇流加。可在不同培养时间点取样测试重组蛋白的表达。对于分泌型蛋白在细胞内及培养液中的含量均用sds-page方法进行分析,表达水平和纯度在每一步中均进行监测。结果显示发酵液中的重组融合蛋白蛋白的表达水平在3~10g/l。图5示例使用500l发酵罐开展的1个发酵批次:9676fj20191106-500l的结果。sds-page分为还原sds-page(reducing)和非还原sds-page(non-reducing)条件下的电泳。还原(r)和非还原(n)的sds-page区别是在样品处理时加或不加还原剂(如dtt或2-巯基乙醇等)。
实施例7酵母工程菌分泌的重组融合蛋白的分离纯化生产工艺
rhsa/cbd和rhcbd/sa重组融合蛋白均可经酵母工程菌发酵培养直接分泌到上清液。经连续流离心将含有分泌出的重组融合蛋白上清液与菌体分离后,柱层析纯化首先采用发明人获得发明专利授权的zl200810089645.1公开的重组人血清白蛋白重组融合蛋白纯化工艺。酵母工程菌发酵上清液(代码:9676fj20191106-500l)可直接按下列分离纯化程序分离纯化:
a.初纯亲和层析柱:capto-mmc;
平衡缓冲液:10mmnaac-hac,0.5mm半胱氨酸,2%甘氨酸,ph值5.0;
洗杂缓冲液:10mmpb,2mm半胱氨酸,2%甘氨酸,ph值6.0;
洗脱缓冲液:20mmpb,2mm半胱氨酸,2%甘氨酸,1.0mnh4cl,ph值7.5。
b.继续在甲基(butyl-),苯基(phenyl-)或辛基(octyl-)基团的疏水填料比较和筛选,并分别选用20~100mm的tris-hcl或磷酸缓冲液,ph值在5.0~9.0范围内,加入1~2m的nh4cl或1~2m的(nh4)2so4的缓冲液为平衡缓冲液,以不含nh4cl或(nh4)2so4的缓冲液为洗脱缓冲液,也可在缓冲液中加入一定量的甘氨酸或半胱氨酸保持蛋白质的稳定性。过程包括将capto-mmc层析柱的洗脱峰用ph值5.0~9.0,含有1~2m的nh4cl或1~2m的(nh4)2so4的20~100mm的tris-hcl或磷酸缓冲液稀释数倍,或在capto-mmc层析柱的洗脱峰中直接加入高浓度的nh4cl或(nh4)2so4溶液至浓度为1~2m的nh4cl或1~2m的(nh4)2so4,上样于疏水柱,然后以平衡缓冲液冲洗柱子,再以洗脱缓冲液进行洗脱,收集洗脱峰。通过疏水柱可进一步去除可能存在的多聚体、糖类、脂类、降解蛋白、色素等杂质,进一步提高目的蛋白的纯度。
经疏水层析纯化后的样品,也从生产工艺考量,从q或deae等阴离子交换柱进一步直接再纯化。通过与疏水层析不同的分离机制,离子交换层析可使目标蛋白得到进一步的纯化。可以选用ph范围在6.0~9.0之间的20~100mm的tris-hcl或磷酸缓冲液做为平衡缓冲液,也可在缓冲液中加入一定量的甘氨酸或半胱氨酸保持蛋白质的稳定性。可以在平衡缓冲液中加入浓度为200~1000mmnacl或nh4cl做为洗脱缓冲液。经过阴离子交换层析的样品通常可以达到95%以上的纯度。
c.离子纯化分离层析柱:capto-deaetmfastflow;
平衡缓冲液:20mmtris,3mm半胱氨酸,2%甘氨酸,ph值7.2;
洗杂缓冲液:20mmtris,180mmnacl,10mm半胱氨酸,5%甘氨酸,ph值7.2;
洗脱缓冲液:20mmtris,800mmnacl,10mm半胱氨酸,5%甘氨酸,ph值7.2;
经离子交换层析后收集的洗脱峰,可直接上样于sephacryl、superdex或sephadex等凝胶层析柱,进行脱盐换液。凝胶层析用5~50mm的磷酸缓冲液(pb)为平衡缓冲液,也可在缓冲液中加入一定量的甘氨酸或半胱氨酸保持蛋白质的稳定性。可将阴离子交换层析条件下得到的目的蛋白cbd-hsa的缓冲液体系改为5~10mm的磷酸缓冲液可以直接用于制剂的配制,而无须采用透析或超滤等其他手段,减少处理步骤中可能的污染、蛋白的变性、降解及聚集等损失。
或c.层析柱:sephacryls-200hr
平衡缓冲液:20mmpb,5%甘氨酸,ph值7.2。
整个纯化过程顺序合理,操作简便,易于工业放大生产,最终的产品单一组分可达99%(≥95%以上)。目的蛋白的聚合体、二聚体、目的蛋白的相关蛋白计算为目的蛋白则宿主蛋白残留量则小于0.05%。本发明形成的可大规模化用于生产制备重组融合蛋白分离纯化生产工艺,最终纯度达到99%以上的意想不到的高度纯化效果。图6为长效广谱性肿瘤治疗靶向性基质的重组融合蛋白cbd处于hsa的c端之间设有连接肽(a、c)或cbd处于hsa的n末端(b、d)获得的精纯原液,在还原(reducing,样品a和b)和非还原(non-reducing,样品c和d)条件下的sds-page蛋白电泳图;标准分子量处于中间泳带(从上到下:97kd、66kd、45kd、35kd、24kd、14kd)。
实施例8高效液相色谱法用于重组融合蛋白的纯度测定
使用岛津lc-10avpplus高效液相色谱仪,色谱柱:tosoh公司tsk-gelg2000swxl7.8×300mm柱。以50mmpb-0.1mnacl缓冲液,ph7.0为流动相,流速:0.8ml/min,检测波长:280nm。
经上述程序建立的优化分离纯化工艺,重组融合蛋白纯度经sec-hplc检测,结果表明rhsa/cbd样品的纯度约为99.62%(图7),rhcbd/sa样品的纯度约为99.04%(图8),目的蛋白相关蛋白含量(目的蛋白聚合体和目的蛋白降解物)则低于1%。
实施例9重组融合蛋白酵母菌宿主蛋白残留量检测
采用双抗体夹心酶联免疫法检测。重组融合蛋白的宿主蛋白残留量,不高于总蛋白的0.01%。检测试剂盒immunoenzymetricassaykitforthemeasurementofpichiapastorishostcellproteins(美国cygnus公司),货号:cat#f140,检测波长为450/650nm;标准品溶液制备:使用试剂盒内提供的标准品溶液。设置回收率测定孔(复孔)。测定方法则以试剂盒制造商提供的操作说明书为准。
结果表明:重组融合蛋白原液中的宿主蛋白残留量应不高于总蛋白的0.01%。经本发明生产制备工艺生产的高纯度可注射用重组融合蛋白产品,经检测结果表明宿主蛋白残留量已经在0.01%以下。即目的蛋白的纯度已经达到99.99%。
实施例10重组融合蛋白与小分子化合物偶联
重组融合蛋白用含2mmedta的10mmpbs稀释。4倍等分子摩尔的traut’s试剂(特劳特试剂abcam公司产品,cat#ab145615,主要成分为2-亚氨基硫烷盐酸盐,cas#:4781-83-3。thermo的traut’s试剂cat#26101;pierce公司也有traut’s试剂销售),溶解在相同的含2mmedta的pbs加入到蛋白质溶液中,置暗处室温下孵育1h。使用zebaspin脱盐柱(thermofisher公司)去除traut试剂。然后加入到去除traut试剂的蛋白溶液中,溶解在10mm磷酸钠缓冲液(ph5.9)的15个分子摩尔比的sigma-aldrich公司药用级阿霉素(多柔比星,aldoxorubicin),或5-氟尿嘧啶或其它小分子药物继续在暗处室温孵育1h。停止反应则需加入20mm的l-半胱氨酸[溶解在含2mmedta的pbs缓冲液中]。未发生反应未偶联的多柔比星(小分子化合物)可用离心法去除(10,000g,5min)。上清液则继续用zebaspin脱盐柱纯化,随后用amiconultra超滤(merck,10kda分子截留)。经浓缩的蛋白质产物经pierce的bca(bicinchoninicacidassay)蛋白含量测定方法定量,蛋白质测定试剂盒购自thermofisher,使用方法按试剂盒说明书方法操作。以495nm吸收值测定,10,650摩尔消光系数(l/mol/cm)的方法定量,对药物复合物中偶联在重组融合蛋白上的多柔比星含量进行测定,结果表明偶联后的药物复合物终产品中,多柔比星含量结合率约为重组融合蛋白分子摩尔数的3~5倍。结果表明每个重组融合蛋白上可至少偶联上2~5个多柔比星药物分子。同理,试验确定重组融合蛋白可偶联小分子化合物、化疗药物。当与不同的小分子药物偶联就可形成不同的创新药物复合物,作为临床上不同的实体肿瘤适应症的治疗用药。
实施例11重组融合蛋白与rhegf偶联形成纳米颗粒生产工艺
具体实验方法采用王树斌等人建立的方法(中国肿瘤临床,2008,35:9,516-519)。取1ml水相(20%重组融合蛋白生理盐水溶液)和50ml油相(环己烷,含2%乳化剂op-4),600r/min转速下搅拌混合1h,乳化20min。以25%戊二醛甲苯溶液为交联剂,搅拌固化2h。rhegf(本发明人授权专利:zl200710057571.9)与rhsa/cbd纳米颗粒(nano-particle,np)通过可溶性交联剂1-乙基-3-(3-二甲基氨基丙基碳二亚氨)(edc)进行共价联结。按取重组融合蛋白纳米载体1mg加入到0.1mol/lmes溶液(ph6.0)1ml中,加入0.4mgedc(2mmol)和0.6mgn-羟基硫代琥珀酰亚胺(sulfo-nhs)。按此比例放大后,室温反应15min,加入酵母工程菌制备的rhegf(100μg)室温搅拌2h。在连接反应中特异分离药物复合物比例egf:重组融合蛋白纳米基质载体摩尔比为1:1的有效组分。图-9展示了偶联后的rhsa/cbd-egf蛋白(分子量约95kd)与rhsa/cbd(分子量约88.2kd)、rhsa/egf(分子量约72.5kd)sds-page图谱。
检测偶联在重组融合蛋白(rhsa/cbd)作为药物基质复合物上的重组人表皮细胞生长因子(egf),是使用市售hegf检测elisa试剂盒(abcom,cat#ab217772)。检测结果表明其与本公司发明公开的重组人血清白蛋白/表皮生长因子融合蛋白(rhsa/egf)分子结构(中国授权发明专利:zl200710057571.9)的检测结果相近。结果表明偶联比例符合分子摩尔比(1:1)的预测。
按药典法开展rhsa/cbd-egf复合物的细胞水平生物活性测定【2015版中国药典三部通则3528:重组人表皮生长因子生物活性测定法(细胞增殖法/mtt比色法)】。结果表明当其与rhsa/egf重组融合蛋白摩尔数相同时,生物活性测定值相近。测定结果见表1。
表1样品的egf生物活性测定(比色法)
实施例12重组融合蛋白-egf药物复合物在大鼠体内半衰期测定
使用sprague-dawley大鼠(sd,spf级,雌雄各半)。大鼠给药前一天(d-1)对大鼠体重进行了测量,其中雄鼠体重范围约应为276~372g,雌鼠体重范围约为221~280g。供试药为本发明的重组融合蛋白-egf复合物原液(重组人血清白蛋白/胶原结合域融合蛋白-egf,rhsa/cbd-egf),规格:2.5mg/0.5ml/支(蛋白质浓度为5mg/ml)。供试药给药大鼠给药时,给药剂量均为200μg/kg。每个给药体积为300μl。给药前1h,药后的2min、0.5h、2h、4h、6h、8h、24h、48h、72h、96h、120h、168h取血。采用异氟烷吸入麻醉后,眼眶静脉丛取血,每只每次采血量约0.05ml。血样采集后转移入含edta的ep管中,充分摇匀,置于碎冰中(碎冰中保存不超过2h),之后在4000rpm低温(约4℃)条件下离心10min,分离血浆,-20℃以下保存待分析。偶联用的药物rhegf的半衰期测定结果是1-2h,而rhsa/cbd-egf偶联后的血液半衰期则为80-100h。图10结果表明egf多肽蛋白单体被偶联到rhsa/cbd重组融合蛋白上后的血液半衰期被提高或被延长至少30倍。且偶联药物复合物中的egf生物活性并没有改变,确认了重组融合蛋白作为基质载体可偶联蛋白多肽或毒性蛋白,偶联后的蛋白多肽的半衰期被大大延长。结果验证了重组融合蛋白偶联药物分子,可将药物的体内半衰期大大延长,对形成创新的实体肿瘤特异靶向性药物复合物给予了技术支持。
以上所述仅是本发明的实施方式示例。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中美福源生物技术(北京)股份有限公司
天津溥瀛生物技术有限公司
北京美福源生物医药科技有限公司
天津林达生物科技有限公司
<120>肿瘤特异靶向性基质的重组人血清白蛋白-胶原结合域融合蛋白和应用
<160>8
<170>siposequencelisting1.0
<210>1
<211>790
<212>prt
<213>人工序列(artificialsequence)
<400>1
cysserglygluglyleuglnileprothrleuserproalaproasp
151015
cysserglnproleuaspvalileleuleuleuaspglyserserser
202530
pheproalasertyrpheaspglumetlysserphealalysalaphe
354045
ileserlysalaasnileglyproargleuthrglnvalservalleu
505560
glntyrglyserilethrthrileaspvalprotrpasnvalvalpro
65707580
glulysalahisleuleuserleuvalaspvalmetglnargglugly
859095
glyproserglnileglyaspalaleuglyphealavalargtyrleu
100105110
thrserglumethisglyalaargproglyalaserlysalavalval
115120125
ileleuvalthraspvalservalaspservalaspalaalaalaasp
130135140
alaalaargserasnargvalthrvalpheproileglyileglyasp
145150155160
argtyraspalaalaglnleuargileleualaglyproalaglyasp
165170175
serasnvalvallysleuglnargilegluaspleuprothrmetval
180185190
thrleuglyasnserpheleuhislysleucysserglyaspalahis
195200205
lyssergluvalalahisargphelysaspleuglyglugluasnphe
210215220
lysalaleuvalleuilealaphealaglntyrleuglnglncyspro
225230235240
phegluasphisvallysleuvalasngluvalthrgluphealalys
245250255
thrcysvalalaaspgluseralagluasncysasplysserleuhis
260265270
thrleupheglyasplysleucysthrvalalathrleuarggluthr
275280285
tyrglyglumetalaaspcyscysalalysglngluprogluargasn
290295300
glucyspheleuglnhislysaspaspasnproasnleuproargleu
305310315320
valargprogluvalaspvalmetcysthralaphehisaspasnglu
325330335
gluthrpheleulyslystyrleutyrgluilealaargarghispro
340345350
tyrphetyralaprogluleuleuphephealalysargtyrlysala
355360365
alaphethrglucyscysglnalaalaasplysalaalacysleuleu
370375380
prolysleuaspgluleuargaspgluglylysalaserseralalys
385390395400
glnargleulyscysalaserleuglnlyspheglygluargalaphe
405410415
lysalatrpalavalalaargleuserglnargpheprolysalaglu
420425430
phealagluvalserlysleuvalthraspleuthrlysvalhisthr
435440445
glucyscyshisglyaspleuleuglucysalaaspaspargalaasp
450455460
leualalystyrilecysgluasnglnaspserileserserlysleu
465470475480
lysglucyscysglulysproleuleuglulysserhiscysileala
485490495
gluvalgluasnaspglumetproalaaspleuproserleualaala
500505510
aspphevalgluserlysaspvalcyslysasntyralaglualalys
515520525
aspvalpheleuglymetpheleutyrglutyralaargarghispro
530535540
asptyrservalvalleuleuleuargleualalysthrtyrgluthr
545550555560
thrleuglulyscyscysalaalaalaaspprohisglucystyrala
565570575
lysvalpheaspgluphelysproleuvalglugluproglnasnleu
580585590
ilelysglnasncysgluleuphegluglnleuglyglutyrlysphe
595600605
glnasnalaleuleuvalargtyrthrlyslysvalprogluvalser
610615620
thrprothrleuvalgluvalserargasnleuglylysvalglyser
625630635640
lyscyscyslyshisproglualalysargmetprocysalagluasp
645650655
tyrleuservalvalleuasnglnleucysvalleuhisglulysthr
660665670
provalseraspargvalthrlyscyscysthrgluserleuvalasn
675680685
argargprocyspheseralaleugluvalaspgluthrtyrvalpro
690695700
lysglupheasnalagluthrphethrphehisalaaspilecysthr
705710715720
leuserglulysgluargglnilelyslysglnthralaleuvalglu
725730735
leuvallyshislysprolysalathrlysgluglnleulysalaval
740745750
metaspaspphealaalaphevalglulyscyscyslysalaaspasp
755760765
lysgluthrcysphealaglugluglylyslysleuvalalaalaser
770775780
glnalaalaleuglyleu
785790
<210>2
<211>2376
<212>dna
<213>人工序列(artificialsequence)
<400>2
tgttctggtgaaggtttgcaaattccaactttgtctccagctccagattgttctcaacca60
ttggatgttattttgttgttggatggttcttcttcttttccagcttcttactttgatgaa120
atgaagtcttttgctaaggcttttatttctaaggctaacattggtccaagattgactcaa180
gtttctgttttgcaatacggttctattactactattgatgttccatggaacgttgttcca240
gaaaaggctcatttgttgtctttggttgatgttatgcaaagagaaggtggtccatctcaa300
attggtgatgctttgggttttgctgttagatacttgacttctgaaatgcatggtgctaga360
ccaggtgcttctaaggctgttgttattttggttactgatgtttctgttgattctgttgat420
gctgctgctgatgctgctagatctaacagagttactgtttttccaattggtattggtgat480
agatacgatgctgctcaattgagaattttggctggtccagctggtgattctaacgttgtt540
aagttgcaaagaattgaagatttgccaactatggttactttgggtaactcttttttgcat600
aagttgtgttctggtgatgctcacaagagtgaggttgctcatcggtttaaagatttggga660
gaagaaaatttcaaagccttggtgttgattgcctttgctcagtatcttcagcagtgtcca720
tttgaagatcatgtaaaattagtgaatgaagtaactgaatttgcaaaaacatgtgttgct780
gatgagtcagctgaaaattgtgacaaatcacttcataccctttttggagacaaattatgc840
acagttgcaactcttcgtgaaacctatggtgaaatggctgactgctgtgcaaaacaagaa900
cctgagagaaatgaatgcttcttgcaacacaaagatgacaacccaaacctcccccgattg960
gtgagaccagaggttgatgtgatgtgcactgcttttcatgacaatgaagagacatttttg1020
aaaaaatacttatatgaaattgccagaagacatccttacttttatgccccggaactcctt1080
ttctttgctaaaaggtataaagctgcttttacagaatgttgccaagctgctgataaagct1140
gcctgcctgttgccaaagctcgatgaacttcgggatgaagggaaggcttcgtctgccaaa1200
cagagactcaagtgtgccagtctccaaaaatttggagaaagagctttcaaagcatgggca1260
gtagctcgcctgagccagagatttcccaaagctgagtttgcagaagtttccaagttagtg1320
acagatcttaccaaagtccacacggaatgctgccatggagatctgcttgaatgtgctgat1380
gacagggcggaccttgccaagtatatctgtgaaaatcaagattcgatctccagtaaactg1440
aaggaatgctgtgaaaaacctctgttggaaaaatcccactgcattgccgaagtggaaaat1500
gatgagatgcctgctgacttgccttcattagctgctgattttgttgaaagtaaggatgtt1560
tgcaaaaactatgctgaggcaaaggatgtcttcctgggcatgtttttgtatgaatatgca1620
agaaggcatcctgattactctgtcgtgctgctgctgagacttgccaagacatatgaaacc1680
actctagagaagtgctgtgccgctgcagatcctcatgaatgctatgccaaagtgttcgat1740
gaatttaaacctcttgtggaagagcctcagaatttaatcaaacaaaattgtgagcttttt1800
gagcagcttggagagtacaaattccagaatgcgctattagttcgttacaccaagaaagta1860
ccccaagtgtcaactccaactcttgtagaggtctcaagaaacctaggaaaagtgggcagc1920
aaatgttgtaaacatcctgaagcaaaaagaatgccctgtgcagaagactatctatccgtg1980
gtcctgaaccagttatgtgtgttgcatgagaaaacgccagtaagtgacagagtcaccaaa2040
tgctgcacagaatccttggtgaacaggcgaccatgcttttcagctctggaagtcgatgaa2100
acatacgttcccaaagagtttaatgctgaaacattcaccttccatgcagatatatgcaca2160
ctttctgagaaggagagacaaatcaagaaacaaactgcacttgttgagcttgtgaaacac2220
aagcccaaggcaacaaaagagcaactgaaagctgttatggatgatttcgcagcttttgta2280
gagaagtgctgcaaggctgacgataaggagacctgctttgccgaggagggtaaaaaactt2340
gttgctgcaagtcaagctgccttaggcttatgataa2376
<210>3
<211>798
<212>prt
<213>人工序列(artificialsequence)
<400>3
aspalahislyssergluvalalahisargphelysaspleuglyglu
151015
gluasnphelysalaleuvalleuilealaphealaglntyrleugln
202530
glncysprophegluasphisvallysleuvalasngluvalthrglu
354045
phealalysthrcysvalalaaspgluseralagluasncysasplys
505560
serleuhisthrleupheglyasplysleucysthrvalalathrleu
65707580
arggluthrtyrglyglumetalaaspcyscysalalysglnglupro
859095
gluargasnglucyspheleuglnhislysaspaspasnproasnleu
100105110
proargleuvalargprogluvalaspvalmetcysthralaphehis
115120125
aspasnglugluthrpheleulyslystyrleutyrgluilealaarg
130135140
arghisprotyrphetyralaprogluleuleuphephealalysarg
145150155160
tyrlysalaalaphethrglucyscysglnalaalaasplysalaala
165170175
cysleuleuprolysleuaspgluleuargaspgluglylysalaser
180185190
seralalysglnargleulyscysalaserleuglnlyspheglyglu
195200205
argalaphelysalatrpalavalalaargleuserglnargphepro
210215220
lysalagluphealagluvalserlysleuvalthraspleuthrlys
225230235240
valhisthrglucyscyshisglyaspleuleuglucysalaaspasp
245250255
argalaaspleualalystyrilecysgluasnglnaspserileser
260265270
serlysleulysglucyscysglulysproleuleuglulysserhis
275280285
cysilealagluvalgluasnaspglumetproalaaspleuproser
290295300
leualaalaaspphevalgluserlysaspvalcyslysasntyrala
305310315320
glualalysaspvalpheleuglymetpheleutyrglutyralaarg
325330335
arghisproasptyrservalvalleuleuleuargleualalysthr
340345350
tyrgluthrthrleuglulyscyscysalaalaalaaspprohisglu
355360365
cystyralalysvalpheaspgluphelysproleuvalgluglupro
370375380
glnasnleuilelysglnasncysgluleuphegluglnleuglyglu
385390395400
tyrlyspheglnasnalaleuleuvalargtyrthrlyslysvalpro
405410415
glnvalserthrprothrleuvalgluvalserargasnleuglylys
420425430
valglyserlyscyscyslyshisproglualalysargmetprocys
435440445
alagluasptyrleuservalvalleuasnglnleucysvalleuhis
450455460
glulysthrprovalseraspargvalthrlyscyscysthrgluser
465470475480
leuvalasnargargprocyspheseralaleugluvalaspgluthr
485490495
tyrvalprolysglupheasnalagluthrphethrphehisalaasp
500505510
ilecysthrleuserglulysgluargglnilelyslysglnthrala
515520525
leuvalgluleuvallyshislysprolysalathrlysgluglnleu
530535540
lysalavalmetaspaspphealaalaphevalglulyscyscyslys
545550555560
alaaspasplysgluthrcysphealaglugluglylyslysleuval
565570575
alaalaserglnalaalaleuglyleuglyglyglyserglyglygly
580585590
sercysserglygluglyleuglnileprothrleuserproalapro
595600605
aspcysserglnproleuaspvalileleuleuleuaspglyserser
610615620
serpheproalasertyrpheaspglumetlysserphealalysala
625630635640
pheileserlysalaasnileglyproargleuthrglnvalserval
645650655
leuglntyrglyserilethrthrileaspvalprotrpasnvalval
660665670
proglulysalahisleuleuserleuvalaspvalmetglnargglu
675680685
glyglyproserglnileglyaspalaleuglyphealavalargtyr
690695700
leuthrserglumethisglyalaargproglyalaserlysalaval
705710715720
valileleuvalthraspvalservalaspservalaspalaalaala
725730735
aspalaalaargserasnargvalthrvalpheproileglyilegly
740745750
aspargtyraspalaalaglnleuargileleualaglyproalagly
755760765
aspserasnvalvallysleuglnargilegluaspleuprothrmet
770775780
valthrleuglyasnserpheleuhislysleucyssergly
785790795
<210>4
<211>2472
<212>dna
<213>人工序列(artificialsequence)
<400>4
atgaagtgggtaacctttatttcccttctttttctctttagctcggcttattccaggggt60
gtgtttcgtcgagatgcacacaagagtgaggttgctcatcggtttaaagatttgggagaa120
gaaaatttcaaagccttggtgttgattgcctttgctcagtatcttcagcagtgtccattt180
gaagatcatgtaaaattagtgaatgaagtaactgaatttgcaaaaacatgtgttgctgat240
gagtcagctgaaaattgtgacaaatcacttcataccctttttggagacaaattatgcaca300
gttgcaactcttcgtgaaacctatggtgaaatggctgactgctgtgcaaaacaagaacct360
gagagaaatgaatgcttcttgcaacacaaagatgacaacccaaacctcccccgattggtg420
agaccagaggttgatgtgatgtgcactgcttttcatgacaatgaagagacatttttgaaa480
aaatacttatatgaaattgccagaagacatccttacttttatgccccggaactccttttc540
tttgctaaaaggtataaagctgcttttacagaatgttgccaagctgctgataaagctgcc600
tgcctgttgccaaagctcgatgaacttcgggatgaagggaaggcttcgtctgccaaacag660
agactcaagtgtgccagtctccaaaaatttggagaaagagctttcaaagcatgggcagta720
gctcgcctgagccagagatttcccaaagctgagtttgcagaagtttccaagttagtgaca780
gatcttaccaaagtccacacggaatgctgccatggagatctgcttgaatgtgctgatgac840
agggcggaccttgccaagtatatctgtgaaaatcaagattcgatctccagtaaactgaag900
gaatgctgtgaaaaacctctgttggaaaaatcccactgcattgccgaagtggaaaatgat960
gagatgcctgctgacttgccttcattagctgctgattttgttgaaagtaaggatgtttgc1020
aaaaactatgctgaggcaaaggatgtcttcctgggcatgtttttgtatgaatatgcaaga1080
aggcatcctgattactctgtcgtgctgctgctgagacttgccaagacatatgaaaccact1140
ctagagaagtgctgtgccgctgcagatcctcatgaatgctatgccaaagtgttcgatgaa1200
tttaaacctcttgtggaagagcctcagaatttaatcaaacaaaattgtgagctttttgag1260
cagcttggagagtacaaattccagaatgcgctattagttcgttacaccaagaaagtaccc1320
caagtgtcaactccaactcttgtagaggtctcaagaaacctaggaaaagtgggcagcaaa1380
tgttgtaaacatcctgaagcaaaaagaatgccctgtgcagaagactatctatccgtggtc1440
ctgaaccagttatgtgtgttgcatgagaaaacgccagtaagtgacagagtcaccaaatgc1500
tgcacagaatccttggtgaacaggcgaccatgcttttcagctctggaagtcgatgaaaca1560
tacgttcccaaagagtttaatgctgaaacattcaccttccatgcagatatatgcacactt1620
tctgagaaggagagacaaatcaagaaacaaactgcacttgttgagcttgtgaaacacaag1680
cccaaggcaacaaaagagcaactgaaagctgttatggatgatttcgcagcttttgtagag1740
aagtgctgcaaggctgacgataaggagacctgctttgccgaggagggtaaaaaacttgtt1800
gctgcaagtcaagctgccttaggcttaggtggtggttctggtggtggttcttgttctggt1860
gaaggtttgcaaattccaactttgtctccagctccagattgttctcaaccattggatgtt1920
attttgttgttggatggttcttcttcttttccagcttcttactttgatgaaatgaagtct1980
tttgctaaggcttttatttctaaggctaacattggtccaagattgactcaagtttctgtt2040
ttgcaatacggttctattactactattgatgttccatggaacgttgttccagaaaaggct2100
catttgttgtctttggttgatgttatgcaaagagaaggtggtccatctcaaattggtgat2160
gctttgggttttgctgttagatacttgacttctgaaatgcatggtgctagaccaggtgct2220
tctaaggctgttgttattttggttactgatgtttctgttgattctgttgatgctgctgct2280
gatgctgctagatctaacagagttactgtttttccaattggtattggtgatagatacgat2340
gctgctcaattgagaattttggctggtccagctggtgattctaacgttgttaagttgcaa2400
agaattgaagatttgccaactatggttactttgggtaactcttttttgcataagttgtgt2460
tctggttgataa2472
<210>5
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>5
gaattcatgaagtgggtaacctttatttcc30
<210>6
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>6
gaattcttataagcctaaggcagcttgacttgc33
<210>7
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>7
ctggttccaattgacaagc19
<210>8
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>8
gactcatcagcaacacatg19
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



