一种可快速检测酵母细胞生存状态的荧光碳点的制备方法及其应用与流程
 2021-02-02 19:02:31|
2021-02-02 19:02:31| 397|
397| 起点商标网
起点商标网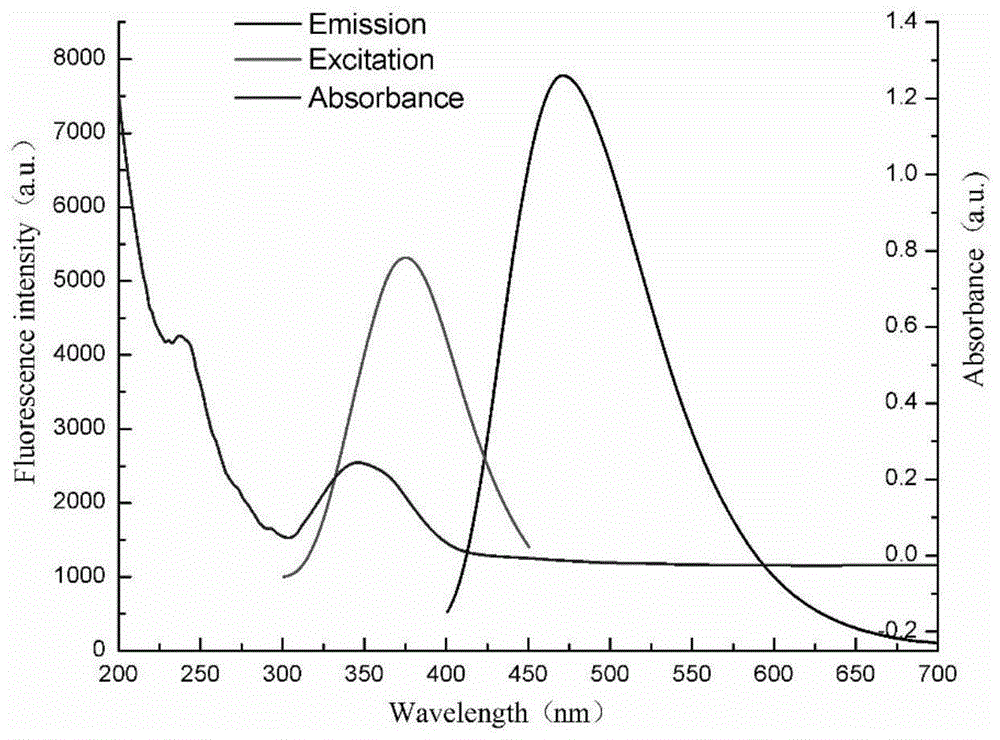
本发明属于细胞计数领域,涉及一种荧光碳点的制备方法及利用其对酵母细胞进行快速检测的方法。
背景技术:
酵母细胞是啤酒生产上常用的典型的上面发酵酵母,在主发酵过程中如果活酵母细胞数量不足,酵解糖的速度较慢,将影响啤酒产量;但如果活酵母细胞数量过多,则会导致酵母细胞自溶,啤酒产生“酵母风味”。因此,检测酵母细胞生存状态至关重要。目前用于鉴别酵母活性的方法包括美兰染色和荧光染料染色。
美兰染色:美兰染色酵母细胞,活酵母细胞中的脱氢酶可以将美兰还原为无色物质,而死酵母细胞仍为蓝色,进而可以区分死活酵母细胞。然而,此方法需要控制染色时间且存在人工误差。
荧光染料染色:溴化乙锭(eb)和碘化丙啶(pi)是目前最常用的荧光染料,它们可以穿透膜受损的酵母细胞来识别死细胞。然而这些荧光染料是有毒性的,给操作人员带来危害,并对环境造成污染,且易被淬灭,因此操作环境须严格避光,操作过程繁琐。
因此,发明一种细胞毒性小、操作便利、可以快速检测酵母细胞生存状态的荧光染料迫在眉睫。
技术实现要素:
本发明的目的是提供一种可快速检测酵母细胞生存状态的荧光碳点的制备方法及其应用。本发明所制备的荧光碳点可快速检测酵母细胞生存状态,细胞毒性低,对操作人员和环境有利,且短时间内无需严格避光,操作便利。此外,该荧光碳点具有不依赖激发波长的光致发光特性,可以避免细胞自发荧光和荧光显微镜成像时激发光源的限制。
本发明的目的是通过以下技术方案实现的:
一种可快速检测酵母细胞生存状态的荧光碳点的制备方法,包括如下步骤:
步骤一、将柠檬酸、乙二胺和硼酸溶于去离子水中,控制柠檬酸、乙二胺和硼酸的摩尔比为0.010~0.050:0.010~0.050:0.010~0.050,优选摩尔比为0.025~0.035:0.025~0.035:0.020~0.035;
步骤二、将步骤一获得的混合溶液转移至反应釜中进行水热反应或微波反应,其中:水热反应的温度为160~220℃,时间为3~8h,优选反应温度为175~185℃,反应时间为4.5~5.5h;微波反应的功率为600~1200w,时间为10~60min,优选功率为800~1000w,时间为15~25min;
步骤三、反应结束后冷却到室温,反应液依次经透析、旋蒸得到荧光碳点溶液,可以通过冻干制成荧光碳点粉末。
上述方法制备的荧光碳点荧光强度高,荧光性质稳定,可以三色成像,并且具有不依赖激发波长的光致发光特性。在较宽的ph范围内荧光强度无明显变化,抗光漂白,储存稳定性较好。具有良好的水溶性和分散性,细胞毒性较低,该荧光碳点细胞成像中具有明显优势。
上述方法制备的荧光碳点可快速检测酵母细胞生存状态,具体方法如下:
步骤一、取待测样品均匀涂于载玻片上,自然干燥后向涂有待测样品的载玻片上滴加荧光碳点溶液染色,自然干燥;或者取待测样品与荧光碳点溶液混合染色50~180s,再将此混合溶液均匀涂于载玻片上,自然干燥;其中:待测样品的加入量为50~150μl;荧光碳点溶液的加入量为50~300μl,浓度为150~250μg·ml-1,所使用的稀释剂是去离子水;
步骤二、用荧光显微镜观察玻片,获得酵母细胞荧光图像,其中:荧光显微镜成像的激发光源可以选择紫外、蓝光和绿光,最佳激发光源为紫外;
当荧光碳点与酵母细胞成像时,在紫外激发下,酵母细胞可能呈现出两种不同的状态,一种状态呈现出周身明亮的蓝色,为死酵母细胞;另一种状态呈深蓝色,外部有明亮的光圈,为有活性的酵母细胞;
当荧光碳点与酵母细胞成像时,在蓝光激发下,酵母细胞可能呈现出两种不同的状态,一种状态呈现出周身明亮的绿色,为死酵母细胞;另一种状态呈深绿色,外部有明亮的光圈,为有活性的酵母细胞;
当荧光碳点与酵母细胞成像时,在绿光激发下,酵母细胞可能呈现出两种不同的状态,一种状态呈现出周身明亮的红色,为死酵母细胞;另一种状态呈深红色,外部有明亮的光圈,为有活性的酵母细胞。
相比于现有技术,本发明具有如下优点:
1、本发明制备的荧光碳点可以三色成像,具有较高的荧光量子产率和不依赖激发波长的光致发光特性,可以避免细胞自发荧光和荧光显微镜成像时激发光源的限制。
2、本发明制备的荧光碳点在水溶液中具有良好的溶解性和分散性,细胞毒性较低,荧光性质稳定,对操作人员和环境的危害较小,在一定时间的光照下不会发生明显的淬灭,光学性质稳定,操作过程不需严格避光,操作便利。
3、本发明制备的荧光碳点可以在短时间内(60s后)快速检测酵母细胞的生存状态,当荧光碳点与酵母细胞成像时,在紫外激发下,酵母细胞呈现出两种不同的状态,死亡的酵母细胞均呈现出周身明亮的蓝色,而有活性的酵母细胞为深蓝色,外部有明亮的光圈。
4、本发明制备的荧光碳点可应用在啤酒发酵过程中酵母细胞计数领域,快速检测酵母细胞生存状态,解决啤酒发酵过程中酵母细胞计数问题。
5、本发明相比美兰染色,荧光碳点细胞毒性较低,对于染色时间无限制,在染色过程中无需进行洗脱脱色,操作便利。
6、本发明相比其他的荧光染料(pi/fda),细胞毒性较低,荧光性质稳定,对操作人员和环境的危害较小,在一定时间的光照下不会发生明显的淬灭,光学性质稳定,操作过程不需严格避光,操作便利。
附图说明
图1为实施例1制备的荧光碳点的紫外-可见光谱、荧光激发和发射光谱;
图2为实施例1制备的荧光碳点在不同激发波长下的荧光光谱;
图3为实施例1制备的荧光碳点在不同ph条件下的荧光强度变化;
图4为实施例1制备的荧光碳点在紫外激发下的荧光强度变化;
图5为不同浓度的荧光碳点条件下的酵母生长曲线;
图6为实施例1制备的荧光碳点与酵母细胞分别在紫外、蓝光,绿光激发下成像,比例尺为5μm;
图7为实施例1制备的荧光碳点与酵母细胞和全部死亡的酵母细胞在紫外激发下成像,比例尺为5μm。
具体实施方式
下面结合实施例对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
实施例1
本实施例提供了一种荧光碳点的制备方法,所述方法采用水热法制备荧光碳点,具体步骤如下:
(1)将0.026mol柠檬酸、0.030mol乙二胺和0.032mol硼酸溶解在30ml去离子水中。
(2)将溶液转移到50ml高压釜中,在180℃下加热5h,溶液由无色变为棕黄色表明合成了碳点。
(3)将反应液冷却至室温,并以6000rpm离心10min去除杂质大颗粒。
(4)用3500da透析膜透析上清液24h,然后用真空旋转蒸发器浓缩溶液至10ml,得到荧光碳点溶液。
实施例2
本实施例提供了一种荧光碳点的制备方法,所述方法采用微波法制备荧光碳点,具体步骤如下:
(1)将0.026mol柠檬酸、0.030mol乙二胺和0.032mol硼酸溶解在30ml去离子水中。
(2)将溶液转移到50ml高压釜中,在功率为800w的条件下微波加热20min,溶液由无色变为棕黄色表明合成了碳点。
(3)将反应液冷却至室温,并以6000rpm离心10min去除杂质大颗粒。
(4)用3500da透析膜透析上清液24h,然后用真空旋转蒸发器浓缩溶液至10ml,得到荧光碳点溶液。
实施例3
将实施例1制备的荧光碳点稀释至0.01mg·ml-1进行表征,其紫外吸收光谱、荧光激发和发射光谱如图1所示。由图1可见:在紫外吸收光谱中观察到240和350nm处的峰,归因于c=c的π=π跃迁和c=0的n-π*跃迁。最大激发和发射波长分别为360nm和472nm。荧光碳点在不同激发波长下的荧光光谱如图2所示。由图2可见:当激发波长从310nm增加到390nm时,在472nm处荧光碳点的最大发射波长保持不变,表明实施例1制备的荧光碳点具有不依赖激发波长的光致发光特性,可以避免细胞的自发荧光和荧光显微镜成像时激发光源的限制。
实施例4
使用盐酸和氢氧化钠配制一系列ph为1~14的溶液,分别以这些不同ph的溶液为溶剂配制0.01mg·ml-1的荧光碳点溶液,用荧光光谱仪测量其荧光发射图谱,来考察不同ph对荧光碳点荧光强度的影响。荧光碳点在不同ph条件下的荧光强度如图3所示。由图3可见:在ph为5~10条件下,碳点的荧光强度无明显变化,荧光碳点表面的酰胺基是其荧光强度稳定的主要原因。荧光碳点在2h不间断的紫外激发下的荧光强度变化如图4所示。由图4可见:在2h的紫外激发下,碳点的荧光强度没有显著变化,表明碳点具有良好的光稳定性,有利于应用到细胞成像领域。
实施例5
将酵母细胞分别接种在6个150ml装有ypd培养基的锥形瓶中培养24h,其中每个锥形瓶中分别加入相同体积的0、10、20、40、100、200、400mg/ml荧光碳点溶液,并使用轨道摇床以180rpm进行培养。每隔3h取一次培养液,用分光光度计测量酵母的光密度(在600nm处)。不同浓度碳点条件下的酵母生长曲线如图5所示。由图5可见:当碳点浓度从10mg/ml逐渐升高到400mg/ml时,啤酒酵母的生长曲线都没有受到影响,表明荧光碳点具有低细胞毒性,可以应用到细胞成像领域,对操作人员和环境危害较小。
实施例6
将100μl待测样品涂于载玻片上,待其自然干燥后,再滴加150μl的200μg/ml的荧光碳点溶液染色60s,分别在紫外、蓝光和绿光下激发,荧光图像如图6所示。由图6可见:在紫外、蓝光和绿光的激发下,酵母细胞分别发射蓝色(b)、绿色(c)和红色(d)荧光,酵母细胞全部被标记,被标记的酵母细胞轮廓清晰,易于计数。
实施例7
本实施例与实施例6不同的是:将待测样品和荧光碳点溶液染色60s后涂于载玻片上,待其自然干燥,分别在紫外、蓝光和绿光激发下进行酵母细胞成像,获得酵母细胞荧光图像。
实施例8
本实施例与实施例6不同的是:将待测样品和荧光碳点溶液染色60s后涂于载玻片上,然后覆盖载玻片分别在紫外、蓝光和绿光激发下进行酵母细胞成像,获得酵母细胞荧光图像。
实施例9
本实施例与实施例6不同的是:将待测样品涂于载玻片上,待其自然干燥后,再滴加荧光碳点溶液染色60s,然后覆盖载玻片分别在紫外、蓝光和绿光激发下进行酵母细胞成像,获得酵母细胞荧光图像。
实施例10
取待测样品按照实施例6的方式用荧光碳点染色,然后在荧光显微镜下成像,荧光图像如图7所示。由图7可见:当荧光碳点溶液染色酵母细胞时,酵母细胞呈现出周身明亮的蓝色或者为深蓝色且外部有明亮的光圈这两种状态(a),对应于酵母细胞的死活状态。
为进一步验证试验,将酵母细胞置于100℃沸水中水浴10分钟使其全部死亡,将全部死亡的酵母细胞用荧光碳点染色,在荧光显微镜下观察,荧光图像如图7(b)所示。可以看出全部死亡的酵母细胞均呈现出周身明亮的蓝色,可进一步说明实施例1制备的碳点可以快速检测死活酵母细胞,荧光图像中的酵母细胞边界清晰,易于计数。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



