基于单细胞阵列的纳米电穿孔装置及其应用的制作方法
 2021-02-02 18:02:52|
2021-02-02 18:02:52| 504|
504| 起点商标网
起点商标网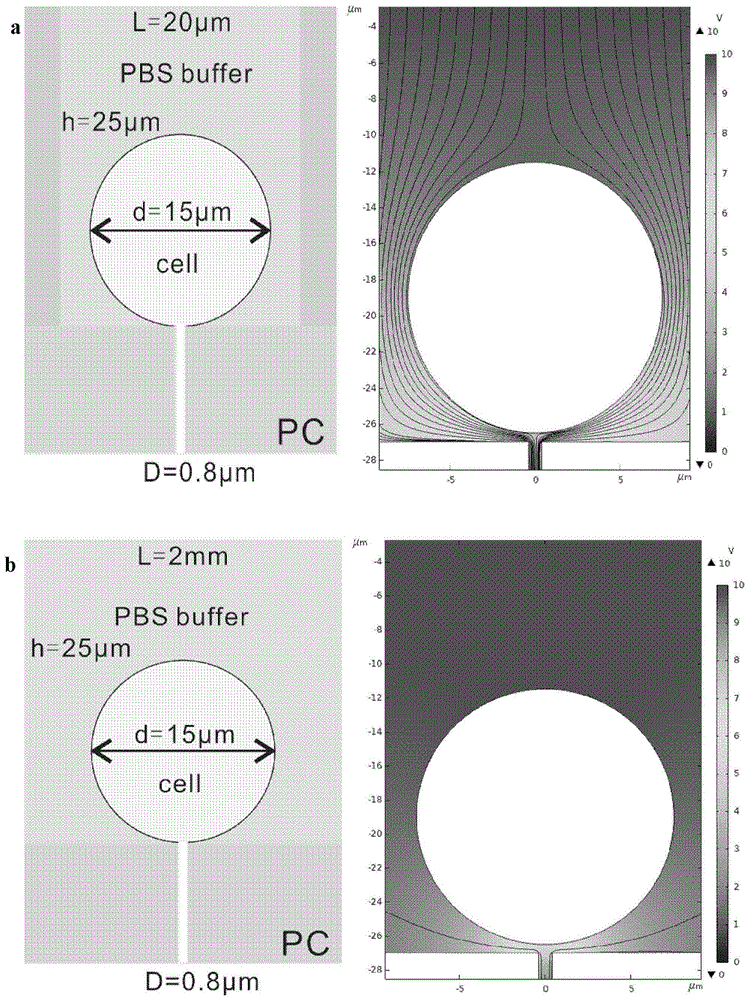
本公开涉及细胞生物分析技术领域,更具体地,涉及一种基于单细胞阵列的纳米电穿孔装置及应用其进行生物分子输送的方法。
背景技术:
肿瘤细胞广泛存在细胞异质性,这是造成肿瘤治疗过程中产生耐药细胞亚型的主要原因,并与肿瘤转移具有密切的相关性。单细胞分析技术是研究细胞异质性的有效手段。目前,传统的生物技术,如pcr,westernblotting等,往往需要从大量细胞中进行标志物的提取和分析,无法精准地反映出单细胞水平上的异质性,并且容易造成分析结果不完善。近年来发展的单细胞分析技术,将传统方法与微纳米芯片相结合,虽然能在单细胞水平上进行基因组和蛋白组等的分析,但均无法保证细胞的活性,且操作步骤复杂,重复性差。
细胞原位分析技术可以提供细胞标志物的信息,并可以对细胞状态进行实时的观察,进而能够获得丰富的细胞行为学信息。尤其是还能在单细胞水平上,对细胞的异质性进行直观地比较。在单细胞原位分析中,往往需要将外源的功能分子递送至细胞内,或者将细胞内的物质提取至细胞外,再进行分析。目前的递送技术可分为病毒载体、化学方法和物理方法。
病毒载体,例如腺病毒、慢病毒等,在递送效率方面具有较高的优势。但是由于病毒自身基因片段也可能被导入宿主染色体中,因此,在基因检测方面的应用受到限制。
化学方法主要是将人工合成的微纳米材料作为载体,通过细胞的内吞作用和外排作用,实现生物分子的输送。对于分子量较小的生物分子,例如sirnas,化学方法具有较高的递送效率。但是,对于大分子量的生物分子,例如crispr-cas9质粒(>9kbs),其递送效率非常有限。
物理方法递送的主要原理是在细胞膜上施加物理场,例如电场、磁场等,使细胞膜瞬间产生可逆的通道,同时细胞周围溶液中的外源分子,如dna、rna、药物等在物理场的作用下发生转移,进而可以实现功能分子的递送。
其中,电穿孔技术作为一种简单直接的物理输送工具,已被广泛地用于生物医学研究,包括再生医学,过继免疫疗法和在体基因编辑等。与显微注射,声纳穿孔和渗透作用等其他物理方法相比,电穿孔方法更加容易操作且更具普适性。
但是,在传统的电穿孔装置中,细胞需要承受上百伏的高压,极易造成细胞损伤甚至死亡,不利于对细胞进行后续的基因分析。另外,在不同的细胞类型,待递送物和缓冲溶液的条件下,传递的效率对于每个细胞来说并不一致,这对细胞异质性的分析造成了阻碍。
技术实现要素:
为解决现有技术中存在的上述问题,本公开实施例提出一种基于单细胞阵列的纳米电穿孔装置及应用其进行生物分子输送的方法,以精确地对单细胞进行操控和电穿孔,生物分子的输送,细胞内分子的检测,以及细胞的高通量筛选,从而实现大量单细胞的同时原位分析。
本公开的一个方面提供了一种基于单细胞阵列的纳米电穿孔装置包括:三维微纳米结构芯片,用于阵列化单细胞并提供用于分子传输的纳米通道;细胞培养室,位于所述三维微纳米结构芯片之上,用于细胞培养;生物分子储存室,位于所述三维微纳米结构芯片之下,用于生物分子的存储;位于所述细胞培养室上方的顶电极,以及位于所述生物分子储存室下方的底电极,用于电穿孔时形成回路。
在本公开的一个实施例中,所述三维微纳米结构芯片包括微孔阵列结构和纳米孔片层,其中所述微孔阵列结构形成于所述纳米孔片层之上。
在本公开的一个实施例中,所述微孔阵列结构包括多个微孔,所述微孔为直径10-50微米、深度5-20微米的圆孔,所述微孔的数量为100×100-1000×1000个,所述微孔边缘最小间距为2-10微米;所述纳米孔片层采用的材质为聚碳酸酯、聚对苯二甲酸乙二醇酯或硅;所述纳米孔片层中纳米孔的直径为1-1000纳米。
在本公开的一个实施例中,所述细胞培养室为具有中心孔的聚二甲基硅氧烷片层,所述三维微纳米结构芯片位于所述聚二甲基硅氧烷片层的中心孔的底部位置,所述聚二甲基硅氧烷片层的中心孔与所述三维微纳米结构芯片形成一空腔,该空腔即作为细胞培养室来进行细胞培养;所述细胞培养室的中心孔的尺寸为:长度2-10毫米,宽度2-10毫米,厚度2-5毫米。
在本公开的一个实施例中,所述生物分子储存室为具有中心孔的聚二甲基硅氧烷片层,所述三维微纳米结构芯片位于所述聚二甲基硅氧烷片层的中心孔的顶部位置,所述聚二甲基硅氧烷片层的中心孔与所述三维微纳米结构芯片形成一空腔,该空腔即作为生物分子储存室来存储生物分子;所述生物分子储存室的中心孔的尺寸为:长度2-10毫米,宽度2-10毫米,厚度1-2毫米。
在本公开的一个实施例中,所述顶电极和所述底电极均为导电金属针、金属平板或导电玻璃;所述顶电极与所述底电极二者之间的间隔为2-8毫米,分别连接外部正负电源,用于提供基于单细胞阵列的纳米电穿孔装置所需的脉冲电压;所述脉冲电压设定为:电压10-50v,脉冲个数10-300个,脉冲持续时间0.1-1秒,脉冲间隔0.1-1毫秒。
本公开的另一方面提供了一种应用所述的基于单细胞阵列的纳米电穿孔装置进行生物分子输送的方法,包括:大量细胞被均匀加载于所述三维微纳米结构芯片之上,待细胞与所述三维微纳米结构芯片底层的纳米孔片层中的纳米孔密切接触,向顶电极和底电极施加电压,使细胞膜上瞬间形成微通道,从而将作为待送物的生物分子通过纳米孔快速输送到细胞内,或者自细胞内释放生物分子。
在本公开的一个实施例中,所述大量细胞被均匀加载于所述三维微纳米结构芯片之上的步骤中,细胞加载方式包括采用磁力、电场、光镊、离心、重力或流体力学在内的可操控细胞空间位置的方法。
在本公开的一个实施例中,所述将作为待送物的生物分子通过纳米孔快速输送到细胞内的步骤中,生物分子输送方向是从生物分子储存室递送至细胞内;所述从生物分子储存室递送至细胞内生物分子的种类包括蛋白、质粒、dna探针、rna、药物分子或染料分子。
在本公开的一个实施例中,所述自细胞内释放生物分子的步骤中,生物分子输送方向是从细胞内输送到生物分子储存室;所述从细胞内输送到生物分子储存室生物分子的种类包括外泌体、蛋白、dna、rna、化合物或盐离子。
本公开实施例提出的基于单细胞阵列的纳米电穿孔装置及应用其进行生物分子输送的方法,通过将电穿孔技术与微纳米芯片相结合,能够对电场进行聚焦,从而精确地对单细胞进行操控和电穿孔,生物分子的输送,细胞内分子的荧光检测,以及细胞的高通量筛选,从而实现大量单细胞的同时原位分析。与传统的电穿孔方法相比,本公开采用的纳米电穿孔施加的电压小于50伏,电压大幅度降低,能够在维持细胞良好活性的前提下,同时具有递送高效、安全、高通量和均一性高的优势。
附图说明
为了更完整地理解本公开及其优势,现在将参考结合附图的以下描述,附图中的器件结构无需按比例,而是将重点放在清楚地说明本公开的原理上。在附图中:
图1为本公开实施例提出的基于单细胞阵列的纳米电穿孔装置的结构示意图。
图2中a为采用单细胞阵列进行电穿孔的电场线模拟图;b为在无单细胞阵列存在的情况下,直接采用纳米孔芯片进行电穿孔的电场线模拟图。
图3为单细胞阵列制备流程示意图。
图4中a图为单细胞阵列显微放大图,右上角的放大图为单细胞阵列底部的纳米孔;b图为细胞在单细胞阵列上形成的荧光显微图。
图5中a图为采用纳米电穿孔装置分别递送荧光探针(hch)至肺癌细胞系h1975(21号外显子l858r突变),hcc827(19号外显子e746-a750缺失)和a549(无egfr突变)中,以检测21号外显子l858r突变位点和19号外显子e746-a750缺失的荧光图;b图为采用流式细胞仪对细胞进行检测得到的荧光强度分布图。
图6中a图为采用传统电穿孔装置(bep)递送荧光探针(hch)至肺癌细胞系h1975中检测21号外显子l858r突变位点的流式细胞仪表征结果;b图为荧光探针(hch)与h1975细胞共同孵育以检测21号外显子l858r突变位点的流式细胞仪表征结果;c图为采用纳米电穿孔、传统电穿孔装置和孵育方法进行探针递送检测细胞突变的荧光强度对比。
图7为采用纳米电穿孔装置同时向细胞内递送多种荧光蛋白标记质粒得到的荧光显微镜结果。
图8为使用纳米电穿孔装置在不同孔径的细胞阵列中进行细胞内分子提取,ptp酶的活性随细胞数量的关系。
具体实施方式
以下,将参照附图及实施例对本公开进行详细描述,以辅助本领域技术成员充分地理解本公开的目的、特征和效果。附图中展示了本公开的示例性实施方式,但应当理解,本申请中还能以其他各种形式实现,不应被此处阐述的实施方式所限制。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本公开的概念。另外,本公开以下提供的各个实施例以及实施例中的技术特征可以以任意方式相互组合。
在此使用的术语仅仅是为了描述具体实施例,而并非意在限制本公开。此外,在此使用的术语“包括”、“包含”、“具有”等表明了所述特征、步骤、操作和/或部件的存在,但是并不排除存在或添加一个或多个其他特征、步骤、操作或部件。在此使用的所有术语(包括技术和科学术语)具有本领域技术人员通常所理解的含义,除非另外定义。应注意,这里使用的术语应解释为具有与本说明书的上下文相一致的含义,而不应以理想化或过于刻板的方式来解释。
下面结合图1和图2详细描述本公开提出的基于单细胞阵列的纳米电穿孔装置及应用其进行生物分子输送的方法,以更好地理解本公开的技术方案以及所实现的有益效果。
如图1所示,图1为本公开实施例提出的基于单细胞阵列的纳米电穿孔装置的结构示意图,该基于单细胞阵列的纳米电穿孔装置包括:三维微纳米结构芯片、细胞培养室、生物分子储存室、顶电极和底电极。其中,三维微纳米结构芯片,用于阵列化单细胞并提供用于分子传输的纳米通道;细胞培养室,位于所述三维微纳米结构芯片之上,用于细胞培养;生物分子储存室,位于所述三维微纳米结构芯片之下,用于生物分子的存储;顶电极位于所述细胞培养室的上方,底电极位于所述生物分子储存室的下方,用于电穿孔时形成回路。
在本公开的一个实施例中,所述三维微纳米结构芯片包括微孔阵列结构和纳米孔片层,其中所述微孔阵列结构形成于所述纳米孔片层之上。所述微孔阵列结构包括多个微孔,所述微孔为直径10-50微米、深度5-20微米的圆孔,所述微孔的数量为100×100-1000×1000个,所述微孔边缘最小间距为2-10微米。所述纳米孔片层采用的材质为聚碳酸酯、聚对苯二甲酸乙二醇酯或硅;所述纳米孔片层中纳米孔的直径为1-1000纳米。
在本公开的一个实施例中,所述细胞培养室为具有中心孔的聚二甲基硅氧烷片层,所述三维微纳米结构芯片位于所述聚二甲基硅氧烷片层的中心孔的底部位置,所述聚二甲基硅氧烷片层的中心孔与所述三维微纳米结构芯片形成一空腔,该空腔即作为细胞培养室来进行细胞培养。所述细胞培养室的中心孔的尺寸为:长度2-10毫米,宽度2-10毫米,厚度2-5毫米。
在本公开的一个实施例中,所述生物分子储存室为具有中心孔的聚二甲基硅氧烷片层,所述三维微纳米结构芯片位于所述聚二甲基硅氧烷片层的中心孔的顶部位置,所述聚二甲基硅氧烷片层的中心孔与所述三维微纳米结构芯片形成一空腔,该空腔即作为生物分子储存室来存储生物分子。所述生物分子储存室的中心孔的尺寸为:长度2-10毫米,宽度2-10毫米,厚度1-2毫米。
在本公开的一个实施例中,所述顶电极和所述底电极均为导电金属针、金属平板或导电玻璃。所述顶电极与所述底电极二者之间的间隔为2-8毫米,分别连接外部正负电源,用于提供基于单细胞阵列的纳米电穿孔装置所需的脉冲电压。所述脉冲电压设定为:电压10-50v,脉冲个数10-300个,脉冲持续时间0.1-1秒,脉冲间隔0.1-1毫秒。
基于图1所示的基于单细胞阵列的纳米电穿孔装置,以下详述应用所述基于单细胞阵列的纳米电穿孔装置进行生物分子输送的方法,该方法包括:大量细胞被均匀加载于所述三维微纳米结构芯片之上,待细胞与所述三维微纳米结构芯片底层的纳米孔片层中的纳米孔密切接触,向顶电极和底电极施加电压,使细胞膜上瞬间形成微通道,从而将作为待送物的生物分子通过纳米孔快速输送到细胞内,或者自细胞内释放生物分子。
在本公开的一个实施例中,所述大量细胞被均匀加载于所述三维微纳米结构芯片之上的步骤中,细胞加载方式包括采用磁力、电场、光镊、离心、重力或流体力学在内的可操控细胞空间位置的方法。
在本公开的一个实施例中,所述将作为待送物的生物分子通过纳米孔快速输送到细胞内的步骤中,生物分子输送方向是从生物分子储存室递送至细胞内。所述从生物分子储存室递送至细胞内生物分子的种类包括蛋白、质粒、dna探针、rna、药物分子或染料分子。
在本公开的一个实施例中,所述自细胞内释放生物分子的步骤中,生物分子输送方向是从细胞内输送到生物分子储存室。所述从细胞内输送到生物分子储存室生物分子的种类包括外泌体、蛋白、dna、rna、化合物或盐离子。
实施例1:探针递送用于单细胞突变位点实时检测
针对egfr突变位点21号外显子l858r和19号外显子e746-a750缺失分别设计并制备荧光探针hch。采用基于单细胞阵列的纳米电穿孔装置(图1)将探针递送至细胞内,以完成活细胞内突变位点的实时检测,并对细胞异质性进行分析。根据图2中电场的模拟结果,当单细胞阵列存在的情况下,电场线会更密集,从而可以在更低的电压下完成细胞电穿孔。具体步骤为:
步骤1:基于聚碳酸酯纳米孔膜的单细胞阵列制备,具体如图3所示;
步骤1.1:在洁净室环境中,使用去离子水浸润粘贴聚碳酸酯纳米孔膜至玻璃片上;
步骤1.2:在聚碳酸酯纳米孔膜上滴加光刻胶(spr-220),采用匀胶机进行旋涂,转速1500rpm,时间30s;
步骤1.3:将步骤1.2中得到的涂覆有光刻胶的聚碳酸酯纳米孔膜在80℃下烘干2min;
步骤1.4:使用曝光机在单细胞阵列掩膜的辅助下,将步骤1.3中的涂覆在聚碳酸酯纳米孔膜上的光刻胶进行曝光,曝光条件:8个循环,每次11s,功率7.5mw/cm2;
步骤1.5:将步骤1.4处理后的聚碳酸酯纳米孔膜上的光刻胶在室温下静置30min;
步骤1.6:使用mf-26a显影剂对步骤1.5中的聚碳酸酯纳米孔膜上的光刻胶进行显影,时间90s;
通过以上制备步骤,即可得到如图4a中展示的单细胞阵列。
步骤2:细胞培养室和生物分子储存室的制备;
步骤2.1:将弹性体与固化剂(slygard184,dowcorning)按照质量比10:1的比例进行充分混合;
步骤2.2:将步骤2.1中的混合物在干燥器中脱气30分钟,得到pdms胶体;
步骤2.3:将步骤2.2中的pdms胶体倒在模具上,厚度4mm,在80℃的温度下,固化60分钟;
步骤2.4:将步骤2.3中固化的pdms进行使用孔径7mm的打孔器进行打孔,可分别得到细胞培养室和生物分子储存室。
步骤3:单细胞阵列纳米电穿孔装置的制备;
步骤3.1:将步骤2中得到的细胞培养室和生物分子储存室分别涂覆一层步骤1.7中的pdms胶体;
步骤3.2:将步骤1中得到的单细胞阵列粘附在细胞培养室涂有pdms胶体的一面,含有单细胞阵列的一面朝向细胞培养室方向;
步骤3.3:将镀金电极片粘附在生物分子储存室涂有pdms胶体的一面;
步骤3.3:在80℃的温度下,固化60分钟。
步骤4:单细胞阵列形成;
步骤4.1:将10000个细胞悬浮液加至细胞培养室;
步骤4.2:采用悬挂转子,离心1000rpm,1分钟。
根据图4b中所展示的,采用离心法可在单细胞阵列上获得均匀的细胞排布,实现上万个单细胞的直观对比与异质性统计。
步骤5:探针递送及细胞突变检测;
步骤5.1:将探针溶液加入生物分子储存室,随后,将含有细胞的单细胞阵列放置在生物分子储存室上;
步骤5.2:将顶电极连接商用电转仪的正极,底电极连接商用电转仪的负极,设置电穿孔参数:电压10v,脉冲次数100次;脉冲持续时间0.3毫秒,脉冲间隔时间为0.1毫秒;
步骤5.3:确定电路导通后,开始电穿孔,实现探针向细胞内的递送;
步骤5.4:将完成探针递送的细胞放置在细胞培养箱内孵育30分钟后,采用流式细胞仪和荧光显微镜分别对细胞进行表征。
由图5中展示的结果可以确定探针能够递送至细胞内,完成对21号外显子l858r突变和19号外显子e746-a750缺失的检测,并且具有良好的特异性。根据图6中的结果,采用本公开中的纳米电穿孔装置进行递送的效率,显著优于采用商业化电转仪和直接孵育的递送效率。
实施例2:递送质粒用于基因编辑
采用本公开设计的基于单细胞阵列的纳米电穿孔装置用于基因编辑质粒的递送,可以对大量细胞进行基因改造,具有递送效率高的优势,同时还能够使细胞保持良好的活性。具体实施步骤如下:
步骤1-步骤4与实施例1中的操作步骤相同;
步骤5:基因编辑质粒递送及表达;
步骤5.1:将基因编辑质粒溶液(浓度50-100ng/ul)加入生物分子储存室;
步骤5.2:将顶电极连接商用电转仪的正极,底电极连接商用电转仪的负极,设置电穿孔参数:电压20v,脉冲次数100次;脉冲持续时间0.2毫秒,脉冲间隔时间为0.1毫秒;
步骤5.3:确定电路导通后,开始电穿孔,实现质粒向细胞内的递送;
步骤5.4:电穿孔过程结束后,添加新鲜的细胞培养基至单细胞阵列上,放入细胞培养箱中培养24小时;
步骤5.6:采用荧光显微镜对细胞质粒表达情况进行表征。
由图7中展示的结果可以确定质粒能够被递送至细胞内,并在细胞内完成表达。另外,通过同时递送多种质粒,可以实现多个基因位点的同时编辑。以上结果说明此装置在疾病产生机制和基因治疗等方面具有强大的应用潜力。
实施例3:细胞内ptp酶的提取与分析
使用本公开设计的基于单细胞阵列的纳米电穿孔装置对细胞进行穿孔时,细胞膜被瞬间打开,细胞内的带电生物分子在电场的作用下被输运至细胞外。通过在生物分子储存室进行特异性探针的修饰,即能够实现对细胞内分子的捕获。捕获得到的分子可在单细胞的水平进行表征,用于研究细胞内生物分子的异质性。以检测细胞内蛋白质酪氨酸磷酸酶(ptps)为例,实施步骤如下:
步骤1-4与实施例1中的操作步骤大致相同。其中,在步骤3中需要对生物分子储存室进行特异性捕获分子的修饰,步骤如下:
步骤3.4:将生物分子储存室下方的金电极通过一端标记巯基另一端标记羧基的聚乙二醇分子进行过夜孵育;
步骤3.5:使用pbs缓冲液洗去未结合的分子,加入edc/nhs溶液孵育1小时;
步骤3.6:加入能特异性识别ptps的抗体,室温孵育2小时;
步骤3.7:使用pbs缓冲液洗去未结合的分子,得到经特异性捕获分子修饰的生物分子储存室。
步骤5:细胞内生物分子的提取及分析
步骤5.1:通过电极连接商用电转仪,设置电穿孔参数:电压20v,脉冲次数100次;脉冲持续时间0.5毫秒,脉冲间隔时间为0.1毫秒;
步骤5.2:利用在生物分子储存室修饰的抗体捕获ptps;
步骤5.3:将收集得到的ptps使用抗体进行识别,并通过标记有荧光的二抗进行荧光分析。
由图8可以得到,当微孔中培养不同的细胞时,得到的ptps的活性不同,且ptps的活性随着细胞数量的增加而增加。说明采用本公开设计的基于单细胞阵列的纳米电穿孔装置可以实现细胞内生物分子向细胞外的输送,并成功地用于生物分子的分析。
依据以上实施例能够成功制备基于单细胞阵列的纳米电穿孔装置,并能分别用于实现荧光探针和基因编辑质粒向细胞内的快速高通量递送,以及细胞内蛋白质分子向细胞外的输运,说明本公开的装置在生物分子输送中具有非常广阔的应用空间。
需要说明的是,尽管已经参照本公开的特定示例性实施例示出并描述了本公开,但是本领域技术人员应该理解,本公开并不局限于上述实施方式,凡是对本公开的各种改动或变型不脱离本公开的精神和范围,倘若这些改动和变型属于本公开的权利要求和等同技术范围之内,则本公开也意味着包含这些改动和变型。
特别地,在不脱离本公开精神和教导的情况下,本公开的各个实施例和/或权利要求中记载的特征可以进行多种组合和/或结合,即使这样的组合或结合没有明确记载于本公开中。所有这些组合和/或结合均在本公开的保护范围。因此,本公开的范围不仅由所附权利要求来进行确定,还应由所附权利要求的等同物来进行限定。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



