呼气中病原体自动检测系统及方法与流程
 2021-02-02 18:02:23|
2021-02-02 18:02:23| 293|
293| 起点商标网
起点商标网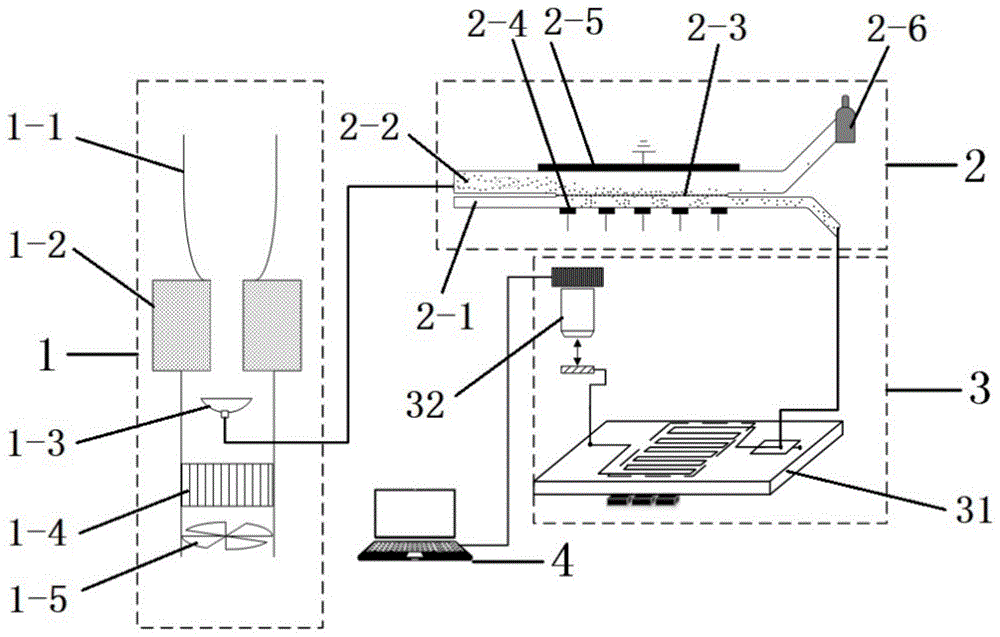
本发明属于呼吸道病原体检测技术领域,具体涉及一种基于微流控芯片的可连续不间断地实时检测呼吸道病毒的系统及方法。
背景技术:
呼吸道传染病时常爆发,过去十几年有新冠肺炎、sars、中东呼吸综合症、禽流感等。传染病若无有效控制,将会引起病毒大流行,从而对人类健康、社会经济带来造成极大的威胁。吸道病毒以呼吸道为侵入门户,在呼吸道黏膜上皮细胞增殖,引起呼吸道局部感染或或呼吸道以外组织器官病变。其多为ssrna病毒,有包膜及刺突,主要经呼吸道传播,病毒定位于呼吸道。可反复感染,流行率高。
传染病的主要防治是传染病的预防措施可以分为控制传染源、切断传播途径和保护易感人群三个方面。而传染源的鉴定又成为了其中的重中之重。尤其是在地铁、火车站、机场等人流密度极大的区域,若能及时发现传染源并将其隔离,则可极为有效地降低传染病爆发的可能性。因此,希望可以开发一种可连续不间断地实时检测呼吸道病毒的系统,从而实现在流动人口聚集地区对潜在传染源的监测。
呼吸诊断作为一种具有很好发展前景的无创诊断方法,受到越来越多的重视。呼吸诊断具有无损、廉价的特点,其诊断的研究主要围绕两大类标志物展开:呼出气体中的挥发性有机化合物以及呼出气体冷凝物中的生物标志物。
人体呼出气体中存在上千种挥发性有机化合物,其中大多数浓度在皮摩尔及更低的级别,且其中只有一少部分被认为是与疾病相关的。而通过冷却装置将呼出气体冷凝下来以得到冷凝物。冷凝物同样也是一种无损、便捷的获取人体健康信息的途径。冷凝物采集到的生物标志物中除了占接近总体积约99%的水之外,还包含种类非常多的离子、代谢产物以及核酸、atp、氨、过氧化氢、前列腺素、乳酸、氧化氮、多肽以及细胞因子等分子。因此,可以通过检测呼吸冷凝物中的生物标志物如呼吸道病毒的rna来发现病毒携带者。
传统的对于气体中病毒的检测包含采样及检测两部分。气体中微生物采集方法主要四类方法,分别为重力采样、惯性撞击、过滤阻留、静电沉着。其主要思路是使用空气采样器将空气中的微生物转移到一定的介质上,可以是液体、固体或半固体。由于收集到的病毒较少,因此需要先培养病毒,再采用测序、化学发光或光学等手段进行检测。
重力采样法利用微生物气溶胶的重力作用,在一定时间内将微生物粒子收集到培养皿内,然后在适宜的温度下培养生长成菌落,进行生物学的观察和研究。惯性采样法是利用抽气泵抽气,迫使含有微生物粒子的空气通过采样器上的喷嘴,以形成高速喷射气流,在离喷嘴时迫使喷射气流发生偏转,粒径大于或者等于切割粒径d50(收集效率为50%时的粒子空气动力学直径,μm)的粒子,由于惯性作用,被收集到采样介质上;而比d50小的粒子由于惯性小,则随气流发生偏转而逃逸。静电采样器是利用静电作用力,当带电粒子进入电场后,在电场力的作用下发生偏转,从而将其收集到极板上。
然而,这些方法都存在一定的缺陷。重力采样法对于空气中的粒径小以及数量少的病菌等采样效率极低,且受到气流的影响较大。惯性采样法同样不好收集粒径较小的病菌粒子,且由于采样操作时的气流喷射,容易损伤微生物。过滤式采样器可以将病菌粒子阻留在滤材上,从而收集粒子,然而,若连续长时间的采样则会使得滤膜上的微生物脱水,从而失去活性。静电采样器结构简单、压降小,可采集空气样本量大、浓缩倍数高、对细颗粒物捕集效率高,且能够较好地保持微生物形态和生物活性。然而,长时间采样,介质如琼脂以及液滴等的蒸发会导致采样器内湿度的变化影响收集效率。
对于微生物分析,目前大多采用分离培养与显微镜观察结合的方法进行检测,不仅费时(一般需几天到数周),而且不同微生物对于营养物质有不同的需求,所以大部分微生物难以通过人工手段快速培养。有些微生物的生物特征决定该物种不易在短时间内大量繁殖,因此可通过人工培养进行分析的微生物种类有限。
通过分子生物学手段进行微生物分析成为当前研究的热点,主要包括对于病毒核酸及其携带的特异性蛋白质或糖肽分子的检测。其中测序是最精确的确定呼吸道病毒的检测方法。
感染性病毒的检测需要良好的环境,熟练的操作人员,而自动化是解决该问题的最佳手段。开发一种可以直接处理,使用的传染源鉴别手段与方法,减少环节,直接处理,并在处理过程中无人值守的自动化方案在人群密集处就变得非常重要了。
若想在现场实现连续不间断实时监测空气中病毒含量,则需完成从采样到检测的完整流程,将涉及众多实验设备,而微流控实验室则为此提供了一种解决方法。微流控芯片又称为芯片实验室(lab-on-chip),是把化学和生物等领域中所涉及的样品制备、反应、分离、检测及细胞培养、分选、裂解、富集、检测等基本操作单元集成或基本集成到一块几平方厘米或更小的芯片上,由微通道形成网络,以可控流体贯穿整个系统,用以取代常规化学或生物实验室的各种功能的一种技术平台。目前已经有研究人员通过微流控芯片对于一些环境中的细菌、病毒(hiv和梅毒)、微生物、寄生虫等进行了检测。该技术的特点是低价、高效、简易、容易集成、自动化程度高、可控性好、兼容性好。常用的微流控检测技术有荧光检测、紫外吸收光度检测、化学发光检测、电化学检测、质谱检测、生物传感器检测等。
液滴数字化分析是近期发展的一种高精度定量分析方法。液滴数字化分析的原理是利用液滴技术将待测靶标随机分配到大量相互隔离的微滴中,每个微滴相当于一个独立的微反应器;继而针对待测靶标在微液滴中的直接或间接信号,区分阳性和阴性液滴。阳性微滴判读为1,阴性微滴判读为0,可根据泊松分布算法实现待测靶标的绝对定量分析。与传统的分析技术相比,液滴数字化分析最突出的特点是其具有不依赖标准品的绝对定量分析能力。此外,基于大规模液滴分散体系的数字化分析在检测灵敏度和定量分析精度等方面也显著优于传统定量分析方法。鉴于微流控技术是大规模液滴操控的有利工具,微流控芯片成为数字化液滴分析的主要平台。
液滴数字化分析不依赖标准品的绝对定量分析能力,以及在灵敏度和定量分析精度方面的优势,非常有利于现场快速病毒检测,然而,此技术在这个领域的应用还鲜有报道。其主要原因在于微流控芯片上的液滴发生多依赖基于气压或注射泵等流体驱动装置。且若要现场检测,还需相应的荧光检测平台,这类装置体积较大且操作繁琐,难以应用于现场快速检测。因而希望可进一步集成相关系统,实现基于微流控平台的从采样到检测一体化的不间断快速连续采样检测,从而实现在密集地区对潜在传染源的鉴别。
总体来看,现有病原体检测技术存在一定的局限:
1)样品处理及检测过程复杂而且耗时,需要多个仪器配合;
2)检测准确率低,假阴性较高;
3)以定性检测为主,不能较好地区分亚型和相似症状的流感病毒,造成了交叉感染;
4)现场收集的样品需封装送到医院检测,缺少可以在现场进行检测的设备。为了能及时、精准地进行隔离和救治,更为有效地控制疫情的蔓延,亟需一种可在现场方便操作的准确性高的即时病原体检测技术。
技术实现要素:
本发明的目的是提供一种自动化的病原体采集检测系统及方法,实现对人群中呼吸道病毒连续快速检测。该系统首先收集呼出气体,进一步浓缩得到呼出病毒浓缩液,结合相关检测装置,能够一体化和自动化地实现病原体连续快速收集、浓缩、检测。
为解决上述技术问题,本发明提供技术方案如下:
本发明首先提供一种呼气中病原体自动检测系统,该系统包括气体中病原体回收单元、病原体浓缩单元、样品检测单元;
所述气体中病原体回收单元与病原体浓缩单元偶联,实现连续上样、连续检测;
所述病原体浓缩单元包括微通道、电极、过滤元件;所述微通道包括浓缩通道和样品通道;所述浓缩通道和样品通道之间设置有过滤元件;所述电极包括正电极和负电极,所述正电极包括若干个子正电极,若干个子正电极间隔阵列布置于靠近浓缩通道的一侧,所述负电极设置于靠近样品通道的一侧,浓缩过程中,单个子正电极上施加有大于零的波动电压,与之邻近的子正电极的电压与所述波动电压交替变化,在邻近的子正电极之间形成变化的电势差;所述气体中病原体回收单元中形成的样品流入微通道,在所述电极的作用下,所述样品中的病原体在浓缩通道的正电极一侧区域化富集,在浓缩通道中形成浓缩样品;
所述样品检测单元与所述浓缩通道相连,用于检测浓缩样品中的病原体。
更进一步的,还包括第一驱动装置,所述样品由第一驱动装置驱动进入微通道。
更进一步的,所述第一驱动装置包括正压力泵、和/或负压泵、和/或注射泵、和/或蠕动泵。
更进一步的,所述微通道的出入口处设置有驱动电极对。
更进一步的,所述样品检测单元包括微流道、温控模块、检测装置、储油装置、第二驱动装置,所述微流道的入口分别与浓缩通道和储油装置相连通,储油装置中的油由第二驱动装置驱动在微流道的入口处与浓缩样品共同形成油包水液滴样品,所述温控模块包括若干个温控单体,使微流道主体区域产生所需的温度变化,所述油包水液滴样品经扩增后,通过所述检测装置检测扩增后的病原体。
更进一步的,所述大于零的波动电压的波动形式包括矩形波、和/或三角波、和/或正弦波。
更进一步的,所述过滤元件为半透膜、和/或微柱阵列、和/或凝胶聚合物,为带有空隙的过滤结构。
更进一步的,所述浓缩通道的宽度小于样品通道的宽度。
更进一步的,所述样品通道的宽度l1和浓缩通道的宽度l2满足:
l1v1/l2v2≥x
其中,v1为样品通道的流速,v2为浓缩通道的流速,x为浓缩样品的浓度与浓缩前样品的浓度的比值。
本发明还提供一种呼气中病原体自动检测方法,该方法包括:
气体中病原体回收单元回收的样品进入病原体浓缩单元;
在正电极和负电极的作用下,病原体粒子逐渐向正电极一侧偏移,病原体粒子经过滤元件进入浓缩通道;在单个子正电极上施加大于零的波动电压,与之邻近的子正电极的电压与所述波动电压交替变化,在邻近的子正电极之间形成变化的电势差,病原体粒子在邻近的两个子正电极之间往复运动,并逐渐在邻近的两个子正电极的中间区域富集;驱动浓缩样品移动至样品检测单元;
所述浓缩样品在样品检测单元被即时检测。
更进一步的,所述单个子正电极设置有若干个,其中部分或全部单个子正电极上施加有波动电压,在其中的几个子正电极之间形成波动变化的电场,形成一个或多个富集区域;并可在富集过程中逐步减少提供电压的电极数量,形成更少的富集区,以进一步富集。
本发明与现有技术相比,具有如下有益效果:
采用本发明的呼气中病原体自动检测系统,能够实现病原体连续快速收集、浓缩、检测,是一种自动化、一体化的病原体快速检测系统。样本收集、浓缩、检测一体化,检测时间短,检测灵敏度高,检测实际消耗少,成本低,可实现连续采样和检测。其中,病原体浓缩单元通过精准的电控制,使样本浓缩效率大幅提高。极大地降低了实验场所的要求,实现公共环境的现场检测。另一方面,本发明不需要专业人员对样品的操作,降低了使用过程中的专业人员的依赖。更进一步,样品从采集开始就进行灭活,消除了样品的二次传染风险。相比于传统的病原体检测方案,本发明实现了对大量人群的快速检测,实现了病原体高灵敏检测技术的高度集成化,可用于机场、车站、公司等人群相对集中地点的病原体快速安全检测。
附图说明
图1为实施例中呼气中病原体自动监测系统的结构原理图;
图2为实施例中微流控芯片以及温控反应示意图;
图3为实施例中在一组邻近的子正电极(子正电极a、子正电极b)上施加的电压示意图;
图4为图3中t1时刻的电场分布图;
图5为图3中t2时刻的电场分布图;
图6为病原体颗粒在图3中子正电极a和子正电极b之间的富集状态图。
图中标记:1、病原体回收单元;1-1、进气口;1-2、冷却模块;1-3、收集器;1-4、过滤器;1-5、风扇;2、病原体浓缩单元;2-1、浓缩通道;2-2、样品通道;2-3、过滤元件;2-4、正电极;2-5、负电极;2-6、废液池;3、样品检测单元;31、微流控扩增模块;31-1、液滴生成位置;31-2、微流道;31-3、在片式荧光检测位置;31-4、毛细管片外荧光检测位置;31-5、温控模块;32、荧光检测模块;4、计算机。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
在本实施例的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。
本实施例提供一种如图1所示的呼气中病原体自动检测系统。该呼气中病原体自动检测系统包括气体中病原体回收单元1、病原体浓缩单元2、样品检测单元3。
其中,气体中病原体回收单元1与病原体浓缩单元2偶联,本发明对该气体中病原体回收单元1的具体结构和形式不做限定,凡是能够与病原体浓缩单元2偶联实现连续上样、连续检测功能的装置均包含在本发明的保护范围之内。本实施例中,气体中病原体回收单元1以冷却收集方式为例进行说明,其结构包括进气口1-1、冷却模块1-2、收集器1-3。为了便于呼出气体的收集和提高系统检测的可连续性,可以在进气口1-1位置安装一次性吹气嘴,进气口1-1是整个系统的进气入口,每次使用完毕即更换该一次性吹气嘴。冷却模块1-2连接于进气口1-1下游,可由负压收集样品。呼出气体从进气口1-1进入气体中病原体回收单元1,经冷却模块1-2冷却形成的样品由收集器1-3收集并经由管路输送至病原体浓缩单元2。气体中病原体回收单元1还可以包括过滤器1-4和风扇1-5,样品以外的呼气在风扇1-5的作用下经过滤器1-4后输出进行无菌无毒处理。
其中,所述病原体浓缩单元2包括电浓缩装置,电浓缩装置包括微通道、电极、过滤元件2-3。微通道包括浓缩通道2-1和样品通道2-2,在浓缩通道2-1和样品通道2-2之间设置有过滤元件2-3(该过滤元件2-3可以是半透膜、和/或微柱阵列、和/或凝胶聚合物,和/或其它带有空隙的过滤结构的过滤元件2-3)。电极包括正电极2-4和负电极2-5(负电极2-5可采用接地方式),正电极2-4包括若干个子正电极,若干个子正电极间隔阵列布置于靠近浓缩通道2-1的一侧,负电极设置于靠近样品通道2-2的一侧。浓缩过程中,单个子正电极上施加有大于零的波动电压,所述大于零的波动电压的波动形式包括矩形波、和/或三角波、和/或正弦波等,本实施例中,该波动电压优选为如图3所示的矩形波状电压,与之邻近的子正电极的电压与所述波动电压交替变化,在邻近的子正电极之间形成变化的电势差。需要说明的是,此处所说的“邻近”并非指物理位置上的相邻,而是指具有交替变化的电压关系的最相邻的两个子正电极,例如,当某一个或某几个子正电极接地时,邻近的两个子正电极之间可能跨越了一个或某几个子正电极。样品从微通道的入口流入微通道,在电极的作用下,样品中的病原体在浓缩通道2-1的正电极2-4一侧区域化富集,在浓缩通道2-1中形成浓缩样品。废液从样品可以驶出后进行无害化处理,例如,可以在样品通道2-2的出口设置一废液池2-6。该电浓缩装置可实现低浓度的病原体样本快速浓缩并即时检测。
本实施例中,为了进一步控制样品在微通道中的流动,可以在微通道的出入口处设置驱动电极对。例如,在微通道的进口处设置驱动负电极,在微通道的出口处设置驱动正电极,这样,样品在样品通道2-2中受到流场和电场的双重作用,流场和电场共同对病原微生物颗粒提供向前流动的动力;又如,在微通道的进口处设置驱动正电极,在微通道的出口处设置驱动负电极,这样,可以通过减小样品在微通道中流动的速度,延长浓缩过程的时间。
本实施例中,浓缩通道2-1的宽度优选为小于样品通道2-2的宽度,当浓缩样品的浓度为浓缩前样品的浓度的x倍以上时,(以下以100倍为例进行说明),假设样品通道2-2的宽度l1,浓缩通道2-1的宽度l2,两个流道高度一致为h,样品通道2-2的流速v1,浓缩通道2-1的流速v2,样品通道2-2现有m个样本需要在t时间内浓缩至浓缩通道2-1,则:
流量:q=lhvt;
含量:w=m/q;
为使浓缩后的浓度至少是浓缩以前的100倍,则w2≥100w1;
则有:m/l2h2v2t≥100m/l1h1v1t;
则有:l1v1/l2v2≥100。
其中,所述样品检测单元与浓缩通道2-1相连,样品在流场和/或电场的作用下从浓缩通道2-1的出口流动至样品检测单元。样品检测单元用于检测浓缩样品中的病原体,经样品检测单元3检测后的浓缩样品可输出后进行无害化处理。本实施例中,样品检测单元3优选包括微流控扩增模块31和荧光检测模块32。其中:
所述微流控扩增模块31包括微流道31-2、温控模块31-5、储油装置、驱动装置。微流道31-2优选为如图2所示的曲折的pcr蛇形结构,所述微流道31-2的入口分别与浓缩通道2-1和储油装置相连通,储油装置中的油由驱动装置驱动在微流道31-2的入口处(即如图2中所示的液滴生成位置31-1)与浓缩样品共同形成油包水滴状的液滴样品。该液滴停留在微流道31-2的反应区域,并且在温控模块31-5的作用下反应。温控模块31-5包括若干个间隔设置的温控单体,使微流道31-2主体区域产生所需的温度变化,油包水液滴样品经扩增后,通过所述检测装置检测扩增后的病原体。
所述荧光检测模块32包可以采用光学检测器件,可通过光学检测器件和计算机4配合实现检测结果的分析和报告。如图2所示,所述光学检测器件的检测位置可以是在微流控芯片上直接检测的在片式荧光检测位置31-3,也可以是在微流控芯片之外的毛细管片外荧光检测位置31-4。
本实施例优选采用荧光检测方法进行检测,首先使含有病原体的液滴经过扩增反应后产生荧光。液滴中扩增反应产生荧光信号可以采用以下几种方法实现:
1、taqman探针法荧光定量pcr法
本方法中,引物设计优选包括以下步骤:根据genbank中禽流感病毒aiv的h9亚型禽流感病毒血凝素基因序列,用dnaman软件进行同源性分析,采用primerexpress5.0软件,在其保守区域设计特异性引物和taqman荧光探针。所述的taqman荧光探针标记一个报告荧光基团如fam,joe,cy5,rox等和一个淬灭荧光基团优选bhq1和bhq2。引物及探针序列为:探针5’fam-ctcaccatttattcgactgtcgcctc-bhq13’,上游引物:5’caattcggaacgggacct3’和下游引物:5’acaggaaggcagcaaacc3’。所述荧光定量pcr扩增的反应体系使用taq酶反应体系。荧光定量pcr扩增的反应条件为:95℃变性5min;以95℃5s,55℃20s,共40个循环,在55℃进行荧光检测。
2、rt-pcr荧光染料法快速检测法
本方法中,针对h9n2亚型禽流感病毒进行rt-pcr荧光染料快速检测,所用荧光染料为sybrgreeni,不限制其他荧光染料。将富集的病毒粒子用trizol方法进行rna的提取,然后将rna作为模板,通过rt-pcr荧光染料方法进行h9n2亚型流感病毒ha基因的特异性检测。设计引物为f:5’cctcaccatttattcgactgt3’和r:5’ayccattgracatggcccag3’。将sybrgreeni荧光染料加入到pcr反应体系建立荧光rt-pcr方法。反应条件为42℃5min,95℃10s,95℃5s,60℃34s共40个循环。
3、lamp检测法
本方法中,将h9n2亚型禽流感病毒富集后进行rna提取,反转录成cdna后采用环介导等温扩增技术(lamp)反应体系进行检测。针对h9n2亚型禽流感病毒设计引物如下:
fip5’cgttgttcttttgagtcaaccatc-acaagcaaagcatgttcag3’
bip5’agacgcccaatacacaaataataga-gtctgcgcagtatcagtg3’
f35’ggaatgtgcttacagtgga3’
b35’tgtcaatccttgtgtacagat3’
反应条件为恒温60℃~65℃反应30~90min。lamp方法扩增过程中加入了sybrgreeni染料,根据液滴是否出现荧光证明病原体是否存在。
本实施例还提供利用上述呼气中病原体自动检测系统进行呼气中病原体自动检测的方法。该方法包括:
s1、气体中病原体回收单元1回收的样品进入病原体浓缩单元2;
s2、冷凝液样品的浓缩;
s2-1、在正电极2-4和负电极2-5的作用下,病原体粒子逐渐向正电极2-4一侧偏移,病原体粒子经过滤元件进入浓缩通道2-1,废液进入样品通道2-2;
s2-2、如图3所示,在单个子正电极上施加大于零的波动电压,与之邻近的子正电极的电压与所述波动电压交替变化,在邻近的子正电极之间形成变化的电势差。需要说明的是,子正电极可以设置多个,当子正电极设置有多个时,正电极包含有多组邻近的子正电极,而图3中仅以其中一组(即邻近的子正电极a和b)进行示例说明。其中,t1时刻的电场分布如图4所示,t2时刻的电场分布图如图5所示。病原体粒子在邻近的两个子正电极之间往复运动,并逐渐在邻近的两个子正电极的中间区域富集,多个子正电极控制下所形成的区域富集状态如图6所示;通过该步骤形成的聚集有病原体颗粒的富集区域可以有多个,也可以通过调整电极的工作与否形成少数几个甚至一个富集区域,这样就使得呼气中的病原体得到有效浓缩,不仅大大减少了气体收集冷凝单元所需收集的呼气量,而且提高了浓缩样品中病原体可被检测的几率,从而可以极大地提高检测的便捷性和准确性;仅微量的浓缩样品即可被送入样品检测单元3检测,从而有利于实现系统的小型化和检测的连续性;
本实施例中,该步骤的优选控制方法为:设置若干个单个子正电极,其中在部分或全部子正电极上施加波动电压,在其中的几个子正电极之间形成波动变化的电场,形成一个或多个富集区域;并可在富集过程中逐步减少提供电压的电极数量,形成更少的富集区,以进一步富集。
以下以一种优选的方案进行示例说明(假设单个子正电极设置有n个,依序编号为1、2、3、4……n):
首先,在第1、3、5……个子正电极上施加大于零的波动电压,在第2、4、6……个子正电极上施加与所述波动电压呈交替变化趋势的交变电压,直至病原体粒子在第1和2个子正电极之间、第2和3个子正电极之间、第3和4个子正电极之间……富集,形成a个富集区域;
然后,控制使第2、4、6……个子正电极接地,在第1、5、9……个子正电极上施加大于零的波动电压,在第3、7、11……个子正电极上施加与所述波动电压呈交替变化趋势的交变电压,直至病原体粒子在第1和3个子正电极之间、第3和5个子正电极之间、第5和7个子正电极之间……富集,形成数量小于a的b个富集区域;
然后,进一步控制使第3、7、11……个子正电极接地,在第1、9、17……个子正电极上施加大于零的波动电压,在第5、13、21……个子正电极上施加与所述波动电压呈交替变化趋势的交变电压,直至病原体粒子在第1和5个子正电极之间、第5和9个子正电极之间、第9和13个子正电极之间……富集,形成数量小于b的c个富集区域;
依此类推,使病原体颗粒富集区域逐渐减少,同时每个富集区域浓缩的病原体颗粒量逐渐增多。
s2-3、控制使正电极2-4接地,浓缩样品被运至样品检测单元3;
s3、浓缩样品在样品检测单元3被即时检测。
该优选的控制方法可有序地使病原体颗粒浓缩成所需浓度的浓缩样品。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



