一种基于磁珠靶向富集目标基因的核酸提取方法及其应用与流程
 2021-02-02 18:02:47|
2021-02-02 18:02:47| 397|
397| 起点商标网
起点商标网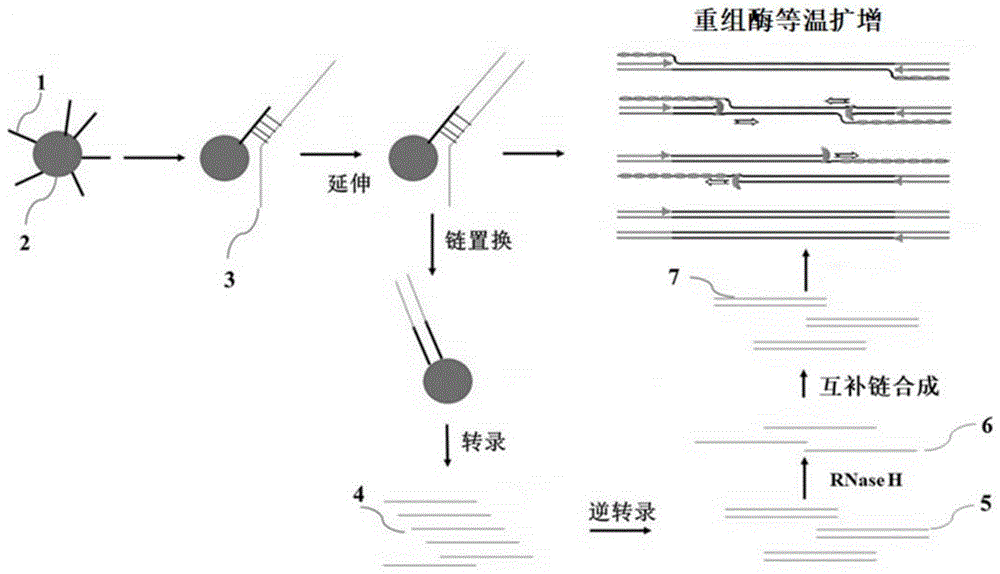
本发明属于分子生物学领域,涉及一种基于磁珠靶向富集目标基因的核酸提取方法及其应用。
背景技术:
:pcr扩增技术是一项重要的核酸检测技术,但前期的样本处理、核酸提取对于核酸检测的结果同样起到了至关重要的结果。核酸提取的纯度和浓度直接影响了pcr的结果,因此更好的核酸提取技术将能够大幅提高pcr检测的特异性和灵敏度。在重组酶等温扩增中,复杂的背景核酸还会造成靶标基因扩增的抑制,带来假阴性的检测结果。常规的核酸提取如柱提法等提取总dna或rna,在样本中核酸含量较高的情况下会造成假阴性结果。brittanyrohrman等研究发现,复杂的背景dna抑制了重组酶等温扩增的扩增,从而使结果变为阴性,且经常会出现在临床样本中,会影响临床样本检测的准确性(详见rohrman,b.,&richards-kortum,r.(2015).inhibitionofrecombinasepolymeraseamplificationbybackgrounddna:alateralflow-basedmethodforenrichingtargetdna.analyticalchemistry,87(3),1963–1967.)。重组酶等温扩增的反应特点使其需要准确的控制扩增反应中的核酸起始含量,这便给重组酶等温扩增用于临床检测造成了很大的不方便。同时,重组酶等温扩增还具有一定的局限性,例如,cn101333565a公开了一种核酸的恒温同步放大检测方法及其应用。该方法中利用带有t7启动子的引物对rna序列进行扩增,但该方法只能对rna序列进行扩增,而不能便捷对dna进行等温扩增,dna样本需要高温变性后才能检测。另外,目前常规的核酸提取主要包括过柱法和磁珠法,常见的提取方法是以全dna或全rna为提取对象,当需要针对某个或几个特定基因进行检测时,如特定基因检测诊断试剂,全基因组或总rna的提取方法在针对微量样本时就很容易造成待测基因的损失,从而导致pcr结果的假阴性。因此,也出现了一些靶向核酸富集方法。其中,磁珠靶向富集技术多采用生物素-亲和链霉素方式进行靶向基因富集,但是生物素-亲和链霉素不耐受高温,不适用于高温裂解样本的方法,导致样本的裂解和核酸提取需要分步进行,增加了操作步骤。因此,为了解决复杂背景核酸抑制重组酶等温扩增反应的问题,提高核酸扩增的灵敏度和准确性,本领域亟需开发一种更加便捷且快速有效的核酸靶向富集分离方法。技术实现要素:鉴于现有技术中存在的问题,通过氨基和羧基的缩合反应将捕获探针和磁珠偶联在一起与样本裂解液混合,一步完成核酸富集。同时,联合重组酶等温扩增技术使用,能够解决样本中复杂背景核酸抑制扩增的问题,解决重组酶等温扩增的实际应用问题。同时,磁珠靶向提取联合转录和重组酶等温扩增,能够检测出低丰度的样本,提高重组酶等温扩增的应用价值。为达此目的,本发明采用以下技术方案:第一方面,本发明提供一种基于磁珠靶向富集目标基因的核酸提取方法,包括如下步骤:(1)合成捕获探针,所述捕获探针包括顺次连接的启动子和与目标基因互补的核苷酸,并在所述捕获探针的5′末端修饰氨基或羧基;(2)通过氨基羧基缩合反应将磁珠与所述捕获探针相连,得到捕获磁珠;(3)将所述捕获磁珠、样本裂解液与待测样本混合,加热,所述捕获磁珠上的捕获探针与待测样本中的目标基因互补配对;(4)除去样本裂解液及杂质,得到结合目标基因的捕获磁珠。本发明中,根据所需检测的核酸序列设计捕获探针,合成5′末端携带羧基或氨基修饰的捕获序列,所述捕获探针的5′端连接启动子,包括t3启动子、t5启动子、t7启动子、sp6启动子或p35启动子等启动子序列。通过缩合反应将捕获探针与带有氨基或羧基的磁珠偶联,将含有磁珠的裂解液与样本混合、加热,使捕获探针结合目标基因,通过磁铁吸附,获得目标基因,吸附有靶核酸的磁珠直接加入pcr反应体系中。本发明中,采用携带启动子的捕获序列,可对dna与rna进行转录,放大扩增起始序列,提高检测灵敏度。在捕获探针结合目标基因后,当目标基因为dna时,探针在dna聚合酶的作用下延伸出靶核酸互补序列,接着以经过延伸的捕获探针为模板,在单链结合蛋白、重组酶以及dna聚合酶的作用下合成其互补链。针对dna靶标,可以在序列不同位置设计分别针对正义链和反义链的捕获探针,从而最大限度进行靶向基因捕获;当目标基因为rna时,探针在逆转录酶作用下,延伸获得与靶核酸互补的cdna序列,在rnaseh和dna聚合酶的作用下合成cdna链的互补序列。随后在rna聚合酶和逆转录酶作用下获得大量含有目标基因的cdna序列,极大提高检测灵敏度。因此,本发明提供的方法针对特定基因进行富集,既可以应用于重组酶等温扩增反应中,避免过量的复杂背景核酸造成的扩增抑制,还可以用于对样本中微量的靶基因进行富集,提高检测的灵敏度。同时也可作为pcr检测的上游核酸提取纯化步骤,该靶向富集方法不仅可以结合重组酶等温扩增等核酸扩增方法、常规realtimepcr,还可以结合多种不同的pcr检测方法,提升检测效果,具有广泛的应用范围。本发明中,在需要进行多重pcr反应时,可以设计针对多个靶标的捕获探针,即磁珠上可以连接不同的捕获探针。优选地,步骤(1)中所述启动子包括包括t3启动子、t5启动子、t7启动子、sp6启动子或p35启动子等启动子序列,本发明中并不局限与上述种类的启动子,其他可实现相同功能的启动子同样适用,优选为t7启动子。优选地,步骤(1)中所述捕获探针的长度为20~200nt,例如可以是30nt、50nt、60nt、80nt、100nt、120nt、130nt、150nt、160nt或180nt等。优选地,步骤(1)中所述捕获探针的gc含量为30~70%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%或70%等。作为本发明优选的技术方案,所述捕获探针的5′末端修饰氨基时,所述磁珠表面修饰羧基。相应的,所述捕获探针的5′末端修饰羧基时,所述磁珠表面修饰氨基。优选地,在所述捕获探针的5′端进行氨基修饰,游离的3′端可以以捕获到的核酸序列为模板,进行自发延伸,从而增加靶标基因含量。此外,磁珠与捕获探针也可通过链霉亲和素与生物素及生物素衍生物包括desthiobiotin、desthiobiotin-teg、biotin-teg等,以及通过fitc与fitc抗体、fam与fam抗体等方式相互连接,考虑上述修饰方法对高温的不耐受,可首先将经上述修饰的捕获探针与样本高温反应,待温度降至室温后,再加入具有相对应修饰的磁珠,结合捕获探针。优选地,步骤(2)中所述磁珠的直径为50~1000nm,例如可以是50nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm或1000nm等。优选地,步骤(2)中所述磁珠可以是硅基磁珠、聚苯乙烯磁性微球、gma磁珠或琼脂糖磁珠等不同类型的磁珠,本方案所采取的的为聚苯乙烯磁性微球。优选地,步骤(2)中所述缩合反应前,加入活化剂对磁珠上的羧基或捕获探针上的羧基进行活化。优选地,所述活化剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和/或n-羟基琥珀酰亚胺(nhs)。本发明中,捕获磁珠制备时可采用如下反应体系:作为本发明优选的技术方案,步骤(3)中所述样本裂解液为包含异硫氰酸胍、十二烷基硫酸钠和三羟甲基氨基甲烷的无核酸酶水。优选地,所述异硫氰酸胍的摩尔浓度为0.1~5m,例如可以是0.1m、0.5m、1m、1.5m、2m、2.5m、3m、4m或5m等。优选地,所述十二烷基硫酸钠的质量浓度为0.1~1.5%,例如可以是0.2%、0.4%、0.6%、0.8%、0.9%、1%、1.1%、1.2%、1.3%或1.4%等。优选地,所述三羟甲基氨基甲烷的摩尔浓度为0.05~0.15m,例如可以是0.06m、0.08m、0.1m、0.11m、0.12m、0.13m或0.14m等。优选地,步骤(3)中所述样本裂解液的ph为6.0~8.0,例如可以是6.1、6.3、6.5、6.7、6.9、7.1、7.3、7.5、7.7或7.9等。优选地,步骤(3)中所述加热的温度为80~100℃,例如可以是83℃、85℃、87℃、91℃、92℃、93℃、94℃、96℃、97℃、98℃或99℃等,优选为95℃。优选地,步骤(3)中所述加热的时间为5~10min,例如可以是6min、7min、8min或9min等。作为本发明优选的技术方案,步骤(4)中所述除去样本裂解液及杂质的方法为:使用磁铁吸附所述捕获磁珠,除去样本裂解液及杂质,加入清洗缓冲液清洗。优选地,所述清洗缓冲液包括tris-hcl缓冲液或无核酸酶水等。优选地,步骤(4)中所述结合目标基因的捕获磁珠保存于核酸保存液中。优选地,所述核酸保存液包括无核酸酶水或te(10mmph为8.0的tris-hcl,1mmedta)缓冲液等。作为本发明优选的技术方案,所述核酸提取方法包括如下步骤:(1)制备捕获探针,所述捕获探针的长度为20~200nt,gc含量为30~70%,且所述捕获探针上连接t7启动子,并在所述捕获探针的5′末端修饰氨基或羧基;(2)在所述捕获探针的5′末端修饰氨基,在磁珠表面修饰羧基;或者,在所述捕获探针的5′末端修饰羧基,在磁珠表面修饰氨基;(3)使用活化剂活化羧基,通过氨基羧基缩合反应将磁珠与所述捕获探针相连,得到捕获磁珠;(4)将所述捕获磁珠、样本裂解液与待测样本混合,80~100℃加热5~10min,冷却,所述冷却可以是自然冷却,也可以是通过程序降温,使其缓慢冷却;其中,所述样本裂解液为包含0.1~5m异硫氰酸胍、质量浓度0.1~1.5%十二烷基硫酸钠和0.05~0.15m三羟甲基氨基甲烷的无核酸酶水;(5)使用磁铁吸附磁珠,再加入tris-hcl缓冲液清洗,而后将结合目标基因的捕获磁珠分散于无核酸酶水中,悬浮磁珠并保存。第二方面,本发明提供一种如第一方面所述的核酸提取方法在核酸扩增和/或核酸检测中的应用。其中,所述核酸扩增包括如下步骤:将结合目标基因的捕获磁珠与核酸扩增反应液混合,进行核酸扩增;或者,将所述目标基因与捕获磁珠分离后,再加入核酸扩增反应液,进行核酸扩增。第三方面,本发明还提供一种如第一方面所述的核酸提取方法进行核酸扩增的试剂盒,所述试剂盒包括:核酸靶向富集磁珠、样本裂解液、清洗缓冲液、核酸保存液、扩增反应液、扩增引物和扩增缓冲液。优选地,所述扩增反应液包括rna聚合酶、dna聚合酶(链置换dna聚合酶)、逆转录酶、单链结合蛋白、重组酶、rnaseh和核酸外切酶iii。优选地,所述扩增缓冲液包括:tris缓冲液、二硫苏糖醇、dntps、ntps、atp、磷酸肌醇和醋酸镁。优选地,所述试剂盒中还包括探针,所述探针为经过修饰的荧光探针。第四方面,本发明还提供一种如第三方面所述的试剂盒的使用方法,具体包括如下步骤:将结合目标基因的捕获磁珠与试剂盒中的扩增缓冲液混合;或者,将目标基因与捕获磁珠分离,再与试剂盒中的扩增缓冲液混合;加入rna聚合酶、dna聚合酶(链置换dna聚合酶)、逆转录酶、单链结合蛋白、重组酶、核酸外切酶iii、扩增引物和荧光探针,对所述目标基因进行核酸扩增检测。优选地,所述使用方法中还包括荧光采集的操作。本发明中,捕获磁珠捕获目标序列后可取1~10μl磁珠直接加入核酸扩增反应液。或者,将所述目标基因与捕获磁珠分离,例如:(1)通过加热至95℃,然后快速冷却,使捕获序列与靶向序列分离,靶向序列与捕获磁珠分离,磁铁吸附磁珠后,取上清液1~10μl,加入核酸扩增反应液;(2)通过核酸外切酶iii,将双链部分降解,使靶向序列与捕获磁珠分离,加热使外切酶失活,再取上清液1~10μl,加入核酸扩增反应液;(3)通过碱液处理,打断核酸序列,加入核酸扩增反应液;(4)当靶标序列为rna时,可通过dna酶处理,消化dna,使rna与捕获磁珠分离,加热使dna酶失活,取上清液1~10μl,加入核酸扩增反应液。本发明中,所述的核酸扩增反应体系中可以包含如下组分:优选地,当检测序列为dna时,捕获探针在5′端进行修饰,与磁珠偶联,捕获探针含有启动子序列,捕获探针与靶标dna结合后,游离3′端在dna聚合酶,包括taq酶、bst、bsu、phi29等聚合酶的作用下,以靶标dna为模板,生成互补dna序列1。然后在dna聚合酶、重组酶、单链结合蛋白的作用下合成与dna序列1互补的dna序列2。此时,dna序列1和2具有启动子序列,在rna聚合酶作用下合成rna,rna在逆转录酶作用下逆转录为cdna。cdna可在dna聚合酶、重组酶、单链结合蛋白的作用下被大量扩增。优选地,当检测序列为rna时,捕获探针在5′端进行修饰,与磁珠偶联,捕获探针含有启动子序列,捕获探针与靶标rna结合后,游离3′端在逆转录酶反应体系作用下,以靶标rna为模板,生成cdna。然后在rnaseh以及dna聚合酶的作用下,合成与cdna链互补的dna序列。此时,捕获探针序列及其互补序列具有启动子序列。同时,在启动子和rna聚合酶作用下合成rna,rna继而逆转录为cdna。进而进入等温扩增循环,在dna聚合酶、重组酶、单链结合蛋白的作用下对目标片段进行大量扩增。本发明中,使用荧光探针对对产生的dna序列进行实时检测。优选地,本发明中可以使用携带脱嘌呤/脱嘧啶修饰的荧光探针对dna序列进行检测,该探针与目标dna序列结合后,可在核酸外切酶iii或内切酶iv的作用下进行切割。本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。与现有技术相比,本发明至少具有以下有益效果:(1)本发明中,使用含有t7或其它启动子的捕获序列结合靶序列后,通过dna聚合酶或逆转录酶的作用,可产生与dna或rna靶标序列互补的序列,在等温扩增体系中,再次合成与捕获序列互补的序列,从而将启动子序列引入待测序列,通过rna聚合酶对包括dna和rna的待测序列进行放大,增强检测灵敏度,缩短检测时间。(2)本发明提供的基于磁珠靶向富集目标基因的核酸提取方法,根据所需检测的核酸序列设计捕获探针,通过缩合反应将捕获探针与磁珠偶联,而后与样本混合,该方法能够将样本中的目标核酸进行靶向富集,从而减少背景核酸对扩增的影响,将携带启动子的捕获探针与重组酶等温扩增结合,可消除由背景核酸复杂性引起的重组酶等温扩增检测假阴性结果,同时可使检测灵敏度进一步提高,大幅提高重组酶等温扩增的实用性。(3)本发明提供的基于磁珠靶向富集目标基因的核酸提取方法,可将捕获磁珠直接加入pcr反应体系,捕获探针3′游离序列可以以所结合序列为模板,进行延伸,放大pcr反应起始含量,提高检测灵敏度;(4)该方法能够靶向富集样本中的目标核酸,可适用于dna、rna的靶向性富集提取,能够结合pcr、等温扩增等核酸检测方法,操作简便快捷。附图说明图1为本发明提供的核酸提取、扩增以及检测方法的原理示意图;其中,1-捕获探针,2-磁珠,3-目标核酸序列,4-rna序列,5-cdna/rna复合双链,6-cdna,7-双链dna序列。图2为实施例1中未将磁珠与目标核酸分离进行扩增后反应液中目标核酸的荧光强度曲线图。图3为实施例1中将磁珠与目标核酸分离再进行扩增后反应液中目标核酸的荧光强度曲线图。图4为实施例2中在不同背景下进行扩增后反应液中目标核酸的荧光强度曲线图。图5为实施例3中在有t7启动子和无t7启动子的情况下扩增目标rna后得到的荧光强度曲线图。图6为实施例4中分别采用t3启动子和t7启动子扩增后产物的荧光强度曲线图。图7为实施例5中不同模拟样本扩增后得到的产物荧光强度曲线图。具体实施方式下面结合附图并通过具体实施方式来进一步说明本发明的技术方案,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。首先,结合图1对本实施例中涉及的核酸提取、扩增以及检测方法的原理进行简单描述:(1)核酸提取:在磁珠2上连接带有携带启动子的捕获探针1,捕获序列与磁珠通过氨基羧基缩合反应形成;而后捕获序列与待测样本中的目标核酸序列3互补配对,实现目标核酸的富集;(2)扩增:在dna聚合酶或者逆转录酶等的作用下,捕获探针的3′端开始延伸,而后一部分片段在dna聚合酶、重组酶、单链结合蛋白的作用下直接开始扩增,另一部分片段在链置换dna聚合酶的作用下合成与带有启动子序列互补序列,而后转录得到rna序列4,而后在逆转录酶的作用下得到cdna/rna复合双链5,通过rnaseh的作用得到单链的cdna6;随后在dna聚合酶的作用下合成互补链,得到双链dna序列7并进行重组酶扩增;(3)检测:使用与dna互补配对的荧光探针进行检测。以下实施例中,自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件;所用序列均由上海捷瑞生物公司合成。实施例1本实施例中利用所述核酸提取方法靶向捕获新冠状病毒orf1ab基因的dna序列并采用realtimepcr进行扩增检测。1、合成orf1ab基因dna序列,连接入puc57质粒orf1ab基因dna序列如下所示(seqidno.1):tagatgatgatagtcaacaaactgttggtcaacaagacggcagtgaggacaatcagacaactactattcaaacaattgttgaggttcaacctcaattagagatggaacttacaccagttgttcagactattgaagtgaatagttttagtggttatttaaaacttactgacaatgtatacattaaaaatgcagacattgtggaagaagctaaaaaggtaaaaccaacagtggttgttaatgcagccaatgtttaccttaaacatggaggaggtgttgcaggagccttaaataaggctactaacaatgccatgcaagttgaatctgatgattacatagctactaatggaccacttaaagtgggtggtagttgtgttttaagcggacacaatcttgctaaacactgtcttcatgttgtcggcccaaatgttaacaaaggtgaagacattcaacttcttaagagtgcttatgaaaattttaatcagcacgaagttctacttgcacc引物f:5′-cttactgacaatgtataca-3′(seqidno.2)引物r:5′-gtagccttatttaaggctc-3′(seqidno.3)荧光探针:5′-fam-aacagtggttgttaatgcagccaat-bhq1-3′(seqidno.4)2、捕获探针制备捕获探针的序列如seqidno.5所示(包含t7启动子,下划线部分为t7启动子序列和靶标基因互补序列,且其5'端连接氨基):5'-nh2c6-taatacgactcactatagggagacagtgtttagcaagattgtgtccgctt-3',该序列中在5'端连接的c6中的“c”指的是碳原子,而非胞嘧啶;通常用于在核酸序列上修饰氨基;3、捕获磁珠制备制备体系如下:实验步骤:(1)制备上述反应体系后,涡旋混匀,37℃孵育4h,每隔30min涡旋混匀1次;(2)反应结束后短暂离心收集管盖及壁上磁珠,置于磁力架上,弃上清;(3)加入500μl1mnahco3室温洗涤2次;(4)加入500μl1mnahco3孵育30min;(5)加入500μl无核酸酶水室温洗涤1次,弃废液;(6)加入500μl0.01%proclin重悬磁珠,获得偶联磁珠,4℃保存。4、样本靶向富集(1)取2ml不同浓度的质粒模拟样本(保存于0.5m异硫氰酸胍溶液中),106拷贝/ml,105拷贝/ml,104拷贝/ml,103拷贝/ml,102拷贝/ml,加入25μl带有捕获探针的磁珠;(2)涡旋混匀后,92℃孵育10min;(3)反应结束后短暂离心收集管盖及壁上磁珠,置于磁力架上,弃上清;(4)加入500μl洗液(无核酸酶去离子水),瞬离收集管盖及壁上磁珠,置于磁力架上,弃上清;(5)加入50μl核酸保存液(无核酸酶去离子水),震荡混匀,置于4℃保存;磁珠和靶序列分离:取25μl核酸磁珠混合液,置于95℃孵育10min。离心,趁热分离磁珠和核酸,保留上清。5、pcr检测(1)试剂:taqdna聚合酶、dntp、mgcl2(上海生工)(2)体系:组分名称用量组分名称用量taq酶1μl10μm引物f1μl10xbuffer2.5μl10μm引物r1μlmgcl22μl10μm荧光探针0.8μldntp1μl核酸5μlh2o10.7μl按上述体系,分别加入与磁珠分离或不分离的核酸5μl;(3)检测程序:6、实验结果如图2所示,其中加入的是5μl磁珠混合液;如图3所示,其中加入的5μl热洗脱上清,在扩增一段时间之后,能检测到靶向序列,说明捕获磁珠能够有效捕获和富集靶向序列。同时,结果还表明可将磁珠直接加入pcr反应液,进行pcr检测,也可将捕获到的靶向序列与磁珠分离,再加入pcr反应体系进行检测。两种方法相比,直接将磁珠加入pcr反应液中可以简化实验步骤,同时可以获得更好的扩增灵敏度,理由如下:首先,通过预延伸步骤,以捕获探针的3′端为引物,延伸出与靶基因互补的序列,在理论上将待测的起始基因量增加一倍,提高检测灵敏度;其次,将捕获到的靶基因与磁珠分离后再加入pcr体系,相比将磁珠直接加入pcr反应体系,会造成一定的基因损失,导致检测灵敏度有所降低。实施例2本实施例用于比较靶向捕获重组酶等温扩增与过柱提取重组酶等温扩增的效果。以helacelldna作为背景dna,模拟复杂背景dna样本情况下,对重组酶等温扩增检测的影响。使用实施例1中的质粒,作为检测靶标基因。待测样本1中含有hela细胞1×109/ml和质粒10000拷贝/ml;待测样本2中含有hela细胞3×108/ml和质粒10000拷贝/ml;待测样本3中含有hela细胞109/ml和质粒1000拷贝/ml;待测样本4中含有hela细胞3×108/ml和质粒1000拷贝/ml;其中所述质粒为实施例1中含有orf1ab基因序列的质粒。采用常规核酸柱提法与靶向富集法进行样本处理并进行重组酶等温扩增实验。实验步骤:1、按照实施例1中所述的方法制备靶向捕获磁珠;捕获探针序列同实施例1中捕获序列(seqidno.5)。2、样本提取a)靶向富集法:取2ml各个浓度样本,按照实施例1进行靶向富集;b)过柱提取法:取2ml各个浓度样本,使用购买的商品化dna提取试剂盒(dna柱提法试剂盒购自天根生化科技(北京)有限公司),按照操作说明进行核酸提取;两种提取方法均加入50μl核酸保存液,置于4℃保存。3、重组酶等温扩增检测(1)扩增体系:60mmtris(ph7.2)、6mm二硫苏糖醇、5%聚乙二醇、5mmatp、1.5mmdntps、100μm磷酸肌醇、50ng/μl单链结合蛋白ssb、10ng/μlrecq、50ng/μluvsx、50ng/μluvsy、70ng/μlbsu、10urnaseh、1u核酸外切酶iii、1μm引物f、1μm引物r、0.8μm荧光探针、20mm醋酸镁;制备完成后,取35μl,加入5μl的样本提取液。引物f:5′-gttgttcagactattgaagtgaatagtttta-3′(seqidno.6)引物r:5′-gtagccttatttaaggctcctgcaacacctcctc-3′(seqidno.7);荧光探针:5′-gtggaagaagctaaaaaggtaaaaccaacag/i6famdt/g/idsp/ibhq1dt/tgttaatgcagccaac3spacer-3′(seqidno.8)其中:i6famdt为6-fam荧光素修饰的胸腺嘧啶t-残基;idsp为无碱四氢呋喃thf残基;ibhq1dt为bhq1淬灭基团修饰的胸腺嘧啶t-残基;c3spacer表示c3中的“c”指的是碳原子,而非胞嘧啶。检测程序:步骤程序温度时间循环数1预热40℃1秒12延伸及荧光采集40℃30秒304、实验结果如图4所示,曲线“磁珠-1”、“磁珠-2”、“磁珠-3”、“磁珠-4”分别表示的是用磁珠提取的待测样本1~4的实验结果,曲线“过柱-1”、“过柱-2”、“过柱-3”、“过柱-4”表示的是用过柱法进行提取的待测样本1~4的实验结果;图中,在处理高浓度的dna的样本时,采用柱提法进行核酸提取,提取液中含有的复杂背景dna显著的抑制了重组酶等温扩增的扩增效率,而采用核酸靶向富集,则可以去除背景dna,只保留靶标基因,使重组酶等温扩增能够进行很好的扩增,充分发挥其检测优势。实施例3本实施例中使用所述核酸提取方法靶向捕获新冠状病毒n基因的rna序列。同时对比使用含有启动子序列与不含启动子序列的捕获探针对扩增灵敏度的影响。1、合成n基因dna序列,在序列5′端加上t7启动子序列(下划线序列为t7启动子),连接入puc57质粒n基因dna序列如下所示(seqidno.9):taatacgactcactatagggtaatacgactcactataggggggagccttgaatacaccaaaagatcacattggcacccgcaatcctgctaacaatgctgcaatcgtgctacaacttcctcaaggaacaacattgccaaaaggcttctacgcagaagggagcagaggcggcagtcaagcctcttctcgttcctcatcacgtagtcgcaacagttcaagaaattcaactccaggcagcagtaggggaacttctcctgctagaatggctggcaatggcggtgatgctgctcttgctttgctgctgcttgacagattgaaccagcttgagagcaaaatgtctggtaaaggccaacaacaacaaggccaaactgtcactaagaaatctgctgctgaggcttctaagaagcctcggc引物f:5′-tcatcacgtagtcgcaacagttcaagaaattca-3′(seqidno.10);引物r:5′-gcctttaccagacattttgctctcaagctggttc-3′(seqidno.11);荧光探针:5′-gcagcagtaggggaacttctcctgctagaa/i6famdt/g/idsp/c/ibhq1dt/ggcaatggcggtgatc3spacer-3′(seqidno.12);2、n基因rna序列制备使用transcriptaidt7highyieldtranscriptionkit(thermoscientific),按照试剂盒的操作步骤,进行rna转录,用无核酸酶水分别稀释为1000拷贝/ml、300拷贝/ml和100拷贝/ml。3、捕获磁珠制备:与实施例1中所述的捕获磁珠的制备方法相同;含t7启动子序列的捕获探针的序列(seqidno.13)5'-nh2c6-taatacgactcactatagggctcagcagcagatttcttagtgacagtttggc-3′无t7启动子序列的捕获探针的序列(seqidno.14):5'-nh2c6-ctcagcagcagatttcttagtgacagtttggc-3′4、rna序列的靶向捕获取2ml制备好的不同浓度rna产物,分别加入25μl带有捕获序列的磁珠,涡旋混匀后,92℃孵育10min;反应结束后,离心收集管盖及壁上磁珠,置于磁力架上,弃上清;加入500μl洗液,离心收集管盖及壁上磁珠,置于磁力架上,弃上清,重复一次;加入50μl核酸保存液,震荡混匀,置于4℃保存;5、pcr检测pcr反应体系中包括:60mmtris(ph7.2)、6mm二硫苏糖醇、5%聚乙二醇、5mmatp、1.5mmdntps、0.8mmntps、100μm磷酸肌醇、50ng/μl单链结合蛋白ssb、10ng/μlrecq、50ng/μluvsx、50ng/μluvsy、70ng/μlbsu、50ut7rnapolymerase、10um-mlv、10urnaseh、1u核酸外切酶iii、1μm引物f、1μm引物r、0.8μm荧光探针、20mm醋酸镁。制备完成后,取35μl,加入5μl样本提取液。反应程序为:步骤程序温度时间循环数1预热40℃1秒12延伸及荧光采集40℃30秒306、实验结果实验结果如图5所示:1#组表示捕获序列带有t7启动子,2#组表示捕获序列不带t7启动子;通过对比带有t7启动子和无t7启动子的捕获序列,带有t7启动子的序列对靶rna检测的灵敏度更高,证明在启动子及rna转录酶的作用下,能够扩大靶标序列,有效提高检测效率。实施例4本实施例中使用所述核酸提取方法靶向捕获新冠状病毒n基因的dna序列。采用t3启动子,对比与t7启动子的效果,同时采用了打乱序列的靶向探针作为阴性对照,进行靶向捕获特异性测试。1、使用实施例3中的含有新冠状病毒n基因序列的puc57质粒,以新冠状病毒n基因作为检测靶标基因。以人基因组(helacell,109cells/ml)、以及107cfu/ml细菌包括大肠杆菌(atcc25922)、金黄色葡萄球菌(atcc6538p)、肠炎沙门氏菌(gem1.345)、艰难梭菌(atcc9689)、产气荚膜梭菌(atcc13124),各取0.2ml混合,作为背景基因,再分别加入0.8ml1×106拷贝/ml、1×105拷贝/mlpuc57质粒,制备两个含有不同浓度的n基因模拟样本。2、按照实施例1中所述的方法制备靶向捕获磁珠;使用t7启动子的靶向捕获探针序列同实施例3中的靶向捕获序列,含t7启动子捕获序列为seqidno.13,无启动子捕获序列为seqidno.14;使用t3启动子的靶向序列如下(下划线部分为t3启动子序列):5'-nh2c6-aattaaccctcactaaagggctcagcagcagatttcttagtgacagtttggc-3'(seqidno.15),该序列中在5'端连接的c6中的“c”指的是碳原子,而非胞嘧啶。同时,使用打乱序列的捕获序列做为阴性对照(含t7启动子),其序列为:5'-nh2c6-taatacgactcactatagggcgattgccataggttctacgattggcatgcat-3′(seqidno.16)3、样本提取:取2ml各个浓度样本,按照实施例1进行靶向富集;最后加入50μl核酸保存液,置于4℃保存。4、重组酶等温扩增检测(1)扩增体系:60mmph为7.2的tris缓冲液、6mm二硫苏糖醇、5%聚乙二醇、5mmatp、1.5mmdntps、0.8mmntps、100μm磷酸肌醇、50ng/μl单链结合蛋白ssb、10ng/μlrecq、50ng/μluvsx、50ng/μluvsy、70ng/μlbsu、10um-mlv、10urnaseh、1u核酸外切酶iii、1μm引物f、1μm引物r、0.8μm荧光探针、20mm醋酸镁、t7启动子靶向捕获序列组加入50ut7rnapolymerase/t3启动子靶向捕获序列组加入50ut3rnapolymerase。制备完成后,取35μl,加入5μl的样本提取液。(2)引物和探针引物f:seqidno.10,引物r:seqidno.11,荧光探针:seqidno.12;检测程序:步骤程序温度时间循环数1预热40℃1秒12延伸及荧光采集40℃30秒305、实验结果如图6所示,通过对比发现,采用t3启动子的捕获序列与采用t7启动子的捕获序列具有相似的扩增效果,不同的启动子可配合相应的rna聚合酶,具有比较接近的效果,可根据实际应用选取合适的启动子。同时,携带t7启动子的对照序列无扩增信号,说明该方法具有良好的扩增特异性。实施例5本实施例采用携带启动子序列的靶向捕获序列,对粪便样本中的细菌靶基因进行检测。通过对粪便模拟样本和生理盐水模拟样本的检测对比,来验证磁珠靶向捕获重组酶等温扩增方法是否能够应用于复杂的样本检测。本实施例中对艰难梭菌(atcc9689)的tcdb基因进行检测。1、健康人员的粪便样本,取黄豆大小样本,称重,分别加入500μl5×104cfu/ml、500μl5x103cfu/ml艰难梭菌,同时,取同样重量的生理盐水,分别加入500μl5x104cfu/ml、500μl5×103cfu/ml艰难梭菌,以不加艰难梭菌组为阴性对照。艰难梭菌的tcdb基因序列为seqidno.17,具体为ataaaattagttatgaagcagcatgtaacttatttgcaaagactccttatgatagtgtactgtttcagaaaaatatagaagattcagaaattgcatattattataatcctggagatggtgaaatacaagaaatagacaagtataaaattccaagtataatttctgatagacctaagattaaattaacatttattggtcatggtaaagatgaatttaatactgatatatttgcaggtcttgatgtagattcattatccacagaaatagaaacagcaatagatttagctaaagaggatatttctcctaagtcaatagaaataaatttattaggatgtaatatgtttagctactctatcaacgtagaggagacttatcctgga引物f:gattaaattaacatttattggtcatggtaaaga(seqidno.18)引物r:tcctctacgttgatagagtagctaaacatatta(seqidno.19)荧光探针seqidno.20:ttaatactgatatatttgcaggtcttgatg/i6famdt/a/idsp/a/ibhq1dt/tcattatccacagaac3spacer2、捕获磁珠制备:与实施例1中所述的捕获磁珠的制备方法相同;带有t7启动子序列的捕获探针的序列:(5'nh2c6)taatacgactcactatagggtataatcctggagatggtgaaatacaagaaatagacaagt(seqidno.21)3、粪便模拟样本和生理盐水模拟样本的tcdb基因捕获样本处理:向样本加入100μl0.5mm的玻璃球,加入1ml裂解液,裂解液为4mol/l异硫氰酸胍、0.1%sds和20mmtris-hcl;在振荡器中,震荡混匀10min;置于高速离心机,12000rpm,离心5min;取上清,置于新的1.5mlep管。靶向捕获纯化:向样本加入25μl带有捕获序列的磁珠,涡旋混匀后,95℃孵育10min;反应结束后,离心收集管盖及壁上磁珠,置于磁力架上,弃上清;加入500μl洗液,离心收集管盖及壁上磁珠,置于磁力架上,弃上清,重复一次;加入50μl核酸保存液,震荡混匀,置于4℃保存;4、重组酶等温扩增检测(1)扩增体系:60mmph为7.2的tris缓冲液、6mm二硫苏糖醇、5%聚乙二醇、5mmatp、1.5mmdntps、0.8mmntps、100μm磷酸肌醇、50ng/μl单链结合蛋白ssb、10ng/μlrecq、50ng/μluvsx、50ng/μluvsy、70ng/μlbsu、50ut7rnapolymerase、10um-mlv、10urnaseh、1u核酸外切酶iii、1μm引物f、1μm引物r、0.8μm荧光探针、20mm醋酸镁。制备完成后,取35μl,加入5μl的样本提取液。检测程序:步骤程序温度时间循环数1预热40℃1秒12延伸及荧光采集40℃30秒305、实验结果:如图7所示,1#是粪便模拟样本的结果,2#是生理盐水模拟样本的结果。通过对比显示粪便样本与生理盐水样本的检测结果,磁珠靶向捕获重组酶等温扩增能够能够有效富集粪便样本和生理盐水样本中的靶序列,并且能够去除样本中复杂成分可能存在对检测的影响。该方法能够用于临床样本中病原微生物的核酸检测。综上所述,本发明提供的基于磁珠靶向富集目标基因的核酸提取方法能够有效地富集目标核酸,对包括dna和rna的目标核酸序列进行放大,并实现扩增,消除由背景核酸过高引起的重组酶等温扩增检测假阴性结果,提高检测灵敏度。申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属
技术领域:
的技术人员应该明了,任何属于本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



