CRISPR/Cas12a体系可视化半定量检测转基因作物NOS终止子的方法与流程
 2021-02-02 18:02:44|
2021-02-02 18:02:44| 386|
386| 起点商标网
起点商标网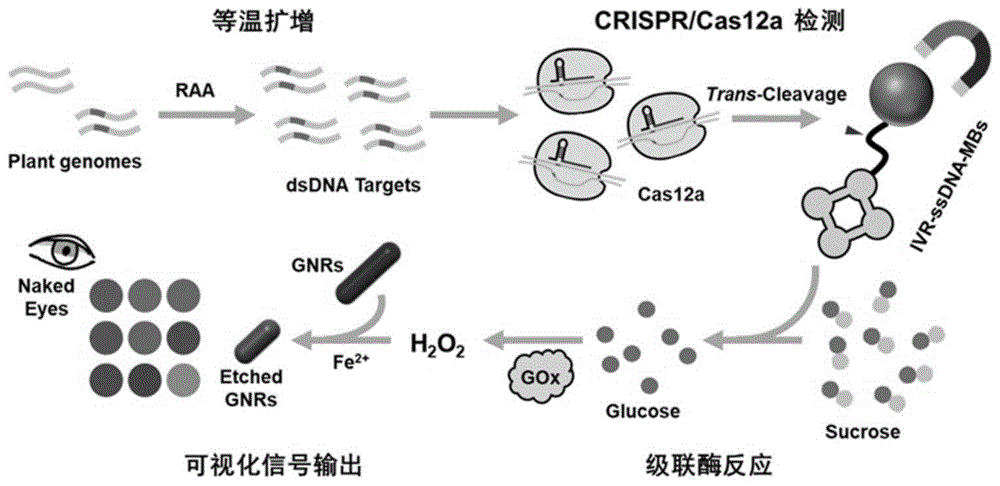
本发明属于可视化半定量分析方法技术领域,具体涉及crispr/cas12a体系可视化半定量检测转基因作物nos终止子。
背景技术:
crispr(clusteredregularlyinterspacedshortpalindromicrepeats),即规律成簇的间隔短回文重复序列,连同其相关cas(crisprassociatedprotein)蛋白形成了crispr-cas系统,它是细菌和古菌抵抗噬菌体侵染的一种获得性免疫机制。其中cas12a为第2类v型cas蛋白,它在未激活时呈自抑制状态,当其与特定的crrna结合后,构象将发生改变,从而形成cas12a-crrna二元复合物。该复合物能特异性得识别靶标dna,并激活其核酸内切酶活性。当cas12a依次对dna双链进行cis切割后,该活性位点将持续暴露,因而展现出引人注目的trans切割活性,对周围的ssdna进行非特异性切割。针对cas12a的特性,科学家们设计了多种高灵敏度、高特异性的核酸检测平台。(1.chenjs,mae,harringtonlb,etal.crispr-cas12atargetbindingunleashesindiscriminatesingle-strandeddnaseactivity.science,2018,360(6387):436-439.2.swartsdc,jinekm.mechanisticinsightsintothecis-andtrans-actingdnaseactivitiesofcas12a.molecularcell,2019,73(3):589-600.)
近年来,“转基因”成了社会大众讨论的热门话题,人们对转基因产品作物安全性的关注程度也达到了空前的高度。为确保转基因产品的安全,世界各国与国际组织制订了一系列转基因作物安全评价标准,因此不论转基因技术的利弊,国家对转基因作物的安全性都需要进行严格的把控。转基因作物在研发、种植、生产、运输、销售等每个环节的所有监管过程都离不开转基因检测技术,这对检测技术的成本、便携度及时效性和灵活性都有着很高的要求。显然,基于专业实验室的传统检测方法将难以满足所有生产环节的安全监管。因此,在生产和运输等过程的现场,对作物是否含有外源基因进行即时检测,从而实现对转基因作物高效、准确且简便、快速的监管,将成为转基因技术在市场化过程中的重要发展方向之一,也是目前国内外分析化学的研究热点之一。
现阶段科研人员对转基因作物及其相关制品的分子检测主要是基于外源基因或其表达产物的。前者依靠变温和等温扩增技术,如聚合酶链式反应(polymerasechainreaction,pcr)、多重pcr(multiplexpcr)、实时定量pcr(quantitativereal-timepcr)、环介导等温扩增反应(loop-mediatedisothermalamplification,lamp)等,来对目的基因进行扩增,再借助测序或荧光信号实现检测。但该类检测方法对仪器和检测人员的技术要求较高,难以在基层进行大批量的检测。后者包括针对蛋白质的酶联免疫吸附法(enzymelinkedimmunosorbentassay,elisa)、蛋白质免疫印迹(westernblot,wb)、免疫试纸条(lateralflowimmunoassay,lfia)、质谱法等。上述基于抗原-抗体反应的检测方法虽然特异性好、灵敏度高,但抗体制备和纯化的成本较高,难以推广至所有转基因作物的检测。转基因蛋白质的表达具有时空特异性,同种作物在不同的生长阶段或不同的生长环境下对于蛋白质的表达具有明显的差异,且蛋白质在作物的加工和运输过程中容易遭到降解和破坏,在一定程度上影响了检测的实际效果。(3.ocafiamf,fraserpd,patelrkp,eta1.massspectrometricdetectionofcp4epspsingeneticallymodifiedsoyaandmaize[j].rapidcommumcationsinmassspectromet,2007,21(3):319-328.4.leed,lamuram,allnutttretal.detectionofgeneticallymodifiedorganisms(gmos)usingisothermalamplificationoftargetdnasequences.bmcblotechnology,2009,9(1).7.5.vanduljng,biertrv,bleeker-marcelishetal.detectionmethodsforgeneticallymodifiedcrops.foodcontrol,1999,10(6):375-378.)
技术实现要素:
本发明的目的在于克服转基因作物检测的技术缺陷,以nos终止子为检测目标,提供一种方便、快捷、灵敏检测转基因作物的方法。为此,本发明采用的技术方案如下:
crispr/cas12a体系可视化半定量检测转基因作物nos终止子,包括如下步骤:
步骤一:借助核酸扩增技术(pcr、rpa、lamp等)对nos终止子中的检测片段进行扩增;
步骤二:在crrna的介导下,cas12a可特异性识别扩增产物,并激活其核酸酶活性,从而释放借助ssdna偶联于磁珠上的具有催化水解产生葡萄糖的产糖酶(转化酶淀粉酶、半乳糖苷酶、葡聚糖酶等);
步骤三:通过磁分离,游离的产糖酶进入级联酶反应,催化各种底物(蔗糖、淀粉、乳糖、葡聚糖等)水解产生葡萄糖,并在葡萄糖氧化酶的作用下生成过氧化氢;
步骤四:借助fenton反应,体系产生大量·oh自由基,从而刻蚀具有颜色指示作用的纳米粒子,呈现出不同的颜色,测量其吸收峰波长,从而实现对于nos终止子的半定量检测。
其中,步骤二中,cas12a浓度为50-100nm,cas12a与crrna的浓度比为1:1-1:4。
步骤三中,反应体系中各种底物浓度为0.02-0.95m,葡萄糖氧化酶的浓度为2-10u/ml。
步骤四中,反应体系中fe2+的浓度为1-2mm,所使用的具有颜色指示作用的纳米粒子为金纳米棒,在检测体系内的浓度为0.5-1.0nm,纵向表面等离子吸收峰在810-830nm。
进一步地,rpa扩增所用引物序列rpa-f、rpa-d以及crrna序列nos-crrna、磁珠偶联序列mbs-linker分别为:
rpa-f:5’-taagattgaatcctgttgccggtcttgcgatga-3’,即序列表seqidno.1序列。
rpa-d:5’-cctagtttgcgcgctatattttgttttctatcg-3’,即序列表seqidno.2序列。
nos-crrna:
uaauuucuacuaaguguagauuguugaauuacguuaagcau,即序列表seqidno.3序列。
mbs-linker:5’-biotin-n(100)-thiol-3’,即序列表seqidno.4序列。
进一步地,步骤二中,cas12a浓度为50-100nm,cas12a与crrna的浓度比为1:1-1:4。
进一步地,步骤三中,反应体系中0.02-0.95m,葡萄糖氧化酶的浓度为2-10u/ml。
进一步地,步骤四中,反应体系中fe2+的浓度为1-2mm。
进一步地,所使用的具有颜色指示作用的纳米粒子为金纳米棒,在检测体系内的浓度为0.5-1.0nm,纵向表面等离子吸收峰在810-830nm。
对各步反应的温度和时间进行优化:步骤二中,crispr/cas12a体系的反应温度为25-37℃,反应时间为15-90min;步骤三中,级联酶反应体系的反应温度为25-37℃,反应时间为15-60min;步骤四中,信号输出体系的反应温度为25-37℃,反应时间为15-60min。
所用功能化磁珠的制备方法为:转化酶通过4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐与mbs-linker进行连接,mbs-linker通过生物素基团与链霉亲和素修饰的磁珠进行偶联,从而形成各种产糖酶-ssdna-磁珠复合物。
由上述对本发明的描述可知,本发明提出了一种crispr/cas12a体系可视化半定量检测转基因作物nos终止子的新方法。与现有分析检测方法相比,该方法具有灵敏度高、特异性好、操作便捷、用户友好且价格低廉、便携式快速检测等优点,具有广泛推广价值的转基因作物即时检测新平台。
附图说明
图1为本发明的工作原理图。
图2为本发明中所使用的功能化磁珠制备原理图。
图3为sds-page表征mbs-linker与转化酶偶联情况图,泳道1为未经偶联的转化酶,泳道2为偶联后的复合物,可见部分转化酶成功地与mbs-linker进行了偶联,使其分子量明显增大,验证了该化学偶联方法的可行性。
图4为本发明对转基因作物bt-11中nos终止子的检测灵敏度,展示了(a)不同转基因作物含量的实际样品rpa等温扩增效率图;(b)实际样品中不同转基因作物含量对金纳米棒溶液颜色的响应情况;(c)金纳米棒溶液纵向表面等离子共振峰蓝移距离与转基因作物含量的对应关系;(d)基于纵向表面等离子共振峰蓝移距离的检测线性范围(y=33.73*ln(100*x)+116.381;x:转基因作物含量,y:纵向表面等离子共振峰蓝移距离(nm))。0%,0.05%,0.1%,0.5%,2%,5%,20%,40%,100%转基因含量的实际作物样品经rpa等温扩增后,利用该crispr/cas12a体系可视化半定量检测体系进行分析,裸眼可直接分辨低至0.1%的转基因作物含量,利用纵向表面等离子共振峰蓝移距离可以实现0.1%-40%区间内转基因作物含量的半定量检测,满足各国对转基因作物检测的实际需求。
图5为实际样品中nos终止子的检测。利用该crispr/cas12a体系可视化半定量检测体系分别对转基因作物bt-11玉米、cp4-epsps大豆,非转基因玉米、大豆、水稻进行了检测。通过裸眼观察,2个阳性样品均观察到了明显的颜色变化,而3个阴性均未发生明显颜色变化。而根据0.1%-40%区间内转基因作物含量与纵向表面等离子共振峰蓝移距离的定量关系,可计算阳性样品的转基因作物含量分别为24.08%和2.24%。
图6为利用qpcr法对不同转基因含量的实际样品进行检测,用于考察本发明方法检测的准确性。利用qpcr法中ct值与转基因含量的线性关系(y=-1.344*ln(100*x)+26.700,x:转基因作物含量,y:ct值)计算得阳性样品的转基因作物含量分别为25.39%和2.35%,体现了本发明方法较好的准确性。
具体实施方式
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述:
一、金纳米棒的合成
本发明中所使用的金纳米棒通过种子生长发合成,主要分为两个步骤:(1)晶种生长:于25ml圆底烧瓶中加5ml0.2m十六烷基三甲基溴化铵(ctab)和5ml1mmhaucl4·3h2o,磁力搅拌直至充分混匀。加入1ml6mmnabh4(于冰浴中新鲜配置),于30℃搅拌孵育2min,再于30℃避光静止30min,即可得到晶种溶液。(2)金纳米棒生长:在50ml离心管中先加35ml水,再加1.26gctab和0.222g油酸钠,迅速加热超声直至溶解。于50ml比色管(需避光)中加入加20ml上述表面活性剂,于30℃搅拌孵育10min。快速加入840μl4mmagno3,磁力搅拌混匀后于30℃静置15min。准确加入20.00ml1mmhaucl4·3h2o,于30℃搅拌孵育90min。快速加入168μlhcl,充分搅拌直至无色。后续加入100ul0.064m抗坏血酸和64μl步骤(1)中预先制备的晶种,搅拌混匀后于30℃静置12h。生长液于6500g离心30min,弃上清,并重悬于ctab溶液中,浓缩至0.57nm待用。
二、功能化磁珠的制备
2.1偶联转化酶功能磁珠的制备
功能化磁珠的制备主要分为四个步骤:(1)mbs-linker中巯基的活化:将5μl1mmmbs-linker,1μl30mm三(2-羧乙基)膦(tcep)以及1μlbuffera(1m磷酸盐缓冲液,ph5.5)充分混合,并于室温孵育1h。利用amicon-3k分离活化后的mbs-linker(即序列表seqidno.4),并利用bufferb(0.1mnacl,0.1m磷酸盐缓冲液,ph7.3)清洗,重复8次。(2)转化酶的活化:配置5.0-40mg/ml转化酶水溶液,分别吸取400μl转化酶水溶液中加入1mg4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc),充分混匀后于室温孵育1h。离心除去未反应的sulfo-smcc,并利用amicon-100k分离活化后的转化酶,并利用bufferb清洗,重复8次。(3)转化酶-linker复合物的形成:将上述活化的mbs-linker与转化酶充分混匀,并于室温旋转孵育48h。利用amicon-100k纯化产物,并利用bufferb清洗,重复8次。如图3所示,利用sds-page表征mbs-linker与转化酶偶联情况,泳道1为未经偶联的转化酶,泳道2为偶联后的复合物,可见部分转化酶成功地与mbs-linker进行了偶联,使其分子量明显增大,验证了该化学偶联方法的可行性。(4)复合物与磁珠的偶联:按每100pmol复合物加入1μl10mg/ml链霉亲和素磁珠的比例进行混合,并于室温旋转孵育15min。通过磁分离弃去上清,并利用bufferb清洗5次,最重重悬于5倍体积的bufferb中,于4℃保存待用。
2.2偶联淀粉酶功能磁珠的制备
基本制备工艺如2.1,其中仅用8.0-50mg/ml淀粉酶水溶液液代替5.0-40mg/ml转化酶水溶液。
2.3偶联半乳糖苷酶功能磁珠的制备
基本制备工艺如2.1,其中仅用5.0-30mg/ml半乳糖苷酶水溶液液代替5.0-40mg/ml转化酶水溶液。
2.3偶联葡聚糖酶功能磁珠的制备
基本制备工艺如2.1,其中仅用8.0-60mg/ml葡聚糖酶水溶液液代替5.0-40mg/ml转化酶水溶液。
三、crispr/cas12a体系可视化半定量检测转基因作物nos终止子
利用商品化试剂盒对实际样本基因组进行提取,利用rpa等温扩增技术即可在37℃下,30min内实现对目标片段的扩增,所用引物即序列表seqidno.1和no.2。取10μl功能化偶连转化酶磁珠,通过磁分离弃去保存液,加入50nmcas12a、150nmcrrna(即序列表seqidno.3)、0.5μl扩增产物、2μlbufferc(50mmnacl,10mmtris-hcl,10mmmgcl2,1mmdtt,ph7.9)并用rnase-free水补足20μl。于37℃孵育30min,利用磁铁将磁珠与上清分离。取15μl上清,加入30μl1m蔗糖,4.8μl100u/ml葡萄糖氧化酶,以及6μlbufferc(100mm柠檬酸盐缓冲液,ph5.6),于37℃孵育30min。取11.25μl上述反应液,与75μl金纳米棒溶液,7.5μl20mmfeso4·7h2o以及11.25μl4mhcl充分混合,于37℃孵育30min,即可借助颜色的变化进行检测结果的分析。而利用便携式分光光度仪可对上述溶液的吸收峰进行分析,根据纵向表面等离子共振吸收峰的蓝移距离,即可实现对于待测靶标的半定量检测。该方法可在2h内完成检测全过程,且无需大型仪器辅助测试,优于rt-pcr等检测金标准。
在以上检测过程中,可以分别用偶联淀粉酶,半乳糖苷酶,葡聚糖酶功能磁珠代替偶联转化酶功能磁珠,需要分别加入各种相应的反应底物(淀粉,乳糖和葡聚糖),浓度范围在0.5-2m,加样量相同,可取得类似的检测效果。
四、该方法检测转基因作物nos终止子的灵敏度表征
为考察本发明对转基因作物bt-11中nos终止子的检测灵敏度,具有0%,0.05%,0.1%,0.5%,2%,5%,20%,40%,100%转基因含量的实际作物样品经rpa等温扩增后,利用该crispr/cas12a体系可视化半定量检测体系进行分析。图4a展示了不同转基因作物含量的实际样品rpa等温扩增效率图;图4b展示实际样品中不同转基因作物含量对金纳米棒溶液颜色的响应情况,通过肉眼可直接识别低至0.1%的转基因含量,具有较好的检测灵敏度。图4c和4d展现了金纳米棒溶液纵向表面等离子共振峰蓝移距离与转基因作物含量的对应关系,且在0.1%-40%转基因含量的区间范围内存在线性关系(y=33.73*ln(100*x)+116.381;x:转基因作物含量,y:纵向表面等离子共振峰蓝移距离(nm)),可用于转基因作物的定量检测。
五、该方法检测转基因实际作物
利用该crispr/cas12a体系可视化半定量检测体系分别对转基因作物bt-11玉米、cp4-epsps大豆,非转基因玉米、大豆、水稻进行了检测。如图5所示,通过裸眼观察,2个阳性样品均观察到了明显的颜色变化,而3个阴性均未发生明显颜色变化,体现了该方法的特异性。而根据0.1%-40%区间内转基因作物含量与纵向表面等离子共振峰蓝移距离的定量关系,可计算阳性样品的转基因作物含量分别为24.08%和2.24%。如表1和图6所示,通过qpcr对该方法的检测准确性进行验证,利用线性关系(y=-1.344*ln(100*x)+26.700,x:转基因作物含量,y:ct值)计算得阳性样品的转基因作物含量分别为25.39%和2.35%,体现了该方法较好的准确性。
表1
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容进行非实质性的改动,均应属于侵犯本发明保护范围的行为。
序列表
<110>浙江大学
<120>crispr/cas12a体系可视化半定量检测转基因作物nos终止子的方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>33
<212>dna
<213>artificialsequence
<400>1
taagattgaatcctgttgccggtcttgcgatga33
<210>2
<211>33
<212>dna
<213>artificialsequence
<400>2
cctagtttgcgcgctatattttgttttctatcg33
<210>3
<211>41
<212>rna
<213>artificialsequence
<400>3
uaauuucuacuaaguguagauuguugaauuacguuaagcau41
<210>4
<211>100
<212>dna
<213>artificialsequence
<400>4
nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn60
nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn100
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



