异源串联双环肽复合物的制作方法
 2021-02-02 17:02:08|
2021-02-02 17:02:08| 292|
292| 起点商标网
起点商标网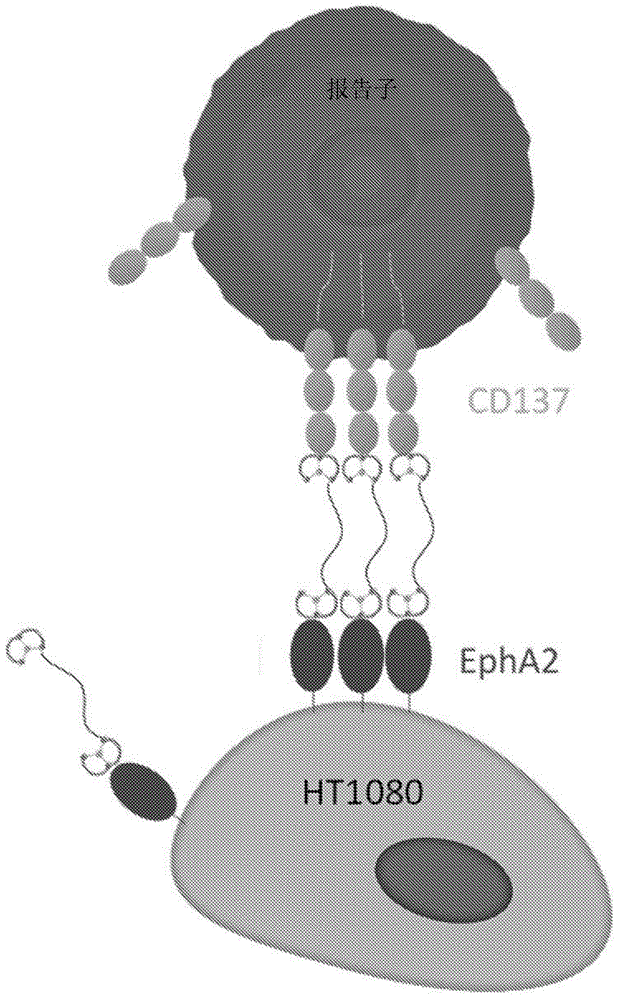
本发明涉及异源串联双环肽复合物,其包含与免疫细胞上存在的组分结合的第一肽配体,该第一肽配体通过接头缀合至与癌细胞上存在的组分结合的第二肽配体。本发明还涉及所述异源串联双环肽复合物在预防、抑制或治疗癌症中的用途。
背景技术:
:环肽能够以高亲和力和靶标特异性结合蛋白质靶标,因此对于开发治疗剂是有吸引力的分子类别。实际上,临床上已经成功使用了几种环肽,例如抗菌肽万古霉素、免疫抑制剂药物环孢霉素或抗癌药奥曲肽(driggers等人(2008),natrevdrugdiscov7(7),608-24)。良好的结合特性是由于肽和靶标之间形成的相对大的相互作用表面以及环结构的构象柔韧性降低。通常,大环结合至数百平方埃的表面,例如环肽cxcr4拮抗剂cvx15(wu等人(2007),science330,1066-71)、具有arg-gly-asp基序与整联蛋白αvb3结合的环肽(xiong等人(2002),science296(5565),151-5)或与尿激酶型纤溶酶原激活剂结合的环肽抑制剂upain-1(zhao等人(2007),jstructbiol160(1),1-10)。由于其环状构型,肽大环比线性肽的柔韧性差,导致与靶标结合后熵损失较小,并导致更高的结合亲和力。与线性肽相比,降低的柔韧性还导致锁定靶标特异性构象,增加结合特异性。这种作用已通过基质金属蛋白酶8(mmp-8)的有效且选择性的抑制剂得到了例证,该抑制剂在开环时失去了对其他mmp的选择性(cherney等人(1998),jmedchem41(11),1749-51)。通过大环化获得的有利的结合特性在具有多于一个肽环的多环肽中更为显著,例如在万古霉素、乳链菌肽和放线菌素中。不同的研究团队先前已将具有半胱氨酸残基的多肽附着到合成的分子结构上(kemp和mcnamara(1985),j.org.chem;timmerman等人(2005),chembiochem)。meloen及其同事已使用三(溴甲基)苯和相关分子将多个肽环快速定量地环化到合成的支架上,以结构模拟蛋白质表面(timmerman等人(2005),chembiochem)。在wo2004/077062和wo2006/078161中公开了产生候选药物化合物的方法,其中所述化合物通过将含半胱氨酸的多肽连接至分子支架(例如三(溴甲基)苯)而产生。已经开发了基于噬菌体展示的组合方法来产生和筛选针对感兴趣靶标的双环肽的大文库(heinis等人(2009),natchembiol5(7),502-7和wo2009/098450)。简而言之,在噬菌体上展示包含三个半胱氨酸残基和两个区域的六个随机氨基酸的线性肽(cys-(xaa)6-cys-(xaa)6-cys)的组合文库,并通过将半胱氨酸侧链共价连接至小分子(三(溴甲基)苯)而环化。技术实现要素:根据本发明的第一方面,提供了一种异源串联联双环肽复合物,其包含:(a)与免疫细胞上存在的组分结合的第一肽配体;其通过接头缀合至(b)与癌细胞上存在的组分结合的第二肽配体;其中每个所述肽配体包含多肽和分子支架,所述多肽含有被至少两个环序列隔开的至少三个半胱氨酸残基,所述分子支架与所述多肽的半胱氨酸残基形成共价键,从而在所述分子支架上形成至少两个多肽环。根据本发明的进一步的方面,本发明提供一种药物组合物,其包含本文定义的异源串联双环肽复合物以及一种或多种药学上可接受的赋形剂。根据本发明的另一方面,提供了如本文所定义的用于预防、抑制或治疗癌症的异源串联双环肽复合物。附图说明图1:包含epha2和cd137肽配体的异源串联双环肽复合物与免疫细胞和癌细胞结合的示意图。图2:epha2-cd137异源串联双环肽复合物bcy7985的结构和组成。图3:在表达epha2的ht1080细胞存在的情况下,在promegacd137荧光素酶报告子分析(cs196008)中分析epha2-cd13异源串联双环肽复合物bcy7985。图4:epha2/cd137异源串联在cd137报告子分析中具有活性,激活的诱导倍数取决于共培养所用细胞系上的肿瘤靶标表达水平。图5:epha2/cd137异源串联在原代人t细胞和癌细胞共培养分析中诱导肿瘤细胞杀伤。通过随时间计数活的nuclight红色阳性肿瘤细胞来评估肿瘤细胞杀伤。caspase3/7染料用于鉴定凋亡的肿瘤细胞。图6:在cd137报告子分析中粘连蛋白-4/cd137异源串联具有活性,激活的诱导倍数取决于用于共培养的细胞系(ht1376:粘连蛋白-4高和nci-h292:粘连蛋白-4中等)中肿瘤靶标的表达水平。图7:在pbmc-4t1共培养分析中,粘连蛋白-4/cd137异源串联诱导il-2和ifn-γ细胞因子分泌。bcy9350和bcy9351分别是粘连蛋白-4和cd137的非结合对照。图8:粘连蛋白-4/cd137异源串联在原发性患者源性肺肿瘤的离体培养物中诱导靶标依赖性细胞因子释放。(a)在光学显微镜下10x成像中,离体患者来源的肿瘤细胞在培养4h内形成3d球体。(b)在来自3个供体的患者来源的肿瘤样品中粘连蛋白-4表达的流式分析。(c)表显示了3个供体样品中的%cd137+t细胞和粘连蛋白-4+细胞。(d)热图表明响应于对照/测试化合物的治疗,免疫标志物(相对载体标准化)的%变化。(e)响应于对照/测试化合物治疗的%cd8+ki67+t细胞(载体用虚线表示)。图9:在表达pd-l1的细胞系rko存在下,在cd137报告子分析中pd-l1/cd137异源串联具有活性。图10:异源串联在sd大鼠中的药代动力学:bcy10572和bcy10000的剂量iv为2mg/kg(n=3)。具体实施方式根据本发明的第一方面,提供了一种异源串联双环肽复合物,其包含:(a)与免疫细胞上存在的组分结合的第一肽配体;其通过接头缀合至(b)与癌细胞上存在的组分结合的第二肽配体;其中每个所述肽配体包含多肽和分子支架,所述多肽含有被至少两个环序列隔开的至少三个半胱氨酸残基,所述分子支架与所述多肽的半胱氨酸残基形成共价键,从而在所述分子支架上形成至少两个多肽环。第一肽配体本文提及的术语“免疫细胞”包括免疫系统内的任何细胞。合适的例子包括白细胞,例如淋巴细胞(例如t淋巴细胞或t细胞,b细胞或自然杀伤细胞)。在一个实施方案中,t细胞是cd8或cd4。在另一个实施方案中,t细胞是cd8。免疫细胞的其他示例包括树突细胞,滤泡树突细胞和粒细胞。在一个实施方案中,免疫细胞上存在的组分是cd137。cd137是肿瘤坏死因子(tnf)受体家族的成员。它的替代名称是肿瘤坏死因子受体超家族成员9(tnfrsf9),4-ibb,并由淋巴细胞激活(ila)诱导。cd137可以由活化的t细胞表达,但在cd8+上的表达程度要大于cd4+t细胞。另外,在炎症部位的树突细胞、滤泡树突细胞、自然杀伤细胞、粒细胞和血管壁细胞上发现了cd137表达。cd137的一个表征性活性是其对活化t细胞的共刺激活性。cd137的交联增强t细胞增殖、il-2分泌、存活和溶细胞(cytolytic)活性。此外,它可以增强免疫活性以消除小鼠中的肿瘤。cd137是在tcr激活后诱导的t细胞共刺激受体(nam等人,curr.cancerdrugtargets,5:357-363(2005);waits等人,annu.rev,immunol.,23:23-68(2005))。除了在活化的cd4+和cd8+t细胞上表达外,cd137还可以在cd4+cd25+调节性t细胞、自然杀伤(nk)和nk-t细胞、单核细胞、嗜中性粒细胞和树突细胞中表达。已经描述其天然配体cd137l在抗原呈递细胞上,包括b细胞,单核细胞/巨噬细胞和树突状细胞(watts等人.annu.rev.immunol,23:23-68(2005))。与其配体相互作用时,cd137导致增加的tcr诱导的t细胞增殖,细胞因子产生,功能成熟和延长的cd8+t细胞存活(nam等人,curr.cancerdrugtargets,5:357-363(2005),watts等人,annu.rev.immunol,23:23-68(2005))。通过cd137l或针对cd137的激动性单克隆抗体(mab)通过cd137进行信号传导,会导致增加的tcr诱导的t细胞增殖、细胞因子产生和功能成熟,并延长cd8+t细胞存活。这些影响是由于:(1)激活nf-κb,c-junnh2末端激酶/应激激活蛋白激酶(jnk/sapk)和p38丝裂原激活蛋白激酶(mapk)信号传导通路,以及(2)控制抗凋亡和细胞周期相关基因的表达。在cd137和cd137l缺陷小鼠中进行的实验还证明了cd137共刺激在产生完全感受态t细胞反应中的重要性。il-2和il-15激活的nk细胞表达cd137,而激动性mab连接cd137刺激nk细胞增殖和ifn-γ分泌,但不刺激其溶细胞活性。此外,cd137刺激的nk细胞可在体外促进活化t细胞的扩增。根据其共刺激功能,针对cd137的激动剂mab已显示促进心脏和皮肤同种异体移植的排斥、根除已建立的肿瘤、扩大原发性抗病毒cd8+t细胞反应并增加t细胞溶细胞能力。这些研究支持观点:cd137信号传导可促进t细胞功能,从而增强针对肿瘤和感染的免疫力。在一个实施方案中,第一肽配体包含结合cd137的双环肽配体。结合cd137的双环肽配体的合适示例在gb专利申请号1712589.9和1802934.8中公开,其肽通过引用并入本文。在一个实施方案中,结合cd137的双环肽配体包含氨基酸序列:ciieegqyciifadpy[nle]ciii(seqidno:1);ci[tbuala]pe[d-ala]pyciifadpy[nle]ciii(seqidno:3);ciieegqyciif[d-ala]dpy[nle]ciii(seqidno:4);ci[tbuala]pk[d-ala]pyciifadpy[nle]ciii(seqidno:5);ci[tbuala]pe[d-lys]pyciifadpy[nle]ciii(seqidno:6);ci[tbuala]p[k(pya)][d-ala]pyciifadpy[nle]ciii(seqidno:7);ci[tbuala]pe[d-lys(pya)]pyciifadpy[nle]ciii(seqidno:8);ciiee[d-lys(pya)]qyciifadpy(nle)ciii(seqidno:9);和[dci][di][de][de][k(pya)][dq][dy][dcii][df][da][dd][dp][dy][dnle][dciii](seqidno:10);其中ci、cii和ciii分别代表第一、第二和第三半胱氨酸残基,nle代表正亮氨酸,tbuala代表叔丁基丙氨酸,pya代表4-戊炔酸,或其药学上可接受的盐。在一个可能提及的特定实施方案中,结合cd137的双环肽配体包含氨基酸序列:ciieegqyciifadpy[nle]ciii(seqidno:1);其中ci、cii和ciii分别代表第一、第二和第三半胱氨酸残基,nle代表正亮氨酸或其药学上可接受的盐。在另一个实施方案中,结合cd137的双环肽配体包含n末端和c末端修饰,以及包含:ac-a-(seqidno:1)-dap(以下称为bcy7732);ac-a-(seqidno:1)-dap(pya)(以下称为bcy7741);ac-(seqidno:3)-dap(以下称为bcy9172);ac-(seqidno:3)-dap(pya)(以下称为bcy11014);ac-a-(seqidno:4)-dap(以下称为bcy8045);ac-(seqidno:5)-a(以下称为bcy8919);ac-(seqidno:6)-a(以下称为bcy8920);ac-(seqidno:7)-a(以下称为bcy8927);ac-(seqidno:8)-a(以下称为bcy8928);ac-a-(seqidno:9)-a(以下称为bcy7744);和ac-[da]-(seqidno:10)-[da]-nh2(以下称为bcy11506);其中ac代表乙酰基,dap代表二氨基丙酸以及pya代表4-戊炔酸,或其药学上可接受的盐。在可以提及的另一个实施方案中,结合cd137的双环肽配体包含n末端和c末端修饰,并且包含:ac-a-(seqidno:1)-dap(以下称为bcy7732);其中ac代表乙酰基,以及dap代表二氨基丙酸或其药学上可接受的盐。第二肽配体本文提及术语“癌细胞”包括已知与癌症有关的任何细胞。当负责调节细胞分裂的基因被破坏时产生癌细胞。癌变是由正常细胞遗传物质的突变和表观突变引起的,这破坏了增殖与细胞死亡之间的正常平衡。这导致不受控制的细胞分裂,并通过体内自然选择而导致这些细胞的进化。细胞不受控制且通常迅速增殖会导致良性或恶性肿瘤(癌症)。良性肿瘤不会扩散到身体的其他部位或侵入其他组织。恶性肿瘤可侵袭其他器官,扩散到远处(转移)并威胁生命。在一个实施方案中,癌细胞选自ht1080,sc-ov-3,pc3,h1376,nci-h292,lncap,mc38、4t1-d02和rko肿瘤细胞。在一个实施方案中,癌细胞上存在的组分是epha2。eph受体酪氨酸激酶(eph)属于一大群受体酪氨酸激酶(rtk),其为使酪氨酸残基上的蛋白质磷酸化的激酶。eph及其膜结合肝配蛋白(ephrin)配体(ephrins)控制细胞的定位和组织结构(poliakov等人,(2004)devcell7,465-80)。功能性和生化性eph响应在较高的配体低聚反应(oligomerization)状态下发生(stein等人,(1998)genesdev12,667-678)。在其他模式功能中,各种eph和肝配蛋白已显示在血管发育中起作用。ephb4和肝配蛋白-b2的敲除导致缺乏将毛细血管床重塑成血管的能力(poliakov等人,同上)和胚胎致死性。在新形成的成年微血管中也观察到了一些eph受体和肝配蛋白的持久表达(brantley-sieders等人,(2004)currpharmdes10,3431-42;adams(2003)janat202,105-12)。还观察到成人中失控的一些肝配蛋白及其受体的再度出现有助于肿瘤的侵袭、转移和新血管生成(nakamoto等人,(2002)microscrestech59,58-67;brantley-sieders等人,同上)。此外,已经发现一些eph家族成员在来自多种人类肿瘤的肿瘤细胞上过表达(brantley-sieders等人,同上)。marme(2002)annhematol81suppl2,s66;booth等人(2002)natmed8,1360-1)。eph受体a2(肝配蛋白a型受体2)是一种在人中由epha2基因编码的蛋白质。epha2在人多种癌症中上调,通常与疾病进展、转移和不良预后有关,例如:乳腺(zelinski等人(2001)cancerres.61,2301-2306;zhuang等人(2010)cancerres.70,299–308;brantley-sieders等人(2011)plosone6,e24426)、肺(brannan等人(2009)cancerprevres(phila)2,1039-1049;kinch等人(2003)clincancerres.9,613-618;guo等人(2013)jthoraconcol.8、301-308)、胃(nakamura等(2005)cancersci.96,42-47;yuan等人(2009)digdissci54,2410-2417)、胰腺(mudali等人(2006)clinexpmetastasis23,357-365)、前列腺(walker-daniels等人(1999)prostate41,275–280)、肝脏(yang等(2009)hepatolres.39,1169-1177)和胶质母细胞瘤(wykosky等人(2005)molcancerres.3,541–551;li等人(2010)tumorbiol.31,477–488)。epha2在癌症进展中的完整作用仍未确定,尽管有证据表明在癌症进展的许多阶段(包括肿瘤细胞生长、存活、侵袭和血管生成)有相互作用。epha2表达下调抑制了肿瘤癌细胞的增殖(binda等人(2012)cancercell22,765-780),而epha2的阻断则抑制了vegf诱导的细胞迁移(hess等人(2001)cancerres.61,3250-3255),发芽和血管生成(cheng等人(2002)molcancerres.1、2-11;lin等(2007)cancer109,332-40)和转移性进展(brantley-sieders等人(2005)fasebj.19,1884-1886)。已显示epha2的抗体药物偶联物(conjugate)在大鼠和小鼠异种移植模型中可显著减少肿瘤生长(jackson等人(2008)cancerresearch68,9367-9374),尽管因为治疗相关不良事件已被迫中止治疗,然而已在人中尝试了类似的方法(annunziata等人(2013)investnewdrugs31,77-84)。在一个实施方案中,所述第二肽配体包含结合epha2的双环肽配体。结合epha2的双环肽配体的合适示例在gb专利申请号1721259.8和1804102.0中公开,其中的肽通过引用并入本文。在一个实施方案中,结合epha2的双环肽配体包含氨基酸序列:ci[hyp]lvnplciilhp[dd]w[harg]ciii(seqidno:2);和cilwdptpciianlhl[harg]ciii(seqidno:11);其中ci、cii和ciii分别代表第一、第二和第三半胱氨酸残基,hyp代表羟基脯氨酸,dd代表d-构型的天冬氨酸,以及hag代表高精氨酸,或其药学上可接受的盐。在一个可以提及的实施方案中,结合epha2的双环肽配体包含氨基酸序列:ci[hyp]lvnplciilhp[dd]w[harg]ciii(seqidno:2);其中ci、cii和ciii分别代表第一、第二和第三半胱氨酸残基,hyp代表羟基脯氨酸,dd代表d-构型的天冬氨酸以及hag代表高精氨酸,或其药学上可接受的盐。在另一实施方案中,结合epha2的双环肽配体包含n-末端修饰并且包含:a-harg-d-(seqidno:2)(以下称为bcy9594);[b-ala]-[sar10]-a-[harg]-d-(seqidno:2)(以下称为bcy6099);[pya]-[b-ala]-[sar10]-a-[harg]-d-((seqidno:2)(以下称为bcy6169);以及[pya]-[b-ala]-[sar10]-vgp-(seqidno:11)(以下称为bcy8941);其中harg代表高精氨酸,pya代表4-戊炔酸,sar10代表10肌氨酸单元,b-ala代表β-丙氨酸,或其药学上可接受的盐。在可以提及的另一实施方案中,结合epha2的双环肽配体包含n-末端修饰并且包含:a-harg-d-(seqidno:2)(以下称为bcy9594)。其中harg代表高精氨酸,或其药学上可接受的盐。在一个可选择的实施方案中,在癌细胞上存在的组分是pd-l1。程序性细胞死亡1配体1(pd-l1)是290个氨基酸的i型跨膜蛋白,由小鼠19号染色体和人类9号染色体上的cd274基因编码。pd-l1表达参与慢性感染有关的免疫反应的逃避,例如,慢性病毒感染(包括,例如hiv、hbv、hcv和htlv等)、慢性细菌感染(包括,例如幽门螺杆菌(helicobacterpylori)等),慢性寄生虫感染(包括,例如曼氏血吸虫(schistosomamansoni))。已经在包括t细胞、b细胞、巨噬细胞,树突细胞和非造血细胞(包括内皮细胞、肝细胞、肌肉细胞和胎盘)在内的多种组织和细胞类型中检测到pd-l1表达。pd-l1表达还参与抑制抗肿瘤免疫活性。肿瘤表达可被宿主t细胞识别的抗原,但肿瘤的免疫清除很少。这种失败的部分原因是由于肿瘤微环境的免疫抑制。在许多肿瘤上表达的pd-l1是这种抑制性环境的一个组分,与其他免疫抑制信号协同作用。pd-l1表达已在多种实体瘤上原位显示,包括乳腺、肺、结肠、卵巢、黑素瘤、膀胱、肝、唾液、胃、神经胶质瘤、甲状腺、胸腺上皮、头和颈(brownja等人2003immunol.170:1257-66;dongh等人2002nat.med.8:793-800;hamanishij等人2007proc.natl.acad.sci.usa104:3360-65;stromese等人2003cancerres.63:6501-5;inmanba等人2007cancer109:1499-505;konishij等人2004clin.cancerres.10:5094-100;nakanishij等人2007cancerimmunol.immunother.56:1173-82;nomit等人2007clin.cancerres.13:2151-57;thompsonrh等人2004proc.natl.acad.sci.usa101:17174-79;wuc等人2006actahistochem.108:19-24)。此外,pd-l1受体,程序性细胞死亡蛋白1(也称为pd-1和cd279)的表达在肿瘤浸润淋巴细胞上被上调,这也有助于肿瘤免疫抑制(blankc等.2003immunol.171:4574-81)。最重要的是,有关肿瘤上pd-l1表达与疾病结局的研究表明,pd-l1表达与肾癌、卵巢癌、膀胱癌、乳腺癌、胃癌和胰腺癌的不良预后密切相关(hamanishij等人2007proc.natl.acad.sci.usa104:3360-65;inmanba等人2007cancer109:1499-505;konishij等人2004clin.cancerres.10:5094-100;nakanishij等人2007cancerimmunol.immunother.56:1173-82;nomit等人2007clin.cancerres.13:2151-57;thompsonrh等人2004proc.natl.acad.sci.usa101:17174-79;wuc等人2006actahistochem.108:19-24)。另外,这些研究表明,肿瘤上较高水平的pd-l1表达可能促进肿瘤分期的进展和侵袭更深的组织结构。pd-1通路也可在血液系统恶性肿瘤中发挥作用。pd-l1在多发性骨髓瘤细胞上表达,但在正常浆细胞上不表达(liuj等人,2007blood110:296-304)。pd-l1在某些原发性t细胞淋巴瘤,特别是间变性大细胞t淋巴瘤上表达(brownja等人,2003immunol.170:1257-66)。pd-1在血管免疫母细胞性淋巴瘤的t细胞上高表达,而pd-l1在相关的滤泡树突状细胞网络上表达(dorfmandm等人2006amj.surg.pathol.30:802-10)。在结节性淋巴细胞为主的霍奇金淋巴瘤中,与淋巴细胞或组织细胞(l&h)相关的t细胞表达pd-1。使用由pd-1连接诱导的基因的读数进行的微阵列分析表明,在霍奇金淋巴瘤中,与肿瘤相关的t细胞原位响应pd-1信号(chemnitzjm等人,2007blood110:3226-33)。pd-1和pd-l1在htlv-1介导的成人t细胞白血病和淋巴瘤的cd4t细胞上表达(shimauchit等人,2007int.j.cancer121:2585-90)。这些肿瘤细胞对tcr信号反应低下。动物模型中的研究表明,肿瘤上的pd-l1抑制t细胞活化和肿瘤细胞裂解,在某些情况下会导致肿瘤特异性t细胞死亡增加(dongh等人,2002nat.med.8:793-800;hiranof等人,2005cancerres.65:1089-96)。肿瘤相关的apc也可以利用pd-1:pd-l1通路来控制抗肿瘤t细胞反应。在一群肿瘤相关的髓样dc上pd-l1表达受肿瘤环境因子上调(curieltj等人,2003nat.med.9:562-67)。在b16黑色素瘤的肿瘤引流淋巴结中的浆细胞样树突状细胞(dc)表达ido,其强烈激活调节性t细胞的抑制活性。ido处理的调节性t细胞的抑制活性需要细胞与表达ido的dc接触(sharmamd等人,2007clin.invest.117:2570-82)。在一个实施方案中,第二肽配体包含结合pd-l1的双环肽配体。结合pd-l1的双环肽配体的合适示例在gb专利申请号1820956.9和1820969.2中公开,其中的肽通过引用并入本文。在一个实施方案中,结合pd-l1的双环肽配体包含选自以下的氨基酸序列:ci[harg]dwciihwtfshghpciii(seqidno:12);cisagwltmciiqklhlciii(seqidno:13);和cisagwltmciiq[k(pya)]lhlciii(seqidno:14);其中ci、cii和ciii分别代表第一、第二和第三半胱氨酸残基,harg代表高精氨酸,而pya代表4-戊炔酸或其药学上可接受的盐。在另一个实施方案中,结合pd-l1的双环肽配体包含n-末端和/或c-末端修饰,以及包含:[pya]-[b-ala]-[sar10]-(seqidno:12)(以下称为bcy8938);[pya]-[b-ala]-[sar10]-sdk-(seqidno:13)(以下称为bcy10043);nh2-sdk-(seqidno:13)-[sar10]-[k(pya)](以下称为bcy10044);nh2-sdk-(seqidno:14)(以下称为bcy10045);和ac-sdk-(seqidno:14)-psh(以下称为bcy10861);其中pya代表4-戊炔酸,b-ala代表β-丙氨酸,sar10代表10肌氨酸单元,或其药学上可接受的盐。在另一个实施方案中,在癌细胞上存在的组分是粘连蛋白-4(nectin-4)。粘连蛋白-4是属于蛋白质的粘连蛋白(nectin)家族的表面分子,其包含4个成员。粘连蛋白是在发育和成年期间对于上皮、内皮、免疫和神经元细胞的各种生物学过程(例如极化、增殖、分化和迁移)中起关键作用的细胞粘附分子。它们参与了人的几种病理过程。它们是脊髓灰质炎病毒、单纯疱疹病毒和麻疹病毒的主要受体。编码粘连蛋白-1(pvrl1)或粘连蛋白-4(pvrl4)的基因中的突变引起与其他异常相关的外胚层发育不良综合征。粘连蛋白-4在胎儿发育中表达。在成人组织中,其表达比该家族其他成员更受限制。粘连蛋白-4是肿瘤相关抗原,分别存在于50%、49%和86%的乳腺癌、卵巢癌和肺癌中,主要存在于不良预后的肿瘤中。在相应的正常组织中未检测到其表达。在乳腺肿瘤中,粘连蛋白-4主要在三阴性和erbb2+癌中表达。在患有这些癌症的患者的血清中,检测到可溶形式的粘连蛋白-4与不良预后相关。血清粘连蛋白-4的水平在转移进展中升高,并且在治疗后降低。这些结果表明,粘连蛋白-4可能是治疗癌症的可靠靶标。因此,在现有技术中已经描述了几个抗粘连蛋白-4抗体。具体地,enfortumabvedotin(asg-22me)是靶向粘连蛋白-4的抗体-药物偶联物(adc),并且目前已在临床上研究以治疗患有实体瘤的患者。在一个实施方案中,第二肽配体包含结合粘连蛋白-4的双环肽配体。结合粘连蛋白-4的双环肽配体的合适示例在gb专利申请号1810250.9、1815684.4和1818499.4中公开,其中的肽通过引用并入本文。在一个实施方案中,结合粘连蛋白-4的双环肽配体包含选自以下的氨基酸序列:cip[1nal][dd]ciim[harg]dwstp[hyp]wciii(seqidno:15;以下称为bcy8116);cip[1nal][dd]ciim[harg]d[dw]stp[hyp][dw]ciii(seqidno:16;以下称为bcy11415);和cip[1nal][dk](sar10-(b-ala))ciim[harg]dwstp[hyp]wciii(seqidno:17);cipfgciim[harg]dwstp[hyp]wciii(seqidno:18;以下称为bcy11414);其中ci、cii和ciii分别代表第一、第二和第三半胱氨酸残基,1nal代表1-萘丙氨酸,harg代表高精氨酸,hyp代表羟基脯氨酸,sar10代表10肌氨酸单元,b-ala代表β-丙氨酸,或其药学上可接受的盐。在另一个实施方案中,结合粘连蛋白-4的双环肽配体任选地包含n-末端修饰并包括:seqidno:15(以下称为bcy8116);[pya]-[b-ala]-[sar10]-(seqidno:15)(以下称为bcy8846);seqidno:16(以下称为bcy11415);[pya]-[b-ala]-[sar10]-(seqidno:16)(以下称为bcy11942);ac-(seqidno:17)(以下称为bcy8831);和seqidno:18(以下称为bcy11414);其中pya代表4-戊炔酸、b-ala代表β-丙氨酸、sar10代表10肌氨酸单元,或其药学上可接受的盐。在另一个实施方案中,癌细胞上存在的组分是前列腺特异性膜抗原(psma)。前列腺特异性膜抗原(psma)(也称为谷氨酸羧肽酶ii(gcpii)、n-乙酰基-l-天冬氨酰-l-谷氨酸肽酶i(naaladasei)和naag肽酶)是在人中由folh1(叶酸水解酶1)基因编码的酶。人gcpii包含750个氨基酸,重约84kda。人psma在前列腺中高表达,比大多数其他组织高约100倍。在某些前列腺癌中psma是第二高上调的基因产物,比非癌性前列腺细胞的水平高8到12倍。由于这种高表达,psma正在被开发为用于某些癌的治疗和成像的有效生物标记物。在人前列腺癌中,更高表达的肿瘤与更快时间的进展以及更大百分比的复发患者相关。在一个实施方案中,第二肽配体包含结合psma的双环肽配体。结合psma的双环肽配体的合适示例在gb专利申请号1810318.4、1810325.9以及1820325.7中公开,其中的肽通过引用并入本文。接头应当理解,第一肽配体可以通过任何合适的接头与第二肽配体缀合。通常,所述接头的设计应使得两个双环肽以这样的方式存在:它们可以不受阻碍地与其相应的靶结合,所述相应的靶单独存在或同时与两个靶受体结合。另外,接头应允许同时结合两个靶,并且在靶标细胞之间保持适当的距离,这将导致所想要的功能结果(outcome)。可以调节接头的性质以增加长度、刚性或溶解度以优化所想要的功能结果。还可以设计接头以允许将多于一个的双环(bicycle)附着在相同的靶上。增加任一种结合肽的化合价可用于增加异源串联对靶细胞的亲和力或可有助于诱导一种或两种靶受体的寡聚反应(oligomerisation)。在一个实施方案中,接头选自以下序列:-ch2-、-peg5-、-peg10-、-peg12-、-peg23-、-peg24-、-peg15-sar5-、-peg10-sar10-、-peg5-sar15-、-peg5-sar5-、-b-ala-sar20-、-b-ala-sar10-peg10-、-b-ala-sar5-peg15-和-b-ala-sar5-peg5-。合适的接头的结构表示如下:异源串联复合物在一个具体的实施方案中,第一肽配体包含与tata支架附着的结合cd137的双环肽配体,第二肽配体包含与tata支架附着的结合epha2的双环肽配体,以及所述异源串联复合物选自:异源串联双环肽复合物bcy7985由cd137特异性肽bcy7859,经由peg12连接到epha2特异性肽bcy6169的n末端pya基团组成(如图2所示)。cd137是同三聚体蛋白,天然配体cd137l作为同三聚体存在,可以在免疫细胞上表达或分泌。cd137的生物学高度依赖于多聚化以诱导免疫细胞中的cd137活性。产生cd137多聚体的一种方法是通过cd137特异性激动剂与另一细胞上存在的特异性受体相互作用而使细胞交联。epha2在肿瘤细胞上高度表达,该受体酪氨酸激酶通过肝配蛋白-a配体的寡聚反应驱动其活化。不受理论限制,发明人认为,由一个epha2-特异性肽偶联至一个cd137-特异性肽组成的epha2-cd137异源串联起作用交联cd137。这意味着cd137将在细胞(例如肿瘤细胞)中存在epha2的情况下多聚化并被激活。这将驱动局部肿瘤环境中的cd137免疫细胞活化(图1)。这种假设在本文所述的cd137细胞活性报告子分析中进行了测试,并且这里在图3中显示结果,其中可以看出,在存在表达epha2的ht1080细胞的情况下,在promegacd137荧光素酶报告子分析(cs196008)中,bcy7985显示出对cd137细胞活性强诱导。在一个可选择的特定实施方案中,第一肽配体包含与tata支架附着的结合cd137的双环肽配体,第二肽配体包含与tata支架附着的结合粘连蛋白-4的双环肽配体,以及所述异源串联复合物选自:不受限于理论,发明人认为,与上文对epha2所述的相同方式,由一个粘连蛋白-4特异性肽偶联一个cd137-特异性肽组成的粘连蛋白-4-cd137异源串联作用为交联cd137。在一个实施方案中,粘连蛋白-4-cd137异源串联不是以下任何一种或多种:bcy11857、bcy11858和/或bcy11859。在一个可选择的特定实施方案中,第一肽配体包含与tata支架附着的结合cd137的双环肽配体,第二肽配体包含与tata支架附着的结合pd-l1的双环肽配体,以及所述异源串联复合物选自:不受限于理论,发明人认为,与上文对epha2所述的相同方式,由一个pd-l1特异性肽偶联一个cd137-特异性肽组成的pd-l1-cd137异源串联作用为交联cd137。除非另有定义,否则本文所用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义,例如在肽化学、细胞培养和噬菌体展示、核酸化学和生物化学领域中。将标准技术用于分子生物学、遗传和生化方法(参见sambrook等人,molecularcloning:alaboratorymanual,第3版,2001,coldspringharborlaboratorypress,coldspringharbor,ny;ausubel等人,shortprotocolsinmolecularbiology(1999)第4版,johnwiley&sons,inc.),在此引用作为参考。命名法编号当提及本发明的化合物内的氨基酸残基位置时,由于半胱氨酸残基是不变的,因而从编号中省略了半胱氨酸残基(ci、cii和ciii),因此,seqidno:1中氨基酸残基的编号如下所示:ci-i1-e2-e3-g4-q5-y6-cii-f7-a8-d9-p10-y11-[nle]12-ciii(seqidno:1)为了说明的目的,假定所有双环肽都被tbmb(1,3,5-三(溴甲基)苯)或1,1′,1″-(1,3,5-三嗪烷-1,3,5-三基)三丙-2-烯-1-酮(tata)环化并生成三取代结构。tbmb和tata的环化反应发生ci、cii和ciii。分子式双环核心序列的n-或c-末端延伸区添加到序列的左侧或右侧,并以连字符分隔。例如,n末端βala-sar10-ala尾巴将表示为:βala-sar10-a-(seqidno:x)。反向肽序列根据nair等人(2003)jimmunol170(3),1362-1373中的公开,设想本文公开的肽序列也将以其逆反形式使用。例如,该序列被颠倒(即n末端变成c末端,反之亦然),它们的立体化学也被颠倒(即d-氨基酸变成l-氨基酸,反之亦然)。肽配体如本文所指,肽配体是指与分子支架共价结合的肽。通常,这样的肽包含两个或更多个能够与支架形成共价键的反应性基团(即半胱氨酸残基),以及在所述反应性基团之间相对(subtended)的序列,因为肽与支架结合时该序列形成环,因而其被称为环序列。在当前情况下,肽包含至少三个半胱氨酸残基(在本文中称为ci、cii和ciii),并在支架上形成至少两个环。药学上可接受的盐应当理解,盐形式属于本发明的范围内,并且提及肽配体时包括所述配体的盐形式。可以通过常规化学方法,例如在pharmaceuticalsalts:properties,selection,anduse,p.heinrichstahl(编)、camilleg.wermuth(编)isbn:3-90639-026-8精装388页,2002年8月中描述的方法,从含有碱性或酸性部分(moiety)的母体化合物来合成本发明的盐。通常,可以通过使这些化合物的游离酸或碱形式与水中、或在有机溶剂中、或在两者的混合物中的适当的碱或酸进行反应,来制备这些盐。可以用多种酸(无机和有机酸)形成酸加成盐(单盐或二盐)。酸加成盐的示例包括与选自以下的酸形成的单盐或二盐:乙酸、2,2-二氯乙酸、己二酸、藻酸、抗坏血酸(例如l-抗坏血酸)、l-天冬氨酸、苯磺酸、苯甲酸、4-乙酰胺基苯甲酸、丁酸、(+)樟脑酸、樟脑磺酸、(+)-(1s)-樟脑-10-磺酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、2-羟基乙磺酸、甲酸、富马酸、半乳酸、龙胆酸、葡庚糖酸、d-葡萄糖酸、葡萄糖醛酸(如d-葡萄糖醛酸)、谷氨酸(如l-谷氨酸)、α-氧代戊二酸、乙醇酸、马尿酸、氢卤酸(如氢溴酸、盐酸、氢碘酸)、羟乙基磺酸、乳酸(例如(+)-l-乳酸、(±)-dl-乳酸)、乳糖酸、马来酸、苹果酸、(-)-l-苹果酸、丙二酸、(±)-dl-扁桃酸、甲磺酸、萘-2-磺酸、萘-1,5-二磺酸、1-羟基-2-萘甲酸、烟碱、硝酸、油酸、乳清酸、草酸、棕榈酸、帕莫酸、磷酸、丙酸、丙酮酸、l-焦谷氨酸、水杨酸、4-氨基水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、丹宁酸、(+)-l-酒石酸、硫氰酸、对甲苯磺酸、十一烯酸和戊酸、以及酰化氨基酸和阳离子交换树脂。一组具体的盐由以下形成的盐组成:乙酸、盐酸、氢碘酸、磷酸、硝酸、硫酸、柠檬酸、乳酸、琥珀酸、马来酸、苹果酸、羟乙基磺酸、富马酸、苯磺酸、甲苯磺酸、硫酸、甲磺酸(甲磺酸盐)、乙磺酸、萘磺酸、戊酸、丙酸、丁酸、丙二酸、葡萄糖醛酸和乳糖酸。一种具体的盐是盐酸盐。另一种具体的盐是乙酸盐。如果化合物是阴离子化合物,或具有可以是阴离子的官能团(例如,-cooh可以是-coo-),则可以与有机或无机碱形成盐,产生合适的阳离子。合适的无机阳离子的示例包括但不限于碱金属离子,如li+、na+和k+;碱土金属阳离子,如ca2+和mg2+;和其他阳离子。如al3+或zn+。合适的有机阳离子的示例包括但不限于铵离子(即nh4+)和取代的铵离子(例如,nh3r+、nh2r2+、nhr3+、nr4+)。一些合适的取代铵离子的示例是衍生自以下的那些:甲胺、乙胺、二乙胺、丙胺、二环己胺、三乙胺、丁胺、乙二胺、乙醇胺、二乙醇胺、哌嗪、苄胺、苯基苄胺、胆碱、葡甲胺和氨丁三醇,以及氨基酸,如赖氨酸和精氨酸。常见的季铵离子的示例是n(ch3)4+。当本发明的化合物含有胺官能团时,这些可以形成季铵盐,例如通过根据本领域技术人员熟知的方法与烷化剂反应。这样的季铵化合物在本发明的范围内。修饰衍生物应当理解,本文所定义的肽配体的修饰衍生物在本发明的范围内。此类合适的修饰衍生物的示例包括选自以下的一种或多种修饰:n-末端和/或c-末端修饰;用一个或多个非天然氨基酸残基替换一个或多个氨基酸残基(例如用一个或多个等位或等电子氨基酸替换一个或多个极性氨基酸残基;用其他非天然等位或等电子氨基酸替换一个或多个非极性氨基酸残基);添加间隔基团;用一个或多个氧化抗性氨基酸残基替换一个或多个氧化敏感性氨基酸残基;用丙氨酸替换一个或多个氨基酸残基,用一个或多个d-氨基酸残基替换一个或多个l-氨基酸残基;双环肽配体内一个或多个酰胺键的n-烷基化;用替代性键替换一个或多个肽键;肽主链长度修饰;用其他化学基团取代一个或多个氨基酸残基的α-碳上的氢,用合适的胺、硫醇、羧酸和酚反应性试剂修饰氨基酸(例如半胱氨酸、赖氨酸、谷氨酸/天冬氨酸和酪氨酸),使得所述氨基酸官能化,以及引入或替换引入适合于官能化的正交反应性氨基酸,例如叠氮或带有炔基的氨基酸,其分别允许用带有炔或叠氮的部分进行官能化。在一个实施方案中,修饰的衍生物包括n-末端和/或c-末端修饰。在另一个实施方案中,其中所述修饰的衍生物包括使用合适的氨基反应化学的n-末端修饰,和/或使用合适的羧基反应化学的c-末端修饰。在另一个实施方案中,所述n-末端或c-末端修饰包括添加效应基团,所述效应基团包括但不限于细胞毒性剂、放射螯合剂或发色团。在另一个实施方案中,修饰的衍生物包括n-末端修饰。在另一个实施方案中,n-末端修饰包括n-末端乙酰基。在该实施方案中,在肽合成过程中,n-末端半胱氨酸基团(在本文中称为ci的基团)被乙酸酐或其他合适的试剂封端,从而产生n-末端乙酰化的分子。该实施方案提供了去除氨基肽酶的潜在识别点的优点,避免了双环肽降解的可能性。在一个可选的实施方案中,n-末端修饰包括添加分子间隔基团,其促进效应基团的缀合并保留双环肽对其靶标的效力。在另一个实施方案中,修饰的衍生物包括c-末端修饰。在另一个实施方案中,c-末端修饰包含酰胺基。在该实施方案中,c-末端半胱氨酸基团(本文中称为ciii的基团)在肽合成过程中作为酰胺合成,从而产生c-末端被酰胺化的分子。该实施方案提供了去除羧肽酶的潜在识别点的优点,降低了双环肽被蛋白水解降解的可能性。在一个实施方案中,修饰的衍生物包括用一个或多个非天然氨基酸残基替换一个或多个氨基酸残基。在该实施方案中,可以选择具有等位/等电子侧链的非天然氨基酸,其既不被降解蛋白酶识别,也不对靶标效力产生任何不利影响。备选地,可以使用具有受约束的氨基酸侧链的非天然氨基酸,使得附近肽键的蛋白水解性水解在构象和空间上受到阻碍。具体地,这涉及脯氨酸类似物、庞大的侧链、cα-二取代的衍生物(例如氨基异丁酸、aib)和环氨基酸,简单的衍生物是氨基-环丙基羧酸。在一个实施方案中,修饰的衍生物包括添加间隔基团。在另一个实施方案中,修饰的衍生物包括向n-末端半胱氨酸(ci)和/或c-末端半胱氨酸(ciii)添加间隔基团。在一个实施方案中,修饰的衍生物包括用一个或多个氧化抗性氨基酸残基替换一个或多个氧化敏感性氨基酸残基。在另一个实施方案中,修饰的衍生物包括用萘基丙氨酸或丙氨酸残基替换色氨酸残基。该实施方案提供了改善所得双环肽配体的药物稳定性谱的优点。在一个实施方案中,修饰的衍生物包括用一个或多个疏水性氨基酸残基替换一个或多个带电荷的氨基酸残基。在另一个实施方案中,修饰的衍生物包括用一个或多个带电荷的氨基酸残基替换一个或多个疏水性氨基酸残基。带电荷的氨基酸残基与疏水性氨基酸残基的正确平衡是双环肽配体的重要特征。例如,疏水性氨基酸残基影响血浆蛋白结合的程度,从而影响血浆中可用的游离组分的浓度,而带电荷的氨基酸残基(尤其是精氨酸)可能会影响肽与细胞表面磷脂膜的相互作用。两者的组合可能影响肽药物的半衰期、分布体积和暴露量,并且可以根据临床终点进行调整。另外,带电荷的氨基酸残基与疏水性氨基酸残基的正确组合和数量可以降低注射部位的刺激性(如果肽药物已通过皮下施用)。在一个实施方案中,修饰的衍生物包括用一个或多个d-氨基酸残基替换一个或多个l-氨基酸残基。该实施方案被认为是通过空间位阻和通过d-氨基酸稳定β-转角构象的倾向来增加蛋白水解稳定性(tugyi等人(2005)pnas,102(2),413–418)。在一个实施方案中,修饰的衍生物包括去除任何氨基酸残基并用丙氨酸取代。该实施方案提供了去除潜在的蛋白水解攻击位点的优点。应当注意的是,每个上述修饰都用于有意地改善肽的效力或稳定性。通过以下机制可以实现基于修饰的进一步效能的改善:-并入利用疏水作用并导致较低的解离率的疏水部分,从而实现更高的亲和力;-并入利用长距离离子相互作用的带电荷的基团,从而导致更快的结合速率和更高的亲和力(参见例如schreiber等人,rapid,electrostaticallyassistedassociationofproteins(1996),naturestruct.biol.3,427-31);和-并入另外的对肽的约束,例如通过正确地约束氨基酸的侧链以使得在靶标结合时熵的损失最小,约束主链的扭转角以使得在靶标结合时熵的损失最小,并且出于相同的原因在分子中引入另外的环化。(关于综述,参见gentilucci等人,curr.pharmaceuticaldesign,(2010),16,3185-203,和nestor等人,curr.medicinalchem(2009),16,4399-418)。同位素变异本发明包括所有药学上可接受的(放射性)同位素标记的本发明肽配体,其中一个或多个原子被具有相同原子序数但原子质量或质量数不同于自然界中通常发现的原子质量或质量数的原子所取代,本发明的肽配体,其中附着能够保持相关的(放射性)同位素的金属螯合基团(称为“效应物”),以及本发明的肽配体,其中某些官能团被相关的(放射性)同位素或同位素标记的官能团共价取代。适合包含在本发明肽配体中的同位素的示例包括氢的同位素,如2h(d)和3h(t);碳,如11c、13c和14c;氯,如36cl;氟,如18f;碘,如123i、125i和131i;氮,如13n和15n;氧,如15o、17o和18o;磷,如32p;硫,如35s;铜,如64cu;镓,如67ga或68ga;钇,如90y;和镏,如177lu;和铋,如213bi。某些同位素标记的本发明肽配体,例如并入放射性同位素的那些,可用于药物和/或底物组织分布的研究中,并用于临床评估患病组织中粘连蛋白-4(nectin-4)靶标的存在和/或不存在。本发明的肽配体还可具有有价值的诊断性质,因为它们可用于检测或鉴定标记化合物与其他分子、肽、蛋白、酶或受体之间复合物的形成。检测或鉴定方法可以使用标记有标记试剂的化合物,如放射性同位素、酶、荧光物质、发光物质(例如鲁米诺、鲁米诺衍生物、荧光素、水母发光蛋白和荧光素酶)等。鉴于其易于并入和现成的检测手段,放射性同位素氚(即3h(t))和碳-14(即14c)特别适用于此目的。用较重的同位素如氘(即2h(d))取代,可以提供由于更高的代谢稳定性导致的某些治疗优势,例如体内半衰期延长或剂量需求减少,因此在某些情况下可能是优选的。用正电子发射同位素(如11c、18f、15o和13n)取代,可用于正电子发射断层扫描(pet)研究,以检查靶标占有率。通常可以通过本领域技术人员已知的常规技术或通过与所附实施例中描述的那些方法类似的方法,使用适当的同位素标记试剂代替之前所用的非标记试剂,制备本发明肽配体的同位素标记的化合物。分子支架分子支架描述于例如wo2009/098450和其中引用的参考文献,特别是wo2004/077062和wo2006/078161。如前述文献所述,分子支架可以是小分子,例如有机小分子。在一实施方案中,分子支架可以是大分子。在一个实施方案中,分子支架是由氨基酸、核苷酸或碳水化合物组成的大分子。在一个实施方案中,分子支架包含能够与多肽的官能团反应以形成共价键的反应性基团。分子支架可以包含与肽形成连接的化学基团,例如胺、硫醇、醇、酮、醛、腈、羧酸、酯、烯烃、炔烃、叠氮化物、酸酐、琥珀酰亚胺、马来酰亚胺、烷基卤化物和酰基卤化物。在一个实施方案中,分子支架可以包含六氢-1,3,5-三嗪,尤其是1,3,5-三丙烯酰基六氢-1,3,5-三嗪('tata')或其衍生物,或可以由其组成。在一实施方案中,分子支架是2,4,6-三(溴甲基)均三甲苯。该分子类似于1,3,5-三(溴甲基)苯(tbmb),但包含三个另外的连接至苯环的甲基。这样做的优点是,另外的甲基可以与多肽形成进一步的接触,因此增加了另外的结构约束。本发明的分子支架包含化学基团,其允许本发明的编码文库的多肽的官能团与分子支架形成共价连接。所述化学基团选自多种官能团,包括胺、硫醇、醇、酮、醛、腈、羧酸、酯、烯烃、炔烃、酸酐、琥珀酰亚胺、马来酰亚胺、叠氮化物、烷基卤化物和酰基卤化物。可以用于在分子支架上与半胱氨酸的硫醇反应的支架反应性基团是烷基卤化物(或也称为卤代烃或卤代烷)。示例包括溴甲基苯(以tbmb为例的支架反应性基团)或碘乙酰胺。用于选择性地将化合物与蛋白质中的半胱氨酸偶联的其他支架反应性基团是马来酰亚胺、含有αβ不饱和羰基的化合物和含有α卤代甲基羰基的化合物。可以在本发明中用作分子支架的马来酰亚胺的示例包括:三-(2-马来酰亚胺基乙基)胺、三-(2-马来酰亚胺基乙基)苯、三-(马来酰亚胺基)苯。包含αβ不饱和羰基的化合物的示例是1,1',1”-(1,3,5-三嗪烷-1,3,5-三基)三丙-2-烯-1-酮(tata)(angewandtechemie,国际版(2014),53(6),1602-1606)。包含α卤代甲基羰基的化合物的示例是n,n',n”-(苯-1,3,5-三基)三(2-溴乙酰胺)。硒代半胱氨酸也是一种天然氨基酸,其与半胱氨酸具有相似的反应性,可用于相同的反应。因此,无论在何处提及半胱氨酸,除非上下文另外指出,否则通常都可以用硒代半胱氨酸代替。合成本发明的肽可以通过标准技术合成制备,然后与分子支架在体外反应。进行此操作时,可以使用标准化学方法。这样可以快速大规模地制备可溶性材料,以用于进一步的下游实验或验证。以使用诸如timmerman等人(同上)中公开的常规化学方法来完成这样的方法。因此,本发明还涉及如本文所述选择的多肽或偶联物的制备,其中所述制备任选地包括如下所述的其他步骤。在一个实施方案中,这些步骤在通过化学合成制备的最终产物多肽/偶联物上进行。当制备偶联物或复合物时,感兴趣多肽中的氨基酸残基可任选被取代。肽也可以延伸,以并入例如另一个环并因此引入多种特异性。为了延伸该肽,可以使用正交保护的赖氨酸(和类似物)、使用标准固相或液相化学方法,简单地在其n-末端或c-末端或在环内进行化学延伸。可以使用标准的(生物)缀合技术来引入激活的或可激活的n-或c-末端。备选地,可以通过片段缩合或天然化学连接进行添加,例如,如(dawson等人1994.synthesisofproteinsbynativechemicalligation.science266:776-779)所述,或者通过酶进行添加,例如,使用如(chang等人procnatlacadsciusa.1994dec20;91(26):12544-8或hikari等人bioorganic&medicinalchemistryletters第18卷,第22期,2008年11月15日,第6000-6003页)所述的变位酶(subtiligase)。或者,可以通过二硫键的进一步缀合来延伸或修饰肽。这具有额外的优点,即在细胞的还原环境中允许第一和第二肽彼此一次解离。在这种情况下,可以在第一肽的化学合成过程中加入分子支架(例如tbmb),以便与三个半胱氨酸基团反应;然后可以将另外的半胱氨酸或硫醇附加到第一肽的n或c-末端,这样该半胱氨酸或硫醇仅与第二肽的游离半胱氨酸或硫醇反应,形成二硫键连接的双环肽-肽偶联物。类似的技术同样适用于两个双环和双特异性大环的合成/偶联,潜在地产生四特异性分子。此外,可以以相同的方式、使用适当的化学方法、在n-或c-末端或经由侧链偶联而实现其他官能团或效应基团的添加。在一个实施方案中,以不阻碍任何一个实体的活性的方式进行偶联。药物组合物根据本发明的另一方面,本发明提供一种药物组合物,其包含本文定义的肽配体以及一种或多种药学上可接受的赋形剂。一般地,本发明的肽配体将与药理学上适当的赋形剂或载体一起以纯化的形式使用。典型地,这些赋形剂或载体包括水性或醇/水溶液、乳剂或混悬液,包括生理盐水和/或缓冲介质。肠胃外载剂包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠和乳酸林格氏试剂。如果需要在混悬液中保持多肽复合物,合适的生理学上可接受的佐剂可以选自增稠剂如羧甲基纤维素、聚乙烯吡咯烷酮、明胶和海藻酸盐。静脉内载剂包括流体和营养补充剂和电解质补充剂,如基于林格氏右旋糖的那些。还可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体(mack(1982)remington'spharmaceuticalsciences,第16版)。本发明的肽配体可以用作单独施用的组合物,或者与其他试剂结合施用。这些可以包括抗体、抗体片段和各种免疫治疗药物,例如环孢霉素、甲氨蝶呤、阿霉素或顺铂和免疫毒素。药物组合物可以包括与本发明的蛋白配体结合的各种细胞毒素或其他试剂的“鸡尾酒混合物”,或甚至包括具有不同特异性的根据本发明所选多肽的组合,例如使用不同靶标配体选择的多肽,而无论是否在施用之前进行合并。根据本发明的药物组合物的施用途径可以是本领域普通技术人员通常已知的那些。对于治疗方法,本发明的肽配体可以根据标准技术施用于任何患者。施用可以通过任何适当的模式,包括肠胃外、静脉内、肌肉内、腹腔内、经皮、经肺途径、或者适当地通过直接导管输注。优选地,通过吸入施用根据本发明的药物组合物。施用的剂量和频率取决于患者的年龄、性别和状况,其他药物的同时施用、禁忌症和临床医生要考虑的其他参数。本发明的肽配体可以被冻干储存并在使用前重构在合适的载体中。已经表明这种技术是有效的,并且可以采用本领域已知的冻干和重构技术。本领域技术人员将理解,冻干和重构可导致不同程度的活性损失,并且可能需要向上调整水平以进行补偿。可以施用含有本发明肽配体的组合物或其鸡尾酒混合物用于预防性和/或治疗性治疗。在某些治疗应用中,将实现所选细胞群体的至少部分抑制、阻遏、调节、杀死或某些其他可测量参数的足够量定义为“治疗有效剂量”。实现该剂量所想要的量将取决于疾病的严重程度和患者自身免疫系统的一般状态,但通常每千克体重0.005至5.0mg所选的肽配体,更常用0.05至2.0mg/kg/剂量的剂量。对于预防性应用,含有本发明肽配体的组合物或其鸡尾酒混合物也可以以相似或稍低的剂量施用。包含根据本发明的肽配体的组合物可以用于在预防和治疗环境中帮助改变、灭活、杀死或去除哺乳动物中的选择的靶细胞群体。此外,本文所述的肽配体可以选择性地用于在体外(extracorporeally)或体外(invitro),以从异质的细胞集合中杀死、消耗或以其他方式有效去除靶细胞群体。来自哺乳动物的血液可以与所选的肽配体体外组合,由此从血液中将不期望的细胞杀死或以其他方式去除,并根据标准技术返回哺乳动物。治疗用途根据本发明的另一方面,提供了如本文所定义的用于预防、抑制或治疗癌症的异源串联双环肽复合物。可以被治疗(或被抑制)的癌症(及其良性对应物)的示例,包括但不限于上皮起源的肿瘤(腺瘤和各种类型的癌,包括腺癌、鳞癌、移行细胞癌和其他癌),例如膀胱和泌尿道癌、乳腺癌、胃肠道癌(包括食道癌、胃(胃)癌、小肠癌、结肠癌、直肠癌和肛门癌)、肝癌(肝细胞癌)、胆囊和胆道系统癌、外分泌胰腺癌、肾癌、肺癌(例如腺癌、小细胞肺癌、非小细胞肺癌、支气管肺泡癌和间皮瘤)、头颈癌(例如舌癌、颊腔癌、喉癌、咽癌、鼻咽癌、扁桃体癌、唾液腺癌、鼻腔癌和鼻旁窦癌)、卵巢癌、输卵管癌、腹膜癌、阴道癌、外阴癌、阴茎癌、子宫颈癌、子宫肌瘤、子宫内膜癌、甲状腺癌(例如甲状腺滤泡癌)、肾癌、前列腺癌、皮肤和附属物癌(例如黑色素瘤、基底细胞癌、鳞状细胞癌、角化棘皮瘤、异常增生痣);血液系统恶性肿瘤(即白血病、淋巴瘤)和恶化前的血液系统疾病以及边缘恶性疾病,包括血液系统恶性肿瘤和淋巴谱系的相关病症(例如急性淋巴细胞性白血病[all]、慢性淋巴细胞性白血病[cll]、b细胞淋巴瘤如弥漫性大b细胞淋巴瘤[dlbcl]、滤泡性淋巴瘤、伯基特氏淋巴瘤、套细胞淋巴瘤、t细胞淋巴瘤和白血病、自然杀伤[nk]细胞淋巴瘤、霍奇金淋巴瘤、毛细胞白血病、意义不确定的单克隆丙种球蛋白病、浆细胞瘤、多发性骨髓瘤和移植后淋巴增生性疾病)、和血液系统恶性肿瘤和髓系的相关病症(例如急性髓性白血病[aml]、慢性髓性白血病[cml]、慢性骨髓单核细胞白血病[cmml]、嗜酸性粒细胞增多综合征、骨髓增生性疾患,例如真性红细胞增多症、原发性血小板增多症和原发性骨髓纤维化、骨髓增生综合征、骨髓增生异常综合症和早幼粒细胞性白血病);间充质起源的肿瘤,例如软组织肉瘤、骨或软骨肉瘤,例如骨肉瘤、纤维肉瘤、软骨肉瘤、横纹肌肉瘤、平滑肌肉瘤、脂肪肉瘤、血管肉瘤、卡波西肉瘤、尤因肉瘤、滑膜肉瘤、上皮样肉瘤、胃肠道间质瘤、良性和恶性组织肉瘤以及隆突性皮纤维肉瘤;中枢或周围神经系统的肿瘤(例如星形细胞瘤、神经胶质瘤和胶质母细胞瘤、脑膜瘤、室管膜瘤、松果体瘤和神经鞘瘤);内分泌肿瘤(例如垂体瘤、肾上腺肿瘤、胰岛细胞瘤、甲状旁腺肿瘤、类癌和甲状腺髓样癌);眼和附属器肿瘤(例如视网膜母细胞瘤);生殖细胞和滋养细胞肿瘤(例如畸胎瘤、精原细胞瘤、胚芽细胞瘤、葡萄胎和绒毛膜癌);以及小儿和胚胎肿瘤(例如,髓母细胞瘤、神经母细胞瘤、威尔姆斯肿瘤和原始神经外胚层肿瘤);或先天性或其他形式的综合征,使患者容易患恶性肿瘤(例如着色性干皮病)。在另一个实施方案中,所述癌症选自造血系统恶性肿瘤,例如选自:非霍奇金淋巴瘤(nhl)、伯基特淋巴瘤(bl)、多发性骨髓瘤(mm)、b慢性淋巴细胞性白血病(b-cll)、b和t急性淋巴细胞性白血病(all)、t细胞淋巴瘤(tcl)、急性髓性白血病(aml)、毛细胞白血病(hcl)、霍奇金淋巴瘤(hl)和慢性粒细胞白血病(cml)。本文中对术语“预防”的引用涉及在诱发疾病之前施用保护性组合物。“抑制”是指在诱导事件之后但在疾病的临床表现之前施用组合物。“治疗”涉及在疾病症状变得明显之后施用保护性组合物。有可用于筛选肽配体在预防或治疗疾病中的有效性的动物模型系统。本发明允许开发可以与人和动物靶标交叉反应的多肽配体,从而允许使用动物模型,这促进了动物模型系统的使用。下面参考以下实施例进一步描述本发明。实施例实施例1:接头的合成com128化合物1(700.0mg、1.18mmol、1.0eq)、3-叠氮丙-1-胺(117.66mg、1.18mmol、1.0eq)、edci(270.4mg、1.41mmol、1.2eq)、hobt(190.6mg、1.41mmol、1.2eq))的混合物溶解于dcm(20ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌1小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:677.33,实测值m/z:678.2([m+h]+))。蒸发溶剂以产生获得呈白色固体的化合物2(600mg,粗品)。化合物2(600.0mg、885.3μmol、1.0eq)、n-乙基乙胺(1.29g、15.19mmol、1.50ml、17.2eq)的混合物溶解于dcm(3ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于25-30℃搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:455.51,实测值m/z:456.3([m+h]+))。蒸发溶剂以产生获得呈无色油的化合物3(400mg、粗品)。化合物3(150.0mg、329.3μmol、1.0eq)、化合物4(320.1mg、329.3μmol、1.0eq)、hatu(125.2mg、329.3μmol、1.0eq)、diea(42.6mg、329.3μmol、57.4μl、1.0eq)的混合物溶解于dmf(2ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于25-30℃搅拌2。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1408.76,实测值m/z:705.3([m/2+h]+))。蒸发溶剂以产生获得呈黄色油的化合物5(400mg、粗品)。化合物5(400mg、283.77μmol、1.0eq)溶解在dmf中(4ml、预脱气并用n2吹扫3次),接着添加哌啶(862.2mg、10.13mmol、1ml、35.7eq),然后将混合物在n2气氛下于25-30℃搅拌15分钟。lc-ms显示化合物5已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1187.37,实测值m/z:594.4([m/2+h]+)、1187.4([m/3+h]+))。蒸发溶剂以产生获得呈无色油的com128(250mg,粗品)。com129化合物1(1.4g、1.47mmol、1.0eq)、3-叠氮丙-1-胺(162.1mg、1.62mmol、1.1eq)、edci(338.6mg、1.77mmol、1.2eq)、hobt(238.7mg、1.77mmol、1.2eq)的混合物溶解于dcm(5ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌1小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1033.14,实测值m/z:1033.2([m+h]+))。用几滴1mhcl处理反应混合物,并减压蒸发有机层以除去溶剂。获得呈黄色油的化合物2(1.1g,粗品)。化合物2(1.1g、1.06mmol、1.0eq)、n-乙基乙胺(3.89g、53.24mmol、5.48ml、50eq)的混合物溶解于dcm(5ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌1小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:810.90,实测值m/z:810.9([m+h]+))。将反应混合物在减压下蒸发以及获得呈白色固体的化合物3(810mg、粗品)。化合物3(810.0mg、998.9μmol、1.0eq)、化合物4(810.7mg、1.10mmol、1.1eq)、hatu(455.8mg、1.20mmol、1.2eq)、diea(258.2mg、2.00mmol、348.0μl、2.0eq)的混合物溶解于dmf(2ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于25-30℃搅拌2。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1530.72,实测值m/z:765.5([m/2+h]+))。用几滴1mhcl处理反应混合物,收集有机层并在减压下蒸发有机层以除去溶剂。获得呈黄色固体的化合物5(1.1g,粗品)。化合物5(1g、653.29μmol、1.0eq)溶解在dcm中(10ml、预脱气并用n2吹扫3次),接着添加哌啶(2.39g、32.66mmol、3.36ml、50eq),然后将混合物在n2气氛下于25-30℃搅拌2小时。lc-ms显示化合物5已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1308.47,实测值m/z:1308.4([m+h]+))。通过制备型hplc(tfa条件:a相:h2o中0.075%tfa,b相:mecn,柱:luna200*25mm10um,c18,110a和gemin150*30mm,c18,5um,110a,连接,50℃)纯化残余物。获得呈黄色固体的com129(700mg、463.72μmol、产率70.98%)。com130化合物1(291mg、222.75μmol、1.0eq)、3-叠氮丙-1-胺(24.53mg、245.02μmol、1.1eq)、edci(51.24mg、267.30μmol、1.2eq)、hobt(36.12mg、267.30μmol、1.2eq)的混合物溶解于dcm(3ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌1小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:1388.53,实测值m/z:694.7([m/2+h]+))。通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的化合物2(200mg、144.04μmol、产率64.66%)。化合物2(200mg、144.04μmol、1.0eq)、n-乙基乙胺(210.7mg、2.88mmol、297μl、20.0eq)的混合物溶解于dcm(3ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌1小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:1166.29,实测值m/z:1166.3([m+h]+))。蒸发反应混合物,获得呈黄色油的化合物3(150mg、粗品)。化合物3(150mg、128.61μmol、1.0eq)、化合物4(75mg、144.91μmol、1.13eq)、hatu(58.7mg、154.34μmol、1.2eq)和diea(33.24mg、257.23μmol、44.80μl、2.0eq)的混合物溶解于dmf(5ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1665.84,实测值m/z:833.2([m/2+h]+))。在减压下除去溶剂以及获得呈黄色油的化合物5(300mg、粗品)。向粗的化合物5(300mg,溶解在10ml的dmf中)加入哌啶(2ml),混合物在30℃搅拌2小时。lcms显示检测到一个主峰具有所想要的m/z(mw:1443.60实测值m/z:722.7([m/2+h]+))。通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的com130(140mg、58.19μmol、产率32.31%、纯度60%)。com131化合物1(700.0mg、1.18mmol、1.0eq)、3-叠氮丙-1-胺(117.7mg、1.18mmol、1.0eq)、hobt(190.6mg、1.41mmol、1.2eq)、edci(270.4mg、1.41mmol、1.2eq))的混合物溶解于dcm(20ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于25-30℃搅拌2小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:677.75,实测值m/z:678.2([m+h]+))。用几滴1mhcl处理反应混合物,并收集有机层以及在减压下蒸发有机层。获得呈白色固体的化合物2(600.0mg,粗品)。化合物2(600.0mg、885.2μmol、1.0eq)溶解在dmf中(3ml、预脱气并用n2吹扫3次),接着添加哌啶(1.29g、15.19mmol、1.50ml、17.2eq),然后将混合物在n2气氛下于25-30℃搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:455.51实测值m/z:456.3([m+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈无色油的化合物3(400.0mg、879.1μmol)。化合物3(250.0mg、548.83μmol、1.0eq)、化合物4(284.1mg、548.83μmol、1eq)、hatu(229.6mg、603.72μmol、1.1eq)、diea(141.9mg、1.10mmol、191.19μl、2.0eq)的混合物在dcm(20ml,预脱气并用n2吹扫3次)中,然后将混合物在n2气氛下于25-30℃搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:955.06,实测值m/z:955.6([m+h]+))。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物5(400.0mg、419.1μmol)。化合物5(400.0mg、418.82μmol、1.0eq)的混合物溶解在dmf中(4ml、预脱气并用n2吹扫3次),接着添加哌啶(862.2mg、10.13mmol、1ml、24.2eq),然后将混合物在n2气氛下于25-30℃搅拌2小时。lc-ms显示化合物5已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:732.83实测值m/z:733.3([m+h]+))。通过制备型hplc(tfa条件)纯化残余物。获得呈无色油的com131(200mg、272.9μmol)。com470向com122(228mg、149.83μmol、1.0eq)、化合物1(51.31mg、164.82μmol、1.1eq)的dmf(6ml)溶液中加入hatu(85.40mg、224.75μmol、1.5eq)和diea(19.37mg、149.83μmol、26.10μl、1.0eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:1814.99,实测值m/z:908.2([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的化合物2(54mg、29.75μmol、产率19.86%)。向化合物2(54mg、29.8μmol、1.0eq)的dmf(2ml)溶液中加入哌啶(61mg、715μmol、71μl、24.0eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:1592.75,实测值m/z:796.27([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的com470(40mg、25.11μmol、产率84.41%)。com471化合物1(900mg、1.23mmol、1.0eq)和化合物2(1.0g、3.21mmol、2.6eq)的混合物溶解在dcm(20ml)中,接着加入(284.0mg、1.48mmol、1.2eq)、hobt(200.2mg、1.48mmol、1.2eq)。将混合物在25℃下搅拌2小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1021.49,实测值m/z:1022.2([m+h]+))。在减压下浓缩反应混合物以除去溶剂。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物3(0.900g、880.53μmol、产率71.30%)。化合物3(500.0mg、489.19μmol、1.0eq)和化合物4(257.6mg、489.19μmol、1.0eq)的混合物溶解在dcm(5ml)中,接着加入hobt(132.2mg、978.37μmol、2.0eq)、edci(187.6mg、978.37μmol、2.0eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1529.80实测值m/z:765.9([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物。获得呈无色油的化合物3(420mg、246.94μmol、产率50.48%)。化合物5(420mg、274.38μmol、1.0eq)溶解在dmf(4ml)中,接着加入哌啶(865.2mg、10.16mmol、1ml、37eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物5已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1308.48、实测值m/z:654.8([m/2+h]+))。通过制备型hplc(tfa条件)纯化粗产物。获得呈无色油的com471(386mg、265.50μmol、产率96.76%)。com472将化合物1(0.5g、839.43μmol、1.0eq)、化合物2(627.0mg、839.43μmol、1.0eq)和diea(217.0mg、1.68mmol、292.4μl、2.0eq)的混合物溶解在dmf(2ml),然后将hatu(319.2mg、839.4μmol、1.0eq)添加到混合物中。然后将混合物在25℃搅拌30分钟。tlc(dcm:ch3oh=10:1、rf=0.24)显示化合物1完全消耗并且形成一个新的斑点。蒸发溶剂以产生作为无色油的化合物3(0.45g、339.75μmol、产率40.47%、粗品),其无需进一步纯化即可用于下一步。化合物3(450.0mg、339.75μmol、1.0eq)溶解在dmf(8ml)中,接着加入哌啶(2ml)。将混合物在25℃下搅拌15分钟。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的(计算值mw:1102.27,实测值m/z:552.1([m/2+h]+))。通过制备型hplc(tfa条件)纯化残余物。获得呈无色油的化合物3(370.0mg、335.67μmol、产率98.80%)。向com126(60mg、54.45μmol、1.0eq)、化合物4(15.5mg、81.68μmol、1.5eq)的dmf(5ml)溶液中加入hatu(31mg、81.68μmol、1.5eq)和diea(10.5mg、61.68μmol、15μl、1.5eq)。将混合物在30℃下搅拌2小时。lc-ms显示com126完全消耗,以及检测到一个主峰具有所想要的。蒸发混合物以除去溶剂,以及获得呈无色油的化合物5(30mg,粗品),其无需进一步纯化即可用于下一步。将化合物5(30mg、23.57μmol、1.0eq)溶解于dcm(4.5ml)中,然后加入tfa(0.5ml),并将混合物在25-30℃下搅拌2小时。lc-ms显示化合物5完全消耗,以及检测到一个主峰具有所想要的。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的com472(10mg、8.52μmol)。com473化合物1(300mg、449.96μmol、1.0eq)、化合物2(138mg、449.96μmol、1.0eq)、hobt(122mg、899.93μmol、2.0eq)、edci(173mg、899.93μmol、2.0eq)的混合物溶解于dcm(10ml,预脱气并用n2吹扫3次),然后将混合物在n2气氛下于20-25℃搅拌1小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的(mw:955.06,实测值m/z:955.3([m+h]+))。在减压下浓缩反应混合物以除去溶剂。在减压下蒸发混合物并获得呈黄色油的化合物3(300mg、粗品)。将化合物3(300mg、314.12μmol、1.0eq)溶解于dmf(4ml)中,然后加入哌啶(1ml),并将混合物在20-25℃搅拌1小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:732.83实测值m/z:733.2([m+h]+))。通过制备型hplc(中性条件)纯化残余物。获得呈无色油的com473(160mg、218.33μmol、产率69.51%)。实施例2:结合epha2/cd137的异源串联双环肽的合成bcy9173bcy9172-peg12-n3的制备步骤bcy9172(520mg、248.16μmol、1eq)和化合物1(370mg、499.47μmol、2.01eq)溶解在dmf(5ml)中,加入diea(48.11mg、372.24μmol、64.84μl、1.5eq)然后将混合物在30℃下搅拌12小时。lc-ms显示bcy9172已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2721.12实测值m/z:1360.9([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(284mg、101.10μmol、产率40.74%、纯度96.87%)。bcy9173的制备步骤该反应在两个独立的容器中平行进行。对于一个容器,化合物2(100mg、36.75μmol、1.0eq)和bcy6169(120mg、36.78μmol、1.0eq)先溶解在10ml的t-buoh/h2o(1:1)中,然后加入cuso4(0.4m、91.9μl、1.0eq)、vcna(0.4m、183.8μl、2.0eq)和thpta(0.4m、91.9μl、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在40℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5983.85实测值m/z:997.6600([m/6+h]+)以及1197.2300([m/5+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy9173(218mg、34.97μmol、产率47.58%、纯度96%)。bcy7985bcy7859的通用制备程序向n3-peg12-cooh(250mg、388μmol)和hosu(67.0mg、583μmol)的dma(4.5ml)和dcm(1.5ml)溶液中添加edci(89.3mg、466μmol)并且在20℃搅拌16小时。向另一个含有bcy7732(855mg、388μmol)混合物的5mldma溶液的50ml圆形烧瓶中加入diea(186mg、1.44mmol、250μl),搅拌10分钟。然后将初始反应混合物加入烧瓶中,在20℃下进一步搅拌另外5小时。lc-ms(es8396-307-p1b1)显示bcy7732完全消耗,以及检测到一个主峰具有所想要的质量。通过制备型hplc(tfa条件)直接纯化所得反应混合物以产生呈白色固体的化合物bcy7859(621mg、200μmol、产率51.6%、tfa盐)。bcy6169的通用制备程序向bcy6099(300mg、94.3μmol)的dma(2ml)溶液中添加diea(36.6mg、283μmol、49.3μl),搅拌十分钟。之后,加入pya-nhs(36.8mg、189μmol),进一步在20℃下搅拌另外15小时。lc-ms显示bcy6099完全消耗,以及检测到一个主峰具有所想要的质量。通过制备型hplc(中性条件)纯化反应混合物以得到呈白色固体的化合物bcy6169(299mg、86.2μmol、产率91.5%)。bcy7985的通用制备程序向用氮气吹扫2小时的bcy7859(220mg、77.8μmol)和bcy6169(251mg、77.1μmol)的dmf(5ml)溶液加入水性的抗坏血酸溶液(0.8m,963μl),然后在氮气气氛下加入的水性的cuso4(0.8m,289μl)。然后,将混合物在20℃下搅拌2小时。lc-ms显示bcy6169完全消耗,以及检测到一个主峰具有所想要的质量。通过制备型hplc(tfa条件)直接纯化反应混合物以得到呈白色固体的化合物bcy7985(283mg、43.4μmol、产率56.3%、tfa)。bcy8942bcy8940的通用制备程序在搅拌下,向n3-peg12-cooh(120mg、186μmol、1.0eq)的dma(3ml)和dcm(1ml)溶液中加入hosu(32.2mg、280μmol、1.5eq)。然后将edci(42.9mg、224μmol、1.2eq)加入到混合物中,并在20℃下进一步搅拌另外7小时。lcms显示活化酯完全形成。在搅拌下,向另一个具有bcy8045(410mg、186μmol、1.0eq)的dma(3ml)溶液的烧瓶(flask)中加入diea(120mg、932μmol、162μl,5.0eq),然后加入活化的酯并将混合物在20℃下搅拌18小时。lc-ms显示检测到一个具有所需m/z的主峰。将反应混合物真空浓缩以除去dcm。通过制备型hplc(tfa条件)纯化反应混合物以获得呈白色固体的化合物bcy8940(190mg、67.2μmol、产率36.1%)。bcy8942的通用制备程序向bcy8940(28.6mg、10.1μmol、1.1eq)和bcy6169(30.0mg、9.19μmol、1.0eq)的dmf(2.0ml)溶液中添加(2r)-2-[(1s)-1,2–[二羟乙基]-3,4-二羟基-2h-呋喃-5-酮(1.0m,92.0μl)和cuso4(1.0m,27.6μl),在氮气气氛下于20℃搅拌2小时。lc-ms显示bcy6169已完全消耗,检测到一个主峰具有所想要的m/z(计算值mw:6089.91实测值m/z:1218.4([m/5+h]+)、1016.0([m/6+h]+)、870.7([m/7+h]+)。通过制备型hplc(tfa条件)纯化反应混合物以得到呈白色固体的化合物bcy8942(15.4mg、2.46μmol、产率26.8%、纯度97.3%)。bcy8943bcy8941的通用制备程序向bcy6015(与bcy8941相同的肽,除了缺少pya部分;100mg、32.9μmol)的dma(2ml)溶液中添加diea(12.8mg、98.7μmol、17.2μl),并搅拌10分钟。然后将(2,5-二氧杂吡咯烷-1-基)戊4-炔酸酯(12.8mg、65.8μmol)加入到混合物中,接着于20℃进一步搅拌16小时。lc-ms显示化合物1已完全消耗,检测到一个主峰具有所想要的m/z(计算值mw:3119.60、实测值m/z:1040.5([m/3+h]+)。通过制备型hplc(中性条件)纯化混合物,得到呈白色固体的化合物bcy8941(90.0mg、28.9μmol、产率87.7%)。bcy8943的通用制备程序向bcy7859(其可按bcy7985所述制备;40.0mg、14.2μmol)和bcy8941(42.0mg、13.5μmol)的dmso(2ml,用氮气预吹扫1小时)溶液中添加(2r)-2-[(1s)-1,2-二羟乙基]-3,4-二羟基-2h-呋喃-5-酮(1.0m,270μl)和cuso4(1.0m,80.9μl)。用氮气吹扫混合物3次,并在15℃下搅拌2小时。lc-ms显示bcy8941已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5946.77、实测值m/z:1190.2([m/5+h]+)、991.5([m/6+h]+)、849.9([m/7+h]+)。通过制备型hplc((a:h2o中0.075%tfa,b:acn)纯化反应混合物,得到呈白色固体的化合物bcy8943(11.5mg、1.90μmol、产率14.1%、纯度98.1%)。bcy9647化合物2的制备程序向com134(30.0mg、57.0μmol、1.0eq)、化合物1(17.2mg、85.3μmol、1.5eq)的dcm(0.5ml)溶液中添加tea(8.65mg、11.9μl、1.5eq)。将混合物在25℃下搅拌1小时。lc-ms显示com134已完全消耗,以及检测到一个主峰具有所想要的质量(计算值mw:691.72、实测值m/z:692.3([m+h]+)和709.3([m+nh4]+))。将反应混合物在减压下浓缩,然后冻干以产生呈白色的粗品化合物2(30.5mg,粗品)。化合物3的制备程序向化合物2(10mg、1.0eq)的dmf(1ml)溶液中添加bcy6099(46mg、1.0eq)和diea(5.61mg、7.55μl,3.0eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:3735.28实测值m/z:1245.9([m/3+h]+)和934.5([m/4+h]+))。在过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(34mg、产率62.96%、纯度100%)。bcy9647的制备程序将化合物3(34mg、9.10μmol、1.0eq)、bcy7741(23mg、10.08μmol、1.11eq)和thpta(0.4m、11.4μl、0.5eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、11.4μl、0.5eq)和vcna(0.4m、22.8μl、1eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:6016.82、实测值m/z:1204.1([m/5+h]+)、1003.5([m/6+h]+)、860.3([m/7+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9647(31.2mg、54.67%产率、95.96%纯度)。bcy9648化合物2的制备程序向com135(30mg、27.29μmol、1.0eq)、化合物1(8.25mg、40.94μmol、1.5eq)的dcm(0.5ml)溶液中加入tea(4.14mg、40.94μmol、5.70μl、1.5eq)。将混合物在25-30℃下搅拌1小时。lc-ms显示com135已完全消耗,以及检测到一个主峰具有所想要的质量(计算值mw:1264.41、实测值m/z:1281.4([m+nh4]+)、649.8([m/2+h]+)]。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物以得到化合物2(18mg、14.2μmol、产率52.14%)。化合物3的制备程序向化合物3(9mg、7.12μmol、1eq)的dmf(1ml)溶液中添加bcy6099(23mg、7.23μmol、1.02eq)和diea(2.76mg、21.35μmol、3.72μl,3.0eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4307.96、实测值m/z:1436.9([m/3+h]+)、1077.9([m/4+h]+)、862.5([m/5+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(14.6mg、产率47.61%、纯度100%)。bcy9648的制备程序将化合物3(14.6mg、3.39μmol、1eq)、bcy7741(8.5mg、3.73μmol、1.1eq)和thpta(0.4m,4.3μl,0.5eq)的混合物溶于t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下加入cuso4(.4m,4.3μl,0.5eq)和vcna(0.4m,8.6μl,1.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:6589.50实测值m/z:1098.8([m/6+h]+)、942.1([m/7+h]+)、824.6([m/8+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9648(14.7mg、63.34%产率、96.22%纯度)。bcy9655化合物2的制备程序向com128(120mg、101.06μmol、1.0eq)、化合物1(25mg、124.03μmol、1.25eq)的dcm(0.5ml)溶液中加入tea(15.34mg、151.59μmol、21.10μl、1.5eq)。将混合物在25℃下搅拌1小时。lc-ms显示检测到一个新的峰具有所想要的m/z(计算值mw:1352.48,实测值m/z:676.8([m/2+h]+)、1369.3([m+nh4]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物。获得呈无色油的化合物2(14mg、8.99μmol、产率8.90%、纯度86.86%)。化合物3的制备程序向化合物2(7mg、5.18μmol、1.0eq)和bcy6099(16mg、5.03μmol、1.0eq)的dmf(2ml)溶液中加入diea(2.01mg、15.53μmol、2.70μl)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4396.02,实测值m/z:879.8([m/5+h]+)和1099.8([m/4+h]+))。过滤反应混合物并在减压下浓缩,以得到残余物。通过反相hplc(0.1%tfa条件)纯化粗产物。获得呈白色固体的化合物3(11.8mg、产率48.29%、纯度93.11%)。bcy9655的制备程序将化合物3(11.8mg、2.69μmol、1.0eq)、bcy7741(7.0mg、3.07μmol、1.14eq)和thpta(0.4m,6.8μl,1eq)的混合物溶解在t-buoh/h2o(1:1、2ml,预脱气并用n2吹扫3次)中,然后在n2下添加cuso4(0.4m,6.8μl,1.0eq)和vcna(0.4m,13.6μl,2.0eq)。通过滴加0.2mnh4hco3(在1∶1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:6677.57、实测值m/z:1113.7([m/6+h]+),954.7([m/7+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9655(1.9mg、0.26μmol、产率9.65%,纯度91.15%)。bcy9656化合物2的制备程序向com129(30.0mg、22.93μmol、1.0eq)、化合物1(6.9mg、34.39μmol、1.5eq)的dcm(3ml)溶液中加入tea(3.5mg、34.39μmol、4.8μl、1.5eq)。将混合物脱气,并用n2吹扫3次,然后将该混合物在n2气氛下在25℃下搅拌1小时。lc-ms显示com129已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1473.58、实测值m/z:737.3([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物,得到呈白色固体的化合物2(12.3mg、8.35μmol、产率36.41%)。化合物3的制备程序向化合物2(9.26mg、6.28μmol、1.0eq)和bcy6099(10mg、3.14μmol、0.5eq)的dmf(3ml)溶液中加入tea(0.7mg、6.93μmol、1μl、1.1eq)。将混合物脱气,并用n2吹扫3次,然后将混合物在n2气氛下在25-30℃下搅拌1小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4517.12、实测值m/z:1129.8([m/4+h]+)、904.1([m/5+h]+)、753.7([m/6+h]+)。过滤反应混合物,并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(12mg、产率72.36%、纯度85.58%)。bcy9656的制备程序将化合物3(11mg、2.44μmol、1.0eq)、bcy7741(6.0mg、2.63μmol、1.08eq)和thpta(0.4m、6.1μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次)中,然后在n2下添加cuso4(0.4m、6.1μl、1.0eq)和vcna(0.4m、12.2μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:6798.66、实测值m/z:1133.8([m/6+h]+)、971.9([m/7+h]+)、850.7([m/8+h]+)。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9656(6.8mg、37.36%产率、90.97%纯度)。bcy9657化合物2的制备程序向com130(30.0mg、20.78μmol、1.0eq)、化合物1(6.3mg、31.17μmol、1.5eq)的dcm(3ml)溶液中加入tea(3.2mg、31.17μmol、4.4μl、1.5eq)。将混合物在25-30℃下搅拌1小时。lc-ms显示com130完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1608.7,实测值m/z:804.8([m/2+h]+))。将反应混合物在减压下浓缩并冻干以产生呈白色固体的化合物2(7.9mg、粗品)。化合物3的制备程序向化合物2(7.9mg、4.91μmol、1.0eq)和bcy6099(16mg、5.03μmol、1.02eq)的dmf(1ml)溶液中加入diea(1.9mg、14.73μmol、2.6μl、3.0eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4652.25,实测值m/z:1551.3([m/3+h]+)、1163.6([m/4]+)、931.1[m/5+h]+)、776.1([m/6+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(13.3mg、2.86μmol、产率53.22%、纯度91.42%)。bcy9657的制备程序将化合物3(13.3mg、2.86μmol、1.0eq)、bcy7741(7.0mg、3.07μmol、1.03eq)和thpta(0.4m、7.5μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次)中,然后在n2下添加cuso4(0.4m、7.5μl、1eq)和vcna(0.4m、15μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:6933.78、实测值m/z:1156.7([m/6+h]+)、991.4([m/7+h]+)、867.4([m/8+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9657(8.4mg、40.21%产率、94.9%纯度)。bcy9658化合物2的制备程序向com131(167.0mg、227.89μmol、1.0eq)、化合物1(55.0mg、272.87μmol、1.2eq))的dcm(5ml)溶液中加入tea(36.4mg、359.23μmol、50.0μl、1.6eq)。将混合物在25-30℃下搅拌1小时。lc-ms显示检测到一个主峰具有所想要的m/z(mw:897.93,实测值920.3([m+na+])。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈无色油的化合物2(35mg、33.74μmol、产率14.81%、纯度86.56%)。化合物3的制备程序向化合物2(15mg、16.71μmol、1.0eq)和bcy6099(53mg、16.65μmol、1.0eq)的dmf(2ml)溶液中加入diea(6.48mg、65.05μmol、50.1μl、4.0eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:3941.47,实测值m/z:986.0([m/4+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的[bcy6099]-[com131](5mg、50.48%产率、94.96%纯度)。bcy9658的制备程序将化合物3(35mg、8.88μmol、1.0eq)、bcy7741(21mg、9.20μmol、1.03eq)和thpta(0.4m、22.2μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1,2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、22.2μl、1eq)和vcna(0.4m、44.4μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:6223.01,实测值m/z:1038.0([m/6+h]+)、889.8([m/8+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9658(13.2mg、21.54%产率、90.16%纯度)。bcy9659化合物2的制备程序向com132(20.0mg、65.28μmol、1.0eq)、化合物1(15.8mg、78.34μmol、1.2eq))的dcm(5ml)溶液中加入tea(36.4mg、359.23μmol、50μl、5.5eq)。将混合物在25℃下搅拌1小时。lc-ms检测到一个主峰具有所想要的m/z(mw:471.46,实测值m/z:489.2([m+nh4]+))。将反应混合物在减压下浓缩以得到呈无色油的化合物2(26mg、粗品)。化合物3的制备程序向化合物2(15.0mg、4.71μmol、1.0eq)和bcy6099(3.33mg、7.07μmol、1.5eq)的dmf(3ml)溶液中加入tea(0.7mg、6.93μmol、1μl、1.5eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:3515.01,实测值m/z:1172.1([m/3+h]+)、879.5([m/4+h]+)]。过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(12.7mg、3.26μmol、产率69.23%、纯度90.3%)。bcy9659的制备程序将化合物3(12.7mg、2.89μmol、1.0eq)、bcy7741(6.80mg、2.98μmol、1.03eq)和thpta(1.3mg、2.99μmol、1.03eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、7.3μl、1eq)和vcna(0.4m、14.6μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5796.54,实测值m/z:1159.8([m/5+h]+)、966.7([m/6+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9659(6.2mg、1.06μmol、产率36.58%、纯度98.86%)。bcy9758化合物2的制备程序向化合物1(5.0mg、3.54μmol、1.0eq)、bcy6099(11.3mg、3.54μmol、1.0eq)的dmf(3ml)溶液中加入diea(0.9mg、7.07μmol、1.2μl、2.0eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示检测到一个主峰具有所想要的m/z(mw:4481.11,实测值m/z:1101.3([m/4+h]+))。将反应混合物过滤并在减压下浓缩继而冻干以产生呈白色固体的化合物2(15mg、粗品)。bcy9758的制备程序向化合物2(15mg、3.35μmol、1.0eq)和bcy7732(14.74mg、6.69μmol、2.0eq)的dmf(3ml)溶液中加入diea(0.9mg、7.07μmol、1.2μl、2.1eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:6567.48,实测值m/z:1095.1([m/6+h])、938.8([m/7+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的bcy9758(5.8mg、24.26%产率、91.97%纯度)。bcy10568bcy8919-peg12-n3的制备程序bcy8919(80.0mg、38.47μmol、1.0eq)和化合物1(29.6mg、40.01μmol、1.04eq)溶解在dmso(1ml)中。然后向该溶液中加入dipea(7.46mg、55.71μmol、10.0μl、1.5eq),接着将混合物在25-30℃下搅拌2小时。lc-ms显示大多数bcy8919已经消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2705.16,实测值m/z:1353.1([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(18.6mg、6.86μmol、产率17.83%、纯度99.76%)。bcy10568的制备程序化合物2(9.0mg、3.33μmol、1.0eq)和bcy6169(11.0mg、3.36μmol、1.01eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、8.3μl、1.0eq)、vcna(1.4mg、7.06μmol、2.1eq)和thpta(1.4mg、3.22μmol、1.0eq)。最后,加入0.4mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,并且一个主峰具有所想要的m/z(计算值mw:5967.90,实测值m/z:995.00([m/5+h]+)和1194.70([m/6+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy10568(13.4mg、2.16μmol、产率69.44%、纯度96.3%)。bcy10570bcy8920-peg12-n3的制备程序向bcy8920(37mg、17.31μmol、1.0eq)和化合物1(15mg、20.25μmol、1.2eq)的dmso(2ml)溶液中加入diea(3.36mg、25.96μmol、4.5μl、1.5eq)。将混合物在30℃下搅拌12小时。lc-ms显示bcy8920完全消耗、检测到一个主峰具有所想要的m/z(计算值mw:2763.2,实测值m/z:689.07([m/4-h]+))。在减压下浓缩反应混合物以除去溶剂并产生残余物。通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的化合物2(22.8mg、8.15μmol、产率47.09%、纯度98.78%)。bcy10570的制备程序化合物2(6mg、2.17μmol、1.0eq)和bcy6169(7.08mg、2.17μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1)中,然后加入cuso4(0.4m、5.4μl、1.0eq)、vcna(0.4m、10.8μl、2.0eq)和thpta(0.4m、5.4μl、1.0eq)。最后,加入0.2mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌4小时。lc-ms显示化合物2被完全消耗,以及检测到一个主峰具有所想要的m/z[ms:6025.93,实测值m/z:1004.56([m/6+h]+),以及861.48([m/7+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过制备型hplc(tfa条件)纯化粗产物。获得呈白色固体的bcy10570(7.2mg、1.17μmol、产率53.90%、纯度97.95%)。bcy10574化合物2的制备程序向bcy9594(65mg、27.07μmol、1eq)、化合物1(12.00mg、27.75μmol、1.02eq))的dmso(1ml)溶液中加入diea(5.25mg、40.61μmol、7.07μl、1.5eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示bcy9594完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2718.13,实测值m/z:906.04([m/3+h]+)、1359.07([m/2+h]+)]。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(42.6mg、15.67μmol、产率57.89%、纯度100%)。bcy10574的制备程序将化合物2(20mg、7.36μmol、1.0eq)、bcy8927(17mg、7.87μmol、1.07eq)和thpta(0.4m、18.4μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、18.4μl、1.0eq)和vcna(0.4m、36.8μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4877.68、实测值m/z:1219.42([m/4+h]+)、以及975.54([m/5+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy10574(17.6mg、3.41μmol、产率46.29%,纯度94.40%)。bcy10575化合物2的制备程序向bcy9594(65mg、27.07μmol、1eq)、化合物1(12.0mg、27.75μmol、1.02eq))的dmso(1ml)溶液中加入diea(5.25mg、40.61μmol、7.07μl、1.5eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物1已完全消耗,检测到一个主峰具有所想要的m/z(计算值mw:2718.13,实测值m/z:906.04([m/3+h]+)和1359.07([m/2+h]+)]。在减压下浓缩反应混合物以除去溶剂、得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(42.6mg、15.67μmol、产率57.89%、纯度100%)。bcy10575的制备程序将化合物2(20mg、7.36μmol、1.0eq)、bcy8928(17mg、7.67μmol、1.04eq)以及thpta(0.4m、18.4μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、18.4μl、1.0eq)和vcna(0.4m、36.8μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4935.71,实测值m/z:1234.59([m/4+h]+)、以及987.71([m/5+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy10575(12mg、2.37μmol、产率32.27%、纯度97.67%)。bcy10576化合物2的制备程序向bcy9594(30.0mg、12.50μmol、1.0eq)、化合物1(5.54mg、12.81μmol、1.02eq)的dmso(1ml)溶液中加入diea(2.42mg、18.74μmol、3.3μl、1.5eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2718.13,实测值m/z:906.45([m/3+h]+)、1359.50([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(16mg、5.80μmol、产率46.42%、纯度98.54%)。bcy10576的制备程序将化合物2(17.0mg、6.25μmol、1.0eq)、bcy11014(13.6mg、6.25μmol、1.0eq)以及thpta(0.4m、1.8μl、2.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、15.6μl、1.0eq)和vcna(0.4m、1.84μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示大多数化合物2已经消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4893.63,实测值m/z:1224.7([m/4+h]+)、980.0([m/6+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy10576(20.5mg、4.13μmol、产率66.02%、纯度98.57%)。bcy10577化合物2的制备程序向化合物1(5.0mg、49.5μmol、1.0eq)的dmf(1ml)溶液中加入edci(8.5mg、54.8μmol、1.1eq)和hosu(5.7mg、49.5μmol、1.0eq)。将混合物在25-30℃搅拌30分钟。tlc表明化合物1完全消耗并形成一个新斑点。然后,将bcy9172(53mg、25.29μmol、0.47eq)和diea(3.27mg、25.29μmol、4.4μl、0.47eq)加入到反应混合物中。将混合物在25-30℃搅拌2小时。lc-ms显示bcy9172完全消耗,以及检测到一个主峰具有所想要的m/z(mw:2178.46,实测值m/z:1089.5700([m/2+h+]))。在减压下浓缩反应混合物以除去溶剂并产生残余物。通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的化合物2(30mg、13.77μmol、产率54.45%,纯度100%)。bcy10577的制备程序化合物2(20mg、9.18μmol、1.0eq)和bcy6169(32.95mg、10.10μmol、1.1eq)先溶解在2ml的t-buoh/h2o(1:1)中,然后加入cuso4(0.4m、23μl、1eq)、vcna(0.4m、46μl、2.0eq)和thpta(0.4m、23μl、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌4小时。lc-ms显示化合物2已完全消耗,并检测到一个主峰具有所想要的m/z(计算值mw:5441.20,实测值m/z:1361.8([m/4+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过制备型hplc(tfa条件)纯化粗产物。获得呈白色固体的bcy10577(16.2mg、2.98μmol、产率32.43%)。实施例3:结合粘连蛋白-4/cd137的异源串联双环肽的合成bcy8854bcy8846的通用制备程序向bcy8234(与bcy8846相同的肽,除了没有pya部分;300mg、102μmol、1.0eq)的dma(3ml)溶液中加入diea(52.5mg、406μmol、70.8μl、4.0eq),搅拌10分钟。然后向其中加入(2,5-二氧杂吡咯烷-1-基)戊-4-炔酸酯(25.8mg、132μmol、1.3eq),并将混合物在20℃下进一步搅拌16小时。lc-ms显示bcy8234完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:3034.43,实测值m/z:1011.8([m/3+h]+)、1517.0([m/2+h]+)]。通过制备型hplc(中性条件)纯化反应混合物并且获得呈白色固体的化合物bcy8846(290mg、95.6μmol、产率94.1%)。bcy8854的通用制备程序向bcy8846(234mg、77.1μmol、1.0eq)的dmf(5ml)溶液中加入bcy7859(其可如bcy7985所述制备;220mg、77.8μmol、1.0eq),接着加入(2r)-2-[(1s)-1,2-二羟乙基]-3,4-二羟基-2h-呋喃-5-酮(0.80m、963μl、1.0eq)和cuso4(0.80m、289μl、0.3eq)。将混合物在20℃下搅拌2小时。lc-ms显示bcy8846完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5861.59,实测值m/z:837.9([m/7+h]+)、977.6([m/6+h]+)、1173.3([m/5+h]+)。通过制备型hplc((a:h2o中0.075%tfa,b:acn)纯化反应混合物,得到呈白色固体的化合物bcy8854(292mg、46.8μmol、产率60.8%、纯度95.9%、tfa)。bcy9350bcy8782-pya的通用制备程序向bcy8782(与bcy11942相同的肽,除了没有pya部分;20.0mg、6.77μmol、1.0eq)的dma(1ml)溶液中加入diea(4.37mg、33.9μmol、5.90μl、5.0eq)和(2,5-二氧杂吡咯烷-1-基)戊-4-炔酸酯(2.64mg、13.5μmol、2.0eq),在25℃搅拌12小时。lc-ms显示bcy8782已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:3034.43,实测值m/z:1012.1([m/3+h]+))。通过制备型hplc(中性条件)纯化反应混合物以得到呈白色固体的bcy11942(20.0mg、6.00μmol、产率88.6%、纯度91.0%)。bcy9350的通用制备程序向bcy11942(20mg、6.59μmol、1.0eq)和bcy7859(其可如bcy7985所述制备;20.5mg、7.25μmol、1.1eq)的dmf(1ml)溶液中加入(2r)-2-[(1s)-1,2-二羟乙基]-3,4-二羟基-2h-呋喃-5-酮(0.4m、330μl、20.0eq),以及向混合物中加入cuso4(0.4m、98.9μl、6.0eq)。将混合物在25℃下搅拌2小时。lc-ms显示bcy8782-pya完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5861.59,实测值m/z:1173.3([m/5+h]+))。通过制备型hplc((a:h2o中0.075%tfa,b:acn)纯化反应混合物,得到呈白色固体的bcy9350(14.5mg、2.40μmol、产率36.5%、纯度97.2%)。bcy9351bcy9351的通用制备程序在氮气气氛下,向bcy8940(其可通过如bcy8942所述制备;9.4mg、3.33μmol、1.01eq)和bcy8846(10.0mg、3.30μmol、1.0eq)的dmf(1ml)溶液中加入vc(0.4m、165μl、20.0eq)和cuso4(0.4m、49.4μl、6.0eq)。将混合物在25℃下搅拌1小时。lc-ms显示bcy8940完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5861.59,实测值m/z:975.4([m/6+h]+)、1172.3([m/5+h]+))。通过制备型hplc((a:h2o中0.075%tfa,b:acn)纯化反应混合物,得到呈白色固体的bcy9351(5.30mg、0.904μmol、产率26.3%、纯度96.0%)。bcy9399化合物2的制备程序向com134(30mg、56.97μmol)、化合物1(17.22mg、85.45μmol)的dcm(0.5ml)溶液中加入tea(8.65mg、85.45μmol、11.9μl)。将混合物在25℃下搅拌1小时。lc-ms显示com134完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:691.72,实测值m/z:692.3([m+h]+)以及709.3([m+nh4]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物。获得呈无色油的化合物2(30.5mg)。化合物3的制备程序向化合物2(15mg、21.68μmol)和bcy8116(47mg、21.68μmol)的dmf(1ml)溶液中加入diea(8.41mg、65.05μmol、11.33μl)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:2725.1,实测值m/z:1362.7([m/2+h]+)、909.0([m/3+h]+))。过滤反应混合物并在减压下浓缩以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(20mg、产率33.41%、纯度98.71%)。bcy9399的制备程序将化合物3(20.0mg、5.35μmol、1.0eq)、bcy7741(13.0mg、5.70μmol、1.01eq)和thpta(0.4m、13.4μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m,13.4μl,1.0eq)和vcna(0.4m,26.8μl,2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5006.64,实测值m/z:834.9([m/6+h]+)、1002.3([m/5+h]+)、1252.4([m/4+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9399(9.1mg、27.20%产率、96.29%纯度)。bcy9400化合物2的制备程序向com135(其可如bcy9648所述制备;30.0mg、27.29μmol)、化合物1(8.3mg、40.94μmol)的dcm(2ml)溶液加入tea(4.14mg、40.94μmol、5.7μl)。然后,将反应混合物在25-30℃搅拌1小时。lc-ms显示com135已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1264.40,实测值m/z:1281.4([m+nh4]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物以得到呈白色固体的化合物2(18mg)。化合物3的制备程序向化合物2(15.5mg、7.12μmol)和bcy8116(9mg、7.12μmol)的dmf(2ml)溶液中加入diea(1.4mg、10.68μmol、1.9μl)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:3297.78,实测值m/z:1099.7([m/3+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(19.5mg、5.91μmol、产率33.41%、纯度83.07%)。bcy9400的制备程序将化合物3(19.5mg、5.91μmol)、bcy7741(14mg、6.14μmol、1.01eq)和thpta(0.4m、15μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m,15μl,1eq)和vcna(0.4m、30μl、2eq)。通过滴加0.2mnh4hco3(在1∶1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5579.31,实测值m/z:930.5([m/6+h]+)、1116.6([m/5+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9400(13.9mg、2.33μmol、产率27.20%,纯度93.56%)。bcy9401化合物3的制备程序向化合物1(50.0mg、31.39μmol、1eq)、化合物2(6.6mg、32.96μmol、1.05eq))的dcm(2ml)溶液中加入tea(4.8mg、47.09μmol、6.6μl、1.5eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1757.86,实测值m/z:879.10([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂、得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物3(0.02g、6.56μmol、产率20.91%、纯度57.7%)。化合物4的制备程序向化合物3(20mg、11.38μmol、1eq)、bcy8116(25mg、11.51μmol、1.01eq)的dmf(4ml)溶液中加入diea(2.2mg、17.07μmol、2.97μl、1.5eq)。将混合物在25-30℃下搅拌12小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:3791.23,实测值m/z:1263.2([m/3+h]+))。通过制备型hplc(中性条件)直接纯化反应。获得呈无色油的化合物4(10mg、2.43μmol、产率21.33%、纯度92%)。bcy9401的制备程序将化合物4(10mg、2.43μmol、0.9eq)、bcy7741(6.32mg、2.77μmol、1.0eq)以及thpta(0.4m、6.7μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、6.7μl、1.0eq)和vcna(0.4m、13.4μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物4已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:mw:6072.77,实测值m/z:1012.00([m/6+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9401(8.4mg、1.56μmol、产率59.31%、纯度95.52%)。bcy9403化合物2的制备程序向com471(100.0mg、76.42μmol、1.0eq)、4-硝基苯基氯甲酸酯(4-nitrophenylchloroformate)(16.2mg、80.25μmol、1.05eq)的dcm(10ml)溶液中加入tea(11.6mg、114.64μmol、16.0μl、1.5eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示com471完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1473.58,实测值m/z:736.83([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂、得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色油的化合物2(62.8mg、42.67μmol、产率55.84%,纯度48.37%)。化合物3的制备程序向化合物2(44mg、29.46μmol、1.0eq)、bcy8116(63mg、29.18μmol、1.0eq)的dmf(2ml)溶液中加入diea(5.66mg、43.77μmol、7.62μl、1.5eq)。将混合物在40℃下搅拌12小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:3506.95,实测值m/z:1168.58([m/3+h]+))。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物3(20mg、5.42μmol、产率18.57%、纯度95.04%)。bcy9403的制备程序将化合物3(10.0mg、2.71μmol、1.0eq)、bcy7741(6.83mg、2.99μmol、1.1eq)和thpta(0.4m、7μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、7μl、1.0eq)和vcna(0.4m、14μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5788.49,实测值m/z:1157.00([m/5+h]+)、964.60([m/6+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9403(2.1mg、0.34μmol、产率11.93%,纯度93.80%)。bcy9405化合物2的制备程序向com472(44.7mg、38.1μmol)、化合物1(9.2mg、45.72μmol)的dcm(4ml)溶液中加入tea(5.8mg、57.14μmol、8μl)。将混合物在25℃下搅拌2小时。lc-ms显示com472完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1338.45,实测值m/z:686.23([m/2+nh4+]))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(中性条件)纯化残余物。获得呈无色油的化合物2(20mg、14.94μmol、产率39.2%)。化合物3的制备程序向化合物2(20mg、14.94μmol)和bcy8116(38.96mg、17.93μmol)的dmf(4ml)溶液中加入diea(1.9mg、14.94μmol、2.6μl)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:3371.82,实测值m/z:1123.94([m/3+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(10mg、产率99.07%、纯度19.66%)。bcy9405的制备程序将化合物3(10.0mg、2.97μmol、1.0eq)、bcy7741(7.4mg、3.26μmol、1.1eq)和thpta(1.3mg、2.97μmol、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、7.5μl、1.0eq)和vcna(0.4m、151μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5653.36,实测值m/z:1130.47([m/5+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9405(7.8mg、46.08%产率、97.8%纯度)。bcy9406化合物2的制备程序向com473(130.0mg、177.40μmol、1.0eq)、(4-硝基苯基)氯甲酸酯(4-nitrophenyl)carbonochloridate)(36.4mg、180.59μmol、1.02eq)的dcm(10ml)溶液中加入tea(27.0mg、266.09μmol、37μl、1.5eq)。将混合物在35℃下搅拌2小时。lc-ms显示com473完全消耗,以及检测到一个主峰具有所想要的m/z(mw:897.93,实测值m/z:897.65([m+h]+)、914.60([m+nh4]+))。在减压下浓缩反应混合物以除去溶剂、得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈无色油的化合物2(90mg、95.87μmol、产率54.04%、纯度95.65%)。化合物3的制备程序向化合物2(10mg、11.14μmol、1eq)、bcy8116(25mg、11.51μmol、1.03eq)的dmf(2ml)溶液中加入diea(2.16mg、16.71μmol、2.91μl、1.5eq)。将混合物在25-30℃下搅拌12小时。lc-ms显示检测到一个主峰具有所想要的m/z(mw:2931.30、实测值m/z:977.00([m/3+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(fta条件)纯化粗产物。获得呈白色固体的化合物3(15mg、5.12μmol、产率45.79%,纯度99.66%)。bcy9406的制备程序将化合物3(15mg、5.12μmol、1.0eq)、bcy7741(12mg、5.26μmol、1.03eq)和thpta(0.4m、12.8μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、12.8μl、1.0eq)和vcna(0.4m、25.6μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5212.84,实测值m/z:1042.74([m/4+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9406(14.4mg、2.57μmol、产率50.21%、纯度93.01%)。bcy9407化合物2的制备程序向com128(60mg、50.53μmol、1.0eq)、化合物1(13mg、64.50μmol、1.28eq)、diea(9.80mg、75.80μmol、13.20μl、1.5eq)的dcm(5ml)溶液脱气并用n2吹扫3次,然后将混合物在n2气氛下在25-30℃下搅拌1小时。lc-ms显示com128已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:1352.48,实测值m/z:676.7([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈无色油的化合物2(12mg、8.87μmol、产率17.56%)。[bcy8116]-[com128]的制备程序向化合物2(7mg、5.18μmol、1.0eq)、bcy8116(11mg、5.06μmol、1.0eq)、diea(2.01mg、15.53μmol、2.70μl、3.0eq)的dmf(3ml)溶液脱气并用n2吹扫3次,然后将混合物在n2气氛下在25-30℃下搅拌1小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:3385.85,实测值m/z:1129.3([m/3+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的[bcy8116]-[com128](15.6mg、4.46μmol、产率86.13%、纯度96.75%)。bcy9407的制备程序将[bcy8116]-[com128](15.6mg、4.61μmol、1.0eq)、bcy7741(11mg、4.82μmol、1.05eq)和thpta(0.8m、5.8μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、11.6μl、1.0eq)和vcna(0.4m、23.2l、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:5667.39,实测值m/z:945.6([m/6+h]+)以及1134.2([m/5+h]+))。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9407(1.3mg、0.23μmol、产率4.33%、纯度86.90%)。bcy9408化合物2的制备程序向com129(45.0mg、34.39μmol、1.0eq)、化合物1(15.0mg、74.42μmol、2.1eq)的dcm(5ml)溶液中加入tea(5.5mg、53.88μmol、7.5μl、1.5eq),然后将混合物在n2气氛下在25-30℃下搅拌1小时。lc-ms显示com129完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1473.58,实测值m/z:737.3([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(9mg、6.11μmol、产率17.01%、纯度95.76%)。化合物3的制备程序向化合物2(9.0mg、6.11μmol、1.0eq)、和bcy8116(13.3mg、6.11μmol、1.0eq)的dmf(3ml)溶液中加入diea(2.4mg、18.32μmol、3.2μl、3.0eq)。所有溶剂进行脱气,并用n2吹扫3次,然后将混合物在n2气氛下在25-30℃下搅拌1小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:3506.95,实测值m/z:877.4([m/4+h]+)和m/z:1169.6([m/3+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(7.2mg、2.05μmol、产率31.93%、纯度95%)。bcy9408的制备程序将化合物3(7.2mg、2.05μmol、1.0eq)、bcy7741(5.0mg、2.19μmol、1.03eq)和thpta(0.4m、5.1μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.1μl、1.0eq)和vcna(0.4m、10.2μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5788.49,实测值m/z:968.9([m/6+h]+)和1158.0([m/5+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9408(3.1mg、4.97e-1μmol、产率24.23%、纯度92.87%)。bcy9409化合物2的制备程序向化合物1(30mg、20.78μmol)、com130(6.28mg、31.17μmol)的dcm(3ml)溶液中加入tea(3.15mg、31.17μmol、4.34μl、1.5eq)。将混合物在25-30℃下搅拌1小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:1608.70,实测值m/z:804.8([m/2+h]+))。将反应混合物在减压下浓缩并冻干以产生呈白色固体的化合物2(10.2mg,粗品)。化合物3的制备程序向化合物2(10.2mg、6.34μmol)和bcy8116(13.50mg、6.22μmol)的dmf(2ml)溶液中加入diea(0.8mg、6.22μmol、1.1μl、1.0eq)。将混合物在30℃下搅拌2小时。lc-ms检测到想要的m/z(mw:3642.08,实测值m/z:1214.4([m/3+h]+)。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(15.0mg、4.12μmol、产率62.94%、纯度95%)。bcy9409的制备程序将化合物3(15mg、4.12μmol、1.0eq)、bcy7741(10mg、4.38μmol、1.03eq)和thpta(0.4m、5.1μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、10.3μl、1.0eq)和vcna(0.4m、20.6μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5923.61,实测值m/z:988.2([m/6+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9409(3.1mg、0.52μmol、产率12.62%、纯度90.89%)。bcy9410化合物2的制备程序向com131(167.0mg、227.89μmol、1.0eq)、化合物1(55.0mg、272.87μmol、1.2eq)的dcm(5ml)溶液中加入tea(36.4mg、359.23μmol、50.0μl、1.6eq)。将混合物在25-30℃下搅拌1小时。lc-ms显示检测到一个主峰具有所想要的m/z(mw:897.93,实测值920.3([m+na+]))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈无色油的化合物2(35mg、33.74μmol、产率14.81%、纯度86.56%)。化合物3的制备程序向化合物2(20mg、22.27μmol、1.0eq)和bcy8116(48mg、22.09μmol、1.0eq)的dmf(2ml)溶液中加入diea(8.64mg、66.82μmol、11.64μl、3.0eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物3已完全消耗,检测到一个主峰具有所想要的m/z(mw:2931.32,实测值m/z:977.7([m+h]+))。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物3(40mg、13.08μmol、产率58.7%、纯度95.82%)。bcy9401的制备程序将化合物3(40mg、13.08μmol、1.0eq)、bcy7741(35mg、15.34μmol、1.17eq)和thpta(0.4m、34μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、34μl、1.0eq)和vcna(0.4m、68μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5212.85,实测值m/z:1043.2([m/5+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9410(38.6mg、6.78μmol、产率49.71%、纯度91.6%)。bcy9411化合物2的制备程序向com132(5mg、16.32μmol、1eq)、化合物1(4mg、19.85μmol、1.22eq)的dcm(5ml)中的溶液中加入tea(2.8mg、24.48μmol、3.4μl、1.5eq)。将混合物在25℃下搅拌1小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:471.46,实测值m/z:489.2([m/nh4]+))。将反应混合物在减压下浓缩以除去溶剂,然后冻干以产生呈白色固体的化合物2(8mg,粗品)。化合物3的制备程序向化合物2(3.3mg、6.9μmol、1.5eq)和bcy8116(10.0mg、4.6μmol、1.0eq)的dmf(5ml)溶液中加入diea(0.7mg、6.90μmol、1μl、1.5eq)。将混合物在30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2504.83,实测值m/z:1252.3([m/2+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的化合物3(4.2mg、1.51μmol、产率32.78%、纯度90%)。bcy9411的制备程序将化合物3(4.2mg、1.68μmol、1.0eq)、bcy7741(4.0mg、1.75μmol、1.05eq)和thpta(0.04m、84μl、2.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.04m,84μl,2.0eq)和vcna(0.04m,168μl,4.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物3被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:4786.37,实测值m/z:1596.2([m/3+h]+)、1196.9([m/4+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy9411(4.1mg、0.86μmol、产率50.20%、纯度98.26%)。bcy9759化合物2的制备程序向化合物1(5.0mg、3.54μmol、1.0eq)、bcy8116(7.7mg、3.54μmol、1.0eq)的dmf(3ml)溶液中加入diea(0.9mg、7.07μmol、1.2μl、2.0eq)。将混合物在0℃搅拌20分钟。lc-ms检测到对应于具有nhs基团脱落的化合物2的质量(计算值mw:3470.95、水解的mw:3373.81,实测值m/z:1125.0([m/3+h]+))。将反应混合物过滤并在减压下浓缩继而冻干以产生呈白色固体的化合物2(15mg、粗品)。bcy9759的制备程序向化合物2(20mg、5.76μmol、1.0eq)和bcy7732(12.7mg、5.76μmol、1.0eq)的dmf(3ml)溶液中加入diea(1.5mg、11.52μmol、2.0μl、2.0eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(mw:5557.3,实测值m/z:927.0([m/6+h]+)和1112.2([m/5+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过反相hplc(tfa条件)纯化粗产物。获得呈白色固体的bcy9759(2.3mg、6.92%产率、96.29%纯度)。bcy10000bcy9172-peg12-n3的制备程序bcy9172(520mg、248.16μmol、1.0eq)和化合物1(370mg、499.47μmol、2.01eq)溶解在dmf(5ml)中,然后向混合物中加入diea(48.11mg、372.24μmol、64.84μl、1.5eq)并在30℃下搅拌12小时。lc-ms显示bcy9172已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2721.12,实测值m/z:1360.9([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(284mg、101.10μmol、产率40.74%、纯度96.87%)。bcy10000的制备程序该反应在两个独立的容器中平行进行。对于一个容器,化合物2(142mg、52.18μmol、1.0eq)和bcy8846(157mg、51.74μmol、1.0eq)先溶解在10ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、130.5μl、1.0eq)、vcna(0.4m、261.0μl、2.0eq)和thpta(0.4m、130.5μl、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌12小时。lc-ms显示化合物2已完全消耗,以及监测一个主峰具有所想要的m/z(计算值mw:5755.54,实测值m/z:959.60([m/6+h]+)和1151.55([m/5+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy10000(314.9mg、51.99μmol、产率49.82%、纯度95.03%)。bcy10567bcy8919-peg12-n3的制备程序bcy8919(60.0mg、28.85μmol、1.0eq)和化合物1(22.2mg、30.01μmol、1.04eq)溶解在dmso(1ml)中。然后向该溶液中加入dipea(5.6mg、43.28μmol、7.6μl、1.5eq),接着将混合物在25-30℃下搅拌2小时。lc-ms显示bcy8919已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2705.16,实测值m/z:1353.15([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(bcy8919-peg12-n3、18.5mg、6.77μmol、产率23.47%、纯度99.04%)。bcy10567的制备程序注意:该反应已进行两次,下面描述第一次:化合物2(9.0mg、3.33μmol、1.0eq)和bcy8846(10.1mg、3.33μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、8.3μl、1.0eq)、vcn(1.3mg、6.56μmol、2.0eq)和thpta(1.4mg、3.22μmol、1.0eq)。最后,加入0.4mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及监测一个主峰具有所想要的m/z(计算值mw:5739.58、实测值m/z:956.75([m/6+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy10567(6.85mg、1.18μmol、产率35.48%、纯度98.91%)。bcy10569化合物3的制备程序化合物bcy8920(40.0mg、18.71μmol、1.0eq.)、化合物2(16.0mg、21.6μmol、1.15eq.)和diea(5.0μl、28.0μmol、1.5eq.)的混合物溶解在dmf中。将反应混合物在40℃下搅拌1小时,直到lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:2763.2、实测值m/z:912.17([(m-28)/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物3(23.4mg、8.47μmol、产率45.25%、纯度99.0%)。bcy10569的制备程序将化合物3(5.0mg、1.81μmol、1.0eq.)、bcy8846(5.8mg、1.9μmol、1.05eq.)和thpta(1.0mg、2.3μmol、1.03eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.0μl、1.0eq.)和vcna(0.4m、5.0μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5797.62,实测值m/z:1160.7([m/5+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy10569(5.7mg、1.18μmol、产率52.25%、纯度96.16%)。bcy10571bcy8116-peg5-n3的制备程序bcy8116(60mg、27.62μmol、1.0eq)和化合物1(12.0mg、27.75μmol、1.0eq)先溶解在dmso(1ml)中,然后向混合物中加入diea(5.4mg、41.43μmol、7.22μl、1.5eq)。将混合物在30℃下搅拌12小时。lc-ms显示检测到一个主峰具有所想要的m/z(mw:2489.82,实测值m/z:1245.1700([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(48mg、19.28μmol、产率69.80%、纯度100%)。bcy10571的制备程序该反应在两个独立的容器中平行进行。对于一个容器,化合物2(10mg、4.02μmol、1.0eq)和bcy8927(9mg、4.17μmol、1.04eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、10.0μl、1.0eq)、vcna(0.4m、20.1μl、2.0eq)和thpta(0.4m、10.0μl、1eq)。最后,加入0.4mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌4小时。lc-ms显示化合物3已完全消耗,检测到一个主峰具有所想要的m/z[mw:4649.36,实测值m/z:1162.57([m/4+h]+)、1549.69([m/3+h]+)]。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的bcy10571(13mg、2.79μmol、产率34.88%、纯度96.48%)。bcy10572bcy8116-peg5-n3的制备程序bcy8116(60mg、27.62μmol、1.0eq)和化合物1(12.0mg、27.75μmol、1.0eq)先溶解在dmso(1ml)中,然后向混合物中加入diea(5.4mg、41.43μmol、7.22μl、1.5eq)。将混合物在30℃下搅拌12小时。lc-ms显示检测到一个主峰具有所想要的m/z(mw:2489.82,实测值m/z:1245.1700([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(48mg、19.28μmol、产率69.80%、纯度100%)。bcy10572的制备程序该反应在两个独立的容器中平行进行。对于一个容器,化合物2(10mg、4.02μmol、1.0eq)和bcy8928(9mg、4.06μmol、1.01eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、10.1μl、1eq)、vcna(0.4m、20.2μl、2.0eq)和thpta(0.4m、10.1μl、1.0eq)。最后,加入0.4mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌4小时。lc-ms显示化合物1已完全消耗,检测到一个主峰具有所想要的m/z[mw:4707.40,实测值m/z:1568.29([m/3+h]+)和1176.83([m/4+h]+)]。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的bcy10572(21mg、4.46μmol、产率55.7%、纯度97.51%)。bcy10573化合物2的制备程序向bcy8116(35mg、16.11μmol、1eq)、化合物1(7.00mg、16.19μmol、1eq))的dmso(1ml)溶液中加入diea(3.12mg、24.17μmol、4.21μl、1.5eq)。将混合物在25-30℃下搅拌2小时。lc-ms显示大多数bcy8116已经消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2489.82,实测值m/z:1245.37([m/2+h]+)和830.25([m/3+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(26.8mg、10.76μmol、产率66.81%、纯度100%)。bcy10573的制备程序将化合物2(15mg、6.02μmol、1.0eq)、bcy11014(13.50mg、6.21μmol、1.03eq)和thpta(0.4m、15.1μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、15.1μl、1.0eq)和vcna(0.4m、30.2μl、2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物2被完全消耗,以及检测到一个主峰具有所想要的m/z[mw:4665.32,实测值m/z:1167.50([m/4+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy10573(11.5mg、2.42μmol、产率40.14%、纯度98.11%)。bcy10578化合物2的制备程序通过与edci(8.5mg、54.8μmol、1.1eq)和hosu(5.7mg、49.5μmol、1.0eq)混合,首先激活化合物1(5.0mg、49.5μmol、1.0eq)。将混合物在25-30℃搅拌30分钟。tlc说明化合物1完全消耗并形成一个新斑点。然后,向该混合物中加入化合物bcy9172(80.0mg、38.18μmol、0.8eq.)以及diea(6.3mg、8.5μl、49.5μmol、1.0eq.),并且在40℃搅拌1小时,直到lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:2178.46,实测值m/z:1089.44([m/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物2(15mg、6.88μmol、产率18.66%、纯度73.3%)。bcy10578的制备程序将化合物2(9.8mg、4.5μmol、1.0eq.)、bcy8846(14.0mg、4.6μmol、1.0eq.)和thpta(2.0mg、4.6μmol、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、12μl、1.0eq.)和vcna(0.4m、24μl、2.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5212.88,实测值m/z:1304.2([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy10578(13.78mg、2.64μmol、产率58.66%、纯度96.23%)。bcy10917bcy8831-peg12-n3的制备程序bcy8831(40.0mg、13.29μmol、1.0eq)和化合物1(10.5mg、14.17μmol、1.07eq)溶解在dmf(1ml)中。然后向该溶液中加入dipea(2.6mg、20.09μmol、3.5μl、1.5eq),接着将混合物在30℃下搅拌16小时。lc-ms显示bcy8831已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:3635.16,实测值m/z:1212.0([m/3+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(22.0mg、5.83μmol、产率43.85%、纯度96.39%)。bcy10917的制备程序注意:制作了两批,第一批写下作为最终报告。化合物2(10.0mg、2.75μmol、1.0eq)和bcy11014(5.98mg、2.75μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、13.7μl、2.0eq)、vcna(1.1mg、5.55μmol、2.0eq)和thpta(1.2mg、2.76μmol、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5810.66、实测值m/z:1163.0([m/5+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy10917(6.4mg、1.07μmol、产率39.03%、纯度97.49%)。bcy11020bcy8831-peg5-n3的制备程序bcy8831(25.0mg、8.31μmol、1.0eq)和化合物1(3.9mg、9.02μmol、1.09eq)溶解在dmf(1ml)中。然后向该溶液中加入dipea(1.6mg、12.46μmol、2.2μl、1.5eq),接着将混合物在35℃下搅拌2小时。lc-ms显示bcy8831已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:3326.79,实测值m/z:1109.66([m/3+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(7.3mg、2.09μmol、产率25.20%、纯度95.41%)。bcy11020的制备程序化合物2(7.3mg、2.19μmol、1.0eq)和bcy11014(4.8mg、2.19μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、5.5μl、1.0eq)、vcna(1.0mg、5.05μmol、2.3eq)和thpta(1.0mg、2.30μmol、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫三遍。将反应混合物在n2气氛下在30℃下搅拌12小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5502.29、实测值m/z:1101.74([m/5+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11020(3.3mg、0.577μmol、产率26.30%、纯度96.24%)。bcy11373化合物2的制备程序向化合物1(5.0mg、49.5μmol、1.0eq)的dmf(1ml)溶液中加入edci(8.5mg、54.8μmol、1.1eq)和hosu(5.7mg、49.5μmol、1.0eq)。将混合物在25-30℃搅拌30分钟。tlc说明化合物1完全消耗并形成一个新斑点。然后,0.3ml的该混合物中加入bcy8116(30.0mg、13.81μmol、0.28eq.)和diea(2.4μl、13.81μmol、0.28eq.),然后在25-30℃搅拌2小时。lc-ms显示bcy8116已完全消耗、监测一个主峰具有所想要的m/z(计算值mw:2255.53,实测值m/z:1128.34([m/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物2(21mg、8.9μmol、产率64.43%、纯度95.56%)。bcy11373的制备程序将化合物2(5mg、2.22μmol、1.0eq.)、bcy8928(4.79mg、2.22μmol、1.0eq.)和thpta(1.0mg、2.30μmol、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.6μl、1.0eq.)和vcna(0.4m、5.6μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4415.07、实测值m/z:1471.5([m/3+h]+)和1103.8([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11373(4.9mg、1.03μmol、产率46.26%、纯度92.4%)。bcy11374bcy11374的制备程序将化合物2(其可通过如制备bcy11373的步骤所述进行制备;5mg、2.22μmol、1.0eq.)、bcy8928(4.9mg、2.22μmol、1.0eq.)和thpta(1.0mg、2.30μmol、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.6μl、1.0eq.)和vcna(0.4m、5.6μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4473.11、实测值m/z:1491.5([m/3+h]+)和1118.5([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11374(4.1mg、1.27μmol、产率38.04%、纯度92.0%)。bcy11375bcy11375的制备程序将化合物2(其可通过如制备bcy11373的步骤所述进行制备;5mg、2.22μmol、1.0eq.)、bcy11014(4.8mg、2.22μmol、1.0eq.)和thpta(0.5mg、2.30μmol、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.6μl、1.0eq.)和vcna(0.4m、5.6μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms检测到一些想要的m/z(计算值mw:4431.03、实测值m/z:1107.59([m/4+h]+以及1477.90([m/3+h]+)。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11375(6mg、1.31μmol、产率59.13%、纯度96.8%)。bcy11616化合物3的制备程序化合物bcy8116(30.0mg、13.81μmol、1.0eq.)、化合物2(6.0mg、13.88μmol、1.0eq.)和diea(2.4μl、13.82μmol、1.0eq.)的混合物溶解在dmf中。将反应混合物在40℃下搅拌1小时,直到lc-ms显示化合物1完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2489.82、实测值m/z:1245.4([m/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物3(27mg、10.29μmol、产率74.52%、纯度94.9%)。bcy11616的制备程序将化合物3(5mg、2.01μmol、1.0eq.)、bcy7744(5.2mg、2.21μmol、1.1eq.)和thpta(1.0mg、2.30μmol、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.0μl、1.0eq.)和vcna(0.4m、5.0μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4827.46、实测值m/z:1207.12([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11616(4.7mg、1.0μmol、产率48.48%、纯度94.7%)。bcy11617bcy11617的制备程序将化合物3(其可通过如制备bcy11616的步骤所述进行制备;5mg、2.01μmol、1.0eq.)、bcy11506(5.2mg、2.21μmol、1.1eq.)和thpta(1.0mg、2.30μmol、1.1eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.0μl、1.0eq.)和vcna(0.4m、5.0μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4828.45、实测值m/z:1206.97([m/4+h]+)和以及965.91([m/5+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11617(3.2mg、0.63μmol、产率31.37%、纯度95.05%)。bcy11857bcy11414-peg5-n3的制备程序bcy11414(60.0mg、29.06μmol、1.0eq)和化合物1(13.0mg、30.06μmol、1.03eq)溶解在2ml的mecn/h2o(1:1)中。使用nahco3(0.4m)调节ph至8,然后将混合物在25-30℃搅拌2小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:2381.72、实测值m/z:1191.07([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(38.0mg、15.9μmol、产率54.71%、纯度97.35%)。bcy11857的制备程序化合物2(10.0mg、4.20μmol、1.0eq)和bcy7744(11.5mg、4.92μmol、1.2eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、11.0μl、1.0eq)、vcna(2.0mg、10μmol、2.4eq)和thpta(2.0mg、4.6μmol、1.1eq)。最后,加入0.2mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫3遍。将反应混合物在n2气氛下在30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4719.37、实测值m/z:1180.24([m/4+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11857(10.3mg、2.18μmol、产率51.90%、纯度96.02%)。bcy11858bcy11414-peg5-n3的制备程序bcy11414(60.0mg、29.06μmol、1.0eq)和化合物1(13.0mg、30.06μmol、1.03eq)溶解在2ml的mecn/h2o(1:1)中。使用nahco3(0.4m)调节ph至8,然后将混合物在25-30℃搅拌2小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:2381.72、实测值m/z:1191.07([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(38.0mg、15.9μmol、产率54.71%、纯度97.35%)。bcy11858的制备程序化合物2(20.0mg、8.40μmol、1.0eq)和bcy8928(22.0mg、9.92μmol、1.1eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、21.0μl、1.0eq)、vcna(4.0mg、20.19μmol、2.4eq)和thpta(4.0mg、9.20μmol、1.1eq)。最后,加入0.4mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫3遍。将反应混合物在n2气氛下在30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4599.30、实测值m/z:920.38([m/5+h]+)、1150.79([m/4+h]+)、1533.35([m/3+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11858(16.9mg、3.67μmol、产率43.43%、纯度99.25%)。bcy11859bcy11415-peg5-n3的制备程序bcy11415(30.0mg、13.81μmol、1.0eq)和化合物1(6.0mg、30.06μmol、1.0eq)溶解在2ml的mecn/h2o(1:1)中。使用nahco3(0.4m)调节ph至8,然后将混合物在25-30℃搅拌2小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:2489.82、实测值m/z:1245.18([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(24.0mg、9.63μmol、产率69.7%、纯度99.28%)。bcy11859的制备程序化合物2(20.0mg、8.03μmol、1.0eq)和bcy8928(21.0mg、9.47μmol、1.1eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、21.0μl、1.0eq)、vcna(4.0mg、2.5eq)和thpta(4.0mg、1.1eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并在n2气氛下吹扫3遍。将反应混合物在n2气氛下在30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4707.40、实测值m/z:941.7([m/5+h]+)、1176.9([m/4+h]+)、1569.6([m/3+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11859(19.2mg、4.01μmol、产率49.87%、纯度98.22%)。实施例4:pd-l1/cd137结合的异源串联双环肽的合成bcy8939bcy8939的通用制备程序向n3-peg12-cooh(250mg、388μmol)和hosu(67.0mg、583μmol)的dma(4.5ml)和dcm(1.5ml)溶液中添加edci(89.3mg、466μmol)并且在20℃搅拌16小时。lcms显示所想要的中间体完全形成。将bcy7732(854.97mg、388.37μmol、1eq)和diea(186mg、1.44mmol、250μl)加入混合物,同时再在20℃下搅拌另外5小时。lc-ms显示bcy7732完全消耗,以及检测到一个主峰具有所想要的质量。通过制备型hplc(tfa条件)纯化反应混合物以得到呈白色固体的化合物bcy7859(621mg、200.58μmol、产率51.65%、纯度95%、tfa)。计算值mw:2817.16,实测值m/z:942.7[m/3+h]+。bcy8939的通用制备程序向bcy7859(31.1mg、11.0μmol)和bcy8938(30.0mg、10.0μmol)的dmf(2ml)溶液中加入(2r)-2-[(1s)-1,2-二羟乙基]-3,4-二羟基-2h-呋喃-5-酮(1m、100μl)和cuso4(1m、30.0μl),在氮气氛下在20℃搅拌2小时。lc-ms显示bcy7859完全消耗以及检测到一个主峰具有所想要的质量。通过制备型hplc(tfa条件)纯化反应混合物以得到呈白色固体的化合物bcy8939(16.1mg、2.72μmol、产率27.1%、纯度98.3%)。计算值mw:5823.49,实测值m/z:1165.4[m/5+h]+、971.0[m/6+h]+、832.9[m/7+h]+。bcy10580bcy9172-peg12-n3的制备程序向bcy9172(100.0mg、47.72μmol、1eq)和化合物1(40.0mg、54.00μmol、1.13eq)的dmso(1ml)溶液中加入diea(9.25mg、71.58μmol、12.47μl、1.5eq)。将混合物在30℃下搅拌12小时。lc-ms显示bcy9172完全消耗,以及检测到一个主峰具有所想要的m/z(mw:2721.12、实测值m/z:1361.07([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂并产生残余物。然后,通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的化合物2(48mg、17.44μmol、产率45.68%、纯度98.87%)。bcy10580的制备程序化合物2(20mg、7.35μmol、1.0eq)和bcy10043(23.1mg、7.35μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、18.4μl、1.0eq)、vcna(0.4m、36.8μl、2.0eq)和thpta(0.4m、18.4μl、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在30℃下搅拌4小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5855.74,实测值m/z:976.40([m/6+h]+)和1171.67([m/5+h]+)]。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的bcy10580(29mg、4.85μmol、产率65.95%、纯度97.879%)。bcy10581bcy9172-peg12-n3的制备程序向bcy9172(100mg、47.72μmol、1eq)和化合物1(40.00mg、54.00μmol、1.13eq)的dmso(2ml)溶液中加入diea(9.25mg、71.58μmol、12.47μl、1.5eq)。将混合物在30℃下搅拌12小时。lc-ms显示bcy9172完全消耗,以及检测到一个主峰具有所想要的m/z(mw:2721.12、实测值m/z:1361.07([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂并产生残余物。然后,通过制备型hplc(中性条件)纯化残余物。获得呈白色固体的化合物2(48mg、17.44μmol、产率45.68%、纯度98.87%)。bcy10581的制备程序化合物2(12mg、4.41μmol、1eq)和bcy10044(14.08mg、4.41μmol、1eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、11.02l、1eq)、vcna(0.4m、22.05μl、2eq)和thpta(0.4m、10.04μl、1eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在30℃下搅拌4小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z[mw:5912.84,实测值m/z:985.90([m/6+h]+)和1183.28([m/5+h]+)]。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的bcy10581(9.3mg、1.47μmol、产率33.36%、纯度93.541%)。bcy10582化合物2的制备程序向bcy9172(100.0mg、47.7μmol、1.0eq)、化合物1(40.0mg、54.0μmol、1.13eq)的dmso(2ml)溶液中加入diea(9.2mg、71.6μmol、12.5μl、1.5eq)。将混合物在30℃下搅拌12小时。lc-ms显示bcy9172已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2721.12、实测值m/z:1361.07([m/2+h]+))。在减压下浓缩反应混合物以除去溶剂,得到残余物。通过制备型hplc(tfa条件)纯化残余物。获得呈白色固体的化合物2(37mg、13.60μmol、产率28.49%)。bcy10582的制备程序将化合物2(16.0mg、5.9μmol、1.0eq)、bcy10045(14.0mg、6.0μmol、1.01eq)和thpta(0.4m、14.7μl、1.0eq)的混合物溶解在t-buoh/h2o(1:1、2ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m,14.7μl,1.0eq)和vcna(0.4m,29.4μl,2.0eq)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在25-30℃下搅拌12小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z[计算值mw:5073.89、实测值m/z:1015.24([m/5+h]+)和1268.97([m/4+h]+)]。通过制备型hplc(tfa条件)直接纯化反应混合物。获得呈白色固体的bcy10582(10mg、1.92μmol、产率32.58%、纯度97.21%)。bcy11017bcy11017的制备程序化合物2(其可通过如制备bcy10567的步骤所述进行制备;7.0mg、2.59μmol、1.0eq)和bcy10861(7.03mg、2.59μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、13.0μl、2.0eq)、vcna(1.0mg、5.03μmol、2.0eq)和thpta(1.1mg、2.53μmol、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在35℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5421.30、实测值m/z:1084.7([m/5+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11017(6.6mg、1.17μmol、产率45.24%、纯度96.16%)。bcy11018bcy11018的制备程序化合物2(其可通过如制备bcy10570的步骤所述进行制备;6.0mg、2.17μmol、1.0eq)和bcy10861(5.9mg、2.17μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、11.0μl、2.0eq)、vcna(1.0mg、2.3eq)和thpta(1.1mg、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在35℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5479.34、实测值m/z:1096.40([m/5+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11018(2.3mg、0.40μmol、产率18.31%、纯度94.73%)。bcy11019bcy11019的制备程序化合物2(其可通过如制备bcy10581的步骤所述进行制备;8.0mg、2.94μmol、1.0eq)和bcy10861(8.0mg、2.59μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、14.7μl、2.0eq)、vcna(1.2mg、6.05μmol、2.0eq)和thpta(1.3mg、2.99μmol、1.0eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在35℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5437.26、实测值m/z:1088.09([m/5+h]+)以及1360.19([m/4+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11019(7.6mg、1.36μmol、产率46.09%、纯度96.95%)。bcy11376化合物2的制备程序向化合物1(5.0mg、49.5μmol、1.0eq)的dmf(1ml)溶液中加入edci(8.5mg、54.8μmol、1.1eq)和hosu(5.7mg、49.5μmol、1.0eq)。将混合物在25-30℃搅拌30分钟。tlc说明化合物1完全消耗并形成一个新斑点。然后,0.2ml的该混合物中加入bcy8919(20.0mg、9.62μmol)和diea(1.7μl、9.62μmol)。将混合物在25-30℃下搅拌2小时。lc-ms显示bcy8919已完全消耗、检测一个主峰具有所想要的m/z(计算值mw:2162.51,实测值m/z:1081.8([m/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物2(12mg、5.55μmol、产率56.28%、纯度97.54%)。bcy11376的制备程序将化合物2(3mg、1.39μmol、1.0eq.)、bcy10861(3.8mg、1.40μmol、1.0eq.)和thpta(1.2mg、2.76μmol、2.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、3.5μl、1.0eq.)和vcna(0.4m、3.5μl、1.0eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示bcy10861已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4878.64、实测值m/z:1220.8([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11376(1.9mg、1.0μmol、产率27.01%、纯度96.2%)。bcy11377化合物2的制备程序向化合物1(5.0mg、49.5μmol、1.0eq)的dmf(1ml)溶液中加入edci(8.5mg、54.8μmol、1.1eq)和hosu(5.7mg、49.5μmol、1.0eq)。将混合物在25-30℃搅拌30分钟。tlc说明化合物1完全消耗并形成一个新斑点。然后,0.2ml的该混合物中加入bcy8920(20.0mg、9.36μmol)和diea(1.2mg、9.36μmol)。将混合物在25-30℃下搅拌2小时。lc-ms显示bcy8920已完全消耗、检测到一个主峰具有所想要的m/z(计算值mw:2220.54,实测值m/z:1110.90([m/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物2(12mg、5.15μmol、产率56.28%、纯度95.3%)。bcy11377的制备程序将化合物2(3mg、1.35μmol、1.0eq.)、bcy10861(3.8mg、1.35μmol、1.0eq.)和thpta(0.6mg、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、3.4μl、1eq.)和vcna(0.4m、3.4μl、1eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:4936.68、实测值m/z:1234.9([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11377(3.5mg、0.66μmol、产率48.86%、纯度93.1%)。bcy11378化合物2的制备程序向化合物1(5.0mg、49.5μmol、1.0eq)的dmf(1ml)溶液中加入edci(8.5mg、54.8μmol、1.1eq)和hosu(5.7mg、49.5μmol、1.0eq)。将混合物在25-30℃搅拌30分钟。tlc说明化合物1完全消耗并形成一个新斑点。然后,0.2ml的该混合物中加入bcy9172(20.0mg、9.54μmol)和diea(1.7μl、9.62μmol)。将混合物在25-30℃下搅拌2小时。lc-ms显示化合物1已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2176.49,实测值m/z:1090.0([m/2+h]+))。然后,在减压下浓缩反应混合物以除去溶剂并产生残余物,接着通过制备型-hplc(tfa条件)来纯化。获得呈白色固体的化合物2(20.2mg、7.48μmol、产率78.34%、纯度80.57%)。bcy11378的制备程序将化合物2(5mg、2.30μmol、1.0eq.)、bcy10861(6.24mg、2.30μmol、1.0eq.)和thpta(1.0mg、1.0eq.)的混合物溶解在t-buoh/h2o(1:1、1ml、预脱气并用n2吹扫3次),然后在n2下添加cuso4(0.4m、5.8μl、1.0eq.)和vcna(0.4m、5.8μl、1eq.)。通过滴加0.2mnh4hco3(在1:1t-buoh/h2o中),将该溶液的ph调节至8,溶液变为浅黄色。将反应混合物在n2气氛下在40℃下搅拌2小时。lc-ms显示化合物3已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:4894.61、实测值m/z:1224.3([m/4+h]+))。过滤并在减压下浓缩反应混合物以得到残余物。通过制备型hplc(tfa条件)纯化粗产物并且获得呈白色固体的bcy11378(1.2mg、0.34μmol、产率10.07%、纯度94.3%)。bcy11379bcy8919-peg5-n3的制备程序bcy8919(30.0mg、14.43μmol、1.0eq)和化合物1(6.3mg、14.57μmol、1.01eq)溶解在mecn(1ml)和h2o(1ml)的混合物中。然后向该溶液中加入1mnahco3将ph调节至8,接着将混合物在35℃下搅拌2小时。lc-ms显示bcy8919已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2396.79,实测值m/z:1198.74([m/2+h]+)和799.50([m/4+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(20mg、8.07μmol、产率55.92%、纯度96.68%)。bcy11379的制备程序化合物2(3.0mg、1.25μmol、1.0eq)和bcy10861(3.4mg、1.25μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、7μl、2.24eq)、vcna(1mg、5.04μmol、4.03eq)和thpta(1mg、2.30μmol、1.840eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在25-30℃下搅拌16小时。lc-ms显示化合物2已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5112.93、实测值m/z:1022.96([m/5+h]+)以及1278.74([m/4+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11379(3.4mg、0.615μmol、产率52.00%、纯度97.88%)。bcy11380bcy8920-peg5-n3的制备程序bcy8920(30.0mg、14.04μmol、1.0eq)和化合物1(6.1mg、14.11μmol、1.01eq)溶解在mecn(1ml)和h2o(1ml)的混合物中。然后向该溶液中加入1mnahco3将ph调节至8,接着将混合物在35℃下搅拌2小时。lc-ms显示bcy8920已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2454.83,实测值m/z:1227.63([m/2+h]+)和818.66([m/3+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(20mg、8.03μmol、产率57.21%、纯度98.56%)。bcy11380的制备程序化合物2(3.5mg、1.43μmol、1.0eq)和bcy10861(3.9mg、1.44μmol、1.0eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、8μl、2.24eq)、vcna(1mg、5.04μmol、3.52eq)以及thpta(1mg、2.30μmol、1.61eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在25-30℃下搅拌16小时。lc-ms显示大多数化合物2已经消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:5170.97、实测值m/z:1034.28([m/5+h]+以及1293.10([m/4+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11380(1.6mg、0.296μmol、产率20.77%、纯度96.77%)。bcy11381bcy8920-peg5-n3的制备程序bcy9172(30.0mg、14.32μmol、1.0eq)和化合物1(6.2mg、14.34μmol、1.01eq)溶解在mecn(1ml)和h2o(1ml)的混合物中。向该溶液中加入1mnahco3将ph调节至8,接着将混合物在35℃下搅拌2小时。lc-ms显示bcy9172已完全消耗,以及检测到一个主峰具有所想要的m/z(计算值mw:2412.75、实测值m/z:1206.72([m/2+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的化合物2(15mg、6.14μmol、产率42.87%、纯度98.75%)。bcy11381的制备程序化合物2(3.0mg、1.24μmol、1.0eq)和bcy10861(3.4mg、1.25μmol、1.01eq)先溶解在2ml的t-buoh/h2o(1:1),然后加入cuso4(0.4m、7μl、2.25eq)、vcna(1mg、5.04μmol、4.06eq)和thpta(1mg、2.30μmol、1.85eq)。最后,加入1mnh4hco3调节ph至8。这里所有溶剂脱气并用n2吹扫3遍。将反应混合物在n2气氛下在25-30℃下搅拌16小时。lc-ms显示检测到一个主峰具有所想要的m/z(计算值mw:5128.89,实测值m/z:1026.05([m/5+h]+)以及1282.50([m/4+h]+))。通过制备型hplc(tfa条件)纯化反应混合物并且获得呈白色固体的bcy11381(1.6mg、0.295μmol、产率23.73%、纯度94.59%)。实施例5:产生cd137单克隆抗体激动剂在美国专利号us7,288,638中公开了在本文介绍的实验中用于与cd137多聚体比较的cd137单克隆抗体激动剂的序列。在dna表达构建体瞬时转染后,使用expicho表达系统(thermofisherscientific)表达igg4同种型(isotype)抗体。通过蛋白a亲和层析纯化抗体,并在ph7.2的磷酸盐缓冲溶液(pbs)中配制。使用hplc-sec(gf-250柱,agilent)的纯度分析表明,cd137单克隆抗体的单体率约为95%。结合活性分析表明,浓度高于1μg/ml的cd137单克隆抗体可以与表达cd137的cho细胞结合。使用toxinsensortm显色lal内毒素检测试剂盒(chromogeniclalendotoxinassaykit)(genscript)进行的内毒素分析表明,cd137单克隆抗体制剂中含有<7eu/mg的内毒素。生物数据1.cd137biacore实验说明进行biacore实验以确定与人cd137蛋白结合的异源串联肽的ka(m-1s-1)、kd(s-1)、kd(nm)值。将重组人cd137(r&d系统)重悬于pbs中,并按照制造商建议的规程使用ez-linktmsulfo-nhs-lc-lc-biotin试剂(thermofisher)进行生物素化。使用旋转柱将蛋白质脱盐以除去未偶联的生物素,并将其移入pbs中。为了分析肽结合,将biacoret200或biacore3000仪器与xanteccmd500d芯片一起使用。使用标准胺偶联化学试剂,在25℃下以hbs-n(10mmhepes、0.15mnacl、ph7.4)作为运行缓冲液,将链霉亲和素固定在芯片上。简而言之,以1:1比例的0.4m1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)/0.1mn-羟基琥珀酰亚胺(nhs),以流速为10μl/分钟注射7分钟,活化羧甲基葡聚糖表面。为了捕获链霉亲和素,将蛋白质在10mm乙酸钠(ph4.5)中稀释至0.2mg/ml,并通过将120μl的蛋白质注射到活化的芯片表面上进行捕获。通过注射1m乙醇胺(ph8.5)7分钟来封闭残基活化的基团,并将生物素化的cd137捕获到270-1500ru的水平。将缓冲液更改为pbs/0.05%tween20,并在该缓冲液中制备一系列稀释的肽,最终dmso浓度为0.5%。最高肽浓度为500nm,进行6次2倍或3倍稀释。spr分析在25℃下运行,以90μl/分钟的流速进行60秒结合(association)和900秒解离(dissociation)。在每个循环后,采用再生步骤(10μl的10mm甘氨酸ph2)。根据需要对数据进行dmso排除体积影响的校正。使用标准处理程序对所有数据进行空白注射(injection)和参考表面的双参考,并使用2.0c版scrubber软件(biologicsoftware)进行数据处理和动力学拟合。使用简单的1:1结合模型拟合数据,以便在适当的情况下实现质量传输效应。在该分析法中测试某些异源串联肽,结果示于下表1中。表格1:使用异源串联肽的cd137biacore分析数据2.粘连蛋白-4biacore实验说明进行biacore实验以确定异源串联肽结合至人粘连蛋白-4蛋白质(获自charlesriver)的ka(m-1s-1)、kd(s-1)、kd(nm)值。具有gp67信号序列和c末端flag标签的人粘连蛋白-4(残基gly32-ser349;ncbirefseq:np_112178.2)克隆到pfastbac-1和杆状病毒(baculovirus)中,所述杆状病毒使用标准bac-to-bactm方案(lifetechnologies)制备。在27℃下,使用p1病毒原液(stock)以2的moi感染excell-420介质(sigma)中的1x106ml-1的sf21细胞,并在72小时收获上清液。将上清液与在pbs中洗涤的抗flagm2亲和琼脂糖树脂(sigma)在4℃下分批结合1小时,然后将树脂转移至柱中并用pbs过度洗涤。用100μg/mlflag肽洗脱蛋白质。将洗脱的蛋白质浓缩至2ml,并以1ml/min的速度上样至在pbs中的s-200superdex柱(gehealthcare)。收集2ml级分(fraction),并将含有粘连蛋白-4蛋白的级分浓缩至16mg/ml。根据制造商建议的方案,使用ez-linktm的sulfo-nhs-lc-lc-biotin试剂(thermofisher)在pbs中将蛋白质随机生物素化。使用旋转柱将蛋白质广泛脱盐以除去未偶联的生物素,并移入pbs中。为了分析肽结合,将biacore3000仪器与cm5芯片(gehealthcare)一起使用。使用标准胺偶联化学试剂,在25℃下以hbs-n(10mmhepes、0.15mnacl、ph7.4)作为运行缓冲液,将链霉亲和素固定在芯片上。简而言之,以1:1比例的0.4m1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)/0.1mn-羟基琥珀酰亚胺(nhs),以10μl/分钟的流速注射7分钟,活化羧甲基葡聚糖表面。为了捕获链霉亲和素,将蛋白质在10mm乙酸钠(ph4.5)中稀释至0.2mg/ml,并通过将120μl的链霉亲和素注射到活化的芯片表面上进行捕获。通过注射1m乙醇胺(ph8.5)7分钟来封闭残基活化的基团,并将生物素化的粘连蛋白-4捕获到1,200-1,800ru的水平。将缓冲液更改为pbs/0.05%tween20,并在该缓冲液中制备肽的一系列稀释液,最终dmso浓度为0.5%。最高肽浓度为100nm,进一步进行6次2倍稀释。spr分析在25℃下运行,以50μl/分钟的流速进行60秒结合和400至1,200秒的解离(取决于各个肽)。对数据进行dmso排除体积影响的校正。使用标准处理程序对所有数据进行空白注射和参考表面的双参考,并使用2.0c版scrubber软件(biologicsoftware)进行数据处理和动力学拟合。使用简单的1:1结合模型拟合数据,以便在适当的情况下实现质量传输效应。在上述提到的粘连蛋白-4结合分析中测试了本发明的某些异源串联肽,结果在下表2中显示:表2:使用异源串联肽的粘连蛋白-4biacore分析数据复合物idsprkd(nm)bcy88542.76bcy9350>200nmbcy93512.47bcy93991.67bcy94001.8bcy94081.57bcy94091.66bcy94101.49bcy94111.48bcy97592.14bcy100002.263.epha2biacore实验说明进行biacore实验以确定与人epha2蛋白结合的异源串联肽的ka(m-1s-1)、kd(s-1)、kd(nm)值。在4mm乙酸钠、100mmnacl、ph5.4中,使用与蛋白质相比,3x摩尔过量的生物素,使用ez-linktm的sulfo-nhs-lc-biotin对epha2进行1小时生物素化。将反应混合物透析至pbs中之后,使用荧光生物素定量试剂盒(thermo)测定标记的程度。为了分析肽结合,将biacoret200仪器与xanteccmd500d芯片一起使用。使用标准胺偶联化学试剂,在25℃下以hbs-n(10mmhepes、0.15mnacl、ph7.4)作为运行缓冲液,将链霉亲和素固定在芯片上。简而言之,以1:1比例的0.4m1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)/0.1mn-羟基琥珀酰亚胺(nhs),以10μl/分钟的流速注射7分钟,活化羧甲基葡聚糖表面。为了捕获链霉亲和素,将蛋白质在10mm乙酸钠(ph4.5)中稀释至0.2mg/ml,并通过将120μl注射到活化的芯片表面上进行捕获。通过注射1m乙醇胺(ph8.5):hbs-n(1:1)7分钟来封闭残基活化的基团。将缓冲液更改为pbs/0.05%tween20,使用在缓冲液中稀释至0.2μm的蛋白将生物素化的epha2捕获至500-1500ru的水平。在该缓冲液中制备肽的一系列稀释液,最终dmso浓度为0.5%,最高肽浓度为50或100nm,进一步进行6次2倍稀释。spr分析在25℃下运行,以90μl/分钟的流速进行60秒结合和900至1200秒解离。对数据进行dmso排除体积影响的校正。使用标准处理程序对所有数据进行空白注射和参考表面的双参考,并使用2.0c版scrubber软件(biologicsoftware)进行数据处理和动力学拟合。使用简单的1:1结合模型拟合数据,以便在适当的情况下实现质量传输效应。在epha2结合分析中测试了本发明的某些异源串联肽,结果在下表3中显示:表3:使用异源串联肽的epha2biacore分析数据复合物idsprkd(nm)bcy91732.1bcy79852bcy89421.7bcy8943>200nmbcy96471.69bcy96481.75bcy96551.33bcy96560.75bcy96571.1bcy96581.9bcy96591.03bcy97581.54.cd137报告子分析与肿瘤细胞共培养通过将1%fbs添加到rpmi-1640(promega试剂盒cs196005的组分)中来制备称为r1介质的培养介质。在无菌的96孔板上制备r1中的测试物品的系列稀释液。在白色细胞培养板上的指定孔中使用每孔25μl的受测物品或r1(作为背景对照)。收集肿瘤细胞*,并以400,000细胞/ml的浓度重悬在r1介质中。白色细胞培养板中使用二十五(25)μl/孔的肿瘤细胞。将jurkat细胞(promega试剂盒cs196005,0.5ml)在水浴中融化,然后添加到5ml预热的r1介质中。二十五(25)μl/孔的jurkat细胞用于白色细胞培养板。将细胞和测试物品在37℃、5%co2下孵育6小时。6小时结束时,添加75μl/孔的bio-glotm(promega)并孵育10分钟,然后在酶标仪(clariostar,bmg)中读取发光。计算相对于细胞(共培养中使用的jurkat细胞+细胞系)的倍数变化,并在graphpadprism中绘制为log(激动剂)相对于响应的曲线,以确定ec50(nm)和相对于背景的倍数诱导(max)。共培养中使用的肿瘤细胞类型取决于异源串联特异的肿瘤靶标,如下表4所示:表4:用于每个肿瘤靶标的细胞系在图3中显示数据,其显示在存在表达epha2的ht1080细胞的情况下,在promegacd137荧光素酶报告子分析中,epha2-cd137异源串联bcy7985显示出对cd137细胞活性的强诱导。在没有ht1080细胞的情况下,异源串联没有cd137诱导作用。在图4中显示数据,其显示在cd137报告子分析中,epha2/cd137异源串联诱导强cd137活性,并且活性的诱导倍数取决于共培养使用的细胞系(a549和sc-ov-3:epha2高和lncap:epha2低)上的肿瘤靶标表达水平。在图6中显示数据,其显示在cd137报告子分析中粘连蛋白-4/cd137异源串联诱导强cd137活性,活性的诱导倍数取决于共培养所使用的细胞系(ht1376:粘连蛋白-4高和nci-h292:粘连蛋白-4中等)上肿瘤靶标的表达水平。在图9中显示数据,其显示在cd137报告子分析中在存在pd-l1表达细胞系时,pd-l1/cd137异源串联诱导cd137的强活性。在cd137报告子分析中在与不同细胞系共培养时由异源串联肽诱导的ec50(nm)和诱导倍数的总结报告在下表5中:表5:cd137报告子分析中异源串联肽诱导的诱导倍数5.人类原代t细胞-a549共培养(肿瘤细胞杀伤)从三个健康供体分离pbmc,并且在存在抗-cd3刺激,以两个浓度以两个限定的比率加入到nuclight红色标记的肿瘤靶标细胞(人肺癌细胞atcccll-185tm)中。将肿瘤细胞:pbmc共培养物以三个浓度与前导双环(leadbicycle)一起孵育。为了检测直接的肿瘤细胞细胞毒性,也在所有的测试条件下铺板没有刺激性pbmc的肿瘤细胞。通过随时间计数活的nuclight红色阳性肿瘤细胞来评估肿瘤杀伤。此外,caspase3/7染料用于鉴定凋亡的肿瘤细胞。使用incucytes3机器分析培养物,该机器允许实时活细胞荧光成像。对共培养在72小时采集图形。每个条件一式三份。数据显示在图5中,其表明epha2/cd137异源串联在原代人t细胞和癌细胞共培养分析中诱导肿瘤细胞杀伤。抗cd137mab激动剂用作对照。6.人pbmc-4t1共培养(细胞因子释放)分析在rpmi1640中培养小鼠乳腺肿瘤细胞系4t1-1(4t1-亲代)和鼠粘连蛋白-4过表达的4t1(4t1-d02),所述rpmi1640补充有10%热灭活胎牛血清,100i.u/ml青霉素和100i.u/链霉素、20mmhepes、1x非必需氨基酸、和2mml-谷氨酰胺(rpmi工作介质)。将来自健康人供体的冷冻pbmc解冻,并在室温pbs中洗涤一次,然后重悬于rpmi工作介质中。对于肿瘤细胞和pbmc共培养,将10000个pbmc和2000个肿瘤细胞(5:1)混合并铺在384孔板的每个孔中。为了刺激人pbmc,在第0天将125ng/ml可溶性抗cd3mab(克隆okt3)添加到培养物中。将测试、对照化合物或载体对照添加到各个孔中,并使每孔的最终体积达到100ul。将平板在含有5%co2的37℃细胞培养箱中孵育三天。在刺激后48小时收集上清液,并使用htrf分析法检测人il-2和ifnγ。使用excel或prism软件分析原始数据,以生成标准曲线以内插(interpolate)蛋白质浓度。数据表示一项研究,其中在一式两份的实验中测试了三个不同的供体pbmc。图7中呈现的数据表明,在pbmc-4t1共培养分析中,粘连蛋白-4/cd137异源串联诱导强劲的il-2和ifn-γ细胞因子分泌。bcy9350和bcy9351分别是粘连蛋白-4和cd137的非结合对照。在下表6中报告了在人pbmc-4t1共培养(细胞因子释放)分析中的由选择的粘连蛋白-4/cd137异源串联肽诱导的ec50(nm)和最大的ifn-γ细胞因子分泌(pg/ml)的总结。表6:在人pbmc-4t1共培养(细胞因子释放)分析中的由选择的粘连蛋白-4/cd137异源串联肽诱导的ec50和最大ifn-y细胞因子分泌7.离体培养规程将来自discoverylifesciences(dls)的原代患者来源的肿瘤细胞在新鲜加入(spikedfresh)benzonase的10ml预热洗涤介质中轻轻解冻。来自greiner的3d球体试剂盒(目录号655840)用于将细胞保持培养2天。简而言之,使用血细胞计数器用台盼蓝对肿瘤细胞进行计数。将细胞以1500rpm离心5分钟以洗涤,然后将沉淀重悬于每1x106个细胞100μl的n3d纳米穿梭中。为了使它们具有磁性,将细胞以1500rpm离心5分钟,然后重悬;此过程总共重复4次。最后一次旋转后,将细胞重悬于适量的新鲜肺dtc介质(dls)中,以得到在100μl/孔中的50,000-100,000个细胞。greiner细胞防护(cell-repellent),96孔板(目录号655976)用于此实验。如果可见细胞团块或碎片,则在铺平板之前将样品施加到70-100μm的过滤器上。每个样品至少保存50,000个细胞用于第0天流式细胞仪组,将这些细胞染色、固定、并保存在4℃以便以后进行流式分析。在肺dtc介质中以2x在单独的平板中制备对照/测试化合物稀释液,并按照平板图所述,将100μl/孔的这些2x药物溶液添加到孔中。然后将分析平板置于37℃、5%co2的湿润容器中的96孔磁球体驱动上。在第24h时,去除磁性球体驱动。在第48h,收集介质用于细胞因子分析,并收集细胞用于第2天流式细胞仪组。使用来自r&d系统的客户定制的细胞因子/趋化因子组(ip-10、颗粒酶b、ifnγ、il-2、il-6、tnfα、il-8、mip-1a、mip-1b、mcp-1、il-10、mig)在luminex读取仪上来定量细胞因子。流式组:第0天=生/死,cd45、epcam、粘连蛋白4、cd3、cd4、cd8、cd137;day2=生/死,cd45、epcam、粘连蛋白4、cd3、cd8、ki67和计数珠。使用flowjo软件分析流式数据。图8中呈现的数据表明,粘连蛋白-4/cd137异源串联在原代患者来源的肺肿瘤的离体培养物中诱导靶标依赖性细胞因子释放。bcy10572的治疗在患者来源的样品中诱导了粘连蛋白-4依赖性的几种免疫标记物(相对于载体进行标准化)和%cd8+ki67+细胞的变化。8.cd137双特异性物质在sd大鼠中的药代动力学每个双环多聚体按2mg/kg给药雄性sd大鼠,所述双环多聚体配制在25mm组氨酸hcl、10%蔗糖ph7中。在每个时间点通过下颌下静脉或大隐静脉进行连续性放血(约80μl血液/时间点)。立即将所有血样转移到含有作为抗凝剂的2μlk2-edta(0.5m)的预冷微量离心管中,并置于湿冰上。通过将血样在约4℃、3000g下离心将其立即加工为血浆。立即将包括内标物在内的沉淀物添加到血浆中,充分混合,并在4℃下以12,000rpm离心10分钟。将上清液转移到预先标记的聚丙烯微量离心管中,然后在干冰上快速冷冻。根据需要将样品存储在70℃或更低的温度下直至分析。使用orbitrapqexactive以正离子模式直接注入7.5μl上清液样品进行lc-ms/ms分析,以确定双环多聚体的浓度。使用phoenixwinnonlin6.3软件程序通过非隔室(non-compartmental)方法分析血浆浓度相对时间的数据。报告c0、cl、vdss、t1/2、auc(0-last)、auc(0-inf)、mrt(0-last)、mrt(0-inf)以及血浆浓度相对时间的曲线图。图10显示了来自2mg/kg,iv给药的sd大鼠(n=3)的bcy10572和bcy10000的血浆浓度相对时间的曲线。实验所得的药代动力学参数如表7所示:表7:bcy10572和bcy10000血浆浓度相对时间曲线的药代动力学参数序列表<110>拜斯科技术开发有限公司<120>异源串联双环肽复合物<130>bic-c-p2349pct<150>1805492.4<151>2018-04-04<150>1820981.7<151>2018-12-21<160>18<170>patentinversion3.5<210>1<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>1cysileglugluglyglntyrcysphealaaspprotyrxaacys151015<210>2<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是hyp<220><221>xaa<222>(14)..(14)<223>xaa是harg<400>2cysxaaleuvalasnproleucysleuhisproasptrpxaacys151015<210>3<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是tbuala<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>3cysxaaproglualaprotyrcysphealaaspprotyrxaacys151015<210>4<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>4cysileglugluglyglntyrcysphealaaspprotyrxaacys151015<210>5<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是tbuala<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>5cysxaaprolysalaprotyrcysphealaaspprotyrxaacys151015<210>6<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是tbuala<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>6cysxaaproglulysprotyrcysphealaaspprotyrxaacys151015<210>7<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是tbuala<220><221>xaa<222>(4)..(4)<223>xaa是k(pya)<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>7cysxaaproxaaalaprotyrcysphealaaspprotyrxaacys151015<210>8<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是tbuala<220><221>xaa<222>(5)..(5)<223>xaa是d-lys(pya)<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>8cysxaaprogluxaaprotyrcysphealaaspprotyrxaacys151015<210>9<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(5)..(5)<223>xaa是d-lys(pya)<220><221>xaa<222>(14)..(14)<223>xaa是nle<400>9cysileglugluxaaglntyrcysphealaaspprotyrxaacys151015<210>10<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(5)..(5)<223>xaa是k(pya)<220><221>xaa<222>(14)..(14)<223>xaa是dnle<400>10cysileglugluxaaglntyrcysphealaaspprotyrxaacys151015<210>11<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(14)..(14)<223>xaa是harg<400>11cysleutrpaspprothrprocysalaasnleuhisleuxaacys151015<210>12<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(2)..(2)<223>xaa是harg<400>12cysxaaasptrpcyshistrpthrpheserhisglyhisprocys151015<210>13<211>15<212>prt<213>人工<220><223>合成肽<400>13cysseralaglytrpleuthrmetcysglnlysleuhisleucys151015<210>14<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(11)..(11)<223>xaa是k(pya)<400>14cysseralaglytrpleuthrmetcysglnxaaleuhisleucys151015<210>15<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(3)..(3)<223>xaa是1nal<220><221>xaa<222>(7)..(7)<223>xaa是harg<220><221>xaa<222>(13)..(13)<223>xaa是hyp<400>15cysproxaaaspcysmetxaaasptrpserthrproxaatrpcys151015<210>16<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(3)..(3)<223>xaa是1nal<220><221>xaa<222>(7)..(7)<223>xaa是harg<220><221>xaa<222>(13)..(13)<223>xaa是hyp<400>16cysproxaaaspcysmetxaaasptrpserthrproxaatrpcys151015<210>17<211>16<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(3)..(3)<223>xaa是1nal<220><221>xaa<222>(5)..(5)<223>xaa是(sar10-(b-ala))<220><221>xaa<222>(8)..(8)<223>xaa是harg<220><221>xaa<222>(14)..(14)<223>xaa是hyp<400>17cysproxaalysxaacysmetxaaasptrpserthrproxaatrpcys151015<210>18<211>15<212>prt<213>人工<220><223>合成肽<220><221>xaa<222>(7)..(7)<223>xaa是harg<220><221>xaa<222>(13)..(13)<223>xaa是hyp<400>18cyspropheglycysmetxaaasptrpserthrproxaatrpcys151015当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



