通过连接共定位的夹心测定法的制作方法
 2021-02-02 17:02:08|
2021-02-02 17:02:08| 269|
269| 起点商标网
起点商标网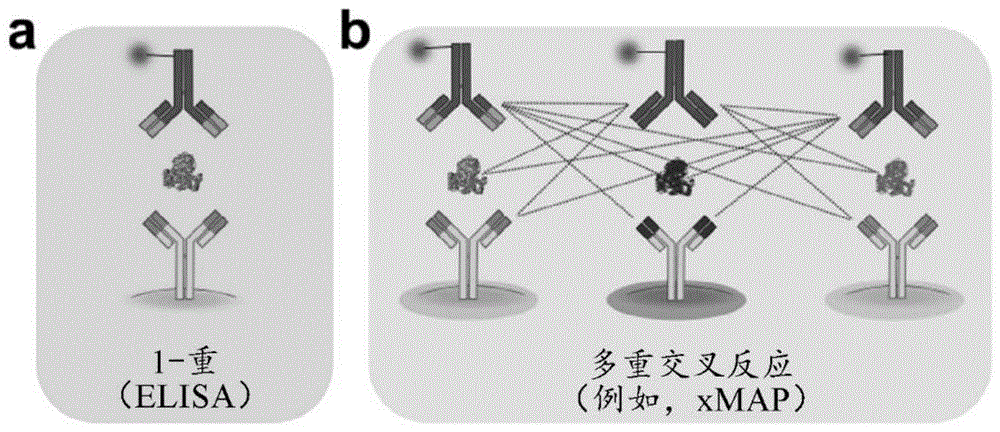
相关领域的交叉申请
本申请要求2018年4月3日提交的名为“通过连接共定位的夹心测定法”的美国临时专利申请号62/651,943的的权益,该临时申请的全部内容通过引用并入本文。
本发明涉及生物分析领域,尤其涉及用于采用通过连接共定位的夹心测定法检测和/或量化生物分子的方法和系统,并且涉及用于同时检测和/或量化样本中的多种生物分子的多重夹心测定法。
背景技术:
血红细胞、白细胞、血小板、蛋白质、dna和rna等生物细胞和生物分子的快速、特异性检测在基因组学、蛋白质组学、诊断、治疗和病理学研究等不同领域中已经愈发重要。例如,快速且准确地检测特异性抗原和病毒对于抗击流行性疾病如aids、流感和其它传染性疾病来说至关重要。基因组技术的成熟以及个体化医疗的进步将需要用于检测和量化大量细胞和生物分子的更快更灵敏的测定法。医疗研究的进步将愈发依赖通过蛋白质组学对多种蛋白质进行准确、及时且经济的评估。然而,目前自动化、高度灵敏、低成本的测定法无法高效地多重化。
夹心测定法是最流行的生物测定法形式之一。在该形式中,捕获探针分子固定在表面上。然后将含有靶细胞或感兴趣生物分子的生物样本施加到表面上。靶标以浓度依赖性方式与固定在表面上的捕获探针分子结合。在随后的步骤中,将检测探针分子施加到表面上。检测探针分子与靶生物分子结合,从而使该靶生物分子“夹”在捕获探针与检测探针分子之间。在某些测定法中,还可以将结合检测探针分子的第二探针施加到表面上。第二探针可与荧光团等标签缀合,在这种情况下,可使用荧光扫描仪或荧光显微镜来检测该结合。在某些情况下,第二探针与放射性元素缀合,在这种情况下,检测放射性以读出测定结果。在某些情况下,第二探针与酶缀合,在这种情况下,将含有底物的溶液添加到表面上,并且检测酶对底物的转化。在所有的情况下,所检测信号的强度与生物样本中的靶标的浓度成比例。夹心测定法中双重识别的要求提供了一个具有低背景噪音的高保真度信号,因此提供了高灵敏度的检测。
酶联免疫吸附测定(elisa)是众所周知的夹心测定法的示例。elisa通常使用抗体和变色反应来鉴定生物样本中的生物分子。例如,elisa可使用固相酶免疫测定(eia)来检测施加到固相中的液态或湿生物样本中的抗原等生物分子的存在。通常在被动结合抗体和蛋白质的96孔板或384孔聚苯乙烯板中进行elisa。正是这种试剂在固体表面上的结合和固定,使得elisa的设计和执行变得如此容易。将试剂固定在微板表面上易于使结合的靶生物分子与未结合的材料在测定期间分离并且清洗掉非特异性结合的材料。此外,对由捕获和探测探针分子进行的双重识别的要求提供了高度特异性。因此elisa是用于测量特定粗制剂中特异性靶生物分子的有力工具。
可以设计并构建夹心测定法以并行测量或检测多种分析物(也称为多重化)。可以使用诸如dna微阵列、蛋白质微阵列或抗体微阵列等微阵列实现多重夹心测定法(msa)。微阵列是含有与基底表面如玻璃、塑料或硅附接的生物分子的微点的集合,因而形成“微观”阵列。这种微阵列可用于例如同时测量大量基因或蛋白质的表达水平。通常通过荧光标签的光学读数来检测微阵列芯片上的诸如dna、蛋白质或抗体等生物分子,所述荧光标签与靶分子附接,所述靶分子与探针分子特异性附接或杂交。所使用的标签可由例如酶、放射性同位素或荧光团组成。
也可以在颗粒上进行msa。在这种情况下,悬浮在溶液中的颗粒与捕获蛋白质或特异性dna分子等感兴趣靶标所必需的生物附接。为了进行多重测定,必须对颗粒编码以区分溶液中的不同测定。一种流行的形式是光谱编码的微粒,该微粒用荧光或发光染料编码。颗粒也可以以图形方式编码,因此它们通常被称为“条形码化颗粒”。颗粒的大小的范围可从纳米(纳米颗粒)到微米(微粒)。其中,荧光编码的微粒可以在细胞仪上快速、高通量地读出。
然而,目前的夹心测定法当用于同时测量样本中的多种生物分子(多重化)时性能较差。多重elisa受到抗体、蛋白质等试剂之间交叉反应的限制,因此易于受到非特异性信号转导的影响。在阵列和微珠形式的常规多重夹心测定法中,通常将检测抗体以混合物施用,但是这种方法会引起试剂之间的相互作用,从而导致交叉反应。检测抗体混合物的施用因此会导致假结合,并且例如在捕获和非靶分析物(如本文图1所示)之间从非特异性结合事件中产生假阳性信号,该信号难以与真正的靶蛋白结合信号区分。这种试剂驱动的交叉反应是msa固有的问题,并且以二次方关系随靶标数目规模化,从而严重限制了多重化的规模。由于交叉反应的问题,目前的msa通常限于30-40种靶标。即便如此,仍需要冗长而昂贵的优化方案来发现和去除交叉反应试剂(如抗体),这严重限制了这些测定法的适用性并增加了其成本。
交叉反应也因此阻碍了其它类型的多重测定。例如,准确的蛋白质磷酸化分析可用于揭示蛋白质表达水平不明显的细胞信号转导事件。目前用于量化特异性蛋白质翻译后修饰(ptm)的部分的方法和流程在多重化中受到严重限制,因为ptm特异性抗体通常对蛋白质本身没有足够的特异性(即,磷特异性抗体对于试剂驱动的交叉反应问题高度易感)。因此,常规的ptm板不能多重化。
常规的夹心免疫测定也不适用于分析蛋白质-蛋白质相互作用。蛋白质-蛋白质相互作用是细胞过程的关键部分,理解这些相互作用的调节物对解决相关疾病而言是极其重要的。然而,使用检测抗体混合物允许非所需的相互作用并导致能使相互作用信号模糊的假结合。目前的多重夹心测定也很昂贵,因为在制造和进行测定期间低效率地使用了昂贵的试剂如抗体。例如,在溶液中添加抗体混合物需要高浓度(纳摩尔),然而,与蛋白质结合以定量分析微阵列或微珠所需的量少3个数量级,对应于99.9%的抗体损失。进一步地,给定的夹心免疫测定的灵敏度受到背景信号的严重影响,该背景信号通常是由于标记的检测抗体的非特异性结合和/或不完全清洗所致。已经使用了通过增加清洗周期并包括添加试剂来减少不完全清洗的方法,然而,这些方法会导致测定时间和测定复杂度增加。
美国专利号9,481,945描述了抗体共定位微阵列(acm),其依赖于单个检测抗体对微阵列上每个捕获抗体点的寻址,从而避免了单重elisa测定中发现的抗体试剂和再现测定条件之间的相互作用。该方法的实施需要首先对捕获抗体进行点样,从点样仪上取下载玻片,将其与样本一起培养,根据需要清洗和漂洗,然后将其放回以点样检测抗体,然后进行结合和培养。因此,该方法依赖于将n种不同试剂转移到n个点,每个点也使用不同的试剂,代表n对n转移。进行点样的需要作为测定的一部分是繁琐和缓慢的,并且通量有限。
美国专利号7,306,904描述了用于检测和/或量化一种或多种分析物的测定法是使用所谓的邻近探针的解决方案。邻近探针包括结合部分和核酸。来自一种邻近探针的核酸与来自另一种邻近探针的核酸的相互作用仅当它们非常邻近,即与它们具有特异性的分析物相结合时才是可能的。然而,一般情况下,多重化的基于邻近性的测定需要以单重形式进行检测或读出,因此需要复杂的微流控将样本分为n个部分进行n-重测定。
美国专利申请公开号us2016/0153973描述了一种在免疫测定中使用可切割接头检测分析物的方法和系统。然而,由于高背景信号和试剂间的交叉反应,该方法和系统不适合在高灵敏度的免疫测定中多重化或同时检测多种分析物。
技术实现要素:
提供了使用生物化学测定法检测和/或量化生物分子的方法和系统。本发明的目的是至少改进现有技术中存在的某些缺点。本技术的实施方案是基于发明人的认识开发的,即需要可扩展、成本效益高、敏感、快速和/或简单的多重化夹心测定法,例如,以代替elisa用于常规用途。因此,在某些方面,本文提供了多重夹心测定法,包括快速、灵敏、成本效益高和/或可扩展的试剂之间具有最小交叉反应的多重夹心免疫测定,允许同时检测和/或量化样本中的多种分析物。
本文提供的方法和系统至少部分地基于试剂和载体之间的连接的设计和构造,其中这些连接能够实现可寻址和可编程的拓扑和功能。在不希望受到理论限制的情况下,相信本文提供的系统和方法可以减少或消除多重夹心测定中的一种或多种背景噪声和/或假阳性的来源。在一些实施方案中,通过最小化或消除非同源亲和力结合物之间的相互作用来最小化或消除多重测定中试剂之间的交叉反应。在一些实施方案中,本文提供的方法和系统可以减少或消除由检测试剂的不完全清洗和/或非特异性结合引起的背景噪声。在一些实施方案中,本文提供的方法和系统可允许通过组合试剂在不同测定载体上的组装来实现翻译后修饰的多重检测和/或蛋白质-蛋白质相互作用的鉴定。在一些实施方案中,可以控制试剂的表面结构、接头长度和/或表面间距以调整结合的严格性和信号生成。在一些实施方案中,附加步骤允许通过将测定信号从可逆反应转导至稳定的寡和物杂交体中来稳定测定信号,以最小化未结合,从而最小化测定完成后的信号损失并且从而增加灵敏度。
在第一方面,提供了一种用于检测和/或量化样本中的分析物的生物分子复合物,该生物分子复合物包括:
锚链,所述锚链与载体附接;
捕获试剂,所述捕获试剂与载体附接;和
检测试剂,所述检测试剂与锚链可释放地附接,所述检测试剂或锚链与第一标签任选地附接,第一标签无活性或不可检测;
其中:捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物;在不存在分析物的情况下,从锚链释放检测试剂可使检测试剂从载体上释放;以及当检测试剂从锚链释放时,第一标签可被激活或检测。因此,通过在检测试剂已经从锚链释放后在载体上检测第一标签来确定样本中分析物的存在,因为检测试剂仅在与具有捕获试剂的三重复合物中的分析物结合时才保持与载体附接。因此在一些实施方案中,仅当存在分析物时在载体上检测到第一标签。
在一些实施方案中,当检测试剂从锚链释放时在载体上或从载体上检测到的第一标签的量与样本中分析物的数量和/或浓度成比例。
在一些实施方案中,检测试剂或锚链与第一标签任选地附接。在一些实施方案中,检测试剂与第一标签任选地附接。在一些实施方案中,锚链与第一标签任选地附接。
在一些实施方案中,检测试剂通过共价键、生物素-链霉亲和素键、氢键合、疏水性相互作用、亲和力结合或非共价相互作用与锚链直接可释放地附接。
在其他的实施方案中,检测试剂通过钩链与锚链间接附接,检测试剂与钩链连接以及钩链与锚链可释放地附接,其中在不存在分析物的情况下,从锚链释放钩链可使检测试剂从载体上释放,并且当钩链从锚链释放时第一标签可被激活或检测。在一些此类实施方案中,当钩链从锚链释放时在载体上的第一标签的量与样本中分析物的数量和/或浓度成比例。
在一些实施方案中,检测试剂和钩链中的至少一者与第一标签任选地附接。例如,第一标签可与钩链附接;第一标签可与检测试剂附接;或者第一标签可与钩链和检测试剂二者附接。在一些实施方案中,第一标签不存在,即不与第一链或检测试剂附接,例如,如果第二标签与生物分子复合物中的不同组分附接。
在一些实施方案中,捕获试剂例如通过共价键、生物素-链霉亲和素键、寡核苷酸接头(如dna寡核苷酸接头)或聚合物接头(如聚乙二醇(peg)接头)与载体直接附接。在其他的实施方案中,捕获试剂例如通过与例如经寡核苷酸接头、聚合物接头或共价键与载体附接的锚链连接而与载体间接附接。应理解,捕获试剂可采用任意合适的手段包括化学相互作用、亲和力结合等与载体附接。
在一些实施方案中,锚链是聚合物如聚乙二醇(peg),或者寡核苷酸如单链dna寡核苷酸、单链rna寡核苷酸或者双链dna或rna寡核苷酸。应理解,锚链可采用任意合适的手段诸如共价键、化学相互作用、亲和力结合、共价键、生物素-链霉亲和素键、dna寡核苷酸接头、聚合物接头等与载体附接。
所述载体不受特别限制,可以使用任意合适的载体。载体的非限制性示例包括微粒(如微珠)、多孔板表面、载玻片表面或水凝胶基质。在一些实施方案中,载体是微珠或微粒,通常是微米级的,如不限于聚苯乙烯微珠,磁微珠、顺磁微珠、塑料微珠。在另一实施方案中,载体是平面微阵列。在一些实施方案中,载体是条形码化微珠,例如,与荧光或发光染料或其混合物附接的微珠,或者光谱、图形或化学编码的微珠。
一般地,与检测试剂附接的钩链是具有足够长度和挠性的允许检测试剂与捕获试剂同时与分析物结合以形成三重复合物的接头。钩链的非限制性示例包括聚合物如peg和寡核苷酸如单链dna寡核苷酸、单链rna寡核苷酸或者双链dna或rna寡核苷酸。
在本文提供的生物分子复合物的某些实施方案中,钩链不存在,并且检测试剂例如通过共价键、生物素-链霉亲和素键、亲和力键合等与锚链直接可释放地附接。
捕获试剂可以是能够特异性识别靶分析物并与靶分析物结合的任意分子。捕获试剂的非限制性示例包括抗体、抗原、蛋白质、多肽、多蛋白质复合物、外泌体、寡核苷酸、适配体、经修饰的适配体(如低解离速率经修饰的适配体或适体)和低分子量化合物。在某些实施方案中,捕获试剂是抗体,分析物是抗原、蛋白质、多肽、多蛋白质复合物、激素或外泌体。在其他实施方案中,捕获试剂是抗原、蛋白质、多肽、多蛋白质复合物或外泌体,分析物是抗体。
类似地,检测试剂可以是能够特异性识别靶分析物并与靶分析物结合的任意分子。检测试剂的非限制性示例包括抗体、抗原、蛋白质、多肽、多蛋白质复合物、外泌体、寡核苷酸和低分子量化合物。在某些实施方案中,检测试剂是抗体,分析物是抗原、蛋白质、多肽、多蛋白质复合物或外泌体。在其他实施方案中,检测试剂是抗原、蛋白质、多肽、多蛋白质复合物或外泌体,分析物是抗体。
应理解,如果捕获试剂是抗体,分析物是抗原、蛋白质、多肽、多蛋白质复合物或外泌体,那么检测试剂也是能够与捕获试剂同时结合分析物的抗体。类似地,如果捕获试剂是抗原、蛋白质、多肽、多蛋白质复合物或外泌体,分析物是抗体,那么检测试剂也将是能够与捕获试剂同时结合分析物的抗原、蛋白质、多肽、多蛋白质复合物或外泌体。
捕获试剂和检测试剂可以是相同的或者是不同的,只要它们同时都结合靶分析物,形成三重复合物。在一些实施方案中,捕获试剂和检测试剂都是抗体。它们可以是同一抗体或不同的抗体。它们可以是与分析物上的同一表位结合的不同抗体,或者它们可以是与分析物上的不同表位结合的不同抗体。在捕获试剂和检测试剂结合同一表位的情况下,它们一般与分析物上的表位的不同重复结合,分析物具有该表位的两个或更多个重复。
分析物并不意图受到特别地限制,可以是任何需要在样本中进行检测和/或量化的生物分子或生物细胞。分析物的非限制性示例包括抗原、抗体、蛋白质、多肽、多蛋白复合物、激素、外泌体、寡核苷酸或低分子量化合物。可以在任何感兴趣的样本中检测分析物,并不特别地限制于生物样本,如不限于体液(例如,尿液、唾液、血液、血清、血浆、汗液)、提取物(例如,细胞提取物)和含有蛋白质和/或dna的溶液(例如,反应混合物)。
在一些实施方案中,检测试剂与第一标签附接。在一些实施方案中,钩链与第一标签附接。在一些实施方案中,检测试剂和钩链都与第一标签附接。在一些不存在第一标签的实施方案中,检测试剂和钩链都不与第一标签附接。
在一些实施方案中,钩链与锚链之间的可释放接头包含双链dna杂交体,钩链与锚链包含互补的单链dna寡核苷酸,所述互补的单链dna寡核苷酸杂交在一起形成双链dna杂交体。在一些这种实施方案中,可通过升高温度锚链钩链使得dna杂交体“熔融”或者未结合而从锚链上释放钩链。例如,在双链dna杂交体的熔融温度为大约50至大约80摄氏度的实施方案中,温度可以升高至tm以上,使得双链dna杂交体解离,从而从锚链上释放钩链。
在一些实施方案中,本文提供的生物分子复合物进一步包含置换剂,所述置换剂能够使钩链从锚链释放,从而在不存在分析物的情况下使检测试剂从载体上释放。置换剂可以是能使钩链与锚链之间的连接物特异性断裂或释放的任意试剂。例如,置换剂可以是酶或其他可切割(或者断裂)钩链与锚链之间的可释放的连接物的试剂。置换剂的非限制性示例包括酶、光和还原剂如dtt。置换剂可以能够例如通过酶促反应或通过光致断裂使钩链与锚链之间的连接物断裂。
在一些实施方案中,置换剂是寡核苷酸。例如,当钩链与锚链之间的可释放连接物包含双链dna杂交体时,置换剂可以是单链dna或rna寡核苷酸,所述单链dna或rna寡核苷酸与钩链或锚链杂交,从而通过寡核苷酸或dna置换反应从锚链释放钩链。在置换剂与钩链钩链杂交的实施方案中,置换剂与钩链形成双链dna或rna杂交体。在一些此类实施方案中,置换剂可以被可检测地标记,以使得只有当钩链附接的检测试剂与分析物结合时,置换剂在清洗后仍将保留在载体上,检测置换剂上的标签从而指示在样本中存在分析物。在一些此类实施方案中,第一标签不存在,检测置换剂上的标签用于检测和/或量化分析物。在一些此类实施方案中,在载体上检测到的置换剂上的标签的量与样本中分析物的数量和/或浓度成比例。在置换剂与锚链杂交的实施方案中,置换剂与锚链形成双链dna或rna杂交体。将理解的是,在此类实施方案中,置换剂未被标记,而标签与检测试剂和/或钩链附接,以使得仅在存在分析物的情况下在载体上检测得到标签。
在一些实施方案中,如果第一标签不存在,并且检测置换剂上的标签用于检测和/或量化分析物,并且置换剂通过dna置换反应发挥作用,置换剂与钩链结合(例如,杂交)。在其他实施方案中,如果在检测试剂或钩链上存在第一标签并且置换剂未被标记,并且置换剂通过dna置换反应发挥作用,置换剂可与钩链或锚链结合。
在一些实施方案中,生物分子复合物进一步包含与锚链的近表面序列互补的茎链,茎链和锚链都是单链寡核苷酸,并且茎链能够与锚链结合,形成双链寡核苷酸。在一些实施方案中,通过与锚链形成双链寡核苷酸,茎链可为锚链提供结构载体,例如,以防止复合物塌陷到载体表面,以提供刚性,以在载体表面与复合物之间产生间隔物或者以提供结构稳定性。在一些实施方案中,茎链可以与条形码例如荧光或发光染料附接,并用于将条形码标签与载体附接。一般地,茎链例如通过杂交与锚链附接,并且非共价键地与载体直接结合。
在一些生物分子复合物包含与锚链结合以在邻近载体表面处形成dna杂交体的茎链的实施方案中,锚链与标签钩链附接(而不是检测试剂、钩链或置换剂,所有这些都未被标记)。在这些实施方案中,锚链茎链锚链与当锚链与茎链杂交时无活性或不可检测的标签附接;锚链也与检测试剂直接连接。在标签与载体之间的位点处切割dna杂交体后,标签被激活或者变得可检测。检测试剂在不存在分析物的情况下将从载体上释放,以使得仅在存在分析物的情况下并在切割后(例如,释放检测试剂后)检测到信号。
在一些实施方案中,可调节所述载体上的锚链和捕获试剂的相对密度以控制测定的有效亲和性。在一些实施方案中,可调节钩链的长度以控制测定的有效亲和性。
在一些实施方案中,选择检测试剂与钩链之间的缀合的配价以最小化交叉反应,优化多重测定法的性能。在一个实施方案中,检测试剂与钩链之间的缀合是一价的。在其他实施方案中,检测试剂与钩链之间的缀合为1:2、1:3、1:4、1:5、1:6、1:7或1:8,或者小于1:6、小于1:8或小于1:10。在其他实施方案中,至少90%的检测试剂仅通过一个钩链与载体连接。
在一些捕获试剂与锚链连接的实施方案中,捕获试剂和锚链的接头之间的缀合是一价的。在一些捕获试剂与锚链连接的实施方案中,捕获试剂和锚链的接头之间的缀合为1:2、1:3、1:4、1:5、1:6、1:7或1:8,或者小于1:6、小于1:8或者小于1:10。在一些实施方案中,至少90%的检测试剂仅通过一种捕获链与锚链连接。
在一些实施方案中,锚链和/或捕获试剂随机地分布在载体上。
在一些实施方案中,可选择钩链的长度和/或挠性以在存在捕获试剂的情况下允许或优化检测试剂与分析物的结合。
在一些钩链与锚链之间的连接物是双链dna杂交体的实施方案中,双链dna杂交体的熔融温度(tm)为大约50至大约80摄氏度。
在一些实施方案中,置换后检测试剂的浓度为低于大约10皮摩尔,以避免在已发生置换或释放后检测试剂与脱靶试剂或分析物的再结合。
在进一步的实施方案中,生物分子复合物包含两种检测试剂,从而在分析物被结合时由于存在标签的两种拷贝而生成更强的信号。在这些实施方案中,生物分子复合物进一步包含第二锚链,所述第二锚链与载体连接;第二检测试剂,所述第二检测试剂与第二锚链连接,其中第二钩链与第二锚链连接,并且其中第二检测试剂和第二钩链中的至少一者与第三标签任选地附接;其中捕获试剂、检测试剂和第二检测试剂可同时与分析物(如存在于样本中)结合,形成三重复合物。从第二锚链释放第二钩链可在不存在所述分析物的情况下使第二检测试剂从载体上释放并可激活第三标签。
在一些实施方案中,第二检测试剂与第三标签附接。在一些实施方案中,第二钩链与第三标签附接。第三标签可以是任意合适的标签,如不限于荧光团、特异性特异性dna序列或生物素部分。
在一些第三标签与第二检测试剂和/或第二钩链附接并且无活性或不可检测的实施方案中,第三标签仅在第二钩链从第二锚链释放并且存在分析物时被激活或检测。
在一些实施方案中,生物分子复合物进一步包含第二置换剂,所述第二置换剂能够从第二锚链释放第二钩链,从而使得在不存在分析物时从载体上释放第二检测试剂。第二置换剂与置换剂一样,可通过酶促反应、通过剪切或通过寡核苷酸置换反应从第二锚链释放第二钩链。第二置换剂还可与置换剂一样被可检测地标记,在这种情况下,第二检测试剂和第二钩链一般不被标记(即,第三标签不存在)。第二置换剂可以与置换剂相同或不同。在一些实施方案中,第二置换剂和置换剂是相同的,以使得一种试剂可锚链将第二钩链和钩链从它们对应的锚链释放。
在一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,其中捕获试剂与载体连接;和检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接并且其中检测试剂也被标记;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物,钩链和锚链之间的连接物可断裂,从而在不存在分析物的情况下从载体上释放检测试剂。
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,其中捕获试剂与捕获链连接,其中捕获链与锚链连接;和检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接并且其中检测试剂也被标记;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物;钩链与锚链之间的连接物可断裂,从而在不存在分析物的情况下从载体上释放检测试剂。
在另一实施方案中,提供了一种用于检测样本中分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,所述捕获试剂与载体连接;检测试剂,其中检测试剂与钩链连接,其中钩链与锚链连接;和置换剂,所述置换剂能够通过与钩链结合而使锚链与钩链之间的连接物断裂,导致在不存在分析物的情况下从载体上释放检测试剂和钩链,置换剂被标记;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物。
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包括锚链,所述锚链与载体连接;捕获试剂,所述捕获试剂与捕获链连接,其中捕获链与锚链连接;检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接;和置换剂,所述置换剂能够通过与钩链结合而使锚链与钩链之间的连接物断裂,导致在不存在分析物的情况下从载体上释放出检测试剂和钩链,置换剂被标记;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物。
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,所述捕获试剂与载体连接锚链;检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接,并包含失活的标签;和置换剂,所述置换剂能够钩链使锚链与钩链之间的连接物断裂,导致在不存在分析物的情况下从载体上释放检测试剂和钩链;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物,并且其中使锚链和钩链之间的连接物断裂激活钩链上的标签。
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,所述捕获试剂与捕获链连接,其中捕获链与锚链连接;检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接,该钩链包含失活的标签;和置换剂,所述置换剂能够通过与钩链结合而使锚链与钩链之间的连接物断裂,导致在不存在分析物的情况下从载体上释放检测试剂和钩链;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物,并且其中使锚链与钩链之间的连接物断裂激活钩链上的标签。
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,所述捕获试剂与捕获链连接,其中捕获链与锚链连接;检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接,钩链包含失活的标签;和置换剂,所述置换剂能够钩链使锚链与钩链之间的连接物断裂,导致仅在不存在分析物的情况下从载体上释放检测试剂和钩链;其中捕获试剂和检测试剂是相同的,并且其中分析物具有重复的表位,并且捕获试剂和检测试剂可以同时与分析物(如果存在于样品中)结合,形成三重复合物,其中使锚链和钩链之间的连接物断裂激活钩链上的标签。锚链钩链钩链
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含锚链,所述锚链与载体连接;捕获试剂,所述捕获试剂与捕获链连接,其中捕获链与锚链连接;检测试剂,所述检测试剂与钩链连接,其中钩链与锚链连接,钩链包含失活的标签;和置换剂,所述置换剂能够通过与钩链结合而使锚链与钩链之间的连接物断裂,导致仅在不存在分析物的情况下从载体上释放检测试剂和钩链,其中置换剂被标记;其中捕获试剂和检测试剂是相同的,并且其中分析物具有重复的表位,并且捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物锚链钩链钩链。
在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含第一锚链,所述第一锚链与载体连接;第二锚链,所述第二锚链与载体附接;和捕获试剂,所述捕获试剂与载体连接锚链;第一检测试剂,所述第一检测试剂与第一钩链连接,其中第一钩链与第一锚链连接,第一钩链包含失活的第一标签;第二检测试剂,所述第二检测试剂与第二钩链连接,其中第二钩链与第二锚链连接,第二钩链包含失活的第二标签;第一置换剂,所述第一置换剂能够钩链使第一锚链与第一钩链之间的连接物断裂,导致在不存在分析物的情况下从载体上释放第一检测试剂和第一钩链;和第二置换剂,所述第二置换剂能够使第二锚链与第二钩链之间的连接物断裂,导致仅在不存在分析物的情况下从载体上释放第二检测试剂和第二钩链;其中捕获试剂、第一检测试剂和第二检测试剂可以同时与分析物(如果存在于所述样品中)结合,形成四重复合物,其中使锚链和第一钩链之间的连接物断裂激活在第一钩链上的第一标签,其中使锚链和第二钩链之间的连接物断裂激活在第二钩链上的第二标签。
锚链锚链钩链钩链锚链钩链钩链钩链锚链钩链锚链钩链钩链锚链钩链钩链锚链钩链钩链锚链钩链钩链在另一实施方案中,提供了一种用于检测样本中的分析物的生物分子复合物,该生物分子复合物包含第一锚链,所述第一锚链与载体连接;第二锚链,所述第二锚链与载体连接,以及捕获试剂,所述捕获试剂与载体连接;第一检测试剂,所述第一检测试剂与第一钩链连接,其中第一钩链与第一锚链连接;第二检测试剂,所述第二检测试剂与第二钩链连接,其中第二钩链与第二锚链连接;第一置换剂,所述第一置换剂能够通过与第一钩链结合使第一锚链与第一钩链之间的连接物断裂,导致在不存在分析物的情况下从载体上释放第一检测试剂和第一钩链,其中第一置换剂被标记;和第二置换剂,所述第二置换剂能够通过与第二钩链结合使第二锚链与第二钩链之间的连接物断裂,导致仅在不存在分析物的情况下从载体上释放第二检测试剂和第二钩链,其中第一置换剂被标记;其中捕获试剂、第一检测试剂和第二检测试剂可同时与分析物(如果存在于样本中)结合,形成四重复合物。
在一些实施方案中,载体是微粒、孔板表面、载玻片表面或水凝胶基质。
在一些实施方案中,捕获试剂和检测试剂是抗体。在一些实施方案中,分析物是抗原。在一些实施方案中,分析物是多蛋白复合物。在一些实施方案中,分析物是外泌体。
在其他实施方案中,捕获试剂和检测试剂是抗原,分析物是抗体。
在一些实施方案中,捕获试剂通过共价键或者通过生物素-链霉亲和素键与载体连接。在一些实施方案中,捕获试剂通过dna寡核苷酸接头或者通过聚合物接头如peg接头与载体连接。在一些实施方案中,检测试剂通过聚合物接头如peg接头或者通过dna寡核苷酸接头与载体连接。
在一实施方案中,钩链、锚链和置换剂是dna寡核苷酸。
在进一步的实施方案中,钩链与锚链之间的连接物是双链dna杂交体。
在一实施方案中,锚链与载体之间的连接物是共价键或生物素-链霉亲和素键。在另一实施方案中,锚链通过化学相互作用与载体附接。应理解,锚链可采用任意合适的手段与载体附接,诸如但不限于共价键、生物素-链霉亲和素键、dna寡核苷酸接头、聚合物接头或者诸如氢键合、疏水性相互作用、亲和力结合或非共价相互作用等另外的化学相互作用。
在进一步的实施方案中,置换剂通过dna链置换反应使钩链与锚链之间的连接物断裂。
在另一实施方案中,置换剂通过酶促反应使钩链与锚链之间的连接物断裂。
在一实施方案中,标签是荧光团。在一实施方案中,标签是特异性特异性dna序列。在一实施方案中,标签是生物素部分。
在另一实施方案中,检测试剂识别与捕获试剂相同的抗原但不相同的表位。
在另一实施方案中,检测试剂识别在与捕获试剂结合的相同抗原上结合的不同表位。
在另一实施方案中,检测试剂识别在与捕获试剂结合的同一抗原上结合的同一表位。
在另一实施方案中,本文所述的生物分子复合物进一步包含与锚链的近表面序列互补的茎链,所述茎链使锚寡核苷酸成为双链。
在一实施方案中,调节锚链与捕获试剂的相对密度以控制测定的有效亲和性。
在另一实施方案中,调节分析物的检测长度(例如,钩链的长度)以控制检测的有效亲和性。
在另一实施方案中,检测试剂与钩链之间的缀合是一价的。
在一实施方案中,锚链是随机分布的。在另一实施方案中,捕获试剂是随机分布的。
同样提供了一种用于检测样本中的分析物的方法,该方法包括:提供载体、捕获试剂、锚链、钩链和检测试剂,其中捕获试剂与载体连接,锚链与载体连接并与钩链连接,其中钩链与检测试剂连接,其中检测试剂被标记;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本;将钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离;以及通过分析留在载体上的检测试剂标签来量化结合的分析物的量,其中留在载体上的检测试剂标签的浓度与结合的分析物的浓度成比例。
还提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、锚链、捕获链、捕获试剂、钩链和检测试剂,其中锚链与载体、与捕获链和钩链连接,捕获链与捕获试剂连接钩链,并且其中钩链与检测试剂连接;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本;通过在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离而使钩链与锚链之间的键断裂;以及通过分析留在载体上的检测试剂标签来量化结合的分析物的量,其中留在载体上的检测试剂标签的浓度与结合的分析物的浓度成比例。
还提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、捕获试剂、锚链、钩链和检测试剂,其中捕获试剂与载体连接,其中锚链与载体连接并与钩链连接,其中钩链与检测试剂连接;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本;用置换剂温育以通过与钩链结合而使钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中置换剂被标记;通过分析留在载体上的置换剂标签来量化结合的分析物的量,其中留在载体上的置换剂标签的浓度与结合的分析物的浓度成比例。
在另一实施方案中,提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、锚链、捕获链、捕获试剂、钩链和检测试剂,其中锚链与载体连接并与捕获链连接,其中捕获链与捕获试剂连接,锚链与钩链连接,并且其中钩链与检测试剂连接;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本;用置换剂温育以通过与钩链结合而使钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中置换剂被标记;以及通过通过分析留在载体上的置换剂标签来量化结合的分析物的量,其中留在载体上的置换剂标签的浓度与结合的分析物的浓度成比例。
还提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、捕获试剂、锚链钩链、钩链和检测试剂,其中捕获试剂与载体连接,其中锚链与载体连接并与钩链连接,其中钩链与检测试剂连接,其中钩链包含失活的标签;用允许捕获试剂和检测试剂与同一分析物上的不同表位结合的载体温育样本;用置换剂温育以钩链使钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中将钩链与锚链钩链分离激活钩链上的标签;以及通过分析留在载体上的钩链标签来量化结合的分析物的量,其中留在载体上的钩链标签的浓度与结合的分析物的浓度成比例。
还提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、锚链、捕获链、捕获试剂、钩链和检测试剂,其中锚链与载体、捕获链和钩链连接,其中捕获链与捕获试剂连接,其中钩链与检测试剂连接并包含失活的标签;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本;用置换剂温育以通过与钩链结合而使钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中将钩链与锚链分离激活钩链上的标签;以及通过分析留在载体上的钩链标签来量化结合的分析物的量,其中残留在载体上的钩链标签的浓度与结合的分析物的浓度成比例。
还提供了一种用于检测样本中的分析物的方法,包括提供载体、锚链、捕获链、钩链、捕获试剂和检测试剂,其中锚链与载体连接、与捕获链连接和钩链连接,其中捕获链与捕获试剂连接,其中钩链与检测试剂连接,其中钩链包含失活的标签并且其中捕获试剂和检测试剂在结构上相似;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本,其中所述表位在结构上相似;用置换剂温育以钩链使钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中将钩链与锚链分离激活钩链上的标签;以及通过分析留在载体上的钩链标签来量化结合的分析物的量,其中留在载体上的钩链标签的浓度与结合的分析物的浓度成比例。
还提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、锚链、捕获链、钩链、捕获试剂和检测试剂,其中锚链与载体连接、与捕获链和钩链连接,其中捕获链与捕获试剂连接,其中钩链与检测试剂连接,并且其中捕获试剂和检测试剂在结构上相似;用允许捕获试剂和检测试剂与分析物上的不同表位结合的载体温育样本,其中所述表位在结构上相似;用置换剂温育以通过与钩链结合而使钩链与锚链之间的键断裂,在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中置换剂被标记;以及通过分析留在载体上的置换剂链标签来量化结合的分析物的量,其中留在载体上的置换剂链标签的浓度与结合的分析物的浓度成比例。
在一实施方案中,捕获试剂和检测试剂是肽。在一实施方案中,捕获试剂通过dna寡核苷酸接头与载体连接。在另一实施方案中,检测试剂通过peg接头与载体连接。
在又一实施方案中,钩链、锚链和置换剂是dna寡核苷酸。在一实施方案中,钩链与锚链之间的连接物是双链dna杂交体。在又一实施方案中,锚链与载体之间的连接物是生物素-链霉亲和素键。
在一实施方案中,置换剂通过dna链置换反应使钩链与锚链之前的连接物断裂。在一实施方案中,置换剂通过酶促反应使钩链与锚链之前的连接物断裂。
在另一实施方案中,标签是生物素部分。
在又一实施方案中,锚链通过化学相互作用与微粒连接。
在另一实施方案中,检测试剂识别与捕获试剂相同的抗原但非相同的表位。在又一实施方案中,检测试剂识别与捕获试剂结合的同一抗原结合的不同表位。在一实施方案中,检测试剂识别捕获试剂结合的同一抗原的不同位置上的同一表位。
在一实施方案中,本文所述的生物分子复合物还包含与锚链的近表面序列互补的茎链,从而使锚寡核苷酸成为双链。
在一实施方案中,调节锚链和捕获试剂的相对密度以控制测定的有效亲和力。
在一实施方案中,调节分析物钩链的检测长度(例如,钩链)以控制检测的有效亲和力。
在一实施方案中,检测试剂与钩链之间的缀合是一价的。
在另一实施方案中,锚链是随机分布的。
在又一实施方案中,捕获试剂是随机分布的。
还提供了检测样本中的多种分析物的多种复合物检测系统,该系统包含多种载体;多种捕获试剂,其中每种捕获试剂与其对应的载体结合;多种检测试剂,其中每种检测试剂通过接头与其对应的载体结合,其中检测试剂被标记;其中在每种载体上,捕获试剂和检测试剂可同时与载体特异性分析物(如果存在于样本中)结合,形成三重复合物;检测试剂与其对应的载体之间的接头可断裂,从而在不存在分析物的情况下从载体上释放检测试剂。
还提供了一种用于检测样本中的多种分析物的多种复合物检测系统,该系统包含多种载体;多种捕获试剂,其中每种捕获试剂与其对应的载体结合;多种检测试剂,其中每种检测试剂通过载体特异性钩链与其对应的载体结合,其中每种钩链包含载体特异性的失活的标签;置换剂,其中置换剂能够使多种钩链与多种载体之间的键断裂,将检测试剂与其对应的载体分离,其中在每种载体上,捕获试剂和检测试剂可同时与载体特异性分析物(如果存在于样本中)结合,形成三重复合物;其中使钩链载体与钩链之间的键断裂激活钩链上的载体特异性标签。
还提供了一种用于检测样本中的多种分析物的多种复合物检测系统,该系统包含多种载体;多种捕获试剂,其中每种捕获试剂与其对应的载体结合;多种检测试剂,其中每种检测试剂通过载体特异性钩链与其对应的载体结合;置换剂,其中置换剂能够使多种钩链与多种载体之间的键断裂,其中当使钩链与载体之间的键断裂时,置换剂与钩链结合,其中置换剂被标记;其中在每种载体上,捕获试剂和检测试剂可同时与载体特异性分析物(如果存在于样本中)结合,形成三重复合物。
在一实施方案中,还提供了一种用于检测样本中的多种分析物的多种复合物检测系统,该系统包含多种载体;多种捕获试剂,其中每种捕获试剂与其对应的载体连接,多种检测试剂,其中每种检测试剂包含失活的标签,其中检测试剂与其对应的载体之间的连接物可断裂;其中在每种载体上,捕获试剂和检测试剂可同时与载体特异性分析物(如果存在于样本中)结合,形成三重复合物,其中检测试剂与其对应的载体之间的连接物断裂时,检测试剂标签被激活。
又提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、锚链、捕获链、钩链、捕获试剂和检测试剂,其中锚链与载体连接,其中锚链还与捕获链连接,其中捕获链与捕获试剂连接,其中锚链还与钩链连接,其中钩链与检测试剂连接;在允许捕获试剂和检测试剂与同一分析物上的不同表位结合的情况下用载体温育样本;用置换剂温育以通过与钩链结合使钩链与锚链之间的键断裂,仅在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离,其中置换剂被标记;通过分析留在载体上的置换剂链标签来量化结合的分析物的量,其中留在载体上的置换剂链标签的量与结合的分析物的浓度变化成比例。
还提供了一种用于检测样本中的分析物的方法,该方法包括提供载体、锚链、捕获链、、捕获试剂、钩链和检测试剂,其中锚链与载体连接,其中捕获试剂与载体连接,其中锚链,其中钩链与载体连接,其中钩链与检测试剂连接;在允许捕获试剂和检测试剂与同一分析物上的不同表位结合的条件下用载体温育样本;使钩链与载体之间的键断裂,仅在不存在与捕获试剂和检测试剂结合的分析物的情况下将检测试剂和钩链与载体分离;用桥形链温育,其中桥形链将锚链与钩链连接,其中桥形链被标记;通过分析留在载体上的桥形链标签来量化结合的分析物的量,其中留在载体上的桥形链标签的量与结合的分析物的浓度变化成比例。
在一些实施方案中,通过包含标签序列(即可被检测的独特的dna序列)来标记钩链。在一些此类实施方案中,钩链还包含重结合序列;在用与锚链结合的置换剂寡核苷酸从锚链释放钩链后,添加桥形链,其中桥形链可与钩链锚链上的重结合序列和锚链结合,从而将钩链与锚链间接地重连接。在此类实施方案中,在通过从锚链中释放而使得与钩链附接的标签被激活或锚链变得可检测后,将具有有活性的的/可检测标签的钩链与载体重新附接。
在一个实施方案中,提供了一种用于检测和/或量化样本中的分析物的生物分子复合物,该生物分子复合物包含:a)锚链,所述锚链与载体附接;b)捕获试剂,所述捕获试剂与载体附接;c)检测试剂,所述检测试剂与钩链连接,钩链与锚链可释放地附接,钩链和锚链通过双链dna杂交体连接在一起,和d)置换剂,所述置换剂包含与钩链的至少一部分互补并且能够与钩链杂交的dna寡核苷酸,从而通dna置换反应将钩链从锚链释放,置换剂可检测地被标记;其中捕获试剂和检测试剂可同时与分析物(如果存在于样本中)结合,形成三重复合物;和通过置换剂将钩链从锚链释放可在不存在分析物的情况下将检测试剂从载体上释放。在一实施方案中,捕获试剂和检测试剂是抗体,分析物是抗原或蛋白质,载体是条形码化的微粒。
在第二方面,提供了一种同时检测和/或量化样本中的两种或更多种分析物的多重夹心测定系统,所述系统包含本文所述的两种或更多种生物分子复合物,其中每种生物分子复合物用于检测和/或量化样本中的不同分析物。
在一些实施方案中,两种或更多种生物分子复合物与相同的载体附接。例如,载体可以是平面、多孔板表面、载玻片表面、水凝胶基质、微粒等。在此类实施方案中,每种生物分子复合物定位在载体上的不同位置处,从而允许每种标记的复合物(和每种分析物)通过其位置被识别。
在一些实施方案中,两种或更多种生物分子复合物与例如不同的条形码化的微粒等不同的载体附接。例如,第一生物分子复合物可与条形码化的第一微珠附接,例如以光谱地、图形化地或化学地方式,例如与第一荧光或发光染料或染料混合物附接,第二生物分子复合物可与也条形码化的第二微珠附接,例如以光谱地、图形化地或化学地方式,例如与第二荧光或发光染料或染料混合物附接。在已将第一和第二复合物组装在其对应的微珠上后,它们可与样本混合和接触在一起,允许同时检测样本中的两种不同分析物。在微珠上的条形码化允许每种标记的复合物(因此每种分析物)被识别。
在一些实施方案中,两种或更多种生物分子复合物中的一种或多种包含第二锚链、与第二钩链连接的第二检测试剂等,以使得在捕获试剂、两种检测试剂和分析物之间形成四重复合物。
在一些实施方案中,两种或更多种生物分子复合物在检测试剂或钩链上都缺少任选的第一标签,该标签仅设置在置换剂上。在一些实施方案中,对于每种生物分子复合物,使用相同的标记的置换剂从对应的锚链释放对应的钩链,每种生物分子复合物(及其对应的分析物)通过其在表面上的位置或者通过表面的条形化来识别,特别地,其中表面是微粒。在其他实施方案中,带有不同标签的不同置换剂可用于每种生物分子复合物。
在一些实施方案中,两种或更多种生物分子复合物可各自检测和/或量化相同的分析物,其中每种生物分子复合物对分析物具有不同的有效亲和力。例如,可通过调节钩链和/或锚链的长度和/或调接捕获试剂和/或检测试剂的表面密度来选择生物分子复合物对分析物的有效亲和力。以这种方式,可以在较大的浓度范围内测定分析物。
其中,可以调节钩链和/或锚链的长度以控制测定的有效亲和力;和/或其中可以调节捕获试剂和/或检测试剂的表面密度以控制测定的有效亲和力。
应理解,可在多重夹心测定系统中同时检测和/或量化的分析物的数目并没有特别限制。在一些实施方案中,多重夹心测定系统可用于同时检测和/或量化样本中的五种或更多种分析物、十种或更多种分析物、15种或更多种分析物、20种或更多种分析物、30种或更多种分析物、40种或更多种分析物、50种或更多种分析物、75种或更多种分析物或者100种或更多种分析物,该系统包含对每种对应的分析物有特异性的对应的生物分子复合物。因此,该多重夹心测定系统易于扩展以用于大规模多重化。
在第三方面,提供了一种采用本文所述的生物分子复合物检测和/或量化样本中的分析物的方法。
在一些实施方案中,提供了采用本文所述的两种或更多种分子复合物同时检测和/或量化样本中的两种或更多种分析物的方法,其中每种生物分子复合物用于检测和/或量化样本中的不同分析物。在一些实施方案中,提供了采用本文所述的多重夹心测定系统同时检测和/或量化样本中的两种或更多种分析物的方法,所述系统包含本文所述的两种或更多种生物分子复合物,其中每种生物分子复合物用于检测和/或量化样本中的不同分析物。应理解,本文提供的方法可用于同时检测和/或量化样本中的大量分析物,该方法扩展以允许大规模多重化。
在以事实方案中,提供了一种用于检测和/或量化样本中的分析物的方法,该方法包括:a)提供载体、与载体附接的捕获试剂、与载体附接的锚链和与钩链锚链任选地连接的检测试剂,其中检测试剂或钩链与锚链可释放地连接,并且其中检测试剂和钩链中的至少一者与第一标签任选地附接,第一标签无活性或不可检测;b)在允许捕获试剂和检测试剂与分析物同时结合的条件下使载体与样本接触,形成三重复合物;和c)添加与第二标签任选地附接的置换剂,其中置换剂使检测试剂或钩链从锚链释放,以使得在不存在分析物的情况下使与钩链任选地连接的检测试剂从载体上释放,并且其中使检测试剂或钩链从锚链释放可激活第一标签或者使第一标签可检测。
在一些实施方案中,该方法进一步包括以下步骤:d)确定第一标签和/或第二标签在载体上的存在和/或量,其中在载体上存在第一标签和/或第二标签说明在样本中存在分析物,第一标签和/或第二标签的量与样本中的分析物数量和/或浓度成比例。
在一些实施方案中,该方法进一步包括在步骤c)后清洗载体以去除任意未结合的试剂或材料的步骤。
在一些实施方案中,该方法进一步包括在步骤c)后存储载体的步骤。
在一些本文提供的方法的实施方案中,载体进一步包含与载体附接的第二锚链、与载体附接的第二捕获试剂和与第二钩链任选地连接的第二检测试剂,其中第二检测试剂或第二钩链与第二锚链连接,并且其中第二检测试剂和第二钩链中的至少一者与第三标签任选地附接,第三标签无活性或不可检测,其中第二捕获试剂和第二检测试剂可与样本中的第二分析物同时结合,形成第二三重复合物,其中置换剂还可将第二检测试剂或第二钩链从第二锚链释放,以使得在不存在第二分析物的情况下使与第二钩链任选地连接的第二检测试剂从载体上释放出来,并且其中使第二检测试剂或第二钩链从第二锚链释放可激活第三标签或者使第三标签可检测;其中载体上第三标签的存在和/或量说明在样本中存在第二分析物,载体上第三标签的量与样本中的第二分析物的数量和/或浓度成比例;以使得在样本中可同时检测和/或量化第一分析物和第二分析物。
在一些实施方案中,第二锚链和第二捕获试剂分别定位在载体上的第一位置处和第二位置处。在其他实施方案中,第二锚链和第二捕获试剂与第二载体附接。载体和/或第二载体可以是例如微粒,如聚苯乙烯微珠。在一实施方案中,第二载体是第一条形码化微珠(即用第一条形码编码的第一微珠,如第一荧光或发光染料或第一染料混合物),第二载体是第二形码化微珠(即用第二条形码编码的第二微珠,如第二荧光或发光染料或第二染料混合物),从而允许在检测到对应的条形码时识别出对应的微珠。
在一些实施方案中,第一载体和第二载体在与样本接触之前先混合在一起。例如,第一载体和第二载体可以同时与样本接触。样本可以是生物样本,如不限于体液、提取物、含有蛋白质和/或dna的溶液、细胞提取物、细胞裂解物或组织裂解物。体液的非限制性示例包括尿液、唾液、血液、血清、血浆、脑脊髓液、泪液、精液和汗液。
在一些实施方案中,该方法使用钩链,所述钩链通过包含标签序列(即可被检测的独特的dna序列)来标记。在一些此类实施方案中,钩链还包含重结合序列;在采用与锚链结合的置换剂寡核苷酸从锚链释放钩链并进行任选的清洗之后,添加桥形链,其中桥形链与钩链锚链上的重结合序列和锚链结合,从而将钩链与锚链间接地重连接。在此类实施方案中,在与钩链附接的标签通过从锚链释放而被激活或者变得可检测之后,具有有活性/可检测标签的钩链与载体重新附接。
在一个实施方案中,提供了一种用于检测和/或量化样本中分析物的方法,该方法包括:a)提供载体、与载体附接的捕获试剂、与载体附接的锚链和与钩链连接的检测试剂,其中钩链通过双链dna杂交体与锚链可释放地连接;b)在允许将捕获试剂和检测试剂同时与分析物结合的条件下将载体与样本接触,形成三重复合物;和c)添加与可检测标签附接的置换剂,其中置换剂是与钩链的至少一部分互补并且能够与钩链杂交的dna寡核苷酸,其中置换剂通过dna置换反应将钩链从锚链释放,以使得在不存在分析物的情况下将检测试剂从载体上释放;和d)任选地确定载体上可检测标签的存在和/或量,其中载体上存在标签说明样本中存在分析物,标签的量与样本中分析物的数量和/或浓度成比例。在一些实施方案中,捕获试剂和检测试剂是抗体,分析物是抗原或蛋白质,载体是条形码化的微粒。条形码化的微粒可以例如被光谱地、图形化地或化学地条形码化。
在第四方面,提供了一种制备多重夹心测定系统的方法,该方法包括:(a)提供包含第一微粒的第一容器,该第一微粒用第一条形码编码;(b)将第一微粒与第一捕获试剂和第一检测试剂附接;(c)任选地,存储第一微粒;(d)提供包含第二微粒的第二容器,该第二微粒用第二条形码编码;(e)将第二微粒与第二捕获试剂和第二检测试剂附接;(f)任选地,存储第二微粒;和(g)将第一微粒和第二微粒混合在一起以用于多重夹心测定系统;其中第一捕获试剂和第一检测试剂与第二捕获试剂和第二检测试剂在与其对应的微粒附接之前不混合。第一和第二条形码可以独立地为光谱、图形或化学条形码。
在一些实施方案中,对应的捕获试剂和对应的检测试剂同时与其对应的微粒附接。在其他实施方案中,对应的捕获试剂和对应的检测试剂在两步反应中与其对应的微粒附接,其中在进行随后的其他试剂的附接之前,捕获试剂或检测试剂先与微粒附接。
在一些实施方案中,该方法进一步包括在步骤(g)中将第一微粒和第二微粒混合在一起之前先对它们进行清洗以除去未附接的试剂。在一些实施方案中,该方法进一步包括一个或更多个额外的清洗步骤,在进行清洗步骤以从微粒中去除未附接的和/或非特异性附接的试剂之前进行每个附接捕获试剂和/或检测试剂的步骤。
在一些实施方案中,微粒是微珠,例如,聚苯乙烯微珠。在一些实施方案中,步骤(a)中的微粒未被条形码化,该方法进一步包括在进行步骤(g)即将第一微粒和第二微粒混合在一起之前进行条形码化微粒的步骤(例如,将条形码如荧光或发光染料或其混合物与微粒附接)。
在一些实施方案中,第一捕获试剂、第一检测试剂、第二捕获试剂和第二检测试剂是抗体。
在一实施方案中,提供了一种制备本文所述的多重夹心测定系统的方法,该方法包括:(a)提供载体,该载体是平面、多孔板表面、载玻片表面或水凝胶;(b)在第一位置处将第一捕获试剂与载体附接;(c)清洗载体以去除未附接的第一捕获试剂;(d)在第二位置处将第二捕获试剂与载体附接;(e)清洗载体以去除未附接的第二捕获试剂;(f)在第一位置处通过与载体附接的第一锚链将第一检测试剂与载体附接;(g)清洗载体以去除未附接的第一检测试剂;(h)在第二位置处通过与载体附接的第二锚链将第二检测试剂与载体附接;和(i)清洗载体以去除未附接的第二检测试剂;以使得无论第一捕获试剂、第二捕获试剂、第一检测试剂和/或第二检测试剂何时混合在一起,一次不超过一种试剂不与载体附接。
在一些实施方案中,制备本文所述的多重夹心测定系统的方法有利于最小化交叉反应,因为不同的试剂在与载体附接和/或组装在生物分子复合物中之前没有在溶液中混合在一起。以这种方式,可避免或至少减少试剂彼此的非特异性结合,以最小化交叉反应。也可避免或至少减少不想要的背景信号或“噪音”。在一些实施方案中,方法还可以扩展,从而允许快速和/或经济地制备多重夹心测定系统。在一些实施方案中,与传统测定系统相比,所需的捕获和/或检测试剂要少得多,这可以为昂贵的抗体试剂等节省大量成本。在一些实施方案中,例如,制备生物分子复合物可需要不到一纳升的抗体试剂。
在结合附图对本发明的以下具体实施方案的描述进行审阅后,本发明的其它方面和特征对本领域的普通技术人员来说将变得显而易见。
附图说明
本专利或申请文件含有至少一张彩色的附图。本局将应要求并在必要费用得到支付后提供本专利或专利申请出版物的复件和彩色附图。
为了更好的理解本发明和更清晰地显示如何实施本发明,现在将通过示例引用附图,附图阐明了根据本发明实施方案的方面和特征,其中:
图1是一个示意图,该示意图说明(a)一种典型的elisa反应,其中仅使用一种抗体对(1-重复合物或单重复合物测定);以及(b)在多重测定中由靶生物分子和混合ab对(图中描述为抗体对)之间发生的非特异性结合事件产生的交叉反应。
图2是示出本技术某些实施方案的示意图。(a)示出了clamp系统,其中通过使用dna连接在单个微珠上共定位抗体对来阻止交叉反应。在(b)中,clamp板的每个成员都是通过一锅法制备带有捕获抗体(cab)和荧光条形码信号比率的微珠制成的。在(c)中,各自有一种cab和一种预杂交检测抗体(dab)的微珠集合混合形成一个clamp板。在(d)中,示出了样本添加和靶蛋白结合。在(e)中,洗涤去除非特异性结合的生物分子。在(f)中,通过dab的荧光dna链置换标记每个种微珠上的夹心复合物。
图3示出了根据本技术的一个实施方案的clamp测定,其中(a)示出了一种自动化的4色条形码化策略,该策略允许在任意多色细胞仪上实施>580个微珠条形码;(b)示出了低价抗体-寡核苷酸共轭物显著提高了链置换效率(>99%)并将最小化测定背景信号;(c)示出了一种upa的1-复合clamp,比传统的(顺序的)微珠免疫测定更敏感;(d)示出了低价共轭物进一步提高了clamp敏感性;(e)示出了5-复合clamp,与以传统夹心形式广泛地进行交叉反应的抗体对组装在一起,无交叉反应;和(f)示出了5-重clamp的单个标准曲线。
图4示出了一个示意图,该示意图说明了(a)仅使用一种抗体对的典型elisa反应(1-重复合物或单重复合物测定);以及(b)在多重分析中由靶生物分子和混合抗体对之间发生的非特异性结合事件产生的交叉反应性(在图中被描绘为抗体对)。(c)显示了一种cla系统,在该系统中,通过使用dna连接将抗体对在单个微珠上进行共定位来防止交叉反应。
图5示出了说明cla络合物在与生物样本接触和置换之前的示例性实施方案的示意图,其中所述标签不存在或无活性/不可检测。(a)使用锚链(即直接连接到锚链)将检测ab连接到载体上。(b)干寡聚体与锚链杂交,锚链被标记,并用来掩盖标记(例如,特异性特异性dna序列),使得在释放前无法检测到。(c)捕获抗体和检测抗体都灵活地与载体相连。(d)检测ab与钩链相连,钩链可释放地附在锚链上,任选地包括不可检测的标签(标签可附在钩链或锚链上)。(e)检测ab与钩链相连,钩链可释放地连接到锚链上,钩链与染料缀合,该染料通过同样结合到锚链的茎状寡聚物上的近端猝灭剂猝灭(释放前)。(f)捕获抗体和检测抗体都连接到锚链,捕获抗体直接连接到锚链,检测抗体通过任选地连接到不可检测标签的钩链寡聚物间接连接(即,当钩链附接到锚链时,标签不可检测,并且释放后可检测)。(g)捕获抗体和检测抗体通过各自的捕获链和钩链间接地连接到锚链上。
图6示出了在成功的置换反应后,在分析物存在下检测cla的示例性实施方案的示意图。(a)标记是一种特异性的dna序列,可以通过dna杂交的方法来检测。(b)置换剂用于将钩链寡核苷酸从锚链上释放,从而激活附接在钩链上的标签(在这种情况下,释放后染料不猝灭)。(c)染料标记的置换剂优先与钩链寡核苷酸结合,将其从锚链上释放,同时标记钩链和结合的三重复合物。(d)序列标记的置换剂优先与钩链寡核苷酸结合,将其从锚链上释放,同时标记钩链和结合的三重复合物。
图7示出了示出置换依赖性检测的实施方案的示意图。(a)示出了cla实施例,其中复合物上不存在标签,并且其中分析物存在并绑定到三重复合物中的捕获和检测ab。染料标记的置换剂(在本实施例中为寡核苷酸)优先与钩链寡核苷酸结合,同时标记钩状链并将其从锚链中置换。(b)置换依赖性检测的and(布尔)逻辑门表示,在复杂级别的检测需要二价捕获靶标和成功的钩锚置换。在考虑分析物存在和置换成功的不同潜在结果中,(a)中所示的情形是导致信号的唯一场景。
图8示出了置换相关检测的一个实施方案的示意图,其中标签是最初不可检测(即,无法结合)的唯一dna序列,因为它通过与锚序列杂交而被掩盖或隐藏。在该图所示的实施例中,未标记置换剂与锚的底部夹持(toe-hold)保持序列杂交以触发钩链寡核苷酸的置换,从而通过二次杂交或其他dna检测和/或扩增方法,如pcr。
图9示出了说明具有用于夹心抗体检测的置换依赖性检测的cla实施例的示意图。同一抗原(例如肽)用作捕获和检测ab,其中一种抗原连接到可释放地连接到锚链的钩链上。使用标记的置换剂(本实施例中的寡核苷酸)进行底部夹持介导的置换,执行置换和标记钩链的双重功能。只有在靶抗体存在的情况下,标记的和释放的钩链(如图所示)仍然附接在载体上。
图10示出了一个示意图,该示意图阐明用于检测多重的蛋白质相互作用的cla实施方案,其中阵列(平面或微珠)与不匹配的ab对组装,允许根据ab对检测蛋白质-蛋白质相互作用。
图11示出了用于检测多重的翻译后修饰(ptm)的cla实施方案的示意图,其中阵列(平面或微珠)与针对总蛋白和ptm特异蛋白的ab对组装。
图12所示为说明cla实施方案的示意图,其中捕获试剂是直接连接到载体上的抗体,并且有两条锚链。这两条锚链中的每一条都通过dna杂交连接到一条连接到检测试剂(也就是抗体)的钩链上。在分析物存在下,形成四重复合物。使用标记的置换剂寡核苷酸将钩链从各自的锚链中释放。这两种标签可能相同或不同。
图13示出了cla的一个实施方案的示意图,该cla用于在置换后和检测之前使用重结合机制稳定信号。在本实施方案中,钩链寡核苷酸包括一个标签序列和一个重结合序列;在使用与锚链结合的置换剂寡核苷酸进行置换和任选地清洗后,桥形链结合到重新绑定序列和锚链,从而将钩链间接地重新连接到锚链。通过这种方式,钩链与有活性的/可检测标签以及与之相连的检测ab一起重新连接到载体上。
图14示出了根据某些实施方案的单重和多重夹心测定法以及微粒上的cla系统(“clamp”)的示意图。(a)单重夹心免疫分析(也称为elisa)包括一对匹配的抗体。(b)混合抗体的msa暴露于大量不匹配抗体和蛋白质之间的相互作用,常常导致rcr和假阳性。(c)使用dna连接对抗体对进行预共定位的clamp允许夹心结合,,同时消除非同源抗体之间的相互作用。(d)dab与钩寡核苷酸(ho)结合,ho通过与捕获寡核苷酸(co)链的部分杂交系于表面。间隔物寡核苷酸(so)用于控制表面上co和dab-ho的密度(见图19)。(e)多重clamp测定通过以下方式进行:(i)将条形码化的clamp微粒与不同靶标混合,(ii)仅在靶分析物存在下,将生物样本与产生夹心结合的微粒一起温育,(iii)洗涤,以及(iv)使用荧光标记的置换剂寡核苷酸(do)通过底部夹持介导的置换(插图)置换和标记ho,导致(v)标记留在表面的夹心复合物。(f)一种通过标记的置换步骤进行检测的and(布尔)逻辑门表示,其中在单分子水平上的检测要求捕获靶标和成功释放ho。
图15示出了底部夹持介导的置换效率的优化。(a)置换反应的图示,其中cy5标记的ho使用未标记的do进行置换。(b)在不同的co起始量下,与增加nacl浓度(x轴)有关的释放效率(对于nco=10pmol,nco=100pmol,分别为蓝色和红色)。本实验中未使用so(即nso=0pmol)。释放效率计算为(i0–if)/(i0–ib),其中i0、if和ib分别是释放前、释放后和背景的荧光。随着离子强度的增加,释放效率显著提高。co浓度的增加导致释放效率的提高,这可能是由于非特异性结合寡核苷酸的比例减少所致。(c)高盐浓度(500mmnacl)下co浓度的释放效率
图16示出了通过调结缀合物价态和表面密度来优化clamp。(a)归一化直方图比较无ho的微粒(蓝色)和多价dab-ho缀合物(黄色)的clamp背景信号(即用cy5标记的do温育后的残余信号)(见图6)。(b)说明多价dab-ho缀合物如何通过标记未成功置换的dab-ho复合物来增加背景信号,尽管靶分析物没有夹心结合。(c)与价态升高的hos缀合的小鼠抗山羊iggs的sds-page,并通过银放大染色。(d)根据升高缀合物价态(柱)和增加co密度(行)绘制测定背景mfi。(e)纯化方案不同阶段的低价dab-ho(小鼠upa单克隆抗体)缀合物的sds-page,其中(1)天然dab,(2)缀合产物dabho(未纯化),(3)回收(非缀合)dab,和(4)纯化的dab-ho。(f)x-upaclamp试验对upa抗原标准稀释液和不同co浓度的mfi测定值。误差条是cy5通道中微粒信号的标准偏差。(g)用低(蓝点)和高(红点)价缀合物在x-upaclamp测定中的mfi信号。误差条是跨孔的mfi信号的标准偏差(n=3)。每条曲线上显示的lod按下文中的方法进行计算。
图17示出了clamp中交叉反应(cr)的消除。用于(a)传统msa和(d)clamp测定的cr筛选的示意图,其中条形码化微粒一次与一种靶标混合并温育,以多重化形式显示cr。snrs量化常规msas(b,c)和clamp(e,f)的特异性(对角线)和非特异性(非对角线)测定信号,响应于分别添加(b,e)1ng/ml和(c,f)100ng/ml抗原。(g)具有在特定浓度(x轴)下的mcp-1(蓝色)和egf(红色)加标(spike-in)的mcp-1单重夹心测定的测定mfi。(h)5重clamp稀释系列的snr信号。(插图)使用条形码特异性的背景和全局标准偏差计算snr。
图18显示了根据一个实施例在clamp中使用的寡核苷酸的序列和熔融温度。捕获寡核苷酸(co,42nt)通过5’生物素与链霉亲和素表面结合,并将3’荧光标记寡核苷酸(lo,21nt)和5’抗体缀合钩寡核苷酸(ho,81nt)连接到微粒表面。一个置换剂寡核苷酸(do30nt)最初与钩寡核苷酸上的9nt底部夹持结合,以取代ho-co杂交体。
图19显示了根据一个实施方案合成条形码化clamp微粒的示意图。图示描述了clamp微粒合成的主要步骤。(a)寡核苷酸预退火,加入抗体以形成生物素化的试剂混合物。生物素化寡核苷酸的混合物包括精确控制的co/so比例(总计90pmol),并定义co(以及后来的dab-ho)表面密度;生物素化寡核苷酸退火到精确控制的比例lo0/lo1/lo2,总计90pmol并限定条形码化。(b)此后,将链霉亲和素mp添加到生物素化的混合物中,用试剂在微粒表面按比例和随机地标记它们,其中寡核苷酸组分(例如lo1/lo2)的相对密度在表面上保持不变。(c)dab-ho最终被拉到表面上完成clamp的合成。表面上的dab密度与co密度成正比,因此与nco成正比。
图20示出了表面密度的微调和精确控制的示意图。(a)用af-647标记的抗山羊抗体检测cab。(b)用cy5标记互补但不置换的寡核苷酸检测ho。使用af647x-山羊第二抗体(红色)和标记cy5的靶向ho(非置换,蓝点)的寡核苷酸标记的具有不同共反应量的clamp微粒的荧光强度。(c)cab和ho检测(分别用红色和蓝色表示),准备clamp时增加起始co量并减少so,使nco+nso=90pmol。数据的线性拟合用虚线表示,误差条表示mp荧光的标准偏差。
图21是几个实施方案的示意图。(1)示出了一个clamp实施方案,其中捕获和检测试剂是抗体,检测试剂通过dna杂交与锚链连接,并且检测抗体被标记;(2)示出了一个实施方案,其中捕获和检测抗体通过寡核苷酸接头和dna杂交体与锚链附接,并对检测抗体进行标记。(3)示出了一个实施方案,其中捕获和检测试剂为抗体,检测试剂通过dna杂交体与锚链连接,并且检测试剂或钩链上没有标签。在分析物存在的情况下形成三重复合物,钩链被标记的置换剂寡核苷酸从锚链中置换。(4)示出了一个实施方案,其中捕获抗体和检测抗体通过寡核苷酸接头和dna杂交体与锚链连接,并且检测试剂或钩链上没有标签。在分析物存在的情况下形成三重复合物,钩链被标记的置换剂寡核苷酸从锚链中置换。(5)示出了(1)的实施方案,但其中标签与钩链附接,并且被将钩链与锚链附接的dna杂交体遮盖。在分析物存在的情况下形成三重复合物,并且钩链被与锚链结合或杂交的置换剂寡核苷酸从锚链置换。钩链上的标签在置换反应后被激活或去遮盖。(6)示出了(4)的实施例,但其中如(5)所示,标签与钩链附接,并且被将钩链与锚链附接的dna杂交体遮盖。在分析物存在的情况下形成三重复合物,并且钩链被与锚链结合或杂交的置换剂寡核苷酸从锚链置换。锚链锚链钩链上的标签在置换反应后被激活或去遮盖。(7)示出了一个实施方案,其中捕获和检测试剂都是抗原,并且都通过与锚链杂交的寡核苷酸接头与锚链连接。在结合两种抗原的抗体(本实施方案中的分析物)存在下形成复合物。标签与钩链附接,并由将钩链与锚链附接的dna杂交体遮盖。钩链上的标签在与锚链分离后被激活或去遮盖。(8)示出了一个实施方案,其中捕获试剂是与载体直接连接的抗体,并且有两条锚链。这两条锚链中的每一条都通过一个dna杂交体与一个检测抗体连接。在分析物的存在的情况下,形成四重复合物。两条钩链中的每一条链都被标记,并且钩链标签通过释放连接物到各自的锚链上而去遮盖。这两个标签可能相同或不同。
图22示出了根据一个实施方案的clamp测定的置换检测抗体浓度分布的计算,其中相对于在置换步骤期间的起始量(y轴)和溶液体积(x轴)绘制检测抗体浓度图。
图23示出了通过标记置换步骤检测的and(布尔)逻辑门表示,其中在单分子水平上的检测需要捕获靶标和成功释放钩链寡核苷酸(ho)。
图24示出了使用两种标记方法获得的校准曲线:使用bv421标记的第二抗体直接检测dab,以及使用标记cy5的置换剂寡核苷酸进行置换依赖性检测。il-7、fn-γ和mmp-9的校准曲线在缓冲液(pbst)中进行,方法是在降低浓度的蛋白质标准溶液中加标,并按说明进行分析。
图25示出了通过调节缀合物价态实现的clamp优化。(a)与价态升高的hos缀合的小鼠抗山羊iggs的sds-page,并通过银放大染色。(b)根据升高缀合物价态(柱)和增加co密度(行)绘制测定背景mfi。(c)x-upaclamp测定对upa抗原标准稀释液和不同co浓度的mfi测定值。误差条是cy5通道中微粒信号的标准偏差。(g)用低(蓝点)和高(红点)价缀合物在x-upaclamp测定中的mfi信号。误差条是跨孔的mfi信号的标准偏差(n=3)。每条曲线上显示的lod按下文中的方法进行计算。
图26示出了针对40种蛋白质(细胞因子和其他)的clamp测定的40重特异性筛选。抗原(重组)被逐个加标到含有多重clamp混合物的缓冲液中。每个孔只含有一种抗原。检测、读出和绘制每个clamp每个孔的信噪比,表明抗原与脱靶的clamp相互作用最小,如热图中最小的非对角线信号所示。
具体实施方式
如本文所述,提供了采用通过连接共定位的测定法检测和/或量化一种或更多种分析物的系统和方法。特别地,提供了具有足够低的背景信号、足够低的试剂间交叉反应和/或足够高的灵敏度的系统和方法,以允许同时检测和/或量化样本中的多种生物分子。还提供了快速、灵敏、经济和/或可扩展的多重夹心测定及其制备方法。
应理解,本发明并不限于特异性装置、系统、方法或用途或工艺步骤,因此它们可以不同。
为了清晰、一致的理解本说明书中使用的术语,下文提供了多种定义。而且,除非有其他限定,否则本文所使用的所有技术和科学术语都具有与本发明所涉及的本领域普通技术人员所理解的相同的语义。
在权利要求和/或说明书中,词语“一”或“一个”与术语“包含”一起使用时可以意味“一个”,但也与“一个或多个”、“至少一个”和“一个或更多个”的含义一致。同样地,“另一个”一词可以意味至少第二个或更多。
如本说明书和权利要求书所述,词语“包含”(以及包含的任意形式,如“包括”和“由…组成”)、“具有”(以及具有的任意形式,如“有”或者“含有”)、“包括”(以及包括的任意形式,如“包括”和“涵盖”)或者“含有”(含有的任意形式,如“含有”和“包含”)是包含的或开放的,不排除其他未引用的元素或过程步骤。
如本文所述,在给定值或范围的上下文中,术语“大约”是指在给定值或范围的20%、优选10%和更优选5%之内的值或范围。
如本文所述,术语“和/或”被视为两个特定特征或组件中的每一个的具体披露,无论是否有另一个。例如,“a和/或b”被视为(i)a、(ii)b和(iii)a和b中的每一个的具体披露,就像在本文中单独列出的一样。
如本文所用,术语“载体”是指固定化结构、表面或基质,例如但不限于微粒、纳米颗粒、板中的孔、多孔聚合物或水凝胶。应理解,载体并不意味着受到特别限制,可以使用任意固体、半固体、凝胶或凝胶状结构。例如,载体可以是阵列、微珠(例如但不限于聚苯乙烯微珠)、多孔板(例如96孔板、384孔板等)的表面、玻璃载玻片的表面、水凝胶基质、微流控芯片、侧流条、玻璃表面、塑料表面、硅表面、陶瓷表面等。在一个实施方案中,载体是微珠或微粒或纳米颗粒,通常为微米级或纳米级,例如但不限于聚苯乙烯微珠、磁微珠、顺磁微珠、塑料微珠等。在另一实施例中,载体是平面微阵列。在一个实施方案中,载体是纳米颗粒。在一个实施方案中,载体是微粒。
]如本文所用,术语“分析物”是指正在识别、检测、测量和/或量化的感兴趣的生物分子或生物细胞。分析物可以是可采用本文提供的系统和方法检测的任意生物分子或生物细胞,例如但不限于蛋白质、核酸(dna、rna等)、抗体、抗原、蛋白质、细胞、化学品、生物标记物、酶、多肽、氨基酸、聚合物、碳水化合物、多蛋白质复合物,外泌体、寡核苷酸、低分子量化合物等。分析物的非限制性示例包括抗体、抗体片段(例如,scfv、fab等)、适配体、经修饰的适配体、体节、适体、抗原、蛋白质、多肽、多蛋白质复合物、外泌体、寡核苷酸和低分子量化合物。
如本文所用,“样本”是指为了检测和/或量化分析物而正被分析的任意液体或液体样本。在一些实施方案中,样本是生物样本。样本的示例包括但不限于体液、提取物、含有蛋白质和/或dna的溶液、细胞提取物、细胞裂解物或组织裂解物。体液的非限制性示例包括尿液、唾液、血液、血清、血浆、脑脊液、眼泪、精液、汗液、胸腔积液、液化粪便和泪腺分泌物。
如本文所用,术语“编码的微粒”是指条形码化的微粒,例如,根据靶分析物或待在测定中进行的特定试验进行光谱编码。条形码化(或编码的)微粒通常用于多重悬浮液测定,因为它们可以区分较大混合物中的颗粒。条形码化的方法没有特别的限制。例如,可以使用光谱、图形或化学方法来进行条形码化。例如,可以通过用精确比例的多色染料标记微粒来进行微粒的光谱编码。这种方法允许通过流式细胞仪进行简单和高通量的读出。作为另一个示例,图形化的形码化的微粒通常被雕刻或以其他方式刻有可通过显微镜表征的视觉图案。也可以例如采用独特的可以在之后通过dna检测手段检测的dna序列化学条形码化微粒。
如本文所用,术语“非特异性结合”是指样本内的试剂和/或分子间的非预期反应,包括但不限于非同源抗体与通过疏水相互作用粘附的蛋白质之间的反应。
如本文所用,术语“亲和结合物”(ab)、“结合物”和“反应物”可互换地使用,以意味着可例如通过非共价相互作用特异性识别靶标分析物的任意分子。亲和结合物(abs)的示例包括但不限于免疫球蛋白g(igg)抗体(例如,全分子或fab片段)、适配体(aptamer)、亲和体(affimer)、纳米体、锚蛋白和单链可变片段(scfv)。
如本文所用,术语“夹心测定”是指分析物靶向测定,其中两种abs同时结合感兴趣的分析物,并可对其检测和/或量化。
如本文所用,术语“多重夹心测定”、“多重夹心分析”和“msa”可互换地使用,意指同时针对来自同一样本和/或分析体积的多种(例如,两种或更多种)分析物的夹心测定,在测定系统中使用多种ab对。
如本文所用,术语“交叉反应”是指在多重测定中非特异性结合或非特异性反应的情况,其中形成包括非同源亲和结合物的非预期复合物,如图1所示。
如本文所用,术语“捕获亲和结合物”、“cab”、“捕获ab”、“捕获结合物”和“捕获试剂”可交替使用,指的是与生物分子复合物中的载体附接且不会从中释放的ab。捕获ab可直接或者间接地(例如,通过与锚链连接,例如通过缀合或通过诸如捕获链等的接头)与载体(例如,通过共价键、生物素-链霉亲和素键、dna寡核苷酸接头或聚合物接头)附接。捕获试剂的非限制性示例包括抗体、抗体片段(例如,scfv、fab等)、适配体、经修饰的适配体(例如慢解离速率修饰的适配体或适体(somamer))、亲和体、抗原、蛋白质、多肽、多蛋白复合物、外泌体、寡核苷酸和低分子量化合物。
术语“捕获链”是指将捕获试剂与锚链(从而连接锚链的载体)的接头(例如,寡核苷酸、聚合物等)。
如本文所用,术语“检测亲和结合物”、“dab”、“检测抗体”、“检测粘合剂”和“检测试剂”可互换地使用,用于指生物分子复合物中与载体可释放地连接的ab。dab通常用于信号转导和测定信号转导。在本文提供的方法和系统的一些实施方案中,例如,从载体上释放出dab未与分析物结合的部分,以使得在不存在结合的分析物的情况下无信号产生。在一些实施方案中,dab与用于信号转导和测定信号转导的标签或装置结合。检测试剂的非限制性示例包括抗体、抗体片段(例如,scfv、fab等)、适配体、经修饰的适配体、适体、亲和体、抗原、蛋白质、多肽、多蛋白复合物、外泌体、寡核苷酸和低分子量化合物。
如本文所用,术语“锚链”是指与载体上的固定点附接的接头。锚链的非限制性示例包括聚乙二醇(peg)等聚合物、寡核苷酸(如单链dna寡核苷酸、单链rna寡核苷酸或者双链dna或rna寡核苷酸或dna-rna杂交体)和低聚糖。
如本文所用,术语“钩链”是指将检测ab与锚链连接并因此将其与载体附接的接头。钩链通常与锚链可释放地附接,例如,以附接物可以释放的方式。通常,当钩链和锚链之间的附接物被释放时,检测ab中未与靶分析物结合的钩链连接的部分将从锚链中释放出来,因此在不存在靶分析物的情况下在载体上检测不到ab的信号。这样,载体上的信号仅在存在靶分析物且被检测ab和捕获ab结合时检测到。
在一些实施方案中,如果标签位于钩链和/或检测试剂上,并且仅在钩链和/或检测试剂从锚链释放后被激活或可检测,则信号是“释放依赖性的”,因为它只有在从锚链释放钩链和/或检测试剂后才能检测到。类似地,在一些实施方案中,如果标签位于与钩链杂交的置换剂上,则信号是“置换依赖性的”。
如本文所用,术语“置换剂”是指直接或间接导致或启动锚链和钩链之间可释放连接的释放,从而从载体上释放钩链(以及与其连接的检测ab)的试剂。置换剂所使用的机理并没有特别受到限制。例如,置换剂可直接或间接引起或引发锚链和钩链之间的连接的切割、置换或去结合;其他机理是可能的,也可以是预期的。在一些实施方案中,使用与钩链和/或锚链杂交的dna寡核苷酸将钩链从锚链置换。置换剂的示例包括但不限于置换dna寡核苷酸、单色或多色光源、限制性酶和诸如二硫苏糖醇(dtt)的还原剂。在一些实施方案中,如果使用可光致裂解的dna片段,则置换剂可以是通过光致断裂反应影响释放的光。在一些实施方案中,置换剂例如用染料、荧光团、特异性dna序列、酶、生物素部分等标记。当置换剂被标记时,可同时起到释放钩链并对其标记的双重功能。
如本文所用,术语“标签”是指产生信号的任意分子或分子的一部分,可以用信号生成分子进行靶向,或者可以以其他方式检测到。标签的示例包括但不限于生物素、荧光团、酶、酶底物和特异性dna序列。“无活性”或“不可检测”标签是指无活性、被掩蔽或以其他方式不可检测的标签,例如,不能产生可检测信号,如但不限于淬灭的荧光染料。
应理解,本文提供的系统和方法可用于几乎任何类型的夹心测定,其中使用两组abs。然而,为了简单起见,本文使用全分子免疫球蛋白g抗体(igg)作为ab来呈现本发明的具体实施方案,其代表许多可能的实施方案之一。应该理解的是,抗体并不限制于全分子igg,可以使用许多不同的抗体、抗体片段等。进一步地,ab并不限制于抗体。类似地,除了本文所述的特定类型之外,还可以使用许多不同类型的夹心测定法。
在一些实施方案中,提供了一种双ab或夹心测定法,该法可在暴露于含有感兴趣分析物的生物样本之前通过在载体上共定位两个ab(捕获ab和检测ab)来避免交叉反应性。载体上的共定位不允许在暴露于分析物之前将不同的ab对混合,因此可以减少或消除试剂和/或背景之间的交叉反应性(如图1或图4所示)。在一个实施方案中,提供了一种与捕获和检测ab的混合物附接的载体,其中每一组捕获和检测ab都能够与感兴趣的分析物结合,检测ab任选地通过可释放的接头与载体附接。在一个实施方案中,提供了一种与捕获和检测ab的混合物附接的载体,其中每个分析物能够同时与捕获ab和检测ab结合,并且其中检测ab任选地通过可释放钩链与载体可释放地附接。在释放检测试剂和/或钩链后,只有在用捕获ab与三重复合物中的分析物结合时,相应的检测抗体才会保留在载体上。
应理解,在本文提供的方法和系统中使用的“接头”和“链”并不受到特别限制。接头和链的非限制性示例包括dna寡核苷酸(也称为dna寡核苷酸)、聚合物、多糖等。dna连接可以是共价的,如钩链寡核苷酸与检测抗体之间的缀合,也可以是非共价的,如两种互补dna序列之间的杂交或碱基堆积。为了形成捕获ab-抗原-检测ab三重复合物,钩链被设计为具有挠性的单链部分。可以使用若干包括但不限于底部夹持介导的dna置换反应、酶切割和光敏切割的方法来进行dna链的置换。特定dna序列也可用作标签,既可以使用荧光标记的互补序列来直接靶向,也可以通过杂交链式反应或聚合酶链式反应作为扩增触发器或引物,也可以通过测序读出。
应理解,在本文提供的方法和系统中使用的“寡核苷酸”(也称为“寡核苷酸(oligo)”)并没有受到特别限制。例如,寡核苷酸可以用荧光染料在5’或3’末端进行修饰,用可光致断裂的磷酸二酯背骨修饰,与蛋白质、生物素或酶等缀合。
在本文中,这些实施方案也可称为“通过连接共定位的测定”或“cla”。在cla的一些实施方案中,检测ab被标记(即,与标签附接)。在cla的一些实施方案中,将检测ab与锚链连接的钩链被标记(即,与标签附接)。通常,与检测ab或钩链附接的标签无活性或不可检测,以使得可以在从载体上释放出检测ab后(即,从锚链释放出钩链)检测到标签。因此,来自标签的信号检测是释放依赖性的(在一些实施方案中也称为“置换依赖性”)。通过这种方式,只检测到具有捕获ab的三重复合物中的分析物结合并从锚形ab中释放出来的检测ab,因为未结合的检测ab将从载体上释放出来(并且可以通过清洗等方式去除)。背景信号也可以减少,因为标签在释放前是无活性或不可检测的,或者如果没有释放出给定的钩链(即,由于信号的释放依赖性或置换依赖性)。因此,在一些实施方案中,本文提供的方法和系统可被称为“释放依赖性转导”(或“rdt”)或“置换依赖性检测”,以反映释放依赖性(或置换依赖性)信号转导。
传统的夹心测定法一般依赖于检测ab的存在以转导信号并检测分析物的存在。类似地,在一些本文所述的系统和方法的实施方案中,检测ab和/或钩链可作为信号传感器。然而,与传统测定法相反,在本文提供的系统和方法中,只有在三重复合物形成有分析物和捕获ab时,任选地与其连接的检测ab和/或钩链仍在载体上。应当理解,如果检测试剂和/或钩链无法成功地或者完全地从锚链中释放出来,则它甚至在不存在分析物的情况下也仍在载体上。在这种情况下,如果检测ab和/或钩链与当附接到锚链时活跃或可检测的标签附接,则任意非释放、标记的检测ab和/或钩链会转导信号。换言之,在那种情况下,任意标记的且非释放的检测试剂和/或钩链会导致独立于分析物的存在的信号,这有助于非特异性背景信号,并减少测定性能和/或灵敏度。应当理解,在那种情况下,背景信号将与非释放的检测试剂和/或钩链的部分成比例。还应当理解,由于空间位阻、附接和/或不完全洗涤,可能很难从载体上完全释放复合物。然而,释放依赖性转导(rdt)可以最小化或消除这些问题,因为如果检测试剂和/或钩链从锚链不完全释放,则不会发生信号转导,如图24所示。
在一些实施方案中,因此,本文提供的系统和方法包括额外的冗余水平以通过使用释放依赖性转导(rdt)来减少背景信号和/或增加灵敏度。在rdt中,只有在满足以下条件中的两种条件时才会发生信号转导:(i)形成三重捕获ab-分析物-检测ab复合物,以及(ii)从锚链释放相应的检测ab和/或钩链。在这种情况下,非释放的检测ab和/或钩链将不有利于背景信号。这种信号转导机制,我们在本文称为“释放依赖性转导(rdt)”,可以通过多种手段实现。例如,一些实施方案可以包括钩链上的标签,其中标签直到从锚链中释放出来后才无活性或不可检测,以使得非释放(例如,未移位的)的钩链和/或检测ab)不利于或者不转导信号。
在rdt的一些实施方案中,用由锚链或另一近端链猝灭的荧光染料标记钩链,以使得释放导致了荧光染料的不猝灭或活化。
在rdt的一些实施方案中,检测试剂和钩链未被标记,并且相反地,置换剂被标记。在这种情况下,置换剂与钩链杂交,从而将其从锚链中置换除去并同时对其进行标记。如果检测ab未与三重复合物中的分析物和捕获ab结合,则将钩链、置换剂和标签从载体上清洗掉。由于标签与置换剂附接,在满足以下两种条件时标签仅存在于载体上:(i)已从锚链中释放或置换出来;和(ii)分析物已与捕获和检测ab结合(如图7)。
应当理解,rdt的其它实施方案也是可能的,rdt的机制并不意味着会受到特别限制。
在rdt的一些实施方案中,检测ab或锚链与标签附接。在一些实施方案中,将检测ab与锚链链接的钩链被标记(即,与标签附接)。一般地,与检测ab附接的标签、锚链或者钩链无活性或不可检测,以使得标签只能在从载体上释放出检测ab后才能检测到(即,从锚链中释放出钩链,如图6只示例所示)。以这种方式,唯一被检测到的检测ab-钩形寡核苷酸复合物是具有与三重复合物中的分析物结合的检测ab的复合物,其中捕获ab和钩子链成功地从锚链中释放出来。否则,无论是否结合分析物,未结合的检测ab将从载体上释放(并且可例如通过清洗去除),未检测到所有非释放的链。以这种方式,来自非释放的检测ab和/或钩链的背景信号得到缓解,确保了低背景信号较低和/或高灵敏度检测。
在rdt的其他实施方案中,钩链含有标签,所述标签仍无活性或不可检测,直到钩链从锚链释放。例如,这可在钩链和锚链是通过杂交结合在一起的dna寡核苷酸来实现,其中钩链含有dna序列标签,所述dna序列标签与锚链正常地杂交并因此进行结合或者不可检测。从锚链寡核苷酸中释放出钩链寡核苷酸揭示了钩链上的可检测标签。这种释放可以例如通过酶切割、dna置换或使用光的光致断裂来实现。
在一些此类实施方案中,提供了一种释放或置换剂,所述释放或置换剂是寡核苷酸,所述寡核苷酸通过经底部夹持置换反应与锚链寡核苷酸结合来置换锚链-钩链杂交体。在一个实施方案中,钩链和检测ab都未被标记,标记的置换剂(例如,荧光标记的寡核苷酸)通过释放(置换)和标记的双功能进行rdt。以这种方式,仅通过标记置换的钩链,仅在满足两种条件时(置换钩链和存在分析物)在载体上发生可检测信号/信号转导,类似于“and”逻辑门(例如如图7b所示)。
在本文提供的测定和系统的一些实施方案中,将一组或多组捕获和检测ab与载体附接,每组对感兴趣的分析物来说都是特异性的。以这种方式,在暴露于含有感情去分析物的生物样本之前,将捕获和检测ab预组装和共定位在载体上。如上文所述,检测ab与载体可释放地附接。在一些实施方案中,检测ab通过与附接到载体的锚链连接的可释放接头(钩链)与载体附接。钩链通常是具有挠性的,并且使检测ab自由地分散在钩链和/或锚链的长度允许的限制范围内。钩链和可释放链并未受到特别限制并且其大小、挠性、结构等都是可以变化的,只要他们允许检测ab和捕获ab同时结合分析物。捕获ab和检测ab通常结合分析物的不同区域,尽管它们可结合重叠位点,只要它们能够同时结合分析物。
在一些实施方案中,采用钩链将检测ab与载体连接,所述钩链是能与附接到载体上的锚链特异性结合的dna寡核苷酸。在与生物样本(即,靶标识别步骤)接触并温育后,通过使表面上的钩链与锚链之间的连接断裂来将检测ab与锚链分离。这可以释放出检测ab中未形成三重捕获ab-分析物-检测ab复合物的部分。应理解,可以多种方式,如不限于dna链置换、酶切割、光激发的切割等等,使钩链与锚链之间的连接释放或断裂。
如本文所包含,靶向许多不同分析物的多种ab可以相同测定体积(即,多重化)混合;不同载体(不同位置/相同载体上的位置处的不同ab之间)上的不同ab之间的相互作用受到与载体的连接的限制,以避免来自不同载体/位置的ab之间的相互作用。这与传统的多重化技术相反,当所有ab混合在溶液中时,传统的多重化技术不能限制ab之间的相互作用。进一步地,可采用本文所述的方法和系统大批量地制备不同的微粒群,每个种微粒群含有检测特定抗原所需的不同ab捕获-检测对。
在一些实施方案中,多重化的cla方法和系统因此可避免图1所示的交叉反应场景。例如,如本领域技术人员所意识到的,同源捕获和检测ab在其对应载体(例如,微粒)上的共定位将消除不想要的相互作用,如非同源检测和捕获ab之间的结合。除了图1所示的那些场景以外,本领域技术人员将认识到,与传统多重化夹心法相反,与脱靶载体结合或附接的分析物无法通过其在本文提供的方式和系统中的同源检测ab检测到,因此不利于增加背景信号。
在一些实施方案中,在每种载体上,捕获和检测ab的局部浓度可以较高,这可浓缩分析物以及增加灵敏度。另一方面,每个捕获和检测ab在整个测定体积中的总浓度只取决于靶标特异性载体(例如,微粒、微阵列点)的浓度,并可设计为释放后获得较低的检测ab的总浓度。例如,虽然局部浓度可在微摩尔范围内,但是较低数目的靶向特异性微粒的使用可产生过低(<pm)的总检测ab浓度以获得任意脱靶结合,如图22所示。通过增加释放步骤期间的体积来进一步降低总浓度。因此,在某些实施方案中,由于载体上使用的检测ab的浓度或量较低,本文提供的方法和系统能进一步避免检测ab释放后发生的交叉反应性。
在一些实施方案中,将两种共定位的结合物(捕获ab、检测ab)同时与同一分析物(即,增加的结合亲合力)的两种不同表位结合可导致与传统夹心测定法低得多的有效解离速率(koff),在所述传统夹心测定法中,捕获和检测ab依次添加。引入和温育样本后,严格地清洗本文提供的方法和系统中的载体,因为可结合分析物,亲和力较高。因此,在本文提供的方法和系统的一些实施方案中,严格的清洗可用于降低测定背景和/或提高灵敏度和/或特异性。在一些实施方案中,可能需要在钩链从锚链释放后快速执行测定步骤,直到读取测定信号为止,因为分析物的分离可导致信号减少,这可有利于灵敏度降低,尽管在cla中这种影响通常会降低。
在本文提供的方法和系统的一个实施方案中,载体用微粒编码,捕获试剂和检测试剂都是抗体,其中用dna链(换言之,钩链和锚链是单链dna寡核苷酸,通过双链dna杂交体连接在一起)捕获试剂及其同源检测试剂共定位在同一载体的表面。在一些此类实施方案中,与钩链和锚链连接的检测试剂均匀地混合并与微粒的表面附接,其中锚链通过部分杂交与钩链连接,钩链用于检测试剂缀合,钩链是具有挠性的并且是可释放的dna接头。锚链与钩链之间的杂交体在样本温育的条件期间一般是稳定的。在一些实施方案中,捕获试剂还通过dna接头与微粒连接。在一些实施方案中,可通过底部夹持介导的dna置换反应从锚链释放钩链。在一些实施方案中,置换剂是寡核苷酸,所述寡核苷酸设计为与钩链上的底部夹持序列结合以向前驱动置换反应。在一些此类实施方案中,不使用置换剂例如通过升温从锚链释放钩链,以使得dna杂交体“熔融”或去结合。
在一个实施方案中,例如用染料、在随后步骤中使用荧光标记的链霉亲和素检测的生物素部分来标记检测ab和/或钩链。在某些实施方案中,可在将分析物与标记的结合物结合后检测检测ab,例如,可采用标记的物种特异性的第二igg来靶向igg。在一些实施方案中,检测ab和钩链未被标记,相反,用于从锚链中释放钩链的置换剂被标记。在此类实施方案中,在从锚链释放钩链后,标记的置换剂与钩链和/或检测ab附接。
在一些实施方案中,标签是特异性dna序列,所述特异性dna序列可以在随后的步骤中检测或靶向。例如,特异性dna序列可以用染料通过随后的标记其的dna杂交步骤靶向。在一个实施方案中,通过聚合酶连反应(pcr)或者其它酶促dna扩增手段来检测和扩增特异性dna序列。特异性dna序列还可通过测序等其他手段切割和检测。使用dna序列作为标签的实施方案未受到限制并且可包括是钩链的一部分(因此最初无活性/不可检测)或者存在于置换剂上(如图6a、图6d中所示)。
在一些实施方案中,提供了一种检测ab,其与钩链附接且通过与锚链附接的可释放接头间接地与微粒附接。钩链部分地与附接到微粒上的锚链互补。锚链可通过例如链霉亲和素/生物素相互作用或化学键附接到微粒上。检测ab因此附接到微粒上。在该实施方案中,进一步提供了一种捕获ab,其附接到微粒表面,并且其中检测ab识别相同的抗原作为捕获ab,两个ab可同时结合抗原。此外,提供了一种置换寡核苷酸(置换剂),其具有与钩链互补、与锚链的序列重叠的序列,以便使检测ab从锚链释放,并因此从微粒中释放出来,如果抗原被结合(即,如果在捕获ab-抗原-检测ab之间不存在三重复合物)。在又一实施方案中,还提供了一种荧光标记的第二抗体,所述第二抗体在置换反应后与留在微粒上的检测ab结合。
应注意,在捕获和捕获ab预组装在载体上并且用可检测标签标记检测ab的实施方案中,任意非释放的钩链-检测ab复合物将导致产生分析物依赖性信号,该信号会有助于背景噪音(如图24所示)。因此,应当理解,为了避免增加背景信号,需要进行几乎完全的锚链-钩链置换反应和清洗钩链-检测ab复合物。应当理解,此类几乎完全的释放即使在优化的条件(图15)下也是困难的。为了减少此类由低效率释放锚链-钩链接头倒置的此类增加的背景信号,在一些实施方案中,用无活性/不可检测的标签标记钩链、锚链或者检测ab,直到钩链从锚链被置换或释放。在另一实施方案中,钩链、锚链或检测ab未被标记,用可检测标签标记置换剂。在此类实施方案中,如果过满足以下条件中的两种条件则仅发生在载体处的信号转导:(i)形成三重捕获ab-分析物-检测ab复合物,和(ii)置换钩链-锚链杂交体。应当理解,类似地,在检测ab和/或钩链上的标签在释放之前是无活性或不可检测的实施方案是有益的,因为非释放(例如,未置换)的钩链(或检测ab)将不利于信号的产生。
在一个实施方案中,标记的置换剂(例如寡核苷酸)可进行释放(置换)和标记双功能。以这种方式,通过仅标记置换的钩链,可检测的信号/信号转导需要两种条件,与“and”逻辑门类似(图23)。此类实施方案的其中一个潜在的优势是它们不要求改变dna序列的设计或包括钩链和锚链的检测复合物的连接特性。
在一些实施方案中,可通过采用具有无活性或不可检测标签的钩链实现额外的冗余水平,所述无活性或不可检测标签仅在从锚链进行置换后被激活或可检测。例如,在一个实施方案中,用染料标记钩链,所述染料由可与锚链缀合的染料猝灭剂猝灭。在另一实施方案中,类似地,通过采用限制性酶来实现置换,之后用标记的寡核苷酸生成信号,所述标记的寡核苷酸靶向钩链中先前杂交(因此不进行结合)的部分,从而仅与已经置换的钩链杂交并且对其进行标记。
在某些实施方案中,提供一种通过钩链与微粒连接的检测ab,所述钩链是寡核苷酸,其与检测ab连接。钩链寡核苷酸与锚链部分互补,所述锚链也是通过例如链霉亲和素/生物素相互作用或者化学键与微粒连接,从而将检测ab附接到微粒上。还提供了一种捕获ab,其余微粒表面连接,并且其中检测ab识别相同的抗原作为捕获ab,两种ab可同时结合抗原。此外,可以提供一种置换剂,其是含有荧光标签或dna条形码序列的寡核苷酸并具有与钩链寡核苷酸互补的与锚链寡核苷酸的序列重叠的序列,以便检测ab从锚链释放,因此可从微粒上释放。
应理解,在本文提供的方法和系统中,共定位和连接的使用可需要合理的拓扑设计以优化载体上的两个ab(捕获ab和检测ab)的可用性。在一些实施方案中,当随机分布的捕获ab和/或检测ab附接到载体上时,分析物的适当结合可能需要优化两个重要的设计参数:(i)捕获和检测ab的相对密度,和(ii)钩链的长度。这两个参数通过考虑检测抗体的回转半径来控制捕获和检测ab之间的时间平均距离。在某些情况下,捕获与检测ab之间的距离以及最终单分子水平上的有效亲和性可能是随机的,并且很难控制。因此,在一些实施方案中,可能需要优化上述两个参数以获得最佳测定性能。
在另一实施方案中,捕获ab和检测ab均与锚链连接,允许同时控制捕获和检测ab密度,同时保持纳米级的共定位,可能允许更精确地控制测定性能(如图5f-g所示,图21中的一些实施方案)。在此类实施方案中,捕获和检测ab是共定位,并且它们的相对密度相同,并且可以被同时调节。本实施方案的一个潜在优点是针对载体上所有线对的捕获和检测ab之间的平均距离均匀。本实施方案的第二个潜在优点在于可以精确地控制捕获和检测ab的结构。例如,可通过减少锚链或钩链的单链部分的长度来控制结合的严格性,从而提供了一种确定的方法来控制测定系统的热动力学。本领域技术人员将意识到,增加结合的严格性可导致有效亲和性的降低。在一些实施方案中,除了其他应用外,这种有效亲和性的调节可用于控制和扩展测定的动态范围。
在有效亲和力可以通过改变钩链或锚链的长度(即,接头长度)或通过调节捕获和检测ab的表面密度来调节的一些此类实施方案中,可以制造具有不同有效亲和力的多重化阵列(例如,多重化微粒)。这有助于扩展特定分析物的测定的动态范围。例如,本领域技术人员将认识到,血液中存在浓度大于5个数量级的一些蛋白质;对于此类靶标,可以使用不同的条形码来设计若干测定法,以能够在更大的动态范围内量化此类蛋白质。
在一个实施方案中,捕获ab与捕获寡核苷酸缀合,所述捕获寡核苷酸与连接载体的锚链的一个序列结构域杂交。锚链的另一序列结构域可与钩链杂交,所述钩链与检测ab连接。在本实施方案中还可利用上述所有用于信号转导和生成的策略。
在一个实施方案中,可设计两组或多组检测同一靶点的可区分(即,多重化)复合物,以增加多重测定的动态范围,其中可控制两组或多组的钩链寡核苷酸的长度,从而控制结合的严格性。例如,可以制备具有不同条形码但靶向同一分析物的两组或多组微粒,其中第一微粒组包括较短的钩链寡核苷酸,以减少灵活性和增加结合的严格性,并且其中第二微粒组包括较长的钩链寡核苷酸,以增加柔韧性并减少结合的严格性等。以这种方式,当分析物以较高浓度存在时,可设计第一微粒组来量化分析物。
本领域技术人员将认识到,多重测定的另一个挑战是干扰和基质效应,这在分析物水平上很难控制。在一些实施方案中,本文提供的方法和系统的其中一个优点在于能够将同一生物样本与相同测定体积内的多重测定配置接触。这种灵活性可以提供单独控制对特定ab和测定试剂的基质效应的能力。例如,某些样本可能含有内源性抗体和其他分子,它们可能对特定分析物的检测信号强度产生积极或消极影响。
在另一实施方案中,提供了不同的载体或生物分子复合物,每种分析物特异性的载体缺少捕获或检测ab中的一种,并且充当分析物特异性的内标物,该内标物控制基质效应和测定的其他潜在失效模式。载体上完全形成的生物分子复合物的测定信号可以与这些单独的ab对照品进行比较。这些内部对照可以用作潜在假阳性的标志。
本领域技术人员将认识到,测定的另一个挑战,特别是当使用具有非零或快速解离速率(k-off)的结合物时,是分析物的分离,从而降低测定信号,这可能发生在生物样本清洗到测定信号读出之间的时间。这种去结合对于低浓度分析物尤其是有问题的,并且读取方法不能在多重测定中测量不同的测定(例如,血细胞计数)。该问题也可能存在于cla传感器程序中,因此释放后(例如,置换后),将分析物与捕获ab或检测ab的分离可能导致信号丢失。因此,在又一实施方案中,因此,可修饰本文提供的cla方法和系统以通过从可逆反应(例如,ab分析物)进入稳定的寡核苷酸杂交体中来以减轻该分离和时间依赖性信号的问题以停止进一步的分离,并且与能在之后存储和读出的载体连接(如图13所示)。本实施方案的潜在优点是最小化测定完成后的信号丢失,这有助于提高灵敏度。本实施方案的另一个潜在优点是对在不可忽略的时间量内读出的不同测定和样本之间的信号降标准化,从而实现更好的信号再现性和改进的精度。在一些此类实施方案中,可以类似于先前的实施方案进行测定,其中所述测定标签是唯一的dna序列,其中在清洗释放的检测ab之后,可以引入替换剂以将钩链与锚链重新连接,从而将信号保存在载体上。如本领域技术人员所意识到的,本实施方案的另一个潜在优点是信号强度的再现性,尤其是消除测定信号对时间-测量和温度的任意依赖性。
在一些此类实施例中,提供了一种置换剂,所述置换剂是一种寡核苷酸,其通过底部夹持置换反应与锚链寡核苷酸结合,然后清洗释放的和未结合的钩链寡核苷酸-检测ab复合物,然后添加能通过与两种寡核苷酸杂交而使钩链寡核苷酸与锚链寡核苷酸重结合的替换寡核苷酸。
若干应用将从本文提供的方法和系统中显著受益,这些方法和系统在一些实施方案中用于解决多重测定夹心测定中背景噪声和假阳性的若干来源。具体而言,在一些实施方案中,蛋白质分析的多重化将通过本文提供的方法和系统显著地来实现。例如,由于试剂的交叉反应性,在传统的多重化中,诸如细胞因子和其他可溶性因子的分析受到限制。在一些实施方案中,本文提供的方法和系统可以显著地改进多重血清学分析。例如,用于检测许多特异性自身抗体的多重自体抗体测定法已被特异性严重阻碍。通常,通过检测自身抗体或自身抗体(例如,抗体)捕获人的特异性抗体。因此,血清中存在的任何自身抗体的非特异性结合都会被检测出来,并且通常会导致假阳性,使这种类型的检测成为单一结合物测定(换言之,仅限于单重形式)。相比之下,本文提供的方法和系统可用于执行双结合物测定;即,分析物(这里是自身抗体)被两种特异性ab(这里是特定抗原)识别和检测。在此类实施方案中,重组抗原或天然抗原可分为两部分,分别表示捕获抗体和检测抗体,它们分别与捕获链和钩链缀合,其中捕获链和钩链都与同一锚链连接,其中锚链连接到载体上(如图9)。如前所述,钩链的挠性可使分析物(此处为抗体)与捕获抗体和检测抗体(此处相同的蛋白质与具有不同功能的不同链连接)结合。清洗未结合的样本后,信号转导可通过标记的链置换进行,如本文所述。
在一些实施方案中,本文提供的方法和系统可以解决使用ab的蛋白质-蛋白质相互作用的多重测定中的主要挑战。为此,可以预先组装ab对,每种ab对针对一种感兴趣的蛋白质,允许cla检测所述对之间的相互作用,如图10所示。由于这种多重测定与另一种测定完全隔离,交叉反应性显著降低,允许组合测量不同蛋白质-蛋白质对之间的相互作用。本文提出的实施例的制造方法的模块化方法使得针对不同蛋白质的ab对的实现和制造相对简单。例如,大批量制备微粒上的cla允许具有捕获ab的微粒的整体功能化,然后分馏并在每种分馏组分中添加不同的检测ab。
在一些实施方案中,本文提供的方法和系统可以解决使用ab的翻译后修饰(ptm)的多重测定中的另一个主要挑战。例如,精确的蛋白质磷酸化测定可以用来揭示细胞信号事件不明显的蛋白质表达水平。目前用于量化特定蛋白质的ptm部分的方法和工作流程在多重化中受到严重限制,因为ptm特异的ab对蛋白质本身没有足够的特异性(即,磷光体特异性ab极易受到试剂驱动的交叉反应性的问题的影响)。因此,传统的ptm组不能多重化。本文提供的多重化的cla测定方法和系统可通过将抗ptm结合物限制在分析物特异性载体上来解决该问题(如图11所示)。
在一些实施方案中,钩链是具有挠性的和可释放的接头,并且是寡核苷酸,其允许形成捕获ab-分析物-检测ab三重复合物,以使得在从载体上释放未结合钩链寡核苷酸中的一种后,仅在响应于夹心捕获ab-分析物-检测ab的识别而生成信号。
在一些实施方案中,提供了一种检测ab,所述检测ab是通过钩链附接到微粒等载体上的抗体,所述钩链是与检测ab连接的寡核苷酸。钩链寡核苷酸与通过链霉亲和素/生物素相互作用例如或化学键附接到载体(例如微粒)上的锚链寡核苷酸部分地互补,从而将检测ab附接到载体上。还提供了一种捕获ab,所述捕获ab是附接到载体上的抗体,并且其中检测ab识别同一抗原但不识别同一表位作为捕获ab。在一些实施方案中,提供了一种置换剂,所述置换剂是含有荧光标签或者dna条形码序列并具有与钩链寡核苷酸互补、与锚链寡核苷酸的序列重叠的序列的寡核苷酸,以便检测ab从锚链寡核苷酸中释放出来,因此可在不存在靶分析物的情况下从载体上释放出来。应理解,一旦捕获ab和检测ab与分析物结合,则在载体上(例如,在微粒上)形成有三重捕获ab-分析物-检测ab。在形成三重复合物后,通过洗涤将未结合的检测ab从载体上去除,而三重复合物留在载体上。之后检测和/或量化载体上三重复合物的存在。
在一些实施方案中,本文提供的方法和系统可以称为“微粒上通过连接共定位的测定”或者“clamp”。本文所述的clamp方法和系统对使用者来说可以是高度可用的并且是有益的。例如,通过提供具有预组装ab对(捕获和检测ab对)的微粒,使用者可以随意地快速地混合和匹配组,快速地执行多重化测定,使用例如任意多色流式细胞仪读出测定结果。本文提供的clamp测定法因此适用于现有的生物学实验工作流程,并且在一些实施方案中可以使用任何多色流式细胞仪读出。
应当理解,clamp实施方案特别适用于大规模、工业规模制造可避免交叉反应性的多重化组。与平面阵列不同的是,clamp可以大批量单独制造,也可以任选地储存,然后在测定前混合。该制造方法允许clamp独立制造,无需非同源ab之间的相互作用,因此在制造步骤期间没有交叉反应,这是与其他cla实施方案相比的关键优势。
在一些实施方案中,为了制造多重clamp,在多组微粒上附接ab对,其中每种靶特异性的ab对在不同的容器中在其对应的微粒组上附接。微粒ab附接之前先条形码化,或者也在该过程期间也被条形码化。可以大批量地进行该反应,存储制造的clamp。为了进行测定,在与生物样本接触之前将针对每个条形码/靶标的微珠的部分混合在一起。采用任意手段,例如光谱地、图形化地或者化学地,条形化微粒。
在一些实施方案中,如果载体是微粒(mp),则可以获得某些优势。例如,在一些实施方案中,通过流式细胞仪快速读出大量mp的能力可使精确度和样本通量增加。此外,mp可以可大排量功能化,然后在溶液中其存储、使用并读出,这可以减少批次间的差异性并实现量化分析(tighe,p.j.等人,proteomics-clinicalapplications9,406量化分析(。白质表达;jani,i.v.等人,thelancet2,243alapplica;krishhan,v.v.,khan,i.h.&luciw,p.a.multiplexedmicrobeadimmunoassaysbyflowcytometryformolecularprofiling:basicconcepts;tighe,p.等人,utility,reliabilityandreproducibilityofimmunoassaymultiplexkits.methods(sandiego,calif.)1utilit;fu,q.等人,clinicalapplications4,271roducibil)。
在一些实施方案中,本文提供的方法和系统可降低或消除试剂的交叉反应。如图2a所示,示出了cla的一个实施方案,利用dna寡核苷酸作为具有挠性和可寻址的接头将两组抗体预共定位可以消除非同源抗体之间的相互作用。进一步,在具有挠性的接头中的一者从表面释放后,仅响应于夹心抗体-抗原-抗体识别而产生信号。
图2b至2f根据一个实施方案示出了clamp的纳米级结构和工作原理。通过对具有限定的荧光寡核苷酸与抗体之比的微粒进行一步法功能化而产生clamp群体(图2b),然后杂交钩形寡核苷酸-检测ab(dab)复合物以完成clamp的构建(图2b)。在一个实施方案中,稳定的生物素-链霉亲和素键用于试剂连接/附接,并且在制造后存储微珠组。然后,通过杂交将单价抗体寡核苷酸成对地组装在条形码微珠组上(即,抗体对a1-a2和b1-b2分别预组装在微珠a和b上)(图2c),然后将微珠组集合在一起。当将一个clamp板添加到样本中时,靶蛋白生成夹心复合物,而非特异性结合的蛋白质不会形成完整的夹心(图2d)。温育后,严格洗涤去除非特异性结合的蛋白质(图2e)。接下来,用dna链置换来同时去杂交和标记每个微珠群上的一种夹心抗体,这确保了只有夹心结合事件产生信号(图2f)。最后,自动读出clamp板以及使用任何常见的多色流式细胞仪解码微珠组。
在一些实施方案中,clamp板的研发费用比传统的免疫测定低;由于添加了新的靶分析物,不仅避免了昂贵的重新优化组,而且clamp还可以在每次测定中使用显著较低数量的抗体。
在一些实施方案中,除了克服试剂交叉反应性外,clamp中的表面栓系抗体对可导致结合亲和力效应,使clamp比传统夹心免疫测定具有更多优势。clamp对靶点具有较高的亲和力,因为clamp中抗体夹心复合物靶点的解离率(koff)远低于使用顺序抗体添加的测定。在一些实施方案中,可在温育后严格清洗clmap测定试样,减少了测定背景并提高了特异性。此外,在一些实施方案中,clamp可降低假阳性的不利因素:clamp中的错误结合事件不会形成完整的夹心复合物,因此它们不会导致假阳性信号。
实施例
通过参考以下实施例,本发明将更容易理解,这些实施例被提供来说明本发明,不应被解释为以任何方式限制其范围。
除非另有定义或上下文另有明确规定,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。应当理解,与本文所述的方法和材料类似或等效的任何方法和材料都可以用于本发明的实践或测试中。
实施例1:一锅法微珠条形码化及clamp制造
在一些实施方案中,在光谱编码的微珠上实现多重测定系统,其中在本文提供的方法和系统中可使用一锅法微珠条形码化策略和自动化解码法。u.s.专利申请号16/153,071和dagher,m.等人,naturenanotechnology,vol.13,pp.925–932,2018中描述了此种条形码化/解码法的示例,其各自的内容都通过引用全文并入本文。此类方法使用荧光团光谱重叠和多色forster共振能量转移(fret)的精确模型。例如,这种策略可以使用两个用于条形码化的激光器和用于分析读出的第三激光器来处理580个以上的条形码(如图3a所示)。带有红外激光的细胞仪有可能将该容量扩大到5000多个条形码。
相同的制造流程用于构建本文所述的共定位抗体测定版本。也就是说,在第一步,链霉亲和素微珠与生物素化的捕获抗体和修饰有不同染料的生物素化锚或捕获寡核苷酸共偶联以产生可区别的条形码。每个条形码和靶特异性抗体都是在单独的试管中制造的。在第二步中,将与钩寡核苷酸缀合的检测抗体(单克隆)添加到第一步中的相应功能化微珠中。钩链寡核苷酸与锚链寡核苷酸互补并与之杂交,导致匹配的抗体对的组装和共定位。微珠可以单独存放,以便以后使用。
在一些实施方案中,可用低寡核苷酸:抗体缀合比率或价态和/或两步纯化来优化(即较低)背景信号。例如,低价态抗体-寡核苷酸缀合物被证明可以最大化clamp链置换效率和最小化背景信号(图3b)。在第一轮优化(改变离子强度、洗涤和温育时间、纳米级设计和试剂浓度)后,1-重clamp对upa的灵敏度比传统的夹心测定法提高了3倍(图3c)。实施单价而非高价缀合物导致进一步提高了3倍(图3d)。
在一个实施方案中,本文所述的clamp系统包括以下组分:
1)微粒,所述微粒将所有其他组分固定在适当位置处;
2)一种捕获抗体(cab),所述捕获抗体与微粒共价偶联;
3)一种检测抗体(dab),所述检测抗体与钩寡核苷酸共价连接,其中检测抗体识别与cab相同的抗原但非相同的表位;
4)锚寡核苷酸(ao),所述锚寡核苷酸例如通过链霉亲和素/生物素相互作用与微粒连接;
5)茎寡核苷酸(so),所述茎寡核苷酸与ao完全或部分互补,从而使其至少部分地是双链;
6)钩寡核苷酸(ho),所述钩寡核苷酸与cab共价连接并且与锚寡核苷酸部分互补,从而将cab附接到微粒上;以及
7)置换寡核苷酸(do),所述置换寡核苷酸具有2种功能:
a)含有荧光标签和
b)具有与ho互补并与ao序列重叠的序列,以便dab从ao释放,进而从微粒上释放。
组装了一种使用抗体的5-重clamp,其中抗体在常规夹心免疫测定中具有高度交叉反应,并确认clamp完全避免了交叉反应(图3e)。图3f示出了为5重clamp的标准曲线。
clamp用于分析人血清。缀合的抗体和条形码化微珠独立储存>1个月,clamp在血清中获得良好的psa加标恢复(未显示数据)。
在一个实施方案中,本文所述的clamp系统是10重细胞因子板。本文所包含的细胞因子是例如但不限于il1至il17、mcp1/3、tnf、egf/r及/或vegf/r。在另一实施例中,本文包含的clamp系统是专注于乳腺癌转移(针对例如但不限于her2、cea、p53及/或ca15-3)的10-=重板。
实施例2:clamp测定法结构。
根据一个实施方案,我们制备并测试了称为“clamp”的在微粒(mp)上进行的共定位-连接测定。clamp是一种多功能测定方法,旨在通过在一组条形码化mp上共定位和限制每个抗体对来消除试剂驱动的交叉反应(“rcr”),从而避免非同源抗体之间的相互作用(图14c)。寡核苷酸(oligo)作为可编程的构件来实现clamp的关键分子“操作”,包括(i)检测抗体(dab)的挠性连接,(ii)dab的按需释放,(iii)测定信号的转导,以及(iv)mp的荧光条形码化。这里,我们详细介绍了clamp试验的概念操作、实验验证和优化,并展示了其使用在传统msa中具有强烈交叉反应的试剂来消除rcr的功效。
在图14的d板和e板中分别示意性地说明了一个实施方案的结构和工作原理,在这里称为clamp测定。为了对每对抗体进行共定位,一个82nt钩链寡核苷酸(称为钩寡核苷酸,或“ho”)与是抗体(称为检测抗体或“dab”,)的检测试剂共价结合,并通过21bp的杂交体与捕获链寡核苷酸部分地杂交,所述捕获链寡核苷酸称为捕获寡核苷酸,该寡核苷酸与是抗体的称为捕获抗体(“cab”)包被的微粒(“mp”)的捕获试剂的表面结合。然而,cab在表面上是不可移动的,但dab由于ho的61nt单链结构域而具有挠性;这种挠性允许与分析物形成三重复合物(图14e)。抗体对的限制排除了不匹配抗体之间的相互作用,并恢复了每个mp上的单重测定配置,确保了单个交叉反应事件(例如,与非同源cab反应的靶分析物)不会导致夹心结合。抗体的先验共定位允许蛋白质的快速双重识别,但需要一种伴随的用于信号转导和生成的方法。一种方法是首先打破ho-co的连接。例如,通过光诱导或酶促裂解,或底部夹持介导的置换,然后,在清洗释放的dab-ho复合物后,标记留在表面的dab,以指示形成夹心。然而,无论是否存在靶分析物,连续的co-ho连接都会导致相dab的标记,从而增加背景信号。例如,3μmmp上2%的dab覆盖率相当于1000-5000dab,如果标记,可能会导致背景信号大幅增加,并严重阻碍敏感性检测。
为了减轻clamp测定中的这种影响,我们设计了一种检测方案,通过使用荧光标记的置换剂寡核苷酸(do)仅排除“成功”释放的缀合物,所述荧光标记的置换剂寡核苷酸与ho上的底部夹持的结构域结合,同时置换并标记它(图14e、图7)。重要的是,这种“置换-检测”是一种逻辑门,需要蛋白质双重捕获和dab释放才能检测到信号(图14f)。在本实施方案中,clamp试剂分两步组装在磁性mp上,受益于生物素-链霉亲和素键和watson-crick碱基配对的亲和力(图18)。第一步,将生物素化寡核苷酸和抗体的混合物共同固定到链霉亲和素包被的mp的表面上。标记的一步法性质提供了对co表面密度的精确控制(图19),同时允许通过使用多色分类染料的一锅法标记进行mp编码,如其他地方所述(dagher,m.等人,naturenanotechnology,vol.13,pp.925-932,2018)。第二步,通过ho-co杂交将dab-ho复合物拉下,以完成clamp的组装。
实施例3:clamp测定法优化。
我们首先通过置换未缀合的标记cy5的ho来优化底部夹持介导的置换反应的效率(图15)。用具有不同co浓度的mp将其拉下,然后用未标记的do将其释放。置换缓冲液中增加的离子强度(mnacl>500mm)有助于筛选带负电荷的寡核苷酸,并提高do与ho杂交和释放的效率。随着离子强度和溶解氧浓度的增加(mnacl~500mm和mdo=1μm),在较宽的co密度范围内,置换率达到98%。
接下来,我们通过测量在缓冲液中标记置换步骤后mp上的残余信号来研究抗体寡核苷酸缀合物对测定背景的影响(参见下文方法)。我们首先使用商业试剂盒(solulink)将ho与免疫球蛋白g(igg)缀合,产生约90%的抗体缀合物,平均每个igg有2个ho(即,λ~2)。使用这些缀合物,测定背景比未结合ho的测定背景大一个数量级(图16a)。背景信号的增加是由于多价ho缀合物引起的,其可导致dab-ho复合物(由于ho-co连接未断裂)未释放,该复合物通过将do与至少一个其它ho链杂交来标记,从而在不存在与蛋白质结合的夹心的情况下产生荧光信号(图16b)。减少多价dab-ho缀合至最低的一种有效方法是降低其平均缀合价,例如,以0.1的λ为靶标,泊松统计量表明<5%的dab将与多种ho结合。如此低的缀合价的代价是抗体结合率(10%)降低,这使得90%的抗体未反应。为了避免浪费未反应的抗体,我们研发了一种结合和纯化工作流程,以保持未结合抗体的天然状态,并允许其回收利用。调整dab和ho的相对浓度,并将其从1.25调节到0.1(图16c)。在不同co浓度的mp上,得到了不同价态的dab-ho缀合物。正如预期的那样,低价态显著降低了残留的测定背景,与0.1<λ<0.2(图16d)的未缀合ho显示的背景信号相匹配,导致多价态缀合物的低价态结合物少于8%。与多价态一致,增加co浓度会放大高价态dab-ho的高背景信号。
为了优化测定性能,我们调整了dab-ho密度。在clamp中,适当的局部dab浓度是敏感和高容量的夹心结合的关键,所述夹心结合在一定的ho长度下主要取决于dab-ho的表面密度和通过杂交捕获co的表面密度。使用低价态dab-ho缀合物和少于8%的多价缀合物制备了具有不同co密度的抗尿激酶纤溶酶原激活物(抗upaclamp)的clamp(图16d;参见下文方法)。用重组upa抗原连续稀释温育抗upaclamp,然后洗涤,用标记置换法检测。正如预期的那样,增加co浓度调节了测定的信噪比(snr),这揭示了大于1014m-2的密度对于足够的snr是必要的(图16e)。另一方面,大于1014m-2的密度几乎米有提高信噪,因为它们也导致背景信号增加。最后,为了评估缀合物价态对测定性能的重要性,我们比较了高价(λ~2,solulink)和低价缀合物(λ~=0.1,图16f)的抗-upa。低价缀合物使背景信号显著降低(10倍),相应地,检测限提高了3倍(图16f)。另一方面,由于夹心结合的dab-ho缀合物主要用单一染料标记,所以低价缀合物的荧光动态范围减小。总之,这些结果强调了缀合物价态对背景信号和测定性能的重要性。
实施例4:多重clamp测定
为了测试clamp在消除试剂驱动的交叉反应(“rcr”)方面的功效,我们根据一种实施方案筛选了多重clamp的测定特异性。此外,为了挑战clamp测定,我们选择了抗体对,这些抗体对在传统的多重夹心测定(“msa”)中一起使用时显示出不同类型的rcr。为此,针对6个靶点(epcam、psa、e-钙黏蛋白、egf、upa和mcp)的抗体对从我们之前在传统msa中对特异性和非特异性结合的35种蛋白质组中进行了筛选(dagher,m.等人,naturenanotechnology,vol.13,pp.925–932,2018)。对于传统的msa,特异性筛选包括用一池cab包被的条形码化mp温育每个单独的抗原,然后添加混合的dab鸡尾酒和二级抗体(“sab”)以分别用于检测和标记(图17a)。响应于抗原浓度为1ng/ml和100ng/ml的抗原浓度测量不同条形码的荧光性(图17b-c),发现了两种类型产生假阳性的非特异性结合,即抗原不加区分地粘附(观察到e-钙黏蛋白和upa)以及抗原和抗体之间的交叉反应性。另一方面,clamp测定的特异性筛选是通过多重clamp一次温育单种抗原并通过标记置换进行检测(图17d-图17f;参见下文方法)来执行的。传统msa中检测到的非特异性信号,除一种外,其余均采用clamp测定完全消除。例如,在传统的msa中,e-钙黏蛋白的普遍、非特异性结合(导致所有非靶向微珠上的信号)在clamp测定中无法检测到。相反,mcp-1抗体和egf抗原在100ng/ml时可检测到交叉反应性,无论是在传统msa还是clamp中。为了研究假阳性信号的来源,我们仅使用mcp-1抗体进行单重测定,分别以1ng/ml或100ng/ml的浓度加入mcp-1或egf(图17g)。单重mcp-1抗体检测egf显示dcr。事实上,这种dcr不能通过clamp或elisa来减轻,并且是一种弱亲和力结合物。总的来说,这些结果显示了clamp在多重测定中消除rcr以及以多重、组合的方式识别dcr的能力。最后,绘制了其余5种蛋白质的稀释曲线,并绘制了它们的snr,如图17h所示。
总之,我们成功地证明了clamp的使用,这是一种均匀的msa,它使用寡核苷酸预共定位mp上的抗体对。通过在样本温育期间将每个抗体对限制在其对应的mp中,可以在保持每个mp上的单重测定环境的同时实现多重化,这样可以消除试剂驱动的cr。值得注意的是,如果匹配抗体在测定开始时是分开的,则clamp中抗体的预共定位代表了与传统夹心免疫测定不同。为了检测正确的夹心结合,我们已经证明了标记置换剂寡核苷酸可以同时释放和标记dab复合物。我们研究并证明了使用单价抗体寡核苷酸缀合物避免来标记未释放复合物和增加背景信号的重要性。我们在实验上验证了该方法,无论是在单重还是多重中,并使用预先选择的5种cr抗体对来筛选复合物分析的特异性,证明clamp消除了传统msa中的所有rcr。
与当前可用的msa相比,clamp可以提供几个明显的优势。首先,clamp可以很容易地展开,因为它不需要专门的设备来读取或引入新的工作流程。其次,clamp可以是一种快速的测定方法,因为它可以在三个多小时内完成。最后,通过消除在溶液中温育检测抗体的需要(通常在高浓度下进行),clamp可以显著减少试剂消耗。由于其高度可扩展性和高效性,clamp可用于提供一种真正可扩展的多重elisa平台,该平台可满足生物标记物发现和药物开发的日益增长的需求。
实施例6:低抗体浓度使clamp测定法中的交叉反应最小化
传统的多重夹心免疫测定通常在溶液相中使用试剂混合物进行。具体地,将针对不同靶点的检测抗体(dab)混合在一起并应用于反应。这种dab混合物的应用导致假结合,并从难以区别于真正靶蛋白结合信号的非特异性结合事件(cab或dab与非靶向的分析物之间)产生假阳性信号。试剂驱动的cr的风险为~4n2,靶分析物的个数是n。
相反,在clamp的实施方案中,试剂(例如抗体)对可以预先组装并共定位在条形码化微粒上,以避免试剂混合。如本文所述,检测抗体(dab)仅在置换反应后以溶液形式释放。在一些实施方案中,为了避免在置换反应后对脱靶微珠进行重结合。以释放到溶液中的dab仍最佳地保持足够低的浓度。图16描绘了在置换步骤期间相对于溶液的起始量(y轴)和体积的dab浓度分布。传统elisa中的典型dab浓度为~1μg/ml(67nm),在足够长的温育时间内,当dab低至1nm时(例如在quanterix的simoa测定中)仍然可以发生结合。
为确保释放后避免脱离结合,理想情况下每种靶点的抗体量应保持在<10pm。在100微升的体积中,抗体的量<1摩尔。在clamp测定中,一些实施方案中,从1000个微粒中释放的ab量估计为0.1-1飞摩尔(图22)。这些数字表明,与需要基于自由扩散的试剂混合的其他方法相比,clamp系统释放的dab浓度显著降低。
实施例7:置换依赖性信号转导使clamp测定法中的背景信号最小化
在clamp共定位测定的一种实施方案中,两种抗体均预共定位在载体上,可通过检测释放和洗涤后残留在表面上的所有dab来执行信号转导。然而,任何未释放的钩形寡核苷酸-dab复合物都可能产生与分析物无关的信号,这显著地有助于背景噪声。因此,将认识到,为了避免增加背景信号,一些实施方案中,需要近乎完全的锚-钩置换以及清洗钩形寡核苷酸-dab复合物。
一些实施方案中,由于低效释放而导致的背景信号增加的问题可以通过置换依赖性信号转导机制来解决。这种机制将确保只有置换的钩形-锚链可检测到,因此,可能会由于无效置换而发生的非位置换的链不会产生背景信号。在此类实施方案中,仅当满足以下两种条件时才会发生分子水平的信号转导:(i)三重复合物的形成和(ii)钩-锚链的置换。
因此,在一些实施方案中,检测ab和钩链未被标记,并且使用标记(例如,荧光标记)的置换剂寡核苷酸发生置换。在本实施方案中,置换剂寡核苷酸可与钩链结合,该钩链优选地(i)将其从锚链中释放出来,(ii)对其进行标记。另一方面,非置换的钩形寡核苷酸未被标记,也不会对信号产生影响。该机制等效于and门,其中信号(输出)取决于置换(输入1)分析物的存在(输入2),如图23所示
为了证明置换依赖性信号转导的有效性,我们对il-7、ifn-γ和mmp-9进行了校正测定。在第一个试验中,置换剂寡核苷酸未标记,而小鼠dabs用抗小鼠bv421第二抗体靶向。标记bv421的第二抗体靶向的是dab,与是否释放无关,因此无论如何置换,都会进行标记。在第二个实验中,用cy5标记置换寡核苷酸,其测试了置换依赖性信号转导。如逻辑门表示图(图23)所示,将在条件(i)、(iii)、(iv)中引入bv421信号,但cy5信号仅在条件(iv)中出现。图24示出了通过使用这两种标记方法获得的示例性靶校准曲线。与cy5信号相比,bv421的信号背景显著提高,而在灵敏度和动态范围方面的测定性能随着标记置换(cy5)的提高而提高。
实施例8:低价态抗体-寡核苷酸使clamp测定中的背景信号最小化
在一些实施方案中,钩链和锚链是dna寡核苷酸。抗体-dna缀合可以例如通过靶向igg分子上的赖氨酸基团来执行。诸如磺基琥珀酰亚胺4-(n-马来酰亚胺甲基)环己烷-1-羧酸盐(磺基smcc)等异双功能接头可用于将巯基端接的dna与igg分子连接。然而,这种反应产生了一种异质缀合物,其中每个抗体的寡核苷酸的数量取决于反应期间的dna:抗体化学计量。多价缀合物(每个抗体有一个以上的寡核苷酸)可以降低置换效率,从而增加背景信号。
如图25a-b所示,我们调节了结合价态并通过sds-page对其测定,并使用所得的缀合物测定置换效率。高价态缀合物导致测定背景增加。如所预期,较高的锚链寡核苷酸密度导致背景信号进一步增加。为了确定高缀合物价态对信号背景的影响,我们使用置换依赖性检测机制进行了cla测定(图25c)。用高价(λ,avg,每个抗体寡核苷酸数~2)和低价缀合物(λ~0.1)生成upa校准曲线。较低的价态导致较低的背景和提高3倍的灵敏度。
实施例9:40重的交叉反应性表征
为了评估具有更高多重化的多重测定中的交叉反应,测试了一组40个靶点,其中将针对40个靶点的clamp混合物(如图26所示)混合在一起,并在缓冲液中温育,其中每孔中添加一个高浓度(100ng/ml)靶点(蛋白质标准物,典型重组)。对角线上的信号表明了正确抗原与其条形码化微粒对之间的特异性相互作用。只有少数脱靶信号是可测量的;但是,这些不是由于试剂的交叉反应。相反,抗原被认为与两种抗体发生交叉反应,因此单重elisa也可能很明显,如图17所示。
方法
材料和试剂。高效液相色谱纯化的寡核苷酸购自idt(coralville,ia,usa);序列和修饰如图11所示。cab、抗原和dab购自rndsystems(minneapolis,mn,usa),并在-20℃下保存长达36个月。链霉亲和素和蛋白质g磁性mp(m270)购自lifetechnologies(carlsbad,ca,usa)。
clamp的合成。将clamp分两步组装在在直径为2.7μm(m270链霉亲和素)的磁性mp上。第一步包括固定化抗体和寡核苷酸的生物素化混合物,使mp功能化,并同时对其进行编码,如别处所述(dagher,m.等人,naturenanotechnology,vol.13,pp.925–932,2018)。简单地说,将90pmol的生物素化寡核苷酸(co和so)和总共90pmol的lo(lo0-lo2)混合在25μlpbs+0.05%吐温20+300mmnacl(pbst0.05+nacl300)中。然而,每种lo0:lo1:lo2的比例设计为产生独特的集合荧光来限定条形码,而co:so的比例允许调节拉动的dab-ho的表面密度。混合物通过加热到80℃进行退火,并通过从热源中去除混合物来冷却至室温。接下来,将5μg生物素化的cab加入17μlpbst0.05+nacl300中,并与退火的寡核苷酸混合物混合。生物素化试剂随后通过在10μlpbst0.05+nacl300中添加3.25mmp并立即通过移液管混合,在mp上进行单步固定。将混合物在室温下以端对端混合方式温育90分钟,然后在150μlpbst0.1中通过磁积聚洗涤3次。条形码化和功能化的mp存储在4$c直到需要。第二步,将100,000份制备的mp与在pbst0.05+nacl300中稀释的ho溶液(例如dab-ho)混合30分钟。下拉ho后,在pbst0.01中清洗3次完全组装好的clamp,并在4℃下储存至测定时间长达一周。
clamp的表征。为了表征clamp,通过使用缀合有alexa-fluor647(af647)的抗山羊igg进行标记或者通过靶向ho的标记cy5的寡核苷酸(lo)杂交证实了抗体和寡核苷酸的固定化。如别处所述,通过使用多色荧光模型拟合多色mp的整体荧光响应来估计co的密度(dagher,m.等人,naturenanotechnology,vol.13,pp.925–932,2018)。为了确定特定clamp组的预期测定背景信号,将mp与1μm标记cy5的do在pbst0.05+nacl300中温育1小时,然后在pbst0.05中进行3次磁清洗,并通过细胞仪测定残余信号。
抗体寡核苷酸缀合、纯化和表征。抗upa单克隆抗体用腙化学法(solulink)与胺修饰的ho缀合,然后根据制造商的方案进行纯化。或者,使用异双功能胺/硫醇反应性交联剂将单克隆抗体与巯基端的ho缀合。首先将40μl的30μm硫醇修饰的ho在37℃下在pbst中的200mm二硫苏糖醇(dtt)中还原1小时。将还原寡核苷酸(i)使用zeba脱盐旋转柱(7kmwco,thermo)缓冲液交换成ph7.0的pbs,(ii)使用8μl的9mm磺基琥珀酰亚胺4-(n-马来酰亚胺甲基)环己烷-1-羧酸盐(磺基smcc)活化10分钟,溶解于80%pbsph7.0和20%无水二甲基二氧化硫,(iii)再次将缓冲液交换到ph7.0的pbs中,以去除多余的磺基smcc,(iv)1-10μl部分(取决于所需)与10μl的1mg/ml抗体反应。反应在室温下放置1小时,然后在4摄氏度下温育过夜。然后分别在抗体和dna纯化两步中纯化缀合物。
抗体寡核苷酸缀合、纯化和表征。使用腙化学(solulink)将抗upa单克隆抗体与胺修饰的ho结合,然后根据制造商的方案进行纯化。或者,使用异双功能胺/硫醇反应性交联剂将单克隆抗体与巯基端的ho缀合。首先将40μl的30μm硫醇修饰的ho在pbst中于37℃下在200mmdtt中还原1小时。将还原寡核苷酸(i)使用zeba脱盐旋转柱(7kmwco,thermo)缓冲液交换成ph7.0的pbs,(ii)使用8μl的9mm磺基琥珀酰亚胺4-(n-马来酰亚胺甲基)环己烷-1-羧酸盐(磺基smcc)活化10分钟,溶解于80%pbsph7.0和20%无水二甲基二氧化硫,(iii)再次将缓冲液交换到ph7.0的pbs中,以去除多余的磺基smcc,(iv)1-10μl部分(取决于所需的价态)与10μl的1mg/ml抗体反应。反应在室温下放置1小时,然后在4℃下温育过夜。缀合物经两种纯化步骤进行纯化。
单重和多重clamp测定。室温下在圆锥形底96孔板中进行温育,其中以950rpm水平摇动。将clamp以每μl每条形码约80mp混合,并用pbst0.05+nacl150+0.5%bsa(pbst0.05+nacl150+bsa0.5)封闭30分钟。将25μl封闭的多重clamp混合物等分试样加入每种孔中,并与含有特异性抗原的25μl溶液一起温育,所述抗原为pbst0.05+nacl150+bsa0.25中规定浓度的2倍,以950rpm振荡温育3小时。用150μl的pbst0.1进行磁聚集和洗涤,在30分钟内重复4次。最后,通过在pbst0.05+nacl300+bsa0.25中添加1μmdo-cy5并摇动温育1小时进行检测-置换,然后在pbst0.1中洗涤3次。
传统msa。为了筛选传统msa形式的特异性和非特异性结合,mp被条形码编码并在合成过程中与它们各自的生物素化cab结合。每次测定时,将mp混合物合并到每种条形码的最终浓度为2000mp。室温下,在圆锥形底96孔板中进行温育,950rpm水平摇动。在用测定试剂进行温育之前,首先用1%牛血清白蛋白和0.05%吐温20溶液在pbs中封闭mp一小时(pbst0.05)。在规定的抗原浓度下温育120分钟。bmp与dab混合物以2μg/ml温育60分钟,然后以4μg/ml的浓度与sab温育45分钟。通过从mfi信号中减去cab特异性特异性平均测定背景(n=6)并标准化为测定背景的全局标准差(即,跨所有条形码,n=210)来计算snrag。
读出并进行数据分析。通过带有蓝光(488nm)、红色(633nm)和紫罗兰色(405nm)激光的bd用facs-canto-ii细胞仪读取mp。在蓝色激光流动池中,fam和cy3分别采用530/30和585/42带通滤波器。在红色激光流动池中,cy5/af647分别采用660/20带通滤波器。mp使用matlab上实现的自动算法进行解码(dagher,m.等人,naturenanotechnology,vol.13,pp.925–932,2018)。所有数据分析在matlab中进行。利用前向散射强度和侧散射强度将单个颗粒与微珠状聚集体和其他颗粒区分开来,并实现了选通自动化。
虽然已经结合本发明的具体实施方案对本发明进行了描述,但是应当理解,本发明能够进一步修改,并且本申请旨在涵盖任何变化、使用或改编,包括本发明中已知或惯常做法范围内的对本发明的偏离,以及适用于上述基本特征的偏离,并在所附权利要求的范围内如下。
本文引用的所有文件和参考文献的内容通过引用全文并入本文。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



