产生纳米阵列和微阵列的方法与流程
 2021-02-02 17:02:25|
2021-02-02 17:02:25| 361|
361| 起点商标网
起点商标网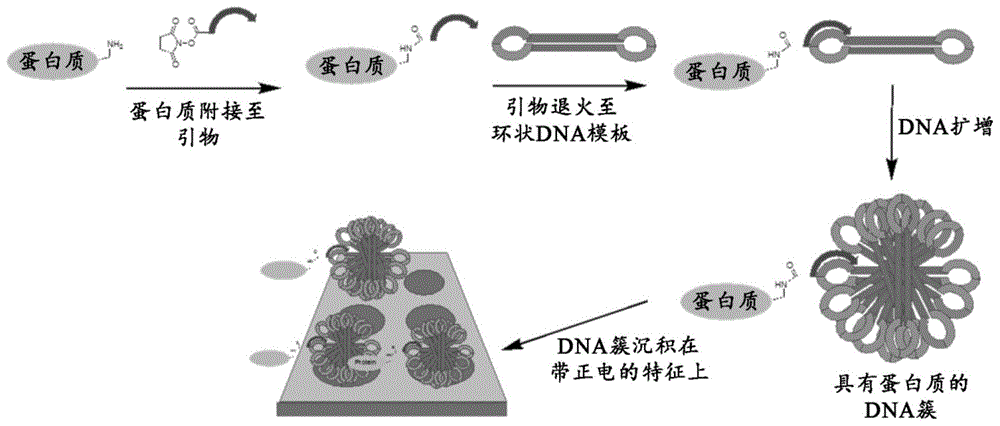
交叉引用
本申请要求于2018年4月4日提交的美国临时专利申请no.62/652,849的权益,将其通过引用整体并入本文。
背景技术:
微阵列和纳米阵列可用于评估生物实体和化学实体。设计纳米阵列和微阵列来适应特定评估可以是有益的。
技术实现要素:
本公开提供了用于分开生物实体和化学实体的方法和系统。
本发明的一个方面提供了一种组合物,其包含共价附接至蛋白质的结构化核酸颗粒(snap)。在一些情况中,所述snap附接至固体支持物。在一些情况中,所述snap共价附接至固体支持物。在一些情况中,所述snap非共价附接至固体支持物。
本发明的一个方面提供了包含共价附接至生物分子的snap的组合物。在一些情况中,所述snap附接至固体支持物。在一些情况中,所述snap共价附接至固体支持物。在一些情况中,所述snap非共价附接至固体支持物。
本发明的一个方面提供了一种组合物,其包含附接至多个结构化核酸颗粒(snap)的固体支持物,其中所述多个snap中的每一个附接至生物分子。在一些情况中,多个snap布置成阵列。
本发明的一个方面提供了一种将单蛋白质附接至固体支持物上的附接位点的方法,其中所述附接位点比所述蛋白质更大;所述方法包括将蛋白质共价附接至snap;其中所述snap的直径至少与附接位点的直径一样大;并将snap附接至附接位点。在一些情况中,所述多个蛋白质中的每一个附接至所述固体支持物上的附接位点;这样使得每个附接位点附接至单蛋白质。
本发明的一个方面提供了一种生物分子阵列,其包含附接至固体支持物的多个生物分子;其中多个生物分子中的每个生物分子共价附接至连接子,并且连接子附接至固体支持物;并且其中每个连接子附接至所述多个生物分子中的仅一个生物分子,并且每个连接子具有至少50nm的直径。
本发明的一个方面提供了一种从多个蛋白质产生空间上分开的蛋白质的阵列的方法,所述方法包括将多个蛋白质中的每个蛋白质共价附接至包含snap的核酸分子的末端,并将snap附接至固体支持物,从而产生空间上分开的蛋白质的阵列。
本发明的一个方面提供了包含蛋白质、snap和固体支持物的组合物;其中所述蛋白质与所述snap共价结合,并且其中所述蛋白质不接触所述固体支持物。
本发明的一个方面提供了一种产生在空间上分开的生物实体或化学实体的阵列的方法,所述方法包括:获得具有附接位点的固体支持物;获得包含多个生物实体或化学实体的样品;获得种子,每个种子都具有官能团;经由所述官能团将所述多个生物实体或化学实体中的每个生物实体或化学实体共价附接至单种子;使每个附接的种子生长为具有期望尺寸的snap;将所述snap附接至所述阵列的附接位点,从而产生在空间上分开的生物实体或化学实体的阵列。
在一些情况中,固体支持物是玻璃、二氧化硅、塑料、硅、金、金属、铬、钛、氧化钛、锡或氧化锡支持物。在一些情况中,固体支持物是光学不透明的。在一些情况中,固体支持物是光学透明的。在一些情况中,将所述固体支持物修饰为具有正电荷。在一些情况中,将所述固体支持物修饰为具有负电荷。在一些情况中,将所述固体支持物修饰为具有可以结合snap的官能团。在一些情况中,所述固体支持物包含附接位点,所述附接位点被修饰为不同于周围表面。在一些情况中,所述固体支持物包含附接位点的阵列。在一些情况中,每个附接位点与每个其他附接位点相距至少70nm。在一些情况中,每个附接位点与每个其他附接位点相距至少25nm。在一些情况中,任何两个附接位点的边缘之间的距离大于所用snap的半径。在一些情况中,任何两个附接位点的边缘之间的距离大于所用snap的直径。
在一些情况中,分子是蛋白质。在一些情况中,种子是寡核苷酸。
在一些情况中,寡核苷酸在3’末端被官能团修饰。在一些情况中,寡核苷酸在5’末端被官能团修饰。在一些情况中,官能团选自由以下组成的组:胺、硫醇、羧酸、三键、双键、环氧化物、炔烃、烯烃、环炔烃、叠氮化物、环辛炔、环炔烃、降冰片烯、四嗪、环辛烷、环氧化物和羟基。在一些情况中,寡核苷酸被修饰以包含可光裂解的键。在一些情况中,snap是通过滚环扩增形成。在一些情况中,snap是树枝状聚合物。在一些情况中,树枝状聚合物带正电,并且阵列上的附接位点带负电。在一些情况中,树枝状聚合物负电,并且阵列上的附接位点带正电。在一些情况中,snap的直径为约100nm。在一些情况中,snap的直径为约300nm。在一些情况中,snap的直径为约10nm至500μm。在一些情况中,snap的直径为约10nm至50μm。在一些情况中,snap的直径为约10nm至5μm。在一些情况中,snap的直径为约100nm至500nm。在一些情况中,snap通过静电相互作用粘附到固体支持物。
本发明的一个方面提供了一种实现分子的空间上分开的方法,所述方法包括:获得多个分子;获得种子,每个种子都具有官能团;经由所述官能团将所述多个分子中的每一个共价附接至单种子;使每个附接的种子生长为具有期望尺寸的snap;将所述snap附接至固体支持物,从而实现单分子的空间分开。
本发明的一个方面提供了单分子的阵列,每个单分子附接至期望尺寸的snap,所述snap经由附接位点附接至所述阵列。
本发明的一个方面提供了用于产生单分子的阵列的试剂盒,所述试剂盒包括:具有附接位点的阵列;种子,每个种子具有单附接位点;以及使所述种子生长成snap的试剂。
本发明的一个方面提供组合物,所述组合物包含固体支持物;以及直接附接至所述固体支持物的基于聚合物的分子,其中所述基于聚合物的分子包含基本上与所述固体支持物相对取向的蛋白质部分,并且其中所述蛋白质部分是亲和试剂可接近的。
本发明的一个方面提供了一种分开阵列上的生物实体或化学实体的方法,所述方法包括:产生多个snap;将单生物实体或化学实体与所述多个snap中的每个偶联;将所述多个snap附接至阵列,其中所述生物实体或化学实体与所述阵列基本相对,从而将所述多个snap中的每个snap的每个生物实体或化学实体基于所述多个snap中的每个snap的尺寸分开一定距离。
本发明的一个方面提供了一种分开分子的方法,所述方法包括将每个分子转化为更大的带电分子。
在一些情况中,将每个分子转化为更大的带电分子包括将分子缀合至可生长至期望尺寸的生物聚合物。
在一些情况中,将每个分子转化为更大的带电分子包括将每个分子转化为10倍大的分子。
在一些情况中,将每个分子转化为更大的带电分子包括将每个分子缀合至更大的带电分子。
本发明的一个方面提供了一种产生在空间上分开的生物实体或化学实体的阵列的方法,所述方法包括:获得具有附接位点的固体支持物;获得包含多个生物实体或化学实体的样品;获得snap,每个snap都具有官能团;将所述多个生物实体或化学实体中的每个生物实体或化学实体共价附接至单snap;将所述snap附接至所述阵列的附接位点,从而产生在空间上分开的生物实体或化学实体的阵列。
在一些情况中,snap是滚环扩增产物。在一些情况中,snap是质粒。在一些情况中,snap是dna折纸分子。在一些情况中,snap是核酸簇。
援引并入
本说明书中所提及的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入。
附图说明
本发明的新颖特征在所附权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述以及附图,将会对本发明的特征和优点获得更好的理解,在这些附图中:
图1a说明了通过结构化核酸颗粒(snap)将蛋白质附接至基质的示例方法,其中蛋白质共价附接至寡核苷酸引物,然后所述引物退火至包含内部互补性区域的环状dna模板,模板上引物的滚环dna扩增产生带有内部杂交区域的dna分子,导致形成dna簇(snap的示例),因为snap带负电,因此可以附接至固体支持物上带正电的附接位点。
图1b示出了将蛋白质附接至基质的可替代方法,其中snap首先形成,然后附接至蛋白质。
图1c示出了将蛋白质附接至基质的可替代方法,其中snap首先形成并共价附接至交联剂,所述交联剂然后再附接至蛋白质。
图1d示出了将蛋白质附接至基质的可替代方法,其中snap沉积在表面上,并且具有化学部分的蛋白质与snap的化学部分反应以将蛋白质附接至snap。
图2示出了用于产生具有以期望间隔排列的附接位点的固体支持物的方法。
图3a示出了实施例1中产生的snap的吸收光谱。
图3b示出了作为斑点印迹成像的snap的荧光强度。
图4示出了在实施例1中产生的snap的显微镜图像中snap和附接的深红色200nm珠的共定位。sybrgold用来可视化488nm的dna荧光和647nm的连接的深红色珠荧光,图像的区域被放大以显示细节,并且箭头指向共定位的示例。
图5示出了在阴离子交换纯化之前和之后的包含snap的样品中的颗粒的半径。
图6示出了在包含snap的样品的阴离子交换纯化期间收集的级分中检测到的强度。
图7示出了不同批次的snap在260nm迹线处的吸收光谱。
图8示出了芯片上小snap的共定位。
图9示出了芯片上没有大snap的共定位。
图10示出了将snap滴定法应用于芯片时的计数和所占用特征的数量。
图11示出了一批snap的亮度。
图12示出了使用opa测定法对snap浓度的测量。
图13示出了具有与叠氮化物-alexafluor568缀合前和缀合后的snap的芯片在488nm和568nm处的荧光图像。
图14示出了具有与叠氮化物-alexafluor568缀合前和缀合后的snap的芯片在488nm和575nm处的荧光图像的强度的量化。
图15示出了与叠氮化物-alexafluor568孵育前和孵育后,具有snap的芯片在488nm处的荧光图像。
图16示出了与叠氮化物-alexafluor568孵育前和孵育后,具有snap的芯片在568nm处的荧光图像。
图17示出了在与pe缀合的叠氮化物点击缀合之后在表面上具有snap的芯片的荧光图像。
图18示出了将来自大肠杆菌裂解物的蛋白质固定在具有被snap包衣的特征的阵列上。
图19示出了使用snap对短三聚体肽表位的短肽的特异性检测。
具体实施方式
具有多个空间上分布在固体支持物表面上并与之稳定缔合的分子的微阵列和纳米阵列正在成为生物分析和相关领域中越来越重要的工具。多肽和多核苷酸的微阵列已被开发出来,并在各种应用中得到使用,例如基因测序、监测基因表达、基因作图、细菌鉴定、药物发现和组合化学。微阵列尤其可用于的领域之一是基因表达分析。
在一些情况中,可能需要产生微阵列或纳米阵列,其中多个生物实体或化学实体在空间上分布在固体支持物的表面上并与之稳定缔合,使得每个单独的生物实体或化学实体在空间上与每个其他生物实体或化学实体分开。
在一些实施方案中,本公开提供了产生空间上分开的生物实体或化学实体的阵列的方法,所述方法可以包括:获得具有附接位点的固体支持物;获得包含生物实体或化学实体的样品;获得种子,每个种子都具有官能团;经由所述官能团将每个生物实体或化学实体共价附接至单种子;将每个附接的种子生长为具有期望尺寸的snap(结构化核酸颗粒);将所述snap附接至所述阵列的附接位点,从而产生生物实体或化学实体的规则阵列。在一些情况中,snap可以是任何类型的基于dna的纳米颗粒,例如基于滚环扩增的纳米颗粒、质粒或dna折纸纳米颗粒。
产生实体例如蛋白质的阵列的这种方法的示例在图1a-d中提供。图1a描绘了一种方法,所述方法开始于将蛋白质通过连接子与寡核苷酸引物附接。然后可以将引物退火至环状dna模板,然后进行滚环扩增以产生snap(在此示例中表示为dna簇)。然后可以将snap沉积到芯片上。在该示例中,dna主链的负电荷可以与阵列的带正电荷的特征相互作用,使得snap变得固定在阵列上。
图1b描绘了一种方法,所述方法以具有连接子的引物开始,所述引物启动使用环状dna模板的滚环扩增。所得snap(在该示例中表示为dna簇)因此包含连接子,所述连接子然后可以与蛋白质缀合。然后可以将snap沉积到芯片上。在该示例中,dna主链的负电荷可以与阵列的带正电荷的特征相互作用,使得snap变得固定在阵列上。
图1c描绘了一种方法,所述方法以引物开始,所述引物启动使用环状dna模板的滚环扩增。然后可以将所得snap(在该示例中表示为dna簇)与交联剂连接,所述交联剂然后可以与蛋白质缀合,以产生与蛋白质交联的snap。然后可以将snap沉积到芯片上。在该示例中,dna主链的负电荷可以与阵列的带正电荷的特征相互作用,使得snap变得固定在阵列上。
图1d描绘了已经通过例如滚环扩增或其他可接受的方法产生的snap。然后可以将这些snap沉积到芯片上。例如,dna主链的负电荷可以与阵列的带正电荷的特征相互作用,使得snap变得固定在阵列上。单独地,可以用可以与可位于snap上的化学部分结合的化学柄(handle)修饰蛋白质。然后可以将处理的蛋白质应用于snap,以使它们共价附接至snap。
在一些实施方案中,本公开提供了单分子的阵列以及用于产生单分子的阵列的方法和试剂盒。在一些实施方案中,本公开提供了生物实体或化学实体的阵列以及用于产生生物实体或化学实体的阵列的方法和试剂盒。在一些示例中,生物实体或化学实体的阵列可以包含排列在固体支持物上的有序系列的生物实体或化学实体。在其他示例中,生物实体或化学实体的阵列可以包含生物实体或化学实体的不规则阵列。
在一些示例中,阵列上的生物实体或化学实体可以分开小于10nm、约10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、120nm、140nm、160nm、180nm、200nm、250nm、300nm、350nm、400nm、450nm、500nm、550nm、600nm、650nm、700nm、750nm、800nm、850nm、900nm、950nm、1μm、1.2μm、1.4μm、1.6μm、1.8μm、2μm、2.5μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、16μm、17μm、18μm、19μm、20μm、25μm、30μm、40μm、50μm、75μm、100μm、200μm、300μm、400μm、500μm或大于500μm。在一些情况中,阵列上的生物实体或化学实体可以分开约50nm至约1μm、约50nm至约500nm、约100nm至约400nm、约200nm至约300nm、约500nm至约10μm、约50nm至约1μm、或约300nm至约1μm。在一些情况中,阵列上的生物实体或化学实体的间距可以通过排列在固体支持物上的附接位点的存在来确定。
在一些实施方案中,在固体支持物上产生阵列。固体支持物可以是分子可以共价或非共价附接的任何固体表面。固体基质的非限制性示例包括载玻片、装置的元件表面、膜、流动池、孔、腔室和宏观流体腔室。本文使用的固体支持物可以是平坦的或弯曲的,或者可以具有其他形状,并且可以是光滑的或有纹理的。在一些情况中,固体支持物表面可以包含微孔。在一些情况中,基质表面可以包含纳米孔。在一些情况中,固体支持物表面可以包含一个或多个微孔以及一个或多个纳米孔。在一些实施方案中,固体支持物可以由玻璃,碳水化合物例如右旋糖酐,塑料例如聚苯乙烯或聚丙烯,聚丙烯酰胺,乳胶,硅,金属例如金、铬、钛或锡,氧化钛,氧化锡或纤维素。在一些示例中,固体支持物可以是载玻片或流动池。
在一些实施方案中,可以修饰固体支持物的表面以允许或增强分子例如本文所述的snap的共价或非共价附接。用于分子附接的固体支持物和方法对于重复的结合、洗涤、成像和洗脱步骤优选是稳定的。在一些情况中,可以将表面修饰为具有正电荷或负电荷。在一些情况中,可以通过用特定官能团(例如马来酸或琥珀酸部分)修饰来使表面官能化,或者可以通过用化学反应性基团(例如氨基、硫醇或丙烯酸酯基团)修饰(例如通过硅烷化)来使表面衍生化。合适的硅烷试剂包括氨基丙基三甲氧基硅烷、氨基丙基三乙氧基硅烷和4-氨基丁基三乙氧基硅烷。所述表面可以用n-羟基琥珀酰亚胺(nhs)官能团官能化。玻璃表面还可以使用其他反应性基团,例如丙烯酸酯或环氧基,使用例如环氧硅烷、丙烯酸酯硅烷或丙烯酰胺硅烷衍生化。
在一些实施方案中,可以修饰固体支持物以减少snap与固体支持物的非特异性附接。在一些实施方案中,可以修饰固体支持物以减少生物实体和/或化学实体对固体支持物的非特异性附接。在一些实施方案中,固体支持物可以被钝化。在一些其他实施方案中,固体支持物的表面可以被钝化。在一些实施方案中,钝化层可包括类金刚石碳、六甲基二硅氮烷、特氟隆、碳氟化合物、诸如聚乙二醇(peg)和/或聚对二甲苯的聚合物。在一些实施方案中,可以通过聚乙二醇(peg)分子跨固体支持物的附接来钝化固体支持物。在一些实施方案中,可以使用鲑鱼精dna、二醇、白蛋白或以上的组合来钝化固体支持物。在一些实施方案中,可以使用一种或多种选自由鲑鱼精dna、二醇和白蛋白组成的组中的组分来钝化固体支持物。在一些实施方案中,钝化组分可以暴露于表面。在一些实施方案中,钝化组分可以不共价结合至表面。在一些实施方案中,钝化材料可以不共价结合至固体支持物。
在一些实施方案中,固体支持物可以在分子将要附接的整个表面上进行修饰。在其他实施方案中,固体支持物可包含经修饰以允许分子附接的区域和未经修饰的区域,或经修饰以减少分子附接的区域和未经修饰的区域,或经修饰以增加分子附接的区域和经修饰以减少分子附接的区域。在一些情况中,可以在阵列(例如有序阵列)中产生附接位点。
附接位点的有序阵列可以通过以下来产生:例如光刻、dip-pen纳米光刻、纳米压印光刻、纳米球光刻、簇光刻、纳米柱阵列、纳米线光刻、扫描探针光刻、热化学光刻、热扫描探针光刻、局部氧化纳米光刻、分子自组装、模版光刻或电子束光刻。可以定位有序阵列中的附接位点,使得每个附接位点与其他任何附接位点距离小于20纳米(nm)、或约20nm、约50nm、约75nm、约100nm、约125nm、约150nm、约175nm、约200nm、约225nm、约250nm、约275nm、约300nm、约325nm、约350nm、约375nm、约400nm、约425nm、约450nm、约475nm、约500nm、约525nm、约550nm、约575nm、约600nm、约625nm、约650nm、约675nm、约700nm、约725nm、约750nm、约775nm、约800nm、约825nm、约850nm、约875nm、约900nm、约925nm、约950nm、约975nm、约1000nm、约1025nm、约1050nm、约1075nm、约1100nm、约1125nm、约1150nm、约1175nm、约1200nm、约1225nm、约1250nm、约1275nm、约1300nm、约1325nm、约1350nm、约1375nm、约1400nm、约1425nm、约1450nm、约1475nm、约1500nm、约1525nm、约1550nm、约1575nm、约1600nm、约1625nm、约1650nm、约1675nm、约1700nm、约1725nm、约1750nm、约1775nm、约1800nm、约1825nm、约1850nm、约1875nm、约1900nm、约1925nm、约1950nm、约1975nm、约2000nm、或大于2000nm。
在一些情况中,可以根据要使用的snap的尺寸选择固体支持物上附接位点的间隔。例如,可以将附接位点的间隔选择为,使得任何两个附接位点的边缘之间的距离大于所使用的snap的直径。
在一些情况中,可以根据要使用的snap的尺寸选择固体支持物上附接位点的尺寸。例如,可以将附接位点的尺寸选择为,使得每个附接位点的直径小于所使用的snap的直径。
在一些情况中,可以在微孔或纳米孔中提供附接位点。
在一些情况中,官能团可以以随机的间隔存在并且可以以一浓度提供,所述浓度使得官能团与任何其他官能团距离平均至少约50nm、约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约650nm、约700nm、约750nm、约800nm、约850nm、约900nm、约950nm、约1000nm、或大于1000nm。
固体支持物可以被间接官能化。例如,固体支持物可以被peg化并且官能团可以被应用至全部peg分子或peg分子的子集。
在一些情况中,snap与固体支持物的附接效率可以是高的。在一些情况中,snap与固体支持物的附接效率可以是中等的。在一些情况中,snap与固体支持物的附接效率可以是低的。snap与固体支持物的附接效率可能受许多因素影响,该许多因素包括但不限于:簇的序列、snap相对于相应结合斑尺寸的尺寸、以影响结合的方式对snap结构修饰的程度、snap的寿命、与snap接触的一种或多种缓冲液的储存条件、snap的储存条件、希望在其中实现结合的溶剂的ph或产生极大影响的其他特性、正阳离子的百分比、和温度。在一些情况中,snap与固体支持物的附接可靠性可以是高的。在一些情况中,snap与固体支持物的附接可靠性可以是中等的。在一些情况中,snap与固体支持物的附接可靠性可以是低的。
在一些实施方案中,固体支持物可以是光学不透明的。在一些情况中,固体支持物在一个或多个波长下可以是光学透明的。在一些情况中,固体支持物可以是部分光学透明的,或者在某些区域可以是光学透明的。例如,固体支持物在未官能化的区域中可以是光学不透明的,并且在官能化的区域中可以是光学透明的。
图2示出了用于产生具有以期望间隔排列的附接位点的固体支持物的方法。首先,提供基质。在一些实施方案中,基质可以是玻璃。特别地,在一些实施方案中,基质可以是非晶玻璃、熔融二氧化硅或石英,以及其他示例。在一些实施方案中,基质可以是硅。在一些实施方案中,基质的厚度可以小于100微米、100微米、150微米、200微米、300微米、400微米、500微米、600微米、700微米、800微米、900微米、1毫米、2毫米或大于2毫米。
最初,例如用水虎鱼清洁来清洁基质。在一些实施方案中,可以使用强酸清洁基质,从而在不蚀刻基质的情况下清洁基质。在一些实施方案中,可以使用去污剂清洁基质。可替代地,可以用溶剂、超声处理或用诸如o2或n2等离子体的等离子体或其组合来清洁基质。
清洁基质后,将铬层沉积在基质的背面。沉积方法可以包括例如蒸镀或溅射。在一些实施方案中,当基质是不透明的时,可以不施加背面铬蒸镀。背面铬蒸镀的厚度可以是1埃、2埃、10埃、10纳米、20纳米、30纳米、40纳米、50纳米、60纳米、70纳米、80纳米、90纳米、100纳米、150纳米、200纳米、250纳米、300纳米、400纳米、500纳米或大于500纳米。可替代地,可以使用其他金属来沉积在基质的背面上,该其他金属例如铝、钨和/或钛,以及其他示例。可替代地,可以使用介质镜在基质的背面上进行沉积。
此外,可以在基质的正面上产生基准。可以通过添加至少一层材料并对该至少一层进行图案化来产生基准。在一些实施方案中,这种材料可以是铬,和/或这种材料可以是其他金属,例如钨或金。可替代地,可以使用介质镜作为用于基准的材料。可替代地,可以将金属氧化物用作基准,例如zro2。这种材料的图案化可以以多种方式进行。对基准材料进行图案化的第一种方法是沉积材料的覆盖层,然后在选定区域中保护该材料,并在不受保护的区域中去除该材料。例如,这可以通过以下来实现:用光敏材料(例如光刻胶)包衣基质的前侧面,通过掩模将光刻胶暴露于uv光然后对光刻胶进行显影来对该光刻胶进行图案化。然后可以通过湿法蚀刻(例如酸)或干法蚀刻(例如反应性离子蚀刻,rie)来执行基准材料的蚀刻。可替代地,可以首先使光刻胶沉积和图案化。在首先使光刻胶沉积和图案化的一些实施方案中,限定没有这种光刻胶的区域,然后可以将基准材料沉积在光刻胶的顶部。然后可以去除光刻胶(例如,在超声处理情况下的溶剂浴中),并且可以将基准材料留在最初没有光刻胶的区域上(例如,使用剥离技术)。可替代地,可以通过在选定区域中从基质去除材料,例如通过对基质正面上的光刻胶层进行图案化,然后对未包衣光刻胶的区域中的基质进行干法刻蚀来产生基准。在另一个可替代方案中,基准可以通过局部修饰基质来定义(例如通过激光熔化和/或分馏)。基准可以有各种形状、线条和/或取向。在一些实施方案中,可以将基准的图案应用到基质上。在又一个实施方案中,基准的形状可以变化,以便编码关于它们在基质表面上的位置的信息。
一旦在基质的正面上产生了基准图案,就可以对该正面进行不同的包衣,以限定可以将目的生物学对象(例如与蛋白质共价附接的核酸簇)固定的特征。在第一实施方案中,可以用两种硅烷(例如,在场中用hmds或peg-硅烷并且在固定点上用aptes)对表面进行不同的图案化。例如,通过在表面上沉积初始的hmds层,然后是剥离层,然后是任选的抗反射层,然后是光刻胶层,来实现这种差异图案化。在一些实施方案中,当使用不透明基质时,可以不提供抗反射层。
一旦施加了光刻胶,就可以提供第二光刻步骤。特别地,可以提供期望的特征。在一些实施方案中,期望的特征可以具有约300nm的长度。在一些实施方案中,特征可以具有小于50nm、100nm、150nm、200nm、250nm、300nm、350nm、400nm、450nm、500nm、600nm、700nm或大于700nm的长度。在一些其他实施方案中,可以不通过该第二光刻的显影步骤来蚀刻沉积在表面上以执行该第二光刻的一个或多个层(例如,抗反射包衣)。
在提供背面包衣的实施方案中,可以例如通过使用湿法蚀刻或干法蚀刻等来去除背面包衣。此外,可以提供定向反应性离子蚀刻(rie)以便去除通过光刻步骤尚未去除的层(例如抗反射包衣)。
一旦提供了孔,就可以进行清洁。如图2所示,提供了氧等离子体清洁和活化步骤。一旦清洁了芯片,就可以提供氨基-硅烷沉积。一旦提供了氨基-硅烷沉积,就可以例如使用热dmf剥离芯片制品的部分。此外,可以执行超声处理步骤。所得芯片可在流动池中用于生物学测定的评估。
在一个可替代实施方案中,可以用硅烷层和金属层(例如,在固定点上用(3-氨基丙基)三乙氧基硅烷(aptes)并且在场中用铬)对表面进行差异图案化。在另一个实施方案中,可以用硅烷层和金属氧化物层(例如,在场中用peg-硅烷层并且在固定点上用zro2层)对表面进行差异图案化。在又另一个实施方案中,可以在固定点上用硅烷层(例如,酰基蛋白硫代酯酶(apts))并且在场中用金属氧化物层(例如zro2)和peg-膦酸层对表面进行差异图案化。
本公开的生物实体或化学实体可以是需要空间上分开的任何生物实体或化学实体。在一些实施方案中,生物实体或化学实体是蛋白质。在一些情况中,蛋白质可以是来自细胞或组织匀浆,来自生物流体或来自环境样品的蛋白质。在一些情况中,生物实体或化学实体可以是抗体。在一些实施方案中,生物实体或化学实体是核酸。例如,生物实体或化学实体可以是dna、rna、mrna、trna或mirna。在一些实施方案中,生物实体或化学实体是碳水化合物。在一些实施方案中,生物实体或化学实体是复合聚合物。在一些实施方案中,生物实体或化学实体是小分子,例如化合物而不是复合聚合物。
本公开的生物实体或化学实体可以附接至种子。这些种子是可以用作生长较大聚合分子的起始“种子”的分子。种子可以是能够生长成聚合物的单体,或者可以包含能够生长成聚合物的单体。通常,种子是可以共价附接至分子的分子。种子可以具有极性,使得种子中仅一个官能团能够结合至待分开的多个分子中的分子,而种子的另一个或多个官能团可以形成聚合物的起始点。
种子中可以存在的单体的示例包括但不限于寡核苷酸、碳水化合物、蛋白质、淀粉样蛋白、原纤维和三角形四肽重复体。在一些情况中,种子是小分子。
种子可以包含单体和能够结合要分开的生物实体或化学实体的官能团。此类官能团的示例可包括但不限于胺、硫醇、羧酸、三键、双键、环氧化物、炔烃、烯烃、环炔烃、叠氮化物、环辛炔、环炔烃、降冰片烯、四嗪、环辛烷、环氧化物和羟基。在一些情况中,种子可以包含与点击化学相容的官能团。在一些情况中,种子还可以在种子和官能团之间包含连接子或间隔子。在一些情况中,连接子或间隔子可以包含光可裂解的键。在一些情况中,种子可以包含与5’末端的氨基缀合的寡核苷酸。在一些情况中,种子可以包含与5’末端的点击化学组分缀合的寡核苷酸。
在一些情况中,生物缀合可用于在两个分子之间形成共价键,其中两个分子中的至少一个是生物分子。生物缀合可以形成但不限于经由化学缀合、酶促缀合、光缀合、热缀合或其组合。(spicer,c.d.,pashuck,e.t.,&stevens,m.m.,achievingcontrolledbiomolecule–biomaterialconjugation.chemicalreviews.,2018,118,pgs.7702-7743,和gregt.hermanson,“bioconjugatetechniques”,academicpress;第3版,2013,对于本公开通过引用并入本文)。在一些情况中,种子和生物实体(例如snap)或化学实体都可以被官能化。使两个配偶体官能化可以提高缀合反应的效率或速度。例如,可以对种子、生物实体或化学实体的化学活性位点的巯基(-sh)或胺(-nh2)进行官能化,以允许缀合反应的更大反应性或效率。各种巯基反应性(或硫醇反应性)或胺缀合化学中的任何一种都可用于将化学部分与巯基或胺基偶联。示例包括但不限于使用卤代乙酰基、马来酰亚胺、氮丙啶、丙烯酰基、芳基化剂、乙烯基砜、吡啶基二硫化物、tnb-硫醇和/或其他巯基反应性/胺反应性/硫醇反应性试剂。这些基团中的许多通过烷基化(例如,通过形成硫醚或胺键)或二硫键交换(例如,通过形成二硫键)与巯基缀合。关于生物缀合反应的更多策略和细节在下面描述,并且可以扩展到其他合适的生物分子。
生物缀合可以部分地通过化学部分或连接子分子与生物分子上的化学活性位点的化学反应来完成。化学缀合可通过以下进行:酰胺形成反应、还原胺化反应、n-末端修饰、硫醇迈克尔加成反应、二硫化物形成反应、铜(i)催化的炔-叠氮化物环加成(cuaac)反应、应变促进的炔-叠氮化物环加成反应(spaac)、应变促进的炔-硝酮环加成(spanc)、逆电子需求狄尔斯-阿尔德(iedda)反应、肟/腙形成反应、自由基聚合反应或其组合。酶介导的缀合可通过转谷氨酰胺酶、过氧化物酶、分选酶、spytag-spycatcher或其组合进行。光缀合和活化可以通过光丙烯酸酯交联反应、光硫醇-烯反应、光硫醇-炔反应或其组合来进行。在一些情况中,缀合可以通过非共价相互作用进行,这些非共价相互作用可以通过自组装肽、结合序列、宿主-客体化学、核酸或其组合来进行。
在一些情况中,可以采用位点选择性方法来修饰生物分子的反应部分,以提高缀合效率、易用性和可重复性。位点选择性生物缀合通常采用三种常见策略(i)修饰策略,其可以从许多中选择单基序,而不是针对通用的反应性柄。这可以通过周围序列、局部环境或反应性的细微差异来确定。酶修饰蛋白质序列或聚糖中单位置处的特定氨基酸的能力尤为突出。表现出优异的化学选择性的反应也属于此类,例如针对聚糖异头物位置或蛋白质n末端的独特反应性的反应。(ii)可以利用通过劫持天然生物合成途径进行非天然官能性的位点特定性掺入。(iii)可以利用通过化学合成的独特反应性的安装。肽和寡核苷酸的完全或部分合成是普遍的,特别是使用固相方法。这些技术允许接近多达100个氨基酸或200个核苷酸的序列,并具有通过精确的位置控制来安装各种官能化单体的能力。
在一些情况中,化学缀合技术可用于创建生物材料-生物分子缀合物。用于生物缀合的官能团对于生物分子可以是天然的或可以是合成地并入的。在以下说明中,r和r'可以是生物分子(例如但不限于:snap、蛋白质、核酸、碳水化合物、脂质、代谢物、小分子、单体、低聚物、聚合物)和/或固体支持物。
在一些情况中,还原胺化可用于生物缀合。胺可以与醛发生可逆反应,形成瞬态亚胺部分,并伴有水的消除。该反应在快速平衡下进行,其中由于水的高浓度,未缀合的起始材料在水性条件下强烈有利。但是,在第二步中,不稳定的亚胺可以通过用氰基硼氢化钠处理而被不可逆地还原为相应的胺。这种温和的还原剂即使在未反应的醛存在下也能够选择性还原亚胺。结果,可以逐渐发生生物分子不可逆缀合至目的生物材料。相反,更强的还原剂,例如硼氢化钠也能够还原醛。此两步还原胺化过程也可用于酮的修饰。例如,还原胺化因此已主要用于修饰经高碘酸钠处理的藻酸盐和壳聚糖骨架。通过利用以开链形式产生的末端醛/酮,对于还原糖的附接,反应顺序也可以颠倒。例如,可以分别通过麦芽糖和乳糖的还原胺化,利用该策略来模仿ecm中天然胶原的糖基化和半乳糖基化模式。
在一些情况中,生物分子或固体支持物的异硫氰酸酯可用于生物缀合。例如,生物分子的异硫氰酸酯可与亲核试剂如胺、巯基、酪氨酸侧链的酚盐离子或其他生物分子反应,以在两个分子之间形成稳定的键。
在一些情况中,生物分子或固体支持物的异氰酸酯可用于生物缀合。例如,异氰酸酯可与含胺分子反应以形成稳定的异脲键。
在一些情况中,生物分子或固体支持物的酰基叠氮化物可用于生物缀合。例如,酰基叠氮化物是可以与伯胺反应形成酰胺键的活化的羧酸酯基团。
在一些情况中,生物分子或固体支持物的酰胺可用于生物缀合。例如,反应性n-羟基琥珀酰亚胺(nhs)酯的使用特别广泛。尽管可以预形成nhs-酯,但通常它们反而可以通过使用n-(3-(二甲基氨基)丙基)-n'-乙基碳二亚胺(edc)偶联化学原位生成,并直接与目标物质偶联。尽管在弱酸性条件下(ph约5)有利于形成活化的nhs-酯,但随后的酰胺偶联在较高的ph下会加速,而在该ph下不会使胺偶联配偶体发生质子化。在约6.5的中等ph值下的一步修饰是可能的。缀合通常如下进行:先在ph5下形成活性nhs-酯,然后再将ph升高至约8并以两步程序添加胺偶联配偶体。在一些情况中,可以使用水溶性衍生物磺基-nhs作为替代。在一些情况中,生物分子的nhs酯可以与和n末端α-胺和赖氨酸侧链ε-胺相对的酪氨酸、丝氨酸和苏氨酸-oh基团发生反应并偶联。
在一些情况中,生物分子或固体支持物的磺酰氯可用于生物缀合。例如,磺酰氯化合物与含伯胺的分子的反应进行伴随氯原子的损失和磺酰胺键的形成。
在一些情况中,生物分子或固体支持物的甲苯磺酸酯可用于生物缀合。例如,包含甲苯磺酸酯的反应性基团可以由4-甲苯磺酰氯(也称为甲苯磺酰氯或tscl)与羟基反应生成磺酰基酯衍生物而形成。磺酰基酯可与亲核试剂偶联以产生共价键,并可导致与伯胺的仲胺键、与巯基的硫醚键或与羟基的醚键。
在一些情况中,生物分子或固体支持物的羰基可用于生物缀合。例如,羰基如醛、酮和乙二醛可与胺反应形成席夫碱中间体,其与其游离形式处于平衡状态。在一些情况中,向含有醛化合物和含胺分子的反应介质中添加硼氢化钠或氰基硼氢化钠会导致席夫碱中间体的还原和共价键的形成,从而在两个分子之间形成仲胺键。
在一些情况中,生物分子或固体支持物的环氧化物或环氧乙烷可用于生物缀合。例如,生物分子的环氧化物或环氧乙烷基团可以通过开环过程与亲核试剂反应。所述反应可以用伯胺、巯基或羟基发生,以分别生成仲胺键、硫醚键或醚键。
在一些情况中,生物分子或固体支持物的碳酸酯可用于生物缀合。例如,碳酸酯可以与亲核试剂反应形成氨基甲酸酯键,即二琥珀酰亚胺基碳酸酯,可用于活化含羟基的分子以形成胺反应性琥珀酰亚胺基碳酸酯中间体。在一些情况中,该碳酸酯活化程序可用于将聚乙二醇(peg)与蛋白质和其他含胺分子偶联。在一些情况中,亲核试剂(例如蛋白质的伯氨基)可以与琥珀酰亚胺基碳酸酯官能团反应,形成稳定的氨基甲酸酯(脂肪族尿烷)键。
在一些情况中,生物分子或固体支持物的芳基卤化物可用于生物缀合。例如,芳基卤化物例如氟苯衍生物可用于与含胺分子例如蛋白质形成共价键。氨基酸侧链的其他亲核试剂(如硫醇、咪唑基和酚酸酯基团)也可以反应形成与生物分子或固体支持物的稳定键。在一些情况中,氟苯型化合物已经用作同双官能交联剂中的官能团。例如,它们与胺的反应涉及氟原子被胺衍生物亲核取代,产生经取代的芳基胺键。
在一些情况中,生物分子或固体支持物的酰亚胺酯可用于生物缀合。例如,蛋白质的α-胺和ε-胺可通过与同双官能酰亚胺酯反应而被靶向和交联。在一些情况中,将两个蛋白质用双官能酰亚胺酯交联剂缀合后,过量的酰亚胺酯官能团可以用乙醇胺封闭。
在一些情况中,碳二亚胺可用于生物缀合。通常,碳二亚胺是零长度交联剂,其可用于分别介导羧酸酯基团与胺之间或磷酸酯和胺之间的酰胺或氨基磷酸酯键的形成。碳二亚胺是零长度试剂,因为在形成这些键时,在缀合分子之间没有引入其他化学结构。在一些情况中,n-取代的碳二亚胺可与羧酸反应形成高反应性的o-酰基异脲衍生物。然后,该活性物质可以与亲核试剂例如伯胺反应形成酰胺键。在一些情况中,巯基可攻击活性物质并形成硫酯键。在一些情况中,还可以使用碳二亚胺介导的反应将含酰肼的化合物与羧酸酯基团偶联。使用双官能酰肼试剂,可将羧酸酯修饰为具有能够与其他羰基化合物缀合的末端酰肼基团。
在一些情况中,还可以通过使用碳二亚胺介导的反应,将含磷酸酯基团(如寡核苷酸的5′磷酸酯)的生物分子与含胺分子缀合。例如,生物分子的碳二亚胺可将磷酸酯活化成中间体磷酸酯,类似于其与羧酸酯的反应。在胺存在下,酯反应形成稳定的氨基磷酸酯键。
在一些情况中,生物分子或固体支持物的酸酐可用于生物缀合。酸酐对亲核试剂具有高反应性,并且能够酰化蛋白质和其他生物分子的许多重要官能团。例如,能够与酸酐反应的蛋白质官能团包括但不限于n末端的α-胺、赖氨酸侧链的ε-胺、半胱氨酸巯基、酪氨酸残基的酚盐离子、和组氨酸的咪唑基环。在一些情况中,蛋白质分子中酸酐的反应位点是任何附接的碳水化合物链的修饰。在一些情况中,除了多肽链中的氨基修饰外,糖蛋白还可在其多糖羟基上修饰以形成酯化衍生物。
在一些情况中,生物分子或固体支持物的氟苯基酯可用于生物缀合。氟苯基酯可以是可以与胺反应的另一种类型的羧酸衍生物,由氟苯酚化合物的酯组成,这样形成能够与蛋白质和其他分子形成酰胺键的基团。在一些情况中,氟苯基酯可能是:五氟苯基(pfp)酯、四氟苯基(tfp)酯或磺基四氟苯基(stp)酯。在一些情况中,氟苯基酯与含胺分子在弱碱性ph值下反应,以产生与nhs酯相同的酰胺键。
在一些情况中,生物分子或固体支持物的羟甲基膦可用于生物缀合。具有羟甲基取代基的膦衍生物可以充当生物缀合试剂,用于偶联或交联目的。例如,三(羟甲基)膦(thp)和β-[三(羟甲基)膦基]丙酸(thpp)是小的三官能化合物,其与亲核试剂例如胺自发反应以形成共价键。
在一些情况中,生物分子或固体支持物的硫醇反应性可用于生物缀合。例如,半胱氨酸的硫醇基是在20种蛋白原氨基酸中发现的最亲核的官能团。通过仔细控制ph,可以轻松实现对其他亲核残基例如赖氨酸的选择性修饰。另一个示例,寡核苷酸的硫醇修饰可用于实现衍生化,尽管可以安装具有增强的化学正交性的替代性反应性柄的简便性限制了用于生物材料缀合。此外,硫醇与α,β不饱和羰基的缀合加成(也称为迈克尔加成)可用于在组织工程、功能材料和蛋白质修饰领域中形成多肽缀合物。通常,反应速度和缀合效率主要受三个因素控制,可以根据需要进行修饰:(i)硫醇的pka;(ii)迈克尔受体的亲电性;(iii)催化剂的选择。关于(i):硫醇根阴离子是迈克尔加成过程中的活性亲核试剂,硫醇发生去质子化的倾向可以决定硫醇根的浓度,并且从而决定反应速率。例如,与芳族硫醇的脂肪族对应物相比,芳族硫醇的较低的pka导致较高的反应速率,而弱碱可用于催化该。结果,局部结构可以显著改变缀合效率,特别是对于多肽基质。可以通过合理选择周围氨基酸来显著改变含半胱氨酸的肽的pka和反应性,带正电荷的氨基酸(例如赖氨酸和精氨酸)的存在会降低硫醇pka并且从而增强反应性。关于(ii):迈克尔受体变得更加缺乏电子,对亲核性攻击变得更加活跃,因此反应速率增加。在生物材料领域中使用最广泛的受体中,反应性的趋势可以概括为:马来酰亚胺>乙烯基砜>丙烯酸酯>丙烯酰胺>甲基丙烯酸酯。关于(iii),迈克尔加成可以通过碱性或亲核催化来加速(尽管两者都通过增加活性硫醇盐的浓度来起作用)。
在一些情况中,可以利用硫醇的独特亲核性与许多可替代的亲电试剂进行选择性反应,这允许实现高效且选择性的生物分子附接。例如,一种这类基团是α-卤代羰基,其中碘乙酰胺类试剂特别有用。使用更少的亲电子溴甚至氯衍生物可以实现更高的硫醇选择性,尽管反应性也大大降低。最近,甲基磺酰基杂芳族衍生物已经成为有希望的用于硫醇特异性缀合的试剂。在其他情况中,可以使用可替代的硫醇反应性柄,例如二硫桥联哒嗪二酮、羰基丙烯酸试剂和环丙烯基酮进行生物缀合。
在一些情况中,生物分子或固体支持物的巯基可用于生物缀合。在一些情况中,可以使用三种形式的活化卤素衍生物来生成巯基反应性化合物:卤代乙酰基、苄基卤化物和烷基卤化物。在这些化合物的每一种中,卤素基团可以容易被攻击性亲核物质取代而形成具有hx损失的烷基化衍生物(其中x是卤素,并且氢来自亲核试剂)。卤代乙酰基化合物和苄基卤化物通常是碘或溴的衍生物,而卤代芥主要采用氯和溴的形式。碘乙酰基也已成功用于将亲和配体与色谱支持物偶联。
在一些情况中,生物分子或固体支持物的马来酰亚胺可用于生物缀合。马来酰亚胺的双键可以与巯基进行烷基化反应以形成稳定的硫醚键。
在一些情况中,生物分子或固体支持物的氮丙啶可用于生物缀合。该杂环的高度受阻性质使其对亲核试剂具有很强的反应性。例如,巯基会在开环过程中与含氮丙啶的试剂反应,形成硫醚键。最简单的氮丙啶化合物乙烯亚胺可用于将可用的巯基转化为胺。在一些情况中,经取代的氮丙啶可用于形成同双官能和三官能交联剂。
在一些情况中,由于生物分子基质的价值,硫醇-马来酰亚胺反应对于在低浓度下进行缀合或在需要极高效率时特别有用。通过用双官能试剂(琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯,更通常简称为smcc)修饰胺而容易地将马来酰亚胺引入广泛的支架材料中,进一步增强了马来酰亚胺在生物缀合中的用途。例如,该试剂已被广泛用于首先在所选的生物材料上引入马来酰亚胺反应性柄,然后使肽和生长因子均能附接以产生生物活性骨架。
在一些情况中,生物分子或固体支持物的丙烯酰基可用于生物缀合。反应性双键能够与巯基进行另外的反应。在一些情况中,丙烯酰基化合物与巯基的反应在产生稳定的硫醚键的情况中发生。在一些情况中,已发现丙烯酰基用于巯基反应性荧光探针6-丙烯酰基-2-二甲基氨基萘的设计中。
在一些情况中,生物分子或固体支持物的芳基可用于与巯基的生物缀合。尽管芳基卤化物通常用于修饰含胺分子以形成芳基胺衍生物,但它们也可以非常容易地与巯基反应。例如,氟苯型化合物已经用作同双官能交联剂中的官能团。它们与亲核试剂的反应涉及双分子亲核取代,从而导致氟原子被巯基衍生物取代并产生经取代的芳基键。与巯基形成的缀合物可通过用过量的硫醇(例如dtt)裂解来逆转。
在一些情况中,生物分子或固体支持物的二硫化物基团可用于生物缀合。在一些情况中,含有二硫化物基团的化合物能够参与跟另一硫醇的二硫化物交换反应。二硫化物交换(也称为互换)过程涉及硫醇对二硫化物的攻击,破坏-s–s-键,随后形成包含一部分原始二硫化物化合物的新混合二硫化物。使用含硫醇的还原剂将蛋白质中的二硫化物基团还原为巯基是通过混合二硫化物的中间体形成进行的。在一些情况中,交联或修饰反应可使用二硫化物交换过程以与含巯基的分子形成二硫化物键合。
在一些情况中,二硫键可用于生物缀合。例如,使用二硫化物交换反应可以有利于引入目标肽或蛋白质。组织工程中最常用的试剂是基于反应性吡啶基硫代二硫化物,其快速进行硫醇交换以释放出亲核性差且具有光谱活性的2-巯基吡啶。另外,由于二硫键形成的可逆性,可以通过添加还原剂(例如二硫苏糖醇(dtt)或谷胱甘肽)以时间精度控制裂解。
在一些情况中,吡啶基二硫醇官能团可用于构建用于生物缀合的交联剂或修饰剂。吡啶基二硫化物可以通过2-亚氨基硫杂环戊烷与4,4′-二吡啶基二硫化物串联反应从分子上的可用伯胺生成。例如,蛋白质或其他生物分子、2-亚氨基硫杂环戊烷和4,4′-二吡啶基二硫化物之间的同时反应在一个步骤中产生包含反应性吡啶基二硫化物基团的修饰。吡啶基二硫化物将容易与游离巯基发生交换反应,从而生成单一的混合二硫化物产物。
在一些情况中,被离去基团5-硫代-2-硝基苯甲酸活化的巯基可用于通过与本文所述的吡啶基二硫化物类似的二硫化物互换来偶联游离硫醇。ellman试剂的二硫化物容易与游离巯基进行二硫化物交换,形成混合二硫化物,同时释放出一分子发色物质5-硫基-2-硝基苯甲酸酯,也称为5-硫代-2-硝基苯甲酸(tnb))。tnb-硫醇基团可以再次与含巯基的靶分子发生互换,从而产生二硫化物交联。与巯基化合物偶联后,tnb基团被释放。
在一些情况中,可以使用含硫醇的化合物(例如tcep、dtt、2-巯基乙醇或2-巯基乙胺)进行二硫化物还原。
在一些情况中,生物分子或固体支持物的乙烯基砜基团可用于生物缀合。例如,已使用硫醇与活化乙烯基砜的迈克尔加成形成生物分子-材料缀合物,这表明半胱氨酸封端的肽可以交联乙烯基砜官能化的多臂peg以形成蛋白酶反应性水凝胶,从而实现在组织生长过程中的细胞侵入。在一些情况中,除硫醇外,乙烯基砜基团也可在较高的ph条件下与胺和羟基反应。硫醇与乙烯基砜的反应产物给出单一的立体异构体结构。另外,含有乙烯基砜的交联剂和修饰剂可用于活化表面或分子以含有硫醇反应性基团。
在一些情况中,含硫醇的生物分子可以与金属离子和金属表面相互作用以形成用于生物缀合的配价键。在一些情况中,含氧和含氮的有机或生物分子可用于螯合金属离子,例如以各种镧系元素螯合物、双官能金属螯合化合物和febabe。此外,蛋白质中的氨基酸侧链和辅基经常通过与作为活性中心的一部分的金属离子配位来形成生物无机基序。
在一些情况中,硫醇有机化合物可常规用于包衣金属表面或颗粒,以形成生物相容性层或产生用于进一步缀合生物分子的官能团。例如,含硫醇的脂肪族/peg连接子已用于在平面金表面和颗粒上形成自组装单层(sam)。
在一些情况中,许多可替代的偶联系统可用于生物分子官能化。这些包括使用o-硝基苯基酯(其在水性条件下稳定性降低)或1,1′-羰基二咪唑(cdi)以形成胺桥联氨基甲酸酯键而不是酰胺。在edc/nhs介导的偶联过程中,肼也可以用于代替胺。肼官能化的肽可以在ph值为5-6下在单一步骤中与生物材料偶联。这样,可以对存在的赖氨酸残基达到一定程度的位点选择性。madl及其同事已成功实施了此方法,以将反应性基团缀合至藻酸盐水凝胶,从而使得能够利用生长因子和粘附肽进行间接官能化。
在一些情况中,生物分子的n末端修饰可用于生物缀合。例如,2-吡啶甲醛修饰的丙烯酰胺水凝胶可与ecm蛋白的n末端特异性反应,形成带有相邻酰胺键的环状咪唑啉酮产物,并能够实现这些关键的生物指导性基序的定向展示。
在一些情况中,生物分子或固体支持物的丙烯酸酯、丙烯酰胺和甲基丙烯酸酯可用于生物缀合。在一些情况中,生物分子或固体支持物的硫醇-炔可以用于生物缀合。
在一些情况中,可以利用硫醇反应性缀合(例如天然化学连接(ncl))以通过肽键形成将肽和蛋白质附接至生物材料骨架。例如,具有c末端硫酯的肽与另一个肽中的n末端半胱氨酸残基反应以进行反式硫酯化反应,这导致与半胱氨酸硫醇形成中间体硫酯。
在一些情况中,(链霉)亲和素的强结合可以用于小分子生物素的生物缀合。在一些情况中,(链霉)亲和素和生物素可以附接至生物分子或固体支持物上以进行生物缀合。在一些情况中,修饰剂可以将官能性生物素基团添加至蛋白质、核酸和其他生物分子。在一些情况中,取决于生物素化化合物上存在的官能性,可以修饰抗体或其他蛋白质上的特定反应性基团以形成(链霉)亲和素结合位点。胺、羧酸酯、巯基、和碳水化合物基团可通过生物素衍生物的适当选择特异性地被靶向以用于生物素化。在一些情况中,使用光反应性生物素化试剂将生物素基团非选择性地添加至不包含用于修饰的方便官能团的分子。在一些情况中,可将生物素结合蛋白固定在表面、色谱支持物、微颗粒和纳米颗粒上,以在偶联生物素化的分子中使用。在一些情况中,可以彼此建立一系列(链霉)亲和素-生物素相互作用,以利用每个四聚体(链霉)亲和素分子的多价性质并增强对靶的检测能力。在一些情况中,可以包含生物素戊酸侧链的反应性基团的胺反应性生物素化试剂能够与蛋白质和其他分子中的伯胺形成共价键。在一些情况中,nhs酯自发地与胺反应形成酰胺键,而含羧酸酯的生物素化合物可以使用edc通过碳二亚胺介导的反应与胺偶联。在一些情况中,nhs-亚氨基生物素可用于用亚氨基生物素标签来标记含胺分子,从而提供与亲和素或链霉亲和素可逆的结合潜力。在一些情况中,磺基-nhs-ss-生物素(也称为nhs-ss-生物素)是磺基琥珀酰亚胺基-2(生物素酰胺基)乙基-1,3-二硫代丙酸酯,一种长链可裂解生物素化试剂,其可用于修饰含胺的蛋白质和其他分子。在一些情况中,1-生物素酰胺基-4-[4′-(马来酰亚胺基甲基)环己烷-羧酰胺基]丁烷(一种在延伸的间隔臂末端含有马来酰亚胺基团的生物素化试剂)与蛋白质和其他分子中的巯基反应形成稳定硫醚键。在一些情况中,n-[6-(生物素酰胺基)己基]-3′-(2′-吡啶基二硫代)丙酰胺,其中所述试剂含有与生物素的戊酸侧链附接的1,6-二氨基己烷间隔子,间隔子的末端氨基可以通过与spdp的酸前体的酰胺键合进一步修饰,以产生末端的巯基反应性基团。生物素-hpdp的吡啶基二硫化物末端可以与蛋白质和其他分子中的游离硫醇基反应形成二硫键,其中失去吡啶-2-硫酮。
在一些情况中,生物分子或固体支持物的羧酸酯可用于生物缀合。在一些情况中,重氮甲烷和其他重氮烷基衍生物可用于标记羧酸酯基团。在一些情况中,n,n′-羰基二咪唑(cdi)可用于在非水性条件下与羧酸反应,形成高反应性的n-酰基咪唑。然后,活性羧酸酯可与胺反应形成酰胺键,或与羟基反应形成酯键。另外,用cdi活化苯乙烯/4-乙烯基苯甲酸共聚物可用于通过其可用的氨基将酶溶菌酶或其他生物分子固定到基质上的羧基上。
在一些情况中,碳二亚胺用作零长度交联剂,其能够活化羧酸酯基团以与用于生物缀合的含胺化合物或固体支持物偶联。在一些情况中,碳二亚胺用于介导羧酸酯和胺之间或磷酸酯和胺之间的酰胺或氨基磷酸酯键的形成。
在一些情况中,n,n′-二琥珀酰亚胺基碳酸酯或n-羟基琥珀酰亚胺基氯甲酸酯可以用于生物缀合。n,n′-二琥珀酰亚胺基碳酸酯(dsc)由实质上含有两个nhs酯的羰基组成。所述化合物对亲核试剂具有高反应性。在水溶液中,dsc将水解形成两分子的n-羟基琥珀酰亚胺(nhs),并释放一分子的co2。在非水性环境中,所述试剂可用于将羟基活化为琥珀酰亚胺碳酸酯衍生物。dsc活化的羟基化合物可用于与含胺分子缀合以形成稳定的交联产物。
在一些情况中,高碘酸钠可用于氧化相邻碳原子上的羟基,形成适合与含胺或酰肼的分子偶联以进行生物缀合的反应性醛残基。例如,这些反应可用于在碳水化合物或糖蛋白中产生交联位点,用于随后通过还原胺化进行含胺分子的缀合。
在一些情况中,酶可用于氧化含羟基的碳水化合物以产生用于生物缀合的醛基。例如,半乳糖氧化酶在末端半乳糖或n-乙酰基-d-半乳糖残基上的反应进行以在多糖链上形成c-6醛基。然后这些基团可用于与含胺或酰肼的分子进行缀合反应。
在一些情况中,反应性烷基卤素化合物可用于特异性修饰碳水化合物、聚合物和其他生物分子中的羟基以进行生物缀合。
在一些情况中,生物分子或固体支持物的醛或酮可用于生物缀合。例如,肼的衍生物,特别是由羧酸酯基团形成的酰肼化合物可以与靶生物分子中的醛或酮官能团特异性反应。为了进一步稳定酰肼和醛之间的键,可以使腙与氰基硼氢化钠反应以减少双键并形成牢固的共价键。
在一些情况中,生物分子或固体支持物的氨氧基可用于生物缀合。例如,在醛基和氨氧基之间发生的化学选择性连接反应产生了肟键(醛肟),其已用于许多生物缀合反应以及配体与不溶性支持物(包括表面)的偶联中。该反应在酮情况下也非常有效,以形成称为酮肟的肟。
在一些情况中,环加成反应可用于生物缀合。在用于生物缀合的环加成反应中,两个或多个不饱和分子聚集在一起形成不饱和度降低的环状产物,这些所需的反应配偶体通常是天然系统所不具备的,因此使用环加成进行缀合需要在生物分子偶联配偶体中引入非天然的官能性。
在一些情况中,可将铜催化的叠氮化物-炔烃环加成物用于生物缀合。在一些情况中,叠氮化物与炔烃之间的(3+2)环加成反应会在高温(>90℃)下自发进行,产生两种三唑异构体的混合物。在一些情况中,该反应在室温、环境、氧合和/或水性环境下进行。在一些情况中,例如,通过cuaac形成肽-材料缀合物,使用炔基封端的肽以形成具有叠氮化物官能化的peg的水凝胶。在一些情况中,cuaac已被广泛用于对具有炔烃和叠氮化物官能化的肽和碳水化合物的支架进行官能化,部分原因是可以通过固相肽合成轻松引入氨基酸叠氮基赖氨酸和高炔丙基甘氨酸。在一些情况中,为了通过cuaac实现生物材料缀合,所需的铜(i)催化剂可以直接添加,或通过还原初始的铜(ii)络合物原位生成(最常使用抗坏血酸)。还原剂的加入进一步降低了cuaac连接对氧的敏感性。尽管三唑的形成不需要另外的配体,但是可以使用基于叔胺的配体的添加。
在一些情况中,可以使用应变促进的叠氮化物-炔烃环加成物(spaac)进行生物缀合。在一些情况中,在生理条件下,高度应变的环辛炔容易与叠氮化物反应生成三唑,而无需添加任何催化剂。在一些情况中,除了使用spaac进行肽缀合外,许多著名的报道还使用spaac通过将非天然的叠氮化物基序引入蛋白质偶联配偶体来将蛋白质基质缀合至环辛炔官能化的生物材料。例如,在一些情况中,这可以通过以下来实现:通过包括骨形态发生蛋白2(bmp-2)中存在的天然半胱氨酸的马来酰亚胺官能化、通过酶介导的ifn-γ的n末端修饰、或通过在许多蛋白质基质中用非天然氨基酸4-叠氮基苯丙氨酸的密码子重分配。在一些情况中,超分子主体-客体相互作用也可用于促进叠氮化物-炔烃环加成。例如,通过将两个反应性配偶体在葫芦[6]脲宿主的腔内紧密靠近,可以在蛋白质表面实现有效的环加成,该策略可以扩展到其他合适的生物分子。
在一些情况中,逆电子需求狄尔斯-阿尔德(diels-alder反应)(iedda)可用于生物缀合。例如,可以使用1,2,4,5-四嗪与应变的烯烃或炔烃之间的逆电子需求狄尔斯-阿尔德反应(iedda)。已经报道了用于进行生物分子缀合的多种合适的衍生物,例如,可以使用一系列渐增应变(因此反应性)的反式-环辛烯。在一些情况中,官能化的降冰片烯衍生物可用于进行iedda反应。在一些情况中,可以使用三嗪。在一些情况中,可以使用螺己烯。这些策略可以扩展到其他合适的生物分子。在一些情况中,马来酰亚胺和呋喃的杂-狄尔斯-阿尔德环加成可用于生物缀合。例如,可以利用呋喃官能化的rgds肽与马来酰亚胺官能化的peg-水凝胶的偶联,该策略可以扩展到其他合适的生物分子。在一些情况中,呋喃官能化的透明质酸水凝胶可通过狄尔斯-阿尔德环加成反应与二马来酰亚胺官能化的肽交联。mmp可裂解的肽能够使种子癌迁移通过凝胶。
在一些情况中,肟和腙的形成可用于生物缀合。在一些情况中,可以通过双官能交联来实现肽和dna经由腙形成来稳定地附接至生物材料,这种策略可以扩展到其他合适的生物分子。在一些情况中,将酮或醛修饰的绿色荧光蛋白(gfp)或金属硫蛋白与羟胺官能化的合成聚合物附接可以扩展到其他合适的生物分子。例如,通过在蛋白质n末端和c末端的肟修饰,产生了蛋白质交联的水凝胶。
在一些情况中,狄尔斯-阿尔德反应由二烯与烯烃的共价偶联组成,以形成六元环络合物进行生物缀合。
在一些情况中,过渡金属络合物可用于生物缀合。后过渡金属的性质可以使过渡金属络合物非常适合于操作不饱和与可极化的官能团(烯烃、炔烃、芳基碘化物、芳基硼酸等)。例如,pd(0)-官能化的微球可以介导氨基甲酸烯丙酯的脱保护和细胞质中的铃木-宫浦(suzuki-miyaura)交叉偶联。在其他示例中,钌催化剂可用于介导活细胞内笼状荧光团的氨基甲酸烯丙酯脱保护。在一些情况中,基于钯的应用在细胞培养中的应用包括无铜的sonagashira偶联、大肠杆菌细胞表面上的细胞外铃木偶联、和硫醇基团与硒代硫酸烯丙酯盐的缀合。在一些情况中,烯烃复分解可用于生物缀合。例如,使用钌络合物,可以通过多种方法轻松地将s-烯丙基半胱氨酸引入蛋白质,包括烯丙基硫醇与脱氢丙氨酸的缀合加成、半胱氨酸的直接烯丙基化、烯丙基二硫化物的脱硫、或在甲硫氨酸营养缺陷型大肠杆菌中作为甲硫氨酸替代物在代谢上并入。
在一些情况中,与硼酸衍生物的络合物形成可用于生物缀合。例如,硼酸衍生物能够与具有相邻官能团的其他分子形成环结构,所述相邻官能团由1,2-二醇或1,3-二醇、1,2-羟基酸或1,3-羟基酸、1,2-羟胺或1,3-羟胺、1-2-羟酰胺或1,3-羟酰胺、1,2-羟肟或1,3-羟肟以及含有这些物质的各种糖或生物分子组成。
在一些情况中,酶介导的缀合可用于生物缀合。例如,转谷氨酰胺酶家族催化赖氨酸侧链的伯胺和互补的谷氨酰胺残基的酰胺键之间异肽键的形成,该策略可以扩展到其他合适的生物分子。在其他情况中,过氧化物酶介导的缀合可用于生物缀合。例如,辣根过氧化物酶(hrp)可以用于氧化多种有机基质,例如酪氨酸的酚基团,从而产生高反应性自由基或醌中间体,其经历自发二聚作用,导致形成两个酪氨酸残基之间的邻碳-碳键,该策略可以扩展到其他适当的生物分子。在一些情况中,短肽标签可用于生物缀合。这些肽标签可以短至5个氨基酸长,并且可以附加至允许它们随后修饰的肽或蛋白质基质上。
在一些情况中,低分子量单体的聚合可用于生物缀合。聚合可归类为通过链生长或逐步生长两种机制之一进行的过程。在链生长聚合过程中,单体被添加到正在生长的聚合物链的“活性”末端,即使在低转化率下也导致形成高分子量材料。在逐步生长的聚合过程中,短的低聚物链偶联形成聚合物,需要高转化率从而达到高分子量。两种技术均可用于形成生物分子-聚合物缀合物。已证明丙烯酸酯和甲基丙烯酸酯单体的聚合特别有效。例如,丙烯酸酯和甲基丙烯酸酯修饰的肽和聚糖可以很容易地聚合。同样,合成的寡核苷酸亚磷酰胺构造单元“acrydite”可用,自由基聚合仍然是用于形成dna和rna官能化的生物材料的最常用方法之一。通过在共单体的存在下进行聚合,可以轻松调节生物分子呈递密度,从而克服了空间位阻带来的潜在困难。聚合的引发可以通过多种手段,包括加热、uv和可见光、氧化还原反应和电化学来触发。丙烯酸酯修饰的蛋白质还可以进行聚合以产生官能性材料,同时保留生物活性。在一些情况中,可以使用活性自由基聚合(lrp)进行生物缀合。例如,最常用的用于形成生物缀合物的lrp包括原子转移自由基聚合(atrp)、可逆加成-断裂链转移(raft)聚合和硝基氧介导的聚合(nmp)。
在一些情况中,光缀合可以用于生物缀合。在一些情况中,聚合是通过自由基的产生而引发的,然后自由基通过键的形成传播以产生活性聚合物链。可以通过多种刺激来诱导起始步骤,其中最常见的是热分解、氧化还原活化和引发物质的电化学电离。可替代地,许多引发剂可通过光诱导的光解键断裂(i型)或从共引发剂中光敏化夺取质子(ii型)而被活化。光引发提供以下益处:可在宽温度范围内使用、使用取决于所用引发剂的窄且可调节的活化波长、迅速产生自由基以及通过去除光源来控制聚合的能力。重要的是,大大增强了聚合对氧的耐受性,使得能够在细胞和组织存在下进行聚合。在光聚合过程中掺入丙烯酸酯官能化的肽和蛋白质可用作产生生物材料缀合物的方法。可替代地,还已经广泛报道了多肽与预形成材料上的乙烯基侧基的光引发附接,并且最近将其用于通过双光子激发的3d图案化。在光缀合的缀合中可以使用多种光引发剂。例如但不限于,曙红υ、2,2-二甲氧基-2-苯基-苯乙酮、igracured2959、苯基-2,4,6-三甲基苯甲酰基次膦酸锂和核黄素可用作光引发剂。光引发剂通常吸收光以引发光反应过程。在一些情况中,光缀合可以利用光硫醇-烯反应。硫醇还可以通过自由基机理与烯烃反应。首先,硫醇自由基与烯烃反应生成以碳为中心的自由基,其然后可以从另一个硫醇中夺取质子,并且因此传播所述反应。富电子烯烃可加速光硫醇-烯反应,所述富电子烯烃生成不稳定的碳自由基中间体,其能够迅速夺取硫醇氢。该规则的例外是降冰片烯衍生物,其中通过硫醇加成后释放环应变来驱动反应性。这导致降冰片烯>乙烯基醚>丙烯基>烯丙基醚>丙烯酸酯>马来酰亚胺的反应性的总体趋势。降冰片烯和烯丙氧基羰基(alloc基团)已被分别特别广泛地用于肽/蛋白质生物材料的官能化,这是由于链转移的贡献几乎可以忽略不计并且它们在肽合成过程中易于引入。例如,通常在固相肽合成过程中用作正交赖氨酸保护基的alloc基团是一种有效的光硫醇-烯反应性柄。在其他示例中,降冰片烯光硫醇-烯反应可用于生物活性肽和生长因子蛋白的栓系和空间图案化。除了最常用的alloc基团和降冰片烯反应基团以外,其他烯烃也已用于生物材料官能化。例如,密码子重分配已用于将烯丙基-半胱氨酸残基位点特异性地掺入蛋白质中,其随后可通过使用光硫醇-烯反应进行缀合。可替代地,丙烯酸酯可以在半胱氨酸封端的肽存在下进行混合模式的光聚合,而最近发现烯丙基二硫化物结构可以进行可逆和受控的缀合硫醇交换。
在一些情况中,生物分子或固体支持物的芳基叠氮化物或卤代芳基叠氮化物可用于生物缀合。
在一些情况中,光反应性基团二苯甲酮可用于生物缀合。
在一些情况中,光反应性基团蒽醌可用于生物缀合。
在一些情况中,光硫醇-炔反应可用于生物缀合。光硫醇-炔反应的大多数示例都利用了简单的炔丙基-醚或炔丙基-胺反应性柄。
在一些情况中,反应性官能性的光笼蔽和活化可用于生物缀合。通常,无论是丙烯酸酯还是硫醇衍生的自由基,都会形成瞬态反应性物质。在一些情况中,光笼蔽可用于掩蔽或保护官能团,直到需要将其暴露。在一些情况中,使用最广泛的笼基于邻硝基苄基和香豆素生色团。例如,可以通过用325nmuv光辐照使硝基苄基封端的半胱氨酸残基去笼蔽,然后释放的硫醇可以通过迈克尔加成与马来酰亚胺官能化的肽反应,生成能够指导细胞迁移的图案化水凝胶。在一些情况中,6-溴-羟基香豆素可用于硫醇笼蔽。在一些情况中,光亲和性探针可用于生物缀合,其中高反应性中间体在辐照后会以高度空间精度与最靠近的可接近官能团快速反应。在一些情况中,最常用的是苯基叠氮化物、二苯甲酮和苯基二氮杂环丙烯。在一些情况中,可以使用光笼蔽的环加成。例如,四唑的uv辐照已显示用于生成反应性腈-亚胺中间体,所述中间体可与缺电子的烯烃(如丙烯酸酯或丙烯酰胺)进行快速环加成。在一些情况中,腈-亚胺与硫醇的副反应可用于将含有半胱氨酸的蛋白质与四唑官能化的表面进行位点特异性缀合。
在一些情况中,非共价相互作用可用于生物缀合。在一些情况中,非共价结合在细胞中在控制生物分子界面和影响蛋白质-蛋白质相互作用、dna-dna络合、dna-蛋白质界面,蛋白质定位等方面起着至关重要的作用。在一些情况中,对目的生物分子表现出结合亲和力的非共价序列允许进行制备后修饰或将天然生物分子在生物样品中与周围环境简单隔离。最常用的结合序列是长度为7至20个氨基酸的短肽,其衍生自多种来源,包括体内存在的或通过诸如噬菌体展示的技术确定的已知蛋白质结合结构域。在一些情况中,称为适体的短寡核苷酸也可用于结合多种蛋白质基质,包括细胞因子血管内皮生长因子(vegf)和血小板衍生生长因子(pdgf)以及细胞表面蛋白,例如表皮生长因子受体(egfr)。在一些情况中,结合序列也能通过与天然生物聚合物(如肝素)的亲和力引入生物材料中。在一些情况中,通过首先诱导生物聚合物结合,然后可以控制添加的或内源的生长因子或信号传导蛋白对生物材料骨架的吸附。在一些情况中,还可以利用氨基酸水平的结合亲和力以能够使肽和蛋白质与某些生物材料基质缀合。例如,基于非天然邻苯二酚的氨基酸的结合可用于诱导与含金属氧化物的生物玻璃和金属植入物的结合,从而能够使这些重要技术的生物活性得到增强。
在一些情况中,自组装肽可用于生物缀合。例如,天然肽和蛋白质采用一系列二级结构,包括β-折叠和α-螺旋,它们既可以稳定单个序列,又可以控制蛋白间的聚集。在一些情况中,自组装肽已被广泛用于组装水凝胶和纤维材料。在许多这些结构中,可以在肽合成过程中将生物表位或官能团附加至某些或所有肽构造单元上,以向系统中添加所需的生物活性。从简单的粘附基序到层粘连蛋白衍生的表位以及生长因子模拟物等肽配体都已展示在自组装纤维的表面上。可替代地,可以组装糖肽以募集细胞外信号传导蛋白和生长因子、在透明质酸中模拟糖基化模式、或研究糖胺聚糖骨架中的最佳磺化率。在一些情况中,自组装结构域也可以添加到全长蛋白质,从而导致在水凝胶形成过程中并入侧链官能性。在一些情况中,在非自组装骨架中还利用了肽形成二级结构的倾向。这可以通过将自组装肽混合到共价水凝胶中来实现,所述共价水凝胶由非相互作用聚合物(例如peg互穿网络)或系统(其中其他电荷相互作用进一步稳定最终构建体(例如带正电荷的肽与带负电荷的藻酸盐凝胶之间))构成。作为可替代方案,可将螺旋侧基附接到共价材料上,并用于通过自组装成卷曲螺旋三重螺旋来驱动生物活性基团(例如生长因子)的非共价附接。
在一些情况中,宿主-客体化学可用于生物缀合。例如,可以通过添加客体萘基官能化的rgds肽并通过随后引入具有较高宿主结合常数的非细胞粘附性金刚烷-rges肽来原位控制β-环糊精修饰的藻酸盐支架的粘附特性,动态调节成纤维细胞附接得以实现。环糊精与萘基官能化或金刚烷官能化的肽之间的宿主-客体相互作用允许藻酸盐官能化,这可以应用于其他合适的生物分子。
在一些情况中,生物素-(链霉)亲和素可用于生物缀合。例如,抗生物素蛋白和链霉亲和素是同四聚体蛋白,其可以同时结合多达四分子的其小分子结合配偶体生物素。生物素的小尺寸(只有244da的质量)并且易于通过其游离羧酸进行官能化已导致生物素-(链霉)亲和素结合被广泛用作进行生物材料缀合的一种手段。链霉亲和素-蛋白融合可以重组产生,并结合到适当官能化的表面上以实现缀合。在一些情况中,进行生物分子生物素化,然后将该构建体结合到(链霉)亲和素官能化的表面上。在一些情况中,这可以通过直接途径,经由将材料与(链霉)亲和素进行化学预缀合或通过利用(链霉)亲和素的四聚体结合以介导生物素官能化的支架的间接修饰或交联来实现。
在一些情况中,核酸可以用于生物缀合。在一些情况中,以类似于自组装肽的方式,核酸本身也可以形成组装材料,以产生用于展示生物分子的可调平台。在一些情况中,可以将加dna标签的肽和生长因子与适当官能化的生物材料缀合,并用于在局部细胞群上引发期望的生物效应。
通常,并入反应性柄可用于生物缀合。例如,将独特的反应性基序引入生物分子基质提供化学“标签”,这使得实现单位点选择性或特异性。在一些情况中,通常可以通过固相合成(sps)来产生短肽和寡核苷酸。有机合成的多功能性使得克服了反应性柄并入方面的困难,其中如本文所述的各种适当官能化的氨基酸和寡核苷酸可用。在一些情况中,可替代方法是引入带有期望反应性柄的非天然氨基酸(uaa)。这可以通过用胺反应性衍生物修饰赖氨酸残基来实现。在一些情况中,使用营养缺陷型细菌菌株(它们不能生物合成特定的氨基酸并且因此需要从生长培养基中摄取),通过使细菌对天然氨基酸饥饿并为其补充结构上相关的非天然类似物,细菌细胞可以在翻译过程中并入uaa。该技术可用于安装基于叠氮化物和炔烃的甲硫氨酸模拟物,从而引入用于进行cuaac和spaac反应的反应性柄。类似策略可用于并入非天然单糖,从而实现复杂聚糖的重塑。在一些情况中,使用了使用在翻译过程中选择性识别uaa并使其带电荷的正交trna和trna合成酶对进行的密码子重分配。在一些情况中,这可以通过将来自另一个界的trnacua/trna合成酶对并入宿主细胞来重分配琥珀终止密码子uag来实现。该对可以能够安装期望的uaa,而对于内源性细胞机构实际上是不可见的。结果,可以使用定点诱变在编码dna的期望位置引入单tag密码子,从而以高特异性和选择性将uaa单一引入。
在一些情况中,一个或多个官能团在与另一官能团或与snap或生物实体或化学实体反应时会释放报告子。当snap与生物实体或化学实体缀合时释放报告子可以允许跟踪反应。在一些情况中,有可能通过监测游离报告子的浓度来监测snap-生物/化学实体缀合反应的完成程度。在一些情况中,报告子一旦通过缀合反应释放则发出荧光。
在一些情况中,生物实体或化学实体可以用连接子官能化。在一些情况中,用连接子官能化生物实体或化学实体可以减少空间位阻。连接子可包含可以使生物实体或化学实体远离snap的刚性或半刚性部分。在一些情况中,连接子可以是长、中等或短的连接子。在一些情况中,连接子可包含选自peg、dna、短羧基、碳链、类肽、间隔子和/或甘油以及其他示例中的一种或多种组分。
在一些情况中,可以使用单罐蛋白质组学方法对snap、种子和/或生物实体或化学实体进行官能化。单罐蛋白质组学方法可以导致很高的官能化效率。在一些情况中,单罐蛋白质组学方法可用于官能化生物实体或化学实体,其中实体损失水平非常低。
在一些实施方案中,snap是可以从种子生长的聚合物。例如,如果种子是dna寡核苷酸,则snap可以是dna分子。在一些情况中,snap可以是具有内部互补性区域的dna分子,使得所述分子可以自杂交。例如,snap可以是通过分子内的自杂交形成的dna簇。在一些情况中,snap可以由dna、rna、l-dna、l-rna、lna、pna或两种或更多种不同类型的核酸的混合物形成。在一些情况中,snap可以具有重复结构,例如核苷酸的重复序列。在一些情况中,snap可以是不规则的聚合物,没有重复序列。例如,snap可以包含核苷酸的随机序列。
在一些情况中,可以通过滚环扩增来形成snap。质粒或其他环状核酸分子可以作为模板与结合环状核酸分子的引物一起提供,其中所述引物在5’末端包含官能团。进行具有足够长的延伸步骤的聚合酶链反应(pcr),或仅进行聚合酶延伸反应,将使官能化的引物结合环状核酸分子并产生单链核酸产物。单链核酸产物的长度可通过改变延伸时间、使用的聚合酶或反应条件来影响。在一些情况中,环状核酸模板包含具有内部互补性的区域,使得单链核酸产物将包含可以自杂交的区域。在一些情况中,环状核酸模板是dsdna分子。在一些情况中,单链核酸产物是ssdna分子。在一些情况中,所用的聚合酶是dna聚合酶。
在一些情况中,snap可以由核酸折纸或dna折纸形成。dna折纸通常是指dna的纳米级折叠,以在纳米级产生非任意的二维和三维形状。互补碱基对之间相互作用的特异性可使dna成为有用的构建材料。在一些情况中,可以通过设计碱基序列来控制不同区域之间的相互作用。dna折纸可用于产生将其他分子固定在适当位置的支架或自行产生结构。
如本文所述的snap可包括通过核酸折纸产生的那些snap。通常,核酸折纸可以指dna折纸,但也可以指rna折纸、dna和rna分子组合的折纸或dna或rna以外的核酸分子例如基于硅的核酸等的折纸。核酸折纸可以产生具有工程化的形状的核酸分子。工程化的形状可以是已经部分或完全规划的形状。形状的规划可以包括对如下进行规划或工程化:核酸的哪部分结合、核酸的哪处区段可以折叠、核酸的哪处区段可以是单链、核酸的哪处区段可以是双链、核酸的哪处区段可以结合至同一链的核酸区段、或核酸的哪处区段可以结合至另一链上的核酸区段。在一些情况中,非核酸分子例如蛋白质可用于促进核酸成为工程化的形状。
通常,核酸折纸可包含至少一个或多个长核酸链和一个或多个短核酸链。通常,这些核酸链是单链的,但它们可以具有可以是双链的区段。短链之一可以包括至少一个可以与长链的第一区段互补的第一区段,以及可以与长链的第二区段互补的第二区段。当短链和长链在允许核苷酸杂交的条件下孵育时,较短的寡核苷酸可以与较长的寡核苷酸杂交。这种杂交可以赋予核酸分子形状。例如,如果第一链上的两个区段是分开的,则可以在杂交期间将这两个区段放在一起以形成形状。在一些情况中,短链可以结合至少2、3、4、5或6个区段,其可以结合长核酸链的至少2、3、4、5或6个互补区段。
在一些情况中,短链可以具有一个或多个不能与长链互补的区段。在这种情况中,与长链不互补的区段可以是至少约1、2、3、4、5、10、15或20个核苷酸长。
可以使用至少约1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、150、200、250、300或更多的短核酸链来执行此过程。这些短核酸链可各自结合长核酸链的一个或多个不同区段。与长核酸链杂交的每个短核酸链可导致长核酸链中的折叠。在一些情况中,短链的数量可以与经工程化的形状的复杂性相关。例如,具有许多折叠的经工程化的形状比具有很少折叠的经工程化的形状可以利用更多的短核酸链。经工程化的形状可以具有至少约1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、150、200、250、300或更多个折叠。
在一些情况中,可以将多于一个长链并入核酸折纸结构中。例如,可以这样做,以增加经工程化的形状的复杂性,简化经工程化的形状的设计或规划,避免产生比期望的经工程化的形状在热力学上更稳定的形状,使产生经工程化的形状更容易,或管理产生经工程化的形状的成本。
可以通过设计2个或更多个长链,使得每个链具有至少一个可与另一个链的区段互补的区段,或通过设计2个或更多个长链,使得每个链具有至少一个可与短核酸链的区域互补的区段,使得两个长链都具有与短核酸链互补的区段,来实现多于一个长链的并入。
短核酸链可与一个长核酸链或多于一个长核酸链具有互补性。在一些情况中,短核酸链也可以与一个或多个短核酸链具有互补性。
本文中的术语“长”和“短”是指通用术语。长链可以比短链长,但在一些情况中,长链的尺寸可以与短链相同。在一些情况中,长链可以是至少约30、40、50、100、150、200、250、300、400、500、600、700、800、900、1000或更多个核苷酸长。在一些情况中,短链可以是至少约6、7、8、9、10、15、20、25、30、35、40、45、50、60、70、80、90、100个或更多个核苷酸长。
可以为特定目的设计经工程化的形状。例如,可以将经工程化的形状设计为支持负载物、封装分子、结合分子、连接两个或更多个分子、装配入腔中、结合突起或其他目的。经工程化的形状可以是任何形状,例如椭圆形、矩形、圆形、环形、球形、平的、纹理化的、光滑的、对称的、不对称的、锥形或不规则形状。经工程化的形状可以是立方体、角锥体、盒、笼、梯或树。
可以组装通过如上所述的核酸折纸形成的经工程化的形状或snap。组装可以指核酸链彼此杂交以产生经工程化的形状的过程。
经工程化的形状或snap可以自发地自组装。当具有可互补区域的长寡核苷酸和短寡核苷酸一起孵育时,会发生自组装。在自发自组装过程中,核苷酸可以杂交,并且在孵育过程中无需辅助分子或催化剂的帮助即可形成经工程化的形状。这种自组装可以在特定条件或特定条件范围内发生。孵育dna链以进行自组装时可以考虑的条件可以是盐浓度、温度和时间。
有时,组装可以利用或需要催化剂。在这种情况中,催化剂可以加快组装速度或确保组装结果达到特定期望的经工程化的形状。催化剂可以包含rna、dna或蛋白质组分。
组装期间的盐浓度可以小于1m、小于0.5m、小于0.25m、小于0.1m、小于0.05m、小于0.01m、小于0.005m或小于0.001m。
组装期间的温度可以为至少室温。在一些情况中,组装期间的温度可以为至少约50、60、70、80、85、90或95℃。在一些情况中,组装过程中的温度可以变化。例如,温度可以升高到至少约20、30、40、50、60、70、80、85、90或95℃。这种增加可以确保核酸链在组装之前不包含二级结构。如所述,一旦温度升高,就可以降低到例如约20、30、40、50、60、70或80℃。温度的这种降低可以使核酸杂交。在一些情况中,温度降低可以经约0.5、1、2、3、4、5、10、15、20、25、30、45或60分钟进行。
组装可以逐步进行。在这种情况中,可以首先将核酸分子的子集一起孵育。在使这些分子杂交之后,可以添加一种或多种另外的核酸分子并使其杂交。在一些情况中,可以将已组装的两个或多个经工程化的形状一起孵育,以组装成更大的经工程化的形状。
在一些情况中,组装可以包括分形组装。分形组装可以产生snap,其可以是经工程化的形状的阵列。组装可以分阶段进行,这可以简化设计过程或确保正确的组装。这样的阵列能以至少1、2、3、4、5、10、15、20、30、40、50、60、70、80、90、100、200、300、400、500、1000或更多个阶段组装。在一些情况中,所使用的阶段数量可以与伪相互作用的减少相关。这可能是由于在任何给定时间减少了可能的反应的总数量。
snap可以组装成至少3×3、至少5×5、至少10×10、至少50×50、至少100×100或至少1000×1000的阵列(经工程化的形状x经工程化的形状)。
每个杂交反应可以花费约10、20、30、40、50或60秒。在一些情况中,每个杂交反应可以花费约1、2、3、4、5、10、15、20、30、40、50或60分钟。在一些情况中,杂交反应可以花费多于1个小时。
可以使用核酸折纸来优先选择snap将如何“降落”在固体支持物上。例如,可以使用核酸折纸来构建具有可以优先接触固体支持物的承坐表面的snap。可以将例如经由核酸折纸制得的snap设计为包括区域,所述区域可以产生与支持物的空间相互作用或静电相互作用,其可以影响snap在支持物上的取向。例如,所述区域可包含具有例如可以促进snap与固体支持物之间相互作用的对核酸骨架的修饰的核苷酸。在另外的示例中,所述区域可以包括可以“装配”至固体支持物上的腔或突起的突起或腔。在一些情况中,支持物表面可包含化学结构(例如纳米颗粒或寡核苷酸)、点击试剂或其他合理设计的材料,其会影响snap结构的位置和取向,包括通过核酸折纸合成的snap。
核酸折纸可用于构建具有可附接生物实体或化学实体的连接子的snap,其中所述连接子相对于承坐表面定位,使得生物实体或化学实体可在固体支持物的远端或大约远端。连接子也可以包含dsdna区域以促成来自snap的刚性前哨(outpost)。在一些情况中,也可以使用蛋白质折纸。
表面可以具有这样的特性,使得snap可以以可以下坠或倾斜的方式结合到所述表面。snap可以向左、向右、向前、向后或其侧面的任意组合下坠或倾斜。snap可以下坠或倾斜一次并保持在原位,或者可以随时间自由在两侧面之间下坠。在一些情况中,snap可以相比于一个或多个其他方向优先沿一个方向下坠。在一些情况中,snap可以优先避免沿特定方向下坠。
在一些情况中,例如,丝状或链状分子,例如纳米颗粒或寡核苷酸链,可以附接至表面。可以包含经工程化的形状的snap可以包含一个或多个可以与丝状或链状分子(例如悬挂的单链寡核苷酸或纳米颗粒)结合的部分。在使表面与此类snap接触时,所述一个或多个部分可以与所述丝状或链状分子中的一个或多个相互作用。在一些情况中,所述部分可以与所述丝状或链状分子紧密结合。在这种情况中,snap可以是可移动的也可以是不可移动的。
可以采用计算建模或模拟工具来设计和优化寡核苷酸或蛋白质序列,以产生特定的snap结构。
在一些情况中,snap可以是核酸质粒,例如dna质粒。质粒可以紧凑形式存在,称为超螺旋dna。超螺旋质粒的半径可以由质粒尺寸决定,即骨架较长的质粒将形成较大的超螺旋实体。在一些情况中,snap可以包含骨架在5kb至150kb之间的质粒。在一些情况中,snap可以包含骨架在5kb至100kb之间的质粒。在一些情况中,snap可以包含骨架在5kb至90kb之间的质粒。在一些情况中,snap可以包含骨架在25kb至50kb之间的质粒。在一些情况中,snap可以包含骨架为至少约5kb、10kb、15kb、20kb、25kb、30kb、35kb、40kb、45kb、50kb、55kb、60kb、65kb、70kb、75kb、80kb、85kb、90kb、95kb、100kb、105kb、110kb、115kb、120kb、125kb、130kb、135kb、140kb、145kb或150kb的质粒。在一些实施方案中,可以使用诸如nanocyte或leica的成像平台对snap进行成像。
在一些情况中,snap可以具有分支结构。例如,snap可以是树枝状聚合物。树枝状聚合物的一些示例可以在newkome,georger.,和carold.shreiner."poly(amidoamine),polypropylenimine,andrelateddendrimersanddendronspossessingdifferent1→2branchingmotifs:anoverviewofthedivergentprocedures."polymer49.1(2008):1-173中找到。与本公开的方法一起使用的树枝状聚合物可以是g1、g2、g3、g4、g5、g6、g7、g8、g9、g10、g11、g12、g13、g14或g15树枝状聚合物。在一些情况中,树枝状聚合物可以高于g15树枝状聚合物,例如是g15至g30的树枝状聚合物。
在一些实施方案中,snap可以是蛋白质或由蛋白质构成。例如,snap可以是蛋白质原纤维。snap可以由已知用于形成原纤维的蛋白质构成,例如tau蛋白或tau蛋白的部分。组装成原纤维的tau的31个残基的部分描述于
在一些实施方案中,snap可以是单分子。在一些实施方案中,snap可以不是单分子。在一些情况中,snap可以由非共价结合的多个分子组装。例如,snap可以由两个或更多个杂交在一起的核酸分子形成。在另一个示例中,snap可以由通过非共价键组装在一起的两个或更多个蛋白质分子形成。
在一些实施方案中,snap的直径在约50nm至约100um之间。
snap通常是聚合物分子。这些可以通过受控的聚合反应、逐步聚合反应或逐步合成方法来生长。snap的生长可以通过可用单体的量、允许反应进行的时间长度或进行的合成步骤的数量来控制。
每个snap的直径可以是至少约10纳米(nm)或约10nm、约50nm、约75nm、约100nm、约125nm、约150nm、约175nm、约200nm、约225nm、约250nm、约275nm、约300nm、约325nm、约350nm、约375nm、约400nm、约425nm、约450nm、约475nm、约500nm、约525nm、约550nm、约575nm、约600nm、约625nm、约650nm、约675nm、约700nm、约725nm、约750nm、约775nm、约800nm、约825nm、约850nm、约875nm、约900nm、约925nm、约950nm、约975nm、约1000nm、约1025nm、约1050nm、约1075nm、约1100nm、约1125nm、约1150nm、约1175nm、约1200nm、约1225nm、约1250nm、约1275nm、约1300nm、约1325nm、约1350nm、约1375nm、约1400nm、约1425nm、约1450nm、约1475nm、约1500nm、约1525nm、约1550nm、约1575nm、约1600nm、约1625nm、约1650nm、约1675nm、约1700nm、约1725nm、约1750nm、约1775nm、约1800nm、约1825nm、约1850nm、约1875nm、约1900nm、约1925nm、约1950nm、约1975nm、约2000nm、约3000nm、约4000nm、约5000nm、约6000nm、约7000nm、约8000nm、约9000nm、约10μm、约15μm、约20μm、约25μm、约30μm、约40μm、约50μm、约75μm、约100μm、约200μm、约300μm、约400μm、约500μm、或大于约500μm。在一些情况中,snap可以具有约100nm至500nm、约200nm至约400nm、约500nm至约10μm或约1000nm至约10μm的直径。
在一些情况中,可以使用点击化学将snap共价附接至固体支持物。通常,术语“点击化学”用于描述高收率、范围广、仅生成无需色谱法即可除去的副产物、立体特异性、易于执行且可在易除去或良性溶剂中进行的反应(mckay,c.,&finnm.g.(2014)clickchemistryincomplexmixturesbioorthogonalbioconjugation第21卷,第9期,第1075-1101页;m.g.meldal,m.,&
在一些情况中,点击化学反应可以是cuaac、spaac、spanc,或如本文其他地方所述。在一些情况中,点击化学反应可能需要铜源,例如cuso4、cu(0)、cubr(ph3p)3、cubr、cubr/cu(oac)2、cubr2、[cu(ch3cn)4]pf6、ps-nme2:cui、二氧化硅:cui、(eto)3p:cui、cucl/pd2(dba)3、cubf4、cucl、cucl2、cu(aco)2、cu(2)、tta:cuso4、cu(1)沸石(usy)、cu(ch3cn)4otf、cuotf、cu(2):双-batho或其组合。在一些情况中,点击化学反应的进行不需要铜源。在一些情况中,点击化学反应的还原剂可以是例如naasc、空气、icl、氧气、n2、hasc、tcep、二硫苏糖醇(dtt)、pph3、巯基乙醇、三(2-羧乙基)膦(tcep)、tcept-盐酸或其组合,或无还原剂。在一些情况中,点击化学反应的溶剂可以是例如thf、吡啶、dmso、dmf、甲苯、nmp、乙腈、水、tbuoh、ibuoh、etoh、meoh、二噁烷、二氯甲烷、hepes、nacl缓冲液、丙酮、pbs、sfm、tris缓冲液、硼酸盐缓冲液、pb、tfh、acoet、pipes、脲、丙酮、tris、盐水、alloco2me、tms-n3、脲溶液、碳酸氢盐缓冲液、其组合,或无溶液。在一些情况中,点击化学反应的碱可以是例如dipea、lutna2co3、ipr2nh、dbu、et3n、et3n·hcl、et3nh+-oac、k2co3、tbaf、cuso4、ps-nme2、哌啶、期望的ph、或其组合。在一些情况中,点击化学反应的配体可以是例如tbta、脯氨酸、bmah、lut、手性lig's、吡啶、his、batho、tta、bim、phen、bipy、pmdeta、dnbipy、trmeda或其组合。在一些情况中,点击化学反应的温度可以是例如0-5℃、5-15℃、15-25℃、20-25℃、25-35℃、35-45℃、45-55℃、55-65℃、65-75℃、75-85℃、85-95℃或更高。在一些情况中,点击化学反应的温度可以低于0℃。在某些反应中,点击化学反应可以被铝箔覆盖。在一些情况中,点击化学反应可以包括酸,例如三氟乙酸、三氯乙酸或三溴乙酸。
在一些情况中,可以将交联剂用于缀合。在一些情况中,交联剂可以是零长度交联剂、同双官能交联剂、异双官能交联剂或三官能交联剂。可以将交联剂并入预先形成的或原位的生物分子中。
在一些情况中,零长度交联剂通过形成不含其他原子的键来介导用于生物缀合的缀合。因此,一个分子的一个原子共价附接至第二分子的原子,而没有中间的连接子或间隔子。在这样的缀合方案中,最终的络合物通过化学组分结合在一起,这些化学组分将外来结构添加到被交联的物质。碳二亚胺可用于介导羧酸酯和胺之间的酰胺键或磷酸酯和胺之间的氨基磷酸酯键的形成,并且是可使用的零长度交联剂的常见类型,可有效地形成两个蛋白质分子之间、肽与蛋白质之间、寡核苷酸与蛋白质之间、生物分子与表面或颗粒之间的缀合物,或这些的任意组合与小分子之间的缀合物。在一些情况中,edc(或edac;1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐)可用于缀合含有羧酸酯和胺的生物分子。在一些情况中,cmc或1-环己基-3-(2-吗啉代乙基)碳二亚胺(通常合成为甲基对甲苯磺酸盐)是一种水溶性试剂,用于在含有羧酸酯的一个分子与可用作生物缀合的交联剂的含有胺的第二分子之间形成酰胺键。在一些情况中,dic或二异丙基碳二亚胺可作为零长度交联剂用于生物缀合。在一些情况中,dcc(二环己基碳二亚胺)可作为零长度交联剂用于生物缀合。在一些情况中,woodward试剂k为n-乙基-3-苯基异噁唑鎓-3'-磺酸酯,这是一种零长度交联剂,能够引起羧酸酯和胺的缩合形成酰胺键。在一些情况中,cdi或n,n′-羰基二咪唑可作为零长度交联剂用于生物缀合。在一些情况中,席夫碱的形成和还原胺化可作为零长度交联剂用于生物缀合。
在一些情况中,同双官能交联剂介导用于生物缀合的缀合。在一些情况中,同官能nhs酯可用于生物缀合。例如,lomant试剂[(二硫代双(琥珀酰亚胺基丙酸酯)或dsp])是一种同双官能nhs酯交联剂,含有长度为
在一些情况中,异双官能交联剂介导用于生物缀合的缀合。异双官能试剂可用于通过两步或三步过程交联蛋白质和其他分子。在一些情况中,使用交联剂的最易反应或最不稳定的末端用异双官能化合物修饰一种蛋白质。然后可以通过凝胶过滤或快速透析从过量试剂中纯化经修饰的蛋白质。在一些情况中,异双官能化合物包含至少一个反应基团,其在水性环境中表现出扩展的稳定性,因此允许在添加有待缀合的第二分子之前纯化活化的中间体。例如,n-羟基琥珀酰亚胺(nhs酯-马来酰亚胺异双官能性)可用于通过其nhs酯末端(最不稳定的官能团)与一个蛋白质的胺基反应,同时保留其马来酰亚胺官能度的活性。由于马来酰亚胺基团在水溶液中比nhs酯基团具有更大的稳定性,因此可以产生马来酰亚胺活化的中间体。在快速纯化步骤之后,然后可以使用交联剂的马来酰亚胺末端缀合至含巯基的分子。异双官能交联剂也可用于将缀合反应定向至靶分子的特定部分。在一些情况中,胺可以偶联在一个分子上,而巯基或碳水化合物在另一个分子上被靶向。在一些情况中,含有一个光反应性末端的异双官能试剂可用于通过uv辐照非选择性地插入靶分子中。异双官能试剂的另一种组分是将两个反应性末端连接在一起的交联桥或间隔子。交联剂的选择不仅可以基于它们的反应性,还可以基于它们所具有的交联桥的长度和类型。一些异双官能家族仅在其间隔子的长度上有所不同。交联桥的性质也可以控制试剂的整体亲水性。例如,基于聚乙二醇(peg)的交联桥产生亲水试剂,其为整个异双官能化合物提供水溶性。在一些情况中,许多异双官能团在其交联桥中包含可裂解基团,这为实验设计提供了更大的灵活性。少数交联剂包含实际上影响其官能团反应性的特殊交联桥成分。例如,已知紧邻芳族环的马来酰亚胺基对于开环和活性丧失的稳定性低于与脂肪族环相邻的马来酰亚胺。此外,根据相关交联剂上间隔子的类型,预定用于体内的缀合物可以具有不同的特性。一些间隔子可以具有免疫原性,并导致针对它们的特异性抗体产生。在其他情况中,缀合物体内的半衰期可通过选择交联桥而改变,尤其是在使用可裂解试剂时。在一些情况中,异双官能交联剂可以是n-琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯(spdp)、标准spdp、lc-spdp、磺基-lc-spdp、琥珀酰亚胺基氧基羰基-α-甲基-α-(2-吡啶基二硫代)甲苯、琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯、磺基琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯、间-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯、间-马来酰亚胺基苯甲酰基-n-羟基磺基-琥珀酰亚胺酯、n-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、磺基琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、琥珀酰亚胺基-4-(对-马来酰亚胺基苯基))丁酸酯、n-(γ-马来酰亚胺基丁酰氧基)琥珀酰亚胺酯、琥珀酰亚胺基-3-(溴乙酰胺)丙酸酯、琥珀酰亚胺基碘乙酸酯、4-(4-n-马来酰亚胺基苯基)丁酸酰肼、4-(n-马来酰亚胺基甲基)环己烷-1-羧基-酰肼、3-(2-吡啶基二硫代)丙酰基酰肼、n-羟基琥珀酰亚胺基-4-叠氮基水杨酸、磺基琥珀酰亚胺基-2-(对-叠氮基水杨酰胺基)乙基-1,3'-二硫代丙酸酯、n-羟基磺基琥珀酰亚胺基-4-叠氮基-苯甲酸酯、n-琥珀酰亚胺基-6-(4'-叠氮基-2'-硝基苯基氨基)己酸酯、磺基琥珀酰亚胺基-6-(4'-叠氮基-2'-硝基苯基氨基)己酸酯、n-5-叠氮基-2-硝基苯甲酰基氧基琥珀酰亚胺、磺基琥珀酰亚胺基-2-(间-叠氮基-邻-硝基苯甲酰胺基)-乙基-1,3'-二硫代丙酸酯、n-琥珀酰亚胺基-(4-叠氮基苯基)1,3'-二硫代丙酸酯、磺基琥珀酰亚胺基4-(对-叠氮基苯基)丁酸酯、磺基琥珀酰亚胺基2-(7-叠氮基-4-甲基香豆素-3-乙酰胺)乙基-1,3'-二硫代丙酸酯、磺基琥珀酰亚胺基7-叠氮基-4-甲基香豆素-3-乙酸酯、对-硝基苯基重氮基丙酮酸酯、对-硝基苯基-2-重氮基-3,3,3-三氟丙酸酯、1-(对-叠氮基水杨酰胺基)-4-(碘乙酰胺基)丁烷、n-[4-(对-叠氮基水杨酰胺基)丁基]-3′-(2′-吡啶基二硫代)丙酰胺、二苯甲酮-4-马来酰亚胺、对-叠氮基苯甲酰基酰肼、4-(对-叠氮基水杨酰胺基)丁胺或对-叠氮基苯基乙二醛。
交联剂的其他示例包括但不限于nhs-peg4-叠氮化物、nhs-膦、n-γ-马来酰亚胺基丁酰基-氧基磺基琥珀酰亚胺酯、间-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯、磺基琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯、磺基琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯、间-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯、1-乙基-3-[3-二甲基氨基丙基]碳二亚胺盐酸盐、庚二亚氨酸二甲酯、磺基琥珀酰亚胺基6-(3'-(2-吡啶基二硫代)丙酰胺基)己酸酯、6-(3'-[2-吡啶基二硫代]丙酰胺基)己酸酯、三-(琥珀酰亚胺基)氨基三乙酸酯、磺基-nhs-lc-双吖丙啶、双马来酰亚胺基己烷、1,4-双马来酰亚胺基丁烷、磺基琥珀酰亚胺基4-(n-马来酰亚胺基苯基)丁酸酯、磺基-sbed生物素标记转移试剂、琥珀酰亚胺基6-(3(2-吡啶基二硫代)丙酰胺基)己酸酯、琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯、磺基琥珀酰亚胺基6-(3'-(2-吡啶基二硫代)丙酰胺基)己酸酯、l-光反应-亮氨酸、l-光反应-甲硫氨酸、磺基琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯、piercebs(peg)5、磺基琥珀酰亚胺基2-((4,4'-叠氮戊酰胺基(azipentanamido))乙基)-1,3'-二硫代丙酸酯、磺基-nhs-ss-双吖丙啶、piercesm(peg)n、nhs-dpeg-mal、n-羟基磺基琥珀酰亚胺、磺基琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯、磺基琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐、n-α-马来酰亚胺基乙酰氧基琥珀酰亚胺酯、磺基-nhs-lc-生物素、双(磺基琥珀酰亚胺基)辛二酸盐、反式-4-(马来酰亚胺基甲基)环己烷-1-甲酸酯、双马来酰亚胺基己烷、1,8-双马来酰亚胺基-二甘醇、n-β-马来酰亚胺基丙酸酰肼、n-琥珀酰亚胺基3-(2-吡啶基二硫代)-丙酸酯、磺基琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯、3-(2-吡啶基二硫代)丙酰基酰肼、4-(4-n-马来酰亚胺基苯基)丁酸酰肼、3,3'-二硫代双(磺基琥珀酰亚胺基丙酸酯、双(磺基琥珀酰亚胺基)2,2,4,4-戊二酸酯-d4或琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯。
在一些情况中,附接至固体支持物或snap的炔烃衍生物可以是例如二苯并环辛炔-胺、二苯并环辛炔-酸、二苯并环辛炔-n-羟基琥珀酰亚胺基酯、二苯并环辛炔-n-羟基琥珀酰亚胺基酯、二苯并环辛炔-磺基-n-羟基琥珀酰亚胺基酯、二苯并环辛炔-磺基-n-羟基琥珀酰亚胺基酯、二苯并环辛炔-s-s-n-羟基琥珀酰亚胺基酯、二苯并环辛炔-peg4-n-羟基琥珀酰亚胺基酯、二苯并环辛炔-peg4-酸、二苯并环辛炔-马来酰亚胺、磺基-二苯并环辛炔-生物素缀合物、(1r,8s,9s)-二环[6.1.0]壬-4-炔-9-基甲基n-琥珀酰亚胺基碳酸酯、(1r,8s,9s)-二环6.1.0壬-4-炔-9-基甲醇、apn-bcn、(1r,8s,9s)-二环6.1.0壬-4-炔-9-基甲醇、乙基(1r,8s,9s)-二环6.1.0壬-4-烯-9-甲酸酯、炔烃-peg5-酸、(r)-3-氨基-5-己炔酸盐酸盐、(s)-3-氨基-5-己炔酸盐酸盐、(r)-3-(boc-氨基)-5-己炔酸、(s)-3-(boc-氨基)-5-己炔酸、n-boc-4-戊炔-1-胺、4-戊炔-1-胺、boc-炔丙基-gly-oh、3-乙炔基苯胺、4-乙炔基苯胺、pc生物素-炔烃、炔丙基氯甲酸酯、炔丙基-n-羟基琥珀酰亚胺基酯、n-z-4-戊炔-1-胺、1-叠氮基-2-(2-(2-乙氧基乙氧基)乙氧基)乙烷、o-(2-叠氮基乙基)庚乙二醇、click-
在一些情况中,与固相支持物、snap或生物分子附接的叠氮化物衍生物可以是例如(s)-5-叠氮基-2-(fmoc-氨基)戊酸、(s)-(-)-2-叠氮基-6-(boc-氨基)己酸(二环己基铵)、(s)-2-叠氮基-3-(4-叔丁氧基苯基)丙酸环己基铵盐、l-叠氮基高丙氨酸盐酸盐、(s)-2叠氮基-3-(3-吲哚基)丙酸环己基铵盐、(s)-2-叠氮基-3-甲基丁酸环己基铵盐、(s)-2-叠氮基-3-苯基丙酸(二环己基铵)盐、boc-3-叠氮基-ala-oh(二环己基铵)盐、n-boc-4-叠氮基-l-高丙氨酸(二环己基铵)盐、n-boc-6-叠氮基-l-正亮氨酸(二环己基铵)盐、boc-4-叠氮基-phe-oh、(s)-(-)-4-叔丁基氢2-叠氮基琥珀酸酯(二环己基铵)盐、n2-[(1,1-二甲基乙氧基)羰基]-n6-[(2-丙炔基氧基)羰基]-l-赖氨酸、fmoc-β-叠氮基-ala-oh、2-乙酰胺基-2-脱氧-β-d-吡喃葡萄糖基叠氮化物、2-乙酰胺基-2-脱氧-β-d-吡喃葡萄糖基叠氮化物3,4,6-三乙酸酯、2-乙酰胺基-3,4,6-三-o-苄基-2-脱氧-β-d-吡喃葡萄糖基叠氮化物、n-叠氮基乙酰基半乳糖胺-四酰基化物、n-叠氮基乙酰基葡糖胺、n-叠氮基乙酰基葡糖胺-四酰基化物、6-叠氮基-6-脱氧-1,2:3,4-二-o-异亚丙基-α-d-吡喃半乳糖、1-叠氮基-1-脱氧-β-d-吡喃半乳糖苷、1-叠氮基-1-脱氧-β-d-吡喃半乳糖苷四乙酸酯、6-叠氮基-6-脱氧-d-半乳糖、1-叠氮基-1-脱氧-β-d-吡喃葡萄糖苷、2-叠氮基-2-脱氧-d-葡萄糖、6-叠氮基-6-脱氧-d-葡萄糖、1-叠氮基-1-脱氧-β-d-吡喃乳糖苷、3-叠氮基-2,3-二脱氧-1-o-(叔丁基二甲基甲硅烷基)-β-d-阿拉伯糖基-吡喃己糖、2-叠氮基-d-半乳糖四乙酸酯、1,2-二-o-乙酰基-3-叠氮基-3-脱氧-5-o-(对甲苯酰基)-d-呋喃核糖、α-d-吡喃甘露糖基叠氮化物四乙酸酯、2,3,4,6-四-o-乙酰基-1-叠氮基-1-脱氧-α-d-吡喃半乳糖基氰化物、2,3,4-三-o-乙酰基-β-d-吡喃木糖基叠氮化物、3'-叠氮基-3'-脱氧胸苷、γ-(2-叠氮基乙基)-atp钠盐溶液、γ-[(6-叠氮基己基)-酰亚氨基]-atp钠盐、(2's)-2'-脱氧-2'-氟-5-乙炔基尿苷、5-乙炔基-2'-脱氧胞苷、n6-炔丙基-atp钠盐、4-乙酰胺基苯磺酰基叠氮化物、(e)-n-(2-氨基乙基)-4-{2-[4-(3-叠氮基丙氧基)苯基]二氮烯基]苯甲酰胺盐酸盐、叠氮基乙酸nhs酯、1-叠氮基金刚烷、4-叠氮基苯胺盐酸盐、(4s)-4-[(1r)-2-叠氮基-1-(苄氧基)乙基]-2,2-二甲基-1,3-二氧戊环、nhs-peg4-叠氮化物、[3as-(3aα,4α,5β,7aα)]-5-叠氮基-7-溴-3a,4,5,7a-四氢-2,2-二甲基-1,3-苯并间二氧杂环戊烯-4-醇、3'-叠氮基-3'-2-叠氮基-1-甲基喹啉鎓四氟硼酸酯、5-叠氮基戊酸、4-叠氮基苯甲酰甲基溴、4-叠氮基苯基异硫氰酸酯、3-(4-叠氮基苯基)丙酸、3-叠氮基-1-丙胺、3-叠氮基-1-丙醇、偶氮生物素-叠氮化物、生物素甲基吡啶叠氮化物、2-(4-{[4-(3-(叠氮基丙氧基)苯基]偶氮}苯甲酰胺基)乙基氨基甲酸叔丁酯、4-羧基苯磺酰叠氮化物、7-(二乙氨基)香豆素-3-羰基叠氮化物、溴化乙锭单叠氮化物、叠氮基乙酸乙酯、4-甲氧基苄基氧基羰基叠氮化物、芳基叠氮化物、双吖丙啶(diazierine)、或o-(2-氨基乙基)-o'-(2-叠氮基乙基)庚乙二醇、溴乙酰胺基-peg3-叠氮化物、碘乙酰胺叠氮化物、alexa
在一些情况中,可以使用snap的固有化学将snap共价附接至固体支持物。在一些情况中,固体支持物可以被对snap具有反应性的官能团覆盖。这些官能团例如可以是羟基、羰基、羧基、氨基、酰胺、叠氮化物、炔烃、烯烃、磷酸酯、巯基、硫醇、异硫氰酸酯、异氰酸酯、酰基叠氮化物、nhs酯、硅烷、磺酰氯、醛、酯、乙二醛、环氧化物、环氧乙烷、链烷硫醇、碳酸酯、芳基卤化物、酰亚胺酯、碳二亚胺、酸酐、氟苯基酯、胺、胸腺嘧啶或其组合。在一些情况中,snap可以具有可以与固体支持物上的官能团反应以形成共价键的官能团。例如,可通过使dna中的一个或多个胸腺嘧啶与固体支持物上的胺反应而将dnasnap附接至固体支持物。例如,多肽链n末端的-nh2或多肽链c末端的-cooh可与适当的官能团反应,并通过共价键附接至固体支持物。在一些情况中,例如,snap的官能团可以是羟基、羰基、羧基、氨基、酰胺、叠氮化物、炔烃、硅烷、烯烃、磷酸酯、巯基、硫醇、异硫氰酸酯、异氰酸酯、酰基叠氮化物、nhs酯、磺酰氯、醛、酯、乙二醛、环氧化物、环氧乙烷、链烷硫醇、碳酸酯、芳基卤化物、酰亚胺酯、碳二亚胺、酸酐、氟苯基酯、胺、胸腺嘧啶或其组合。其他生物缀合过程、反应和官能团在其他地方描述,其中其可用于将snap附接至固体支持物。这样的反应可以是自发的,或者可以通过施加热量或紫外线辐照来诱发。
在一些情况中,硅烷化学可用于生物缀合。在一些情况中,包含有机官能臂或有机反应臂的官能硅烷化合物可用于将生物分子与无机基质缀合。官能团或反应性基团的用于特定应用的适当的选择可允许蛋白质、寡核苷酸、全细胞、细胞器、或甚至组织切片附接至基质。用于这些应用的有机硅烷可以包括官能团或反应性基团,例如羟基、氨基、醛、环氧基、羧酸酯、硫醇、以及甚至烷基基团,以通过疏水相互作用结合分子。在一些情况中,使用3-氨丙基三乙氧基硅烷(apts)和3-氨丙基三甲氧基硅烷在无机表面或颗粒上形成官能团。在一些情况中,烷氧基一旦沉积在基质上,就会形成共价聚合物包衣,其中伯胺基团远离地粘在表面上并且可用于后续的缀合。可以使用碳二亚胺反应或还原胺化将含羧基或醛的配体直接偶联至氨丙基。在一些情况中,可替代地,最初用氨丙基硅烷化合物衍生化的表面可以进一步用间隔臂或交联剂修饰以产生用于偶联亲和配体或生物分子的反应性基团。例如,胺基可以用nhs-pegn-叠氮化物衍生化,用于点击化学或staudinger连接反应中,以连接蛋白质或其他生物分子。在一些情况中,可用胺反应性交联剂进一步将经apts修饰的表面衍生化,以产生另外的表面特征和反应性。用nhs–peg4–叠氮化物的修饰形成亲水性peg间隔子,所述间隔子以叠氮基终止,所述叠氮基可用于点击化学或staudinger连接反应中以偶联其他分子。
在一些情况中,在一个末端上包含胺反应性基团的其他交联剂也可以用于修饰和活化经apts修饰的基质。表面可以被设计成包含例如反应性肼或氨基氧基,用于与含羰基的分子例如通过碳水化合物的高碘酸盐氧化形成的醛或天然存在于糖和聚糖的还原末端上的醛缀合。
在一些情况中,可以使用戊二酸酐将atps表面上的胺基酰化以生成羧酸酯官能性,然后将其用nhs/dcc活化以形成nhs酯。该衍生物可用于通过酰胺键的形成来偶联含胺的蛋白质和其他分子。在第二活化策略中,用1,4-亚苯基二异硫氰酸酯(pditc)活化表面上的氨丙基,以产生末端异硫氰酸酯基团以偶联胺。两种方法均成功地将胺-树枝状聚合物偶联至用于在阵列中使用的二氧化硅表面。在一些情况中,可以使用以下方案将使用氨基硅烷化合物制备的胺表面修饰为包含羧酸酯基团,所述方案涉及与酸酐(例如琥珀酸酐或戊二酸酐)的反应。修饰后,然后使用与edc加磺基-nhs的碳二亚胺反应,将羧酸酯用于偶联含胺分子。在一些情况中,用戊二酸酐对apts表面进行修饰产生末端羧酸酯,用于偶联可用于生物缀合的含胺配体。
在一些情况中,氨基硅烷表面也可通过使用双官能交联剂活化以包含反应性基团,用于随后偶联至生物分子。在一种这样的反应中,使用n,n’-二琥珀酰亚胺基碳酸酯(dsc)与载玻片表面上的胺反应并产生末端nhs-碳酸酯基团,然后将其与可用于生物缀合的含胺分子偶联。在一些情况中,可以用dsc活化经apts修饰的表面,以形成胺反应性琥珀酰亚胺基碳酸酯,用于偶联蛋白质或其他含胺分子。
在一些情况中,含有羧酸酯基团的硅烷偶联剂可用于使具有羧酸的表面官能化,用于随后与含胺分子偶联。例如,羧乙基硅烷三醇在硅烷三醇无机反应性末端上含有乙酸酯有机基团。与大多数其他硅烷化试剂的情况一样,硅烷三醇组分可立即与无机-oh基质发生反应,而无需事先水解烷氧基。在一些情况中,羧乙基硅烷三醇已被用于向荧光二氧化硅纳米颗粒添加羧酸酯基团,以偶联用于多重细菌监测的抗体。该试剂可以类似的方式使用,以向许多无机或金属纳米材料中添加羧酸酯官能性,这还将产生负电荷排斥力,以保持颗粒在水溶液中的分散。在一些情况中,与羧基化表面的共价偶联然后可以通过以下来完成:用碳二亚胺活化羧酸基团,以促进与含胺分子的直接反应或形成中间体nhs酯,其可用于生物缀合。在一些情况中,羧乙基硅烷三醇可用于将无机基质修饰为含有羧酸酯基团,用于偶联含胺配体。
在一些情况中,硅烷修饰剂(例如环氧丙氧基)可用于生物缀合至表面基质。环氧丙氧基化合物含有反应性环氧基。根据反应的ph值,用这些硅烷偶联剂共价包衣的表面可用于缀合含硫醇、含胺或含羟基的配体。在一些情况中,可使用3-环氧丙氧基-丙基三甲氧基硅烷(gopts)或3-环氧丙氧基丙基三乙氧基硅烷将无机二氧化硅或其他含有-oh基团的金属表面与含有这些主要官能团中任何三个的生物分子连接。在一些情况中,含环氧基的硅烷偶联剂形成反应性表面,其可用于偶联可用于生物缀合的含胺、含硫醇或含羟基的配体。
在一些情况中,环氧化物与硫醇基的反应产生硫醚键,而与羟基的反应产生醚,并且与胺的反应产生仲胺键。环氧基的相对反应性是硫醇>胺>羟基,这由每个反应的最佳ph范围反映。在这种情况中,官能团的反应性越低,有效驱动反应所需的ph越高。
在一些情况中,异氰酸酯基团可用于与表面支持物的生物缀合。异氰酸酯基对亲核试剂具有极强的反应性,并会在水溶液中迅速水解,这特别有用于在非水性条件下与羟基共价偶联,适合与许多碳水化合物配体缀合。硅烷化可以在无水有机溶剂中完成,以形成反应性表面,同时保留异氰酸酯的活性。异氰酸丙基三乙氧基硅烷(icptes)在短丙基间隔子的末端包含异氰酸酯基,其与用于附接无机基质的三乙氧基硅烷基连接。在一些情况中,含异氰酸酯的硅烷偶联剂可用于将含羟基的分子偶联至可用于生物缀合的无机表面。
在一些情况中,通过将异氰酸酯基团与碳水化合物的官能团偶联并使用三乙氧基硅烷骨架形成二氧化硅聚合物,icptes可以用于产生新颖的壳聚糖-硅氧烷杂化聚合物。在一些情况中,icptes和apts组合使用以通过羧酸溶剂分解产生有机修饰的二氧化硅干凝胶,所述羧酸溶剂分解形成具有发光特性的杂化材料。
在一些情况中,纳米颗粒或微颗粒可作为表面支持物用于生物缀合。在一些情况中,颗粒类型和组成几乎是无限的形状和尺寸,包括球形、无定形或聚集的颗粒,以及精细的几何形状,如棒、管、立方体、三角形和锥形。另外,在纳米范围内出现了新的对称有机构建体,包括富勒烯(例如,巴基球(bucky-ball))、碳纳米管和树枝状聚合物,它们是用作生物缀合支架的高度定义的合成结构。颗粒的化学组成可以仅随其形状变化。颗粒可以包括聚合物或共聚物、无机构建体、金属、半导体、超顺磁性复合物、可生物降解的构建体、合成树枝状聚合物和树枝块。聚合物颗粒可以由多种不同的单体或共聚物组合构建。一些较常见的包括聚苯乙烯(传统的“胶乳”颗粒)、聚(苯乙烯/二乙烯基苯)共聚物、聚(苯乙烯/丙烯酸酯)共聚物、聚甲基丙烯酸甲酯(pmma)、聚(甲基丙烯酸羟乙酯)(phema)、聚(乙烯基甲苯)、聚(苯乙烯/丁二烯)共聚物和聚(苯乙烯/乙烯基甲苯)共聚物。在一些情况中,通过将官能性单体的组合混合到聚合反应中,可以在颗粒表面上产生反应性基团或官能团,用于随后与亲和配体偶联。这样的一个示例是聚(苯乙烯/丙烯酸酯)共聚物颗粒,其在聚合物结构内产生羧酸酯基团,其数目取决于聚合过程中所用单体的比例。在一些情况中,无机颗粒被广泛用于各种生物应用中。例如,金纳米颗粒可用于免疫组织化学(ihc)染色和侧流诊断测试的检测标记。在一些情况中,在生物应用例如生物缀合中使用颗粒涉及通过被动吸附或共价偶联将亲和捕获配体附接至其表面上。亲和配体与此类颗粒的偶联产生了选择性结合复杂样品混合物中的生物靶标的能力。因此,亲和颗粒复合物可用于分开和分离蛋白质或其他生物分子,或用于特异性检测这些靶标在细胞、组织切片、裂解物或其他复杂生物样品中的存在。在一些情况中,用于将亲和配体偶联至纳米颗粒或微颗粒的反应与用于本文所述分子的生物缀合的那些反应基本相同。
在一些情况中,用于生物应用(例如生物缀合)的颗粒类型是聚合物微球或纳米球,其包含由长的、缠绕的线性或交联聚合物构成的球形的无孔的“硬”颗粒。在一些情况中,这些颗粒的产生涉及使用乙烯基单体的乳液聚合过程,有时在二乙烯基交联单体的存在下。在一些情况中,较大的微颗粒可以通过小得多的纳米颗粒种子的生长从连续的聚合步骤来构建。在一些情况中,聚合物颗粒包括聚苯乙烯、或苯乙烯的共聚物,例如苯乙烯/二乙烯基苯、苯乙烯/丁二烯、苯乙烯/丙烯酸酯或苯乙烯/乙烯基甲苯。其他常见的聚合物支持物包括聚甲基丙烯酸甲酯(pmma)、聚乙烯基甲苯、聚(甲基丙烯酸羟乙酯)(phema)和共聚物聚(二甲基丙烯酸乙二醇酯/甲基丙烯酸2-羟乙酯)[聚(egdma/hema)]。
在一些情况中,将生物分子附接至疏水性聚合物颗粒上的一种方法是使用被动吸附。在一些情况中,蛋白质在疏水性颗粒上的吸附是通过非极性或芳族氨基酸残基与颗粒上的表面聚合物链的强相互作用而进行,同时伴随着水分子的排除。由于蛋白质通常包含具有主要亲水性的表面的疏水性核心结构,因此它们与疏水性颗粒的相互作用必然涉及显著的构象变化,以产生大规模的疏水性接触。
在一些情况中,颗粒类型包含内置于聚合物骨架中并展示在其表面上的官能团。这些基团的量可以根据聚合过程中使用的单体的类型和比例或已经进行的二次表面修饰的程度而广泛地变化。在一些情况中,官能化的颗粒可用于通过适当的反应条件共价偶联生物分子。
颗粒上用于生物缀合的常见的官能团或反应性基团
在一些情况中,颗粒可以与用于生物缀合的交联剂偶联。
在一些情况中,可以通过改变包含snap的dna的序列来改变dnasnap与固体支持物的附接速率,或者附接的功效或强度。例如,在dnasnap通过涉及一个或多个胸腺嘧啶的反应附接至固体支持物的情况中,可以通过改变dna序列中胸腺嘧啶的数量来改变附接。在一些情况中,增加胸腺嘧啶的数量可以促进snap与固体支持物的附接。
在一些情况中,固体支持物是流动池的一部分。在一些情况中,snap可以附接至流动池中的固体支持物。在一些情况中,snap可以直接与流动池中的固体支持物缀合。在一些情况中,snap可以被吸附至流动池中的固体支持物上。将snap附接在流动池中可以允许snap在其附接至固体支持物上时的可视化。通过在附接过程期间监控附接的snap的与附接位点的数量相比的数量,可以优化snap的附接。在一些情况中,可以通过在附接过程期间监控snap覆盖的固体支持物的面积以及snap未占用的固体支持物的面积来优化snap的附接。
在一些情况中,snap可以直接在流动池中缀合。在一些情况中,snap可以与流动池内的表面缀合。在一些情况中,snap可以与流动池内的表面缀合,然后再与生物实体或化学实体缀合。在一些情况中,生物实体或化学实体可以流入流动池并与已经与固体支持物缀合的snap缀合。在一些情况中,可以将生物实体或化学实体与snap缀合,然后将snap引入流动池并与流动池中的固体支持物缀合。在一些情况中,可以将生物实体或化学实体和snap引入到流动池中并使其在流动池内彼此缀合,然后将snap缀合至流动池内的固体支持物。
在一些情况中,可以将生物实体或化学实体与snap缀合,然后将snap附接至固体支持物。进行这样的反应后,可以纯化产物以将缀合的snap-生物/化学实体部分与未缀合的snap和生物/化学实体分离开。
本公开的方法可以用于在空间上分开生物实体或化学实体。在一些实施方案中,本公开的方法可用于在空间上分开蛋白质、小分子、dna、rna、糖蛋白、代谢产物、碳水化合物、酶或抗体。在一些实施方案中,本公开的方法可用于在空间上分开复合物,例如包含两种或更多种蛋白质的蛋白质复合物、蛋白质核酸复合物或其他复合物。在一些情况中,所述方法可用于在空间上分开病毒颗粒或类病毒。在一些情况中,所述方法可用于分开细胞,例如细菌细胞、微生物细胞、哺乳动物细胞或其他细胞。
在一些实施方案中,可以将snap形成在种子上,然后将种子附接至生物实体或化学实体上。
在一些实施方案中,本公开提供了一种组合物,其包含附接至蛋白质的核酸snap、附接至小分子的核酸snap、附接至蛋白质复合物的核酸snap、附接至蛋白质核酸snap的核酸snap、附接至碳水化合物的核酸snap、附接至病毒颗粒的核酸snap或附接至细胞的核酸snap。
在一些实施方案中,本公开提供了一种组合物,其包含附接至蛋白质的树枝状聚合物、附接至小分子的树枝状聚合物、附接至蛋白质复合物的树枝状聚合物、附接至蛋白质树枝状聚合物的树枝状聚合物、附接至碳水化合物的树枝状聚合物、附接至病毒颗粒的树枝状聚合物或附接至细胞的树枝状聚合物。
在一些情况中,可通过裂解光可裂解键或通过化学或酶促消化snap将生物实体或化学实体从固体支持物洗脱。
在一些情况中,生物实体或化学实体可以直接附接至固体支持物,而snap阻止其他生物实体或化学实体在紧邻处附接。在一些情况中,生物实体或化学实体可以直接附接至微孔或纳米孔内的附接位点,并且可以选择snap的尺寸以防止多于一个的snap占用微孔或纳米孔。在这种情况中,可以通过裂解光可裂解键或通过化学或酶促消化snap来去除snap。
在一些实施方案中,本公开的snap可以用作纳米颗粒。例如,本公开的snap可以用作用于检测或可视化的纳米颗粒。在一些情况中,可形成核酸snap,其并入包含荧光部分的经修饰的核苷酸。本领域已知的任何经荧光标记的核苷酸可以用于本公开的snap中。经荧光标记核苷酸的示例包括但不限于alexa
在一些情况中,可以设计本公开的snap,使得可以将探针附接至snap的表面上。带有附接的探针的snap可用作检测试剂。在一些情况中,还用荧光部分标记了带有附接的探针的snap,以形成荧光检测试剂。在一些情况中,带有附接的探针和荧光部分的snap可提供高度的信号放大。可以对snap上的探针量进行滴定,以达到期望程度的样品扩增。在一些情况中,尺寸不同的snap可以附接至不同的探针。在一些情况中,颜色不同的snap可以附接至不同的探针。在一些情况中,不同探针的文库可以附接至经荧光标记的snap,使得第一探针附接至snap,所述snap的尺寸和/或颜色不同于其他探针各自附接的snap。
实施例
实施例1–dnasnap的生成
将寡核苷酸在dh2o中重构至最终浓度为100um,例外是将延伸引物重构为500um(2.9mg/ml)。将延伸引物缀合至深红色200nm珠。
引物1-5’-gccagggtgcgagggtttgtttcattgcttcacgcccttaccctcgcaccctggcacgg
引物2-5’-tcccacggtggcacctcgcacct
引物3-5’-cgcacgctgccaccctcgcttttgcgagggtggcagcgt
引物4-5’-gcgaggtgcgaggtgccaccgtgggaccgt
延伸引物-5’-aagggcgtgaagcaatga
模板扩增
准备了以下子混合物:
子混合物1:
水187.5μl
1mtris-hclph7.512.5μl
引物1[100um]50μl
子混合物2:
子混合物3:
水187.5μl
1mtris-hclph7.512.5μl
引物3[100um]50μl
将每个子混合物等分成100μl等分试样,并按照以下说明进行孵育:
热循环仪条件:
95℃30秒
以0.1℃/s下降至50℃
保持在4℃
滚环模板的连接
混合物:
子混合物1100μl
子混合物2100μl
子混合物3100μl
连接:
10xnebt4dna连接酶缓冲液200μl
混合的寡核苷酸子混合物[5um]200μl
水1500μl
混合。
添加100μlnebt4dna连接酶[400,000u/ml]
将完整混合物等分到pcr管中,并在20℃孵育约20小时,然后在65℃孵育10分钟。
合并溶液,并添加50μl100um储备延伸引物并混合。将混合物等分为pcr管中的100μl等分试样,并进行以下温度条件:
热循环仪条件:
70℃30秒
以0.1℃/s下降到40℃
保持在4℃
此时可以将模板存储在-20℃直至准备使用。
用于纳米颗粒构建的滚环扩增
pcr混合物:
涡旋混合然后添加:
引物化的滚环模板300μl
涡旋混合然后添加:
nebphi29聚合酶[10ku/ml]50μl
颠倒混合。将反应混合物等分为pcr管中的63μl等分试样。
如下孵育:
30℃持续120分钟
65℃持续10分钟
合并样品并添加90ul250mmedta。
将样品在12,500g下于4℃离心5分钟。回收上清液并丢弃白色沉淀。
纳米球的分析
对样品(100ul)以1:100进行系列稀释+1:10稀释,然后添加2ulsybrgold(1x)。在胺表面处理过的载玻片上施加1ul斑点并成像。如图3和图4所示,成功地形成了dnasnap,并且在dnasnap和深红色球之间发现了高度的共定位。
结合分析
在一些情况中,snap可以从其附接的表面(例如芯片或阵列)上去除。snap的去除可以例如通过大量的乙腈、高浓度的氢氧化钠或高浓度的盐来介导。大量的乙腈可以是至少约20%、30%、40%、50%、60%、70%、80%、90%或100%乙腈的最终百分比。大量的氢氧化钠可以为至少约0.1m、0.5m、1m、2m、3m、4m、5m、6m、7m、8m、9m或10m。大量的盐可以为至少约0.1m、0.5m、1m、2m、3m、4m、5m、6m、7m、8m、9m或10m。使用的盐可以是例如mgcl2或nacl。在一些情况中,离液剂(例如dmso或甲酰胺)可以介导snap的去除。
实施例2–使用epimarktaq聚合酶产生snap
在另一个实施例中,使用epimarktaq聚合酶优化了snap的产生。snap模板是根据实施例1所述的方法([0093]-[0098]段)制备。确定taq聚合酶比phi29聚合酶对snap尺寸的控制更好。使用8683ng模板制备500μl反应混合物。在1.5mlpcr管中混合以下试剂:
pcr混合物:
将pcr混合物在pcr管中短暂涡旋。涡旋后,将2.5μlepimarktaq聚合酶添加到pcr混合物中。颠倒pcr管以使聚合酶与其他试剂混合。将pcr混合物置于热循环仪中。首先使模板dna在94℃下变性30秒。在以下热条件下,将反应混合物扩增30个循环:
在94℃变性30秒;
在53℃退火60秒;
在68℃延伸30秒;
在最后的热循环之后,将snap在68℃再保持5分钟。然后将pcr管冷却至4℃并保持直至纯化。
合成后纯化snap。经由edta旋转纯化方法去除dntp。将30μl的250mmedta加入pcr管中的500μlpcr混合物中。将pcr试管在4℃下以12,500g离心5分钟。保存上清液并弃去沉淀。将snap样品用0.22μm滤管过滤,然后使用梯度法使用aktafplc纯化。使用各自1l的去离子水和1mnacl溶液(已通过0.22μm过滤器过滤),通过阴离子交换色谱法纯化snap。收集含snap的级分后,将溶液在透析盒中使用过夜透析进行脱盐。使用真空离心机浓缩snap。将溶剂在28℃蒸发约4小时,直到最终体积小于500μl。
实施例3:snap的纯化
可以如本文所述产生一批snap。snap产生后,即可将其纯化。下面描述了如何纯化snap的三步示例方案。
步骤1:阴离子交换色谱法
快速蛋白质液相色谱法(fplc)阴离子交换色谱用于纯化snap。在这里,盐梯度用于分离带不同电荷的dna分子(snap)用于收集。收集三个级分(底部,中间,顶部)用于分析。
阴离子交换纯化的一个示例在图5中示出。在纯化之前,动态光散射用于测量样品中颗粒的流体动力学半径(左分图)。半径在约0.1nm至10,000nm之间分布。在阴离子交换纯化过程中,收集存在于鉴定的目标峰(中间分图)中的样品。动态光散射用于测量纯化样品中颗粒的流体力学半径,发现样品包含具有约100nm和约1000nm流体力学半径的snap。
在一些情况中,可以使用尺寸排阻色谱法代替阴离子交换色谱法用于纯化。
使用标准显微镜方案对来自三个通道的样品进行成像(图6,左),并对强度进行定量(右)。底部通道的snap展示出比中间通道和顶部通道的snap更高的强度。因此,在一些情况中,snap的尺寸和/或亮度可能会以特定的阴离子交换级分洗脱。
步骤2:透析
进行阴离子交换色谱法后,通过标准透析方案除去盐。简而言之,透析是一种分离技术,其可以通过选择性和被动扩散通过半透膜来促进从溶液中的大分子(例如snap)去除小的不需要的化合物(例如盐)。将包含需要除盐的snap的经阴离子交换纯化的样品和缓冲溶液放在膜的对置侧。snap保留在膜的样品侧,但是盐能够自由通过膜。盐集中在与snap相对的膜一侧,因此降低了样品中盐的浓度。通过这种方式,样品中诸如盐之类的小污染物的浓度被降低到可接受或可忽略的水平。
步骤3:浓度
与常规方法相比,使用标准的真空离心方案,可以以最小的损失浓缩成批snap。
snap可以浓缩至1μm至100μm的最终浓度。例如,生产的成批snap的浓度为约63.6μm、47.5μm、38μm和8.9μm。
图7显示了不同snap批次在260nm(a260)迹线处的吸收光谱。使用不同的荧光dntp类型、不同供应商的荧光dntp、不同荧光染料、不同的taq聚合酶和/或不同供应商使用的taq聚合酶生产各个批次。每个snap显示相似的吸收谱。
实施例4:期望尺寸的snap的产生
如本文所述产生snap,并测量纳米颗粒尺寸。
用于测量纳米颗粒(例如,snap)尺寸的方法可以包括动态光散射,纳米颗粒跟踪分析和显微镜技术,例如透射电子显微镜(tem)、扫描电子显微镜(sem)和原子力显微镜(afm)。
本文使用的动态光散射可以通过整个snap群体的相长和相消干涉图样来测量扩散系数。如果颗粒的尺寸大于30nm,则纳米颗粒跟踪分析可以通过对单个颗粒进行颗粒跟踪来测量扩散系数。包括tem、sem和afm在内的显微镜技术可以测量颗粒尺寸,并可以在不依赖于光散射的情况下对单个颗粒进行后续图像分析。
使用标准成像方案拍摄图像,并通过阴离子交换色谱法确定snap的流体力学半径为25nm至27nm。在一些应用中此尺寸范围可以允许多个snap占用每个特征。如图8所示,观察到这些小的snap被共定位在单一特征内。在此实施例中,将snap应用于阵列并成像(底部分图为snap1,中间分图为snap2),并通过合并图像确定共定位(顶部分图)。
在另外的实验中,将较大的snap应用于芯片表面。在这种情况中,大snap会自己排列在芯片表面上,从而实现“特征的单一占用”。图9示出了应用于具有特征的芯片的具有大流体动力学半径的snap。snap在底部(snap1)和中间(snap2)图像中成像,并且这些图像在顶部图像中叠加(snap1和snap2)。没有观察到明显的共定位。因此,当snap尺寸较大时,它们可以位于特征上,具有很少共定位。相反,当snap尺寸较小时,在一些情况中它们可以共定位至特征。
为了确定snap的合适尺寸范围,可以测量阵列上的snap的占用。可以将其测量为亮度相比于稀释度。
将snap滴定至范围为10-5至100的稀释度,并应用于阵列,并使用动态光散射测量信号。对于每个稀释度,确定了计数数量和snap占用的特征数量(图10)。暗线表示荧光对照,而亮线表示snap。虚线表示所占用特征的数量,而实线表示计数的数量。对于染料相比于阵列上的snap,观察到小分子的不同信号趋势。
对于snap记录了恒定的计数数量(实亮线),而与稀释因子无关,这可表明snap在阵列的特征上的离散占用。
观察到所占用特征的表观数量随检测阈值变化(虚亮线)。这可以表明所占用特征的数量可以是稀释度的函数。针对检测灵敏度和特异性可以制定观测者操作特性(roc)曲线。
产生的snap可以有多种尺寸。在一些情况中,snap的直径可以是约1nm、10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、150nm、200nm、250nm或300nm。直径可以是大直径、小直径或平均直径。在一些情况中,可以产生snap,使得可以产生具有一定直径范围的snap。
实施例5:snap的亮度
将一批snap分别应用于具有特征的阵列,并使用标准成像方案成像。其中最大灰度值为约12,000,具有和不具有snap的区域之间的灰度值差为约6,000,如通过跨阵列的灰度值变化所测量。因此,snap能够与阵列结合,并且可以检测到缀合的snap。
实施例6:snap浓度的测量
snap浓缩后,可以测量snap的浓度。例如,可以使用邻苯二甲醛(opa)游离胺反应来定量缀合胺的snap,如图12左上方所示。简而言之,opa可以与胺反应以使得能够进行荧光检测,并且可以在执行标准曲线(例如,0至100μm的聚t胺系列稀释,图12的左下方)时使得能够进行定量。
在ex/em:380nm/460nm下测量了三个独立批次的snap中由这种反应产生的荧光,如图12所示(右)。定量a260(在260nm处的吸光度),并将其应用于标准曲线以确定每个批次的浓度。确定这三个批次的浓度为47.5μm、38μm和8.9μm。确定另一个批次的浓度为63.6μm(数据未显示)。该测定可以测量至少1μm至100μm范围的snap浓度。在一些情况中,可以根据需要稀释snap样品以适合此范围。使用该测定,可以测量相对少量的经胺修饰的dna(例如,snap)。
实施例7:snap缀合#1
进行实验使得在芯片上进行叠氮化物-alexafluor586与snap的点击缀合。通过流动将dbco-snap(488)(具有缀合至可以在488nm发出荧光的染料的dbco基团的snap)固定在阵列上,并在488nm(snap通道)和575nm(叠氮化物染料通道)处采集图像。然后,将可以在568nm发出荧光的叠氮化物-568(叠氮化物-alexafluor568)在阵列上孵育,以使dbco与叠氮化物之间发生缀合反应,并且在孵育后洗涤阵列。在该方案后,再次在488nm和575nm处采集图像,以评估dbco-叠氮化物反应的程度。孵育后,叠氮化物染料通道显示出比以前明显更多的荧光。snap通道(对照)在反应之前和之后显示相似的信号(图14)。这表明在芯片(阵列)上dbco和叠氮化物之间的点击缀合是可行的。
对于两个通道,在孵育前和孵育后,测量了暗(较暗阴影)和亮(较亮阴影)切片的信噪比和强度(图14)。这些数据证实点击反应后强度显著增加,并且点击反应在芯片上良好执行。
然后将另一组snap固定在阵列上,并与叠氮化物-alexafluor568缀合,其中叠氮化物-alexafluor568以特征总数量的10倍过量施用。每个流动通道大约有2350万个特征。在孵育之前和之后在488nm和568nm处拍摄图像,并对强度进行定量。488nm处的强度在488nm处稍微更低,这可能是封闭溶液的差异手动洗涤的影响(图15)。与10x叠氮化物-alexafluor568孵育后,568nm处的强度显著更高(约2-2.5倍),如图16所示。换句话说,在将叠氮化物-alexafluor568以每通道特征数量的10倍过量缀合后,在568nm处观察到均匀的定位信号。
实施例8:snap缀合#2
进行实验使得在芯片上进行pe-缀合(r-藻红蛋白-缀合)的叠氮化物的点击缀合。使用dbco柄和能够在488nm发出荧光的核苷酸制备snap。将snap沉积在芯片表面上,并允许孵育1小时以附接至芯片表面。将芯片与封闭缓冲液孵育15分钟至30分钟,然后使带有胺上叠氮化物柄的pe(1mg/ml)流经芯片,使得有1000×摩尔过量的pesnap。然后将芯片孵育过夜。然后将通道用具有2%吐温(pbst)的磷酸盐缓冲盐水洗涤并成像。
图像如图17所示。总体而言,整个流动通道中存在高pe信号,这可表明存在明显高的非特异性结合。观察到点状信号或开特征和关特征。观察到开特征通常更高约2000个计数。dbcosnap存在于特征上,并且产生的信号比来自pe的信号低。在一些情况中,可以优化snap的批次,例如通过提高质量和增加浓度来产生更好的结果。也可以进行滴定系列(所用pe的滴定量)。另外,优化封闭程序可以改善结果。
实施例9:生物素化的点击处理的裂解物缀合
可以将使用dbco柄制备的snap沉积在芯片表面上,并允许孵育足够长的时间以附接至芯片表面。然后可以将芯片与封闭缓冲液孵育15分钟至30分钟。
可以将裂解物生物素化,并可以使用叠氮化物点击修饰剂对其进行处理。可以使生物素化的裂解物流经芯片,以允许裂解物与dbcosnap的点击缀合。然后可以例如通过链霉亲和素叶(streptavidinlobe)检测裂解物。
实施例10:dna折纸
dna折纸snap可以例如使用dbco柄进行制备,并且可以沉积在芯片表面上,并允许孵育足够长的时间以附接至芯片表面。在一些情况中,dna折纸snap可以网格状方式沉积在阵列上。在一些情况中,折纸snap可以为约300nm。
在一些情况中,与其他类型的snap相比,dna折纸snap可以提供snap组织的灵活性,snap的形状、设计和尺寸设定。
实施例11:将来自裂解物的蛋白质固定在阵列上
将snap通过流动固定在阵列上。使用具有100×100微米视场的标准成像方案检测snap荧光(图18a和图18d)。将包含生物素柄的大肠杆菌裂解物施加于阵列,并允许蛋白质结合snap。作为对照,将snap暴露于缺乏生物素柄的裂解物并允许与之缀合。用100×100微米的视场,使用标准的成像方案使用荧光链霉亲和素(所述荧光链霉亲和素可以结合生物素以进行检测)进行荧光成像,以检测裂解物,如图18b(生物素柄)和图18e(对照)所示。由于固定的裂解物不含生物素标签,因此荧光链霉亲和素无法检测蛋白质。该对照证明了在(b)中观察到的检测信号对固定的蛋白质是特异性的(即,链霉亲和素检测试剂与阵列表面没有非特异性结合)。
在图18c(生物素柄)和18f(对照)中,将黑和白图像复合以显示snap和经生物素处理的裂解物的共定位。在共定位图像中,白色表示共定位,并且黑色表示没有共定位。
在图像的左下角可以看到基准。可以将没有特征图案化的hmds道视为视场顶部和右侧边缘上的暗条纹。可以看到子阵列内各个特征上的snap。注意:由于荧光从检测通道串道进入该通道,因此snap也更易于可视化(参见b)
实施例12:短肽表位(三聚体)的特异性检测
将经荧光标记的snap通过流动固定在阵列上。使小肽(hhh*)与snap缀合。作为对照,将snap固定在芯片上,并且没有肽与snap缀合。施加对小hhh肽具有特异性的荧光适体。使用具有35×35微米视场的标准成像方案检测snap荧光(图19a和图19d)。该视场可以显示芯片上一个子阵列的角。固定的snap可以看作是阵列上的离散斑点(这些斑点中的每个的直径为300nm)。
使用标准方案,在可以检测适体的不同荧光通道中的相同区域中进行荧光成像以检测肽(图19b(肽)和图19e(无肽对照))。
将黑图像和白图像复合以显示snap和hhh肽的共定位。图19c(肽)和图19f(无肽对照)显示了snap肽通道和适体检测通道之间荧光的共定位。共定位可以表明hhh肽在阵列特征上的snap上的成功结合和鉴定。因为在图19f中没有结合的适体,所以对照图像的合并图像没有显示出共定位。
在无肽对照图像中,由于hhh肽无法与阵列上的snap结合,因此在适体荧光通道中未检测到hhh。因此,该结果可以证实hhh肽是1)直接附接至snap和2)仅在存在靶肽时才能观察到在适体通道中观察到的信号。
在图像的右下角可以看到两个铬基准标记。图像中较暗的通道是经hmds包衣的区域,其不包含图案化的特征。
虽然已经在本文示出和描述了本发明的优选实施方案,但对本领域技术人员将显而易见的是,仅通过示例的方式来提供这样的实施方案。在不脱离本发明的情况下,本领域技术人员此时将想到许多变型、改变和替代。应该理解,在实践本发明时可以采用本文描述的本发明的实施方案的各种替代方案。意图是以下权利要求限定本发明的范围,并且在这些权利要求范围内的方法和结构及其等同方案也包括在本发明内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



