蛋白质ZmHEI10在调控玉米产量和抗病性中的应用的制作方法
 2021-02-02 15:02:32|
2021-02-02 15:02:32| 346|
346| 起点商标网
起点商标网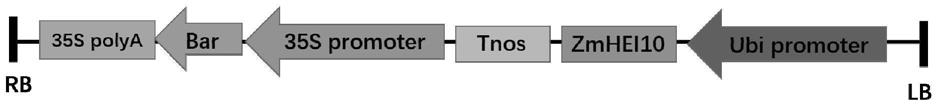
蛋白质zmhei10在调控玉米产量和抗病性中的应用
技术领域
[0001]
本发明属于生物技术领域,具体涉及蛋白质zmhei10在调控玉米产量和抗病性中的应用。
背景技术:
[0002]
玉米是世界上最重要的粮食和饲料作物之一。随着中国经济的发展,玉米播种面积和产量连年增长,在我国农业生产和国民经济中占有十分重要的地位。但近些年来,玉米产量一直停滞不前,因此研究和发掘有重大应用价值的新基因或已知基因的新功能,并利用这些基因提高作物产量十分重要。
[0003]
玉米茎腐病又称玉米茎基腐病或青枯病,该病害由多种病原菌单独或复合侵染引起,主要危害玉米植株的根系和茎基部。一般年份的发病率为15%-20%,严重时可达70%以上,该病害导致的玉米产量损失一般在20%左右,严重的达到50%左右。玉米茎腐病在中国玉米主产区均有发生,特别是近年来,随着玉米重迎茬面积不断增加,秸秆还田措施的推广应用,免耕播种和密植技术的应用,使得玉米茎腐病逐渐加重,已成为玉米生产中亟待解决的问题和重要限制因素之一。因此,在拓宽玉米种质基础的前提下,充分挖掘抗病基因资源,开展抗病遗传研究以及抗病育种工作,是防治玉米茎腐病最根本的有效途径。目前国内茎腐病抗病基因挖掘已取得较大进展,中国农业大学徐明良课题组在研究玉米病害方面取得了显著成绩,已经精细定位到玉米茎腐病的主效抗病基因,为抗病育种提供了理论依据。
技术实现要素:
[0004]
本发明的目的是提高玉米产量。
[0005]
本发明首先保护蛋白质zmhei10的应用,可为如下s1)至s3)中的至少一种:
[0006]
s1)调控植物产量;
[0007]
s2)调控植物抗病性;
[0008]
s3)培育产量改变和/或抗病性改变的转基因植物。
[0009]
上述应用中,所述蛋白质zmhei10为可a1)或a2)或a3):
[0010]
a1)氨基酸序列是序列表中序列1所示的蛋白质;
[0011]
a2)在序列表中序列1所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
[0012]
a3)将a1)或a2)所示的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物产量和/或抗病性相关的蛋白质。
[0013]
其中,序列表中序列1由295个氨基酸残基组成。
[0014]
为了使a1)中的蛋白质便于纯化,可在序列表中序列1所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
[0015]
表1.标签的序列
[0016]
标签残基序列
poly-arg5-6(通常为5个)rrrrrflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
[0017]
上述a3)中的蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
[0018]
上述a3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
[0019]
上述a3)中的蛋白质的编码基因可通过将序列表中序列2所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上表1所示的标签的编码序列得到。
[0020]
本发明还保护编码所述蛋白质zmhei10的核酸分子的应用,可为如下s1)至s3)中的至少一种:
[0021]
s1)调控植物产量;
[0022]
s2)调控植物抗病性;
[0023]
s3)培育产量改变和/或抗病性改变的转基因植物。
[0024]
上述应用中,所述编码蛋白质zmhei10的核酸分子可为如下b1)或b2)或b3)或b4)所示的dna分子:
[0025]
b1)编码区是序列表中序列2所示的dna分子;
[0026]
b2)核苷酸序列是序列表中序列2所示的dna分子;
[0027]
b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质zmhei10的dna分子;
[0028]
b4)在严格条件下与b1)或b2)限定的核苷酸序列杂交,且编码所述蛋白质zmhei10的dna分子。
[0029]
其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
[0030]
其中,序列表中序列2由888个核苷酸组成,序列表中序列2的核苷酸编码序列表中序列1所示的氨基酸序列。
[0031]
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述蛋白质zmhei10的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述蛋白质zmhei10的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述蛋白质zmhei10,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
[0032]
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列表的序列1所示的氨基酸序列组成的蛋白质zmhei10的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
[0033]
上述任一所述产量改变可为产量提高。
[0034]
上述任一所述抗病性改变可为抗病性增强。
[0035]
上述任一所述调控植物产量可为提高植物产量。
[0036]
上述任一所述调控植物抗病性可为增强植物抗病性。
[0037]
本发明还保护一种培育转基因植物的方法,可包括如下步骤:提高出发植物中所述蛋白质zmhei10的表达量和/或活性,得到转基因植物;与出发植物相比,转基因植物的产量提高和/或抗病性增强。
[0038]
上述方法中,所述“提高出发植物中所述蛋白质zmhei10的表达量和/或活性”可通过转基因、多拷贝、改变启动子、调控因子等本领域熟知的方法,达到提高出发植物中上述任一所述蛋白质zmhei10的表达量和/或活性的效果。
[0039]
上述方法中,所述“提高出发植物中蛋白质zmhei10的表达量和/或活性”可通过向出发植物中导入编码所述蛋白质zmhei10的核酸分子实现。
[0040]
上述方法中,所述“向出发植物中导入编码所述蛋白质zmhei10的核酸分子”可通过向出发植物中导入重组载体实现;所述重组载体可为向表达载体插入编码所述蛋白质zmhei10的核酸分子,得到的重组质粒。
[0041]
所述重组载体具体可为重组质粒pbcxun-ubip-zmhei10-nos。所述重组质粒pbcxun-ubip-zmhei10-nos可为向植物表达载体pbcxun-ubip的限制性内切酶xcmi之间插入核苷酸序列是序列表中的序列2所示的dna分子(即zmhei10基因),得到的重组质粒。
[0042]
本发明还保护一种植物育种方法,可包括如下步骤:增加植物中所述蛋白质zmhei10的表达量和/或活性,从而提高产量和/或增强抗病性。
[0043]
上述任一所述植物可为如下c1)至c5)中的任一种:c1)双子叶植物;c2)单子叶植物;c3)禾本科植物;c4)玉米;c5)玉米自交系b73-329。
[0044]
上述任一所述产量可表现为百粒重和/或穗粒数。
[0045]
上述任一所述抗病性可为抗茎腐病。
[0046]
上述任一所述抗病性可为抗禾生腐霉菌和/或谷镰刀菌引起的病害。
[0047]
实验证明,在玉米自交系b73-329中过表达蛋白质zmhei10,可以提高玉米产量和茎腐病抗性;玉米产量提高表现为百粒重增加和穗粒数增加。蛋白质zmhei10可以调控玉米产量和茎腐病抗性。本发明具有重要的应用价值。
附图说明
[0048]
图1为重组质粒pbcxun-ubip-zmhei10-nos的结构示意图。
[0049]
图2为t
2
代纯合转zmhei10基因玉米株系百粒重的增长率的统计结果。
[0050]
图3为t
2
代纯合转zmhei10基因玉米株系穗粒数的增长率的统计结果。
[0051]
图4为t
2
代纯合转zmhei10基因玉米株系产量的增长率的统计结果。
[0052]
图5为t
2
代纯合转zmhei10基因玉米株系对茎腐病抗性的鉴定结果。
具体实施方式
[0053]
以下的实施例便于更好地理解本发明,但并不限定本发明。
[0054]
下述实施例中的实验方法,如无特殊说明,均为常规方法。
[0055]
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
[0056]
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
[0057]
根癌农杆菌eha105记载于如下文献中:影响根癌农杆菌eha105感受态细胞转化效率因素的研究,热带生物学报,2012,3(1):22-27.公众可以从中国农业大学(即申请人处)获得,以重复本实验。
[0058]
植物表达载体pbcxun-ubip为将pbcxun载体(记载于如下文献中:chen songbiao,songkumarnpattavipha,liu jianli,et al.a versatile zero background t-vector system for gene cloning and functional genomics.[j].plant physiol.,2009,150:1111-21.)中的hyg基因更换为bar基因得到的重组质粒。bar基因的核苷酸序列如序列表中序列3所示。植物表达载体pbcxun-ubip中,启动子为ubiquitin启动子,终止子为t-nos终止子。植物表达载体pbcxun-ubip具有抗膦丝菌素抗性(又称草胺磷抗性)。
[0059]
玉米自交系b73-329记载于如下文献中:zhang m,cao y,wang z,et al.a retrotransposon in an hkt1family sodium transporter causes variation of leaf na+exclusion and salt tolerance in maize[j].new phytologist,2017.,在文献中的名称为玉米b73-329。
[0060]
实施例、转zmhei10基因玉米的获得及鉴定
[0061]
一、重组质粒pbcxun-ubip-zmhei10-nos的构建
[0062]
1、取植物表达载体pbcxun-ubip,用限制性内切酶xcmi进行酶切,获得线性化的载体。
[0063]
酶切体系为25μl,包括18μl ddh
2
o、4μl植物表达载体pbcxun-ubip水溶液(含800ng植物表达载体pbcxun-ubip)、2.5μl neb buffer2和0.5μl限制性内切酶xcmi。
[0064]
酶切条件:37℃酶切6h,65℃失活20min。
[0065]
2、采用trizol法提取玉米自交系b73幼嫩叶片的总rna,然后反转录,得到玉米的cdna。
[0066]
3、以玉米的cdna为模板,先采用primer f:5
’-
atgaagtgcaatgcttgctg-3
’
和primer r:5
’-
ctacaacgtgaatatgtgttggcga-3
’
组成的引物对进行pcr扩增。
[0067]
反应体系为15μl,包括9.35μl ddh
2
o、1.5μl 10
×
pcr buffer(toyobo公司的产品)、1.5μl dntps(datp、dttp、dgtp和dctp浓度均为2mm)、0.9μl mgso
4
水溶液(浓度为25mm)、0.35μl dmso、0.3μlkod-plus-neo、0.2μl玉米的cdna、0.45μl primer f水溶液和0.45μl primer r水溶液。
[0068]
反应条件为:94℃1min;98℃10s,68℃30s,68℃3min,8个循环;98℃10s,60℃30s,68℃3min,25个循环;68℃5min。
[0069]
4、完成步骤3后,向所述反应体系中加入0.1μltaq酶,然后72℃运行25min,得到两端加a的pcr扩增产物。
[0070]
5、将步骤4获得的两端加a的pcr扩增产物和步骤1获得的线性化的载体4℃连接过夜,得到重组质粒pbcxun-ubip-zmhei10-nos。
[0071]
将重组质粒pbcxun-ubip-zmhei10-nos进行测序。根据测序结果,对重组质粒pbcxun-ubip-zmhei10-nos进行结构描述如下:向植物表达载体pbcxun-ubip的限制性内切酶xcmi之间插入核苷酸序列是序列表中的序列2所示的dna分子(zmhei10基因)。重组质粒pbcxun-ubip-zmhei10-nos表达序列表中序列1所示的蛋白质zmhei10。
[0072]
重组质粒pbcxun-ubip-zmhei10-nos的结构示意图见图1。
[0073]
二、重组农杆菌的获得
[0074]
将重组质粒pbcxun-ubip-zmhei10-nos导入根癌农杆菌eha105,得到重组农杆菌,将该重组农杆菌命名为eha105/pbcxun-ubip-zmhei10-nos。
[0075]
将植物表达载体pbcxun-ubip导入根癌农杆菌eha105,得到重组农杆菌,将该重组农杆菌命名为eha105/pbcxun-ubip。
[0076]
三、t
2
代纯合转zmhei10基因玉米的获得
[0077]
1、采用农杆菌侵染玉米幼胚的方法将eha105/pbcxun-ubip-zmhei10-nos转化玉米自交系b73-329,获得t
0
代转zmhei10基因玉米。具体步骤如下:
[0078]
(1)将玉米自交系b73-329植株的幼胚(刚剥离的)在eha105/pbcxun-ubip-zmhei10-nos的菌液(od
550nm
为0.3-0.4)中浸泡10min。
[0079]
(2)完成步骤(1)后,将所述幼胚转移至共培养培养基且使幼胚的胚轴接触共培养培养基表面,同时驱除共培养培养基表面多余的农杆菌,用封口膜封住培养皿,20℃暗培养3天。
[0080]
共培养培养基:先将n6盐4g、2,4-d1.5mg、脯氨酸0.7g、葡萄糖30g和植物凝胶3g溶于1l蒸馏水,调节ph值至5.8,121℃灭菌15min;冷却至55℃时加入0.85mg硝酸银、乙酰丁香酮、300mg半胱氨酸和终浓度至1ml/l的1000
×
n6维生素,得到共培养培养基;共培养培养基中,乙酰丁香酮的浓度为100mm。
[0081]
(3)完成步骤(2)后,将所述幼胚转移至静息培养基,同时用封口膜封住培养皿,28℃暗培养7天。
[0082]
静息培养基:含100mg/l羧苄青霉素的共培养培养基。
[0083]
(4)完成步骤(3)后,将所述幼胚转移至选择培养基甲,28℃暗培养2周。
[0084]
选择培养基甲:先将n6盐4g、2,4-d1.5mg、脯氨酸0.7g、葡萄糖30g和植物凝胶3g溶于1l蒸馏水,调节ph值至5.8,121℃灭菌15min;冷却至55℃时加入0.85mg硝酸银、300mg半胱氨酸、终浓度至1ml/l的1000
×
n6维生素、100mg羧苄青霉素和50mg膦丝菌素。
[0085]
(5)完成步骤(4)后,将所述幼胚转移至选择培养基乙,28℃暗培养3周,得到愈伤组织。
[0086]
选择培养基乙:先将n6盐4g、2,4-d1.5mg、脯氨酸0.7g、葡萄糖30g和植物凝胶3g溶于1l蒸馏水,调节ph值至5.8,121℃灭菌15min;冷却至55℃时加入0.85mg硝酸银、300mg半胱氨酸、终浓度至1ml/l的1000
×
n6维生素、100mg羧苄青霉素和100mg膦丝菌素。
[0087]
(6)将步骤(5)得到的愈伤组织转移至再生培养基上,26℃、光暗交替培养(即16h光照培养和8h暗培养交替进行,光照培养时光照强度为10000lux),获得t
0
代拟转zmhei10基因玉米。
[0088]
再生培养基:先将ms盐4.3g、2,4-d 1.5mg、葡萄糖30g和植物凝胶3g溶于1l蒸馏水,调节ph值至5.8,121℃灭菌15min;冷却至55℃时加入终浓度至1ml/l的1000
×
ms维生素和100mg羧苄青霉素。
[0089]
(7)分别提取t
0
代拟转zmhei10基因玉米叶片的基因组dna并以其作为模板,以bar-f:5
’-
cggtctgcaccatcgtcaaccac-3
’
和bar-r:5
’-
agcccgatgacagcgaccac-3
’
为引物进行pcr扩增,得到pcr扩增产物。将pcr扩增产物进行琼脂糖凝胶电泳,然后进行如下判断:如果能够获得325bp的pcr扩增产物,则相应的t
0
代拟转zmhei10基因玉米为t
0
代转zmhei10基
因玉米;如果不能获得325bp的pcr扩增产物,则相应的t
0
代拟转zmhei10基因玉米不为t
0
代转zmhei10基因玉米。
[0090]
2、t
1
代转zmhei10基因玉米的获得
[0091]
将t
0
代转zmhei10基因玉米阳性植株自交,获得t
1
代转zmhei10基因玉米。
[0092]
3、t
2
代纯合转zmhei10基因玉米的获得
[0093]
将t
1
代转zmhei10基因玉米阳性植株自交,获得t
2
代纯合转zmhei10基因玉米。
[0094]
将其中5个t
2
代纯合转zmhei10基因玉米株系分别命名为200021039、200021067、200021078、200021062和200021017。
[0095]
四、t
2
代纯合转空载体玉米的获得
[0096]
按照上述步骤三的方法,将eha105/pbcxun-ubip-zmhei10-nos替换为eha105/pbcxun-ubip,其它步骤均不变(步骤1中(7)除外),得到t
2
代纯合转空载体玉米。
[0097]
五、转zmhei10基因玉米的百粒重、穗粒数和产量的统计
[0098]
以玉米自交系b73-329、t
2
代纯合转空载体玉米、200021039、200021067、200021078、200021062和200021017为实验材料,进行百粒重、穗粒数和产量的统计。实验重复三次,每个实验材料每次种植50株,待实验材料处于成熟期,统计百粒重、穗粒数和产量并分别计算5个t
2
代纯合转zmhei10基因玉米株系的增长率。
[0099]
t
2
代纯合转zmhei10基因玉米株系的增长率=(t
2
代纯合转zmhei10基因玉米株系的的指标-玉米自交系b73-329的指标)/玉米自交系b73-329的指标。指标为百粒重、穗粒数或产量。
[0100]
部分统计结果见表2、图2、图3和图4。结果表明,与玉米自交系b73-329相比,5个t
2
代纯合转zmhei10基因玉米株系的百粒重、产量和穗粒数均显著增加,玉米自交系b73-329和t
2
代纯合转空载体玉米的百粒重、产量和穗粒数均无显著差异。
[0101]
由此可见,在玉米中过表达zmhei10基因可提高玉米的百粒重、产量和穗粒数。
[0102]
表2
[0103] 百粒重(g)穗粒数(粒)产量(g)玉米自交系b73-32915.142150.6t
2
代纯合转空载体玉米14.841147.920002103916.61437.852.9720002106716.47426.952.9720002107816.68447.551.7620002106216.79435.754.3920002101716.29429.854.09
[0104]
六、转zmhei10基因玉米的茎腐病抗性
[0105]
以玉米自交系b73-329、t
2
代纯合转空载体玉米、200021039、200021067、200021078、200021062和200021017为实验材料,测定玉米的茎腐病抗性。具体步骤如下:
[0106]
1、病原菌混合培养物的制备
[0107]
固体培养基:取去皮马铃薯200g,切成小块,加入1.0l蒸馏水,煮沸30min;纱布过滤后收集滤液,向滤液中加入葡萄糖20g和琼脂15g,调节ph值至6.0并用蒸馏水定容至
1.0l,然后115℃灭菌15min。
[0108]
(1)将禾生腐霉菌(记载于如下文献中:盖晓彤.玉米茎腐病与穗腐病致病镰孢菌侵染途径及其致病力差异研究[d].沈阳农业大学,2018.)接种至固体培养基,25℃培养7-10天,得到禾生腐霉菌培养物。
[0109]
(2)将谷镰刀菌(记载于如下文献中:晋齐鸣,潘顺法.玉米茎腐病病原菌致病性及侵染规律的研究[j].玉米科学,1995(2):74-78.)接种至固体培养基,25℃培养7-10天,得到谷镰刀菌培养物。
[0110]
(3)将禾生腐霉菌培养物和谷镰刀菌培养物混合,得到病原菌混合培养物。病原菌混合培养物中,禾生腐霉菌和谷镰刀菌的孢子浓度比为1:1。
[0111]
2、田间鉴定
[0112]
实验重复三次取平均值。每个实验材料每次种植150株,正常田间管理和行距播种。
[0113]
实验材料散粉前一周,在根部附近人工接种病原菌混合培养物30g,然后埋土覆盖,并在行间实行大水漫灌。待实验材料处于乳熟末期或成熟期,统计感病植株数并计算茎腐病感病率。
[0114]
茎腐病感病率=感病植株数/总植株数
×
100%。
[0115]
部分实验结果见表3和图5。结果表明,与玉米自交系b73-329相比,5个t
2
代纯合转zmhei10基因玉米株系的茎腐病感病率均显著降低;玉米自交系b73-329和t
2
代纯合转空载体玉米的茎腐病感病率无显著差异。
[0116]
由此可见,在玉米中过表达zmhei10基因可提高玉米对茎腐病的抗性。
[0117]
表3
[0118] 感病植株数总植株数玉米自交系b73-32969150t
2
代纯合转空载体玉米661502000210391215020002106716150200021078161502000210621515020002101732150
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



