一种耐高温的高产纤维素酶枯草芽孢杆菌及其应用的制作方法
 2021-02-02 15:02:37|
2021-02-02 15:02:37| 481|
481| 起点商标网
起点商标网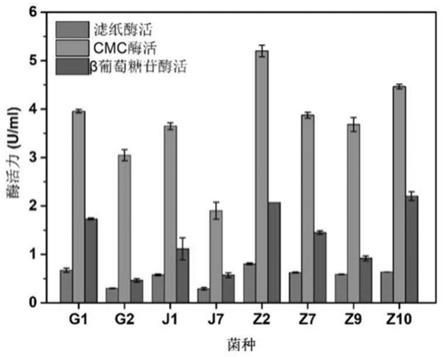
0.1-0.4g/l cacl
2
,0.001-0.005g/l feso
4
.7h
2
o,0.5-1.5g/l tryptone,5-10g/l cmc-na;
[0015]
2)初筛培养基:
[0016]
cmc-na平板培养基:1-2.5g/l k
2
hpo
4
,0.5-2.5g/l nano
3
,0.1-0.5g/l mgso
4
.7h
2
o,0.2-1g/l kcl,0.1-0.5g/l tryptone,1-5g/l cmc-na,15-20g/l agar;
[0017]
无机盐-木质素培养基:1-3g/l k
2
hpo
4
,1-5g/l nano
3
,0.3-0.5g mgso
4
.7h
2
o,0.3-0.8 g/l kcl,0.1-0.4g tryptone,0.005-0.015g/l feso
4
.7h
2
o,0-5g/l lignin,15-20g/l agar;
[0018]
3)复筛培养基:0.8-2g/l k
2
hpo
4
,0.5-2g/l nh
4
so
4
,0.5-2g/l nacl,1-5g/l yeastextract,0.2-0.5g/l cysteine,0.05-0.1g/l cacl
2
,0.5-1g/l mgso4.7h
2
o,2-5g/l cmc-na。
[0019]
一种耐高温的高产纤维素酶枯草芽孢杆菌的应用,该枯草芽孢杆菌具有较高的纤维素酶生产能力,可以以酵母膏、牛肉膏、玉米浆或氯化铵为氮源,以稻草秸秆,玉米秸秆,玉米芯或cmc-na为碳源进行液态发酵产酶,在45-55℃下培养6-24小时后其滤纸酶活,cmc 酶活和β葡萄糖苷酶活分别为0.800u/ml、5.20u/ml及2.07u/ml,大大缩短了发酵周期。
[0020]
一种耐高温的高产纤维素酶枯草芽孢杆菌的应用,上述制备的菌株所产纤维素酶在不同 ph值范围及温度范围的稳定性分析,该分析准确的反应了纤维素酶的稳定性。该制备的枯草芽孢杆菌所产纤维素酶和商业木聚糖酶混合使用水解木质纤维素能够获得较高的还原糖。
[0021]
一种耐高温的高产纤维素酶枯草芽孢杆菌所生产的纤维素酶性能的评价方法,所述方法包括如下步骤:
[0022]
1)将所筛选的菌株所产的纤维素酶于ph值范围在4.0到10.0之间的缓冲液和30℃-80 ℃的水浴锅中加热后以2-5%的cmc-na作为基质检测酶活性,获得最优ph和温度及其在上述范围的稳定性;
[0023]
2)将所筛选的菌株所产的纤维素酶和商业木聚糖酶混合反应48h后测得还原糖产量为 84.27mg/ml。
[0024]
与现有技术相比,本发明具有如下技术优点:
[0025]
1、菌种生长速度快,产酶效率高,发酵时间短,在24小时内可结束发酵;
[0026]
2、菌种具有易于纯培养,不易染菌的特点;
[0027]
3、发酵性能稳定,滤纸酶活,cmc酶活和β葡萄糖苷酶活的活性分别为0.800u/ml、 5.20u/ml及2.07u/ml;
[0028]
4、所产纤维素酶耐高温,有着较广的温度和ph稳定性范围;
[0029]
5、所产纤维素酶可与商业木聚糖酶混合使用,具有较高的水解效率。
附图说明
[0030]
图1为不同菌株cmc-na平板水解圈与菌落图;
[0031]
图2为不同菌株在lignin平板上的生长情况图;
[0032]
图3为不同菌株滤纸酶,cmc酶和β葡萄糖苷酶的活性图;
[0033]
图4为z2系统进化树图;
[0034]
图5为ph对cmc酶活的影响图;
[0035]
图6为温度对cmc酶活的影响图;
[0036]
图7为cmc酶活的ph稳定性图;
[0037]
图8为cmc酶活的温度稳定性图;
[0038]
图9为不同酶的组合水解预处理稻草秸秆所释放的总还原糖量图。
具体实施方式
[0039]
下面结合附图和具体实施方式对本发明作进一步详细地描述。
[0040]
实施例1
[0041]
富集培养:
[0042]
将1g土壤样品加入到50ml富集培养基中,富集培养基成分为:1-2.5g/l kh
2
po
4
, 1.2-1.8g/l(nh4)
2
so
4
,0.3-0.6g/l mgso
4
.7h
2
o,0.1-0.4g/l cacl
2
,0.001-0.005g/lfeso
4
.7h
2
o,0.5-1.5g/l tryptone,5-10g/l cmc-na。温度37℃、200rpm培养48h,培养结束后取1ml培养液于新鲜的富集培养基中相同条件再次培养,重复三次。
[0043]
初筛:
[0044]
cmc-na平板实验
[0045]
取1ml富集培养液适当稀释后涂布于cmc-na平板上,经刚果红染色,nacl脱色后获得具有水解圈的单菌落,并进行富集培养并再次点样于新cmc-na平板上以获得准确的水解圈直径/菌落直径数据,如图1所示。cmc-na平板培养基成分为:1-2.5g/l k
2
hpo
4
,0.5-2.5g/l nano
3
,0.1-0.5g/l mgso
4
.7h
2
o,0.2-1g/l kcl,0.1-0.5g/l tryptone,1-5g/l cmc-na,15-20 g/l agar。如表1所示,z2的水解圈直径/菌落直径值最大可达8.00。
[0046]
表1为不同菌种cmc-na平板水解圈直径与菌落直径比例
[0047][0048]
lignin平板实验
[0049]
将上述所分离得到的8株菌进行富集培养依次稀释10-1
,10-2
,10-3
,10-4
倍,取5μl点样于lignin平板上,无机盐-木质素培养基成分为:1-3g/l k
2
hpo
4
,1-5g/l nano
3
,0.3-0.5gmgso
4
.7h
2
o,0.3-0.8g/l kcl,0.1-0.4g tryptone,0.005-0.015g/l feso
4
.7h
2
o,0-5g/l lignin, 15-20g/l agar。37℃静止培养48h,观察发现z2具有较好的木质素耐受能力。不同菌株在 lignin平板上的生长情况如图2所示。
[0050]
复筛:
[0051]
经过上述定性分析可知,本实验室所分离得到的8株菌具有较好的纤维素酶生产特性,接下来对这8株菌进行产酶定量分析。将8株菌分别接种于250ml的三角瓶中,装液量为 50ml,复筛培养基成分为:0.8-2g/l k
2
hpo
4
,0.5-2g/l nh
4
so
4
,0.5-2g/l nacl,1-5g/l yeastextract,0.2-0.5g/l cysteine,0.05-0.1g/l cacl
2
,0.5-1g/l mgso4.7h
2
o,2-5g/l cmc-na。37℃ 200rpm培养48h。检测其滤纸酶,cmc酶和β葡萄糖苷酶活性,其中z2具有最高
的酶活性,滤纸酶,cmc酶和β葡萄糖苷酶活性分别为0.800u/ml、5.20u/ml及2.07u/ml,如图3所示。
[0052]
实施例2
[0053]
设计16s rrna序列扩增引物,对z2 16s rrna序列blast并做进化树分析,结果显示 z2为bacillus subtilis,如图4所示。
[0054]
实施例3
[0055]
ph及温度对酶活性的影响:
[0056]
取适当量的酶液和同样体积的ph值范围在4.0到10.0之间的缓冲液于50℃孵育过夜,然后以2-5%的cmc-na作为基质检测酶活性,获得最优ph为7。其中citrate buffer(ph 3.0
–ꢀ
5.0),tris-hcl buffer(ph 6.0
–
8.0)及glycine-naoh buffer(ph 9.0
–
10.0)。将ph 调至7,在30℃-80℃的水浴锅中加热过夜后以2-5%的cmc-na作为基质检测酶活性,获得最优温度为50℃。ph对cmc酶活性的影响如图5所示,温度对cmc酶活性的影响如图6所示。
[0057]
ph及温度对酶活稳定性的影响
[0058]
取适当量的酶液和同样体积的ph值范围在4.0到10.0之间的缓冲液于50℃孵育30 min,然后以2-5%的cmc-na作为基质检测酶活性测得ph的稳定性,如图7所示。其中citratebuffer(ph 3.0
–
5.0),tris-hcl buffer(ph 6.0
–
8.0)及glycine-naoh buffer(ph 9.0
–ꢀ
10.0)。将ph调至7,在30℃-80℃的水浴锅中加热30min后以2-5%的cmc作为基质检测酶活性,测得温度稳定性,如图8所示。
[0059]
实施例4
[0060]
在50ml体系中加载10-30%(w/v)的预处理后的稻草秸秆,分别加入实验菌株所产酶液(5-10fpu/g),实验菌株酶液加商业纤维素酶(20-50fpu/g)及实验菌株酶液加商业木聚糖酶(20-50fpu/g)。50℃ 200rpm反应48h后测得还原糖产量,其中实验菌株酶液加商业木聚糖酶在水解48h是可获得最高还原糖量为84.27mg/ml。不同酶的组合水解预处理稻草秸秆所释放的总还原糖量如图9所示。
[0061]
实施例5
[0062]
滤纸酶酶活性检测:
[0063]
采用dns(3,5-dinitrosalicylic acid)法测定滤纸酶酶活。将培养后的细胞培养液置于灭菌的ep管中,于8 000g,4℃离心10min,收集上清液。取上清液100-500μl,加入whatman no.1滤纸(1
×
6cm≈50.0mg)作为基质,于50mm柠檬酸钠-柠檬酸钠缓存液(ph 5.0)中孵育(50℃60min)。孵育结束后用dns法在540nm下检测所释放的还原糖量。酶活定义:每分钟释放1μmol的葡萄糖所需要的酶量。
[0064]
cmcase酶活性检测:
[0065]
采用dns(3,5-dinitrosalicylic acid)法测定cmc酶活。将培养后的细胞培养液置于灭菌的ep管中,于8 000g,4℃离心10min,收集上清液。取上清液100-500μl,加入1%(w/v)cmc-na作为基质,于50mm柠檬酸钠-柠檬酸钠缓存液(ph 5.0)中孵育(50℃ 60min)。孵育结束后用dns法在540nm下检测所释放的还原糖量。酶活定义:每分钟释放1μmol的葡萄糖所需要的酶量。
[0066]
β-葡萄糖苷酶酶活检测:
[0067]
采用pnpg(p-nitrophenyl-β-d-glucopyranoside)法测定β-葡萄糖苷酶酶活。将
培养后的细胞培养液置于灭菌的ep管中,于8 000g,4℃离心10min,收集上清液。取上清液100-500μl,加入200-400μl的5mmol/l pnpg(溶于ph 5.0柠檬酸钠-柠檬酸钠钠缓存液中)混匀,50℃反应30min,立即加入2ml的1mol/l na
2
co
3
终止反应,于400nm下测定吸光值。酶活定义:每分钟释放1μmol的对硝基苯酚所需要的酶量。
[0068]
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



