一种基于磁分离和酶催化的核酸液相杂交捕获检测方法与流程
 2021-02-02 15:02:47|
2021-02-02 15:02:47| 404|
404| 起点商标网
起点商标网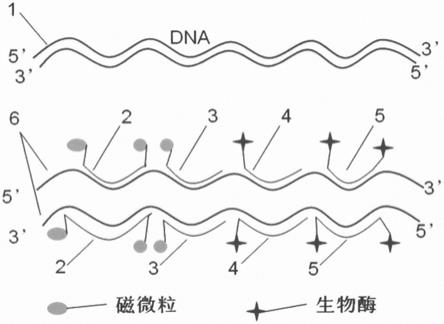
[0001]
本发明涉及到一种核酸液相杂交捕获检测方法。该方法通过磁分离和酶催化两个核心要素实现,其中磁分离通过将磁微粒与杂交探针核酸序列连接,在该探针与目标核酸序列碱基互补形成杂交体后,利用磁场力进行磁微粒的收集,实现从液相中选择性的将目标核酸序列分离和富集的目的。同时另一种或多种与目标核酸序列其他部位互补的核酸探针则与生物酶连接,杂交后将生物酶与目标核酸序列连接在一起,通过酶催化底物显色或发光等途径进行信号放大,可以实现对目标待测核酸序列的高灵敏度、高特异性检测。
背景技术:
[0002]
核酸杂交检测是最早应用的核酸检测手段之一。其原理是核酸变性和复性理论,在变性核酸复性过程中,互补的核苷酸序列(dna与dna、dna与rna、rna与rna等)通过watson-crick碱基两两配对形成非共价键,从而形成稳定的同源或异源双链分子的过程。经典的核酸杂交方法是将dna或rna先转移并固定到硝酸纤维素或尼龙膜载体上,与其互补的单链dna或rna探针用放射性或非放射性标记,在膜上杂交时,探针通过氢键与其互补的靶序列结合,洗去未结合的游离探针后,经放射自显影或显色反应检测特异结合的探针。
[0003]
核酸杂交的方法主要包括:dna印迹杂交(southern blot)、rna印迹杂交(northern blot)、斑点杂交(dot blot)、原位杂交(fish)和pcr反向杂交法等。上述核酸杂交方法均需使用固相载体固定目标待测核酸或固定核酸探针,再用带有信号标记的探针与之杂交,从而检测目标核酸序列。固相载体通常需要通过复杂的实验流程才能完成制备,此类实验不仅操作流程繁琐,而且结果判定方式难以统一,无法进行标准化判读,难以实现全自动检测。而且由于固相载体上的核酸序列为不可移动状态,在杂交时与液相中目标核酸分子的接触碰撞几率受到限制,灵敏度受到影响。多种不利因素限制了杂交法在许多场合的应用,比如在体外诊断、食品安全等需要准确、快速、高灵敏度的在统一标准下出诊断结果的领域,杂交法仅占据很小的比例。
[0004]
在体外诊断和食品安全领域由于pcr和测序法技术成熟度高,实验操作过程可以统一化、标准化等优点,可以在统一的标准下制备成商业化检测试剂盒进行广泛的应用。pcr方法由于循环扩增的逐级放大效应,敏感度较高,但与此对应的,pcr方法对实验条件要求较严格,否则容易引起气溶胶、产物污染等情况发生,导致检测失败,且一旦发生污染事件,实验室需要经过长时间的休整才能恢复。一代测序法周期长费用高、操作步骤繁琐,二代测序法虽然效率和准确度更高,但由于需要经历构建文库、标准化文库等一系列复杂的操作才能完成,应用成本较高,在体外诊断和食品安全领域的广泛应用也面临诸多难题。
[0005]
基于核酸杂交捕获的方法进行核酸检测相对于二代测序来说简单便捷,抗污染能力强,目前已有商业化的应用。德国凯杰qiagen公司hc2法hpv核酸检测试剂盒是其中的一个典型代表。该试剂盒是一种基于核酸杂交捕获法检测hpv核酸的方法,通过在酶标板上包被抗核酸抗体,之后加入的反应液中含有待测核酸序列和与之互补的探针核酸序列,二者杂交后形成双链复合物,被酶标板上的抗体捕获,再加入碱性磷酸酶链接的第二抗双链核
酸抗体,通过底物发光显色,可以判定目标待测核酸存在与否。国内杭州德同生物有限公司dh2、dh3试剂盒也采用了类似的技术原理检测hpv核酸。
[0006]
尽管该方法已经取得成功的商业化应用,但仍然存在一些无法克服的技术短板。如:(1)采用微孔板包被抗体捕获核酸使检测的灵敏度受限。由于微孔板与待测样本的接触面积有限,分子间碰撞几率降低,导致灵敏度受限。要想使反应更充分,则需要延长反应时间,这影响了检测的效率。(2)由于微孔板通常为一排串联设置的多孔板,使一次只检测一份样本的操作成本大大增加,此类检测通常需要先搜集到足够多的标本后再统一检测,使得从采集样本到实施检测的时效性变差。(3)由于需要进行酶标板整板操作,一旦开始操作后,样本排布锁定,不能进行样本的急诊位随机插入检测,样本检测的灵活性较差。
[0007]
国内外有多位该领域技术工作者尝试改进杂交捕获法的操作步骤。发明专利cn101240329a《一种dna的荧光检测方法及其试剂盒》公开了一种改进的荧光标记杂交捕获检测法,通过将捕获探针连接在磁颗粒上,将荧光信号连接在信号探针上,与目标待测核酸形成夹心结构,同时再加入捕获探针和信号探针的竞争性探针,最后通过增强剂激发荧光信号进行检测。该方法用于检测dna序列,其采用荧光进行信号输出,同时还需要加入竞争探针才能实现检测。由于荧光信号的光子效率低,衰变周期短,使得该方案的检测灵敏度受到限制。发明专利cn106755460a《一种单碱基突变检测方法》公开了一种杂交捕获法检测核酸单碱基突变的方法,该技术方案专为解决一种单碱基突变的杂交检测进行设计,同样采用磁探针进行分离和荧光进行信号输出的技术路径,磁分离的目的是将待测核酸序列从样本所处的液相转移到人工缓冲液中,检测时目标核酸序列已经与磁微粒分离,同样该方案也存在荧光信号随时间衰变减弱的特点,同时检测时磁微粒与目标核酸序列分离,使得该技术方案可应用的场景受到限制。专利cn107523611a《一种非扩增型核酸杂交捕获体系及其在核酸检测中的应用》公开的技术路径与凯杰和杭州德同公司的产品技术路径相类似,通过抗核酸抗体实现目标核酸的捕获,在信号生成路径上则采用显色和发光两种方案,从现实应用看,同等条件下发光相比显色法具有较高的敏感度,但在捕获端由于采用微孔板为载体,没有解决充分的接触捕获目标核酸的问题。专利cn107058584a《一种核酸杂交化学发光检测方法》通过将捕获探针链接到聚苯乙烯等有机物基质的微球上的方法实现核酸的杂交发光检测,该方案虽然在信号端使用了信号放大的技术方案,但在捕获端存在以有机质为捕获基质的微球从液相中分离不便的缺陷,同样难以实现全自动检测。专利cn101351564b《通过靶特异性杂交捕获方法检测核酸》提供了一种与cn107058584a载体相类似的杂交捕获检测检测方法,其使用的捕获载体依然是有机物微球,而信号输出则提供了荧光、金标记物和酶催化三种途径,同样存在微球从液相中分离不便的特点。
技术实现要素:
[0008]
本发明提供了一种既可以简便的进行磁分离捕获目标核酸序列,又可以进行信号方大检测目标核酸序列的液相杂交捕获检测方法。该方法通过磁分离核酸探针与目标核酸序列的互补杂交,实现从液相中捕获和分离目标待测核酸序列,同时另外设置的酶催化探针与目标待测核酸序列杂交后,将生物酶引入杂交分子复合体,利用酶催化的放大效应,积累和放大信号,实现高敏感度、高特异性、简便快捷的杂交检测核酸分子的目的。本发明在目标核酸序列捕获端和目标核酸信号输出端都具有较高的敏感度。本发明对
cn101240329a、cn106755460a、cn107523611a、cn107058584a、cn101351564b技术方案缺陷进一步整合和改进,提供了一种更简便、快捷、通用、高效、可实现自动化核酸杂交检测的技术方案。
[0009]
本发明使用磁微粒为固相载体,在液相反应体系中,由于磁微粒粒径小、比表面积大、在液相中能均匀分散的特征,可以快速、充分的在液相中与目标待测核酸分子碰撞接触,从而最大限度的提高捕获端的灵敏度。同时由于磁微粒在磁场作用下可简便、快速、彻底从液相中分离的特性,可以实现目标核酸序列与非目标核酸序列和多余探针的分离,简便快捷地实现了检测的特异性。
[0010]
本发明使用酶催化底物显色或发光的方法生成信号,相比与使用荧光输出信号的方法,由于酶催化信号有伴随时间放大积累的效果,可以最大限度的提高检测的敏感度。
[0011]
本发明还可以通过与全自动核酸提取检测系统配合,实现待测样本从核酸提取到杂交捕获检测的全流程自动化操作,配套的相关仪器通过设置必要的功能模块,能够实现急诊位样本随机插入检测,而不需要像pcr、ngs、fish、southern blot、northern blot等现有技术一样,需要复杂的操作步骤才能实施核酸检测。本发明大大降低了核酸检测的技术难度和条件要求,使核酸的检测较现有方法更简便、高效。
[0012]
本发明的实现技术路径:
[0013]
(1)根据目标待测核酸序列特征设计两个以上与之碱基互补的杂交探针核酸序列,这些杂交探针分为两组功能,一组用于与磁微粒链接,一组用于与生物酶链接;
[0014]
(2)制备杂交探针时在探针的5
’
端或3
’
端或两端修饰生物素、地高辛、氨基基团中的一种或两种,具体修饰组合包括:5
’-
生物素,5
’-
地高辛,5
’-
氨基,3
’-
生物素,3
’-
地高辛,3
’-
氨基,或以下组合:5
’-
生物素——3
’-
生物素,5
’-
生物素——3
’-
地高辛,5
’-
生物素——3
’-
氨基,5
’-
地高辛——3
’-
地高辛,5
’-
地高辛——3
’-
生物素,5
’-
地高辛——3
’-
氨基,5
’-
氨基——3
’-
氨基,5
’-
氨基——3
’-
生物素,5
’-
氨基——3
’-
地高辛;
[0015]
(3)根据预先设计好的探针分组,选择与磁微粒连接的探针组,根据该组探针修饰基团的不同,选择能与该修饰基团形成连接作用的修饰有功能基团的磁性微球,将探针链接到磁性微球上,形成磁分离核酸探针;
[0016]
(4)根据预先设计好的探针分组,选择与生物酶连接的探针组,根据该组探针修饰基团的不同,选择能与该修饰基团对应的链接方法,将该组核酸探针连接到生物酶上,形成生物酶核酸探针,生物酶与探针的结合根据与之连接的探针杂交反应时所处环境条件的不同,可以在杂交前完成连接或者在杂交后连接,避免生物酶受杂交环境影响失活;
[0017]
(5)将磁分离核酸探针、生物酶核酸探针、目标待测核酸序列进行杂交,杂交的顺序可以是先进行生物酶核酸探针与目标待测核酸序列杂交,再与磁分离核酸探针杂交;也可以是先进行磁分离核酸探针与目标待测核酸序列杂交,再与生物酶核酸探针杂交;也可以是磁分离核酸探针、目标待测核酸序列、生物酶核酸探针同时混合杂交;
[0018]
(6)杂交后进行磁分离,弃去上清液,保留磁微粒,此时形成“磁分离核酸探针——目标待测核酸序列——生物酶核酸探针”的复合物,与同一目标待测核酸序列杂交结合的磁分离核酸探针序列数量可以是一个或多个序列,与同一目标待测核酸序列杂交结合的生物酶核酸探针序列数量可以是一个或多个序列;
[0019]
(7)清洗磁微粒,加入生物酶对应的显色底物或发光底物,形成颜色或者发光信
号,再由特定的仪器阅读,通过合理设定阳性判断值(cut-off value)来确定目标待测核酸序列的存在与否。
[0020]
本发明的微粒子的形状可以是任意三维空间结构,其表层修饰了功能基团,可以与核酸探针序列上的修饰基团反应。其平均粒径范围为10纳米至100微米。表层修饰的功能基团有羧基、氨基、羟基、氯甲基苯基、亲和素、地高辛抗体,其中羧基、氨基、羟基、氯甲基苯基与探针上修饰的氨基连接,亲和素与探针上修饰的生物素连接,地高辛抗体与探针上修饰的地高辛连接。
[0021]
本发明的杂交探针核酸序列,其本质是一段核苷酸序列,包括dna序列和rna序列。序列中可以包含锁核酸碱基(locked nucleic acid,lna),也可以不包含锁核酸碱基。与目标待测核酸序列杂交的磁分离核酸探针序列数,典型的数量范围为1-100个,优化的数量范围为1~10个。与目标待测核酸序列杂交的生物酶核酸探针序列数,典型的数量范围为1-100个,优化的数量范围为1~10个。
[0022]
本发明的磁分离探针的形成,根据核酸探针上修饰的基团不同,其可以在进行核酸杂交之前预先形成,也可以在进行核酸杂交过程中形成,也可以在核酸杂交完成后形成。
[0023]
本发明的生物酶探针的形成,根据核酸探针上修饰的基团不同,其可以在进行核酸杂交之前预先形成,也可以在进行核酸杂交过程中形成,也可以在核酸杂交完成后形成,具体情况根据生物酶对应探针杂交时所处环境决定,避免生物酶受到杂交环境影响失去催化活性。
[0024]
本发明的生物酶包括辣根过氧化物酶hrp和碱性磷酸酶alp。hrp酶显色底物包括:四甲基联苯胺(tmb)、3,3-二氨基联苯胺(dab)、邻苯二胺(opd)、5-氨基水杨酸、氯萘酚、3-氨基-9-已基咔唑(aec)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(abts);alp的显色底物包括:4-硝基苯磷酸二钠(pnpp)、四唑氮蓝(nbt)/5-溴-4-氯-3-吲哚-磷酸盐(bcip)。hrp酶的发光底物包括:鲁米诺、异鲁米诺;碱性磷酸酶的发光底物包括:c
18
h
21
na
2
o
7
p(amppd)、c
l8
h
20
clna
2
o
7
p(cspd)、c
l8
h
20
clna
2
o
7
p(adp-star)、c
18
h
19
cl
2
o
7
na
2
p(cdp-star)。
附图说明
[0025]
图1:双链dna磁分离杂交捕获检测原理示意图。其中包含了磁微粒与捕获探针的连接方式,生物酶与探针连接方式,磁分离捕获探针和酶催化探针与目标待测核酸序列结合方式。
[0026]
1-待测目标dna双链;
[0027]
2-磁捕获探针,在3
’
端和5
’
端均连接磁微粒;
[0028]
3-磁捕获探针,在3
’
端或5
’
端连接磁微粒;
[0029]
4-酶催化探针,在3
’
端或5
’
端连接生物酶;
[0030]
5-酶催化探针,在3
’
端和5
’
端均连接生物酶;
[0031]
6-解链后的dna单链分子。
[0032]
图2:单链rna磁分离杂交捕获检测原理示意图。其中包含了磁微粒与捕获探针的连接方式,生物酶与探针连接方式,磁分离捕获探针和酶催化探针与目标待测核酸序列结合方式。
[0033]
1-待测目标rna链;
[0034]
2-磁捕获探针,在3
’
端和5
’
端均连接磁微粒;
[0035]
3-磁捕获探针,在3
’
端或5
’
端连接磁微粒;
[0036]
4-酶催化探针,在3
’
端或5
’
端连接生物酶;
[0037]
5-酶催化探针,在3
’
端和5
’
端均连接生物酶;
[0038]
6-解链后的dna单链分子。
[0039]
图3:显示了本发明的一种应用场景:混合添加杂交探针与目标核酸分子杂交后磁分离检测的操作流程。揭示了从样本收集到酶催化检测的技术路径,其中step3/4没有固定的先后顺序,可以互相调换。
[0040]
step 1-收集待测样本;
[0041]
step 2-变性释放待测核酸;
[0042]
step 3/4-加入磁分离探针杂交;
[0043]
step 4/3-加入酶探针杂交;
[0044]
step 5-磁分离收集磁微粒;
[0045]
step 6-加入酶底物,显色或发光检测。
[0046]
备注:step 3/4没有严格的先后顺序,可以互相交换。
[0047]
图4:显示了本发明的一种应用场景:分步添加杂交探针,分步磁分离检测的操作流程。揭示了从样本收集到酶催化检测的分步操作技术路径。
[0048]
step 1-收集待测样本;
[0049]
step 2-变性释放待测核酸;
[0050]
step 3-加入磁分离探针;
[0051]
step 4-磁分离收集杂交复合物;
[0052]
step 5-加入酶探针或;
[0053]
step 6-磁分离收集杂交复合物;
[0054]
step 7-加入酶底物,显色或发光检测。
[0055]
实施例1
[0056]
使用一对探针检测产毒性大肠杆菌st质粒dna序列
[0057]
从ncbi网站查找产毒性大肠杆菌的核酸序列,进行序列比对,在特异性序列区域设计探针。本实施例设计的探针1序列如下:aaagggaactgtttagttccctt,设计的探针2序列如下:tgtaatcctgcttgtaccgggtgc。
[0058]
在合成探针1时修饰地高辛,制备地高辛-aaagggaactgtttagttccctt,将1 od的地高辛修饰的探针1与1mg的地高辛抗体修饰的磁微粒混合,使探针通过地高辛-地高辛抗体的特异性反应连接到磁微粒上,室温反应60分钟后,在磁场力下进行磁分离,完成磁捕获探针制备,保存在te缓冲液中,避免污染降解。在合成探针2时修饰生物素,制备biotin-tgtaatcctgcttgtaccgggtgc磁捕获探针1。
[0059]
取两只2ml离心管,在离心管分别加入产毒性大肠杆菌st菌液(阳性样本)和大肠杆菌o157菌液(阴性样本)各50ul,各补加裂解液200ul,在室温晃动15分钟,再加入100ul含0.1mol尿素、0.5mol氢氧化钠的dna变性剂,震荡混合30分钟,再加入10ug预先制备好的的磁分离捕获探针1,继续加入2ul的1 od的生物素化探针2,加入0.5mol的ph7.5的pbs 100ul,加入0.5mol盐酸100ul,继续震荡30分钟,用磁铁将磁微粒收集,用10mm pbs缓冲液
回复到100ul,加入1∶500倍稀释的jackson immunoresearch公司的亲和素-hrp酶10ul,室温震荡30分钟,再次进行磁分离,使用10mm的pbs清洗微球两次,加入tmb底物400ul室温显色15分钟,加入终止液100ul,磁分离去除磁微粒,吸取上清液进行酶标仪od 450nm测定。产毒性大肠杆菌st样本检测结果od值2.563,大肠杆菌o157样本检测结果od值0.251。
[0060]
实施例2
[0061]
使用多探针组合磁分离杂交捕获化学发光检测流感病毒b型rna核酸序列
[0062]
设计流感病毒b型的探针组合如下:
[0063]
探针1:地高辛-gtagtaacatccaatgcagatcgaat;
[0064]
探针2:地高辛-gcaccaggaggaccctaca;
[0065]
探针3:生物素-cctgycgggttcggtaaca;
[0066]
探针4:生物素-ggtgarcgcgtggtgtg;
[0067]
制备磁分离探针:在离心管中加入10ug的使用抗地高辛抗体修饰的100nm的磁微粒,加入探针1、探针2各2nmol,室温混合30分钟,磁分离收集磁微粒。
[0068]
磁珠法提取rna核酸:取两支离心管,分别加入甲型h1n1流感病毒培养物50ul(阴性对照)和乙型流感病毒病毒培养物50ul(阳性对照),各加入裂解液350ul,漩涡震荡直至无明显颗粒物,向裂解完毕的离心管中加入200ul氯仿,震荡混匀5分钟,室温静置5分钟,在4℃ 12000rpm条件下离心10分钟,小心取出分层的离心管,吸取最上层清液,转移至新的离心管。向新的离心管中加入400ul的异丙醇和20ul的用于吸附rna的enrichingoligo dt磁珠,高速漩涡震荡5分钟,将离心管置于磁架上,分离磁珠,弃上清液后,向离心管中加入500ul的清洗液,用磁架再次分离,重复清洗一次,打开离心管,晾干磁珠,向离心管中加入50ul的洗脱液,在60℃震荡5分钟,间隔1分钟震荡混匀一次,将rna从磁珠上洗脱下来后,再次磁分离,将上清液转移到新的离心管中。
[0069]
杂交:将制备好的磁探针1、磁探针2各1ug加入两支离心管中,将生物素化探针3、生物素化探针4各取0.2nmol加入上述两支离心管中与释放的核酸rna分子杂交,同时加入1∶5000倍稀释的jackson immunoresearch公司亲和素-alp酶50ul,在室温反应30分钟,置于磁架上进行磁分离,用10mm pbs清洗磁微粒2次。
[0070]
检测:加入200ul金刚烷底物将磁微粒重悬后,转移到发光反应杯中,再在两个反应杯中各加入10ul的4m的氢氧化钠溶液,立即放入发光仪,放入后第5分钟检测,或者放入后动态读数检测。
[0071]
结果:阴性对照在第5分钟检测相对光强度为2120,阳性对照第5分钟检测相对发光强度53521。
[0072]
上述实施例中物料的用量仅供参考,本领域的研究人员应当理解,根据上述实施例可以演变出许多种的具体检测模式,使用的生物酶及与之匹配的酶作用底物可以有更多种的衍变组合。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



