细粒棘球蚴免疫原性蛋白EG95组成型表达载体的构建方法与流程
 2021-02-02 14:02:01|
2021-02-02 14:02:01| 524|
524| 起点商标网
起点商标网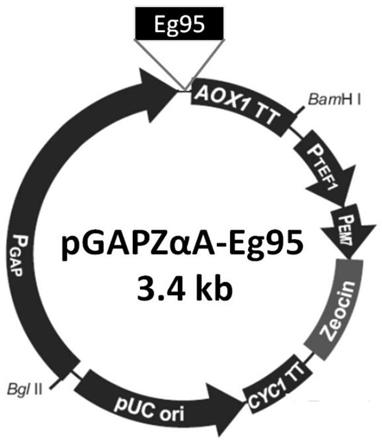
细粒棘球蚴免疫原性蛋白eg95组成型表达载体的构建方法
技术领域
[0001]
本发明属于基因工程技术领域,具体涉及细粒棘球蚴免疫原性蛋白eg95组成型表达载体的构建方法。
背景技术:
[0002]
棘球蚴病(echinococcosis),俗称包虫病,是由棘球属绦虫的幼虫——棘球蚴寄生于动物(包括人)的肝、肺等组织而引起的一种危害严重的人兽共患寄生虫病,是全球性重要公共卫生问题之一。我国是包虫病发病最高的国家之一。棘球蚴病被世界动物卫生组织(oie)归为全球通报的传染性疫病,被世界卫生组织(who)列为17种被忽视的热带病(neglected tropical diseases,ntds)之一。棘球蚴病不仅影响着发展中国家和地区的贫困人群,而且对一些国家或地区动物及动物产品国际贸易构成了障碍。
[0003]
在棘球蚴病防治中,关键环节在于控制动物棘蚴病传染源、切断生活史循环链。一方面,需要对流行区牛、羊进行免疫预防,同时,管控棘球蚴病变牛、羊内脏未经加工直接饲喂犬。另一方面,要按照“犬犬驱虫、月月投药”的方案对流行区的犬进行驱虫管理,从而实现对传染源的控制。但是对终末宿主的驱虫管理也存在一些弊端:驱虫后粪便需要进行无害化处理,如果处理不当,易造成病原的进一步扩散;家养犬可以进行定期驱虫,但是对于流浪犬的驱虫就很难管理,而对于狼、狐狸等野生动物终末宿主就更难进行定期驱虫,因此,通过免疫预防来控制和消灭包虫病是有效而理想的途径。
[0004]
研究证实,棘球绦虫六钩蚴分泌抗原具有较好的保护作用,但无法在体外培养中大量增殖,抗原来源量有限,因而限制了其在免疫预防中的广泛应用。大量实验研究发现,eg95蛋白抗原是六钩蚴组成成分中理想的疫苗抗原候选分子,lightowlers等人利用eg95蛋白抗原成功研制了羊细粒棘球病eg95基因工程亚单位疫苗,免疫羊对细粒棘球绦虫虫卵感染的保护率可以达到96%,是目前控制羊棘球蚴病的唯一疫苗(lightowlers mw,lawrence sb,gauci cg,et al.vaccination against hydatidosis using a defined recombinant antigen.parasite immunol,1996,(18):457-462)。但现有的重组eg95重组蛋白疫苗抗原使用大肠杆菌生产的gst融合蛋白,其表达产物以不可溶的包涵体形式存在,难以维持蛋白的天然结构,也缺乏蛋白质翻译后加工修饰过程,从而影响了疫苗的免疫保护效果,且由于内毒素难以去除而导致免疫副反应大等弊端。
[0005]
贾万忠等人成功在毕赤酵母gs115中实现了eg95蛋白的分泌性表达,蛋白浓度和目的蛋白纯度都较理想(专利:细粒棘球蚴eg95蛋白的修饰及在酵母中的表达,zl201210103512.1)。但是,该酵母表达系统是以醇氧化酶(aox)为启动子的诱导型表达系统,只有以甲醇作为唯一碳源时,才能表达和分泌外源蛋白。然而,甲醇是一种有毒物质,并且易燃、易爆,在大规模生产过程中存在安全隐患。同时,发酵过程中很容易出现甲醇的蒸发,对环境构成威胁,并且也会引起甲醇在发酵产物中的残留,容易对免疫动物的健康造成危害。此外,在高密度发酵过程中,把碳源从甘油更换到甲醇也很不方便,且发酵周期长。而毕赤酵母组成型表达系统以三磷酸甘油醛脱氢酶(pgap)为启动子,该系统表达外源蛋白时
不需要把碳源从甘油更换成甲醇,从而避免了使用甲醇时存在的诸多弊端,更适合大规模生产外源蛋白。并且在高密度发酵时采用连续发酵模式,表达时间短,大大缩短了发酵周期,提高了生产效率,因此,毕赤酵母组成型表达系统已成为近年来研究和开发的热点和方向。
技术实现要素:
[0006]
为了解决现有技术中存在的问题,本发明提供一种细粒棘球蚴免疫原性蛋白eg95组成型表达载体的构建方法,是在毕赤酵母系统中实现细粒棘球蚴eg95蛋白组成型表达,包括细粒棘球蚴eg95基因修饰的处理方法,并利用修饰处理后的基因制备出重组表达质粒、筛选酵母工程菌,以及用这种重组酵母工程菌表达具有可溶、纯度高、易于纯化且具有生物学活性蛋白的方法。在表达时,以甘油为碳源,完全克服了现有毕赤酵母表达系统需要甲醇诱导存在安全隐患的不足。
[0007]
本发明提供细粒棘球蚴免疫原性蛋白eg95的修饰方法,在完整eg95蛋白的基础上,n-端去除16个氨基酸,c-端截去21个氨基酸,并根据酵母表达系统的密码子使用偏好性和密码子的简并性对eg95基因进行密码子优化,修饰后的eg95基因的核苷酸序列为seq id no.1。
[0008]
本发明还提供一种细粒棘球蚴免疫原性蛋白eg95基因组成型表达载体,所述表达载体包括上述的修饰后的细粒棘球蚴免疫原性蛋白eg95编码基因。
[0009]
作为优选,所述表达载体含有毕赤酵母组成型启动子gap和eg95基因形成的融合基因,即pgapzαa-eg95。
[0010]
作为优选,采用的原始连接载体为pgapzαa。
[0011]
作为优选,所述表达载体的构建方法包括以下步骤:
[0012]
(1)对上述的修饰后的细粒棘球蚴免疫原性蛋白eg95基因序列进行基因合成,将其和pmd18-t载体连接,转化至大肠杆菌dh5α感受态细胞,鉴定正确后得到pmd18-eg95克隆载体;
[0013]
(2)用限制性内切酶xho-和ecor-分别对表达载体pgapzαa和pmd18-eg95进行双酶切,回收pmd18-eg95载体片段和含pgap启动子的pgapzαa载体片段,连接,得到表达载体pgapzαa-eg95。
[0014]
本发明还提供上述细粒棘球蚴免疫原性蛋白eg95基因组成型表达载体的构建方法,包括以下步骤:
[0015]
(1)对上述的修饰后的细粒棘球蚴免疫原性蛋白eg95基因序列进行基因合成,将其和pmd18-t载体连接,转化至大肠杆菌dh5α感受态细胞,鉴定正确后得到pmd18-eg95克隆载体;
[0016]
(2)用限制性内切酶xho-和ecor-分别对表达载体pgapzαa和pmd18-eg95进行双酶切,回收pmd18-eg95载体片段和含pgap启动子的pgapzαa载体片段,连接,得到表达载体pgapzαa-eg95。
[0017]
本发明还提供含有上述的表达载体的宿主细胞。
[0018]
作为优选,所述宿主细胞为毕赤酵母smd1168基因工程菌pgap-eg95-1。
[0019]
作为优选,所述宿主细胞的构建方法为:将应用上述方法构建的表达载体pgapzα
a-eg95用限制性内切酶bamh-酶切作线性化处理,然后转化毕赤酵母smd1168,获得重组毕赤酵母smd1168基因工程菌。
[0020]
本发明还提供一种在重组毕赤酵母中表达外源性细粒棘球蚴免疫原性蛋白eg95的方法,将上述的宿主细胞发酵培养,分泌产生细粒棘球蚴主要免疫原性蛋白eg95;优选使用含有甘油且不含甲醇的培养基进行发酵培养。
[0021]
经本发明的修饰方法修饰的细粒棘球蚴eg95蛋白,是对其编码基因进行了密码子优化处理,这种密码子优化可使其在酵母细胞内高效表达,而且对eg95蛋白氨基酸序列和保护性抗原决定簇没有改变,由此构建的表达eg95蛋白的重组酵母菌,可对目的蛋白进行组成型的高效可溶性分泌表达,且可对目的蛋白进行一定程度的蛋白翻译后加工修饰,如n-糖基化。本发明采用真核表达系统毕赤酵母组成型表达eg95蛋白,使用gap启动子,表达过程中只需要甘油作为碳源,不需要甲醇诱导表达,因此具有安全、方便、无毒副作用等优点,显著降低了生产周期、生产成本和生产的复杂性。
[0022]
本申请人成功在毕赤酵母组成型表达系统毕赤酵母smd1168菌株中实现了eg95蛋白的分泌性表达,经三角瓶摇床表达的蛋白浓度达到0.5g/l,目的蛋白纯度达到90%以上。以甘油为碳源,完全克服了现有毕赤酵母表达系统需要甲醇诱导存在安全隐患的不足。经western blotting试验,新表达的重组eg95蛋白与现有羊棘球蚴eg95亚单位疫苗免疫抗体能反应,而与其他重组蛋白抗体无反应,表明其具有良好的反应原性和特异性。
附图说明
[0023]
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
[0024]
图1为本发明的重组酵母表达载体pgapzαa-eg95构建示意图。
[0025]
图2为重组菌株pgap-eg95-1的pcr鉴定电泳图。
[0026]
图3为本发明中重组毕赤酵母pgap-eg95-1在bmgy培养基中诱导表达后培养基上清的sds-page电泳图。
[0027]
图4为本发明中重组蛋白的反应原性和特异性分析的western blotting图。
具体实施方式
[0028]
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为市售。
[0029]
实施例1
[0030]
1.表达载体pgapzαa-eg95的构建方法
[0031]
1.1细粒棘球蚴主要免疫原性蛋白eg95基因的修饰
[0032]
在完整eg95蛋白的基础上,从n-端去除16个氨基酸的信号肽序列,从c-端截去21个氨基酸,并根据酵母表达系统的密码子使用偏好性和密码子的简并性对eg95基因进行密码子优化,改造后的eg95基因序列(5
’-
3
’
)如下:
[0033]
caggaatacaagggtatgggtgttgagactcgtacgactgagactcctttgaggaaacactttaacctgaccccagttggatcgcaaggtatcagactttcatgggaagtgcaacatctgtctgatttgaaaggtaccgacatctc
cctgaaagctgtcaatccttccgatcccttggtttacaagagacaaacagcaaagtttagcgacggtcagctaacaattggagagttaaaaccatctactttgtataagatgaccgttgaagctgtgaaggctaaaaagacaattcttggcttcactgtggatattgagactccaagagccggaaaaaaggaaagtactgtaatgaca
[0034]
eg95蛋白的氨基酸序列如下:
[0035]
qeykgmgvetrttetplrkhfnltpvgsqgirlswevqhlsdlkgtdislkavnpsdplvykrqtakfsdgqltigelkpstlykmtveavkakktilgftvdietpragkkestvmt
[0036]
本申请的优化后的核苷酸序列与优化前的核苷酸序列对比,相似性为72.83%,而氨基酸序列未改变,完全一致。
[0037]
1.2按照步骤1.1中的修饰后的eg95基因序列进行基因合成,pcr扩增后,通过xho-和ecor-酶切位点连接到pmd18-t载体(takara)上,转化大肠杆菌dh5α感受态细胞,构建pmd18-eg95克隆载体,将pmd18-eg95和表达载体pgapzαa分别用xho-和ecor-进行双酶切,胶回收目的产物,t4dna连接酶连接,构建成酵母表达载体pgapzαa-eg95。
[0038]
图1为本发明的重组酵母表达载体pgapzαa-eg95构建示意图。
[0039]
1.3将pgapzαa-eg95用bamh-酶切进行线性化。
[0040]
2.重组酵母转化子的构建方法
[0041]
挑取毕赤酵母smd1168单菌落,接种至ypd培养基,30℃下培养至od
600nm
达到1~2,离心收集菌体,制备感受态细胞。将10~30pg的经bamh-线性化的pgapzαa-eg95质粒与80μl的感受态细胞混匀,在1500v,200ω,25μf的条件下电击5ms将酶切产物转化至毕赤酵母smd1168。转化液涂布于含有100μg/ml zeocin的ypd平板上,在30℃培养,然后将抗性菌转接至含200μg/ml zeocin的ypd平板上培养筛选获得抗性菌株单克隆。其中,ypd培养基(又称ypd平板)配方为:1%酵母提取物,2%蛋白胨和2%葡萄糖。并分别利用pgapzaa载体序列和优化后的eg95基因序列设计引物进行鉴定,阳性单克隆命名为pgap-eg95-1。
[0042]
其中,依据载体设计的扩增引物序列如下:
[0043]
上游引物(seq-f):5
′-
gtc cct att tca atc aat tg-3
′
;
[0044]
下游引物(seq-r):5
′-
ttc tcg taa gtg ccc aac-3'。
[0045]
用eg95基因序列设计的特异性引物序列如下:
[0046]
上游引物(p1):5'-caggaatacaagggtatgggt-3';
[0047]
下游引物(p2):5'-ttatgtcattacagtactttccttt-3'。
[0048]
3.酵母抗性转化子单克隆的pcr鉴定
[0049]
3.1挑取步骤2获得的阳性单克隆菌落置于无菌水中混匀,在56℃水浴中加热2min,再置于-70℃冰箱中,冷冻10min,如此重复三次。离心后取上清液为模板进行pcr扩增
[0050]
反应体系如表1所示:
[0051]
表1 pcr反应体系
[0052][0053]
pcr扩增条件为:95℃5min;94℃30s,54℃30s,72℃1min,进行30个循环;72℃,延伸10min。反应产物通过1.0%琼脂糖凝胶电泳检测扩增条带。
[0054]
3.2扩增产物在2%的琼脂糖凝胶上进行电泳分析。在以zeocin抗性毕赤酵母菌基因组dna为模板的反应管中,扩增出大小为357bp的片段,而普通毕赤酵母菌及pgapzαa空载体转化菌中则无此片段,表明eg95基因已整合到smd1168的酵母基因组中,见附图2。如此得到了重组菌株pgap-eg95-1。
[0055]
图2为重组菌株pgap-eg95-1的pcr鉴定电泳图。图中,m:dl2000 dna marker;泳道1:载体特异鉴定引物扩增结果(830bp);泳道2:eg95基因特异性引物扩增结果(357bp);泳道3:阴性对照。
[0056]
由图2可以看出,本发明成功在毕赤酵母组成型表达系统中实现了eg95蛋白的分泌性表达,目的蛋白纯度达到90%以上。
[0057]
4.摇瓶表达
[0058]
将高效表达的重组工程菌株pgap-eg95-1接种于装有50ml bmgy液体培养基的250ml三角瓶中,无菌培养容器透气封口膜扎口,30℃培养表达,此后每24h取菌1ml,并向培养基中补加甘油至终浓度为1%,以保证持续的表达。接菌后96h,收集上清液即为含有目的蛋白的表达液。表达量为0.5mg/ml。
[0059]
其中,bmgy培养基配方为:1%酵母提取物,2%蛋白胨,1.34%ynb,4
×
10-5
%生物素,1%甘油,100mmol/l的磷酸盐缓冲液(ph6.0)。
[0060]
5.重组蛋白eg95的检测与鉴定
[0061]
5.1重组蛋白eg95的sds-page分析
[0062]
重组毕赤酵母pgap-eg95-1在bmgy培养基中30℃诱导表达完成后,离心收集上清液,变性后进行12%sds-page分析,结果显示在14kda左右处出现蛋白质条带,参见附图3,表明目的蛋白在酵母表达系统内进行了可溶性分泌表达。
[0063]
图3为本发明中重组毕赤酵母pgap-eg95-1在bmgy培养基中诱导表达后培养基上清的sds-page电泳图。图中,m:蛋白分子量标准(116.0/66.2/45.0/35.0/25.0/18.4/14.4kda);泳道1-3:重组eg95蛋白在补加甘油后48h、72h和96h时的电泳图,箭头所指为重组蛋白。
[0064]
5.2重组蛋白eg95的质谱分析
[0065]
从考马斯亮蓝染色凝胶上切下重组蛋白带,送上海鹿明生物科技有限公司进行质谱鉴定。蛋白质谱图出峰情况正常,说明质谱测定结果良好。重组eg95蛋白数据库检索分析结果显示(表2),sequest程序打分最高的三条肽段序列均为eg95蛋白氨基酸残基序列,其
中打分最高达到169.2,且其序列对eg95蛋白序列的覆盖率达61%,一般评分大于85分的结果可信,表明表达蛋白为eg95蛋白高度可信,表达产物氨基酸序列正确,表达上清中的重组蛋白为细粒棘球蚴eg95蛋白,参见表2。
[0066]
表2本发明的重组eg95蛋白的肽段序列数据库检索结果
[0067][0068]
表2中提到蛋白评分大于85分的结果可信,检索蛋白评分最高的均为细粒棘球蚴eg95蛋白序列,表达蛋白为eg95蛋白高度可信。
[0069]
5.3重组eg95蛋白的反应原性和特异性分析
[0070]
对表达产物进行了western blotting分析,鉴定其对已有羊棘球蚴病eg95亚单位疫苗免疫阳性血清的反应原性,及对抗细粒棘球蚴agb蛋白阳性血清、抗多头带绦虫tm18蛋白阳性血清的特异性。结果显示,在蛋白相对分子质量约为14kda的条带对应大小处与羊棘球蚴病疫苗免疫抗体阳性血清发生免疫反应,而两种其他特异性血清无相应条带(图4)。说明重组蛋白能够与疫苗免疫阳性血清反应,具有较强的反应原性,且特异性高。
[0071]
图4为本发明中重组蛋白的反应原性和特异性分析的western blotting结果。图中,m:蛋白分子量标准(116.0/66.2/45.0/35.0/25.0/18.4/14.4kda);1:毕赤酵母-eg95表达产物的sds-page结果;2~4:依次对本发明的重组eg95蛋白与羊棘球蚴病重组抗原疫苗免疫抗体阳性血清、抗细粒棘球agb蛋白阳性血清、抗多头带绦虫tm18蛋白阳性血清的western blotting结果。
[0072]
以上表明,经本发明的密码子优化和截短处理后构建的表达eg95蛋白的重组酵母菌pgap-eg95-1,可对目的蛋白eg95进行组成型高效可溶性分泌表达,完全克服了现有原核表达技术的表达产物多以不可溶的包涵体形式存在,难以维持蛋白的天然结构和缺乏蛋白质翻译后加工修饰过程的不足,也完全克服了现有毕赤酵母表达系统需要甲醇诱导存在安全隐患的不足。目的蛋白能够与羊棘球蚴病疫苗免疫抗体阳性血清发生免疫印迹反应,且与抗细粒棘球agb蛋白阳性血清、抗多头带绦虫tm18蛋白阳性血清均无特异性反应,表明重组eg95蛋白的抗原反应性和特异性良好。
[0073]
本发明中eg95蛋白编码基因的优化是根据组成型表达毕赤酵母菌株的的密码子偏爱性进行的,选择的表达菌株是毕赤酵母smd1168菌株。优化后的eg95蛋白编码基因核苷酸序列与专利201210103512.1中优化后的eg95蛋白编码基因核苷酸序列对比,相似性为80.2%,与优化前的原始核苷酸序列相比,序列相似性为72.83%,而氨基酸序列则完全相同。优化后的eg95蛋白编码基因能在毕赤酵母smd1168菌株高效表达,经质谱鉴定证实表达后的蛋白氨基酸残基序列正确;经western blotting试验证实,eg95蛋白具有较强的反应原性。
[0074]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可
以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



