芳香族双马来酰亚胺化合物及其制造方法、及含该化合物的热固性环状酰亚胺树脂组合物与流程
 2021-02-02 14:02:57|
2021-02-02 14:02:57| 244|
244| 起点商标网
起点商标网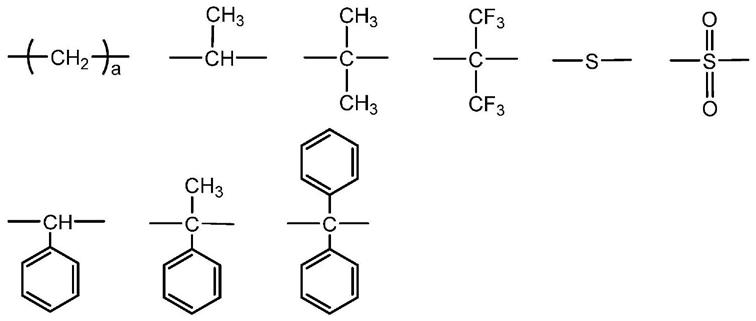
[0001]
本发明涉及芳香族双马来酰亚胺化合物及其制造方法、以及含有该化合物的热固性环状酰亚胺树脂组合物。
背景技术:
[0002]
双马来酰亚胺树脂已知为高耐热性树脂之一,且作为具有弥补环氧树脂和聚酰亚胺之间的耐热性的差异的可能性的化合物一直被探讨着。近年也公开了新型双马来酰亚胺化合物(专利文献1和专利文献2)。另外,还公开了具有非常低的介电特性的双马来酰亚胺化合物(专利文献3)。这些双马来酰亚胺化合物大多作为基材用树脂使用,广泛用于浸渍清漆、层叠板,并进一步用于成型品等。但是,在多数情况下,虽然想将双马来酰亚胺化合物本身进行膜化但却不能成膜,因此,虽然双马来酰亚胺化合物与成膜剂并用,但其不能有效地利用双马来酰亚胺化合物本身的特性。
[0003]
大多的双马来酰亚胺化合物是分子量为2000以下的低分子、或单体,尽管存在在重复单元中含有马来酰亚胺的高分子量化的化合物(专利文献4),但是,极少有在分子的主链中具有直链状、链状的高分子骨架、且在分子的两末端具有马来酰亚胺基团的高分子量的双马来酰亚胺化合物的公开例。
[0004]
另外,大多的芳香族双马来酰亚胺化合物存在仅溶解于nmp(n-甲基-2-吡咯烷酮)、dmac(n,n-二甲基乙酰胺)等高沸点非质子性极性溶剂中等的缺点。因此,人们期待着可溶解于其它通用性溶剂中的芳香族双马来酰亚胺化合物。
[0005]
另外,近年来,为了应对智能手机、平板电脑等高性能移动终端的数据处理的高速化
·
大容量化,正在推进数字信号的高频化。为了使这种高频电子部件能够高性能化,所传输的印刷布线的设计尤为重要,并且还要求在不损害包括高阶的高频的高速数字信号质量的情况下使信号传播速度高速化。
[0006]
其中,为了减少高频数字信号的传输损耗,则需要使相对介电常数和介电损耗角正切变小。因此,对近年来用于印刷布线板等高性能移动终端等的高频电子部件的各种材料,均要求为非常低的相对介电常数和介电损耗正切。
[0007]
从这些观点考虑,已有具有低介电特性的聚酰亚胺树脂的报告(专利文献5和专利文献6)。
[0008]
由于聚酰亚胺树脂的耐热性、阻燃性、机械特性以及电绝缘性等优异,其被广泛用作半导体的层间绝缘膜或表面保护膜用的清漆。还公开了在直接或隔着绝缘膜将处于清漆状态下的聚酰亚胺树脂涂布在半导体元件等上之后,使其固化,形成由聚酰亚胺树脂组成的保护膜,进一步用环氧树脂等成型材料进行封装。(专利文献7和专利文献8)。另外,还有从清漆中除去溶剂进而作为膜使用的报告(专利文献9)。
[0009]
该聚酰亚胺清漆通常通过将聚酰亚胺溶解在n-甲基-2-吡咯烷酮(nmp)中来制备。nmp作为非质子性极性溶剂,以往虽在许多情况下使用,但由于其为高沸点且具有毒性,因
此,以欧洲为中心严格限制使用。另外,由于聚酰亚胺需要在250℃以上的非常高的温度的条件下进行固化,因此,也期望着其替代材料。
[0010]
现有技术文献
[0011]
专利文献
[0012]
专利文献1:日本特开2011-219539号公报
[0013]
专利文献2:日本特开2018-012671号公报
[0014]
专利文献3:日本特开2014-194021号公报
[0015]
专利文献4:日本特开2012-036233号公报
[0016]
专利文献5:日本特开2013-199646号公报
[0017]
专利文献6:日本特开2016-069651号公报
[0018]
专利文献7:日本特开2007-008977号公报
[0019]
专利文献8:日本特开2010-070645号公报
[0020]
专利文件9:日本特开2018-134808号公报
技术实现要素:
[0021]
发明所要解决的问题
[0022]
因此,本发明其目的在于,提供一种新型芳香族双马来酰亚胺化合物及其制造方法。该热芳香族双马来酰亚胺化合物不使用成膜剂也能够成膜,且可以溶解在除高沸点非质子性极性溶剂以外的溶剂中。
[0023]
本发明的另一目的在于,提供一种半导体装置。该半导体装置可以在不使用nmp等的非质子性极性溶剂、且在低温条件下进行固化,并且具有可赋予机械特性、耐热性、相对介电常数、介电损耗角正切、耐湿性以及粘接性优异的固化物的热固性环状酰亚胺树脂组合物和使用该组合物的粘接剂、基板材料、底漆、涂料以及该组合物的固化物。
[0024]
解决问题的方法
[0025]
本发明人们为了解决上述问题而反复进行深入研究的结果发现,下述芳香族双马来酰亚胺化合物以及含有该化合物的热固性环状酰亚胺树脂组合物能够达到上述目的,从而完成了本发明。
[0026]
<1>
[0027]
下述式(1)表示的芳香族双马来酰亚胺化合物,
[0028][0029]
式(1)中,x
1
独立地为选自下述式的二价基团,m为1~30的数,n为1~5的数,
[0030][0031]
(a为1~6的数)
[0032]
a
1
和a
2
分别独立地为下述式(2)或下述式(3)表示的二价芳香族基团,
[0033][0034][0035]
式(2)中,x
2
独立地为选自下述式中的二价基因,r
1
独立地为氢原子、氯原子、或者未经取代或经取代的碳原子数1~6的脂肪族烃基,
[0036][0037]
(a为1~6的数)
[0038]
式(3)中,x
1
与上述含义相同。
[0039]
<2>
[0040]
如<1>所述的芳香族双马来酰亚胺化合物,
[0041]
其中,所述式(1)的芳香族双马来酰亚胺化合物的数均分子量为3000~50000。
[0042]
<3>
[0043]
如<1>或<2>所述的芳香族双马来酰亚胺化合物,
[0044]
其中,所述式(1)的x
1
和所述式(3)的x
1
为相同的二价基团。
[0045]
<4>
[0046]
如<1>~<3>中任一项所述的芳香族双马来酰亚胺化合物,
[0047]
在所述式(1)中,a
1
由所述式(2)表示时、a
2
由所述式(3)表示;或者a
1
由所述式(3)表示时,a
2
由所述式(2)表示。
[0048]
<5>
[0049]
<1>~<4>中任一项所述的芳香族双马来酰亚胺化合物的制造方法,该方法包括:
[0050]
工序a,通过使芳香族二邻苯二甲酸酐和芳香族二胺在摩尔比为芳香族二邻苯二甲酸酐/芳香族二胺=1.01~1.50/1.0的条件下进行反应,合成酰胺酸,进行闭环脱水;
[0051]
工序b,其为所述工序a之后的工序,由所述工序a中得到的反应物和芳香族二胺合成酰胺酸,进行闭环脱水;以及
[0052]
工序c,其为所述工序b之后的工序,通过使所述工序b中得到的反应物和马来酸酐进行反应,合成马来酰胺酸,进行闭环脱水,由此用马来酰亚胺基团对分子链末端进行封端,
[0053]
所述工序a中的芳香族二邻苯二甲酸酐由下述式(4)表示,
[0054][0055]
式(4)中,x
1
独立地为选自下述式中的二价基团,
[0056][0057]
(a为1~6的数)
[0058]
所述工序a中的芳香族二胺由下述式(5)表示,
[0059][0060]
式(5)中,r
1
独立地为氢原子、氯原子、或者未经取代或经取代的碳原子数为1~6的脂肪族烃基,x
2
独立地为选自下述式中的二价基团,
[0061][0062][0063]
(a为1~6的数)
[0064]
所述工序b中的芳香族二胺由下述式(6)表示,
[0065][0066]
式(6)中,x
1
与上述含义相同。
[0067]
<6>
[0068]
<1>~<4>中任一项所述的芳香族双马来酰亚胺化合物的制造方法,该方法包括:
[0069]
工序a
’
,通过使芳香族二邻苯二甲酸酐和芳香族二胺在摩尔比为芳香族二邻苯二甲酸酐/芳香族二胺=1.01~1.50/1.0的条件下进行反应,合成酰胺酸,进行闭环脱水;
[0070]
工序b
’
,其为所述工序a
’
之后的工序,由所述工序a
’
中得到的反应物和芳香族二胺合成酰胺酸,进行闭环脱水;以及
[0071]
工序c
’
,其为所述工序b
’
之后的工序,通过使所述工序b
’
中得到的反应物和马来酸酐进行反应进,合成马来酰胺酸,进行闭环脱水,由此用马来酰亚胺基团对分子链末端进行封端,
[0072]
所述工序a
’
中的芳香族二邻苯二甲酸酐由下述式(4)表示,
[0073][0074]
式(4)中,x
1
独立地为选自下述式中的二价基团,
[0075]
[0076][0077]
(a为1~6的数)
[0078]
所述工序a
’
中的芳香族二胺由下述式(6)表示,
[0079][0080]
式(6)中,x
1
独立地为选自下述式中的二价基团,
[0081][0082]
(a为1~6的数)
[0083]
所述工序b
’
中的芳香族二胺由下述式(5)表示,
[0084][0085]
式(5)中,r
1
独立地为氢原子、氯原子、或者未经取代或经取代的碳原子数为1~6的脂肪族烃基,x
2
独立地为选自下述式中的二价基团,
[0086]
[0087][0088]
(a为1~6的数)。
[0089]
<7>
[0090]
一种热固性环状酰亚胺树脂组合物,其含有:
[0091]
(a)权利要求1~4中任一项所述的芳香族双马来酰亚胺化合物;
[0092]
(b)反应引发剂;以及
[0093]
(c)有机溶剂。
[0094]
<8>
[0095]
如<7>所述的热固性环状酰亚胺树脂组合物,其中,
[0096]
所述(c)有机溶剂为选自甲乙酮(mek)、环己酮、乙酸乙酯、四氢呋喃(thf)、异丙醇(ipa)、二甲苯、甲苯以及苯甲醚中的1种或2种以上。
[0097]
<9>
[0098]
如<7>所述的热固性环状酰亚胺树脂组合物,其中,
[0099]
(b)反应引发剂的1小时半衰期温度为80~115℃,且所述热固性环状酰亚胺树脂组合物为底漆用。
[0100]
<10>
[0101]
如<9>所述的热固性环状酰亚胺树脂组合物,
[0102]
其中,(c)有机溶剂为选自环己酮、四氢呋喃(thf)、异丙醇(ipa)、二甲苯、甲苯以及苯甲醚中的1种或2种以上。
[0103]
<11>
[0104]
一种固化物的制造方法,该方法包括:
[0105]
将<9>或<10>所述的热固性环状酰亚胺树脂组合物在150℃以下的条件下进行固化。
[0106]
<12>
[0107]
一种粘接剂组合物、底漆组合物、基板用组合物或涂布材料组合物,其包含<7>或<8>所述的热固性环状酰亚胺树脂组合物。
[0108]
<13>
[0109]
<7>或<8>所述的热固性环状酰亚胺树脂组合物的固化物。
[0110]
<14>
[0111]
一种半导体装置,其具有<13>所述的热固性环状酰亚胺树脂组合物的固化物。
[0112]
<15>
[0113]
一种基板材料,其具有<13>所述的热固性环状酰亚胺树脂组合物的固化物。
[0114]
发明的效果
[0115]
本发明的芳香族双马来酰亚胺化合物不使用成膜剂也可成膜,且可溶解在除高沸
点非质子性极性溶剂以外的溶剂中。具有这种特性的本发明的芳族双马来酰亚胺化合物可用作粘接剂、底漆以及涂层材料等。
[0116]
另外,本发明的热固性环状酰亚胺树脂组合物可以在不使用nmp等非质子极性溶剂且在低温条件下进行固化,并且能够赋予机械特性、耐热性、相对介电常数、介电损耗角正切、耐湿性以及粘接性优异的固化物。因此,本发明的热固性环状酰亚胺树脂组合物作为粘接剂、基板材料、底漆、涂料材料以及具有该组合物的固化物的半导体装置是有用的。
附图说明
[0117]
图1a、图1b是实施例1中合成的芳香族双马来酰亚胺化合物的1h-nmr谱图。
[0118]
图2是实施例1中合成的芳香族双马来酰亚胺化合物的ir谱图。
具体实施方式
[0119]
以下,对本发明的具体的实施方式进行说明。
[0120]
<芳香族双马来酰亚胺化合物>
[0121]
本发明的双马来酰亚胺化合物为下述式(1)表示的芳香族双马来酰亚胺化合物,
[0122][0123]
式(1)中,x
1
独立地为选自下述式中的二价基团,m为1~30的数,优选为2~20的数;n为1~5的数,优选为1~3的数,更优选为1的数,
[0124][0125]
(a为1~6的数)
[0126]
a
1
和a
2
分别独立地为下述式(2)或下述式(3)表示的二价芳香族基团,
[0127][0128]
式(2)中,x
2
独立地为选自下述式中的二价基团,r
1
独立地为氢原子、氯原子、或者未经取代或经取代的碳原子数1~6的脂肪族烃基,
[0129][0130]
(a为1~6的数)
[0131]
式(3)中,x
1
与上述含义相同。
[0132]
从原料是否容易入手的观点考虑,作为x
1
,优选为-ch
2-、-c(ch
3
)
2-。m为1~30的数、优选为2~20的数。m在该范围内时,上述芳香族双马来酰亚胺化合物在未固化时对于溶液的溶解性、成膜能力、与得到的固化物的韧性、耐热性之间的平衡良好。n为1~5的数、优选为1~3的数、更优选为1的数。
[0133]
从原料是否容易入手的观点考虑,作为x
2,
优选为-ch
2-、-c(ch
3
)
2-。另外,r
1
独立地为氢原子、氯原子、或未经取代或经取代的碳原子数1~6的脂肪族烃基。作为具未经取代或经取代的碳原子数1~6的脂肪族烃基,可列举甲基、乙基、正丙基、异丙基、正丁基、叔丁基、环己基等。也可以列举用f、cl、br等卤原子等取代了上述这些基团的部分氢原子、或全部氢原子而得到的基团,例如,三氟甲基等。从原料是否容易入手的观点考虑,作为r
1
,优选为氢原子、或未经取代或经取代的碳原子数1~3的脂肪族烃基,更优选a
1
和a
2
互不相同。
[0134]
所述式(1)的芳香族双马来酰亚胺化合物的数均分子量优选为3000~50000、更优选为5000~40000。如果数均分子量在该范围内,则芳香族双马来酰亚胺化合物能够稳定地溶解于溶剂,且成膜能力也变得良好。
[0135]
需要说明的是,本发明中所提及的数均分子量是指,在下述条件下通过凝胶渗透色谱法(gpc)测定的以聚苯乙烯作为标准物质的数均分子量。
[0136]
[gpc的测定条件]
[0137]
展开溶剂:四氢呋喃
[0138]
流量:0.35ml/min
[0139]
检测器:ri
[0140]
柱:tsk-gel h型(tosoh corporation制造)
[0141]
柱温:40℃
[0142]
试样注入量:5μl
[0143]
另外,所述式(1)中的x
1
和所述式(3)中的x
1
具有同样的二价基团。本发明的芳香族双马来酰亚胺化合物使用具有相同的双酚骨架的二价酸酐和二胺而制造。以下,对其制造方法详细地进行说明。
[0144]
<芳香族双马来酰亚胺化合物的制造方法>
[0145]
对于本发明的芳香族双马来酰亚胺化合物的制造方法,没有特别限定,例如可以通过以下示出的任一方法高效地进行制造。
[0146]
作为一个方法,是包括工序a、工序b、以及工序c的芳香族双马来酰亚胺化合物的制造方法。
[0147]
在所述工序a中,用下述式(4)
[0148][0149]
(式中,x
1
与上述含义相同,且独立地为选自下述式
[0150][0151]
(a为1~6的数)
[0152][0153]
中的二价基团)表示的芳香族二邻苯二甲酸酐和下述式(5)
[0154][0155]
(式中,r
1
和x
2
与上述含义相同;r
1
独立地为氢原子、氯原子、或未经取代或经取代的碳原子数为1~6的脂肪族烃基,并且x
2
独立地为选自下述式
[0156][0157]
(a为1~6的数)
[0158][0159]
中的二价基团)表示的芳香族二胺合成酰胺酸,进行闭环脱水。
[0160]
所述工序b在所述工序a之后,用所述工序a中得到的反应物与下述式(6)
[0161][0162]
(式中,x
1
与上述含义相同)
[0163]
表示的芳香族二胺合成酰胺酸,进行闭环脱水。
[0164]
所述工序c在所述工序b之后,使所述工序b中得到的反应物与马来酸酐进行反应,合成马来酰胺酸,进行闭环脱水,由此用马来酰亚胺基团对分子链末端进行封端。
[0165]
作为另一种方法,为包括工序a
’
、工序b
’
、以及工序c
’
的芳香族双马来酰亚胺化合物的制造方法。
[0166]
在所述工序a
’
为用下述式(4)
[0167][0168]
(式中,x
1
与上述含义相同,且独立地为选自下述式
[0169][0170]
(a为1~6的数)
[0171]
[0172]
中的二价基团)表示的芳香族二邻苯二甲酸酐和下述式(6)
[0173][0174]
(式中,x
1
与上述含义相同)
[0175]
表示的芳香族二胺合成酰胺酸,进行闭环脱水。
[0176]
所述工序b
’
在所述工序a
’
之后,用所述工序a
’
中得到的反应物与下述式(5)
[0177][0178]
(式中,r
1
和x
2
与上述含义相同;r
1
独立地为氢原子、氯原子、或未经取代或经取代的碳原子数为1~6的脂肪族烃基,x
2
独立地为选自下述式
[0179][0180]
(a为1~6的数)
[0181][0182]
中的二价基团)表示的芳香族二胺合成酰胺酸,进行闭环脱水。
[0183]
所述工序c
’
在所述工序b
’
之后,使所述工序b
’
中得到的反应物与马来酸酐进行反应,合成马来酰胺酸,进行闭环脱水,由此用马来酰亚胺基团对分子链末端进行封端。
[0184]
虽然已经示出了上述两种制造方法,但作为基本流程,经过用芳香族二邻苯二甲酸酐和芳香族二胺合成酰胺酸、进行闭环脱水的工序a(或工序a
’
),然后在工序a(或在工序a
’
)之后,经过加入与之前的工序a(或工序a
’
)不同的芳香族二胺、合成酰胺酸、进一步进行闭环脱水的工序b(或工序b
’
),在工序b(或在工序b
’
)之后,经过使马来酸酐反应、合成马来酰胺酸、最后进行闭环脱水、由此用马来酰亚胺基团对分子链末端进行封端的工序c(或工序c
’
),可获得芳香族双马来酰亚胺化合物。上述两种制备方法之间的区别主要仅在于投入的芳族二胺的种类的顺序不同。
[0185]
反应可大致分为酰胺酸或马来酰胺酸的合成反应和闭环脱水反应这两种,以下详细地进行说明。
[0186]
在工序a(或工序a
’
)中,首先,通过使最初特定的芳香族二邻苯二甲酸酐与特定的芳香族二胺发生反应,合成酰胺酸。该反应通常在高沸点非质子性极性溶剂中且在室温(25
℃)~100℃条件下进行,但在芳香族二邻苯二甲酸酐与芳香族二胺的反应中,也可以使用苯甲醚及其衍生物(例如邻甲基苯甲醚、对甲基苯甲醚等)作为溶剂,而不是高沸点非质子性极性溶剂。
[0187]
接下来,对于酰胺酸的闭环脱水反应,在120~180℃的温度条件下进行反应之后,在从体系中除去因缩合反应而作为副产物生成的水的同时进行。为了促进闭环脱水反应,也可以添加高沸点非质子性极性溶剂、酸催化剂。作为高沸点非质子性极性溶剂,可列举n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)等。它们可以单独使用1种或并用2种以上。另外,作为酸催化剂,可列举硫酸、甲磺酸、三氟甲磺酸等。它们也可以单独使用1种或并用2种以上。
[0188]
对于芳香族二邻苯二甲酸酐与芳香族二胺的配合比,以摩尔比计优选为芳香族二邻苯二甲酸酐/芳香族二胺=1.01~1.50/1.0、更优选为芳香族二邻苯二甲酸酐/芳族二胺=1.01~1.15/1.0。通过以该比例进行配合,其结果为能够合成两末端含有酰亚胺基的共聚物。
[0189]
在工序b(或工序b
’
)中,首先通过由最初工序a(或工序a
’
)得到的两末端含有酰亚胺基的共聚物与特定的芳香族二胺发生反应来合成酰胺酸。该反应也通常在高沸点非质子性极性溶剂中且室温(25℃)~100℃的条件下进行反应,但在两末端含有酰亚胺基的共聚物与特定的芳香族二胺的反应中,优选使用苯甲醚及其衍生物(例如邻甲基苯甲醚,对甲基苯甲醚等)作为溶剂,而不是高沸点非质子性极性溶剂。它们也可以单独使用一种或可并用2种以上。
[0190]
同样,接下来,对于酰胺酸的闭环脱水反应,在120~180℃的温度条件下进行反应后,在从体系中除去因缩合反应而作为副产物生成的水的同时进行。为了促进闭环脱水反应,也可以添加高沸点非质子性极性溶剂酸催化剂。作为高沸点非质子性极性溶剂,可列举n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)等。它们可以单独使用1种或并用2种以上。另外,作为酸催化剂,可列举硫酸、甲磺酸、三氟甲磺酸等。它们也可以单独使用1种或并用2种以上。
[0191]
作为两末端含有酰亚胺基的共聚物与芳香族二胺的配合比,以摩尔比计优选为1.0:1.6~2.5、更优选为1.0:1.8~2.2。
[0192]
在工序c(或工序c
’
)中,通过在室温(25℃)~100℃的条件下使工序b(或在工序b
’
)中得到的两末端具有胺基的二胺与马来酸酐发生反应而合成马来酰胺酸,最后在除去在120~180℃的温度条件下作为副产物生成的体系中的水的同时进行闭环脱水,由此,用马来酰亚胺基团对分子链末端进行封端,能够得到目标芳香族双马来酰亚胺化合物。
[0193]
两末端具有胺基的二胺与马来酸酐的配合比以摩尔比计优选为1.0:1.6~2.5、更优选为1.0:1.8~2.2。
[0194]
<热固性环状酰亚胺树脂组合物>
[0195]
本发明的热固性环状酰亚胺树脂组合物含有上述(a)芳香族双马来酰亚胺化合物、(b)反应引发剂以及(c)有机溶剂。
[0196]
(a)芳香双马来酰亚胺化合物
[0197]
(a)成分的芳香族双马来酰亚胺化合物可以单独使用1种,也可以并用两种以上。
[0198]
在本发明的组合物中,(a)成分的含量优选为2.5~50质量%、更优选为4~45质
量%,进一步优选为5~40质量%。
[0199]
(b)反应引发剂
[0200]
(b)成分的反应引发剂为了促进(a)成分的芳香族马来酰亚胺的交联反应而添加。作为(b)成分,只要能够促进交联反应即可,并无特别限制,例如,可例举咪唑类、叔胺类、季铵盐类、三氟化硼胺络合物、有机膦类、有机盐等离子催化剂;有机过氧化物、氢过氧化物、偶氮异丁腈等自由基聚合引发剂等。其中,优选咪唑类、有机过氧化物。
[0201]
作为咪唑类,可例举为2-甲基咪唑、2-乙基-4-甲基咪唑、2-苯基咪唑、1-苄基-2-苯基咪唑、2-苯基-4,5-二羟基甲基咪唑等。
[0202]
作为有机过氧化物,可列举二枯基过氧化物、过氧化苯甲酸叔丁酯、过氧化苯甲酸叔戊酯、过氧化二苯甲酰、过氧化双月桂酰、过氧化2-乙基己酸叔戊酯、1,6-双(过氧化叔丁基羰基氧)己烷等。
[0203]
在将本发明的组合物作为铜基板用的底漆的情况下,(b)成分的反应引发剂优选使用1小时半衰期温度为80~115℃的反应引发剂(有机过氧化物)作为组分。作为这种1小时半衰期温度为80~115℃的反应引发剂(有机过氧化物),可列举以下的化合物(括号中的温度表示该化合物的1小时半衰期温度)。
[0204]
过氧化二苯甲酰(92.0℃)
[0205]
过氧化叔戊基-2-乙基己酸酯(88.0℃)
[0206]
1,6-双(过氧化叔丁基羰基氧)己烷(115.0℃)
[0207]
(b)成分的反应引发剂可以单独使用1种,也可以并用2种以上。
[0208]
相对于(a)成分100质量份,反应引发剂的配合量优选为0.05~10质量份,更优选为0.1~5质量份。如果反应引发剂的配合量超出上述范围,则有可能固化物的耐热性与耐湿性之间的平衡变差、成型时的固化速度变得非常慢或非常快。
[0209]
(c)有机溶剂
[0210]
在本发明的组合物中还进一步含有有机溶剂作为(c)成分。其只要是可溶解(a)成分的有机溶剂即可,对类型并无限制。此时,所说的“所述(c)成分可溶解所述(a)成分”是指在25℃条件下,相对于(c)成分,添加25质量%的(a)成分时,用肉眼确认没有(a)成分的未溶解而残留。
[0211]
作为(c)成分,例如,可以使用甲乙酮(mek)、环己酮、乙酸乙酯、四氢呋喃(thf)、异丙醇(ipa)、二甲苯、甲苯、苯甲醚等一般的有机溶剂,它们可以单独使用1种,也可以并用2种以上。
[0212]
在使用本发明的组合物作为铜基板用的底漆的情况下,作为(c)成分的有机溶剂,优选环己酮、四氢呋喃(thf)、异丙醇(ipa)、二甲苯、甲苯以及苯甲醚等。
[0213]
从上述(a)成分的溶解性的观点考虑,优选使用苯甲醚、二甲苯、甲苯等有机溶剂。另一方面,从为高沸点、具有毒性的观点考虑,优选不使用二甲基亚砜(dmso)、二甲基甲酰胺(dmf)、n-甲基-2-吡咯烷酮(nmp)等非质子性极性溶剂。与含有仅可溶于非质子性极性溶剂中的聚酰亚胺化合物的现有组合物不同,本发明的组合物具有也可以不使用这些非质子性极性溶剂的优点。
[0214]
其它添加剂
[0215]
可以在不损害本发明的效果的范围内向本发明的热固性环状酰亚胺树脂组合物
中添加各种添加剂。例如,为了改善树脂特性,也可配合丙烯酸树脂、环氧树脂等热固性树脂、有机聚硅氧烷、硅油、热塑性树脂、热塑性弹性体、有机合成橡胶、光稳定剂、阻聚剂、阻燃剂、颜料、染料、助粘剂等。另外,为了改善电特性,也可以配合离子捕获剂等。此外,为了改善介电特性,也可以配合含氟材料等。为了调整热膨胀系数(cte),还可以添加二氧化硅等无机填充材料。
[0216]
本发明的热固性环状酰亚胺树脂组合物可以作为粘接剂、底漆、半导体装置用涂料以及基板用材料使用。对其使用方法和使用形式并无特别地限制。
[0217]
以下,例示出使用例,但并非限定于此。
[0218]
例如,在将含有(a)成分、(b)成分以及(c)成分的热固性环状酰亚胺树脂组合物涂布于基材之后,通常在80℃以上、优选为100℃以上的温度条件下加热0.5~5小时,从而除去有机溶剂。进一步,在150℃以上、优选为175℃以上的温度条件下将所述基板加热0.5~10小时,从而能够形成表面平坦且牢固的环状酰亚胺被膜。为了在有效地除去组合物中的有机溶剂的同时还能有效地进行树脂的反应,根据情况也可以逐步提高固化温度。对本发明的组合物进行固化而获得的固化物(被膜)在机械特性、耐热性、相对介电常数、介电损耗角正切、耐湿性以及粘接性的方面优异。因此,本发明的固化物例如能够作为半导体元件表面的钝化膜:二极管、晶体管等的接合部的结保护膜:vlsi的α射线屏蔽膜:层间绝缘膜:离子注入掩膜:印刷电路板的保形涂层;液晶表面元件的取向膜;玻璃纤维的保护膜;太阳能电池的表面保护膜等而使用。
[0219]
作为涂布方法,并无特别地限制,可列举使用旋涂机、狭缝涂布机、喷涂机、浸涂机以及棒涂机进行涂布的方法。
[0220]
在形成上述固化物(被膜)之后,通过在该固化物(涂层)上对半导体封装用环氧树脂成型材料进行模塑,从而能够提高半导体封装用环氧树脂成型材料与基材之间的粘接性。如此获得的半导体装置即使在吸湿后的回流焊中也不会观察到半导体封装用环氧树脂成型材料的裂纹和从基材上剥离,可靠性高。
[0221]
在这种情况下,作为半导体封装用环氧树脂成型材料,可使用含有在1个分子中具有2个以上环氧基的环氧树脂;酚醛树脂;酸酐等环氧树脂的固化剂;和/或无机填充材料等的公知的半导体封装用环氧树脂组合物,也可以使用市售品。
[0222]
在使用铜等容易氧化的金属作为基材的情况下,为了防止氧化,使热固性环状酰亚胺树脂组合物、半导体封装用环氧树脂成型材料进行主固化的环境优选为氮气气氛。
[0223]
也可以通过将本发明的组合物涂布在片状基材上形成膜状而使用。作为该片状基材,可以使用通常使用的材料,例如可列举聚乙烯(pe)树脂、聚丙烯(pp)树脂、聚苯乙烯(ps)树脂等聚烯烃树脂;聚对苯二甲酸乙二醇酯(pet)树脂、聚对苯二甲酸丁二酯(pbt)树脂、聚碳酸酯(pc)树脂等聚酯树脂等。也可以对这些树脂的表面进行脱模处理。
[0224]
另外,对本发明的组合物的涂布方法也并无特别地限定,可列举使用间隙涂布机、淋幕涂布机、辊涂机、层压机等进行涂布的方法。对涂层的厚度也无特别地限制,蒸馏除去溶剂后的厚度优选为1~100μm、更优选为3~80μm。
[0225]
进一步,也可以在涂布层上使用覆盖膜。另外,还可以将铜箔粘贴在涂层上以带树脂的铜箔的形式作为基板材料使用。
[0226]
本发明的组合物的另一方式为将铜作为基材的底漆组合物。在将铜作为基材的底
漆组合物中,如果使用1小时半衰期温度为80~115℃的有机过氧化物作为(b)成分,则底漆组合物能够在低温条件下进行固化且即使在空气气氛中也能进行固化,并且能够抑制铜基板的氧化、与此相伴的变色。在作为铜基材用的底漆组合物使用的情况下,优选在空气气氛中,且在150℃以下的温度条件下使热固性环状酰亚胺树脂组合物固化,特别是不需要在氮气气氛中也固化的装置等,因而优选。需要说明的是,如果在如氧气气氛那样的以高浓度存在有氧气的气氛中进行固化反应,则有可能粘接耐久性降低、挥发的溶剂容易引燃,因而不优选。如上所述,如果固化温度为150℃以下,例如,也可以将热固性环状酰亚胺树脂组合物涂布在铜基材上之后,通常为80℃以上、优选为100℃以上作为第一固化温度的温度条件下进行加热0.5~5小时,从而去除有机溶剂,进一步,在高于第一固化温度的150℃以下作为第二固化温度的温度条件下加热0.5~10小时。
[0227]
实施例
[0228]
以下,示出实施例和比较例、并对本发明具体地进行说明,但本发明并不限定于下述的实施例。需要说明的是,在实施例和比较例中,“室温”的含义为25℃。
[0229]
以下,数均分子量(mn)为在下述测定条件下通过凝胶渗透色谱法(gpc)测定的以聚苯乙烯为标准物质的数均分子量。
[0230]
[gpc的测定条件]
[0231]
展开溶剂:四氢呋喃
[0232]
流量:0.35ml/min
[0233]
检测器:ri
[0234]
柱:tsk-gel h型(tosoh corporation制造)
[0235]
柱温:40℃
[0236]
试样注入量:5μl
[0237]
实施例1
[0238]
双马来酰亚胺化合物的制造
[0239]
将65.06g(0.125摩尔)的2,2-双[4-(2,3-二羧基苯氧基)苯基]丙二酐、35.26g(0.115摩尔)的4,4-亚甲基双(2,6-二乙基苯胺)以及250g的苯甲醚加入至具备搅拌器、迪安-斯达克管、冷却冷凝器以及温度计的1l玻璃制四颈烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。之后,直接将其升温至150℃,并在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了共聚物。
[0240]
之后,将7.05g(0.015摩尔)的2,2-双[4-(4-氨基苯氧基)苯基]丙烷加入到已冷却至室温的装有共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,合成了酰胺酸。然后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了两末端二胺体。
[0241]
通过将装入了得到的两末端二胺体溶液的烧瓶冷却至室温后,再向其中加入1.45g(0.015摩尔)的马来酸酐,并在80℃条件下搅拌3小时,合成了马来酰胺酸。之后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,得到了作为目标物的芳香族双马来酰亚胺化合物的清漆。之后,在130℃、减压条件(10mmhg以下)下蒸馏除去苯甲醚,得到了深褐色固体。由得到的生成物的
1
h-nmr光谱和ir光谱可知该生成物为下述式(a-1)表示的结构。将
1
h-nmr光谱表示在图1,将ir光谱表示在图2。图1b为图1a所示的
1
h-nmr光谱的局部放大图。另外,得到的生成物的数均分子量为11600。
[0242][0243]
m=8,n=1(分别为平均值)
[0244]
1
h-nmr(400mhz,cdcl
3
)δ1.26-1.28(-c
6
h
2
(-ch
2-ch
3
)
2,
12h),1.72-1.78(-c(ch
3
)
2-,12h),2.45-2.52(-c
6
h
2
(-ch
2-ch
3
)
2,
8h),3.7(-c
6
h
2-ch
2-c
6
h
2-,2h),4.14(-ch=ch-,4h),6.65-7.05(来自芳香族环,14h),7.06-7.14(来自芳香族环,8h),7.28-7.48(来自芳香族环,24h),7.92-7.95(来自芳香族环,2h)
[0245]
实施例2
[0246]
双马来酰亚胺化合物的制造
[0247]
将65.06g(0.125摩尔)的2,2-双[4-(2,3-二羧基苯氧基)苯基]丙二酐、54.05g的(0.115摩尔)2,2-双[4-(4-氨基苯氧基)苯基]丙烷以及250g的苯甲醚加入至具备搅拌器、迪安-斯达克管、冷却冷凝器以及温度计的1l玻璃制四颈烧瓶中,并通过在80℃条件下搅拌6小时,从而合成了酰胺酸。之后,直接将其升温至150℃,并且在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了共聚物。
[0248]
之后,将4.60g(0.015摩尔)的4,4-亚甲基双(2,6-二乙基苯胺)加入到冷却至室温的加入有共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,合成了酰胺酸。然后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了两末端二胺体。
[0249]
通过在将装入了得到的两末端二胺体溶液的烧瓶冷却至室温后,向其中加入1.45g(0.015摩尔)的马来酸酐,然后,在80℃条件下搅拌3小时,合成了马来酰胺酸。之后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,得到了作为目标物的芳香族双马来酰亚胺化合物的清漆。之后,在130℃、减压条件(10mmhg以下)下蒸
馏除去苯甲醚,得到了具有下述式(a-2)表示的结构的深褐色固体。另外,得到的生成物的数均分子量为15100。
[0250][0251]
m=8,n=1(分别为平均值)
[0252]
实施例3
[0253]
双马来酰亚胺化合物的制造
[0254]
将65.06g(0.125摩尔)的2,2-双[4-(2,3-二羧基苯氧基)苯基]丙二酐、40.78g的(0.115摩尔)4,4-亚甲基双(2,6-二丙基苯胺)以及250g的苯甲醚加入至具备搅拌器、迪安-斯达克管、冷却冷凝器以及温度计的1l玻璃制四颈烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。之后,直接将其升温至150℃,并且在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了共聚物。
[0255]
之后,将7.05g(0.015摩尔)的2,2-双[4-(4-氨基苯氧基)苯基]丙烷加入到冷却至室温的装入有共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,合成了酰胺酸。然后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了两末端二胺体。
[0256]
通过在将装入了得到的两末端二胺体溶液的烧瓶冷却至室温后,向其中加入1.45g(0.015摩尔)的马来酸酐,然后在80℃条件下搅拌3小时,合成了马来酰胺酸。之后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,得到了作为目标物的芳香族双马来酰亚胺化合物的清漆。之后,在130℃、减压条件(10mmhg以下)下蒸馏除去苯甲醚,得到了具有下述式(a-3)表示的结构的深褐色固体。另外,得到的生成物的数均分子量为12500。
[0257][0258]
m=8,n=1(分别为平均值)
[0259]
通过下述的方法对得到的双马来酰亚胺化合物(实施例1~3)和下述的双马来酰亚胺化合物(比较例1~3)对于各种有机溶剂的溶解性和成膜能力进行了调查。将结果表示在表1。
[0260]
比较例1:4,4
’-
二苯基甲烷双马来酰亚胺(ki
·
chemical,industryco,制造)
[0261]
比较例2:2,2
’-
双-[4-(4-马来酰亚胺基苯氧基)苯基]丙烷(ki
·
chemical,industryco,制造)
[0262]
比较例3:含有长链烷基的双马来酰亚胺化合物(bmi-1500,designer molecular inc.制造)
[0263]
溶解性试验
[0264]
相对于100g有机溶剂(苯甲醚、四氢呋喃(thf)、n-甲基-2-吡咯烷酮(nmp)或n,n-二甲基甲酰胺(dmf)),在25℃条件下分别溶解各种双马来酰亚胺化合物,并测定了其溶解度(g/100g溶剂)。
[0265]
成膜能力的评价方法
[0266]
使用贝克式涂布器,将各双马来酰亚胺化合物的n,n-二甲基甲酰胺(dmf)溶液(有效成分50质量%)以成为30μm厚、a4尺寸(210mm
×
297mm)的方式,分别涂布于38μm厚的聚对苯二甲酸乙二醇酯(pet)制膜(g2-38,帝人制造)上,并在150℃条件下使其干燥。在干燥后,将外观良好且没有问题的膜评价为
○
,将由于发生收缩而不能成膜或由于双马来酰亚胺析出而发生凝聚进而导致外观不良的膜评价为
×
。
[0267]
[表1]
[0268][0269]
实施例4
[0270]
将65.06g(0.125摩尔)的2,2-双[4-(2,3-二羧基苯氧基)苯基]丙二酐、35.26g(0.115摩尔)的4,4-亚甲基双(2,6-二乙基苯胺)以及250g的苯甲醚加入至具备搅拌器、迪安-斯达克管、冷却冷凝器以及温度计的1l玻璃制四颈烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。之后,直接将其升温至150℃,并在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了共聚物。
[0271]
之后,将7.05g(0.015摩尔)的2,2-双[4-(4-氨基苯氧基)苯基]丙烷加入到已冷却至室温的装有共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,合成了酰胺酸。然后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了两末端二胺体。
[0272]
通过将装入了得到的两末端二胺体溶液的烧瓶冷却至室温后,向其中加入1.45g(0.015摩尔)的马来酸酐,并在80℃条件下搅拌3小时,合成了马来酰胺酸。之后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,得到了下述式(a-1)表示的芳香族双马来酰亚胺化合物的清漆。芳香族双马来酰亚胺化合物的数均分子量(mn)为11500。以使非挥发性成分成为16质量%的方式将苯甲醚追加至所述清漆中,然后,相对于非挥发性成分100质量份,向所述清漆中再添加2质量份的二枯基过氧化物,在室温条件下搅拌至溶解,得到了组合物。
[0273][0274]
m=8,n=1(分别为平均值)
[0275]
实施例5
[0276]
将65.06g(0.125摩尔)的2,2-双[4-(2,3-二羧基苯氧基)苯基]丙二酐、40.78g
(0.115摩尔)的4,4-亚甲基双(2,6-二乙基苯胺)以及250g的苯甲醚加入至具备搅拌器、迪安-斯达克管、冷却冷凝器以及温度计的1l玻璃制四颈烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。之后,直接将其升温至150℃,并在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了共聚物。
[0277]
之后,将7.05g(0.015摩尔)的2,2-双[4-(4-氨基苯氧基)苯基]丙烷加入到已冷却至室温的装有共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,合成了酰胺酸。然后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了两末端二胺体。
[0278]
通过将装入了得到的两末端二胺体溶液的烧瓶冷却至室温后,向其中加入1.45g(0.015摩尔)的马来酸酐,并在80℃条件下搅拌3小时,合成了马来酰胺酸。之后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,得到了下述式(a-3)表示的芳香族双马来酰亚胺化合物的清漆。芳香族双马来酰亚胺化合物的数均分子量(mn)为12500。以使非挥发性成分成为16质量%的方式将苯甲醚添加至所述清漆中,然后,相对于非挥发性成分100质量份,向所述清漆中再添加2质量份二枯基过氧化物,在室温条件下搅拌至溶解,得到了组合物。
[0279][0280]
m=8,n=1(分别为平均值)
[0281]
实施例6
[0282]
除了将实施例4中的4,4-亚甲基双(2,6-二乙基苯胺)的配合量由35.26g(0.115摩尔)更改为61.32g(0.220摩尔)以外,通过与实施例4相同的方法进行合成,得到了下述式(a-4)表示的芳香族双马来酰亚胺化合物。得到的芳香族双马来酰亚胺化合物的数均分子量(mn)为3500。合成后的清漆的制备也通过与实施例4相同的方法进行。
[0283][0284]
m=1,n=1(分别为平均值)
[0285]
实施例7
[0286]
除了将实施例4中的4,4-亚甲基双(2,6-二乙基苯胺)的配合量由35.26g(0.115摩尔)更改为38.08g(0.124摩尔),且将苯甲醚由250g更改为200g以外,通过与实施例4相同的方法进行合成,得到了下述式(a-5)表示的芳香族双马来酰亚胺化合物。得到的芳香族双马来酰亚胺化合物的数均分子量(mn)为47500。合成后的清漆的制备也通过与实施例4相同的方法进行。
[0287][0288]
m=25,n=1(分别为平均值)
[0289]
比较例4
[0290]
加入16质量份的含直链烷基的马来酰亚胺化合物(bmi-3000j,mn:6700,designer moleculars inc.制造),0.32质量份的二枯基过氧化物以及84质量份的苯甲醚,在室温条件下搅拌至全部溶解,得到了组合物。
[0291]
比较例5
[0292]
除了将比较例4的含直链烷基的马来酰亚胺化合物替换为4,4'-二苯基甲烷双马来酰亚胺(bmi-1000,mn:410,大和化成股份有限公司制造)以外,其它部分全部与比较例4相同,得到了组合物。
[0293]
比较例6
[0294]
直接使用聚酰胺酸清漆(kjr-655,信越化学工业股份有限公司制造,使用了nmp清漆,非挥发成分15质量%)。
[0295]
比较例7
[0296]
将65.06g(0.125摩尔)的2,2-双[4-(2,3-二羧基苯氧基)苯基]丙二酐、35.26g(0.115摩尔)的4,4-亚甲基双(2,6-二乙基苯胺)以及250g的苯甲醚加入至具备搅拌器、迪安-斯达克管、冷却冷凝器以及温度计的1l玻璃制四颈烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。之后,直接将其升温至150℃,并在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了共聚物。
[0297]
之后,将7.05g(0.015摩尔)的2,2-双[4-(4-氨基苯氧基)苯基]丙烷加入到已冷却至室温的装有共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,合成了酰胺酸。然后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,合成了两末端二胺体。
[0298]
通过将装入了得到的两末端二胺体溶液的烧瓶冷却至室温后,向其中加入1.45g(0.015摩尔)的马来酸酐,在80℃条件下搅拌3小时,合成了马来酰胺酸。之后,将其直接升温至150℃,在蒸馏除去作为副产物生成的水分的同时搅拌2小时,得到了芳香族双马来酰亚胺化合物的清漆。然后,进一步将该清漆在180℃条件下加热了48小时。该芳香族双马来酰亚胺化合物的数均分子量(mn)为69000。以使非挥发性成分成为16质量%的方式将苯甲醚添加至所述清漆中,然后,相对于非挥发性成分100质量份,向所述清漆中再添加2质量份二枯基过氧化物,在室温条件下搅拌直至溶解,得到了组合物。
[0299]
对在所述实施例4~7和比较例4~7中得到的组合物对于表2中所记载的有机溶剂的溶解性进行了评价。对比较例6的聚酰胺酸清漆,在一度通过减压加热除去作为溶剂的nmp的基础上,对其溶解性进行了评价。另外,对于所述组合物,在制备含有25质量%的(a)成分的组合物的苯甲醚溶液之后,进行了粘度测定。粘度根据jis k 7117-1:1999中记载的方法、在25℃条件下使用旋转粘度计而测定。需要说明的是,由于在比较例5和比较例6中,所述组合物对于苯甲醚的溶解性不足,因此未能对其进行粘度测定。将结果表示在表2。
[0300]
固化物(膜)的制备
[0301]
用辊涂机以干燥后的厚度为50μm的方式将在所述实施例4~7和比较例4~7中得到的组合物分别涂布在厚度为38μm的pet膜上,在130℃条件下加热干燥1小时后,在180℃条件下加热固化2小时,得到了固化物(膜)(固化条件a)。需要说明的是,由于比较例6在上述固化条件下固化不充分,因此,在150℃条件下加热1小时后,又在200℃条件下加热了1小时,并且进一步在250℃条件下加热固化4小时,得到了固化物(膜)(固化条件b)。另外,由于比较例7在加热固化后的溶剂脱除差,不能除去空隙,导致不能制备固化物(膜),因此,未能进行以后的评价。
[0302]
在以下的条件下,对得到的固化物(膜)进行了玻璃化转变温度、相对介电常数、介电损耗角正切以及粘接力的测定。将结果表示在表3。
[0303]
<玻璃化转变温度>
[0304]
使用上述制备的固化物(膜),通过tma装置(ta instruments制造q400),对其进行了玻璃化转变温度测定。
[0305]
<相对介电常数、介电损耗角正切>
[0306]
使用上述制备的固化物(膜),将网络分析仪(keysight technologies,inc.制造e5063-2d5)与电介质条状线(keycom股份有限公司公司制造)进行连接,对上述固化物(膜)在频率为1.0ghz时的相对介电常数和介电损耗角正切进行了测定。
[0307]
<粘接力>
[0308]
吸湿前的粘接力试验
[0309]
用喷雾器将所述实施例4~7和比较例4~7中得到的组合物分别涂布在对20mm
×
20mm的铜制框架实施了镀镍后的框架基板上,在表3中记载的固化条件下进行固化,形成了固化膜(底漆)。
[0310]
在上述固化膜上,将信越化学工业股份有限公司制造的半导体封装用环氧树脂成型材料kmc-2110g-7成型为底面积为10mm
2
、高度为3mm的圆柱形(在压力为6.9mpa、温度为175℃的条件下固化120秒)。然后,使用万能粘接试验机(dage series 4000:nordson dage公司制造),以0.2mm/秒的速度对在180℃条件下后固化了4小时的试验片进行了在室温条件下的吸湿前的粘接力的测定。
[0311]
吸湿后的粘接力试验
[0312]
为了测定吸湿后的粘接力,通过与吸湿前的粘接力试验相同的方法制备了试验片。在将该试验片在85℃/85%rh的气氛中放置168小时后,在260℃条件下进行3次ir回流焊,使用万能粘接试验机(dage series 4000:nordson dage公司制造),以0.2mm/秒的速度对该试验片进行了在室温条件下的吸湿后的粘接力的测定。
[0313]
在没有固化膜(底漆)的情况下,成型时环氧树脂成型材料全部剥离。
[0314]
[表2]
[0315][0316]
[表3]
[0317][0318]
·
固化条件a:
[0319]
(在130℃条件下加热1.0小时)+(在180℃条件下加热2.0小时)
[0320]
·
固化条件b:
[0321]
(在150℃条件下加热1.0小时)+(在200℃条件下加热1.0小时)+(在250℃条件下加热4小时)
[0322]
铜基板用底漆组合物
[0323]
以使非挥发成分含量为16质量%的方式将苯甲醚添加到表4中示出的(a)成分中,相对非挥发性成分100质量份再添加2质量份表4中示出的(b)成分,在室温条件下搅拌直至溶解,得到了组合物。
[0324]
将获得的组合物用喷雾器喷涂在20mm
×
20mm的铜制框架基板上,并在表4中记载的固化条件下进行固化,形成了固化膜(底漆)。
[0325]
初始粘接力试验
[0326]
在该固化膜上,将由信越化学工业股份有限公司制造的半导体封装用环氧树脂成型材料kmc-2110g-7成型为底面积为10mm
2
、高度为3mm的圆柱形(压力6.9mpa,在温度175℃条件下固化120秒)。然后,使用万能粘接试验机(dage series 4000:nordson dage公司制造),以0.2mm/秒的速度对在180℃条件下后固化4小时的试验片进行了在室温条件下的初始粘接力测定。
[0327]
热处理后的粘接力试验
[0328]
通过与初始粘接力试验相同的方法制备了试验片。将该试验片在180℃的气氛中放置1000小时后,使用万能粘接试验机(dage series 4000:nordson dage公司制造),以0.2mm/秒的速度对该试验片进行了在室温条件下的热处理后的粘接力测定。
[0329]
[表4]
[0330][0331]
a-1:实施例4中得到的芳香族双马来酰亚胺化合物
[0332]
a-3:实施例5中得到的芳香族双马来酰亚胺化合物
[0333]
a
’-
1:kjr-655(聚酰胺酸清漆,信越化学工业股份有限公司制造,使用了nmp清漆,非挥发成分为15质量%)
[0334]
a
’
2:bmi-3000j(含有直链烷基的马来酰亚胺化合物,designer moleculars inc.制造,mn:6700)
[0335]
b-1:二枯基过氧化物(1小时半衰期温度:137.5℃)
[0336]
b-2:过氧化叔戊基-2-乙基己酸酯(1小时半衰期温度:88℃)
[0337]
b-3:1,6-双(叔丁基过氧羰基氧基)己烷(1小时半衰期温度:115℃)
[0338]
·
固化条件a:
[0339]
(在130℃条件下加热1.0小时)+(在180℃条件下加热2.0小时)
[0340]
·
固化条件b:
[0341]
(在150℃条件下加热1.0小时)+(在200℃条件下加热1.0小时)+(在250℃条件下加热4小时)
[0342]
·
固化条件c:
[0343]
(在110℃条件下加热1.0小时)+(在130℃条件下加热2.0小时)
[0344]
可知本发明的树脂组合物通过使用1小时半衰期温度为80~115℃的有机过氧化物作为反应引发剂,在使用未进行电镀处理的铜作为底漆的情况下,能够在低温条件下固化,铜不被氧化,能够抑制固化时的变色。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



