蛋白肽、冻干粉、口服液及其制备方法与流程
 2021-02-02 14:02:40|
2021-02-02 14:02:40| 365|
365| 起点商标网
起点商标网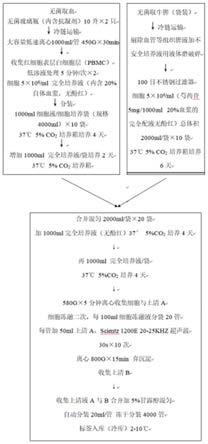
[0001]
本发明涉及生物医药技术领域,具体来说是一种蛋白肽、冻干粉、口服液 及其制备方法。
背景技术:
[0002]
功能蛋白、功能肽经人体吸收后会增强人体免疫功能,蛋白质氨基酸组成 的不同决定了该蛋白质的结构及体内消化酶解产生的多肽种类与数量。蛋白质 经酶解或水解产物可被续分为两类,即功能肽和营养肽及氨基酸等,其中功能 肽参与调节动物的生理活动或具有某特殊的作用,如抗菌肽免疫功能肽、抗氧 化肽、激素肽、生长类肽、外泌体蛋白等,而营养肽则不具备调节生理功能。
[0003]
从中反应出用生物培养扩增方式富集生物功能蛋白肽是尤为重要的,此理 论观点似乎与中国经典中医:安身之本必资于食(食甲者则补甲论)相吻合。
[0004]
人体摄入的小肽、多肽可在小肠近端直接吸收入血循环进入细胞,并直接 组装成蛋白质,而氨基酸进入人体血液经肝脏合成小肽、多肽后才被人体利用, 此说明小肽、多肽合成蛋白质比率远高于氨基酸,并且与合成功能蛋白质相关。
[0005]
在小肽的研究进展中,施用晖等人发现在产蛋鸡饲料中添加酪蛋白水解肽 能使血浆中的酪蛋白肽增加鸡蛋的产率显著提高。
[0006]
backwell用同位素标记乳蛋白技术说明了多肽与合成功能蛋白的关系,功 能蛋白生理活性表示小肽不仅可合成蛋白质,还可将功能肽结构方面的信息提 供给宿主,而表达出与氨基酸完全不同的生理作用。
[0007]
中国药理学报(2013july29(7)897~9)说明了口服多肽类药物(功能肽 类)大多数具有生理活性,如生命中细胞分化、神经、激素与递质调节、免疫 调节及肿瘤发生等生理、病理过程均与活性多肽密切相关。
[0008]
2016年11月1日题为the mesentery:structure tanction and roleindisease的研究证实人类身体里存在一个迄今尚未被承认的新器官-肠系膜, 该研究改写和更新了世界最知名的医学教材之一的《grays anatomy》,认为连 接肠和躯体的肠系膜其实是一个连续的器官,从而推测人体内消化与吸收有随 机性也有模式性。
技术实现要素:
[0009]
本发明的目的在于解决现有技术的不足,提供一种蛋白肽、冻干粉、口服 液及其制备方法,巧妙地运用动物体内动物单个核细胞和脾脏细胞,以脾脏细 胞作为滋养层诱导培养单个核细胞pbmc,使动物单个核细胞pbmc生物功能 肽的扩增。
[0010]
为了实现上述目的,设计一种蛋白肽的制备方法,所述的方法将无酚红rpmi 完全培养液、动物血浆与动物的自体脾脏混合培养以诱导产生细胞因子,然后 将动物的自体脾脏的脾细胞作为滋养层与诱导产生的细胞因子培养液一起加入 动物单个核细胞pbmc中扩增培养若干天,培养后通过离心法获得细胞与上清液 a,并在所述的上清液a加入5%甘露
醇后混匀,以获得所述的蛋白肽。
[0011]
所述的方法具体包括如下步骤:收集动物血浆中的动物单个核细胞pbmc, 并加入无酚红rpmi完全培养液,而后置于培养箱中培养若干天,培养后再加入 无酚红rpmi完全培养液,并继续置于培养箱中培养若干天。
[0012]
将所述的细胞培养液与动物的自体脾脏细胞混合,并置于培养箱中培养若 干天。
[0013]
培养后,再向细胞培养液与动物的自体脾脏细胞中加入无酚红rpmi完全培 养液再次培养若干天,培养后再加入无酚红rpmi完全培养液,并再次置于培养 箱中培养若干天。
[0014]
对通过离心法获得的细胞冻融后加入少量上清液a并进行超声波粉碎,而 后再次通过离心法获得上清液b,并将上清液a与上清液b合并后加入5%甘露 醇混匀,以获得所述的蛋白肽。
[0015]
本发明还提供一种冻干粉的制备方法,采用所述的蛋白肽的制备方法获得 富集蛋白肽,并对所述的富集蛋白肽进行冷冻干燥,以获得冻干粉。
[0016]
本发明还提供一种口服液的制备方法,采用所述的蛋白肽的制备方法获得 富集蛋白肽,并制成口服液。
[0017]
本发明还涉及一种采用所述的蛋白肽的制备方法制备获得的富集蛋白肽。
[0018]
本发明还涉及一种采用所述的制备方法获得的冻干粉。
[0019]
本发明还涉及一种采用所述的制备方法获得的口服液。
[0020]
本发明同现有技术相比,其优点在于:利用动物体的二大免疫细胞中的白 细胞与脾脏细胞,使白细胞中pbmc细胞,在脾脏细胞作为滋养层细胞的条件下, 诱导、培养、增殖到30~100倍以上;本方法利用分离等生化技术提取动物物 质的“精华”,其具有免疫功能的细胞外泌体、大量细胞因子及增强免疫功能的 多肽及小分子物质。
[0021]
人类疾病存在主要是免疫功能低下,肿瘤疾病生存的基础则是人体体内长 期免疫功能异常或下降等因素造就适合肿瘤生长的微环境,称之为肿瘤生存的 微环境,当肿瘤生存的微环境形成后想改变它难度极大,根据荷瘤动物试验证 明使用本产品具有明显的效果,若长期使用效果将更好。
[0022]
本产品细胞培养过程中富集生物功能性物质,经服用后以多肽等形式递送 给人体,调节人的免疫系统,增强人体细胞免疫与体液免疫的活力,维持与增 强人的免疫功能,清除体内自由基,清除体内连绵不断的突变细胞(包括肿瘤 细胞)。延缓衰老与防止肿瘤发生效果尤为显著,对肿瘤患者而言,服用本产品 可有效地改变肿瘤赖依生存的微环境。
附图说明
[0023]
图1是本发明的方法流程图。
[0024]
图2是杀伤比率的实验示意图。
[0025]
图3是实施例中显微镜下a1组别的示意图。
[0026]
图4是实施例中显微镜下a2组别的示意图。
[0027]
图5是实施例中显微镜下b1组别的示意图。
[0028]
图6是实施例中显微镜下b2组别的示意图。
[0029]
图7是实施例中显微镜下b3组别的示意图。
[0030]
图8是实施例中显微镜下b4组别的示意图。
[0031]
图9是实施例中对照实验示意图。
[0032]
图10是实施例4中的生物学实验的数据结果。
[0033]
图11是实施例6中的瘤重比较示意图。
[0034]
图12是实施例6中的实验对照示意图。
[0035]
图13是实施例6中的出瘤速度的实验结果示意图。
[0036]
图14是实施例6中小鼠反复毒性试验的分组示意图。
[0037]
图15是实施例6中尾静脉注射后小鼠的状况示意图。
具体实施方式
[0038]
下面结合附图对本发明作进一步说明,这种物质及制备方法的结构和原理 对本专业的人来说是非常清楚的。应当理解,此处所描述的具体实施例仅仅用 以解释本发明,并不用于限定本发明。
[0039]
本实施方式提供一种蛋白肽的制备方法,恰当巧妙地运用动物单个核细胞 和脾脏细胞,脾脏细胞作为滋养层诱导培养pbmc单个核细胞,使动物单个核 细胞(pbmc)生物功能肽的扩增,汇集脾脏细胞(脾脏细胞是动物体最大的免 疫器官是体液、细胞免疫的活动中心,储存大量功能蛋白肽)和单个核细胞 (pbmc是动物免疫功能细胞)并优化两类细胞的培养条件,细胞培养可扩大 30-100倍,使大量细胞因子表达至最佳状态。细胞经体外分离工艺制备成具备 大量免疫成分的营养品(或药品),对肿瘤细胞株具有抑制作用,对人正常pbmc 及人上皮细胞有良好促生长作用。通过该方法能够获得蛋白肽,进一步对蛋白 与肽加工,可以获得相应的冻干粉和口服液等产品。
[0040]
本制备方法的研发思路是:首先将无酚红rpmi(氨基酸等培养成分)与20% 动物血浆的培养液与动物自体脾脏细胞诱导产生白介素-、干扰素等等细胞因 子,然后将脾细胞作为滋养层与脾脏细胞诱导产生的细胞因子及rpmi新鲜培养 液一起加入动物单个核细胞中扩增培养若干天后,使其富集大量的优质功能蛋 白质及多肽,多种细胞因子根据功能分类为白介素系、干扰素系、肿瘤坏死因 子类、集落刺激因子、趋化因子和各种生长因子、免疫调节因子(cytokimenetwork)、免疫功能肽及小分子系等然后收集分装保存。
[0041]
在一个实施方式中,所述的方法具体包括如下步骤:无菌取100ml动物血 浆,收集动物血浆中的动物单个核细胞pbmc,并加入1000ml无酚红rpmi完全 培养液以获得细胞培养液(内含20%动物血浆),而后将细胞培养液置于37℃5% co
2
的培养箱中培养4天,培养后再加入1000ml无酚红rpmi完全培养液,并再 次置于培养箱中培养2天。
[0042]
此外,优选地,无菌取牛脾后提出血管等组织并加不完全培养液后将所述 的牛脾磨碎,并通过100目不锈钢过滤器过滤,而后再与动物血浆和无酚红完 全培养液混合,其中牛脾细胞的含量为5*10
6
/ml,并加入5mg芍药苷/l,而后 置于培养箱中培养6天,每袋袋装自体脾脏细胞的总体积为2000ml。
[0043]
此后,再将培养后的前述的2000ml袋装自体脾脏细胞和细胞培养液混合, 并加入1000ml无酚红rpmi完全培养液再次培养4天,培养后再加入1000ml无 酚红rpmi完全培养液,并再次置于培养箱中培养4天。
[0044]
培养后通过离心法获得细胞与上清液a,在所述的上清液a加入5%甘露醇 并混
匀,以获得蛋白与肽。
[0045]
优选地,结合图1,在获得上清液a后,对所述的细胞冻融后加入少量上清 液a并进行超声波粉碎,而后再次通过离心法获得上清液b,并将少量上清液a 与上清液b合并后加至5%甘露醇混匀,以获得蛋白与多肽。
[0046]
此外,在获得蛋白肽后,可以对蛋白肽做进一步的处理以获取后续产物, 例如对所述的蛋白与多肽进行冷冻干燥,以获得冻干粉;又如将其制备成口服 液。
[0047]
此外,在优选的实施方式中,动物血浆与动物的自体脾脏的获取方式分别 如图1所示。
[0048]
本实施方式的蛋白质、多肽的工艺,将完全培养液加入芍药苷诱导脾细胞, 其扩增培养过程中脾细胞会释放大量细胞因子,生长因子等,然后将脾细胞包 括分泌的细胞因子作用滋养层细胞与动物自体(pbmc)单个核细胞共培养,在 最佳培养条件下进入诱导,扩增pbmc细胞生长扩增到30~100倍以上,使分泌 功能蛋白、多肽至曲线的高端,然后离心收集细胞培液上清,离心收集细胞, 经超声波处理释放细胞内的蛋白质分子与多肽,然而多肽居多,这些优质量的 多肽及脾分泌的小分子物质,能被制成冻干粉或口服液等。
[0049]
实施例1:本产品的细菌检测方法
[0050]
本实施例将本产品的冻干粉溶解后按如下方法检定其细菌含量。
[0051]
牛肉膏琼脂培养基:牛肉膏0.3g,蛋白胨1.0g,氯化钠0.5g,琼脂15g, h
2
01000ml(纯水)。
[0052]
首先在烧杯中加100ml水并放入牛肉膏,蛋白胨和氯化钠,用记号笔在烧 杯外做上记号后放在火上加热,待烧杯内各组分溶解后,加入琼脂,不断搅拌 以免粘底,等琼脂完全溶解后补足失水,用10%盐酸、10%氢氧化钠调试ph至 7.2-7.6之间,置于分管三角瓶加棉花塞后,用高压蒸汽灭菌30分钟,1.2磅灭 菌完毕,在超净工作台分装平皿。
[0053]
将无菌待检样,点在平皿上放置72小时。
[0054]
实施例2:foiln
--
酚试剂法(lowry法)
[0055]
1、试剂甲
[0056]
2、试剂乙
[0057]
3、标准蛋白质溶解液,将牛血清白蛋白溶于蒸馏水,溶度为250mg/ml,若 牛血清蛋白溶于水有浊度,可改用0.9%nact溶液。
[0058]
4、标记曲线的制备:取16支试管,1支空白、3支留作未知样品,其余试 管分成两组分别加入0、0.1、0.2、0.4、0.6、0.8、1.0毫升标准蛋白溶解液。
[0059]
将每个试管中的溶液用水补足到1.0ml,然后每支试管加入5ml试剂甲混匀 于20-25℃,放置10min,再逐管加入0.5ml试剂乙(foiln
--
酚试剂),混匀要 快,然后在室温下放置30分钟,第一支为空白对照,700nm处测定光吸收值, 以蛋白为横坐标,吸光度作为纵坐标,绘制曲线。
[0060]
5、样品测定
[0061]
取1ml已稀释的样品(估计浓度20-250ug),3个复管按上述方法操作(取 1mlh
2
o做空白对照),根据光密度在标注曲线查蛋白浓度,测得每冻存管蛋白含 量为6.25mg。
[0062]
实施例3:蛋白质、多肽分析
[0063]
取冻干粉一支(6.25mg)溶解于1ml生理盐水中,溶解于1ml生理盐水后 的浓度为
6.25mg/ml,而后稀释成50-100ug/ml,用180nm-300nm波长的紫外线 扫描,检测结果为蛋白质、多肽比例各50%
±
20。能有效降低mda(脂质过氧化 物)作用,提高老鼠血清内sod(超氧化物歧化酶)活性。
[0064]
实施例4:生物学实验
[0065]
1.取冻干粉一支用不完全培养液稀释样品至0.25mg/ml、0.5mg/ml、 1.0mg/ml、2.0mg/ml。
[0066]
2.培养肿瘤细胞株a549,按2
×
10
4
接种于96孔cornins培养板,37℃5%co
2
培养培养箱中培养过夜贴壁,除去上清待用。
[0067]
①
对照组:只加完全培养液,4个复孔,200μl/孔。
[0068]
②
样品组:0.25mg/ml、0.5mg/ml、1.0mg/ml、2.0mg/ml,每个样品做4个 复孔,200ul/孔。
[0069]
将
①--②
置于37℃co2培养箱内培养3-5hr。
[0070]
3.如图10所示,将上述96孔的培养板去除上清,并用生理盐水洗二次/孔, 加100μl完全培养液10μlcck8,37℃5%co2培养2-4hr,在酶标仪450nm读 取光密度值/孔,结果见下表所示,其中,杀伤率(%)=样品组od值/对照组 od值*100%,第4组为样品对照组,5、6、7、8组分别为上述的0.25mg/ml、 0.5mg/ml、1.0mg/ml、2.0mg/ml样品组,od数值(加样检测数值)如图2所示, 其结果说明本样品对肿瘤细胞株a549有显著杀伤效果。
[0071]
注:图10中框出的为实验测试数值。
[0072]
实施例5:体外效应(形态学)测试
[0073]
a组取24孔corning板,1
×
10
5
细胞株a549/孔,在37℃,5%co
2
培养 箱中培养过夜。
[0074]
1、样品组:加0.1mg(本产品)/ml的不完全培养液/孔,培养2-5小时。
[0075]
2、对照组,加1ml完全培养液培养2-5小时。
[0076]
将上述24孔板去除上清,用生理盐水洗二次/孔,加1ml完全培养液,加 100ml cck8,37℃5%co
2
培养2-4小时,拍照,a1、a2两组的结果分别如图3 和图4所示。
[0077]
b组取24孔corning板,1
×
10
5
pbmc/孔
[0078]
1、样品组(人的正常单个核细胞):加0.1mg/ml(本产品)/ml的不完全 培养液/孔,培养2-5小时(37℃5%co
2
)。
[0079]
2、对照组:加1ml完全培养液/孔,培养2-5小时(37℃5%co
2
)。
[0080]
3、a549培养的上清浓缩0.1,mg/ml孔液1ml/孔,培养2-5小时(37℃5% co
2
)
[0081]
4、加完全培养液1ml/孔,培养2-5小时(37℃5%co
2
)。
[0082]
将上述24孔板离心去除上清洗二次/孔。
[0083]
分别加1ml完全培养液,加100μl(微升)cck8培养2-4小时,拍照, b1、b2、b3、b4四组的结果分别如图5、图6、图7和图8所示。
[0084]
结果表明:
[0085]
a1:样品(本产品)+肺腺瘤细胞株a549,在2-5小时之内肿瘤细胞凋亡。
[0086]
a2:完全培养液+肺腺瘤细胞株a549,2-5小时之内,肿瘤细胞不凋亡,反 而越长越好。
[0087]
说明本实验(本产品)改变肿瘤细胞生存微环境,使瘤细胞调亡。
[0088]
b1:样品(本产品)+人的正常细胞单个核细胞,细胞形态很好。
[0089]
b2:1ml完全培养液+人的正常细胞单个核细胞,细胞形态很好。
[0090]
b3:a549培养上清1ml+人的正常细胞单个核细胞,细胞有凋亡现象。
[0091]
b4:完全培养液+人的正常细胞单个核细胞,细胞形态很好。
[0092]
实施例6
[0093]
在建立人胃癌裸鼠移植瘤模型后,为考察类本产品的体内抗肿瘤作用,我 们选用强效的临床常用化疗药物5-fu作为阳性对照,生理盐水作空白对照。给 药于接种肿瘤细胞次日开始,而不是同时,目的是提高移植瘤模型的成功率, 尽可能减少对肿瘤细胞定植的干扰。给药方式为每天瘤周围皮下局部注射,共 计给药14天,然后停药观察一周,考察瘤体积、抑瘤率、出瘤速度、肿瘤组织 浸润等各项评价指标。
[0094]
本产品与化疗药物5-fu联合应用的方案设计为:前七天给药本产品制剂, 后七天本产品制剂和5-fu联合给药;作为对照组,前七天给生理盐水,后七天 给药5-fu,便于观察类本产品与化疗药物5-fu的协同效果。给药方式以及评价 指标均与上同。
[0095]
裸鼠肿瘤模型的建立
[0096]
1)收集处于对数生长期的贴壁sgc-7901细胞,调整细胞浓度为4.25
ꢀ×
10
6
/ml,于裸鼠右前肢腋下注射0.2ml的sgc-7901细胞悬液(0.85
×
10
6
个细胞左右),进行建模。
[0097]
2)除生理盐水空白对照组和“生理盐水+5-fu”组中各有一只裸鼠 未长瘤以外,其余裸鼠都出瘤,实验建模成功率较高。
[0098]
3)肿瘤形成的特性:在种瘤后第9天首次发现各组裸鼠开始能触及 结节,之后逐渐增大,突起。
[0099]
瘤体积
[0100]
结合图9所示,在种瘤后第9天,发现各组裸鼠开始长瘤,从第12天起肿 瘤大小可测,各组肿瘤体积增长动态变化如图9所示。从荷瘤裸鼠体内移植瘤 生长状况来看,生理盐水对照组肿瘤体积动态曲线的斜率远远大于其他治疗组, 各治疗组均有效;肿瘤体积增长动态曲线表明,本产品制剂在14天的用药期间 有效抑制肿瘤体积增长,抑瘤效果略好于5-fu阳性对照组,但无显著性差异; 本产品与5-fu联合用药组抑瘤效果则十分明显,与对照组(生理盐水+5-fu) 差异非常显著,尤其在停药后肿瘤生长速度仍然非常缓慢。
[0101]
图中可观察到生理盐水组和生理盐水+5-fu组在起点(第12天)时的差异, 这是由于生理盐水+5-fu组已经历5天的5-fu杀伤所致。
[0102]
上述结果表明,用药期间肿瘤生长速度缓慢,维持在较低水平,停止用药 后开始较快生长,提示如果延长本产品的疗程则可能取得更好的疗效。鉴于5-fu 的强烈毒副作用,以及本产品使用的安全性,提示本产品作为潜在抗肿瘤药物 的更好发展前景。
[0103]
抑瘤率
[0104]
参见图11和图12,肿瘤24小时后用药,连续给药14天,停药观察7天后, 各组裸鼠均称重后颈椎脱臼处死,完整剥离瘤块,精密电子天平称瘤重并记录, 分别用肿瘤抑制率公式计算肿瘤抑制率。
[0105]
结果表明,本产品抑瘤率达58.10%,略高于5-fu阳性对照组,显示其在体 内具有相当好的抗肿瘤活性;本产品与5-fu联合用药组抑瘤效果更高达88.20%, 这与上述肿瘤体积增长动态变化结果一致,表明本产品细胞培养上清制剂在体 内复杂环境下确有抗肿瘤的最终生物效应,充分展示了其单独使用或与化疗药 物联合使用的应用研究价值。
[0106]
出瘤速度
[0107]
在种瘤后第9天发现各组裸鼠开始长瘤。在第9天统计各组荷瘤裸鼠个数, 一定程度上反映肿瘤生长速度。相对于其它各组,联合用药组在第9天出瘤的 裸鼠只有一只,出瘤速度最慢(见下表“种瘤后第9天各组荷瘤裸鼠个数”)。 本产品尽管在第9天已有4只裸鼠出瘤,但肿瘤体积动态曲线结果表明肿瘤生 长较缓慢。
[0108]
肿瘤组织浸润观察
[0109]
种瘤后21天颈椎脱臼处死裸鼠,暴露肿瘤组织,观察肿瘤包膜完整性,边 界是否清晰,以及组织粘连、血管增生情况。
[0110]
本产品+联合用药,裸鼠皆包膜完整、边界清晰,没有出现组织粘连、浸润 现象,肿瘤较小。
[0111]
本产品用药,裸鼠包膜完整、边界清晰,没有出现组织粘连、浸润现象。
[0112]
生理盐水+5-fu,裸鼠包膜完整,没有出现组织粘连、浸润现象。
[0113]
阳性对照(5-fu),裸鼠基本包膜完整,有1只裸鼠出现组织粘连、血管增 生、浸润现象。
[0114]
空白对照(生理盐水),有4只裸鼠出现组织粘连、血管增生、浸润现象, 肿瘤体积较大。
[0115]
浸润是转移的重要监测指标,浸润程度也反映了肿瘤的恶性程度。初步观 察本产品和联合用药组情况好于其它各组。
[0116]
人胃癌sgc-7901裸鼠移植瘤模型体内实验表明,本产品抑瘤率达58.10%, 肿瘤体积增长动态曲线也表明较好的抑瘤效果,总体表现略好于5-fu阳性对照 组,显示其在体内具有相当好的抗肿瘤活性。
[0117]
本产品与5-fu联合用药组抑瘤效果高达88.20%,肿瘤体积增长动态曲线也 表明最好的抑瘤效果,说明二者具有体内协同作用。
[0118]
联合用药组出瘤速度最慢,本产品尽管出瘤速度快,但肿瘤生长缓慢;本 产品和联合用药组均显示肿瘤包膜完整、边界清晰,未发现组织粘连和浸润现 象。
[0119]
本产品在裸鼠体内的人胃癌肿瘤模型中表现出较好的抗肿瘤活性,与我们 实验室前期对小鼠b16黑色素瘤模型的抗肿瘤结果一致,表明本产品对鼠源和 人源肿瘤都具有良好的体内抗肿瘤效果。联合用药组的抗肿瘤活性更为突出, 说明二者具有体内协同作用。
[0120]
安全性评价
[0121]
为了估算体内进行抗肿瘤治疗的起始剂量,需要对本产品在小鼠体内进行 急性毒性试验;另外为了预测受试物的毒性靶器官或靶组织,及预测受试物毒 性反应的性质、程度和可逆性,需要对本产品在小鼠体内进行长期毒性试验, 对其用药时的体况进行观察,从而对本产品在体内的应用进行安全性评价,为 临床试验方案的制定提供参考。
[0122]
实验材料
[0123]
1)试剂配方
[0124]
将本产品冻干粉按使用比例溶解。
[0125]
2)实验动物
[0126]
50只健康清洁级雄性balb/c小鼠,6周龄,体重20~25g,购自上海斯莱 克实验动
物有限公司,许可证号:scxk(沪)2007-0005。
[0127]
30只雄性裸鼠
[0128]
实验方法
[0129]
1)急性毒性试验
[0130]
为了判断本产品在小鼠体内应用的最大耐受剂量,从而确定体内治疗的起 始剂量,我们给balb/c小鼠尾静脉注射不同浓缩倍数的上清制剂后,观察小鼠 的及时和随后几天的反应状态。
[0131]
尾静脉给药方法:固定小鼠,用酒精棉球擦拭小鼠尾巴,使血管扩张有利 于注射。用左手的食指、中指、无名指及大拇指将小鼠尾巴固定,注射部位先 远后近,选择距尾尖1/3处进针,此处皮肤较薄,血管清晰,容易进针。进针 时针头与桌面平行,针尖稍稍朝下,从中指及无名指与拇指接触处稍上方进针, 一旦进入,须将针头稍稍向上挑起,针头沿血管进入,注入药液。
[0132]
2)长期毒性试验(反复给药毒性试验)
[63]
[0133]
将正常5~8周龄balb/c小鼠(体重20g)随机分为高、中、低3组浓度的 本产品组和生理盐水对照组,每组10只。按下表10尾静脉给药,小鼠给药前4 小时停食。
[0134]
评价指标:
[0135]
(1)分别于注射后每天测体重及一般状态:观察动物自主活动(行动)、 呼吸、反射、痉挛、瘫痪、皮毛、肤色、眼睛、瞳孔、黏膜、分泌物、排泄。
[0136]
(2)试验结束后存活的动物均应解剖,分析心、肺、脾、肝、肾等器 官的病理组织学检查。
[0137]
(3)致瘤性安全性评估:小鼠经7天给药后,继续饲养30天后,拉颈 致死,剖腹取心、肺、肝、肾做镜检,观察体内是否有癌瘤结结出现,鉴定类 tk上清制剂致瘤的可能性。
[0138]
3)体况观察
[0139]
30只裸鼠分为5组试验,每日正常喂饲,记录裸鼠体重,并观察饮食、精 神状态、活动、排便等一般状况。
[0140]
实验结果
[0141]
急性毒性试验
[0142]
初步摸索不同浓缩倍数的本产品,对正常小鼠的急性毒性,摸索最大耐受 剂量,从而确定体内治疗的起始剂量。
[0143]
将本产品用无菌双蒸水按下表中的不同倍数浓缩复溶后进行尾静脉注射, 观察小鼠状态来判断急性最大耐受剂量。
[0144]
由表可见,一次尾静脉注射0.3ml的7倍以下浓缩上清液,不会引起小鼠 严重反应或死亡,可作为小鼠体内实验的参考指标。
[0145]
长期毒性试验(反复给药毒性试验)
[0146]
我们用40只balb/c小鼠,每天尾静脉注射高、中、低浓度的类tk上清制 剂的浓缩液,连续注射共7天,然后继续饲养观察30天后处死解剖。
[0147]
各项评价指标的结果如下:
[0148]
1)一般体况:连续尾静脉注射7天时间内,所有组别小鼠无异常反应,一 般状况与用药前基本无明显变化;在给药后饲养观察的30天之内,治疗组 小鼠与生理盐水对照组的
小鼠相比,无明显差异。
[0149]
2)小鼠经7天给药后,继续饲养30天后,断颈处死,剖腹分析心、肺、脾、 肝、肾等器官的病理组织学检查。观察后发现,所有脏器中均无明显病理组 织学异常;
[0150]
3)致瘤性安全性评估:取心、肺、肝、肾等脏器做镜检,未发现任何瘤子, 提示类tk上清制剂无致瘤性可能,因而在临床上应用是安全的。
[0151]
体况观察
[0152]
在给药过程中,本产品和联合用药组的裸鼠生长状态都比较好,体重增加, 进食正常,肿瘤生长慢。而空白对照(生理盐水)组裸鼠状态比较差,体重增 加,肿瘤生长迅速,进食量减少。体现了类tk上清制剂毒副反应轻,相对安全 有效的特点。
[0153]
因此,我们可以得出如下结论:
[0154]
1)急性毒性试验表明用药最大耐受剂量为:一次尾静脉注射0.3ml的7倍 以下浓缩上清液,可作为小鼠体内实验的参考指标。
[0155]
2)长期毒性试验结果证明本产品安全性良好。
[0156]
3)实验裸鼠体况正常:本产品单独和联合5-fu使用时,裸鼠生长状态都比 较好,体重增加、进食正常,体现了本产品毒副反应轻、安全有效。
[0157]
急性毒性试验和长期毒性试验均采用尾静脉注射,这种给药方式对小鼠的 健康及存活危害很大,而我们的给药方式是瘤周围皮下局部注射,危害小得多, 尽管如此,我们仍然参考上述剂量标准。
[0158]
理论上本产品也是相当具有安全性的:
[0159]
1)我们的产品按照临床试验要求制备,该培养上清液既符合生产标准,也 达到临床卫生要求;
[0160]
2)本产品中都是天然产生的人源化细胞因子,人与鼠的细胞因子同源化程 度非常高,应有良好的安全性。
[0161]
3)本产品的安全性,为进行体内外的实验奠定了基础,也是该制剂开发成 为产品所必须具备的前提条件。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



