作为HPK1抑制剂的三环化合物的制备方法与流程
 2021-02-02 14:02:02|
2021-02-02 14:02:02| 391|
391| 起点商标网
起点商标网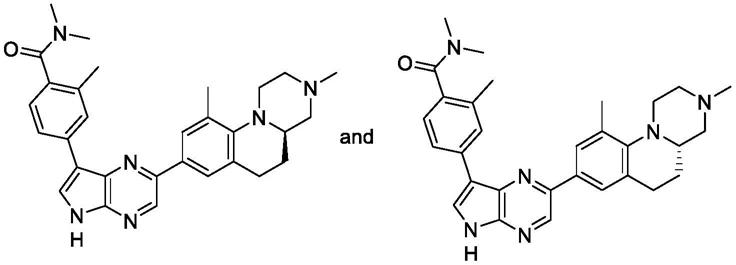
作为hpk1抑制剂的三环化合物的制备方法
技术领域
[0001]
本披露提供了三环化合物的制备方法。本文披露的化合物调节(例如抑制)造血祖细胞激酶1(hpk1)活性,并且可用于治疗包括癌症在内的多种疾病。
背景技术:
[0002]
hpk1调节多种免疫细胞的不同功能,并且已经显示其激酶活性在t细胞受体(tcr)[liou j.等人,immunity[免疫],2000.12(4):pp.399-408]、b细胞受体(bcr)[liou j.等人,immunity[免疫],2000.12(4):pp.399-408]、转化生长因子受体(tgf-βr)[wang,w.等人,j biol chem[生物化学杂志],1997.272(36):pp.22771-5;zhou,g.等人,j biol chem[生物化学杂志],1999.274(19):pp.13133-8]以及gs-偶联的pge2受体(ep2和ep4)[ikegami,r.等人,j immunol[免疫学杂志],2001.166(7):pp.4689-96]激活时被诱导。hpk1的过表达以激酶依赖性方式抑制tcr诱导的ap-1依赖性基因转录的激活,这表明hpk1是抑制erk mapk途径所必需的[liou j.等人,immunity[免疫],2000.12(4):pp.399-408],并且这种阻断被认为是负向调节tcr诱导的il-2基因转录的抑制机制[s.sawasdikosol.等人,immunol res[免疫学研究],2012.54:pp.262-265]。
[0003]
体外hpk1-/-t细胞具有较低的tcr激活阈值,可以稳健增殖,产生提高的量的th1细胞因子,hpk1-/-小鼠会经历更严重的自身免疫症状[s.sawasdikosol.等人,immunol res[免疫研究],2012.54:pp.262-265]。在人类中,hpk1在银屑病关节炎患者的外周血单核细胞或系统性红斑狼疮(sle)患者的t细胞中被下调[batliwalla f.m.等人,mol med[分子医学],2005.11(1-12):pp.21-9],这指示hpk1活性减弱可能有助于患者的自身免疫。此外,hpk1还可以经由t细胞依赖性机制调控抗肿瘤免疫力。在产生pge2的路易斯(lewis)肺癌肿瘤模型中,与野生型小鼠相比,hpk1敲除小鼠的肿瘤发展更为缓慢[美国专利申请号2007/0087988]。hpk1缺陷型t细胞比野生型t细胞更能有效控制肿瘤生长和转移[alzabin,s.等人,cancer immunol immunother[癌症免疫学与免疫疗法],2010.59(3):pp.419-29]。类似地,与野生型bmdc相比,hpk1敲除小鼠的bmdc更能有效增强t细胞反应以根除路易斯肺癌[alzabin,s.等人,j immunol[免疫学杂志],2009.182(10):pp.6187-94]。总之,对于增强抗肿瘤免疫力而言,hpk1可能是良好的靶标。
[0004]
作为hpk1调节剂,wo 2016205942披露了苯并咪唑化合物,wo 2018049152 a1披露了吡唑并嘧啶化合物,wo 2018049191 a1披露了吡唑并吡啶酮化合物,以及wo 2008124849、wo 2018049200 a1和wo 2018049214 a1披露了吡唑并吡啶化合物。
[0005]
然而,需要提供可用于治疗癌症的新hpk1激酶抑制剂。
技术实现要素:
[0006]
在第一方面,本文披露了式(i)的三环化合物的制备方法。第一实施例包含以下方面:
[0007]
方面1:一种式(i)化合物的制备方法
包含:步骤1:使用过渡金属催化下,将反应生成步骤2:使用过渡金属催化下,将反应生成步骤3:将原位脱保护或逐步脱保护以获得式(i)的化合物;其中,每个r各自独立地是boc或磺酰基;
每个r
’
各自独立地是氢或烷基;x
1
和x
2
各自独立地是ch或n;r
1
和r
2
各自独立地是氢、卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-or
a
、-so
2
r
a
、-cor
a
、-co
2
r
a
、-conr
a
r
b
、-c(=nr
a
)nr
b
r
c
、-nr
a
r
b
、-nr
a
cor
b
、-nr
a
conr
b
r
c
、-nr
a
co
2
r
b
、-nr
a
sonr
b
r
c
、-nr
a
so
2
nr
b
r
c
或-nr
a
so
2
r
b
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基中的每一个任选地被卤素、羟基、-c
1-8
烷氧基、环烷基、杂环基、芳基或杂芳基取代;r
a
、r
b
、和r
c
各自独立地是氢、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、或杂芳基;n是0、1、2、3或4;在每次出现时,r
3
和r
4
独立地是卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-or
3a
、-so
2
r
3a
、-so
2
nr
3a
r
3b
、-cor
3a
、-co
2
r
3a
、-conr
3a
r
3b
、-c(=nr
3a
)nr
3b
r
3c
、-nr
3a
r
3b
、-nr
3a
cor
3b
、-nr
3a
conr
3b
r
3c
、-nr
3a
co
2
r
3b
、-nr
3a
sonr
3b
r
3c
、-nr
3a
so
2
nr
3b
r
3c
或-nr
3a
so
2
r
3b
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、-c
1-8
烷基-杂环基、芳基或杂芳基中的每一个任选地被至少一个取代基r
3d
取代;或当附接至苯基环的相邻碳原子上时,r
3
和r
4
与它们所附接的两个碳原子一起形成包含0、1或2个杂原子作为一个或多个环成员的5元至8元环,所述杂原子独立地选自氮、氧或任选地氧化的硫,所述环任选地被至少一个取代基r
3e
取代;或当附接至苯基环的相邻碳原子上时,两个r
4
与它们所附接的两个碳原子一起形成包含0、1或2个杂原子作为一个或多个环成员的5元至8元环,所述杂原子独立地选自氮、氧或任选地氧化的硫;r
3a
、r
3b
、和r
3c
各自独立地是氢、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、或杂芳基,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、或杂芳基中的每一个任选地被至少一个取代基r
3e
取代;或(r
3a
和r
3b
)、(r
3b
和r
3c
)、或(r
3c
和r
3a
)与它们所附接的一个或多个原子一起形成3元至12元环,所述环包含0、1或2个另外的杂原子作为一个或多个环成员,所述杂原子独立地选自氮、氧或任选地氧化的硫,所述环任选地被至少一个取代基r
3e
取代;r
3d
和r
3e
各自独立地是卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-or
3f
、-so
2
r
3f
、-so
2
nr
3f
r
3g
、-cor
3f
、-co
2
r
3f
、-conr
3f
r
3g
、-c(=nr
3f
)nr
3g
r
3h
、-nr
3f
r
3g
、-nr
3f
cor
3g
、-nr
3f
conr
3g
r
3h
、-nr
3f
co
2
r
3f
、-nr
3f
sonr
3f
r
3g
、-nr
3f
so
2
nr
3g
r
3h
、或-nr
3f
so
2
r
3g
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、或杂芳基中的每一个任选地被至少一个选自卤素、-c
1-8
烷基、-or
3i
、-nr
3i
r
3j
、环烷基、杂环基、芳基、或杂芳基的取代基取代;r
3f
、r
3g
、r
3h
、r
3i
和r
3j
各自独立地是氢、-c
1-8
烷基、c
1-8
烷氧基-c
1-8
烷基-、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、或杂芳基;l
1
选自单键、亚烷基、-o-、-nr
7-、-亚环烷基、*
1-o-亚烷基-**
1
、*
1-亚烷基-o-**
1
、*
1-nh-亚烷基-**
1
、*
1-亚烷基-nh-**
1
、*
1-nhc(o)-**
1
、*
1-c(o)nh-**
1
、亚烯基或亚炔基;其中*
1
是指附接到部分的位置,并且**
1
是指附接到的位置;在每次出现时,r
6
独立地是卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-or
6a
、-so
2
r
6a
、-so
2
nr
6a
r
6b
、-cor
6a
、-co
2
r
6a
、-conr
6a
r
6b
、-c(=nr
6a
)nr
6b
r
6c
、-ch
2
conr
6a
r
6b
、-ch
2
ch
2
conr
6a
r
6b
、-ch
2
ch
2
ch
2
conr
6a
r
6b
、-nr
6a
r
6b
、-ch
2
nr
6a
r
6b
、-ch
2
ch
2
nr
6a
r
6b
、-ch
2
ch
2
ch
2
nr
6a
r
6b
、-nr
6a
cor
6b
、-nr
6a
conr
6b
r
6c
、-nr
6a
co
2
r
6b
、-nr
6a
sonr
6b
r
6c
、-nr
6a
so
2
nr
6b
r
6c
或-nr
6a
so
2
r
6b
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基中的每一个任选地被至少一个取代基r
6d
取代;或当附接至苯基环的相邻碳原子上时,两个r
6
与它们所附接的原子一起形成4元、5元、6元、7元或8元环,所述环包含0、1或2个杂原子作为一个或多个环成员,所述杂原子独立地选自氮、氧或任选地氧化的硫,所述环任选地被至少一个取代基r
6e
取代;r
6a
、r
6b
和r
6c
各自独立地是氢、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、c
1-8
烷氧基-c
1-8
烷基-、环烷基、杂环基、芳基或杂芳基,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基中的每一个任选地被至少一个取代基r
6e
取代;或(r
6a
和r
6b
)、(r
6b
和r
6c
)、或(r
6c
和r
6a
)与它们所附接的一个或多个原子一起形成3元至12元环,所述环包含0、1或2个另外的杂原子作为一个或多个环成员,所述杂原子独立地选自氮、氧或任选地氧化的硫,所述环任选地被至少一个取代基r
6e
取代;r
6d
和r
6e
各自独立地是氢、卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-or
6f
、-so
2
r
6f
、-so
2
nr
6f
r
6g
、-cor
6f
、-co
2
r
6f
、-conr
6f
r
6g
、-c(=nr
6h
)nr
6f
r
6g
、-nr
6f
r
6g
、-nr
6f
cor
6g
、-nr
6h
conr
6f
r
6g
、-nr
6f
co
2
r
6h
、-nr
6h
sonr
6f
r
6g
、-nr
6h
so
2
nr
6f
r
6g
或-nr
6f
so
2
r
6g
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基中的每一个任选地被至少一个选自卤素、-c
1-8
烷基、-or
6i
、-nr
6i
r
6j
、环烷基、杂环基、芳基或杂芳基的取代基取代;r
6f
、r
6g
、r
6h
、r
6i
和r
6j
各自独立地是氢、-c
1-8
烷基、c
1-8
烷氧基-c
1-8
烷基-、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基;p是0、1、2、3或4;x
3
、x
4
和l
2
各自独立地是单键、-o-、-co-、-so
2-、-nr
7-、-s-、-cr
7
r
8-或-cr
7
r
8-cr
9
r
10-,条件是主链内没有两个杂原子是相邻的;l
3
是单键、-co-、-cr
7
r
8-或-cr
7
r
8-cr
9
r
10-;r
51
是氢、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基;在每次出现时,r
52
、r
7
、r
8
、r
9
和r
10
独立地是氢、卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-or
5a
、-so
2
r
5a
、-so
2
nr
5a
r
5b
、-por
5a
r
5b
、-cor
5a
、-co
2
r
5a
、-conr
5a
r
5b
、-c(=nr
5a
)nr
5b
r
5c
、-ch
2
conr
5a
r
5b
、-ch
2
ch
2
conr
5a
r
5b
、-ch
2
ch
2
ch
2
conr
5a
r
5b
、-nr
5a
r
5b
、-nr
5a
cor
5b
、-nr
5a
conr
5b
r
5c
、-nr
5a
co
2
r
5b
、-nr
5a
sonr
5b
r
5c
、-nr
5a
so
2
nr
5b
r
5c
或-nr
5a
so
2
r
5b
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、-c
1-8
烷基-环烷基、杂环基、芳基或杂芳基中的每一个任选地被至少一个取代基r
5d
取代;或当附接至环的相
邻碳原子上时,r
51
和一个r
52
或两个r
52
与它们所附接的原子一起形成4元、5元、6元、7元或8元环,所述环包含0、1或2个杂原子作为一个或多个环成员,所述杂原子独立地选自氮、氧或任选地氧化的硫,所述环任选地被至少一个取代基r
5e
取代;r
5a
、r
5b
和r
5c
各自独立地是氢、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、-c
1-8
烷基-c
1-8
烷氧基、环烷基、-c
1-8
烷基-杂环基、-c
1-8
烷基-芳基、杂环基、芳基或杂芳基,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、-c
1-8
烷基-c
1-8
烷氧基、环烷基、-c
1-8
烷基-杂环基、-c
1-8
烷基-芳基、杂环基、芳基或杂芳基中的每一个任选地被至少一个取代基r
5e
取代;或(r
5a
和r
5b
)、(r
5b
和r
5c
)、或(r
5c
和r
5a
)与它们所附接的一个或多个原子一起形成3元至12元环,所述环包含0、1或2个另外的杂原子作为一个或多个环成员,所述杂原子独立地选自氮、氧或任选地氧化的硫,所述环任选地被至少一个取代基r
5e
取代;r
5d
和r
5e
各自独立地是氢、卤素、-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基、杂芳基、氧代、-cn、-no
2
、-cf
3
、-or
5f
、-so
2
r
5f
、-so
2
nr
5f
r
5g
、-por
5f
r
5g
、-cor
5f
、-co
2
r
5f
、-conr
5f
r
5g
、-c(=nr
5h
)nr
5f
r
5g
、-nr
5f
r
5g
、-nr
5f
cor
5g
、-nr
5h
conr
5f
r
5g
、-nr
5f
co
2
r
5h
、-nr
5h
sonr
5f
r
5g
、-nr
5h
so
2
nr
5f
r
5g
或-nr
5f
so
2
r
5g
,所述-c
1-8
烷基、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基中的每一个任选地被至少一个选自卤素、-c
1-8
烷基、-or
5i
、-nr
5i
r
5j
、环烷基、杂环基、芳基或杂芳基的取代基取代;r
5f
、r
5g
、r
5h
、r
5i
和r
5j
各自独立地是氢、-c
1-8
烷基、-c
1-8
烷氧基、羟基、c
1-8
烷氧基-c
1-8
烷基-、-c
2-8
烯基、-c
2-8
炔基、环烷基、杂环基、芳基或杂芳基;m是0、1、2、3或4。
[0008]
方面2:根据方面1所述的化合物的制备方法,其中x
1
是ch并且x
2
是n;或x
1
是n并且x
2
是n。
[0009]
方面3:根据方面1或2所述的化合物的制备方法,其中r
1
和r
2
各自是氢或-c
1-8
烷基(优选氢或甲基)。
[0010]
方面4:根据方面1-3中任一项所述的化合物的制备方法,其中r
3
是-conr
3a
r
3b
;r
3a
和r
3b
各自独立地是氢或-c
1-8
烷基(优选甲基、乙基、丙基、2-甲基丙基、丁基、戊基或己基);所述-c
1-8
烷基任选地被至少一个取代基r
3e
取代,其中r
3e
是如式(i)所定义的。优选地,r
3e
选自卤素、-or
3f
、cn或杂环基;r
3f
选自氢或-c
1-8
烷基(例如甲基、乙基、丙基、丁基、戊基或己基)。优选地,r
3e
是包含选自氮、氧或任选地氧化的硫的1或2个杂原子的3元至7元杂环基,例如哌嗪基、哌啶基、四氢呋喃基、四氢吡喃基或吡咯烷基。
[0011]
方面5:根据方面4所述的化合物的制备方法,其中r
3
是-conr
3a
r
3b
;r
3a
和r
3b
各自独立地是氢或-c
1-8
烷基(优选甲基、乙基、丙基、2-甲基丙基、丁基、戊基或己基);所述-c
1-8
烷基任选地被至少一个取代基r
3e
取代,其中r
3e
选自-or
3f
或杂环基;r
3f
选自氢或-c
1-8
烷基(例如甲基、乙基、丙基、丁基、戊基或己基),并且杂环基是包含选自氮或氧的1个或多个杂原子的5元、6元或7元杂环基,例如哌啶基、四氢呋喃基、四氢吡喃基或吡咯烷基。
[0012]
方面6:根据方面1-5中任一项所述的化合物的制备方法,其中r
3
是-conr
3a
r
3b
;r
3a
是-c
1-8
烷基(优选甲基、乙基、丙基、2-甲基丙基、丁基、戊基或己基),并且r
3b
是任选地被至少一个取代基r
3e
取代的-c
1-8
烷基(优选甲基、乙基、丙基、2-甲基丙基、丁基、戊基或己基),其中r
3e
选自-or
3f
或杂环基;r
3f
选自氢或-c
1-8
烷基(例如甲基、乙基、丙基、丁基、戊基或己基),并且杂环基是包含选自氮或氧的1个或多个杂原子的5元、6元或7元杂环基,例如哌啶
基、四氢呋喃基、四氢吡喃基或吡咯烷基。
[0013]
方面7:根据方面1-3中任一项所述的化合物的制备方法,其中r
3
是-conr
3a
r
3b
或-nr
3a
r
3b
,其中r
3a
和r
3b
与它们所附接的氮原子一起形成4元至12元环,所述环包含1或2个另外的氮或氧杂原子作为一个或多个环成员(例如单环3元至8元环或双环螺7元至12元环),所述环任选地被至少一个取代基r
3e
取代;r
3e
各自独立地选自氧代、-c
1-8
烷基、-or
3f
、-nr
3f
r
3g
或杂环基,所述-c
1-8
烷基或杂环基任选地被至少一个卤素取代,其中r
3f
和r
3g
各自独立地是氢或-c
1-8
烷基。
[0014]
方面8:根据方面7所述的化合物的制备方法,其中r
3
是-conr
3a
r
3b
或-nr
3a
r
3b
,其中r
3a
和r
3b
与它们所附接的氮原子一起形成单环3元至8元环,所述环包含1或2个另外的氮或氧杂原子作为一个或多个环成员,所述环任选地被至少一个取代基r
3e
取代;r
3e
各自独立地选自氧代、-c
1-8
烷基、-or
3f
、-nr
3f
r
3g
或杂环基,所述-c
1-8
烷基或杂环基任选地被至少一个卤素取代,其中r
3f
和r
3g
各自独立地是氢或-c
1-8
烷基。优选地,包含1或2个另外的氮或氧杂原子作为一个或多个环成员的所述单环3元至8元环是氮杂环丁烷基、吡咯烷基、哌啶基或哌嗪基,其中的每一个进一步被杂环基基团(例如,如本文所定义的单环4元至9元杂环基基团)取代。
[0015]
方面9:根据方面7所述的化合物的制备方法,其中r
3
是-conr
3a
r
3b
或-nr
3a
r
3b
,其中r
3a
和r
3b
与它们所附接的氮原子一起形成双环螺7元至12元环,所述环包含1或2个另外的氮或氧杂原子作为一个或多个环成员,所述环任选地被至少一个取代基r
3e
取代;r
3e
各自独立地选自氧代、-c
1-8
烷基、-or
3f
、-nr
3f
r
3g
或杂环基,所述-c
1-8
烷基或杂环基任选地被至少一个卤素取代,其中r
3f
和r
3g
各自独立地是氢或-c
1-8
烷基。优选地,包含1或2个另外的氮或氧杂原子作为一个或多个环成员的所述双环螺7元至12元环是4元/3元、4元/4元、3元/5元、4元/5元、4元/6元、5元/5元或5元/6元单螺杂环基。更优选地,包含1或2个另外的氮或氧杂原子作为一个或多个环成员的所述双环螺7元至12元环是2,3-二氢螺[茚-1,2'-吡咯烷](例如2,3-二氢螺[茚-1,2'-吡咯烷]-1'-基)、1,3-二氢螺[茚-2,2'-吡咯烷](例如1,3-二氢螺[茚-2,2'-吡咯烷]-1'-基)、氮杂螺[2.4]庚烷(例如5-氮杂螺[2.4]庚烷-5-基)、2-氧杂-6-氮杂螺[3.3]庚烷(例如2-氧杂-6-氮杂螺[3.3]庚烷-6-基)、氮杂螺[3.4]辛烷(例如6-氮杂螺[3.4]辛烷-6-基)、2-氧杂-6-氮杂螺[3.4]辛烷(例如2-氧杂-6-氮杂螺[3.4]辛烷-6-基)、氮杂螺[3.4]辛烷(例如6-氮杂螺[3.4]辛烷-6-基)、氮杂螺[3.4]辛烷(例如6-氮杂螺[3.4]辛烷-6-基)、1,7-二氧杂螺[4.5]癸烷、2-氧杂-7-氮杂-螺[4.4]壬烷(例如2-氧杂-7-氮杂-螺[4.4]壬-7-基)、7-氧杂-螺[3.5]壬基或5-氧杂-螺[2.4]庚基。
[0016]
方面10:根据方面1-9中任一项所述的化合物的制备方法,其中r
3
选自
优选地,r
3
选自选自
[0017]
方面11:根据方面1-10中任一项所述的化合物的制备方法,其中n是0或1;r
4
选自卤素、-c
1-8
烷基(优选甲基)、卤素、cn、-or
3a
或-nr
3a
conr
3b
r
3c
;所述-c
1-8
烷基任选地被至少一个取代基r
3d
取代;r
3a
、r
3b
和r
3c
各自独立地是氢、-c
1-8
烷基(优选甲基);r
3d
各自独立地是卤素或-c
1-8
烷基。
[0018]
方面12:根据方面11所述的化合物的制备方法,其中n是0。
[0019]
方面13:根据方面11所述的化合物的制备方法,其中n是1,r
4
是-c
1-8
烷基(例如甲基)。
[0020]
方面14:根据方面1-13中任一项所述的化合物的制备方法,其中l
1
是单键。
[0021]
方面15:根据方面1-14中任一项所述的化合物的制备方法,其中m是0。
[0022]
方面16:根据方面1-15中任一项所述的化合物的制备方法,其中r
51
是氢或-c
1-8
烷基(例如,甲基、乙基、丙基、丁基、戊基或己基)。
[0023]
方面17:根据方面1-16中任一项所述的化合物的制备方法,其中所述部分是其中r
51
、r
52
、m和r
6
是如上所定义的。
[0024]
方面18:根据方面17所述的化合物的制备方法,其中l
3
是-cr
7
r
8-,其中r
7
和r
8
是在式(i)中所定义的。优选地,r
7
和r
8
是氢、卤素或-c
1-8
烷基。
[0025]
方面19:根据方面1-18中任一项所述的化合物的制备方法,其中x
3
、x
4
和l
2
中的一个是-o-、-so
2-、-nr
7-或-s-,并且其余两个各自独立地是单键-co-、-cr
7
r
8-或-cr
7
r
8-cr
9
r
10-,其中r
7
、r
8
、r
9
和r
10
是在式(i)中所定义的,优选地各自是氢或-c
1-8
烷基。优选地,x
3
、x
4
和l
2
中的一个是-o-或-nr
7-,并且其余两个各自独立地是-cr
7
r
8-,其中r
7
和r
8
各自是氢或-c
1-8
烷基,优选地两者都是氢。
[0026]
方面20:根据方面17所述的化合物的制备方法,其中选自以下:选自以下:其中r
6
、r
51
和r
7
是在以上式(i)中所定义的;优选地,r
6
、r
51
和r
7
各自是氢或-c
1-8
烷基;更优选地,r
6
和r
51
是-c
1-8
烷基(例如甲基、乙基、丙基、丁基、戊基或己基)并且r
7
是氢。
[0027]
方面21:化合物的制备方法,所述化合物选自:
具体实施方式
通用合成
[0096]
本文披露的化合物(包括其盐)可以使用已知的有机合成技术制备并且可以根据众多可能的合成途径中的任何途径来合成。
[0097]
可以在有机合成领域的技术人员可以容易地选择的合适的溶剂中进行用于制备本文披露的化合物的反应。合适的溶剂可以在进行反应的温度(例如,范围从溶剂的沸腾温度的温度)下基本上不与起始材料、中间体或产物反应。给定反应可以在一种溶剂或多于一种溶剂的混合物中进行。
[0098]
适当的保护性基团的选择可以由本领域技术人员容易地确定。可以根据本领域中已知的任何适合的方法(例如,nmr、uv、hplc、lc-ms和tlc)监测反应。化合物可以通过多种方法(包括hplc和正相硅胶色谱法)纯化。
[0099]
将手性分析型hplc用于不同手性实例的保留时间分析,根据所用的柱、流动相和溶剂比率,将条件分为以下方法。方案i
[0100]
例如,式(i)化合物可以如方案i所示形成。可以使用过渡金属催化的反应,将化合物(i)与硼酸或硼酸酯进行反应以给出化合物(ii);可以使用过渡金属催化的反应,将化合物(ii)与硼酸或硼酸酯进行反应以给出化合物(iii);可以将化合物(iii)原位脱保护或逐步脱保护以给出化合物(iv)[即,式(i)]。方案ii
[0101]
例如,式(i)化合物可以如方案ii所示形成。可以使用过渡金属催化的反应,将化合物(i)与硼酸或硼酸酯进行反应以给出化合物(ii);可以将化合物(ii)硼基化以给出化合物(iii);可以使用过渡金属催化的反应,将化合物(iii)与硼酸或硼酸酯进行反应以给出化合物(iv);可以将化合物(iv)原位脱保护或逐步脱保护以给出化合物(v)[即,式(i)]。简写ts
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
对甲苯磺酰基(tosyl)thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃lda
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙基酰胺锂dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺et
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙基ac
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酰基pe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚nmr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
核磁共振lc-ms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱-质谱tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸me
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷dppf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,1'-双(二苯基膦基)二茂铁xphos
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-二环己基膦基-2
’
,4
’
,6
’-
三异丙基联苯tlc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
薄层色谱法hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐dipea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二异丙基乙胺tbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基二甲基甲硅烷基uv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
紫外线tbaf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四-正丁基氟化铵hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相色谱法dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲亚砜dea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二乙胺mtbe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基叔丁醚boc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基氧基羰基
[0102]
实例14-(5-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n,n-二甲基苯甲酰胺
[0103]
1
h nmr(400 mhz,cdcl
3
)δ9.97(s,1h),8.54(s,1h),8.32(s,1h),7.77-7.64(m,2h),7.62-7.48(m,3h),7.26(s,1h),7.19(s,1h),3.54-3.27(m,2h),3.26-2.77(m,14h),2.78-2.47(m,4h),2.36(s,3h)。lc-ms(m+h)
+
=479.9。
[0125]
实例2a/2b
[0126]
4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((s)-2-羟基丙基)-n-甲基苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((s)-2-羟基丙基)-n-甲基苯甲酰胺
[0127]
步骤1:4-溴-n-[(2s)-2-羟基丙基]苯甲酰胺
[0128]
向4-溴苯甲酸(11.80g,55.8mmol)在dmf(120ml)中的溶液中添加dipea(10.50g,104mmol)、hatu(22.40g,58.9mmol)和(2s)-1-氨基丙-2-醇(4.00g,53.3mmol)。将所得混合物在室温搅拌6h。通过添加水将反应淬灭。将所得混合物用etoac(600ml x 3)提取。将合并的有机层用盐水(100ml)洗涤,经无水na
2
so
4
干燥。过滤后,将滤液在减压下浓缩。将残余物通过硅胶柱色谱法(用pe/etoac(30:70)洗脱)纯化以给出标题化合物(12.0g,88%)。lc-ms(m+h)
+
=258.1
[0129]
步骤2:4-溴-n-[(2s)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]苯甲酰胺
[0130]
在0℃,向4-溴-n-[(2s)-2-羟基丙基]苯甲酰胺(12.0g,46.7mmol)和tbscl(15.0g,59.0mmol)在dcm(150ml)中的搅拌混合物中滴加et
3
n(15.0g,149mmol)。将所得混合物在室温搅拌15h。通过添加水将反应淬灭。将所得混合物用dcm(500ml x 3)提取。将合并的有机层用盐水(100ml)洗涤,经无水na
2
so
4
干燥。过滤后,将滤液在减压下浓缩以提供标题化合物(19.0g,粗制)。将粗产物不经进一步纯化而直接用于步骤3。lc-ms(m+h)
+
=372.2。
[0131]
步骤3:4-溴-n-[(2s)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]-n-甲基苯甲酰胺
[0132]
在0℃在氮气氛下,向4-溴-n-[(2s)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]苯甲酰胺(19.0g,来自步骤2的粗制品)在dmf(120ml)中的搅拌溶液中分批添加nah(5.10g,在矿物油中60%,127mmol)。将所得混合物搅拌30min,然后在0℃滴加ch
3
i(9.50g,63.6mmol)。将所得混合物在室温在氮气氛下搅拌3h。将反应在0℃用冰水淬灭。将所得混合物用etoac(700ml x 3)提取。将合并的有机层用盐水(150ml)洗涤,经无水na
2
so
4
干燥。过滤后,将滤液在减压下浓缩以给出标题化合物(18.0g,粗制)。将粗产物不经进一步纯化而直接用于步骤4。lc-ms(m+h)
+
=386.3。
[0133]
步骤4:4-溴-n-[(2s)-2-羟基丙基]-n-甲基苯甲酰胺
[0134]
向4-溴-n-[(2s)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]-n-甲基苯甲酰胺(18.0g,来自步骤3的粗制品)在thf(200ml)中的溶液中添加tbaf(在thf中1.0m,70ml,70mmol)。将所得混合物在室温搅拌15h。将反应混合物在真空下浓缩,并将残余物通过硅胶柱色谱法(用etoac洗脱)纯化以给出标题化合物(8.3g,65%,经3个步骤)。lc-ms(m+h)
+
=272.0。
[0135]
步骤5:n-[(2s)-2-羟基丙基]-n-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺
[0136]
向4-溴-n-[(2s)-2-羟基丙基]-n-甲基苯甲酰胺(8.3g,30.5mmol)和4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(12.0g,44.9mmol)在二噁烷(200ml)
中的溶液中添加pd(dppf)cl
2
dcm(2.60g,3.02mmol)和koac(9.30g,90.0mmol)。将反应混合物在100℃在氮气氛下搅拌3h。将混合物冷却至室温、然后过滤。将滤饼用二噁烷(10ml x 3)漂洗。将滤液在减压下浓缩。将残余物通过硅胶柱色谱法(用etoac洗脱)纯化以给出标题化合物(7.8g,80%)。lc-ms(m+h)
+
=320.2。
[0137]
步骤6:5-溴-3-碘-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶
[0138]
在0℃,向5-溴-3-碘-1h-吡咯并[2,3-b]吡啶(43.3g,134.1mmol)在dmf(300ml)中的溶液中分批添加nah(60%,7.0g,175mmol)。将混合物在0℃下搅拌30分钟。在0℃,向混合物中滴加苯磺酰氯(35.5g,201mmol)并将混合物在室温搅拌3h。将反应用水(300ml)淬灭。通过过滤收集沉淀物,用水(50ml x 5)洗涤并真空干燥,以给出标题化合物(65.0g,100%)。lc-ms(m+h)
+
=462.6,464.5。
[0139]
步骤7:(s)-4-(5-溴-1h-吡咯并[2,3-b]吡啶-3-基)-n-(2-羟基丙基)-n-甲基苯甲酰胺
[0140]
向5-溴-3-碘-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶(1.0g,2.16mmol)、n-[(2s)-2-羟基丙基]-n-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺(689mg,2.16mmol)和k
2
co
3
(596mg,4.32mmol)在1,4-二噁烷(20ml)和水(20ml)中的混合物中添加pd(dppf)cl
2
dcm(176mg,0.216mmol)。将反应混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将粗制品通过硅胶色谱法(dcm:meoh=30:1至20:1)纯化以给出标题化合物(330mg,45%)。lc-ms(m+h)
+
=387.8,389.8。
[0141]
步骤8:3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉
[0142]
向8-溴-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(2.0g,6.78mmol)在1,4-二噁烷(100ml)中的溶液中添加4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(2.58g,10.2mmol)和pd(dppf)cl
2
.dcm(277mg,0.339mmol)和koac(1.33g,13.56mmol)。将溶液在90℃在n
2
下搅拌过夜。添加水(100ml),并将混合物用etoac(100ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出标题化合物(1.93g,83%)。lc-ms(m+h)
+
=343.1。
[0143]
步骤9:4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((s)-2-羟基丙基)-n-甲基苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((s)-2-羟基丙基)-n-甲基苯甲酰胺
[0144]
向(s)-4-(5-溴-1h-吡咯并[2,3-b]吡啶-3-基)-n-(2-羟基丙基)-n-甲基苯甲酰胺(330mg,0.853mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(292mg,0.853mmol)在1,4-二噁烷(10ml)和水(10ml)中的溶液中添加xphos pd g2(67mg,0.085mmol)和k
3
po
4
(362mg,1.71mmol)。将反应混合物在80℃在n
2
下搅拌过夜。添加水(10ml),并将混合物用etoac(10ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将粗制品通过硅胶色谱法(dcm:meoh=10:1)纯化以给出异构体混合物(160mg),然后将其通过手性hplc分离以给出实例2a/2b。
[0145]
实例2a:(55mg,12%)
1
h nmr(400mhz,dmso-d6)δ12.01(s,1h),8.49(d,j=1.7hz,1h),8.37(d,j=1.7hz,1h),7.97(d,j=2.6hz,1h),7.87-7.78(m,2h),7.52-7.46(m,2h),7.34(s,1h),7.27(s,1h),4.92-4.76(m,1h),4.05-3.80(m,1h),3.55-3.42(m,0.5h),3.37-3.27(m,1h),3.22-3.12(m,0.5h),3.09-2.81(m,8h),2.65-2.56(m,2h),2.48-2.42(m,1h),2.34-2.24(m,4h),2.24-2.12(m,4h),1.65-1.52(m,1h),1.17-0.88(m,3h)。lc-ms(m+h)
+
=524.0。在手性hplc中的tr:2.83min。
[0146]
实例2b:(50mg,11%)
1
h nmr(400mhz,dmso-d6)δ12.02(s,1h),8.49(s,1h),8.37
(s,1h),7.98(d,j=2.4hz,1h),7.88-7.77(m,2h),7.53-7.45(m,2h),7.34(s,1h),7.27(s,1h),4.93-4.77(m,1h),4.08-3.81(d,j=39.0hz,1h),3.55-3.43(m,0.5h),3.37-3.27(m,1h),3.22-3.12(m,1h),3.11-2.81(m,8h),2.66-2.55(m,2h),2.48-2.41(m,1h),2.35-2.25(m,4h),2.23-2.12(m,4h),1.65-1.50(d,j=12.9hz,1h),1.17-0.88(m,3h)。lc-ms(m+h)
+
=524.0。在手性hplc中的tr:3.41min。
[0147]
制备型hplc条件
[0148][0149]
手性分析型hplc条件
[0150]
实例3a/3b
[0151]
4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((r)-2-羟基丙基)-n-甲基苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((r)-2-羟基丙基)-n-甲基苯甲酰胺
[0152]
步骤1:4-溴-n-[(2r)-2-羟基丙基]苯甲酰胺
[0153]
以与实例2a/2b、步骤1类似的方式,从4-溴苯甲酸和(2r)-1-氨基丙-2-醇制备标题化合物(4.63g,67%)。lc-ms(m+h)
+
=258.1。
[0154]
步骤2:4-溴-n-[(2r)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]苯甲酰胺
[0155]
以与实例2a/2b、步骤2中类似的方式,从4-溴-n-[(2r)-2-羟基丙基]苯甲酰胺和tbscl制备标题化合物(12.1g,60%)。lc-ms(m+h)
+
=372.3。
[0156]
步骤3:4-溴-n-[(2r)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]-n-甲基苯甲酰胺
[0157]
以与实例2a/2b、步骤3中类似的方式,从4-溴-n-[(2r)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]苯甲酰胺和mei制备标题化合物(9.79g,53%)。lc-ms(m+h)
+
=386.1。
[0158]
步骤4:4-溴-n-[(2r)-2-羟基丙基]-n-甲基苯甲酰胺
[0159]
以与实例2a/2b、步骤4中类似的方式,从4-溴-n-[(2r)-2-[(叔丁基二甲基甲硅烷基)氧基]丙基]-n-甲基苯甲酰胺制备标题化合物(5.48g,70%)。lc-ms(m+h)
+
=272.0。
[0160]
步骤5:(r)-n-(2-羟基丙基)-n-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺
[0161]
以与实例2a/2b、步骤5中类似的方式,从4-溴-n-[(2r)-2-羟基丙基]-n-甲基苯甲酰胺制备标题化合物(3.75g,47%)。lc-ms(m+h)
+
=320.1。
[0162]
步骤6:(r)-4-(5-溴-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-(2-羟基丙基)-n-甲基苯甲酰胺
[0163]
向5-溴-3-碘-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶(1.0g,2.16mmol)和(r)-n-(2-羟基丙基)-n-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺(689mg,2.16mmol)和k
2
co
3
(596mg,4.32mmol)在1,4-二噁烷(20ml)和水(20ml)中的混合物中添加xphos pd g2(165mg,0.216mmol)。将反应混合物在50℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=30:1至20:1)纯化以给出标题化合物(582mg,51%)。lc-ms(m+h)
+
=527.7,529.7
[0164]
步骤7:4-(5-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((r)-2-羟基丙基)-n-甲基苯甲酰胺
[0165]
向(r)-4-(5-溴-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-(2-羟基丙基)-n-甲基苯甲酰胺(582mg,1.10mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(378mg,1.10mmol)在1,4-二噁烷(20ml)和水(20ml)中的溶液中添加xphos pd g2(87mg,0.11mmol)和k
3
po
4
(468mg,2.21mmol)。将反应混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出标题化合物(437mg,60%)。lc-ms(m+h)
+
=663.9
[0166]
步骤8:4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((r)-2-羟基丙基)-n-甲基苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((r)-2-羟基丙基)-n-甲基苯甲酰胺
[0167]
向4-(5-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-((r)-2-羟基丙基)-n-甲基苯甲酰胺(437mg,0.69mmol)在meoh(10ml)中的溶液中添加k
2
co
3
(286mg,2.07mmol)。将所得混合物在室温搅拌3h。添加水(10ml),并将混合物用etoac(10ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=15:1)纯化以给出异构体混合物(230mg),然后将其通过手性hplc分离以给出实例3a/3b。
[0168]
实例3a:(79mg,22%)
1
h nmr(400mhz,dmso-d6)δ12.02(s,1h),8.50(d,j=1.7hz,1h),8.37(d,j=1.8hz,1h),7.98(d,j=2.6hz,1h),7.87-7.78(m,2h),7.52-7.46(m,2h),7.34(s,1h),7.27(s,1h),4.91-4.78(m,1h),4.07-3.80(m,1h),3.53-3.44(m,0.5h),3.36-3.28(m,1h),3.23-3.11(m,0.5h),3.08-2.81(m,8h),2.65-2.57(m,2h),2.49-2.40(m,1h),
2.34-2.25(m,4h),2.24-2.13(m,4h),1.65-1.52(m,1h),1.17-0.88(m,3h)。lc-ms(m+h)
+
=524.0。在手性hplc中的tr:4.50min。
[0169]
实例3b:(88mg,24%)
1
h nmr(400mhz,dmso-d6)δ12.02(s,1h),8.49(s,1h),8.37(d,j=1.6hz,1h),7.98(d,j=2.6hz,1h),7.87-7.78(m,2h),7.52-7.46(m,2h),7.34(s,1h),7.26(s,1h),4.98-4.72(m,1h),4.04-3.79(m,1h),3.54-3.43(m,0.5h),3.35-3.25(m,1h),3.24-3.11(m,0.5h),3.07-2.79(m,8h),2.66-2.54(m,2h),2.49-2.41(m,1h),2.34-2.24(m,4h),2.23-2.09(m,4h),1.66-1.51(m,1h),1.19-0.81(m,3h)。lc-ms(m+h)
+
=524.0。在手性hplc中的tr:5.65min。
[0170]
制备型hplc条件
[0171][0172]
手性分析型hplc条件
[0173]
实例4a/4b
[0174]
4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺
[0175]
步骤1:(s)-4-溴-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0176]
向4-溴苯甲酸(2.0g,9.9mmol)和(s)-(四氢呋喃-3-基)甲胺(1.0g,9.9mmol)在dmf(20ml)中的溶液中添加hatu(5.64g,14.9mmol)和dipea(2.55g,19.8mmol)。将所得溶液在室温搅拌过夜。添加水(20ml),并将溶液用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法纯化,用ch
2
cl
2
/meoh(100:1)洗脱以给出标题化合物(4.6g,含有dmf)。将材料不经进一步纯化而用于步骤2。lc-ms(m+h)
+
=283.8,285.8。
[0177]
步骤2:(s)-4-溴-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0178]
在0℃在n
2
下,将nah(1.3g,32.4mmol,60%)添加到(s)-4-溴-n-((四氢呋喃-3-基)甲基)苯甲酰胺(4.6g,来自步骤1)在dmf(30ml)中的溶液中。将所得溶液在0℃搅拌1h,并滴加mei(3.45g,24.3mmol)。将溶液温热至室温并搅拌1h。添加水(30ml),并将溶液用etoac(30ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(用dcm/meoh(100:1)洗脱)纯化以给出标题化合物(2.42g,82%,对于2个步骤)。lc-ms(m+h)
+
=297.8,299.8。
[0179]
步骤3:(s)-n-甲基-n-((四氢呋喃-3-基)甲基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺
[0180]
在n
2
下,向(s)-4-溴-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺(2.42g,8.12mmol)在1,4-二噁烷(50ml)中的溶液中添加4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(3.09g,12.2mmol)、pd(dppf)cl
2
dcm(332mg,0.406mmol)和koac(1.59g,16.2mmol)。将所得溶液在90℃搅拌过夜。添加水(50ml),并将混合物用etoac(50ml x3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱
基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺
[0186]
向(s)-4-(5-溴-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺(403.5mg,0.947mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(333mg,0.947mmol)在1,4-二噁烷(20ml)和水(10ml)中的溶液中添加xphos pd g2(77mg,0.097mmol)和k
3
po
4
(413mg,1.948mmol)。将所得混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机物用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将粗制品通过硅胶色谱法(dcm:meoh=10:1)纯化以给出异构体混合物(310mg),将其通过手性hplc分离以给出实例4a/4b。
[0187]
实例4a:(127mg,24%)
1
h nmr(400mhz,dmso-d6)δ12.03(s,1h),8.50(d,j=2.0hz,1h),8.37(d,j=1.9hz,1h),7.99(d,j=2.5hz,1h),7.89-7.81(m,2h),7.53-7.41(m,2h),7.34(s,1h),7.27(s,1h),3.86-3.38(m,6h),3.05-2.98(m,4h),2.96-2.84(m,4h),2.74-2.53(m,4h),2.49-2.42(m,1h),2.36-2.26(m,4h),2.25-2.13(m,4h),2.08-1.53(m,2h)。lc-ms(m+h)
+
=549.9。在手性hplc中的tr:3.38min。
[0188]
实例4b:(101mg,19%)
1
h nmr(400mhz,dmso-d6)δ12.03(s,1h),8.50(d,j=1.8hz,1h),8.37(d,j=1.9hz,1h),7.99(d,j=2.4hz,1h),7.89-7.81(m,2h),7.53-7.41(m,2h),7.34(s,1h),7.26(s,1h),3.86-3.36(m,6h),3.05-2.95(m,4h),2.95-2.81(m,4h),2.70-2.54(m,3h),2.48-2.42(m,1h),2.33-2.24(m,4h),2.24-2.12(m,4h),2.08-1.51(m,3h)。lc-ms(m+h)
+
=549.9。在手性hplc中的tr:4.07min。
[0189]
制备型hplc条件
[0190]
手性分析型hplc条件
[0191]
实例5a/5b
[0192]
4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((r)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((r)-四氢呋喃-3-基)甲基)苯甲酰胺
[0193]
步骤1:(r)-4-溴-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0194]
向4-溴苯甲酸(2.0g,9.9mmol)和(r)-(四氢呋喃-3-基)甲胺(1.0g,9.9mmol)在dmf(20ml)中的溶液中添加hatu(5.64g,14.85mmol)和dipea(2.55g,19.8mmol)。将所得溶液在室温搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=100:1)纯化以给出标题化合物(7.18g,含有dmf)。将此材料不经进一步纯化而用于步骤2。lc-ms(m+h)
+
=283.8,285.8。
[0195]
步骤2:(r)-4-溴-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0196]
在n
2
下,将nah(2.02g,50.4mmol,60%)添加到(r)-4-溴-n-((四氢呋喃-3-基)甲基)苯甲酰胺(7.18g,含有dmf,9.9mmol)在dmf(40ml)中的0℃溶液中。将所得混合物在0℃搅拌1h,然后滴加mei(5.37g,37.8mmol)。将反应混合物温热至室温并搅拌1h。添加水(40ml),并将混合物用etoac(40ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=100:1)纯化以给出标题化合物(3.5g,含有dmf)。将此材料不经进一步纯化而用于步骤3。lc-ms(m+h)
+
=297.8,299.8。
[0197]
步骤3:(r)-n-甲基-n-((四氢呋喃-3-基)甲基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺
[0198]
向(r)-4-溴-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺(3.5g,含有dmf,9.9mmol)在1,4-二噁烷(50ml)中的溶液中添加4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(3.09g,12.18mmol)、pd(dppf)cl
2
dcm(332mg,0.406mmol)和koac(1.59g,16.24mmol)。将所得混合物在90℃在n
2
下搅拌过夜。添加水(50ml),并将混合物用etoac(50ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(etoac:pe=1:3)纯化以给出标题化合物(1.76g,52%,经3个步骤)。
1
h nmr(400mhz,cdcl
3
)δ7.83(d,j=7.8hz,2h),7.36(d,j=7.1hz,2h),4.03-3.19(m,6h),3.16-2.90(m,3h),2.79-2.45(m,1h),2.15-1.68(m,2h),1.35(s,12h)。lc-ms(m+h)
+
=346.0。
[0199]
步骤4:(r)-4-(5-溴-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0200]
向5-溴-3-碘-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶(2.0g,4.3mmol)、(r)-n-甲基-n-((四氢呋喃-3-基)甲基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺(1.49g,4.3mmol)和k
2
co
3
(1.19g,8.6mmol)在1,4-二噁烷(30ml)和水(20ml)中的混合物中添加pd(dppf)cl
2 dcm(351mg,0.43mmol)。将所得混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(30ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(etoac:pe=1:1)纯化以给出标题化合物(1.8g,75%)。lc-ms(m+h)
+
=553.7,555.7。
[0201]
步骤5:(r)-4-(5-溴-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0202]
向(r)-4-(5-溴-1-(苯磺酰基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺(1.8g,3.25mmol)在meoh(50ml)中的溶液中添加k
2
co
3
(1.35g,9.74mmol)。将所得混合物在室温搅拌过夜。添加水(50ml),并将混合物用etoac(50ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(etoac:pe=1:1)纯化以给出标题化合物(908mg,67%)。lc-ms(m+h)
+
=413.8,415.8。
[0203]
步骤6:4-(5-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((r)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(5-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-(((r)-四氢呋喃-3-基)甲基)苯甲酰胺
[0204]
向(r)-4-(5-溴-1h-吡咯并[2,3-b]吡啶-3-基)-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺(404mg,0.947mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(333mg,0.947mmol)在1,4-二噁烷(20ml)和水(10ml)中的溶液中添加xphos pd g2(77mg,0.097mmol)和k
3
po
4
(413mg,1.95mmol)。将所得混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=10:1)纯化以给出异构体混合物(240mg),将其通过手性hplc分离以给出实例5a/5b。
[0205]
实例5a:(101mg,19%)
1
h nmr(400mhz,dmso-d6)δ12.03(s,1h),8.50(d,j=1.9hz,1h),8.37(d,j=1.7hz,1h),7.99(d,j=2.5hz,1h),7.87-7.81(m,2h),7.51-7.41(m,2h),7.34(s,1h),7.27(s,1h),3.88-3.35(m,6h),3.05-2.96(m,4h),2.95-2.82(m,4h),2.70-2.53(m,3h),2.48-2.42(m,1h),2.36-2.24(m,4h),2.24-2.12(m,4h),2.08-1.52(m,3h)。lc-ms(m+h)
+
=549.9。在手性hplc中的tr:2.93min。
[0206]
实例5b:(82mg,16%)
1
h nmr(400mhz,dmso-d6)δ12.03(s,1h),8.50(d,j=1.9hz,1h),8.37(d,j=1.7hz,1h),7.99(d,j=2.5hz,1h),7.87-7.81(m,2h),7.51-7.41(m,2h),7.34(s,1h),7.27(s,1h),3.89-3.34(m,6h),3.05-2.96(m,4h),2.95-2.79m,4h),2.71-2.53(m,3h),2.46-2.39(m,1h),2.35-2.24(m,4h),2.24-2.12(m,4h),2.09-1.52(m,3h)。lc-ms(m+h)
+
=549.9。在手性hplc中的tr:2.80min。
[0207]
制备型hplc条件制备型hplc条件
[0208]
手性分析型hplc条件
[0209]
实例6a/6b
[0210]
(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺
[0211]
步骤1:4-溴-n,n,2-三甲基苯甲酰胺
[0212]
将4-溴-2-甲基苯甲酸(25.0g,116mmol)在socl
2
(200ml)中的混合物在60℃搅拌3h。将溶剂真空除去。将残余物重新溶解于无水dcm(200ml)。在0℃添加盐酸二甲胺(14.0g,174.4mmol)和tea(80ml,581mmol)。将混合物在室温搅拌2h。添加水(200ml),并将混合物用dcm(200ml x 3)提取。将合并的有机层用盐水(150ml)洗涤,经na
2
so
4
干燥,在减压下浓缩以给出标题化合物(28.0g,99%)。lc-ms(m+h)
+
=242.0,244.0。
[0213]
步骤2:n,n,2-三甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺
[0214]
在氮气下,将4-溴-n,n,2-三甲基苯甲酰胺(28.0g,115mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)(44.0g,174mmol)、pd(dppf)cl
2
(5.1g,
6.94mmol)和acok(22.7g,231mmol)添加至二噁烷(400ml)中。将反应混合物加热至回流过夜、然后冷却至室温。添加etoac(400ml),并将混合物用盐水(300ml x 2)洗涤。将水层用etoac(400ml)提取。将合并的有机层经na
2
so
4
干燥,然后在减压下浓缩。将残余物通过硅胶柱色谱法纯化,用etoac/pe(1:5至2:1)洗脱,以给出标题化合物(26.0g,73%)。lc-ms(m+h)
+
=290.1。
[0215]
步骤3:2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪
[0216]
在0℃,向2-溴-7-碘-5h-吡咯并[2,3-b]吡嗪(162g,500mmol)在无水dmf(1500ml)中的溶液中分批添加氢化钠(30.0g,750mmol)。在0℃将所得混合物搅拌15min,并且然后分批添加tscl(124g,650mmol)。在搅拌的同时,将混合物温热至室温。3h后,将反应混合物倒入冰水(2l)中并且通过过滤收集沉淀物。将固体用水(200ml x 5)漂洗然后真空干燥,以给出标题化合物(239g,99%)。lcms(m+h)
+
=479.9。
[0217]
步骤4:4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺
[0218]
在氮气氛下,向2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪(16.5g,34.6mmol)和n,n,2-三甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺(10.0g,34.5mmol)在二噁烷(150ml)和水(50ml)中的溶液中添加k
2
co
3
(9.55g,69.2mmol)和pd(dppf)cl
2
(1.54g,2.07mmol)。在50℃搅拌5h后,将反应混合物冷却至室温并在减压下浓缩。将残余物通过硅胶柱色谱法纯化,用etoac/pe(1:2至2:1)洗脱,以给出标题化合物(11.0g,62%)。
1
h nmr(400mhz,dmso-d6)δ8.88(s,1h),8.68(s,1h),8.09-8.01(m,4h),7.49-7.44(m,2h),7.29(d,j=7.8hz,1h),3.02(s,3h),2.79(s,3h),2.36(s,3h),2.27(s,3h)。lcms(m+h)
+
=513.0。
[0219]
步骤5:4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺
[0220]
向4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺(375mg,0.731mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(250mg,0.731mmol)在1,4-二噁烷(20ml)和水(10ml)中的溶液中添加xphos pd g2(57mg,0.073mmol)和k
3
po
4
(310mg,1.46mmol)。将反应混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出标题化合物(400mg,84%)。lc-ms(m+h)
+
=649.1。
[0221]
步骤6:(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺
[0222]
向4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n,2-三甲基苯甲酰胺(400mg,0.617mmol)在meoh(20ml)中的溶液中添加k
2
co
3
(340mg,2.48mmol)。将所得混合物在室温搅拌2h。添加水(50ml),并将混合物用etoac(50ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=30:1)纯化以给出异构体混合物(162mg),将其通过手性hplc分离以给出实例6a/6b。
[0223]
实例6a:(69mg,23%)
1
h nmr(400mhz,dmso-d6)δ12.28(s,1h),8.82(s,1h),8.43(d,j=2.7hz,1h),8.26(s,1h),8.18(d,j=8.0hz,1h),7.80(s,1h),7.73(s,1h),7.23(d,j=7.9hz,1h),3.09-2.97(m,5h),2.96-2.86(m,3h),2.83(s,3h),2.63-2.53(m,3h),2.38-2.31(m,4h),2.29(s,3h),2.21(s,3h),2.19-2.08(m,1h),1.69-1.59(m,1h)。
[0224]
lc-ms(m+h)
+
=495.0。在手性hplc中的tr:4.97min。
[0225]
实例6b:(69mg,23%)
1
h nmr(400mhz,dmso-d6)δ12.28(s,1h),8.81(s,1h),8.43(d,j=2.7hz,1h),8.26(s,1h),8.18(d,j=7.8hz,1h),7.80(s,1h),7.73(s,1h),7.23(d,j
=8.0hz,1h),3.09-2.98(m,5h),2.96-2.87(m,3h),2.83(s,3h),2.63-2.51(m,3h),2.38-2.31(m,4h),2.29(s,3h),2.21(s,3h),2.19-2.10(m,1h),1.69-1.59(m,1h)。
[0226]
lc-ms(m+h)
+
=495.0。在手性hplc中的tr:6.56min。
[0227]
制备型hplc条件
[0228]
手性分析型hplc条件
[0229]
实例7a/7b
[0230]
(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺
[0231]
步骤1:4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺
[0232]
向2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪(240mg,0.50mmol)和[4-(二甲基氨基甲酰基)苯基]硼酸(106mg,0.52mmol)在1,4-二噁烷(6ml)和水(1ml)中的溶液中添加k
2
co
3
(207mg,1.42mmol)和pd(dppf)cl
2
.ch
2
cl
2
(41mg,0.048mmol)。在70℃在氮气氛下搅拌3h后,将反应混合物在减压下浓缩。将残余物通过硅胶柱色谱法(用chcl
3
/meoh(9:1)洗脱)纯化,以给出标题化合物(200mg,75%)。lcms(m+h)
+
=499.2。
[0233]
步骤2:4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺
[0234]
向4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺(384mg,0.769mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(263mg,0.769mmol)在1,4-二噁烷(20ml)和水(10ml)中的溶液中添加xphos pd g2(61mg,0.077mmol)和k
3
po
4
(326mg,1.54 mmol)。将所得混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=30:1)纯化以给出标题化合物(370mg,76%)。lc-ms(m+h)
+
=635.1。
[0235]
步骤3:(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺
[0236]
向4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,n-二甲基苯甲酰胺(370mg,0.584mmol)在meoh(20ml)中的溶液中添加k
2
co
3
(242mg,1.75mmol)。将反应混合物在室温搅拌2h。添加水(50ml),并将混合物用etoac(50ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=30:1)纯化以给出异构体混合物(160mg),将其通过手性hplc分离以给出实例7a/7b。
[0237]
实例7a:(72mg,26%)
1
h nmr(400mhz,dmso-d6)δ10.06(s,1h),8.76(s,1h),8.46(s,1h),8.39-8.33(m,2h),7.77(s,1h),7.70(s,1h),7.52-7.45(m,2h),3.09-2.97(m,8h),2.96-2.86(m,3h),2.64-2.51(m,3h),2.39-2.28(m,4h),2.21(s,3h),2.19-2.08(m,1h),1.68-1.59(m,1h)。lc-ms(m+h)
+
=480.9。在手性hplc中的tr:4.47min。
[0238]
实例7b:(73mg,26%)
1
h nmr(400mhz,dmso-d6)δ。9.52(s,1h),8.75(s,1h),8.46(s,1h),8.40-8.33(m,2h),7.77(s,1h),7.70(s,1h),7.51-7.45(m,2h),3.09-2.96(m,8h),2.95-2.86(m,3h),2.63-2.51(m,3h),2.39-2.29(m,4h),2.21(s,3h),2.18-2.08(m,1h),1.69-1.57(m,1h)。lc-ms(m+h)
+
=481.0。在手性hplc中的tr:5.87min。
[0239]
制备型hplc条件
[0240]
手性分析型hplc条件
[0241]
实例8a/8b
[0242]
(r)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮和(s)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0243]
步骤1:6-(4-溴-2-甲基苯甲酰基)-2-氧杂-6-氮杂螺[3.3]庚烷
[0244]
以与实例2a/2b、步骤1中类似的方式,从4-溴-2-甲基苯甲酸和2-氧杂-6-氮杂螺[3.3]庚烷制备标题化合物(250mg,78%)。lcms(m+h)
+
=296.0。
[0245]
步骤2:(2-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0246]
以与实例2a/2b、步骤5中类似的方式,从6-(4-溴-2-甲基苯甲酰基)-2-氧杂-6-氮杂螺[3.3]庚烷和4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)制备标题化合物(200mg,67%)。lcms(m+h)
+
=344.2。
[0247]
步骤3:(4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0248]
以与实例6a/6b、步骤4中类似的方式,从(2-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮和2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪制备标题化合物(185mg,67%)。lc-ms(m+h)
+
=567.1。
[0249]
步骤4:(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0250]
向(4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮(340mg,0.60mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(205mg,0.60mmol)在1,4-二噁烷(20ml)和水(10ml)中的溶液中添加xphos pd g2(47mg,0.06mmol)和k
3
po
4
(254mg,1.2mmol)。将反应混合物在80℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将粗制品通过硅胶色谱法(dcm:meoh=20:1)纯化以给出标题化合物(300mg,71%)。lc-ms(m+h)
+
=703.0。
[0251]
步骤5:(r)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮和(s)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0252]
向(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-2-甲基苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮(300mg,0.427mmol)在meoh(20ml)中的溶液中添加k
2
co
3
(177mg,1.28mmol)。将反应混合物在室温搅拌2h。添加水(30ml),并将混合物用etoac(30ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出异构体混合物(108mg),将其通过手性hplc分离以给出实例8a/8b。
[0253]
实例8a:(39mg,17%)
1
h nmr(400mhz,dmso-d6)δ12.32(s,1h),8.82(s,1h),8.45(s,1h),8.27(s,1h),8.17(d,j=8.1hz,1h),7.80(s,1h),7.74(s,1h),7.36(d,j=7.9hz,1h),4.76-4.58(m,4h),4.26-4.12(m,4h),3.10-2.98(m,2h),2.97-2.84(m,3h),2.63-2.51(m,3h),2.39(s,3h),2.37-2.29(m,4h),2.21(s,3h),2.19-2.11(m,1h),1.70-1.59(m,1h)。lc-ms(m+h)
+
=548.9。在手性hplc中的tr:3.74min。
[0254]
实例8b:(46mg,20%)
1
h nmr(400mhz,dmso-d6)δ12.32(s,1h),8.82(s,1h),8.45(s,1h),8.27(s,1h),8.17(d,j=7.8hz,1h),7.80(s,1h),7.73(s,1h),7.36(d,j=8.0hz,1h),4.75-4.61(m,4h),4.30-4.08(m,4h),3.11-2.98(m,2h),2.97-2.84(m,3h),2.64-2.52(m,3h),2.39(s,3h),2.37-2.29(m,4h),2.21(s,3h),2.19-2.08(m,1h),1.70-1.59(m,1h)。lc-ms(m+h)
+
=549.0。在手性hplc中的tr:5.23min。
[0255]
制备型hplc条件
[0256]
手性分析型hplc条件
[0257]
实例9a/9b
[0258]
(r)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮和(s)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0259]
步骤1:(4-(2-氧杂-6-氮杂螺[3.3]庚烷-6-羰基)苯基)硼酸
[0260]
在0℃,向4-氨基苯甲酸(3.32g,19.0mmol)在dmf(20ml)中的溶液中添加hatu(10.8g,28.5mmol)、dipea(7.37g,57.0mmol)和2-氧杂-6-氮杂螺[3.3]庚烷(1.98g,19.0mmol)。将所得混合物加温至室温。16h后,将混合物在真空下浓缩,然后用水(50ml)稀释。将沉淀物通过过滤收集并用水(30ml x 2)洗涤固体以给出标题化合物(4.7g,97%)。lc-ms(m+h)
+
=248.1。
[0261]
步骤2:(4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0262]
以与实例6a/6b、步骤4中类似的方式,从2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪和(4-(2-氧杂-6-氮杂螺[3.3]庚烷-6-羰基)苯基)硼酸制备标题化合物(350mg,76%)。lcms(m+h)
+
=553.1。
[0263]
步骤3:(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0264]
向(4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮(320mg,0.578mmol)、3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(198mg,0.578mmol)在1,4-二噁烷(20ml)和水(10ml)中的溶液中添加xphos pd g2(47mg,0.06mmol)和k
3
po
4
(254mg,1.2mmol)。将反应混合物在50℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩以给出标题化合物(398mg,粗制)。将此材料不经进一步纯化而用于步骤4。lc-ms(m+h)
+
=689.0。
[0265]
步骤4:(r)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮和(s)-(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮
[0266]
向(4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)苯基)(2-氧杂-6-氮杂螺[3.3]庚烷-6-基)甲酮(398mg,0.578mmol)在1,4-二噁烷(25ml)和h
2
o(25ml)中的溶液中添加k
2
co
3
(319mg,2.31mmol)。将所得混合物在80℃搅拌6h。添加水(30ml),并将混合物用etoac(30ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出异构体混合物(165mg),将其通过手性hplc分离以给出实例9a/9b。
[0267]
实例9a:(73mg,24%,经2个步骤)
1
h nmr(400mhz,dmso-d6)δ12.39(s,1h),8.82(s,1h),8.51(s,1h),8.43-8.37(m,2h),7.78(s,1h),7.75-7.67(m,3h),4.70(s,4h),4.57(s,2h),4.23(s,2h),3.10-2.99(m,2h),2.97-2.86(m,3h),2.64-2.52(m,3h),2.40-2.29(m,4h),2.21(s,3h),2.19-2.09(m,1h),1.70-1.60(m,1h)。lc-ms(m+h)
+
=535.5。在手性hplc中的tr:8.42min。
[0268]
实例9a:(55mg,18%,经2个步骤)
1
h nmr(400mhz,dmso-d6)δ12.38(s,1h),8.82(s,1h),8.51(s,1h),8.44-8.36(m,2h),7.78(s,1h),7.75-7.68(m,3h),4.70(s,4h),4.57(s,2h),4.23(s,2h),3.11-2.99(m,2h),2.98-2.86(m,3h),2.64-2.52(m,3h),2.42-2.31(m,4h),2.24(s,3h),2.19-2.06(m,1h),1.70-1.59(m,1h)。lc-ms(m+h)
+
=535.5。在手性hplc中的tr:10.02min。
[0269]
制备型hplc条件
[0270]
手性分析型hplc条件
[0271]
实例10a/10b
[0272]
4-(2-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(2-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺
[0273]
步骤1:(s)-4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0274]
在n
2
下,向(s)-n-甲基-n-((四氢呋喃-3-基)甲基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺(400mg,1.16mmol)和2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪(665mg,1.39mmol)在二噁烷(40ml)和h
2
o(8ml)中的溶液中添加pd(dppf)cl
2
(85mg,0.116mmol)和k
2
co
3
(320mg,2.32mmol)。将混合物在冷凝器下回流5h。将混合物冷却到室温并用etoac(50ml)稀释,然后用盐水(50ml)洗涤,经na
2
so
4
干燥,并在减压下浓缩。将残余物通过硅胶色谱法(用etoac/pe(1:3)洗脱)纯化,以给出标题化合物(350mg,58%)。lc-ms(m+h)
+
=568.9,570.9。
3.37(m,6h),3.09-2.98(m,5h),2.95-2.87(m,3h),2.72-2.52(m,5h),2.41-2.29(m,4h),2.21(s,3h),2.18-1.84(m,2h),1.69-1.57(m,1h)。lc-ms(m+h)
+
=551.0。在手性hplc中的tr:2.67min。
[0280]
实例10b:(41mg,21%,经2个步骤)
1
h nmr(400mhz,dmso-d6)δ12.34(s,1h),8.81(s,1h),8.48(s,1h),8.41-8.35(m,2h),7.78(s,1h),7.71(s,1h),7.52-7.43(m,2h),3.88-3.37(m,6h),3.08-2.96(m,5h),2.96-2.86(m,3h),2.70-2.51(m,5h),2.40-2.27(m,4h),2.21(s,3h),2.18-1.84(m,2h),1.67-1.60(m,1h)。lc-ms(m+h)
+
=551.0。在手性hplc中的tr:3.83min。
[0281]
制备型hplc条件
[0282][0283]
手性分析型hplc条件手性分析型hplc条件
[0284]
实例11a/11b
[0285]
4-(2-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,2-二甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(2-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,2-二甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺
[0286]
步骤1:(s)-4-溴-2-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0287]
以与实例4a/4b、步骤1中类似的方式,从4-溴-2-甲基苯甲酸和(s)-(四氢呋喃-3-基)甲胺制备标题化合物(1.10g,81%)。lc-ms(m+h)
+
=298.0,300.0。
[0288]
步骤2:(s)-4-溴-n,2-二甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0289]
以与实例4a/4b、步骤2中类似的方式,从(s)-4-溴-2-甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺和碘甲烷制备标题化合物(1.07g,93%)。lc-ms(m+h)
+
=311.9,313.9。
[0290]
步骤3:(s)-n,2-二甲基-n-((四氢呋喃-3-基)甲基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺
[0291]
以与实例4a/4b、步骤3中类似的方式,从(s)-4-溴-n,2-二甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺和4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)制备标题化合物(1.20g,99%)。lc-ms(m+h)
+
=359.9。
[0292]
步骤4:(s)-4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,2-二甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺
[0293]
以与实例4a/4b、步骤4中类似的方式,从2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪和(s)-n,2-二甲基-n-((四氢呋喃-3-基)甲基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺制备标题产物(400mg,41%)。lc-ms(m+h)
+
=582.9,584.9。
[0294]
步骤5:4-(2-((r)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,2-二甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺和4-(2-((s)-3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n,2-二甲基-n-(((s)-四氢呋喃-3-基)甲基)苯甲酰胺
[0295]
向(s)-4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n,2-二甲基-n-((四氢呋喃-3-基)甲基)苯甲酰胺(100mg,0.171mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(59mg,0.171mmol)在1,4-二噁烷(15ml)和h
2
o(15ml)中的溶液中添加xphos pd g2(14mg,0.017mmol)和k
2
co
3
(71mg,0.513mmol)。将所得溶液在90℃在n
2
下搅拌过夜并且在100℃再搅拌3h。添加水(15ml),并将混合物用etoac(15ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出异构体混合物(53mg),将其通过手性hplc分离以给出实例11a/11b。
[0296]
实例11a:(20mg,21%)
1
h nmr(400mhz,dmso-d6)δ12.28(s,1h),8.80(s,1h),8.47-8.40(m,1h),8.30-8.24(m,1h),8.22-8.15(m,1h),7.80(s,1h),7.74(s,1h),7.26-7.19(m,1h),3.86-3.42(m,5h),3.25-3.14(m,1h),3.09-2.98(m,3h),2.97-2.87(m,3h),2.83(s,2h),2.71-2.53(m,4h),2.41-2.26(m,7h),2.21(s,3h),2.18-2.10(m,1h),2.07-1.94(m,1h),1.93-1.57(m,2h)。lc-ms(m+h)
+
=565.0。在手性hplc中的tr:10.55min。
[0297]
实例11b:(25mg,26%)
1
h nmr(400mhz,dmso-d6)δ12.30(s,1h),8.80(s,1h),8.47-8.40(m,1h),8.30-8.24(m,1h),8.22-8.15(m,1h),7.80(s,1h),7.73(s,1h),7.26-7.19(m,1h),3.87-3.40(m,5h),3.25-3.14(m,1h),3.09-2.98(m,3h),2.97-2.88(m,3h),2.83(s,2h),2.71-2.51(m,4h),2.41-2.26(m,7h),2.21(s,3h),2.18-2.10(m,1h),2.07-1.94(m,1h),1.93-1.58(m,2h)。lc-ms(m+h)
+
=565.0。在手性hplc中的tr:12.82min。
[0298]
制备型hplc条件
[0299]
手性分析型hplc条件
[0300]
实例12a/12b
[0301]
(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n-甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n-甲基苯甲酰胺
[0302]
步骤1:4-((2-羟基-2-甲基丙基)(甲基)氨基甲酰基)苯基硼酸
[0303]
以与实例9a/9b、步骤1中类似的方式,从2-甲基-1-(甲氨基)丙-2-醇和4-氨基苯甲酸制备标题化合物(415mg,45%)。lc-ms(m+h)
+
=252.2。
[0304]
步骤2:4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n-甲基苯甲酰胺
[0305]
以与实例6a/6b、步骤4中类似的方式,从4-((2-羟基-2-甲基丙基)(甲基)氨基甲酰基)苯基硼酸和2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪制备标题化合物(241mg,32%)。lc-ms(m+h)
+
=557.2。
[0306]
步骤3:(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n-甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n-甲基苯甲酰胺
[0307]
向4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n-甲基苯甲酰胺(295mg,0.530mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(181mg,0.530mmol)在1,4-二噁烷(20ml)和h
2
o(20ml)中的溶液中添加xphos pd g2(42mg,0.053mmol)和k
2
co
3
(219mg,1.59mmol)。将所得混合物在90℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机物用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将残余物通过硅胶色谱法(dcm:meoh=20:1)纯化以给出异构体混合物(145mg),将其通过手性hplc分离以给出实例12a/12b。
[0308]
实例12a:(52mg,18%)
1
h nmr(400mhz,dmso-d6)δ12.33(s,1h),8.81(s,1h),8.51-8.45(m,1h),8.41-8.34(m,2h),7.79(s,1h),7.72(s,1h),7.56-7.38(m,2h),4.67-4.50(m,1h),3.49(s,1h),3.40-3.28(m,1h),3.10(s,3h),3.08-2.99(m,2h),2.98-2.86(m,3h),2.57(s,3h),2.43-2.31(m,4h),2.25(s,3h),2.19-2.06(m,1h),1.71-1.59(m,1h),1.30-1.10(m,5h),1.00-0.90(m,1h)。lc-ms(m+h)
+
=539.5。在手性hplc中的tr:14.93min。
[0309]
实例12b:(52mg,16%)
1
h nmr(400mhz,dmso-d6)δ12.33(s,1h),8.81(s,1h),8.50-8.44(m,1h),8.42-8.35(m,2h),7.79(s,1h),7.72(s,1h),7.56-7.38(m,2h),4.68-4.51(m,1h),3.49(s,1h),3.38-3.28(m,1h),3.10(s,3h),3.08-2.99(m,2h),2.99-2.87(m,3h),2.57(s,3h),2.43-2.31(m,4h),2.23(s,3h),2.19-2.06(m,1h),1.70-1.60(m,1h),
1.30-1.10(m,5h),1.00-0.90(m,1h)。lc-ms(m+h)
+
=539.6。在手性hplc中的tr:16.98min。
[0310]
制备型hplc条件
[0311]
手性分析型hplc条件
[0312]
实例13a/13b
[0313]
(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺
[0314]
步骤1:4-溴-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺
[0315]
以与实例2a/2b、步骤1中类似的方式,从4-溴-2-甲基苯甲酸和2-甲基-1-(甲氨基)丙-2-醇制备标题化合物(2.5mg,86%)。lcms(m+h)
+
=300.0,302.0。
[0316]
步骤2:n-(2-羟基-2-甲基丙基)-n,2-二甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂
环戊硼烷-2-基)苯甲酰胺
[0317]
以与实例2a/2b、步骤5中类似的方式,从4-溴-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺和4,4,4',4',5,5,5',5'-八甲基-2,2'-二(1,3,2-二氧杂环戊硼烷)制备标题化合物(2.5mg,87%)。lc-ms(m+h)
+
=348.0。
[0318]
步骤3:4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺
[0319]
以与实例6a/6b、步骤4中类似的方式,从2-溴-7-碘-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪和n-(2-羟基-2-甲基丙基)-n,2-二甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯甲酰胺制备标题化合物(2.5mg,87%)。lc-ms(m+h)
+
=571.0。
[0320]
步骤4:(r)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺和(s)-4-(2-(3,10-二甲基-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉-8-基)-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺
[0321]
向4-(2-溴-5-甲苯磺酰基-5h-吡咯并[2,3-b]吡嗪-7-基)-n-(2-羟基-2-甲基丙基)-n,2-二甲基苯甲酰胺(327mg,0.573mmol)和3,10-二甲基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2,3,4,4a,5,6-六氢-1h-吡嗪并[1,2-a]喹啉(196mg,0.573mmol)在1,4-二噁烷(20ml)和h
2
o(20ml)中的溶液中添加xphos pd g2(45mg,0.057mmol)和k
2
co
3
(237mg,1.719mmol)。将所得溶液在90℃在n
2
下搅拌过夜。添加水(20ml),并将混合物用etoac(20ml x 3)提取。将合并的有机层用盐水洗涤,经na
2
so
4
干燥,过滤并浓缩。将粗制品
通过硅胶色谱法(dcm:meoh=20:1)纯化以给出异构体混合物(84mg),将其通过手性分离以给出实例13a/13b。
[0322]
实例13a:(28mg,9%)
1
h nmr(400mhz,dmso-d6)δ12.28(s,1h),8.82(s,1h),8.46-8.40(m,1h),8.29-8.24(s,1h),8.23-8.12(m,1h),7.80(s,1h),7.74(s,1h),7.77-7.70(m,1h),4.67-4.48(m,1h),3.49(s,1h),3.31-3.11(m,2h),3.10-2.98(m,2h),2.96-2.87(m,5h),2.69-2.52(m,3h),2.40-2.30(m,6h),2.29-2.07(m,5h),1.69-1.59(m,1h),1.26-1.14(m,5h),0.99-0.91(m,1h)。lc-ms(m+h)
+
=553.6。在手性hplc中的tr:13.36min。
[0323]
实例13b:(24mg,8%)
1
h nmr(400mhz,dmso-d6)δ12.27(s,1h),8.82(s,1h),8.46-8.40(m,1h),8.29-8.24(s,1h),8.23-8.12(m,1h),7.80(s,1h),7.74(s,1h),7.77-7.70(m,1h),4.64-4.50(m,1h),3.49(s,1h),3.31-3.11(m,2h),3.10-2.98(m,2h),2.96-2.87(m,5h),2.69-2.52(m,3h),2.40-2.30(m,6h),2.29-2.08(m,5h),1.69-1.60(m,1h),1.27-1.13(m,5h),0.98-0.90(m,1h)。lc-ms(m+h)
+
=553.6。在手性hplc中的tr:16.57min。
[0324]
制备型hplc条件制备型hplc条件
[0325]
手性分析型hplc条件
[0326]
生物学活性
[0327]
在1mm atp下的hpk激酶活性测定
[0328]
在基于时间分辨荧光共振能量转移(tr-fret)方法的测定中,测试本文披露的化合物对hpk1激酶(aa1-346,生命科技公司(life technologies))活性的抑制。所述测定在384孔小体积黑色板中、在缓冲液中的反应混合物中进行,所述反应混合物含有hpk1激酶(40nm)、1mm atp、0.5μm stk1底物和0-10μm化合物,所述缓冲液含有50mm hepes、0.01%bsa、0.1mm原钒酸盐、10mm mgcl
2
、1mm dtt(ph=7.0)、0.005%tween-20。将激酶与本文披露的化合物或dmso在室温孵育60分钟,并通过添加atp和stk1底物来引发反应。在室温反应120分钟后,根据制造商(cisbio公司)的说明添加等体积的终止/检测溶液。所述终止/检测溶液含有在检测缓冲液中的stk抗体-穴状化合物和xl665-缀合的链霉亲和素。在
pherastar fs酶标仪(bmg labtech公司)上记录tr-fret信号(用337nm波长激发后,665nm处的荧光发射与620nm处的荧光发射的比率)。stk1底物的磷酸化导致stk抗体-穴状化合物与生物素化的stk1底物结合,这使得荧光供体(eu
3
+穴状化合物)紧邻受体(链霉亲和素-xl665),从而产生高程度荧光共振能量转移。基于665nm处与620nm处的荧光比率,计算化合物在浓度渐增情况下对hpk1的抑制。通过graphpad prism软件将数据拟合到四参数逻辑斯谛方程,从而推导出每种化合物的ic
50
。本文披露的化合物显示出如表1所示的酶活性值。
[0329]
表1.本文披露的化合物的酶活性ic
50
(nm)(nm)
[0330]
应理解,如果本文引用任何现有技术出版物;这样的引用并不构成承认出版物形成任何国家的本领域公知常识的一部分。
[0331]
本文通过标识引用(identifying citation)提到的所有出版物、专利、专利申请和公开的专利申请的披露内容通过引用以其全文特此并入本文。
[0332]
虽然出于清楚理解的目的,已经通过说明以及实例的方式相当详细地描述了前述发明,本领域普通技术人员将清楚的是,可以实施某些微小修改或修饰。因此,说明和实例不应当被解释为限制本发明的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



