一种用于石油烃降解的菌-酶复合制剂的制备及其应用的制作方法
 2021-02-02 13:02:28|
2021-02-02 13:02:28| 318|
318| 起点商标网
起点商标网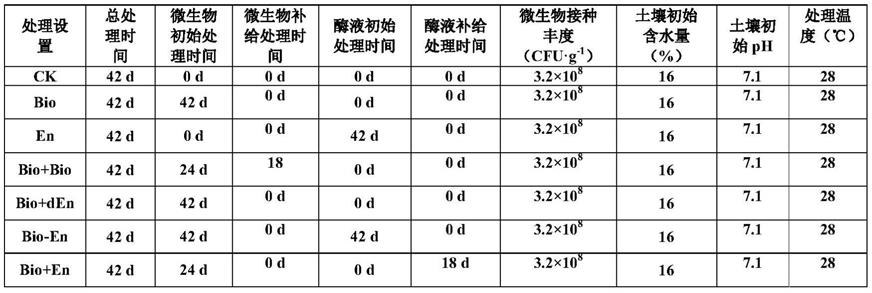
[0001]
本发明属于土壤环境生物修复领域,进一步的说是开发了一种用于石油烃污染土壤中石油烃污染物生物降解的菌-酶复合制剂,以实现高效快速的石油烃污染土壤生物修复。
背景技术:
[0002]
石油工业不断进步,助力了社会经济的蓬勃发展,并带来了可观的经济效益。然而,随之而来出现了不同程度的环境污染问题。其中,在原油开采、运输及石油化工产品的加工生产等过程中,出现了土壤的石油污染问题,导致土壤生态环境遭到破坏,功能丧失,亟需进行修复治理。对此,多种石油污染土壤的修复技术孕育而生,包括客土、阻隔、填埋、脱附、清洗等物理方法,氧化、焚烧、电化学降解等化学方法,以及植物修复、微生物修复、酶制剂降解等生物方法。其中,微生物修复技术鉴于其经济有效、简易环保等优势,成为石油污染土壤行业工程应用治理的首选技术之一。
[0003]
然而,微生物修复技术的发展和应用在长期的实践应用过程中暴露出修复效率易下降,难以维持高效快速降解有机污染物等问题。对此,开发高效持久等微生物修复优化技术,成为了微生物修复技术研究领域等热点方向。随之而来,出现了多种与微生物修复技术相结合的组合型修复技术,如化学氧化联合微生物修复技术,热脱附联合微生物修复技术等,然而,这些技术虽然一定程度上优化的石油烃的去除能力,但仍未有效解决微生物修复阶段,功能菌株降解活性逐渐减弱,有机污染物代谢能力逐渐丧失等老问题,使得现有的组合式修复技术变成了机械化的分段作用。此外,近些年来,为了突破微生物修复低效瓶颈,加快有机污染物生物降解速率,酶制剂的研究逐渐进入视野,并朝着工程应用方向蓬勃发展。然而,酶制剂的石油烃降解过程虽然迅速,但作用短暂,特别是在多向异质性的土壤环境中,生物酶受土壤ph、温度、电解质强度等环境因素影响而易于失活的弊端显露无疑。虽然生物酶的固定化技术一定程度上有效改善了环境因子对生物酶的副作用,然而酶制剂的应用目前仍然难以弥补微生物修复技术短效低效的问题。
技术实现要素:
[0004]
本发明目的在于提供一种用于石油烃降解的菌-酶复合制剂的制备及其应用。
[0005]
为实现上述目的本发明采用的技术方案为:
[0006]
一种用于石油烃降解的菌-酶复合制剂,复合制剂为具有石油烃降解能力的菌剂和该菌剂破碎后获得酶剂;所述菌剂为贪噬菌属 jwlc1(variovorax sp.jwlc1)经30
±
1℃发酵培养至od值为1.5-2.5 的培养液;其中,菌剂和酶剂中发酵培养液的体积比例为1:1-1:3。
[0007]
所述贪噬菌属jwlc1(variovorax sp.jwlc1),已于2019年 10月11日保藏于中国典型培养物保藏中心,地址,中国.武汉.武汉大学,其保藏登录号为cctcc no:m 2019812。
[0008]
所述菌剂为贪噬菌属jwlc1经发酵后所得发酵培养液;
[0009]
所述酶剂为贪噬菌属jwlc1经发酵得发酵培养液后破碎,破碎后经固定化处理后的固液混合物。
[0010]
所述酶剂为贪噬菌属jwlc1经发酵培养后,培养液直接在 300-350w条件下超声破碎处理,破碎处理后混合物经8000-10000 rpm离心进行固液分离,收集液体部分为全酶液,固体部分经炭化处理后全部与全酶液混合(200-300:1,ml/g),4℃条件下静置8-12h,重悬后制得固液混合物,即酶剂。
[0011]
所述固体部分炭化处理为破碎后分离的贪噬菌属jwlc1细胞残体经脱水风干后,在250-300℃无氧条件下炭化处理1-2h,收集处理后的全部固体与全酶液进行混合。
[0012]
一种石油烃降解的菌-酶复合制剂的应用,所述复合制剂在石油烃污染土壤中降解石油烃的应用。
[0013]
所述可将菌-酶复合制剂一次性或分次施加入石油烃污染土壤中进行石油烃降解处理;所述复合制剂在污染土壤中的施加量为5-10% (按菌剂投加比例计,ml/g);而后根据菌剂和酶剂之间发酵培养液的关系计算酶剂的用量。
[0014]
所述一次性施加复合制剂,施加量为5-10%(按菌剂投加比例计, ml/g),且保障土壤中复合制剂中贪噬菌在丰度不小于5
×
10
7
cfu
·
g-1
干土。
[0015]
所述分次施加复合制剂,先向污染土壤中按5-10%(ml/g)的投加比例施加复合制剂中的菌剂,待土壤中石油烃的降解速率降低到初始降解速率的20-50%时,向污染土壤中施加酶剂(酶剂的用量根据菌剂和酶剂之间发酵培养液的关系计算)。
[0016]
本发明所具有的优点包括:
[0017]
1)本发明中所述的贪噬菌属jwlc1(variovorax sp.jwlc1) 具有高效的石油烃降解功能,其发酵培养物中所提取的全酶液具有快速代谢石油烃的能力,突破微生物修复过程中石油烃分子需跨膜进入细胞内的限速步骤,有效提高石油烃降解效率;
[0018]
2)本发明中的贪噬菌属jwlc1(variovorax sp.jwlc1)发酵培养物的细胞超声破碎提取液(即全酶液)不仅具有贪噬菌属jwlc1 全酶组分,同时还具有细胞内容物(多糖、脂质、蛋白质)等物质,由于是原始菌株细胞内的提取物,故而更易于菌株作为营养物质进行代谢利用,从而增强了功能菌株与营养底物间的亲和性;
[0019]
3)本发明中的贪噬菌属jwlc1(variovorax sp.jwlc1)发酵培养物细胞破碎固体组分,经高温炭化处理后,同时发生多孔碳结构及肽聚糖分子裂解等变化过程,从而既提供了有效的固定化炭基材料表面积,增强了全酶吸附性,又为土壤体系中的微生物提供了良好的 c、n、p等营养物质,并具有一定程度的营养物质缓释作用;再有,由于细胞破碎分离的固体组分几乎全部来源于贪噬菌属jwlc1,从而使得固体组分中作为营养物质的c:n:p的含量比例与贪噬菌属jwlc1 所需的营养底物构成基本一致,这有效满足了功能菌株的营养结构需求;
[0020]
4)本发明中的菌剂-酶剂复合制剂在应用过程中,可选择先进行菌剂投加的方式,当石油烃降解速率降低到初始石油烃降解速率的 30~50%时,再投加酶剂组分,这种复合制剂的应用模式比常规的生物放大与生物刺激方法具有更强的作用优势:首先,该种应用模式有效利用了土壤内实时的污染底物组成(包括原始底物+中间产物)对土壤中功能微生物的驯化过程,相比对追加施用只经过原始石油烃底物驯化的微生物而言,在经过酶剂组分进行生物刺激后,土体系中针对实时底物降解的功能微生物活性得到恢复,因而具有更
强的底物降解靶向性;其次,酶剂的应用包括原始细胞内容物及相似c:n:p比例的营养特征,同时附带固定化及缓释能力,较普通的营养助剂追加补给具有更强的针对性,从而与菌剂构成复合助剂,并通过延时补给的方式,显著改善微生物修复高效作用周期,大大提高石油烃污染土壤微生物修复效率。
附图说明
[0021]
图1为本发明实施例提供的贪噬菌属jwlc1(variovorax sp. jwlc1)的16s rdna序列的系统进化分析结果。
[0022]
图2为本发明实施例提供的菌剂-酶剂复合制剂施加条件下土壤中石油烃的残留率随处理时间的动态变化图。
[0023]
图3为本发明实施例提供的菌剂-酶剂复合制剂施加条件下土壤中石油烃的降解速率随处理时间的动态变化图。
[0024]
图4为本发明实施例提供的菌剂-酶剂复合制剂施加条件下土壤中水溶性有机碳含量随处理时间的动态变化图。
[0025]
图5为本发明实施例提供的菌剂-酶剂复合制剂施加条件下土壤中细菌微生物数量随处理时间的动态变化图。
具体实施方式
[0026]
下面结合附图及实施例对本发明做进一步的详细说明。
[0027]
本发明针对在微生物修复技术应用中的长时低效等不足之处,提供一种可有效改善微生物修复难以长时高效维持降解活性的难题的制剂及其应用方法,—力一种菌-酶复合制剂,利用功能菌剂的降解能力,功能酶剂的代谢能力,以及酶剂的营养补给、缓释作用与酶液固定化效果,并通过多元化的应用方式,达到延长微生物修复高效作用周期,并且长时高效维持土壤微生物修复过程的目的。下面通过实施例,从菌-酶复合制剂的制备及针对石油烃污染土壤的修复应用等方面进行详细说明。
[0028]
实施例1贪噬菌属jwlc1(variovorax sp.jwlc1)的筛选与功能鉴定
[0029]
功能菌株的筛选分离来自于某油田区长期受石油烃污染的土壤,污染土壤样品经采集后进行以石油烃为底物的强化驯化培养,驯化培养在摇瓶中震荡培养条件下完成。石油烃初始浓度为1g/kg,震荡培养15天后,增加石油烃浓度为2g/kg,并将一次驯化培养物接种至二次驯化培养瓶中,继续震荡培养15天,再增加石油烃浓度为3 g/kg,将二次驯化培养物接种至三次驯化培养瓶中,再次震荡培养 15天,完成驯化过程,总驯化周期达45天。驯化培养后的培养物在含1g/l的无机盐固体培养基上进行划线分离,挑选长势良好的独立菌株菌落进行三级的划线纯化,以保证获得单一纯菌株,并将纯化获得的菌株在斜面培养基上进行划线保存。
[0030]
在上述筛选过程中,所用到的筛选培养基为无机盐筛选液体培养基,培养基的组成为:0.5g
·
l-1
nacl,1.0g
·
l-1
nh
4
no
3
,0.2g
·
l-1 mgso
4
,1.5g
·
l-1
k
2
hpo
4
,1.0g
·
l-1
kh
2
po
4
,0.02g
·
l-1
feso
4
, 0.02g
·
l-1
cacl
2
,石油烃含量按驯化级别分别为1g
·
l-1
、2g
·
l-1
及3g
·
l-1
,培养体系的ph值为6.5-7.5,121℃灭菌30min;纯化所用固体培养基为在液体培养基基本组成中加入5g/l琼脂粉,固体培养基表面的石油烃物质含量为1g/l。
[0031]
将分离得到的单一菌株进行以石油烃为底物的摇瓶培养降解功能验证:将纯菌株接种于含有5g
·
l-1
石油烃的液体无机盐培养基中,在30
±
1℃条件下震荡培养15天,测定总石油残留量。结果表明,所分离的单一菌株对石油烃的降解具有较高的活性,摇瓶体系培养 15天后石油烃的降解率达到43.7%。
[0032]
所分离的单一菌株即为jwlc1菌株,已于2019年10月11日保藏于中国典型微生物保藏中心,其保藏登录号为cctcc no:m 2019812。该菌属革兰氏染色阴性菌,菌体细胞呈轻微弯曲的棒状,中部隆起,菌落较小,边缘较齐整,表面光滑湿润,不产芽孢,属好氧细菌,化能异养,最适生长温度为30℃
±
2℃,最适生长ph为6.5,能利用果糖、葡萄糖,能使明胶水解。
[0033]
对所分离的上述菌株进行分子生物学鉴定:提取上述菌株jwlc1 的总基因组dna,进行16s rdna的pcr扩增反应,采用细菌扩增通用引物:8f:5
’-
agagtttgatcctggctcag-3
’
及1492r: 5
’-
tacgghtaccttgttacgac tt-3
’
。pcr反应条件为:94℃5min, 94℃1min,55℃1min,72℃3min,35个循环,72℃10min。 pcr产物的测序结果经与genbank数据库blast比对分析可知,序列长度为1436bp,系统进化分析表明(图1),所得菌株与贪噬菌属具有较高同源性。
[0034]
>variovorax sp.
[0035]
gacccatgggcggctgccttaccatgcaagtcgaacggcagcgcgggagcaatcctggcggcgagtggcgaacgggtga gtaatacatcggaacgtgcccaatcgtgggggataacgcagcgaaagctgtgctaataccgcatacgatctacggaagc aggggatcgcaagaccttgcgcgaatggagcggccgatggcagattaggtagttggtgaggtaaaggctcaccaagcct tcgatctgtagctggtctgagaggacgaccagccacactgggactgagacacggcccagactcctacgggaggcagcag tgaccatcgttttggacaatgggcgcaagcctgatccagccatgccgcgtgcaggatgaaggccttcgggttgtaaact gcttttgtacggaacgaaacggccttttctaataaagagggctaatgacggtaccgtaagaataagcaccggctaacta cgtgccagcagccgcggtaatacgtagggtgcaagcgttaatcggaattactgggcgtaaagcgtgcgcaggcggtaat gtaagacagttgtgaaatccccgggctcaacctgggaactgcatctgtgactgcattgctgcattgctggagtacggca gagggggatggaattccgcgtgtagcagtgaaatgcgtagatatgcggaggaacaccgatggcgaaggcaatcccctgg gcctgtactgacgctcatgcacgaaagcgtggggagcaaacaggatctggtagtccacgccctaaacgatgtcaactgg ttgttgggaattcactttctcagtaacgaagctaacgcgtgaagttgaccgcctggggagtacggccgcaaggttgaaa ctcaaaggaattgacggggacccgcacaagcggtggatgatgtggtttaactcgacaacgcgaaaaaccttacccacct tcccacggaattcgccagagatggcttagtgctcgaaagagaaccgtaacacaggtgctgcatggctgtcgtcagctcg tgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgtcattagttgctacatttagttgggcactctaat gagactgccggtgacaaaccggaggaaggtggggatgacgtcaagtcctcatggcccttataggtggggctacacacgt catacaatggctggtacaaagggttgccaacccgcgagggggagctaatcccataaaaccagtcgtagtccggatcgca gtctgcaactcgactgcgtgaagtcggaatcgctagtaatcgtggatcagaatgtcacggtgaatacgttcccgggtct tgtacacaccgcccgtcacaccatgggagcgggttctgccagaagtagttagcttaa ccgcaaggagggcgataccacgtcaggttctttcta
[0036]
实施例2复合制剂的制备
[0037]
1)贪噬菌属jwlc1(variovorax sp.jwlc1)的酶剂制备
[0038]
将筛选所得的贪噬菌属jwlc1(variovorax sp.jwlc1)接种于1l牛肉膏蛋白胨培
养基中,培养基ph为7.0,在30℃、190rpm条件下恒温振荡培养4天。当发酵培养液的od值达到2.1时,停止发酵培养,将发酵培养物在冰浴条件下进行超声破碎处理,处理条件为 330w,总处理时长为35min,破碎后的固液混合物在9500rpm条件下离心10min,进行固液分离,收集上清液体即为全酶液;再收集细胞碎片等固体组分,在300℃条件下进行无氧高温炭化处理2h,制得酶剂中的固体组分。
[0039]
采用考马斯亮蓝法进行全酶液中蛋白质含量测定,选用考马斯亮蓝g250进行蛋白质染色测定,具体测试方法为:称取100mg考马斯亮蓝g250染料粉末,溶于50ml 95%的乙醇中,再加入120ml 85%的磷酸,用水稀释至1l,棕色瓶保存备用。取多支试管,分别向试管中加入标准蛋白质溶液、染料溶液及蒸馏水,总体积为5.1ml,在od595吸光条件下测定并制作标准曲线,标准蛋白质系列浓度为0, 0.02,0.04,0.12,0.16,0.2mg/l,经测定与计算,全酶液中蛋白质浓度达3.4mg/l。
[0040]
再将全酶液与经高温炭化后的固体组分进行混合(混合后体积与贪噬菌属jwlc1发酵培养所得培养液体积大致相当),总的全酶液(1 l)与炭化固体组分(3.8g)的混合比例为263:1(ml/g),混合物在4℃条件下静置12h,即得酶剂。采用tc分析仪进行酶剂中总可溶性有机碳的测定,结果得酶剂中总可溶性有机碳含量达1.31g/l。将酶剂采用冷冻浓缩仪浓缩至需要的体积,备用。
[0041]
2)菌剂的制备
[0042]
将筛选所得的贪噬菌属jwlc1(variovorax sp.jwlc1)接种于 1l牛肉膏蛋白胨培养基中与步骤1)中酶制剂发酵过程相同,培养基ph为7.0,在30℃、190rpm条件下恒温振荡培养4天。当发酵培养液的od值达到2.1时,停止发酵培养,即得菌剂。
[0043]
3)复合制剂的制备
[0044]
将所得菌剂与所得酶剂混合;其中菌剂中发酵培养液(即步骤2) 中发酵后发酵液)和酶剂中发酵培养液(即步骤1)中发酵后未破碎前所得发酵液)的体积比例为1:3。
[0045]
实施例3菌-酶复合制剂的摇瓶试验功能验证
[0046]
将上述实施例获得复合制剂在摇瓶内进行石油烃降解试验,复合制剂中的菌剂和酶剂分别添加:
[0047]
采用筛选培养基配方(即,实施例记载无机盐筛选液体培养基),石油烃初始含量为2.5g/l,首先将实施例2中复合制剂中菌剂加入 (其加入量为3%(按菌剂投加比例计,ml/g)),30℃在190rpm 下震荡培养处置7天,石油烃降解率达51.3%;处理7天后加入复合制剂中酶剂(酶剂的加入量与实施例2中加在的复合制剂中两者混合比例计算),继续震荡培养5天,总的石油烃降解率达到92.6%。
[0048]
与此同时,采用酶剂直接进行石油烃降解的处理,以筛选培养基为基质,向培养体系中同时仅加入实施例2中所制备的酶剂(其加入量与上述复合制剂中酶剂加入量相同)与2.5g/l石油烃,总处理体积为1l,静置培养结合间隔温和震荡处理12h后,总石油烃降解率为29.6%。
[0049]
由此表明,酶剂的使用不仅直接增加了石油烃的降解程度,同时促进了菌剂对石油烃的进一步降解。
[0050]
实施例4菌-酶复合制剂在石油烃污染土壤修复中的应用验证
[0051]
实施例中共设置7个处理,分别为对照组(ck)、单一微生物处理组(bio)、单一酶剂
处理组(en)、二次微生物补给处理组(bio+bio)、菌剂施加结合灭活酶剂补给处理组(bio+den)、菌剂与酶剂共同施加处理组(bio-en)及菌剂施加结合酶剂补给处理组(bio+en),试验设置的具体参数如表1所示。
[0052]
按照实施例3的操作流程制备菌剂,在30℃条件下培养贪噬菌属jwlc1菌液500ml,施加入5kg含石油烃含量3.2%的污染土壤中,其中,菌液od值达2.2,施加后土壤中细菌微生物数量达9.12
×
10
7 cfu/g。
[0053]
按照实施例2的操作流程制备酶剂,在30℃条件下培养贪噬菌属jwlc1菌液1000ml,发酵培养后培养液直接在350w条件下超声破碎处理35min,破碎处理后混合物经9000rpm离心进行固液分离,分别收集液体与固体部分,固体组分进行无氧条件下300℃炭化处理 2h,冷却后与全部液体混合,在4℃条件下静置10h,重悬后制得固液混合物酶剂。将酶剂在冷冻浓缩仪中将总体积浓缩至200ml。
[0054]
针对bio处理组,将500ml菌剂施加入石油烃污染土壤后进行保温保湿处理42d;
[0055]
针对en处理组,将200ml酶剂施加入石油烃污染土壤后进行保温保湿处理42d;
[0056]
针对bio+bio处理组,将500ml菌剂施加入石油烃污染土壤后进行保温保湿处理24d,随后进行菌剂二次补给,将500ml菌剂经离心浓缩后施加入石油烃污染土壤,继续进行保温保湿处理18d,总计处理42d;
[0057]
针对bio+den处理组,将500ml菌剂施加入石油烃污染土壤后进行保温保湿处理24d,随后施加100℃灭活处理的200ml酶剂,继续进行保温保湿处理18d,总计处理42d;
[0058]
针对bio-en处理组,将500ml菌剂离心浓缩成300ml后,与 200ml酶剂混合后共同施加入石油烃污染土壤中,进行保温保湿处理42d;
[0059]
针对bio+en处理组,将500ml菌剂施加入石油烃污染土壤后进行保温保湿处理24d,随后施加200ml酶剂,继续进行保温保湿处理18d,总计处理42d。
[0060]
注上述各处理中酶剂的量为制备该酶剂时破碎前的发酵液体积相当。
[0061]
实施例试验结果表明(参见图2-5),bio-en和bio+en处理的石油烃残留率分别为57.38%和45.10%,表明菌剂-酶剂复合制剂的使用延长了石油烃高效生物降解过程,提高了石油烃总体降解效率,特别是在bio+en处理组中的酶剂施加后,石油烃降解速率显著增大,几乎恢复到降解处理的初始水平。从各项土壤微生态环境指标分析可知:bio+en处理组一定程度上有效维持了微生物的降解活性;从土壤可溶性有机碳含量分析中可知,酶剂的加入显著增加了土壤中可溶性有机碳的含量,增加到处理24天后残留量的3倍以上,有效保持土壤中易利用碳在较高的水平,从而保障了细菌微生物数量,其中bio+en 处理组中细菌微生物数量达到8.51
×
10
6
cfu/g,较bio处理组微生物数量在处理42天时提高4倍以上。
[0062]
表1
[0063]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



