ARID1B的核定位信号序列及其应用的制作方法
 2021-02-02 13:02:16|
2021-02-02 13:02:16| 380|
380| 起点商标网
起点商标网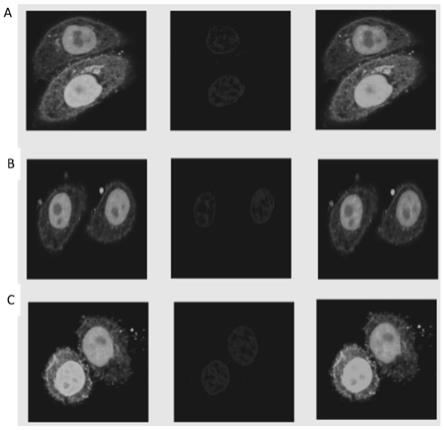
arid1b的核定位信号序列及其应用
技术领域
[0001]
本发明涉及生物医药领域,尤其涉及arid1b的核定位信号序列及其应用。
背景技术:
[0002]
妇科癌症,也称为女性生殖道癌症,包括来自宫颈、输卵管、卵巢、子宫、外阴和阴道的恶性肿瘤。在这些癌症中,虽然子宫内膜癌是最常见的,但卵巢癌是最常见的死亡原因。卵巢癌和子宫内膜癌都是由几个不同的组织学亚型组成的,每一种组织学亚型通常与不同的突变背景和特征相关联,如卵巢癌高恶性浆液性癌的brca突变。最新基因组研究表明,染色质重构复合体(swi/snf)亚基的相关编码基因在妇科肿瘤中也发生高频突变。arid1a作为swi/snf的核心亚基,是一种肿瘤抑制因子,其在卵巢透明细胞癌中基因组测序中有高达57%的突变。在其他妇科肿瘤,如子宫透明细胞癌和子宫内膜样癌、宫颈癌和子宫癌肉瘤中也有不同程度的突变。
[0003]
arid1b是swi/snf(baf)染色质重构复合物的重要组成亚基,其同源基因arid1a在卵巢癌等多种妇科肿瘤中发生高频的错义突变,导致抑癌功能缺失。最近nat medicine的一项研究报道,在多种arid1a突变的肿瘤细胞中敲降arid1b的表达,将抑制肿瘤细胞增殖,出现合成致死。同样nat genet也报道,在结肠癌肿瘤细胞中arid1a发生高频突变导致表达缺失后,arid1b蛋白将维持swi/snf复合体的功能和结构稳定,同时改变核小体与基因增强子区域dna结合位置,调节相关染色质开放性,特别是肿瘤细胞增殖相关通路,促进肿瘤的发展。这些结果说明arid1b可能成为arid1a突变肿瘤的分子治疗新靶点。但是arid1b和arid1a存在高度的序列相似性且不包含小分子结合结构域,此外,尽管与arid1a相比,arid1b在癌症中很少发生突变,但在某些情况下,arid1b被认为是肿瘤抑制因子。所以靶向arid1b具有肿瘤突变风险。设计选择性靶向arid1b的抑制剂具有很高的挑战性。因此,本领域需要一种有效方法来处理arid1a突变的癌细胞。
[0004]
随着人工智能(artificial intelligence,ai)的飞速发展,ai辅助药物设计有望在药物研发阶段实现快速,低价且高效的药物发现新策略之一。针对未知蛋白,首先可以通过计算机模拟与优化的方法构建蛋白三维构象模型,再以靶蛋白的三维结构为基础,筛选规模庞大的类药虚拟分子库,继而借助ai深度学习建立高效的药物筛选与预测模型,能够实现药物分子生物活性与成药性预测,从而在海量样本中筛选出几十个具有相应活性的化合物,通过对筛选出的活性分子进行化学合成与生物活性检测,伴随计算模型的优化与虚拟筛选相结合的策略,辅以传统的构效关系研究,重复几个周期便能够最终筛选出候选药物分子。相比于传统的人工筛选与高通量筛选等策略,该方法能够将筛选时间缩短几十倍,大大提高成功率且极大地缩减新药发现的成本。
[0005]
研究发现在arid1a突变的肿瘤中,swi/snf主要通过arid1b与基因增强子区域dna结合,调节相关染色质开放性,特别是肿瘤细胞增殖相关通路,促进肿瘤的发展。arid1b作为一种大分子核内功能蛋白,其入核需要特殊的转运载体介导。因此,阻断arid1b与入核的关键载体的结合,有望成为抑制arid1a突变肿瘤发生发展的突破性方法。
技术实现要素:
[0006]
本发明的目的在于克服现有技术中的缺陷,提供arid1b的核定位信号序列及其应用,为arid1a突变的合成致死提供策略。
[0007]
本发明为解决上述技术问题,采用以下技术方案:
[0008]
本发明的第一方面是提供arid1b的核定位信号序列,其包括tnpo1与arid1b结合的氨基酸序列中的一条或几条和/或如seq id no.3所示的氨基酸序列。
[0009]
进一步地,上述tnpo1与arid1b结合的氨基酸序列包括seq id no.1和seq id no.2。
[0010]
本发明的第二方面是提供上述核定位信号序列在制备治疗癌症药物中的应用,该药物包括针对上述核定位信号序列的小分子抑制剂。
[0011]
进一步地,上述癌症为妇科癌症,包括但不限于宫颈癌,子宫内膜癌和透明样卵巢癌肿瘤。
[0012]
进一步地,上述药物包括药学上可接受的载体。
[0013]
进一步地,上述药学上可接受的载体包括防腐剂、抗氧化剂、着色剂、表面活性剂、崩解剂、润滑剂、乳化剂、粘合剂、增塑剂、稳定剂、混悬剂中的一种或几种。
[0014]
进一步地,上述药物的剂型为散剂、颗粒剂、片剂、胶囊剂、溶液剂、乳剂、混悬剂、注射剂中的一种或几种。
[0015]
进一步地,上述药物的给药途径为口服、静脉注射、肌肉注射或皮下注射。
[0016]
本发明的第三方面是提供上述核定位信号序列在制备促进arid1a突变的合成致死的药物中的应用,该药物包括针对上述核定位信号序列的小分子抑制剂。
[0017]
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
[0018]
通过实验证明了本发明提供的三条arid1b的核定位信号序列可以帮助arid1b入核发挥功能,所以其可以作为抗肿瘤的药物靶点,且其小分子抑制剂可导致arid1a突变的合成致死,为制备治疗癌症药物提供了新的研究策略。
附图说明
[0019]
图1为数据库中tnpo1在arid1a突变肿瘤中的表达情况及其与预后的关系;对geo数据库多个转录本tnpo1表达水平分析进行分析:其中,图1(a)结果表明与正常子宫内膜组织相比,tnpo1在子宫内膜癌中表达明显升高;图1(b)结果表明与正常卵巢上皮组织相比,tnpo1在卵巢肿瘤中表达明显升高;图1(c)结果表明与宫颈上皮组织相比,tnpo1在宫颈癌组织(cc)中表达明显升高;我们进一步分析tnpo1高表达水平在肿瘤进展中的意义:图1(d)示在子宫颈癌中,tnpo1表达水平与宫颈癌病人总体生存率(overall survival,os)呈显著负相关;图1(e)示在卵巢恶性肿瘤中,tnpo1表达水平与卵巢恶性肿瘤病人总体生存率呈显著负相关,图1(f)示在子宫内膜癌中,tnpo1表达水平与子宫内膜恶性肿瘤病人总体生存率呈显著负相关;图1(g)示在女性生殖道中肿瘤中,子宫颈癌,卵巢恶性肿瘤和子宫内膜癌中,tnpo1表达水平与肿瘤病人总体生存率呈显著负相关;
[0020]
图2示细胞活性敲降tnpo1和arid1b对肿瘤细胞系合成致死检测;其中,图2(a)示在arid1a
+/+
的hela细胞中敲降tnpo1的表达,结果显示与正常组比较,干扰组细胞活性受到明显抑制;图2(b)示在arid1a-/-的c33a宫颈癌细胞中敲降tnpo1的表达,结果显示与正常组
比较,干扰组细胞活性受到明显抑制;图2(c)示在arid1a-/-的tov-21g卵巢透明细胞癌中敲降tnpo1的表达,结果显示与正常组比较,干扰组细胞活性受到明显抑制,结果分析发现在arid1a-/-的肿瘤细胞中敲降tnpo1的表达,与arid1a
+/+
相比将更有效抑制细胞活性;图2(d)示在arid1a
+/+
的hela细胞中敲降arid1b的表达,结果显示与正常组比较,干扰组细胞活性未受到明显抑制;图2(e)示在arid1a-/-的c33a宫颈癌细胞中敲降arid1b的表达,结果显示与正常组比较,干扰组细胞活性受到明显抑制;图2(f)示在arid1a-/-的tov-21g卵巢透明细胞癌中敲降arid1b的表达,结果显示与正常组比较,干扰组细胞活性受到明显抑制;结果分析发现在arid1a-/-的肿瘤细胞中敲降tnpo1能达到与敲降arid1b相似的合成致死效果;
[0021]
图3细胞凋亡检测敲降tnpo1和arid1b对肿瘤细胞系合成致死检测;其中,图3(a)示在arid1a
+/+
的hela细胞中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著诱导肿瘤细胞凋亡;图3(b)示在arid1a-/-的c33a宫颈癌细胞中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著诱导肿瘤细胞凋亡;图3(c)示在arid1a-/-的tov-21g卵巢透明细胞癌中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著诱导肿瘤细胞凋亡,结果分析发现在arid1a-/-的肿瘤细胞中敲降tnpo1的表达,与arid1a
+/+
相比将更有效诱导肿瘤细胞凋亡;图3(d)示在arid1a
+/+
的hela细胞中敲降arid1b的表达,结果显示与正常组比较,干扰组细胞凋亡未受到明显影响;图3(e)示在arid1a-/-的c33a宫颈癌细胞中敲降arid1b的表达,结果显示与正常组比较,干扰组能显著诱导肿瘤细胞凋亡;图3(f)示在arid1a-/-的tov-21g卵巢透明细胞癌中敲降arid1b的表达,结果显示与正常组比较,干扰组能显著诱导肿瘤细胞凋亡,结果分析发现在arid1a-/-的肿瘤细胞中敲降tnpo1能达到与敲降arid1b相似的合成致死效果;
[0022]
图4示细胞克隆增殖检测敲降tnpo1和arid1b对肿瘤细胞系合成致死检测;其中,图4(a)示在arid1a
+/+
的hela细胞中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著抑制肿瘤细胞增殖;图4(b)示在arid1a-/-的c33a宫颈癌细胞中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著抑制肿瘤细胞增殖;图4(c)示在arid1a-/-的tov-21g卵巢透明细胞癌中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著抑制肿瘤细胞增殖,结果分析发现在arid1a-/-的肿瘤细胞中敲降tnpo1的表达,与arid1a
+/+
相比将更有效诱制肿瘤细胞增殖;
[0023]
图5示细胞克隆增殖检测敲降tnpo1和arid1b对肿瘤细胞系合成致死检测;其中,图5(a)示在arid1a
+/+
的hela细胞中稳转敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著抑制裸鼠皮下成瘤能力;图5(b)示在arid1a-/-的c33a宫颈癌细胞中敲降tnpo1的表达,结果显示与正常组比较,干扰组能显著抑制裸鼠皮下成瘤能力结果分析发现在arid1a-/-的肿瘤细胞中敲降tnpo1的表达,与arid1a
+/+
相比将更有效抑制裸鼠皮下成瘤能力;
[0024]
图6示hela细胞和c33a宫颈癌细胞中tnpo1和arid1b蛋白免疫共沉淀的结果;其中,图a~b分别为hela细胞和c33a宫颈癌细胞中的结果图;
[0025]
图7示氨基酸序列为seq id no.1~3的加载在pcdna 3.1 gfp-gst标签蛋白上的核定位信号的荧光共定位结果;其中,图a~c分别为序列为seq id no.1~3的核定位信号的荧光共定位结果。
具体实施方式
[0026]
参考图1,在前期研究中,发明人对geo数据库中的表达谱数据进行分析筛选分析在多组宫颈癌/正常宫颈上皮、子宫内膜癌/正常子宫内膜组织和卵巢透明细胞癌/正常卵巢上皮组织基因表达谱数据进行分析,gse9750发现核转运蛋白tnpo1在宫颈癌组织表达水平显著高于正常组织,gse66957发现tnpo1表达水平在子宫内膜癌组织中明显高于正常子宫内膜组织,gse17025发现tnpo1表达水平在卵巢透明细胞癌中表达明显高于正常卵巢上皮组织。进一步结合tcga数据库预后生存分析发现,在宫颈癌中,发现高表达的预后与肿瘤病人总体生存率呈显著负相关;在子宫内膜癌中,发现高表达的预后与肿瘤病人总体生存率呈显著负相关;在卵巢癌中,发现高表达的预后与肿瘤病人总体生存率呈显著负相关;同样的,将宫颈癌、卵巢癌、子宫内膜癌所有病例进行汇总分析发明人发现tnpo1的表达量与肿瘤病人的总体生存率呈显著负相关。
[0027]
基于上述,发明人进一步通过构建arid1b蛋白截断体,探究tnpo1与arid1b结合的具体氨基酸序列,此外还额外发现一条arid1b的核定位信号序列。
[0028]
一方面,本发明提供的arid1b的核定位信号序列包括如下氨基酸序列中至少一条:
[0029]
psgamsnlgmgqrqqfpy(seq id no.1)(arid1b,isoform 1,1300-1318);
[0030]
lgmgqrqqfpygasydrrhepy(seq id no.2)(arid1b,isoform 1,1307-1329);
[0031]
pnykrhmdgmygppakrhegd(seq id no.3)(arid1b,isoform 1,1357-1378);
[0032]
此外,对于seq id no.1和seq id no.2这两条py-nls序列,其在不同物种中高度保守:
[0033]
猪(sus scrofa):psgamsslgmgqrqqfpygasydrrhepy(seq id no.4)(1442-1471);
[0034]
马(equus caballus):psgamsslglgqrqqfpygasydrrhepy(seq id no.5)(1416-1445);
[0035]
猴子(cynomolgus):psgamsnlgmgqrqqfpygasydrrhepy(seq id no.6)(1359-1388);
[0036]
山羊(capra hircus):psgamsslgmgprqqfpygasydrrhepy(seq id no.7)(603-632);
[0037]
狗(canis lupus familiaris):psgamsslgmgqrqqfpygasydrrhepy(seq id no.8)(603-632)。
[0038]
另一方面,本发明提供了上述核定位信号序列在制备治疗癌症药物中的应用,该药物包括针对上述核定位信号序列的小分子抑制剂。此小分子抑制剂可通过三维模型构建。具体为:
[0039]
通过ai辅助药物设计及反馈驱动的药物研发策略,以现有同源靶蛋白为研究背景,以靶蛋白的三维模型与类药虚拟分子库为基础,采用从头设计的方法或碎片连接法通过深度学习在受体活性部位构建出一个性质互补的分子骨架,根据其他作用性质将分子骨架转化为具体分子,再通过计算机虚拟筛选的方法快速高效的寻找具有潜在活性的小分子。通过传统药物化学的方法,对筛选出的化合物进行合成、筛选与生物学鉴定,确定具有生物活性的苗头化合物。并将结果反馈计算模型以进行优化,从而针对苗头化合物进行结构优化与评价,以改善其对靶标的活性与选择性,同时减少毒性与不良影响,最终总结构效
关系,确定具有深入研究价值的的先导化合物。
[0040]
在该反馈周期中用ai技术对特定部分自动化可以避免人为造成的随机性与错误,提高药物开发的效率。通过对该先导化合物与靶蛋白共结晶技术,以及对其作用机制、成药性与药代动力学的深入研究,并以该先导化合物作为化学修饰的起点,找到具有最大治疗效益与最小潜在危害的化合物,最终将其推向临床试验阶段。
[0041]
在本发明一优选的实施例中,癌症为妇科癌症,包括但不限于宫颈癌、子宫内膜癌和透明样卵巢癌肿瘤。
[0042]
在本发明一优选的实施例中,药物包括药学上可接受的载体;该载体包括但不限于防腐剂、抗氧化剂、着色剂、表面活性剂、崩解剂、润滑剂、乳化剂、粘合剂、增塑剂、稳定剂、混悬剂中的一种或几种。
[0043]
在本发明一优选的实施例中,上述药物的剂型为散剂、颗粒剂、片剂、胶囊剂、溶液剂、乳剂、混悬剂、注射剂中的一种或几种
[0044]
在本发明一优选的实施例中,上述药物的给药途径为口服、静脉注射、肌肉注射或皮下注射。
[0045]
另一方面,本发明提供了上述核定位信号序列在制备促进arid1a突变的合成致死的药物中的应用,该药物包括针对上述核定位信号序列的小分子抑制剂。
[0046]
下面通过具体实施例和附图对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
[0047]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。
[0048]
文中所述的较佳实施方法与材料仅作示范之用,未具体说明的原料、工艺、仪器以及操作方法等均为本领域的常规市售原料或常规技术。
[0049]
以下实施例采用的宫颈癌细胞系hela、宫颈癌arid1a-/-细胞系c33a、卵巢透明细胞癌细胞系arid1a-/-tov-21g分别常规培养在含10%fbs的培养中,在37℃、5%的co
2
培养箱中常规培养。
[0050]
实施例1
[0051]
本实施例探究在hela、宫颈癌arid1a-/-细胞系c33a和卵巢透明细胞癌细胞系arid1a-/-tov-21g中通过sirna干扰下调tnpo1和arid1b基因的表达以及tnpo1和arid1b对女性生殖系统肿瘤细胞增殖的影响,具体如下:
[0052]
一、细胞水平:
[0053]
构建稳定敲降tnpo1和arid1b表达的人宫颈癌和卵巢透明细胞癌细胞株:由于tnpo1和arid1b在宫颈癌组织和卵巢透明细胞癌组织中高表达,在宫颈癌和卵巢透明细胞癌细胞系中通过sirna干扰的方法下调tnpo1和arid1b基因的表达。构建tnpo1干扰(shtnpo1-1/2/3)或过表达(lentitnpo1)的慢病毒表达质粒,病毒转染宫颈癌细胞株,利用嘌呤霉素筛选出tnpo1表达下调/上调的宫颈癌细胞稳转株,然后利用cell counting kit-8(cck-8试剂盒),细胞平板克隆实验和流式细胞仪检测细胞增殖凋亡影响(结果如图1-4所示):
[0054]
①
cck-8细胞活力检测敲降tnpo1和arid1b表达对宫颈癌细胞和卵巢透明细胞癌增殖的影响;
[0055]
②
细胞平板克隆或软琼脂集落形成实验检测敲降tnpo1表达对宫颈癌细胞和卵巢透明细胞癌增殖的影响;
[0056]
③
流式细胞仪检测细胞凋亡检测敲降tnpo1和arid1b表达对宫颈癌细胞和卵巢透明细胞癌凋亡影响。
[0057]
由图1-4可知,敲降tnpo1和arid1b的表达显著抑制宫颈癌细胞增殖、促进其凋亡;arid1a-/-细胞系c33a和tov-21g敲降tnpo1的表达能更显著的抑制细胞的增殖和促进细胞的凋亡,而在arid1a
+/+
细胞系hela中敲降arid1b的表达将不会对细胞的增殖产生明显的抑制,在arid1a-/-细胞系c33a和tov-21g敲降arid1b的表达将显著的抑制细胞的增殖和促进细胞的凋亡。因此tnpo1可能是介导arid1b在arid1a-/-细胞系中合成致死的主要因素。
[0058]
二、动物水平
[0059]
检测tnpo1转染效率,验证过表达/敲降成功后,进行后续指标检测。雌性裸鼠饲养于spf级条件下,在5-6周龄左侧腋下皮下接种1
×
10
6
相应的tnpo1过表达或敲降的单克隆宫颈癌细胞稳转株构建裸鼠移植瘤模型,每3-4天用游标卡尺测量小鼠瘤体的长和宽,记录荷瘤小鼠肿瘤体积和小鼠生存率,4周后牺牲小鼠,剥离皮下瘤,称量各组瘤体重量以及计算瘤体体积。将皮下瘤进行石蜡包埋和切片,进一步利用免疫荧光技术检测移植瘤体组织中增殖及凋亡相关标记物的表达情况,研究tnpo1对宫颈癌细胞增殖及凋亡功能的影响。
[0060]
由图5可知,敲降tnpo1的表达显著抑制宫颈癌细胞成瘤能力及瘤体生长速度,同时发现在arid1a-/-细胞系c33a中敲降tnpo1的表达能更显著抑制宫颈癌细胞成瘤能力及瘤体生长速度。
[0061]
实施例2
[0062]
本实施例在实施例1的基础上,验证tnpo1与arid1b是否存在相互结合。在hela细胞和c33a宫颈癌细胞中进行tnpo1和arid1b蛋白免疫共沉淀,具体的步骤和结果如下:
[0063]
1.用预冷的pbs洗涤细胞两次,最后一次吸干pbs;
[0064]
2.加入预冷的ripa buffer(1ml/10
7
个细胞、10cm培养皿或150cm
2
培养瓶,0.5ml/5
×
10
6
个细胞、6cm培养皿、75cm
2
培养瓶);
[0065]
3.用预冷的细胞刮子将细胞从培养皿或培养瓶上刮下,把悬液转到1.5ep管中,在4℃的条件下缓慢晃动15min(ep管插冰上,置水平摇床上);
[0066]
4.4℃,14000g离心15min,立即将上清转移到一个新的离心管中
[0067]
5.准备protein a agarose,用pbs洗两遍珠子,然后用pbs配制成50%浓度,建议减掉枪尖部分,避免在涉及琼脂糖珠的操作中破坏琼脂糖珠;
[0068]
6.每1ml总蛋白中加入100μl protein a琼脂糖珠(50%),4℃摇晃10min(ep管插冰上,置水平摇床上),以去除非特异性杂蛋白,降低背景;
[0069]
7.4℃,14000g离心15min,将上清转移到一个新的离心管中,去除protein a珠子;
[0070]
8.(bradford法)做蛋白标准曲线,测定蛋白浓度,测前将总蛋白至少稀释1:10倍以上,以减少细胞裂解液中去垢剂的影响(定量,分装后,可以在-20℃保存一个月);
[0071]
9.用pbs将总蛋白稀释到约1μg/μl,以降低裂解液中去垢剂的浓度,如果目标蛋白在细胞中含量较低,则总蛋白浓度应该稍高(如10μg/μl);
[0072]
10.加入一定体积的兔抗到500μl总蛋白中,抗体的稀释比例因目标蛋白在不同细胞系中的多少而异;
[0073]
11.4℃缓慢摇动抗原抗体混合物过夜或室温2h,激酶或磷酸酯酶活性分析建议用2h室温孵育;
[0074]
12.加入100μl protein a琼脂糖珠来捕捉抗原抗体复合物,4℃缓慢摇动抗原抗体混合物过夜或室温1h,如果所用抗体为鼠抗或鸡抗,建议加2μl“过渡抗体”(例如兔抗鼠igg或兔抗鸡igg);
[0075]
13.14000rpm瞬时离心5s,收集琼脂糖珠-抗原抗体复合物,去上清,用预冷的ripa buffer洗3遍,800μl/遍,ripa buffer有时候会破坏琼脂糖珠-抗原抗体复合物内部的结合,可以使用pbs;
[0076]
14.用60μl 2
×
上样缓冲液将琼脂糖珠-抗原抗体复合物悬起,轻轻混匀,缓冲液的量依据上样多少的需要而定;
[0077]
15.将上样样品煮5min,以游离抗原,抗体,珠子,离心,将上清电泳,收集剩余琼脂糖珠,上清也可以暂时冻-20℃,留待以后电泳,电泳前应再次煮5min变性。
[0078]
电泳结果如图6可知,用tnpo1抗体能下拉arid1b蛋白,说明tnpo1与arid1b存在相互结合。
[0079]
实施例3
[0080]
本实施例验证氨基酸序列为seq id no.1~3的核定位信号序列的辅助arid1b的辅助入核功能,将每段核定位信号氨基酸序列加载在pcdna 3.1 gfp-gst标签蛋白上,具体的细胞爬片免疫荧光实验步骤和结果如下:
[0081]
1.在培养板中将已爬好细胞的玻片用pbs浸洗3次,每次3min;
[0082]
2.用4%的多聚甲醛固定爬片15min,pbs浸洗玻片3次,每次3min;
[0083]
3.0.5%tritonx-100(pbs配制)室温通透20min;
[0084]
4.pbs浸洗玻片3次,每次3min,吸水纸吸干pbs,在玻片上滴加正常山羊血清,室温封闭30min;
[0085]
5.吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗并放入湿盒,4℃孵育过夜;
[0086]
6.加荧光二抗:pbst浸洗爬片3次,每次3min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中20-37℃孵育1h,pbst浸洗切片3次,每次3min;注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行;
[0087]
7.复染核:滴加dapi避光孵育5min,对标本进行染核,pbst 5min
×
4次洗去多余的dapi;
[0088]
8.用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像,结果如7所示。
[0089]
由图7可知,因为gfp-gst本身不能自由穿透核孔进入细胞核,而分别加载这三段氨基酸序列之后,这三段都能自由穿透核孔,因此可判定这三段氨基酸序列是arid1b的核定位信号,帮助其入核发挥功能,同时也是小分子抑制剂药物的作用靶点。
[0090]
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



