一类基于2,6-二叔丁基蒽的蓝色有机半导体材料及其制备方法与应用与流程
 2021-02-02 13:02:20|
2021-02-02 13:02:20| 322|
322| 起点商标网
起点商标网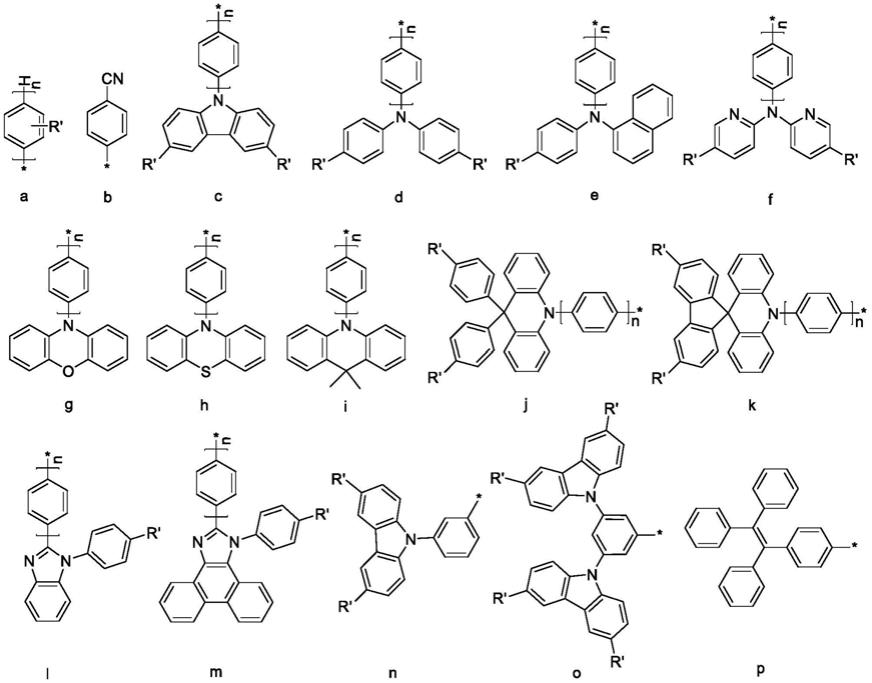
[0001]
本发明属于有机光电材料技术领域,具体涉及一类基于2,6-二叔丁基蒽的蓝色有机半导体材料及其制备方法与应用。
背景技术:
[0002]
有机电致发光器件(organic light emitting diode,oled)由于其具有驱动电压低、响应速度快、发光效率高、色域广、重量轻而薄、可柔性折叠等优良特点,所以在显示和照明领域都显示出了巨大的应用潜力。oled经过近三十年的发展,科学家们在材料制备、器件优化及理论研究方面都取得了巨大的突破;而有机发光材料作为oled的核心技术,向来是显示领域科研的焦点。三原色中的绿光和红光高效率材料先后被研发出来并逐步走向商用领域,而作为三原色之一的蓝光材料却存在效率不足、稳定性差等特点。因此如何设计出高效率、高稳定性、低成本的蓝光材料分子体系逐渐成为显示领域的研发重点。
[0003]
一种性能优异的蓝色荧光材料通常需具备两种特征:高纯度的蓝光发射和高的固态发光效率。通常一个合适的主体发光材料的选择往往就能很好的实现高纯度的蓝光发射。然而传统的有机荧光材料在单分子状态下呈现高亮度发射,而当分子聚集时则会导致荧光猝灭,通常我们将这种现象称之为聚集猝灭发光(aggregation-caused quenching,acq),而这种现象将导致材料的固态发光效率很低,这对于oleds的制作是极其不利的。
[0004]
蒽是一种高效的蓝色荧光发色团,具有较高的光致荧光量子产率;蒽还具有适当的宽禁带,保证了其衍生物的蓝发射;此外蒽还具有良好的光致发光和电致发光性能以及良好的载流子迁移能力,而且蒽的9,10位点可以进行不同基团的不对称修饰。但由于其平面刚性结构,使得其在聚集态下容易发生强的相互作用,使荧光减弱或严重猝灭。因此,许多蒽衍生物的蓝色发射器在薄膜中显示出较低的荧光量子产率。(chen,b.;liu,b.;zeng,j.;nie,h.;xiong,y.;zou,h.;ning,h.;wang,z.;zhao,z.;tang,b.z.efficient bipolar blue aiegens for high-performance nondoped blue oleds and hybrid white oleds.adv.funct.mater.2018,28,1803369.)。聚集诱导发光(aggregation-induced emission,aie)则是2001年唐本忠课题组报道的一个颠覆传统的概念,指的是分子在单分子状态下几乎不发光,而在聚集态或固态薄膜下发光显著增强的现象。aie的提出为解决发光材料的acq问题提供了一个极好的新思路。特别是对于高效率的非掺oled器件来说更是极好的显现了其巨大的优势。因此,选用2,6-二叔丁基蒽核作为发光核心,叔丁基的引入减弱了分子间强的作用力从而缓解了acq现象,然后通过修饰引入一些具有aie性质的基团,从而在保证蓝发射的同时也保证了高的荧光量子产率,从而在分子设计层面有效提高了器件发光效率。
技术实现要素:
[0005]
为了克服现有技术存在的上述不足,本发明的目的是提供一类基于2,6-二叔丁基
蒽的蓝色有机半导体材料及其制备方法与应用。
[0006]
蒽具有良好的光致发光、电致发光性能以及良好的载流子迁移能力,加之其适当的宽禁带,所以蒽是一种高效的蓝色荧光发色团。而蒽的平面和刚性结构使其易发生强的π-π相互作用,从而易导致聚集荧光猝灭(acq)现象,本发明将叔丁基引入则可有效抑制其紧密的分子堆积。
[0007]
本发明的目的在于针对现有技术的不足,提供一种基于2,6-二叔丁基蒽的蓝光有机半导体材料体系。该类发光材料具备蓝光发射和aie特性,由于其具有良好的固态荧光量子产率,所以在制备高效率、低效率滚降的非掺蓝色有机电致发光器件中具有巨大的优势。
[0008]
本发明另一目的在于提供上述基于2,6-二叔丁基蒽的蓝光有机半导体材料的制备方法。本发明的方法工艺简单、原料易得、产率高。
[0009]
本发明再一目的在于提供上述基于2,6-二叔丁基蒽的蓝光有机半导体材料在有机电致发光领域中的应用,特别是在制备有机发光二极管的发光层中的应用。
[0010]
本发明的目的至少通过如下技术方案之一实现。
[0011]
本发明提供的一种基于2,6-二叔丁基蒽的蓝光有机半导体材料,其化学结构式如下所示:
[0012][0013]
其中,ar
1
、ar
2
为功能调控基团,ar
1
、ar
2
为取代或未取代的芳基或杂芳基;ar
1
、ar
2
相同或者不同。本发明主要通过2,6-二叔丁基蒽的9,10位上连接不同的修饰基团调控蒽衍生物的发光物理性质和能级特性。
[0014]
进一步地,所述功能调控基团为如下结构式a-p中的一种:
[0015][0016]
其中,结构式a中n为大于等于1的整数,结构式b-p中的n为0~10的整数。同一结构或不同结构中的r'相同或不同,r'为氢原子、取代或未取代的烷基。所述烷基为具有1~20个碳原子的直链、支链烷基,烷基中的取代独立地指一个或多个碳原子被氧原子、烯基、炔基、羟基、羧基、羰基、氨基、氰基、硝基或酯基取代,或者一个或多个氢原子被氟原子、氯原子、溴原子、碘原子、芳基取代。
[0017]
本发明提供的一种制备基于2,6-二叔丁基蒽的蓝光有机半导体材料的方法,包括如下步骤:
[0018]
(1)当材料为对称化合物时
[0019]
以蒽和叔丁醇为原料,在三氟乙酸溶剂中发生friedel-crafts烷基化反应得到叔丁基取代的蒽;然后将叔丁基取代的蒽与液溴进行溴化反应得到9,10位取代的二溴取代化合物;将二溴取代化合物直接与芳基硼酸或硼酸酯进行一步suzuki交叉偶联即得有机半导体材料;
[0020]
(2)当材料为非对称化合物时
[0021]
以蒽和叔丁醇为原料,在三氟乙酸溶剂中发生friedel-crafts烷基化反应得到叔丁基取代的蒽;然后将叔丁基取代的蒽与液溴进行溴化反应得到9,10位取代的二溴取代化合物;将二溴取代化合物与芳基硼酸或硼酸酯进行suzuki交叉偶联得到芳基溴代化合物,将芳基溴代化合物再与另一芳基硼酸或硼酸酯进行suzuki交叉偶联得到蓝光有机半导体材料。
[0022]
所述叔丁基取代的蒽的结构式为式ii,二溴取代化合物的结构式为式iii,芳基溴代化合物的结构式为式iv:
[0023][0024]
进一步地,步骤(1)和(2)所述蒽和叔丁醇的摩尔比为1:3-1:4;叔丁基取代的蒽与液溴的摩尔比为1:1-1:2,优选为1:1。
[0025]
进一步地,当材料为对称化合物时,步骤(1)所述二溴取代化合物与芳基硼酸或硼酸酯的摩尔比为1:2-1:3,优选为1:2.5。
[0026]
进一步地,当材料为非对称化合物时,步骤(2)所述二溴取代化合物与芳基硼酸或硼酸酯的摩尔比为1:1-1:2,优选为1:1;芳基溴代化合物与芳基硼酸或硼酸酯的摩尔比为1:1-1:2,优选为1:1.5。
[0027]
进一步地,步骤(1)和(2)的傅氏(friedel-crafts)烷基化反应的条件为:加热回流;溴化反应的温度为常温或室温,以有机溶剂为介质;suzuki交叉偶联反应的条件为:温度105-115℃,溶剂为甲苯、乙醇与水,反应所需的催化剂为四(三苯基磷钯)和碳酸钾。
[0028]
本发明提供的蓝光有机半导体材料以蒽作为构筑单元,保证了材料的蓝色荧光发射;然后通过在2,6-二叔丁基蒽的9,10位上引入合适的给/吸电子基团或蓝光aie基团,使得材料在保证蓝光发射的前提下即使在聚集状态下不会因形成很强的π-π相互作用而导致荧光猝灭现象,从而获得高的固态发光效率。基于此类材料可制备出高效率、低效率滚降、非掺杂的蓝色有机电致发光器件,在有机电致发光领域具有广泛的应用前景。而且通过2,6-二叔丁基蒽的9,10位上连接不同的修饰基团还可以调控蒽衍生物的发光物理性质和能级特性。本发明所制备的发光材料在固态下具有高效的蓝色或深蓝色发射;材料的能级结构具有良好的调控特性,从而调节材料电子/空穴注入性能,有利于器件结构的简化;所有材料均具有良好的稳定性和成膜性,均可通过真空蒸镀成膜制成非掺或掺杂器件,器件制备工艺选择灵活。
[0029]
与现有技术相比,本发明具有如下优点和有益效果:
[0030]
(1)本发明的基于2,6-二叔丁基蒽构筑单元的蓝光半导体材料合成方法简单,原料方便易得,产率较高,得到的材料结构稳定,这将大大扩大了该分子的可适用范围;
[0031]
(2)本发明的基于2,6-二叔丁基蒽构筑单元的蓝光半导体材料,能够通过改变芳基单元的结构来实现吸收与发射光谱的调节以及发光物理和能级特性的调控,可操作空间大,如本发明实施例中通过不同结构的构筑实现了439-449nm的一个区间发射;
[0032]
(3)本发明的基于2,6-二叔丁基蒽构筑单元的蓝色有机半导体材料用于有机发光二极管的发光层使用,综合表现性能优异,可以广泛应用于有机电致发光等领域,如本发明实施例2中化合物dpac-tabi的非掺器件最大效率达到了5.81%,同时还兼具了较大的最大亮度(2581cd m-2
)。
附图说明
[0033]
图1a为实施例1制备的化合物dmac-tabi在四氢呋喃溶液/薄膜状态下的光致发光光谱;
[0034]
图1b为实施例2制备的化合物dpac-tabi在四氢呋喃溶液/薄膜状态下的光致发光光谱;
[0035]
图1c为实施例3制备的化合物dmac-tapi在四氢呋喃溶液/薄膜状态下的光致发光光谱;
[0036]
图1d为实施例4制备的化合物dpac-tapi在四氢呋喃溶液/薄膜状态下的光致发光光谱;
[0037]
图2a为实施例2和3中基于2,6-二叔丁基蒽的蓝色有机半导体材料制备得到的非掺杂oleds器件的j-v-l曲线图;
[0038]
图2b为实施例2和3中基于2,6-二叔丁基蒽的蓝色有机半导体材料制备得到的非掺杂oleds器件的电流密度和功率密度随亮度变化的曲线图,及其电致发光光谱图;
[0039]
图2c为实施例2和3中基于2,6-二叔丁基蒽的蓝色有机半导体材料制备得到的非掺杂oleds器件的效率随亮度变化的曲线图。
具体实施方式
[0040]
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
[0041]
实施例1
[0042]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dmac-tabi)的制备
[0043][0044]
反应方程式(一):
[0045]
[0046][0047]
(1)中间体2的合成:向装有蒽(4.45g,25mmol)的反应瓶中,加入25ml的三氟乙酸(tfa),并将叔丁醇(8.5ml,88.8mmol)逐滴加入反应瓶中,滴加完毕后加热回流反应12h,反应完毕后将反应液倒入冷水中淬灭,搅拌沉淀后进行抽滤,然后用乙醇和少量正己烷搅拌回流进行重结晶,抽滤得到初步产物后用乙醇二次回流重结晶得到白色固体产物(中间体2),产率76%;
[0048]
(2)中间体3的合成:将中间体2(1.45g,5mmol)加入反应瓶中,用二氯甲烷(dcm)溶解,对反应瓶进行冰水浴,冰水浴恒温后将液溴(0.256ml,5mmol)逐滴缓慢加入反应瓶中,滴加完毕后室温搅拌反应2h,反应完毕后用饱和硫代硫酸钠溶液加入到反应液中进行还原,然后将反应液萃取、洗涤、合并有机相,最后用乙醇搅拌回流进行重结晶得到淡黄色固体产物(中间体3),产率90%;
[0049]
(3)中间体5的合成:将中间体3(0.90g,2mmol)、中间体4(0.82g,2mmol)、四(三苯基磷)钯(0.24g,0.2mmol)、碳酸钾(0.84g,8mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(中间体5),反应产率60%。
[0050]
(4)dmac-tabi的合成:将中间体5(0.65g,1mmol)、中间体6(0.60g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(dmac-tabi),反应产率84%。
1
h nmr(500mhz,cdcl
3
),δ(tms,ppm):7.99(d,j=6.5hz,1h),7.85(dd,j=20.9,8.7hz,3h),7.73(d,j=8.1hz,2h),7.66(d,j=9.2hz,1h),7.52(m,15h),7.43
–
7.40(m,1h),7.35(q,j=5.8hz,2h),7.11
–
7.07(m,2h),7.02
–
6.98(m,2h),6.54(d,j=8.1hz,2h),1.76(s,6h),1.33(s,9h),1.30(s,9h).
13
c nmr(126mhz,cdcl
3
),δ(tms,ppm):147.17,147.12,141.05,140.38,139.54,135.75,133.83,131.46,131.37,130.13,129.95,129.69,129.55,129.31,128.41,128.28,127.47,126.44,126.37,125.34,124.77,120.87,120.65,114.03,110.58,36.08,35.02,31.30,30.83,30.63.
[0051]
实施例2
[0052]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dpac-tabi)的制备
[0053][0054]
反应方程式(二):
[0055][0056]
(1)同实施例1;
[0057]
(2)同实施例1;
[0058]
(3)同实施例1;
[0059]
(4)dpac-tabi的合成:将中间体5(0.78g,1mmol)、中间体6(0.60g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(dpac-tabi),反应产率78%。
1
h nmr(500mhz,cdcl
3
),δ(tms,ppm):8.03
–
7.90(m,2h),7.88
–
7.74(m,4h),7.65
–
7.44(m,15h),7.34(t,j=6.0hz,4h),7.30(dd,j=9.7,4.7hz,4h),7.16(m,2h),7.06(m,4h),6.97
–
6.93(m,4h),6.67(d,j=8.0hz,2h),1.32(s,9h),1.28(s,9h).
13
c nmr(126mhz,cdcl
3
),δ(tms,ppm):146.49,142.31,133.49,131.31,130.45,130.17,129.57,127.67,127.46,126.94,126.30,120.24,113.97,56.84,35.00,30.81,30.63.
[0060]
实施例3
[0061]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dmac-tapi)的制备
[0062][0063]
反应方程式(三):
[0064][0065]
(1)同实施例1;
[0066]
(2)同实施例1;
[0067]
(3)同实施例1;
[0068]
(4)dmac-tapi的合成:将中间体5(0.65g,1mmol)、中间体6(0.75g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(dmac-tapi),反应产率73%。
1
h nmr(500mhz,cdcl
3
),δ(tms,ppm):8.97(d,j=7.4hz,1h),8.79(dd,j=31.6,8.5hz,2h),7.87(d,j=9.8hz,1h),7.85
–
7.77(m,3h),7.74
–
7.64(m,9h),7.60
–
7.54(m,6h),7.52(dd,j=7.7,1.4hz,2h),7.48
–
7.44(m,3h),7.33
–
7.29(m,2h),7.11
–
7.06(m,2h),6.99(m,2h),6.54(dd,j=8.2,1.0hz,2h),1.76(s,6h),1.33(s,9h),1.30(s,9h).
13
c nmr(126mhz,cdcl
3
),δ(tms,ppm):147.12,147.08,141.06,140.36,139.58,135.65,133.84,131.36,131.32,130.13,129.85,129.70,129.55,129.31,129.21,128.48,128.35,128.28,127.36,126.53,126.44,126.35,125.69,125.34,124.98,124.74,124.63,124.18,123.18,121.02,120.96,120.84,120.65,114.03,36.08,35.03,31.30,30.90,30.64.
[0069]
实施例4
[0070]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dpac-tapi)的制备
[0071][0072]
反应方程式(四):
[0073][0074]
(1)同实施例1;
[0075]
(2)同实施例1;
[0076]
(3)同实施例1;
[0077]
(4)dpac-tapi的合成:将中间体5(0.78g,1mmol)、中间体6(0.75g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(dpac-tabi),反应产率72%。
1
h nmr(400mhz,cdcl
3
),δ(tms,ppm):8.97(s,1h),8.83(d,j=8.5hz,1h),8.76(d,j=8.4hz,1h),7.86
–
7.76(m,4h),7.73
–
7.44(m,17h),7.31(m,9h),7.16(m,2h),7.10
–
7.05(m,4h),6.98
–
6.93(m,4h),6.67(d,j=8.2hz,2h),1.32(s,9h),1.29(s,9h).
13
c nmr(126mhz,cdcl
3
),δ(tms,ppm):147.12,147.07,146.49,142.31,139.83,139.60,133.50,131.30,130.45,130.16,129.64,129.56,129.19,128.44,128.30,127.67,126.93,126.49,126.38,126.30,124.67,124.20,123.18,120.97,120.80,120.24,113.97,67.99,56.84,35.01,30.88,30.64,25.62.
[0078]
实施例5
[0079]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(tpe-tabc)的制备
[0080][0081]
反应方程式(五):
[0082][0083]
(1)同实施例1;
[0084]
(2)同实施例1;
[0085]
(3)同实施例1;
[0086]
(4)tpe-tabc的合成:将中间体5(0.47g,1mmol)、中间体6(0.56g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(dpac-tapi),反应产率86%。
1
h nmr(400mhz,cd
2
cl
2
),δ(tms,ppm):7.89(d,j=8.0hz,2h),7.57(d,j=7.9hz,4h),7.41(d,j=20.8hz,4h),7.27(d,j=7.9hz,2h),7.22
–
7.09(m,17h),1.28(s,9h),1.24(s,9h).
13
c nmr(126mhz,cd
2
cl
2
),δ(tms,ppm):148.98,145.19,145.15,142.19,133.56,132.64,132.57,129.10,129.03,129.01,127.89,127.82,125.87,120.34,112.70,36.15,31.90,31.74.
[0087]
实施例6
[0088]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(cz-tabc)的制备
[0089][0090]
反应方程式(六):
[0091]
[0092][0093]
(1)同实施例1;
[0094]
(2)同实施例1;
[0095]
(3)同实施例1;
[0096]
(4)cz-tabc的合成:将中间体5(0.47g,1mmol)、中间体6(0.43g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(cz-tabc),反应产率92%。
1
h nmr(400mhz,cdcl
3
),δ(tms,ppm):8.15(d,j=7.6hz,2h),7.94
–
7.89(m,2h),7.86(m,1h),7.81
–
7.77(m,2h),7.73
–
7.68(m,2h),7.64(m,1h),7.62
–
7.57(m,3h),7.56(s,1h),7.53(m,1h),7.49(m,2h),7.44
–
7.40(m,3h),7.31
–
7.27(m,2h),1.33(s,9h),1.26(s,9h).
13
c nmr(101mhz,cdcl
3
),δ(tms,ppm):132.25,125.98,120.40,120.05,109.75,77.28,77.02,76.71,35.12,34.92,30.76.
[0097]
实施例7
[0098]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dcz-tabc)的制备
[0099][0100]
反应方程式(七)
[0101][0102]
(1)同实施例1;
[0103]
(2)同实施例1;
[0104]
(3)同实施例1;
[0105]
(4)dcz-tabc的合成:将中间体5(0.47g,1mmol)、中间体6(0.68g,1.5mmol)、四(三苯基磷)钯(0.12g,0.1mmol)、碳酸钾(0.42g,4mmol)加入反应瓶中,抽换氮气三次,在氮气保护下注入溶剂(甲苯:乙醇:水=8:1:1(体积比)),注入完毕后110℃加热回流12h,反应完毕后萃取、浓缩、做粉过柱提纯得到白色固体产物(dcz-tabc),反应产率64%。
1
h nmr(400mhz,cdcl
3
),δ(tms,ppm):8.17(d,j=7.6hz,4h),8.07(m,1h),8.00
–
7.87(m,4h),7.85(d,j=1.9hz,2h),7.69(t,j=9.2hz,4h),7.67
–
7.60(m,3h),7.54(d,j=10.8hz,2h),7.51
–
7.43(m,5h),7.33(m,4h),1.42(s,9h),1.31(s,9h).
13
c nmr(101mhz,cdcl3),δ(tms,ppm):148.11,144.58,143.02,140.60,139.55,134.84,132.27,129.55,129.10,128.33,126.42,125.95,125.45,124.18,123.78,120.52,119.03,111.62,109.67,77.31,77.05,76.73,35.13,30.82,30.36,29.74,26.95.
[0106]
实施例8
[0107]
基于2,6-二叔丁基蒽的蓝光有机半导体材料在四氢呋喃溶液和薄膜状态下的光致发光光谱测试
[0108]
称取4.21mg的实施例1制备的dmac-tabi化合物溶于5ml的超干四氢呋喃(thf)中,配成浓度为10-3
mol/l的测试样品。取30μl的dmac-tabi测试样品加到5ml的离心管中,然后再加入2970μl的超干thf。在对应激发波长下测试样品的发射光谱,通过数据处理得到化合物dmac-tabi溶液状态下的光致发光光谱图。然后再通过取适量母液在1x1的石英片上滴涂成膜,在对应激发波长下测试样品的发射光谱,通过数据处理得到化合物dmac-tabi薄膜状态下的光致发光光谱图。基于蒽的蓝光有机半导体材料的光致发光光谱图见图1a。可以从图1a中看到该基于蒽的蓝光有机半导体材料的溶液发射峰为439nm,薄膜的发射峰为448nm,相比于溶液状态其薄膜状态约有10nm左右的红移。
[0109]
实施例2制备的化合物dpac-tabi、实施例3制备的化合物dmac-tapi及实施例4制备的化合物dpac-tapi同样经过上述测试,测试的方法与化合物dmac-tabi相同。测试得到化合物dpac-tabi、化合物dmac-tapi、化合物dpac-tapi分别在thf溶液和薄膜状态下的光
致发光光谱图,结果如图1b、图1c、图1d所示。化合物dpac-tabi(溶液发射峰为441nm,薄膜发射峰为453nm)、化合物dmac-tapi(溶液发射峰为443nm,薄膜的发射峰为455nm)及化合物dpac-tapi(溶液发射峰为443nm,薄膜的发射峰为451nm)在薄膜状态下同样具有10nm左右的红移。
[0110]
实施例9
[0111]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dpac-tabi)的oleds器件性能
[0112]
利用实施例2制备得到的基于2,6-二叔丁基蒽的蓝光有机半导体材料dpac-tabi(蓝光波长=441nm,固态荧光量子产率=47.3%)作为发光材料制备得到非掺杂器件,并对其器件性能进行测试表征,结果见图2a、图2b和图2c。
[0113]
非掺杂器件结构:ito/hatcn(5nm)/tapc(50nm)/tcta(5nm)/dpac-tabi(20nm)/tmpypb(40nm)/lif(1nm)/al。
[0114]
图2a为利用实施例2基于2,6-二叔丁基蒽的蓝光有机半导体材料制备得到的非掺杂oleds器件的j-v-l曲线图。从图中可以看出,基于dpac-tabi的非掺杂器件的最大亮度高并且启动电压低,分别为2581cd/m
2
,3.0v。
[0115]
图2b为利用实施例2基于2,6-二叔丁基蒽的蓝光有机半导体材料制备得到的非掺杂oleds器件的电流密度和功率密度随亮度变化的曲线图,以及dpac-tabi的电致发光光谱图。从图中可以看出,基于dpac-tabi的非掺杂器件的电流和功率稳定,其电致发光发射峰为450nm。
[0116]
图2c为利用实施例2基于2,6-二叔丁基蒽的蓝光有机半导体材料制备得到的非掺杂oleds器件的效率随亮度变化的曲线图。从图中可以看出,基于dpac-tabi的非掺杂器件具有良好的效率且效率滚降低,其最大外部量子效率为5.81%;当亮度为1000cd/m
2
时,外部量子效率为2.95%。
[0117]
实施例10
[0118]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dmac-tapi)的oleds器件性能
[0119]
利用实施例3制备得到的基于2,6-二叔丁基蒽的蓝光有机半导体材料dmac-tapi(蓝光波长=443nm,固态荧光量子产率=49.5%)作为发光材料制备得到非掺杂器件,并对其器件性能进行测试表征,结果见图2a、图2b和图2c。
[0120]
非掺杂器件结构:ito/hatcn(5nm)/tapc(50nm)/tcta(5nm)/dmac-tapi(20nm)/tmpypb(40nm)/lif(1nm)/al。
[0121]
图2a为利用实施例3基于2,6-二叔丁基蒽的蓝光有机半导体材料制备得到的非掺杂oleds器件的j-v-l曲线图。从图中可以看出,基于dmac-tapi的非掺杂器件的最大亮度高并且启动电压低,分别为5051cd/m
2
,3.0v。
[0122]
图2b为利用实施例3基于2,6-二叔丁基蒽的蓝光有机半导体材料制备得到的非掺杂oleds器件的电流密度和功率密度随亮度变化的曲线图,以及dmac-tapi的电致发光光谱图。从图中可以看出,基于dmac-tapi的非掺杂器件的电流和功率稳定,其电致发光发射峰为454nm。
[0123]
图2c为利用实施例3基于2,6-二叔丁基蒽的蓝光有机半导体材料制备得到的非掺杂oleds器件的效率随亮度变化的曲线图。从图中可以看出,基于dmac-tapi的非掺杂器件具有良好的效率且效率滚降低,其最大外部量子效率为3.97%;当亮度为1000cd/m
2
时,外
部量子效率为2.69%。
[0124]
实施例11
[0125]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dmac-tabi)的oleds器件性能
[0126]
利用实施例1制备得到的基于2,6-二叔丁基蒽的蓝光有机半导体材料dmac-tabi(蓝光波长=439nm,固态荧光量子产率=36.6%)作为发光材料制备得到非掺杂器件(非掺杂器件结构:ito/hatcn(5nm)/tapc(50nm)/tcta(5nm)/dpac-tabi(20nm)/tmpypb(40nm)/lif(1nm)/al),并对其器件性能进行测试表征,其启动电压为3.0v、外部量子效率为3.17%、最大亮度为1628cd/m
2
、电致发光发射峰为448nm。
[0127]
实施例12
[0128]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(dpac-tapi)的oleds器件性能
[0129]
利用实施例4制备得到的基于2,6-二叔丁基蒽的蓝光有机半导体材料dpac-tapi(蓝光波长=443nm,固态荧光量子产率=27.6%)作为发光材料制备得到非掺杂器件(非掺杂器件结构:ito/hatcn(5nm)/tapc(50nm)/tcta(5nm)/dpac-tabi(20nm)/tmpypb(40nm)/lif(1nm)/al),并对其器件性能进行测试表征,其启动电压为3.0v、外部量子效率为4.45%、最大亮度为2784cd/m
2
、电致发光发射峰为464nm。
[0130]
实施例13
[0131]
基于2,6-二叔丁基蒽的蓝光有机半导体材料(tpe-tabc)的oleds器件性能
[0132]
利用实施例5制备得到的基于2,6-二叔丁基蒽的蓝光有机半导体材料tpe-tabc(蓝光波长=449nm,固态荧光量子产率=37.3%)作为发光材料制备得到非掺杂器件(非掺杂器件结构:ito/hatcn(5nm)/tapc(50nm)/tcta(5nm)/dpac-tabi(20nm)/tmpypb(40nm)/lif(1nm)/al),并对其器件性能进行测试表征,其启动电压为3.2v、外部量子效率为2.60%、最大亮度为1929cd/m
2
、电致发光发射峰为460nm。
[0133]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



