人类重链伪γ基因编码的新型IGG5类重组免疫球蛋白的制作方法
 2021-02-02 13:02:53|
2021-02-02 13:02:53| 383|
383| 起点商标网
起点商标网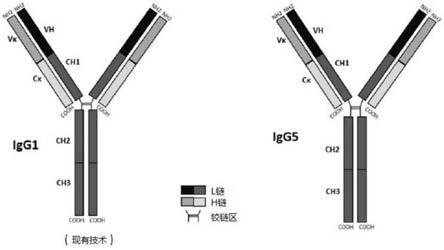
人类重链伪
γ
基因编码的新型igg5类重组免疫球蛋白
技术领域
[0001]
本发明涉及医学领域,尤其涉及人类免疫球蛋白的新结构,这种人类免疫球蛋白由先前被视为未表达的假基因(即,伪γ基因)所编码。已知四种免疫球蛋白g类,分别为igg1,igg2,igg3和igg4 1
(vidarsson,g.,dekkers,g.&rispens,t.igg subclasses and allotypes:from structure to effector functions.front.immunol.5,520(2014))。本发明展示了表示伪γ基因的非常规手段,同时显示了这种假基因编码的产物可以提供用于人的免疫疗法的新工具,从而定义了另外的igg5类别。
背景技术:
[0002]
免疫治疗是研究的一个非常活跃的领域,在癌症治疗、感染性疾病和炎症性疾病方面都有多重发展。靶向肿瘤特异性抗原或免疫检查点的抗体已完全改变了许多肿瘤类型的预后,可长期缓解,并最终将致命疾病转变为几乎受免疫系统控制的慢性疾病。使用单克隆抗体治疗自身免疫性疾病也已完全改变了这些疾病的预后。
[0003]
虽然抗体分子已成为对抗癌症和其他人类疾病的主要工具,但目前可用分子的多样性仅限于igm和四种已知的人类igg类(igg1、igg2、igg3和igg4),每种均具有独特的功能特性(vidarsson,g.,dekkers,g.&rispens,t.igg subclasses and allotypes:from structure to effector functions.front.immunol.5,520(2014))。尽管可以对igg重链的结构进行各种突变以调节其功能,但可能产生的变化的范围固有地受到创建新的免疫原性表位的风险的限制。
[0004]
人类基因组中仅存在编码人igg重链的四个功能基因,而第五个同源基因被标记为“伪γ”,并且解释到,由于缺乏能够在表达之前支持足够重组的足够的侧翼“开关”区域,该第五个同源基因缺乏任何的表达(lefranc,m.p.,lefranc,g.&rabbitts,t.h.inherited deletion of immunoglobulin heavy chain constant region genes in normal human individuals.nature 300,760
–
762(1982);and bensmana,m.,huck,s.,lefranc,g.&lefranc,m.p.the human immunoglobulin pseudo-gamma ighgp gene shows no major structural defect.nucleic acids res.16,3108(1988))。
技术实现要素:
[0005]
第一方面,本发明涉及一种重组核酸分子,其包含:
[0006]-编码免疫球蛋白重链可变区(v
h
)的序列;
[0007]-编码免疫球蛋白轻链可变区(v
l
)的序列;
[0008]-编码轻链恒定区(c
l
)的序列;
[0009]-编码免疫球蛋白重链恒定区(c
h
)的序列,该序列与人类伪γ(ψγ)基因编码的ch1,铰链,ch2和ch3蛋白结构域相对应。
[0010]
优选地,所述编码免疫球蛋白重链恒定区的序列编码三个或四个免疫球蛋白重链恒定结构域。
[0011]
所述编码免疫球蛋白重链恒定区的序列可以仅编码一部分伪γ重链恒定结构域。
[0012]
所述重组核酸分子还可以包含另外的多核苷酸,用于通过在精确位置处同源重组进入宿主细胞的基因组中来指导核酸分子的整合。
[0013]
而且,所述重组核酸分子还可以包含另外的多核苷酸,以表达为单链抗体或杂合抗体,该杂合抗体整合有与经典igg1、igg2、igg3或igg4人igg类同源的一些恒定结构域。
[0014]
例如,所述组合核酸分子可以包含肽接头,肽接头可以将抗体重链和轻链融合成单链抗体分子。
[0015]
另一方面,本发明涉及一种表达盒,其包含可操作地连接至一个或多个控制序列的本发明的重组核酸分子,所述一个或多个控制序列在与所述控制序列相容的条件下指导所述核酸在合适的宿主细胞中的表达。
[0016]
所述重组核酸分子尤其可与免疫球蛋白vh启动子可操作地连接。
[0017]
另一方面,本发明涉及包含本发明的表达盒的载体。载体优选是病毒载体,更优选逆转录病毒载体,甚至更优选慢病毒载体。
[0018]
在优选的实施方案中,所述载体是腺相关病毒(aav)载体,优选aav6载体。
[0019]
另一方面,本发明涉及包含本发明载体的病毒颗粒。
[0020]
另一方面,本发明涉及分离的细胞,其包含本发明的重组核酸分子、表达盒、载体或病毒颗粒。
[0021]
在优选的实施方案中,所述分离的细胞是小鼠胚胎干细胞。
[0022]
在另外优选的实施方案中,所述分离的细胞是b细胞,优选人b细胞。
[0023]
另一方面,本发明涉及非人动物转基因生物,其包含至少一个本发明的细胞,优选地所述转基因生物是小鼠。
[0024]
另一方面,本发明涉及一种抗体,其包含:
[0025]-免疫球蛋白重链可变区(vh);
[0026]-免疫球蛋白轻链可变区(vl);
[0027]-免疫球蛋白轻链恒定区(cl);
[0028]-免疫球蛋白重链恒定区(ch),包括由人免疫球蛋白伪γ基因编码的全部或部分肽。
[0029]
本发明的所述抗体可包含:
[0030]-免疫球蛋白重链可变区(vh);
[0031]-免疫球蛋白轻链可变区(vl);
[0032]-免疫球蛋白轻链恒定区(cl);
[0033]-免疫球蛋白重链恒定区(ch),其与人假γ恒定免疫球蛋白基因同源,以及编码肽接头的序列同源,其中重链和轻链序列融合成单个肽。
[0034]
本发明还涉及产生本发明抗体的方法,其包括:提供本发明的细胞或转基因生物,所述细胞或生物表达所述抗体,培养所述宿主细胞或使所述生物生长,并从所述细胞培养物中或从所述生物样本中回收所述抗体。
[0035]
另一方面,本发明还涉及一种药物组合物,其包含重组核酸分子,表达盒,载体,病毒颗粒,本发明的细胞或本发明的抗体以及药学上可接受的赋形剂。
附图说明
[0036]
图1a-本发明的免疫球蛋白g1类(左,现有技术)和igg5类型(右)的示意图。与已知的igg类相比,igg5恒定域是由人免疫球蛋白重链伪γ基因编码的。igg5和g1类之间存在很多差异,但是就结构上的差异而言,igg5的铰链结构域有所不同,并且比igg1的铰链结构域略长。
[0037]
图1b
–
5种igg类蛋白质序列(ch1、铰链、ch2和ch3)的比对。灰色框突出显示了igg5和igg1之间的差异。
[0038]
图2:利妥昔单抗的vdj序列与人免疫球蛋白重链伪γ基因连接。该序列的合成购自genecust公司,并插入到pcdna3.4(+)载体(a)中。利妥昔单抗的v
k
j
k
和c
k
序列在第二个载体(b)中平行表达。
[0039]
图3:通过elisa方法分析了转染的cho-s细胞系的上清液。上清液中的igg5分子被包被在96孔板上的抗fc多克隆抗体捕获。通过添加ap偶联的抗igg(h+l)多克隆抗体进行检测。igg1重组蛋白用作阳性对照,而阴性对照是igm类重组分子。
[0040]
图4:流式细胞仪分析:在阳性cd20细胞系(el4-cd20)或阴性对照:el4上检测igg5抗cd20。将靶el4和el4-hcd20细胞系与纯化的igg5以10μg/ml的浓度在2-8℃下孵育1小时。洗涤后,将荧光pe多克隆山羊抗higg fc特异性抗体在2-8℃下孵育30分钟。在15分钟内,将细胞用1%pfa固定,并洗涤细胞,然后在fortessa流式细胞分析仪上进行流量分析。
具体实施方式
[0041]
本文的发明人提供了指示实际上将人类伪γ基因不当地视为伪基因的要素,因为从未在蛋白质水平上鉴定出其基因蛋白,并且该基因被描述为缺少侧翼的上游转换区,这种缺少排除正常类别的转换重组和表达(bensmana,m.,huck,s.,lefranc,g.&lefranc,m.p.the human immunoglobulin pseudo-gamma ighgp gene shows no major structural defect.nucleic acids res.16,3108(1988))3。发明人表明,尽管缺乏转换区,但实际上仍然可以在人类中检测到允许在伪基因上游重组的dna断裂。他们还表明,还可以通过灵敏的专用方法检测与重排的vdj区域和伪γ基因恒定序列相关的伪γ基因的功能转录本,证明伪γ基因在人体内的低水平表达。由于这些出乎意料的发现,人类伪γ基因的产物将在人体内被耐受,而不被认为是外源或异常的肽。证明这种肽序列可以在人体内表达并且是非免疫原性的,这可以打破一个局面,并可以制定出将这类新型igg用于人体免疫疗法作为分泌抗体的策略。实际上,发明人还证明了这种所谓的igg5类的重组免疫球蛋白可以表达为重组抗体,并且在结构上与经典的igg1完全免疫球蛋白高度相似。通过使用表达载体获得该分子,该表达载体的一侧编码与伪γ恒定外显子融合的免疫球蛋白vdj序列,表达载体的另一侧编码与光恒定区的c末端融合的轻链可变区(图1a)。如本申请的实验部分所示,发明人证明了用编码所述免疫球蛋白igg5的核酸转化的cho-s细胞可以产生重组抗体,并且还证明了该抗体可以识别其抗原。
[0042]
因此,第一方面,本发明涉及一种重组核酸分子,其包含以下序列或由以下序列组成:
[0043]-编码免疫球蛋白重链可变区(v
h
)的序列;
[0044]-编码免疫球蛋白重链伪γ基因恒定区(ψγc
h
)的序列;
[0045]-编码免疫球蛋白轻链可变区(v
l
)的序列;
[0046]-编码轻链恒定区(c
l
)的序列。
[0047]
如本文所用,术语“核酸分子”,“核酸”和“多核苷酸”可互换使用,并且是指任何长度的聚合形式的核苷酸,即核糖核苷酸或脱氧核糖核苷酸。因此,该术语包括但不限于单链,双链或多链dna或rna,基因组dna,cdna,dna-rna混合物或包含嘌呤碱基和嘧啶碱基的聚合物,或其他天然,化学或生化修饰,非天然或衍生的核苷酸碱基。多核苷酸的主链可包含糖和磷酸基团(通常可在rna或dna中发现),或修饰或取代的糖或磷酸基团。或者,多核苷酸的主链可包含合成亚基的聚合物,例如氨基磷酸酯,因此可以是寡脱氧核苷氨基磷酸酯(p-nh
2
)或混合的氨基磷酸酯-磷酸二酯低聚物。可以通过本领域技术人员已知的任何方法来制备本发明的核酸,这些方法包括化学合成、重组和诱变。在优选的实施方案中,本发明的核酸是dna分子,优选双链dna分子,其中可以通过本领域技术人员公知的重组方法合成该dna分子。
[0048]“重组核酸”是指已被工程化且在自然环境中,特别是在野生型生物中未发现的核酸。
[0049]
本发明的核酸分子包含编码免疫球蛋白重链可变区(v
h
)的序列和编码免疫球蛋白轻链可变区(v
l
)的序列。
[0050]
抗体的“可变区”或“可变结构域”是指抗体重链或轻链的氨基末端结构域。术语“免疫球蛋白重链可变区”或“重链可变结构域”可以称为“v
h”。术语“免疫球蛋白轻链可变区”或“轻链可变结构域”可以称为“v
l”。这些结构域通常是抗体变化最大的部分,并包含抗原结合位点。
[0051]
轻链或重链可变区(v
l
或v
h
)由三个称为“互补决定区”或“cdr”的高变区中断的框架区组成。框架区和cdr的范围已被精确地定义,例如在kabat中就已精确地对此进行了定义(参见“sequences of proteins of immunological interest,"e.kabat et al.,u.s.department of health and human services,(1983)”)。抗体的框架区,即组成轻链和重链的组合框架区,用于定位和排列主要负责与抗原结合的cdr。
[0052]
本发明的核酸分子包含编码轻链恒定区(c
l
)的序列。
[0053]
如本文所定义的“恒定区”是指抗体来源的恒定区,其由轻或重链免疫球蛋白恒定区基因中的其中一个所编码。
[0054]
如本文所用,“免疫球蛋白轻链恒定区”,“恒定轻链”或“轻链恒定区”是指由κ(cκ)或λ(cλ)轻链编码的抗体的区域,并且其可被称为为“c
l”。恒定轻链通常包含单个结构域。
[0055]
在一些实施方案中,本发明的核酸分子可以包含以下序列或由以下序列组成:
[0056]-编码免疫球蛋白重链可变区(v
h
)的序列;
[0057]-编码免疫球蛋白轻链可变区(v
l
)的序列;
[0058]-编码轻链恒定区(c
l
)的序列;
[0059]-编码全部或部分免疫球蛋白重链伪γ恒定区(ψγc
h
)的序列;和
[0060]-编码肽接头的序列,以将igg5或igg5片段表达为单链ig。
[0061]
如本文所用,“免疫球蛋白重链恒定区”,“恒定重链”或“重链恒定区”是指由μ,δ,γ,α或ε基因编码以将抗体同种型分别定义为igm、igd、igg、iga或ige的区域。该区域可被称为“c
h”。
[0062]
恒定重链通常包含三个或四个结构域。为了说明,对于全长igd,igg或iga抗体,本文所定义的恒定重区是指ch1结构域的n端至ch3结构域的c端之间的区域,并且对于全长ige或igm抗体,本文所定义的恒定重区是指ch1结构域的n端至ch4结构域的c端之间的区域。
[0063]
或者,c
h
区可包含全长抗体的恒定重链的片段或由其组成。例如,c
h
区可以包含一个或两个结构域,例如ch1和/或ch2,由其组成。
[0064]
本发明的核酸分子包含伪γ基因的至少一部分。
[0065]
另一方面,本发明涉及一种表达盒,其包含可操作地连接至一个或多个控制序列的本发明的重组核酸分子,所述一个或多个控制序列在与所述控制序列相容的条件下指导所述核酸在合适的宿主细胞中的表达。
[0066]
术语“控制序列”是指基因表达所必需的核酸序列。控制序列可以是天然的(可操作地连接至天然存在的基因组中的编码序列)或异源的(不同于可操作地连接至天然存在的基因组中的编码序列的控制序列)。这样的控制序列包括但不限于前导序列、聚腺苷酸化序列、启动子、信号肽序列和转录终止子。
[0067]
如本文所用,术语“可操作地连接”是指单个核酸分子上的核酸序列的缔合,从而一个核酸序列的功能受到另一个核酸序列的功能的影响。例如,当启动子能够影响该编码序列的表达时,即该编码序列在该启动子的转录控制下,该启动子与该编码序列可操作地连接。
[0068]
如本文所用,术语“表达盒”是指包含编码序列和表达所述编码序列所需的一个或多个控制序列的核酸构建体。通常,表达盒包含表达目的基因产物所需的编码序列和在编码序列之前(5'非编码序列)和之后(3'非编码序列)的调控序列。因此,表达盒通常包含通常含有聚腺苷酸化位点和/或转录终止子的启动子序列、5'非翻译区、编码序列和3'非翻译区。所述表达盒还可包含其他调控元件,例如增强子序列,促进dna片段在载体内插入和/或剪接信号序列的多位点接头序列。表达盒通常包含在载体中,以促进克隆和转化。
[0069]
在一个特定的实施方案中,本发明的重组核酸与预期的宿主细胞的免疫球蛋白v
h
启动子,优选免疫球蛋白v
h
启动子可操作地连接。这样的启动子可被技术人员轻松选到。
[0070]
本发明的表达盒还可以包含其他序列,用于通过同源重组在精确位置指导其整合进入宿主细胞的基因组。可以按照上述定义重组核酸分子的方式来定义这些序列。
[0071]
在这方面,重组核酸分子的所有实施方案也是预期的。
[0072]
另一方面,本发明涉及包含本发明的重组核酸分子或表达盒的载体。
[0073]“载体”是指核酸分子,优选dna分子,dna分子例如来自质粒、噬菌体或病毒,核酸序列可插入或克隆于其中。载体的非限制性实例包括质粒、噬菌体、粘粒、噬菌粒、酵母人工染色体(yac)、细菌人工染色体(bac)、人类人工染色体(hac)、病毒载体例如腺病毒载体或逆转录病毒载体,以及通常用于基因工程和/或能够将所需的dna序列传递至宿主细胞内的所需位置的其他dna序列。
[0074]
载体优选包含一个或多个限制位点,并且能够在包括靶细胞或组织或其祖细胞或组织的限定宿主细胞中自主复制,或者与限定宿主的基因组部分或完全整合,从而克隆的序列是可重现的。因此,载体可以是自主复制载体,即作为染色体外实体存在的载体,这种复制与染色体复制是两码事,例如,线性或封闭的环状质粒、染色体外元件、微型染色体或
人工染色体。载体可以包含确保自我复制的任何手段。可选择地,载体可以是这样一种载体,即在将载体引入宿主细胞时,该载体被整合到基因组中并与已经整合到其中的染色体一起复制。如何选择载体通常取决于载体与将载体引入其中的宿主细胞的相容性。
[0075]
载体还可以包含一种或多种核酸序列,这些核酸序列编码选择性标记物例如营养缺陷标记物(例如leu2、ura3、trp 1或his3),可检测标记物例如荧光或发光蛋白(例如gfp、egfp、dsred、cfp),或赋予对化学/有毒化合物抗性的蛋白质(例如,赋予对替莫唑胺抗性的mgmt基因)。这些标记物可以用于选择或检测包含载体的宿主细胞,并且技术人员可以根据宿主细胞简单选择这些标记物。
[0076]
本发明的载体优选是病毒基因组载体,其包括在宿主细胞中建立本发明的重组核酸分子表达所需的任何元件,例如启动子、itr、核糖体结合元件、终止子、增强子、选择标记、内含子、polya信号和/或复制起点。
[0077]
在一些实施方案中,所述载体是病毒载体,例如衍生自莫洛尼氏鼠白血病病毒载体(momlv),mscv,sffv,mpsv或snv,慢病毒载体(例如衍生自人免疫缺陷病毒(hiv)、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)或马传染性贫血病毒(eiav)),腺病毒(ad)载体、腺相关病毒(aav)载体,猿猴病毒40(sv-40)载体,牛乳头瘤病毒载体,爱泼斯坦-巴尔病毒,疱疹病毒载体,牛痘病毒载体,哈维鼠肉瘤病毒载体,鼠乳腺肿瘤病毒载体,劳斯肉瘤病毒载体。
[0078]
在特定实施方案中,载体是逆转录病毒载体,优选慢病毒载体或非病原性细小病毒。
[0079]
如本领域中已知的,取决于考虑使用的特定病毒载体,应将适当的序列引入本发明的载体中以获得功能性病毒载体,例如用于aav载体的aav itr或用于慢病毒载体的ltr。
[0080]
可通过技术人员已知的任何方法将本发明的重组核酸分子或表达盒引入载体。
[0081]
在这方面也考虑了本发明的重组核酸分子和表达盒的所有实施方案。
[0082]
本发明的载体可以包装到病毒衣壳中以产生“病毒颗粒”。因此,另一方面,本发明还涉及包含本发明载体的病毒颗粒。
[0083]
在这方面,也考虑了本发明的重组核酸分子、表达盒或载体的所有实施方案。
[0084]
另一方面,本发明还涉及分离的宿主细胞,其包含本发明的经转化或转染的表达盒、载体或病毒颗粒。
[0085]
所述宿主细胞可以包含一种或几种本发明的重组核酸、表达盒或载体。
[0086]
术语“宿主细胞”还涵盖由于复制期间发生的突变而与亲本宿主细胞不同的亲本宿主细胞的任何后代。
[0087]
术语“细胞”或“宿主细胞”包含适合于表达本发明的重组核酸分子的任何细胞。用于表达编码抗体的载体的合适的宿主细胞包含本文所述的原核或真核细胞。
[0088]
例如,可以在细菌中产生抗体,特别是在不需要糖基化和fc效应子功能时产生抗体。关于抗体片段和多肽在细菌中的表达,参见,例如,美国专利no.5,648,237,5,789,199和5,840,523。(同样参见charlton,methods in molecular biology,vol.248(b.k.c.lo,ed.,humana press,totowa,nj,2003),pp.245-254,描述了抗体片段在大肠杆菌中的表达)。表达后,可以从细菌细胞裂解物中分离可溶级分的抗体,并可以进一步纯化抗体。
[0089]
除原核生物外,真核微生物(例如丝状真菌或酵母菌)也是编码抗体的载体的合适
表达宿主,包括其糖基化途径已被“人源化”的真菌和酵母菌,从而产生具有部分或完全人类糖基化模式的抗体。参见gerngross,nat.biotech.22:1409-1414(2004),and li et al.,nat.biotech.24:210-215(2006)。
[0090]
用于表达糖基化抗体的合适宿主细胞也来自多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的例子包括植物和昆虫细胞。已经鉴定出许多杆状病毒株,它们可以与昆虫细胞结合使用,特别用于草地贪夜蛾细胞的转染。植物细胞培养物也可以用作宿主。参见,例如,美国专利no.5,959,177,美国专利no.6,040,498,美国专利no.6,420,548,美国专利no.7,125,978和美国专利no.6,417,429。
[0091]
脊椎动物细胞也可以用作宿主。例如,适于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他例子是由sv40(cos-7)转化的猴肾cv1系;人类胚胎肾细胞系(293或293细胞,如graham等,j.gen virol.36:59(1977)中所述);幼仓鼠肾细胞(bhk);小鼠sertoli细胞(tm4细胞,例如在mather,biol.reprod.23:243-251(1980)中所述);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck;水牛大鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤(mmt 060562);tri细胞,如mather等人所述,annals n.y.acad.sci.383:44-68(1982);mrc 5细胞;和fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub et al,proc.natl.acad.sci.usa 77:4216(1980))和骨髓瘤细胞系,例如y0,ns0和sp2/0。对于某些适于产生抗体的哺乳动物宿主细胞系的综述,参见,例如(yazaki and wu,methods in molecular biology,vol.248(b.k.c.lo,ed.,humana press,totowa,nj),pp.255-268(2003))。
[0092]
在一特定的实施方案中,所述宿主细胞选自分枝杆菌细胞、真菌细胞、酵母细胞、植物细胞、昆虫细胞、非人类动物细胞、人类细胞或细胞融合体,例如杂交瘤。优选地,该细胞选自人、灵长动物,兔或啮齿动物(例如,小鼠、大鼠、仓鼠、豚鼠)细胞。更优选地,该细胞选自人和小鼠细胞。更优选地,细胞是人细胞。
[0093]
在一优选的实施方案中,细胞是b细胞,优选人或小鼠b细胞,更优选人b细胞。
[0094]
宿主细胞,优选非人细胞,也可以是全能,多能或成体干细胞,合子或体细胞。在一个实施方案中,宿主细胞是胚胎干细胞,优选为非人类胚胎干细胞,更优选为小鼠胚胎干细胞。
[0095]
可使用任何已知技术将本发明的表达盒或载体转移到宿主细胞中,所述技术包括但不限于磷酸钙-dna沉淀法,deae-右旋糖酐转染,电穿孔,显微注射,生物弹射,脂质转染或病毒感染,同时本发明的表达盒或载体可以异位形式维持在宿主细胞中或可以整合到基因组中。
[0096]
在优选实施方案中,通过病毒感染将本发明的表达盒或载体转移到宿主细胞中,优选使用本发明的病毒颗粒,更优选使用本发明的aav颗粒将本发明的表达盒或载体转移到宿主细胞中。
[0097]
在这方面也考虑了本发明的重组核酸分子、表达盒、载体或病毒颗粒的所有实施方案。
[0098]
另一方面,本发明还涉及转基因生物,优选非人类转基因生物,其包含至少一个本发明的宿主细胞。本发明还涉及产生包含至少一个本发明的转基因宿主细胞的转基因生物
的生产方法。
[0099]
在这方面也考虑了本发明的重组核酸分子、表达盒、载体、病毒颗粒和宿主细胞的所有实施方案。
[0100]
具体地说,该生物可以是非人类动物,例如灵长类动物(例如,非人类灵长类动物,例如猴子),兔子或啮齿动物(例如,小鼠、大鼠、仓鼠、豚鼠)。优选地,所述转基因生物是非人类哺乳动物。更优选地,转基因生物是小鼠。
[0101]
产生转基因生物,特别是转基因小鼠的方法是技术人员所公知的。应当理解,这些方法中的任何一种方法都可以用于实施本发明,并且本文公开的方法是非限制性的。
[0102]
特别地,产生转基因生物的方法可以包括:
[0103]-在非人类胚胎干细胞中引入本发明的表达盒或载体;
[0104]-获得转基因胚胎干细胞,其中优选通过同源重组将本发明的重组核酸分子插入基因组中;
[0105]-将所述转基因胚胎干细胞注射到非人类动物的胚泡中以形成嵌合体;以及
[0106]-将所述注射的胚泡重新植入养母中。
[0107]
通常从体外培养的植入前胚胎中获得胚胎干(es)细胞。优选地,通过电穿孔将本发明的盒或载体转染到所述es细胞中。使用现有技术中已知的方法培养es细胞并准备用于转染。将被本发明的盒或载体转染的es细胞来自同一物种的胚胎或胚泡,该胚胎或胚泡作为es细胞将引入其中的发育中的胚胎或胚泡。通常选择es细胞,因为它们在发育的胚泡阶段被引入胚胎中的动物时,能够整合到内部细胞团中并有助于个体的种系。在一实施方案中,从小鼠胚泡中分离出es细胞。
[0108]
本发明的重组核酸分子转染到es细胞中后会与细胞的基因组dna整合,以产生如下定义的本发明的抗体。
[0109]
转染后,在合适的条件下培养es细胞以检测转染细胞。例如,当盒或载体包含标志物基因,例如抗生素抗性基因,例如新霉素抗性基因,在该抗生素中培养细胞。可以使用southern blot技术分析存活的es细胞的dna和/或蛋白质表达,以验证盒的正确整合。
[0110]
然后将选择的es细胞注射到非人类动物的胚泡中以形成嵌合体。非人类动物优选是小鼠、仓鼠、大鼠或兔子。更优选地,非人类动物是小鼠。
[0111]
具体地,可以使用显微注射将es细胞插入早期胚胎。将注入的胚泡重新植入养母中。当子代出生时,使用southern blot和/或pcr技术对本发明的重组核酸分子、表达盒或载体的存在与否进行筛选。鉴定杂合子,然后杂合子彼此杂交以产生纯合子动物。
[0112]
在另一实施方案中,产生转基因生物的方法可以包括:
[0113]-在非人受精卵中引入:(i)本发明的表达盒或载体和,(ii)用于通过同源重组将盒或载体靶向正确位点的核酸酶系统;
[0114]-获得转基因受精卵,其中本发明的表达盒或载体通过同源重组插入基因组中;以及
[0115]-将所述注射的受精卵重新植入养母中。
[0116]
用于将盒或载体靶向正确位置的核酸酶系统可以是技术人员已知的任何合适的系统,例如涉及zfn、tale或crispr/cas9核酸酶的系统。
[0117]
优选地,所述核酸酶系统是crispr/cas9系统。要使用cas9修饰基因组序列,可以
将蛋白质直接递送至细胞。或者,可以将编码cas9的mrna递送至细胞,或者可以将提供编码cas9的mrna表达的基因递送至细胞。另外,靶标特异性crrna和tracrrna或靶标特异性grna可被递送至细胞(这些rna可替代地由构建为表达这些rna的基因产生)。靶位点的选择和crrna/grna的设计是本领域公知的。
[0118]
本发明还提供了来自本发明的转基因非人类动物及其子代的细胞或组织,包括永生细胞系和原代细胞或组织。
[0119]
在另一方面,本发明涉及一种抗体,其包含:
[0120]-免疫球蛋白重链可变区(v
h
);
[0121]-免疫球蛋白轻链可变区(v
l
);
[0122]-免疫球蛋白轻链恒定区(c
l
);
[0123]-来自伪γ基因的部分或全部免疫球蛋白重链恒定区(c
h
)。
[0124]
具体而言,本发明的抗体可以是通过表达本发明的重组核酸分子的编码序列获得的任何抗体。
[0125]
在这方面也考虑了本发明的重组核酸分子、表达盒、载体、病毒颗粒、宿主细胞和转基因动物的所有实施方案。
[0126]
从广义角度来使用本文的术语“抗体”,并且抗体特别涵盖单克隆抗体(包括全长单克隆抗体),多克隆抗体,多特异性抗体(例如双特异性抗体),抗体片段及其衍生物,只要抗体包含链,其中该链包含v
h
,v
l
,c
l
,伪γc
h
。
[0127]
本发明的抗体可以是仅包含一条链的单链抗体,该一条链包含v
h
,v
l
,c
l
,部分或全部伪γc
h
。或者,本发明的抗体可包含至少两条链,所述两条链包含v
h
,v
l
,c
l
,部分或全部伪γc
h
以及如上定义的经典ig的一部分,从而产生混合的igg分子。
[0128]
在一些实施方案中,所述抗体可以是较大融合分子的一部分,该较大融合分子是通过抗体与一种或多种其他蛋白质或肽的共价或非共价缔合形成的。具体地,本发明的抗体还可以包含另外的抗体结构域,例如,其他重链和轻链结构域。
[0129]
在一些实施方案中,所述抗体是全长抗体。如本文所用,术语“全长抗体”是指具有与天然抗体结构基本相似的结构的抗体,而不是如下定义的抗体片段。该术语特别指具有包含fc区的重链的抗体。在优选的实施方案中,所述抗体为全长igg5抗体。
[0130]
在一些实施方案中,所述抗体是抗体片段。如本文所用,术语“抗体片段”是指全长抗体的一部分,优选地包括包含重链、轻链的可变结构域和恒定伪-γ重链的n末端的至少一个片段的片段。抗体片段优选选自fab、fab'、f(ab)
2
,f(ab')
2
和f(ab)
3
。
[0131]
抗体片段可以通过多种技术制备,这些技术包括但不限于技术人员所公知的完整抗体的蛋白水解消化,以及本文所述的重组技术。木瓜蛋白酶消化抗体会产生两个相同的抗原结合片段,称为“fab”片段和残留的“fc”片段,每个“fab”片段都有一个抗原结合位点,而其名称反映了其易于结晶的能力。胃蛋白酶处理产生具有两个抗原结合位点并且仍能够交联抗原的f(ab')2片段。
[0132]
本文所用的“fab”,“fab片段”或“fab区”是指包含v
h
,ch1,v
l
和c
l
免疫球蛋白结构域的多肽。fab可指分离的该区域或本文所述多肽的上下文中的该区域。
[0133]
fab'片段与fab片段的区别在于在重链ch1结构域的羧基末端添加了一些残基,包括来自抗体铰链区的一个或多个半胱氨酸。f(ab')2抗体片段最初是成对的fab'片段,它们
之间具有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。
[0134]
如本文所用,术语“抗体衍生物”是指本文提供的抗体,例如,全长抗体或抗体片段,其中一个或多个氨基酸经过化学修饰,例如通过烷基化,聚乙二醇化,酰化,酯或酰胺形成等修饰。具体地,该术语可以指本文提供的抗体,其被进一步修饰以包含本领域已知且容易获得的其他非蛋白质部分。适用于抗体衍生的部分包括但不限于水溶性聚合物。水溶性聚合物的实例包括但不限于peg、乙二醇/丙二醇、羧甲基纤维素、葡聚糖和聚乙烯醇的共聚物。
[0135]
所述衍生物也可以是免疫缀合物,其包含与一个或多个异源分子缀合的本发明的抗体,所述异源分子包括但不限于细胞毒性剂,可检测部分例如荧光部分,诊断性放射性同位素或显像剂;或固体支持物,例如琼脂糖珠凳等。细胞毒性剂的实例包括但不限于化学治疗剂或药物,生长抑制剂,毒素(例如蛋白毒素,细菌,真菌,植物或动物来源的酶活性毒素或其片段)或放射性同位素。抗体和细胞毒性剂的缀合物可以使用技术人员所公知的多种双功能蛋白偶联剂来制备。接头可以是“可裂解的接头”,其促进细胞毒性药物在细胞中的释放。例如,可以使用酸不稳定的接头,肽酶敏感的接头,光不稳定的接头,二甲基接头或含二硫键的接头(chari et al.,cancer res.52:127-131(1992))。
[0136]
本发明的抗体可以包含功能性fc区,天然序列fc区或变体fc区。
[0137]“功能性fc区”具有天然序列fc区的效应子功能。示例性的“效应子功能”包括c1q结合;细胞依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞毒性(adcc),吞噬作用,抗体依赖性细胞吞噬作用(adcp),细胞表面受体下调等。此类效应子功能通常需要将fc区与结合域(例如抗体可变域)结合并且可以使用各种众所周知的分析方法进行评估。
[0138]“天然序列fc区”包含与自然界中发现的fc区的氨基酸序列相同的氨基酸序列,优选天然序列人fc区。“变异fc区”包含一种氨基酸序列,这种氨基酸序列由于至少一种氨基酸修饰,优选一个或多个氨基酸取代基而不同于天然序列fc区。优选地,与天然序列fc区或亲本多肽的fc区相比,变异fc区具有至少一个氨基酸取代基,例如,天然序列的fc区或亲本多肽的fc区中的约1至约10个氨基酸取代基,优选约1至约5个氨基酸取代基,本文的变体fc区将优选与天然序列fc区和/或亲本多肽的fc区具有至少约80%的序列同一性,最优选与其具有至少约90%的序列同一性,更优选与其具有至少约95%的序列同一性。
[0139]
在某些实施方式中,本文提供的抗体是多特异性抗体,例如多克隆抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。
[0140]
可以通过在宿主细胞中重组共表达本发明的两个重组核酸分子获得本发明的多特异性抗体,其中这两个重组核酸分子形成本发明的两个单链抗体。这些链通过二硫键自然地结合在一起以形成包含至少两条轻链和至少两条重链的多特异性抗体,所述链的可变结构域识别至少两个不同的表位。
[0141]
在一些实施方案中,所述抗体是纯化的抗体。“纯化的”抗体是已经与其产生环境的组分分离的抗体,优选与其生产细胞和/或其他抗体分离的抗体。具体地,可以通过例如电泳(例如,sds-page,等电聚焦(ief),毛细管电泳)或色谱(例如,离子交换或反向hplc)测定将抗体纯化至大于95%或99%的纯度。如果想要评价抗体纯度的方法的综述,参见,例如,flatman et al.,j.chromatogr.b 848:79-87(2007)例如,可以从包含表达本发明的重组核酸分子的宿主细胞的培养基中纯化抗体。
[0142]
取决于产生本发明或本申请的抗体的方法,本发明的抗体可以是多克隆或单克隆抗体。优选地,抗体是单克隆抗体。如本文所用,术语“单克隆抗体”是指从基本上均质的抗体群体中获得的抗体,即,除了可能以少量存在的可能天然发生的突变以外,构成该群体的各个抗体是相同的。单克隆抗体针对单个抗原位点具有高度特异性。此外,与通常包括针对不同决定簇(表位)的不同抗体的常规(多克隆)抗体制剂相反,每种单克隆抗体针对抗原上的单一决定簇。可以通过技术人员已知的任何方法来制备单克隆抗体。
[0143]
本发明的抗体可以是嵌合,人源化或人抗体。
[0144]“嵌合”抗体是指其中重链和/或轻链的一部分与来自特定物种或属于特定抗体类别或亚类的抗体中相应序列相同或同源的抗体,而链的其余部分与来自另一物种或属于另一种抗体类别或亚类的抗体以及此类抗体的片段中的相应序列相同或同源,只要它们表现出所需的生物学活性即可(morrison et al.,proc.natl.acad sci.usa 81:6851-6855(1984))。优选地,抗体框架的至少一部分是人共有框架序列。
[0145]
非人(例如鼠)抗体的“人源化”形式是嵌合抗体,其包含来自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中受体的高变区残基被来自非人类物种(供体抗体)的高变区残基取代,其中这些非人类物种例如小鼠,大鼠,兔或具有理想的特异性、亲和力和能力的非人灵长类动物。此外,人源化抗体可包含在受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步改善抗体性能。通常,人源化抗体将包含至少一个,通常两个可变域,其中所有或基本上所有高变区与非人免疫球蛋白对应,同时所有或基本上所有fr是人免疫球蛋白序列的fr。人源化抗体还任选包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的恒定区的至少一部分(jones et al.,nature 321:522-525(1986);reichmann et al.,nature 332:323.329(1988);and presta,curr.op.struct.biol.2:593-596(1992))。
[0146]“人抗体”或“完全人抗体”是指以下一种抗体,这种抗体具有与由人产生的抗体的氨基酸序列对应的氨基酸序列和/或已经使用本文公开的任何用于制备人抗体的技术制备而成。人抗体的这一定义特别排除了包含非人抗原结合残基的人源化抗体。
[0147]
在优选实施方案中,本发明的抗体是单克隆抗体,优选人单克隆抗体。
[0148]
本发明的抗体优选是治疗性抗体。治疗性抗体可用于治疗任何疾病,例如癌症、炎性疾病、感染性疾病或自身免疫性疾病。
[0149]
具体而言,本发明的抗体可以包含治疗性抗体,优选经批准的(例如,经ema或fda批准的)治疗性抗体的可变区和/或恒定区。在一个特定的实施方案中,本发明的抗体包含治疗性抗体,优选经批准的治疗性抗体的可变区和恒定区。
[0150]
此类治疗性抗体的实例包括但不限于阿昔单抗、阿达木单抗、阿仑单抗、阿利库单抗、阿特珠单抗、avelumab、巴利昔单抗、贝利单抗、贝伐单抗、bezlotoxumab、博纳吐单抗、本妥昔单抗、brodalumab、康纳单抗、卡罗单抗、西妥昔单抗、达克珠单抗、达雷木单抗、地诺单抗、dinutuximab、dupilumab、度伐单抗、依库丽单抗、艾洛珠单抗、依伏库单抗、戈利木单抗、替伊莫单抗、idarucizumab、英夫利昔单抗、易普利姆玛、ixekizumab、美泊利单抗、那他珠单抗、妥珠单抗、纳武利尤单抗、obiltoxaximab、obinutuzumab、ocrelizumab、奥法木单抗、olaratumab、奥马珠单抗、帕利珠单抗、帕尼单抗、派姆单抗、帕妥珠单抗、雷莫芦单抗、兰尼单抗、瑞利珠单抗、苏金单抗、西妥昔单抗、托珠单抗、付特克单抗、vedolizumab、
sarilumab、利妥昔单抗、inotuzumab、阿达木单抗、吉妥珠单抗、benralizumab、emicizuma和曲妥单抗。
[0151]
本发明还涉及产生本发明的抗体的方法,包括提供本发明的宿主细胞或转基因生物,在适合于抗体表达的条件下培养所述宿主细胞或使所述生物生长,以及任选地从宿主细胞培养物或所述生物的样本中回收抗体。任选地,可以进一步纯化回收的抗体。合适的培养基,培养条件和产生方法是技术人员所公知的,并且可以根据宿主细胞和要产生的抗体简单选择。
[0152]
另一方面,本发明还涉及一种药物组合物,其包含本发明的重组核酸分子,表达盒,载体,病毒颗粒,宿主细胞或抗体,以及药学上可接受的赋形剂。该组合物可以包含本发明的一种或几种重组核酸分子,一种或几种表达盒,一种或几种载体,一种或几种病毒颗粒,一种或几种宿主细胞和/或一种或几种抗体。
[0153]
如本文所用,术语“药物制剂”或“药物组合物”是指这样一种制剂,其形式为允许活性成分的生物活性有效,并且不包含会对受试者产生不可接受的毒性的其它组分,这里的受试者指的是将向其施用该制剂的对象。优选地,这样的制剂是无菌的,即无菌的或不含所有活的微生物及其孢子。
[0154]
如本文所用,术语“药学上可接受的”是指经监管机构或公认的药典例如欧洲药典批准用于动物和/或人类。术语“赋形剂”是指与治疗剂一起施用的稀释剂、佐剂、载体或媒介物。
[0155]
可接受的载体、赋形剂或稳定剂的使用剂量和浓度对接收者而言是无毒的,
[0156]
同时其包括但不限于缓冲剂、稳定剂、防腐剂、等渗剂、非离子型去污剂、抗氧化剂和其他添加剂。
[0157]
如本领域所公知的,药学上可接受的赋形剂是相对惰性的物质,其有助于施用药理学上有效的物质,并且可以以液体溶液或悬浮液,以乳液,或以适于在使用前溶解或悬浮在液体中的固体形式呈现。例如,赋形剂可以赋予形式或稠度,或充当稀释剂。合适的赋形剂包括但不限于稳定剂、湿润剂和乳化剂、用于改变克分子渗透压浓度的盐、包囊剂、ph缓冲物质和缓冲剂。这样的赋形剂包括适合于直接递送到眼睛的任何药剂,可施用这样的赋形剂而不会产生异常毒性。药学上可接受的赋形剂包括但不限于山梨糖醇,各种补间化合物中的任何一种以及诸如水、盐水、甘油和乙醇的液体。其中可以包含药学上可接受的盐,例如,无机酸盐,例如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;以及有机酸的盐,例如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等。第15版的《雷明顿药物科学》中详细描述了药学上可接收的赋形剂。
[0158]
药物组合物的形式,给药途径,剂量和方案取决于要治疗的病症、疾病的严重程度、患者的年龄、体重和性别等。
[0159]
施用的药物剂量可以根据各种参数,特别可以根据所使用的给药方式,相关病理学或期望的治疗持续时间进行调节。
[0160]
本发明的药物组合物可以配制用于外用给药、口服给药、肠胃外给药、鼻内给药、静脉内给药、肌内给药、皮下给药或眼内给药等。
[0161]
优选地,药物制剂是能够注射的制剂。这些制剂尤其可以是等渗的无菌盐溶液(谷氨酸钠或磷酸二氢钠、氯化钠、氯化钾、氯化钙或氯化镁等,或此类盐的混合物),或干燥的,
尤其是冻干的组合物,根据需要,通过添加无菌水或生理盐水后可以将该药物制剂配制注射液。
[0162]
可以通过将所需量的活性化合物与所需的上述各种其他成分掺入到适当的溶剂中,然后过滤灭菌来制备无菌注射液。在用于制备无菌注射液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥法,通过这些方法可以从其先前的无菌过滤溶液中产生活性成分和任何其它所需的成分。
[0163]
除了配制用于肠胃外给药(例如静脉内或肌内注射)的组合物外,其他药学上可接受的形式包括例如口服片剂或其他固体;延时释放胶囊;以及当前使用的任何其他形式。该药物组合物还可以包含一种或几种其它活性化合物。其它活性化合物的实例包括但不限于化学治疗药、抗生素、抗寄生虫剂、抗真菌剂或抗病毒剂。
[0164]
在这方面也考虑了本发明的重组核酸分子、表达盒、载体、病毒颗粒、宿主细胞和抗体的所有实施方案。
[0165]
本发明还涉及用于预防或治疗疾病的本发明的重组核酸分子、表达盒、载体、病毒颗粒、宿主细胞、抗体或药物组合物。
[0166]
本发明涉及本发明的重组核酸分子,表达盒,载体,病毒颗粒,宿主细胞,抗体或药物组合物作为药物治疗疾病的用途。本发明还涉及本发明的重组核酸分子,表达盒,载体,病毒颗粒,宿主细胞或抗体在生产或制备药物中的用途。
[0167]
具体而言,本发明涉及一种治疗受试者的疾病的方法,包括向所述受试者施用有效量的重组核酸分子、表达盒、载体、病毒颗粒、宿主细胞、抗体,或本发明的药物组合物。
[0168]
如本文所用,术语“受试者”或“患者”是指哺乳动物,优选为人类。
[0169]
该疾病可以是可以通过抗体,特别通过本发明的抗体的作用来治疗,预防或减轻的任何疾病。这种疾病的例子包括但不限于癌症、传染病、自身免疫性疾病和炎性疾病。
[0170]
在这方面也考虑了本发明的重组核酸分子,表达盒,载体,病毒颗粒,宿主细胞,抗体和药物组合物的所有实施方案。
[0171]
本发明还涉及用于诊断或检查出疾病的方法中的本发明的重组核酸分子、表达盒、载体、病毒颗粒、宿主细、抗体或药物组合物,优选本发明的抗体。
[0172]
待诊断或检测的基本取决于抗体。
[0173]
该方法可以包括在允许抗体与其抗原结合的条件下(如果样品中存在抗体的情况下),使生物样品与本发明的抗体接触,并检测在抗体与其抗原之间是否形成复合物。这样的方法可以是体外或体内方法。如本文所用,术语“检测”涵盖定量或定性检测。
[0174]
在优选实施方案中,标记用于诊断方法的本发明的抗体。标记包括但不限于直接检测到的标记或部分(例如荧光的,发色团的,电子致密的,化学发光和放射性标记),以及例如,通过酶促反应或分子间相互作用间接检测到的部分(例如酶或配体)。
[0175]
如本说明书中所使用的,术语“约”是指值的范围为规定值的
±
10%,更优选地为值的范围为规定值的
±
5%。例如,“约1”表示当考虑值的范围为规定值的
±
10%时,值在0.9到1.1之间,而当考虑值的范围为规定值的
±
5%,值在0.95到1.05之间。
[0176]
如本文所用,动词“包括”在其非限制性意义上用来表示包括该词之后的项目,但是不排除未特别提及的项目。另外,不定冠词“一”或“一个”所修饰的要素不排除存在一个以上要素的可能性,除非上下文明确要求仅存在一个要素。因此,不定冠词“一”或“一个”通
常表示“至少一个”。
[0177]
本说明书中引用的所有专利和参考文献均通过引用整体并入本文。
[0178]
给出以下实施例是为了说明而不是为了限制。
[0179]
实施例
[0180]
材料和方法
[0181]
构建抗cd20 igg5
[0182]
使用基因合成反应来创建编码抗cd20 igg5(具有来自伪γ基因的恒定序列)的完全合成的盒。可变结构域基于利妥昔单抗序列。为了从igg5类获得抗体,我们设计了一种原始策略,其中:
[0183]-全长v
h
,dj
h
连接至ch1,ch2和ch3组装的外显子,其中根据推测的人假γ基因中未表达的基因确定的所述外显子。然后在该序列之后是聚腺苷酸化位点。
[0184]-利妥昔单抗v j序列后接的是c
k
。然后在该序列之后是聚腺苷酸化位点。
[0185]
最后,在hindiii和ecori位点将构建体克隆到pcdna3.1(+)载体中,该载体包含新霉素基因抗性供选择。
[0186]
生产
[0187]
用质粒载体转染cho和293细胞,并在转染后第二天用0.5至1mg/ml g418互补培养基进行选择。3-4周后,通过酶联免疫吸附测定和流式细胞术筛选上清液,以进行表达。最后在vivaspin上通过离心对上清液进行浓缩处理(截止值为10kda)。
[0188]
表征
[0189]
对于elisa,igg5被多克隆抗人fc特异性抗体捕获,并通过hrp偶联抗人igg(h+l)抗体(均来自sigma aldrich公司)检测得到。
[0190]
对于流式细胞术,在2-8℃的温度下,将100000个表达cd20膜抗原的细胞(或阴性对照细胞)与50μl上清液一起孵育30分钟。用冷的pbs-1%sab洗涤3次后,向细胞悬浮液中加入10μl稀释的抗人igg(h+l)-dylight 650。
[0191]
随后在2-8℃下孵育20分钟,将细胞再次洗涤3次,最后重悬于300μl缓冲液中。在读取之前,加入碘化丙锭以排除死细胞。在facscalibur细胞仪上记录了10000个活细胞事件。
[0192]
结果
[0193]
图1a:igg1和igg5的示意图,显示igg5的铰链结构域与igg1不同,并且比igg1的铰链结构域略长。
[0194]
图1b:5种igg类蛋白序列(ch1,铰链,ch2和ch3)的比对。灰色框突出显示了igg5和igg1之间的差异。
[0195]
图2a和2b:构建用于抗cd20 igg5表达的质粒的图。(a)在xbai和ecorv位点将利妥昔单抗-伪-γ的vdj序列的构建体插入pcdna3.4(+)载体中。(b)在xbai和ecorv位点处将利妥昔单抗的vkappa序列的构建体插入pcdna3.4(+)载体中。
[0196]
图3:通过elisa检测cho-s细胞上清液中的免疫球蛋白。收集转染细胞的上清液并通过elisa对收集到的转染细胞的上清液进行分析。重组igg1和igm mab分别用作阳性和阴性对照。在cho-s转染的细胞系上清液中成功检测到igg5。
[0197]
图4:用上清液对靶细胞进行染色可以显示在阳性cd20细胞系(el4-cd20)而非阴
性对照细胞中检测到igg5抗cd20。该结果表明,用编码本发明的igg5的核酸转化的cho-s细胞可以产生重组抗体(igg5抗cd20),并且它具有功能并且可以识别其抗原。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



