盐芥盐诱导表达基因TsHKT1;2启动子的克隆与应用的制作方法
 2021-02-02 12:02:35|
2021-02-02 12:02:35| 331|
331| 起点商标网
起点商标网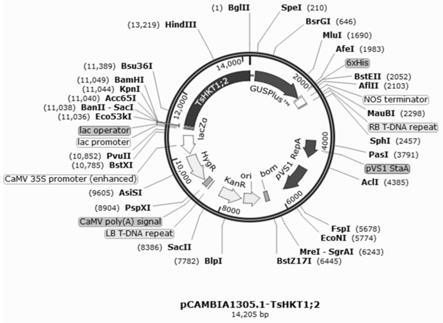
盐芥盐诱导表达基因tshkt1;2启动子的克隆与应用
技术领域
[0001]
本发明属于分子生物学和植物基因工程领域,涉及一种盐芥盐诱导表达基因 tshkt1;2启动子的克隆与应用;尤其涉及一种盐芥盐诱导表达上调tshkt1;2基因的启动子核苷酸编码序列的克隆,此启动子重组表达载体的构建,以及转入双子叶植物拟南芥中启动下游基因表达的方法。
背景技术:
[0002]
土壤盐渍化是植物承受的最主要的环境胁迫之一,严重制约植物的生长,使得农作物的产量严重降低,危害国家的粮食安全。为了抵御土壤中盐离子的胁迫,植物体内产生了一系列的盐胁迫调控机制来适应环境。因此,了解植物如何响应外界盐胁迫的过程是十分重要的。hkt1类型的转运蛋白在植物盐胁迫过程中发挥了重要的作用。在模式植物拟南芥中,只存在一个hkt1类型的基因,即athkt1。而在盐生植物,也是拟南芥的近亲物种盐芥中,却存在着三个hkt1基因,分别是tshkt1;1,tshkt1;2, tshkt1;3。研究这三个基因的功能和表达谱对于解析植物响应盐胁迫的过程是十分重要的。本发明主要针对tshkt1;2的启动子进行分析。
[0003]
常见的启动子可分为组成型启动子,组织特异型启动子和诱导型启动子。在一些情况下,一种类型的启动子可能兼有其他类型启动子的特性。诱导型启动子在植物基因工程中具有重要的功能,植物通过启动不同基因的表达可在一定范围内适应光、温、水等环境的变化。这些基因的启动子通常包含比较保守的顺式作用元件,利用这些保守元件可以推测新基因的可能功能,也可用这些环境应答基因的启动子与抗逆基因融合,从而使转基因植物更好地适应逆境。
技术实现要素:
[0004]
本发明的目的是针对目前的研究现状,提供一种盐芥盐诱导表达基因tshkt1;2启动子的克隆方法与应用。
[0005]
为完成上述目的,本发明采用如下技术方案:
[0006]
本发明涉及一种盐芥盐诱导表达基因tshkt1;2,所述基因核苷酸序列如seq.id.no:1所示。
[0007]
本发明还涉及一种盐芥盐诱导表达基因tshkt1;2启动子,所述启动子核苷酸序列如seq.id.no:2所示。
[0008]
本发明还涉及一种含有所述tshkt1;2启动子的重组表达载体。
[0009]
优选地,所述重组表达载体为在植物gus表达载体pcambia1305.1的酶切位点插入所述tshkt1;2启动子得到的重组质粒;在所述重组表达质粒中,tshkt1;2启动子连接在gus基因的上游。
[0010]
优选地,所述酶切位点为bamh-和bgl-。
[0011]
优选地,所述插入采用的扩增引物为:
[0012]
fp2:ttcgagctcggtacccggggatccgcgtttgtcaaactcgattgg
[0013]
rp2:aaatttaccctcagatctggagagatttagcatgttgcga。
[0014]
本发明还涉及一种所述的tshkt1;2启动子作为盐芥盐诱导上调启动子在植物基因改造工程中驱动目的基因表达的应用。
[0015]
优选地,所述植物包括拟南芥。
[0016]
优选地,将含有所述tshkt1;2启动子的重组表达载体转化农杆菌感受态gv3101,利用花序侵染法进行植物的遗传转化;所收种子经多代潮霉素筛选,获得纯系转基因植株。
[0017]
本发明还涉及一种所述的重组表达载体在植物抗盐机制中的应用。
[0018]
本发明还涉及一种所述的盐芥盐诱导表达基因tshkt1;2在盐芥中的表达分析方法,包括:
[0019]
a.所述盐芥为:(1)萌发后4-10天的盐芥,经150-300mm nacl处理2-30h;或 (2)低温春化后正常光照培养10-20天的盐芥,经20-40天的150-300mm nacl处理;
[0020]
b.设计对所述tshkt1;2基因的相对荧光定量pcr的引物,如下:
[0021]
上游引物:ctctacttctctcatttcattaacttcaa
[0022]
下游引物:gatctgactagaaagcttgacatgatt;
[0023]
c.以步骤a所得盐芥各组织rna为模板进行荧光定量pcr反应,分析tshkt1;2 基因在盐芥各组织中的表达。
[0024]
与现有技术相比,本发明的有益效果为:
[0025]
本发明克隆了盐芥盐诱导表达基因tshkt1;2启动子,该启动子可作为构建植物表达载体时所使用的元件,驱动特定基因在植物中进行表达,从而研究或加强该基因在盐胁迫中的功能,进而为改善作物的农艺性状奠定基础。
附图说明
[0026]
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
[0027]
图1:tshkt1;2启动子的顺式作用元件预测结果图;
[0028]
图2:tshkt1;2启动子驱动gus报告基因表达载体pcambia1305.1的构建示意图;
[0029]
图3:tshkt1;2启动子驱动gus报告基因表达载体pcambia1305.1的转基因拟南芥的 gus染色图(其中a、c图为对照组的gus染色图,b、d图为200mm nacl处理24h后的gus 染色图;a、b中-为拟南芥幼苗期,-、-、-分别为-中子叶、下胚轴和根部放大图;c、d中-、-、-、-、
ⅴ
、
ⅵ
分别为拟南芥成熟期的根、茎、莲座叶、茎生叶、花和角果);
[0030]
图4:盐芥中tshkt1;2转录水平的测定(其中a图为盐芥7天幼苗的tshkt1;2相对表达结果,b图为成熟期盐芥的tshkt1;2相对表达结果)。
具体实施方式
[0031]
下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
[0032]
一种盐芥盐诱导表达基因tshkt1;2启动子的生物信息学分析,
[0033]
1)从phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html)上获取盐芥 tshkt1;2基因启动子序列信息;
[0034]
2)对tshkt1;2启动子中可能存在的顺式作用元件进行预测,利用plantcare在线工具(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/);
[0035]
3)分析存在的顺式作用元件的功能;
[0036]
一种盐芥盐诱导表达基因tshkt1;2启动子的克隆方法,该启动子序列如 seq.id.no:2所示,共包含3151bp。克隆方法具体包括以下步骤:
[0037]
(1)利用ctab法提取盐芥整株dna;
[0038]
(2)根据phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html)上所提供的tshkt1;2的基因序列,在该基因的起始密码子附近设计一对约3200bp启动子片段的引物fp1、rp1:
[0039]
fp1:gcgtttgtcaaactcgattgg seq.id.no:3
[0040]
rp1:ggagagatttagcatgttgcga seq.id.no:4
[0041]
(3)利用高保真酶进行pcr扩增;在此过程中由于盐芥tshkt1;2启动子较长,扩增较为困难,因而会经过多次扩增过程;
[0042]
(4)将扩增片段连接至pmd19-t(购自takara公司)中,转化大肠杆菌感受态 dh5α,送往铂尚测序公司进行测序,从而确认克隆载体构建结果是否正确;
[0043]
一种“启动子-gus报告基因”融合载体的构建。具体操作包括以下步骤:
[0044]
(1)通过检查tshkt1;2启动子和植物gus表达载体pcambia1305.1的图谱,寻找合适的双酶切位点,该双酶切效果应使表达载体pcambia1305.1中驱动gus基因的 35s启动子被切除且不破坏下游的gus基因,同时不存在于tshkt1;2启动子中。本发明最终找到酶切位点bamh-和bgl-,并由此设计扩增引物fp2、rp2:
[0045]
fp2:ttcgagctcggtacccggggatccgcgtttgtcaaactcgattgg seq.id.no:5
[0046]
rp2:aaatttaccctcagatctggagagatttagcatgttgcga seq.id.no:6
[0047]
(2)以测序正确的上述tshkt1;2启动子克隆载体为模板,利用高保真酶进行pcr 扩增。
[0048]
(3)将启动子扩增片段和载体pcambia1305.1利用bamh-和bgl-酶切,利用t4连接酶将载体与片段连接,转化大肠杆菌感受态dh5α,测序确认载体构建结果是否正确。
[0049]“启动子-gus报告基因”融合载体转化模式植物拟南芥,及后续的gus染色分析。具体操作步骤如下:
[0050]
(1)将构建完成的“启动子-gus报告基因”重组质粒转入农杆菌gv3101中,利用花序侵染法侵染拟南芥植株;
[0051]
(2)所收种子经多代潮霉素筛选,最终收获纯合株系;
[0052]
(3)利用gus组织化学染色法检测转基因拟南芥中gus基因的表达特性,分析 tshkt1;2启动子的表达谱;
[0053]
为了确认tshkt1;2启动子的组织特异性表达,进行盐芥苗期和成熟期各组织的荧光定量pcr分析。具体操作步骤如下:
[0054]
(1)萌发后7天的盐芥,实验组经200mm nacl处理,对照组经等量ddh
2
o处理。24h
后,分别提取实验组和对照组的叶片和根部的rna;
[0055]
(2)低温春化后的盐芥,在土壤中生长两周后开始抽薹,实验组经200mm nacl 处理,对照组经等量去离子水处理。30d后,分别提取实验组和对照组的根、茎、莲座叶、茎生叶、花、角果的rna;
[0056]
(3)设计tshkt1;2基因的定量引物fp3,rp3,利用roche的light cycler 96定量 pcr仪进行相对荧光定量pcr反应,分析tshkt1;2基因在盐芥各组织中的表达:
[0057]
fp3:ctctacttctctcatttcattaacttcaa seq.id.no:7
[0058]
rp3:gatctgactagaaagcttgacatgatt seq.id.no:8
[0059]
具体见以下各实施例:
[0060]
实施例1:盐芥盐诱导表达基因tshkt1;2启动子顺式作用元件的预测
[0061]
1)tshkt1;2启动子序列的获得
[0062]
2)从phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html)上获取tshkt1;2的启动子序列:
[0063]
3)tshkt1;2启动子顺式元件的预测
[0064]
为了研究tshkt1;2启动子区的顺式作用位点,利用plantcare在线工具 (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对tshkt1;2启动子中可能存在的顺式作用元件进行预测。
[0065]
tshkt1;2启动子包含的顺式作用元件如图1所示,tshkt1;2启动子中包含5个aba 响应元件abre,几个光响应元件如ace、ae-box、g-box、g-box、gata motif、gt1 motif、 tct motif和box 4等,几个厌氧诱导的元件are,几个茉莉酸甲酯(methyl jasmonate, meja)响应相关的顺式作用元件cgtca-motif和tgacg-motif,一个水杨酸(salicylicacid,sa)响应相关元件tca-element,一个参与栅栏叶肉细胞分化的元件hd-zip 1,一个参与玉米蛋白代谢调控的顺式作用元件o2-site,一个昼夜节律相关顺式作用元件 circadian,几个损伤响应元件wun-motif,一些启动子和增强子区域的共同顺式作用元件caat-box,一些转录因子的结合位点(尤其是myb类转录因子的可能结合位点,如光诱导的myb结合位点mre,干旱诱导的myb结合位点mbs等)以及一些其他元件如 aagaa-motif等。
[0066]
tshkt1;2启动子包含一些胁迫反应相关的顺式作用元件,可能参与植物对胁迫反应的调节过程。其中包含aba响应元件,aba参与盐胁迫相关的调控反应过程,因此 tshkt1;2基因可能受aba相关信号调控。
[0067]
实施例2:盐芥盐诱导表达基因tshkt1;2启动子的克隆
[0068]
1)tshkt1;2启动子克隆引物的设计
[0069]
根据phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html)上所提供的 tshkt1;2的启动子序列,在该基因的起始密码子附近设计一对约3200bp启动子片段的引物fp1、rp1:
[0070]
fp1:gcgtttgtcaaactcgattgg seq.id.no:3
[0071]
rp1:ggagagatttagcatgttgcga seq.id.no:4
[0072]
2)盐芥基因组dna的提取
[0073]
本发明所用材料为山东生态型盐芥。利用经典的ctab法提取幼嫩的盐芥植株 dna。具体操作步骤如下:在液氮条件下将盐芥植株研磨成粉末,加入700μl 65℃预热的1.5
200μl培养基将底部菌体悬浮起来,并涂布至含羧苄青霉素 50mg/l的lb固体平板上;将平板放入37℃恒温培养箱中,倒置培养12-16h。分别挑取数个单菌落,接种于含羧苄青霉素50mg/l的lb液体培养基中,于37℃摇床中培养 3-5h。经pcr鉴定后,将含阳性菌落的lb液体培养基取部分送往上海铂尚测序公司进行测序。测序正确的即得到克隆的tshkt1;2启动子。
[0086]
实施例3:tshkt1;2启动子植物表达载体的构建及其在拟南芥中的遗传转化与阳性转基因植株筛选
[0087]
1)tshkt1;2启动子植物表达载体的构建
[0088]
通过检查tshkt1;2启动子和植物gus表达载体pcambia1305.1的图谱,寻找合适的双酶切位点,该双酶切效果应使表达载体pcambia1305.1中驱动gus基因的35s启动子被切除且不破坏下游的gus基因,同时不存在于tshkt1;2启动子中。本发明最终找到酶切位点bamh-和bgl-,并由此设计扩增引物fp2、rp2:
[0089]
fp2:ttcgagctcggtacccggggatccgcgtttgtcaaactcgattgg seq.id.no:5
[0090]
rp2:aaatttaccctcagatctggagagatttagcatgttgcga seq.id.no:6
[0091]
以正确的tshkt1;2启动子克隆载体为模板扩增得到含酶切位点的片段;随后利用限制性内切酶bamh-和bgl-(购自thermo公司)对该扩增片段和植物gus表达载体 pcambia1305.1进行酶切。经琼脂糖凝胶电泳并切胶回收后,利用t4连接酶(购自thermo 公司)将酶切后的片段和载体连接;随后将连接产物转化大肠杆菌感受态细胞dh5α,并进行菌落pcr验证和测序验证。
[0092]
tshkt1;2启动子植物表达载体的构建如图2所示。
[0093]
2)重组质粒转化农杆菌感受态gv3101
[0094]
在50μl农杆菌感受态gv3101中加入10μl上述重组质粒,在冰上放置30分钟,液氮处理5分钟,37℃热激5分钟,后迅速放置冰上5分钟,加入lb液体培养基约0.5 ml,放入28℃摇床中,220rpm培养约1h;随后5000rpm离心5分钟,去除部分培养基,利用剩余约100-200μl培养基将底部菌体悬浮起来,并涂布至含卡那霉素50mg/l、庆大霉素100mg/l、利福平50mg/l的lb固体平板上;将平板放入28℃恒温培养箱中,倒置培养36-48h。分别挑取数个单菌落,接种于含羧苄青霉素50mg/l、庆大霉素 100mg/l、利福平50mg/l的lb液体培养基中,于28℃摇床中培养3-5h。经pcr鉴定后获得阳性菌落。
[0095]
3)拟南芥的培养与遗传转化
[0096]
将columbia生态型的拟南芥(col-0)种子经70%乙醇和10%次氯酸钠消毒后铺洒于1/2ms培养基上。在4℃冰箱同化处理3天后,放至光照16h/黑暗8h的光周期, 2000lux光照条件和22℃、70%湿度环境的光照培养箱中进行培养,7天后移栽至培养土中,等待开花旺盛时,利用花序侵染法进行拟南芥的遗传转化。具体步骤为:将上述转化重组质粒成功的农杆菌接种至200ml含卡那霉素50mg/l、庆大霉素100mg/l、利福平50mg/l的lb液体培养基,在28℃摇床中培养至od
600
为1.0-2.0,5000rpm离心 10分钟后用侵染液(1/2ms,50%蔗糖,0.04%silwet l-77)重悬,侵染拟南芥花序约30s,覆上保鲜膜,将侵染完成的拟南芥黑暗条件下培养24h后放回人工气候室正常光照继续培养。
[0097]
4)转基因拟南芥植株的筛选与鉴定
[0098]
侵染完成的拟南芥植株记为t0代。将其所收种子利用30mg/l潮霉素进行筛选,所
得阳性植株移栽培养,记为t1代,单株收种子,记为t2代。继续播种t2代,单株收种子,获得t3代。随机取数十粒同株系的t3代种子,利用潮霉素筛选,若全为阳性植株,则说明该株系为纯系转基因植株。
[0099]
5)转基因拟南芥植株的处理和gus染色
[0100]
将纯系的转基因拟南芥种子经70%乙醇和10%次氯酸钠消毒后铺洒于1/2ms培养基上。在4℃冰箱同化处理3天后,放至光照16h/黑暗8h的光周期,2000lux光照条件和22℃、70%湿度环境的光照培养箱中进行培养,7天后,实验组利用200mm nacl 处理24h,对照组用等量ddh
2
o处理24h。实验组和对照组同时取样进行gus染色。约染色12h后,利用不同浓度的乙醇进行梯度脱色。
[0101]
t2代纯系转基因植株的gus染色结果如图3所示。其中,a、c图为对照组的gus 染色图,b、d图为200mm nacl处理24h后的gus染色图;a、c图为幼苗期,b、d图为成熟期。从中可以发现,tshkt1;2在幼苗中的表达较弱,主要集中在叶维管束组织中进行表达。在成熟植株中,tshkt1;2主要在莲座叶叶维管束中进行表达,少量在茎生叶叶维管束和角果中表达。与对照组相比,实验组的染色有所增强,说明tshkt1;2启动子在转基因植株中的表达受盐诱导。
[0102]
实施例4:盐芥中tshkt1;2基因的转录水平分析
[0103]
1)盐芥幼苗中tshkt1;2基因的转录水平分析
[0104]
将山东型盐芥的种子经70%乙醇和10%次氯酸钠消毒后铺洒于1/2ms培养基上。在4℃冰箱同化处理3天后,放至光照16h/黑暗8h的光周期,2000lux光照条件和22℃、 70%湿度环境的光照培养箱中进行培养,7天后,实验组利用300mm nacl处理24h,对照组用等量ddh
2
o处理24h。实验组和对照组同时取样,利用多糖多酚植物总rna提取试剂盒(购自transgene公司)提取样品rna,设计tshkt1;2基因的定量引物fp3, rp3,以及内参基因actin的定量引物fp4,rp4,利用roche的定量pcr仪进行相对荧光定量pcr反应,分析盐芥幼苗中tshkt1;2基因的相对基因表达量。
[0105]
fp3:ctctacttctctcatttcattaacttcaa seq.id.no:7
[0106]
rp3:gatctgactagaaagcttgacatgatt seq.id.no:8
[0107]
fp4:caagcagcatgaagattaaggtcgtt seq.id.no:9
[0108]
rp4:cttggagatccacatctgctggaat seq.id.no:10
[0109]
2)成熟期盐芥各组织中tshkt1;2基因的转录水平分析
[0110]
将山东型盐芥的种子经70%乙醇和10%次氯酸钠消毒后铺洒于1/2ms培养基上。在 4℃冰箱同化处理3天后,放至光照16h/黑暗8h的光周期,2000lux光照条件和22℃、 70%湿度环境的光照培养箱中进行培养,14天后,将盐芥放至4℃培养箱进行低温春化。一个半月后,将盐芥移栽入土壤中,在22℃人工气候室中培养2周,实验组利用200mmnacl处理,对照组用等量去离子水处理。30天后,实验组和对照组同时利用液氮取样,利用多糖多酚植物总rna提取试剂盒(购自transgene公司)提取样品rna,设计 tshkt1;2基因的定量引物fp3,rp3,以及内参基因actin的定量引物fp4,rp4,利用 roche的定量pcr仪进行相对荧光定量pcr反应,分析盐芥幼苗中tshkt1;2基因的相对基因表达量。
[0111]
盐芥中tshkt1;2基因的相对荧光定量pcr结果如图4所示。其中a图为盐芥7天幼苗的tshkt1;2相对表达结果,b图为成熟期盐芥的tshkt1;2相对表达结果。从a图可以看出,在
盐芥幼苗中,tshkt1;2在植株中的表达水平较高,并且在盐处理条件下其在各个组织中的表达上调,并且其在地上部分的表达量略高于根。在成熟盐芥中, tshkt1;2在各个组织中均有表达,其中茎、茎生叶和花中表达量较高,并且在盐处理条件下其在各个组织中的表达上调,其中茎和茎生叶中的上调最为明显。因此,可以说明 tshkt1;2基因在盐芥的幼苗期和成熟期的表达水平较高,且地上部分受盐诱导表达上调明显,该基因的表达受盐胁迫诱导。
[0112]
以上仅是本发明的优选实施方式,并非是对本发明的限制。应当指出,只要符合本发明要求,均属于本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



