TIL/TCR-T细胞治疗平台的制作方法
 2021-02-02 12:02:51|
2021-02-02 12:02:51| 332|
332| 起点商标网
起点商标网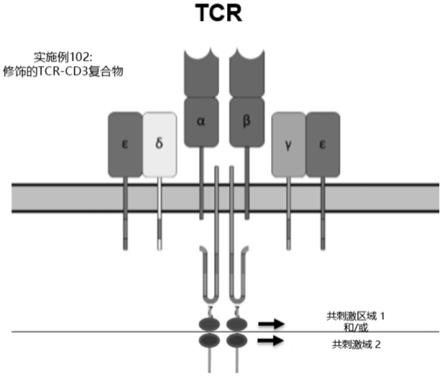
til/tcr-t细胞治疗平台
技术领域
[0001]
本公开涉及使用t细胞疗法治疗包括癌症在内的疾病的组合物和方法。
背景技术:
[0002]
肿瘤的细胞免疫疗法目前已经取得了很大的成果,但是细胞疗法仍然难以治疗某些恶性肿瘤,并且在某些治疗中还引起了副作用。在car-t细胞疗法期间,医生会抽取患者的血液并收获其细胞毒性t细胞。在实验室中对细胞进行改造,以攻击特定癌症。基因组编辑技术的最新进展使科学家能够破坏t细胞中的基因表达,以增强效应子功能或绕过肿瘤免疫抑制和代谢不利的肿瘤微环境。因此,需要调节t/nk细胞以增强肿瘤的细胞免疫疗法。
技术实现要素:
[0003]
普通的tcr只激活cd3,我们设计的tcr加了共刺激结构域,信号更强。同时我们设计的新tcr变成了car,可以成为一个通用元件。并且cd3激活时,会有共刺激结构域信号,可以增强tcr-t的杀伤效果。实施方案涉及工程改造为包含修饰的tcr-cd3复合物的修饰的细胞,其中修饰的tcr-cd3复合物的cd3γ、cd3ζ、cd3ε和/或cd3δ链连接至一个或多个共刺激信号传导结构域。例如,修饰的tcr-cd3复合物可以包含seq id no:18或19的氨基酸序列。
[0004]
本发明内容不旨在标识所要求保护的主题的关键特征或必要特征,也不旨在用于限制所要求保护的主题的范围。
附图说明
[0005]
参照附图描述具体实施方式。在不同附图中使用相同的参考数字表示类似或相同的项目。
[0006]
图1-4显示了tcr-cd3复合物的修饰组分的实例的示意图;
[0007]
图5显示了修饰的tcr-cd3复合物的多核苷酸和修饰的细胞的示意图;
[0008]
图6显示了t细胞中各种载体表达的流式细胞术的结果;
[0009]
图7显示了hla-a2和ny-eso-1在底物细胞中的表达以及cd3ζ在这些细胞中的表达;
[0010]
图8显示了证实了修饰的tcr的结构的蛋白质印迹结果;
[0011]
图9显示了多核苷酸和修饰的细胞的示意图;
[0012]
图10-13是显示代谢过程的示意图。
具体实施方式
[0013]
除非另外定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。尽管可以在本公开的实践或测试中使用与本文描述的那些类似或等同的任何方法和材料,但是描述了优选的方法和材料。出于本公开的目的,以下术语定义如下。
[0014]
冠词“一”和“一个”在本文中用于指代冠词的语法对象中的一个或多个(即,至少一个)。举例来说,“一个元件”是指一个元件或一个以上元件。
[0015]“大约”是指数量、水平、值、数字、频率、百分比、尺寸、大小、量、重量或长度相对于参考数量、水平、值、数字、频率、百分比、尺寸、大小、量、重量或长度,相差多达20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。
[0016]
如本文所用,术语“活化”是指已被充分刺激以诱导可检测的细胞增殖的细胞状态。激活也可以与诱导的细胞因子产生和可检测的效应子功能相关。术语“活化的t细胞”尤其是指正在进行细胞分裂的t细胞。
[0017]
术语“抗体”以最广义使用,指单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的生物学活性或功能即可。本公开中的抗体可以以多种形式存在,包括例如多克隆抗体;单克隆抗体;fv、fab、fab'和f(ab')2片段;以及单链抗体和人源化抗体(harlow等,1999,《使用抗体:实验室手册》,冷泉港实验室出版社,纽约;harlow等,1989,《抗体:实验室手册》,冷纽约州斯普林港;休斯顿等人,1988,美国国家科学院院刊85:5879-5883;伯德等人,1988,科学242:423-426。
[0018]
术语“抗体片段”是指全长抗体的一部分,例如,抗体的抗原结合或可变区。抗体片段的其他实例包括fab、fab'、f(ab')2和fv片段;双体线性抗体;单链抗体分子;由抗体片段形成的多特异性抗体。
[0019]
术语“fv”是指包含完整抗原识别和结合位点的最小抗体片段。该片段由紧密且非共价结合的一个重链和一个轻链可变区结构域的二聚体组成。从这两个结构域的折叠中,散发出六个高变环(每个来自h和l链的3个环),这些环为氨基酸结合贡献了氨基酸残基,并赋予了抗体抗原结合特异性。但是,即使单个可变域(或仅包含三个对抗原具有特异性的互补决定区(cdr)的fv的一半)也具有识别和结合抗原的能力,尽管其亲和力低于整个结合位点(二聚体)。
[0020]
如本文所用,“抗体重链”是指以天然存在的构型存在于所有抗体分子中的两种类型的多肽链中的较大者。如本文所用,“抗体轻链”是指以天然存在的构型存在于所有抗体分子中的两种类型的多肽链中的较小者。κ和λ轻链是指两种主要的抗体轻链同种型。
[0021]
术语“合成抗体”是指使用重组dna技术产生的抗体,例如由噬菌体表达的抗体。该术语还包括通过合成编码该抗体的dna分子和表达该dna分子以获得该抗体或获得编码该抗体的氨基酸而产生的抗体。合成dna是使用本领域已知的技术获得的。
[0022]
术语“抗原”是指引起免疫应答的分子,其可能涉及抗体产生或特定免疫学上具有活性的细胞的激活或两者。抗原包括任何大分子,包括所有蛋白质或肽,或衍生自重组或基因组dna的分子。例如,本文所用的dna包括编码引起免疫应答的蛋白质或肽的核苷酸序列或部分核苷酸序列,因此编码“抗原”。抗原不必仅由基因的全长核苷酸序列编码。抗原可以从包括组织样品、肿瘤样品、细胞或生物流体的生物样品产生、合成或衍生。
[0023]
如本文所用,术语“抗肿瘤作用”是指与肿瘤体积减少,肿瘤细胞数目减少,转移数目减少,肿瘤细胞增殖减少,肿瘤细胞存活减少,具有肿瘤细胞的受试者的预期寿命的增加,或与癌症状况相关的各种生理症状的改善有关的生物学作用。首先,肽、多核苷酸、细胞和抗体在预防肿瘤发生方面的能力也可以表现出“抗肿瘤作用”。
[0024]
术语“自身抗原”是指被免疫系统误认为是外源的内源性抗原。自身抗原包括细胞
蛋白、磷蛋白、细胞表面蛋白、细胞脂质、核酸、糖蛋白,包括细胞表面受体。
[0025]
术语“自体的”用于描述源自受试者的材料,其随后被重新引入相同的受试者中。
[0026]
术语“同种异体的”用于描述衍生自相同物种的不同受试者的移植物。举例来说,供体受试者可以是与受体受试者相关或无关的,但是供体受试者具有与受体受试者相似的免疫系统标记。
[0027]
术语“异种的”用于描述衍生自不同物种的受试者的移植物。例如,供体受试者与接受体受试者来自不同的物种,并且供体受试者和受体受试者可能在遗传和免疫学上不相容。
[0028]
术语“癌症”用于指特征在于异常细胞快速且不受控制的生长的疾病。癌细胞可以局部扩散,也可以通过血液和淋巴系统扩散到身体的其他部位。各种癌症的例子包括乳腺癌、前列腺癌、卵巢癌、子宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、脑癌、淋巴瘤、白血病、肺癌等。
[0029]
在整个说明书中,除非上下文另外要求,否则词语“包括”,“包括”和“包含”将被理解为暗示包括所陈述的步骤或元件或步骤组或元件的组,但不排除任何其他步骤。或元素或一组步骤或元素。
[0030]
短语“由
……
组成”旨在包括并且限于短语“由
……
组成”之后的任何内容。因此,短语“由...组成”表示所列出的元素是必需或强制性的,并且可能不存在其他元素。
[0031]
短语“基本上由
……
组成”是指包括在短语之后列出的任何要素,并且可以包括不干扰或不影响本公开中针对所列要素所指定的活动或动作的其他要素。因此,短语“基本上由
……
组成”表示所列出的要素是必需的或强制性的,但是其他要素是可选的,并且取决于它们是否影响所列举的要素的活动或动作,可以存在或可以不存在。例如,如果该元素不影响细胞的扩展、功能或表型,则该元素不是必需的,并且被认为是可选的。
[0032]
术语“互补的”和“互补性”是指通过碱基配对规则相关的多核苷酸(即核苷酸序列)。例如,序列“agt”与序列“tca”互补。互补性可以是“部分的”,其中仅一些核酸的碱基根据碱基配对规则匹配,或者在核酸之间可以存在“完全”或“全部”互补性。核酸链之间的互补程度对核酸链之间的杂交效率和强度具有重要影响。
[0033]
术语“对应于”或“对应于”是指(a)具有与参考多核苷酸序列的全部或一部分基本相同或互补或编码与氨基酸序列相同的氨基酸序列的核苷酸序列的多核苷酸。在肽或蛋白质中;(b)具有与参考肽或蛋白质中的氨基酸序列基本相同的氨基酸序列的肽或多肽。
[0034]
术语“共刺激配体”是指抗原呈递细胞(例如,apc,树突状细胞,b细胞等)上的分子,其特异性结合t细胞上的同源共刺激分子,从而提供信号,除了由例如tcr/cd3复合物与载有肽的mhc分子结合提供的主要信号外,还介导t细胞反应,包括增殖、激活、分化和其他至少一种细胞反应。共刺激配体可以包括b7-1(cd80)、b7-2(cd86)、pd-l1、pd-l2、4-1bbl、ox40l、诱导型共刺激配体(icos-l)、细胞间粘附分子(icam)、cd30l、cd40、cd70、cd83、hla-g、mica、micb、hvem、淋巴毒素β受体、3/tr6、ilt3、ilt4、hvem、cd7的配体、与toll配体受体结合的激动剂或抗体和与b7-h3特异性结合的配体。共刺激配体还特别包括与存在于t细胞上的共刺激分子如cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1特异性结合的激动剂或抗体、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3以及与cd83特异性结合的配体。
[0035]
术语“共刺激分子”是指t细胞上的同源结合伴侣,其与共刺激配体特异性结合,从而介导t细胞的共刺激应答,例如增殖。共刺激分子包括mhc i类分子、btla和toll样受体。
[0036]
术语“共刺激信号”是指与主要信号结合的信号,例如tcr/cd3连接,导致t细胞增殖和/或关键分子的上调或下调。
[0037]
术语“疾病”和“病症”可以互换使用,也可以不同,因为特定的疾病或病症可能没有已知的病原体(因此病因尚未得到解决),因此尚未得到认可。它是一种疾病,但仅是一种不良状况或综合症,其中临床医生已识别出或多或少的特定症状。术语“疾病”是受试者的健康状态,其中受试者不能维持体内稳态,并且其中如果疾病没有得到改善,则受试者的健康继续恶化。相反,受试者的“疾病”是其中动物能够维持体内稳态的健康状态,但是其中动物的健康状态比没有疾病时的健康状态不利。如果不及时治疗,疾病不一定会导致动物健康状况进一步下降。
[0038]
术语“有效的”是指足以完成期望的,预期的或预期的结果。例如,治疗中的“有效量”可以是足以产生治疗或预防益处的化合物的量。
[0039]
术语“编码”是指多核苷酸中特定序列的核苷酸的固有特性,例如基因、cdna或mrna,以用作模板,用于在具有确定的结构的生物过程中合成其他聚合物和大分子。核苷酸序列(即rrna,trna和mrna)或确定的氨基酸序列以及由此产生的生物学特性。因此,如果对应于该基因的mrna的转录和翻译在细胞或其他生物系统中产生该蛋白质,则该基因编码蛋白质。核苷酸序列与mrna序列相同的编码链(除了用“u”代替“t”以外)通常都在序列表中提供,非编码链均用作模板用于基因或cdna转录的“蛋白质”可以称为编码该基因或cdna的蛋白质或其他产物。
[0040]
术语“外源”是指不是天然存在于野生型细胞或生物中但通常通过分子生物学技术引入细胞中的分子。外源多核苷酸的实例包括编码所需蛋白质的载体,质粒和/或人造核酸构建体。关于多核苷酸和蛋白质,术语“内源”或“天然”是指在给定的野生型细胞或生物中可以发现的天然存在的多核苷酸或氨基酸序列。同样,通过分子生物学技术从第一生物分离并转移到第二生物的特定多核苷酸序列通常被认为是相对于第二生物的“外源”多核苷酸或氨基酸序列。在特定的实施方案中,可以通过分子生物学技术将多核苷酸序列“引入”到已经含有这种多核苷酸序列的微生物中,例如,以产生原本天然存在的多核苷酸序列的一个或多个另外的拷贝,从而促进其的过表达。编码的多肽。
[0041]
术语“表达或过表达”是指特定核苷酸序列例如由其启动子驱动的转录和/或翻译成前体或成熟蛋白。“过表达”是指基因产物在转基因生物或细胞中的产量超过正常或未转化的生物或细胞中的产量。如本文所定义,术语“表达”是指表达或过表达。
[0042]
术语“表达载体”是指包含重组多核苷酸的载体,所述重组多核苷酸包括可操作地连接至待表达的核苷酸序列的表达控制(调控)序列。表达载体包括足够的顺式作用元件用于表达。其他表达元件可以由宿主细胞或在体外表达系统中提供。表达载体包括本领域中所有已知的载体,例如粘粒,质粒(例如裸露或包含在脂质体中)和病毒(例如慢病毒,逆转录病毒,腺病毒和腺相关病毒),其掺入了重组多核苷酸。
[0043]
病毒可用于在体外和体内(在受试者中)将核酸递送到细胞中。可用于将核酸递送到细胞中的病毒的例子包括逆转录病毒、腺病毒、单纯疱疹病毒、牛痘病毒和腺伴随病毒。
[0044]
还存在用于将核酸递送到细胞中的非病毒方法,例如电穿孔、基因枪、声穿孔、磁
转染、以及使用寡核苷酸、脂复合物、树状聚合物和无机纳米颗粒。
[0045]
术语“同源的”是指当两个比较的序列的两个序列中的一个位置被相同的碱基或氨基酸单体亚基占据时,例如,如果两个的每个中的位置,则两个多肽之间或两个多核苷酸之间的序列相似性或序列同一性。dna分子被腺嘌呤占据,然后该分子在该位置是同源的。两个序列之间的同源性百分比是两个序列共享的匹配或同源位置数除以比较的位置数
×
100的函数。例如,如果两个序列中10个位置中的6个是匹配或同源的,那么两个序列是60%同源的。举例来说,dna序列attgcc和tatggc具有50%的同源性。当两个序列比对以给出最大同源性时进行比较。
[0046]
术语“免疫球蛋白”或“ig”是指充当抗体的一类蛋白质。此类蛋白质中包含的五个成员是iga,igg,igm,igd和ige。iga是存在于人体分泌物(如唾液、眼泪、母乳、胃肠道分泌物和呼吸道和泌尿生殖道的粘液分泌物中)的一抗。igg是最常见的循环抗体。在大多数受试者中,igm是主要免疫反应中产生的主要免疫球蛋白。它是凝集,补体固定和其他抗体反应中最有效的免疫球蛋白,对于防御细菌和病毒很重要。igd是没有已知抗体功能但可以充当抗原受体的免疫球蛋白。ige是一种免疫球蛋白,通过暴露于变应原引起肥大细胞和嗜碱性粒细胞释放介体,从而介导立即超敏反应。
[0047]
术语“分离的”是指基本上或基本上不含在其天然状态下通常伴随其的组分的材料。该材料可以是细胞或大分子,例如蛋白质或核酸。例如,如本文所用,“分离的多核苷酸”是指已经从以天然存在的侧翼存在于其侧面的序列中纯化的多核苷酸,例如已经从正常序列中去除的dna片段。与片段相邻。备选地,本文所用的“分离的肽”或“分离的多肽”等是指从其天然细胞环境中以及从其与细胞的其他组分的缔合中体外分离和/或纯化肽或多肽分子。
[0048]
术语“基本上纯化的”是指基本上不含在其天然状态下通常与其结合的组分的材料。例如,基本上纯化的细胞是指已经从其通常以其天然存在或天然状态结合的其他细胞类型中分离的细胞。在某些情况下,基本上纯化的细胞群是指同质的细胞群。在其他情况下,该术语简单地指的是在其自然状态下与与其自然结合的细胞分离的细胞。在实施方案中,细胞在体外培养。在实施方案中,细胞不体外培养。
[0049]
在本公开的上下文中,使用以下对于常见的核酸碱基的缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,“u”是尿苷。
[0050]
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括彼此为简并形式并且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质或rna的短语核苷酸序列也可以包括内含子,其程度为编码蛋白质的核苷酸序列在某些形式中可以包含一个或多个内含子。
[0051]
术语“慢病毒”是指逆转录病毒科的属。慢病毒在逆转录病毒中是独特的,能够感染非分裂细胞。它们可以将大量遗传信息传递到宿主细胞的dna中,因此它们是基因传递载体中最有效的方法之一。此外,慢病毒的使用能够将遗传信息整合到宿主染色体中,从而稳定地转导遗传信息。hiv、siv和fiv都是慢病毒的例子。源自慢病毒的载体提供了在体内实现显着水平的基因转移的手段。
[0052]
术语“调节”是指与没有治疗或化合物的情况下受试者的反应水平相比,和/或与受试者的水平相比,在受试者中的应答水平可检测到的增加或减少。在其他相同但未治疗的受试者中的反应。该术语涵盖扰动和/或影响天然信号或反应,从而在受试者(优选人)中
介导有益的治疗反应。
[0053]
当核酸与另一核酸序列处于功能关系时,核酸被“有效连接”。例如,如果将前序列或分泌前导序列的dna表达为参与多肽分泌的前蛋白,则将其与多肽的dna可操作地连接。如果启动子或增强子影响序列的转录,则该启动子或增强子与该序列可操作地连接;或核糖体结合位点被可操作地连接至编码序列,如果它被定位以便于翻译。
[0054]
术语“在转录控制下”是指与多核苷酸可操作地连接并以正确的位置和相对于该多核苷酸的启动子,以控制(调节)rna聚合酶的转录起始和多核苷酸的表达。
[0055]
术语“过表达”的肿瘤抗原或肿瘤抗原的“过表达”旨在指示来自患者特定组织或器官内的诸如实体瘤的疾病区域的细胞中肿瘤抗原的异常表达水平。达到该组织或器官在正常细胞中的表达水平。可以通过本领域已知的标准测定来确定具有以肿瘤抗原的过表达为特征的实体瘤或血液系统恶性肿瘤的患者。
[0056]
实体瘤是通常不包含囊肿或液体区域的异常组织肿块。实体瘤可以是良性或恶性的。不同类型的实体瘤因形成它们的细胞类型而异(例如肉瘤、癌和淋巴瘤)。实体瘤(例如肉瘤和癌)的实例包括纤维肉瘤、粘肉肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉肉瘤、横纹肌肉瘤、结肠癌、淋巴恶性肿瘤、胰腺癌、乳腺癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、乳头状甲状腺癌、嗜铬细胞瘤皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、威尔姆斯氏肿瘤、宫颈癌、睾丸肿瘤、精原细胞瘤、膀胱癌、黑色素瘤和中枢神经系统肿瘤(例如神经胶质瘤(例如脑干神经胶质瘤和混合神经胶质瘤),胶质母细胞瘤(也称为多形胶质母细胞瘤))、星形细胞瘤、中枢神经系统淋巴瘤、生殖细胞瘤、髓母细胞瘤、雪旺氏肉瘤咽喉瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、血管瘤、神经母细胞瘤、视网膜母细胞瘤和脑转移瘤)。
[0057]
实体瘤抗原是在实体瘤上表达的抗原。在实施方案中,实体瘤抗原也在健康组织上以低水平表达。表1中提供了实体瘤抗原及其相关疾病肿瘤的实例。
[0058]
表1
[0059]
[0060][0061]
组合物的术语“肠胃外给药”包括例如皮下(sc)、静脉内(iv)、肌内(im)、胸骨内注射或输注技术。
[0062]
术语“患者”,“受试者”和“个体”等在本文可互换使用,并且是指适合本文所述方法的任何人或动物。在某些非限制性实施方案中,患者、受试者或个体是人或动物。在实施方案中,术语“受试者”旨在包括其中可以引起免疫应答的活生物体(例如哺乳动物)。受试者的实例包括人和动物,例如狗、猫、小鼠、大鼠及其转基因物种。
[0063]
需要治疗或其需要的受试者包括患有需要治疗的疾病,病症或失调的受试者。需要其的受试者还包括需要治疗以预防疾病,病症或失调的受试者。
[0064]
术语“多核苷酸”或“核酸”是指mrna、rna、crna、rrna、cdna或dna。该术语通常是指长度至少为10个碱基的核苷酸的聚合形式,即核糖核苷酸或脱氧核苷酸,或任一类型核苷酸的修饰形式。该术语包括所有形式的核酸,包括单链和双链形式的核酸。
[0065]
术语“多核苷酸变体”和“变体”等是指与参考多核苷酸序列显示基本序列同一性的多核苷酸或在以下定义的严格条件下与参考序列杂交的多核苷酸。这些术语还涵盖通过添加,缺失或取代至少一个核苷酸而与参考多核苷酸区分开的多核苷酸。因此,术语“多核苷酸变体”和“变体”包括其中一个或多个核苷酸已被添加或缺失或被不同核苷酸取代的多核苷酸。就这一点而言,本领域众所周知,可以对参考多核苷酸进行某些改变,包括突变,添加,缺失和取代,从而改变后的多核苷酸保留了参考多核苷酸的生物学功能或活性或具有
增加的活性。与参考多核苷酸的关系(即优化的)。多核苷酸变体包括,例如,与参考多核苷酸序列具有至少50%(和至少51%至至少99%以及在例如90%、95%或98%之间的所有整数百分比)序列同一性的多核苷酸。本文所述。术语“多核苷酸变体”和“变体”也包括天然存在的等位基因变体和直向同源物。
[0066]
术语“多肽”、“多肽片段”、“肽”和“蛋白质”在本文中可互换使用,是指氨基酸残基的聚合物及其变体和合成类似物。因此,这些术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是合成的非天然存在的氨基酸,例如相应天然存在的氨基酸的化学类似物,以及适用于天然存在的氨基酸聚合物。在某些方面,多肽可以包括酶促多肽或“酶”,其通常催化(即,增加其速率)各种化学反应。
[0067]
术语“多肽变体”是指通过添加、缺失或取代至少一个氨基酸残基而与参考多肽序列区分开的多肽。在实施方案中,多肽变体通过一个或多个取代而与参考多肽区别开,所述取代可以是保守的或非保守的。在实施方案中,多肽变体包含保守取代,并且就这一点而言,在本领域中众所周知,某些氨基酸可以改变为具有大致相似性质的其他氨基酸,而不改变多肽活性的性质。多肽变体还涵盖其中一个或多个氨基酸已添加或缺失或被不同氨基酸残基取代的多肽。
[0068]
术语“启动子”是指被细胞的合成机制或引入的合成机制识别的dna序列,其是引发多核苷酸序列的特异性转录所必需的。术语“表达控制(调节)序列”是指在特定宿主生物中表达有效连接的编码序列所必需的dna序列。适用于原核生物的控制序列例如包括启动子,任选的操纵子序列和核糖体结合位点。已知真核细胞利用启动子、聚腺苷酸化信号和增强子。
[0069]
术语“结合”,“结合”或“与
……
相互作用”是指识别并附着于样品或生物中的第二分子但基本上不识别或附着于样品中其他结构上不相关的分子的分子。如本文所用,相对于抗体,术语“特异性结合”是指识别特异性抗原但基本上不识别或结合样品中其他分子的抗体。例如,特异性结合一种物种的抗原的抗体也可以结合一种或多种物种的抗原。但是,这种种间反应性本身并不改变抗体的特异性。在另一个实例中,特异性结合抗原的抗体也可以结合抗原的不同等位基因形式。但是,这种交叉反应性本身并不会改变抗体的特异性。在一些情况下,术语“特异性结合”或“特异性结合”可用于指抗体,蛋白质或肽与第二化学物种的相互作用,以表示相互作用取决于存在。化学物种上的特定结构(例如,抗原决定簇或表位);例如,抗体识别并结合特定的蛋白质结构,而不是与任何蛋白质结合。如果抗体对表位“a”具有特异性,则在包含标记“a”和抗体的反应中,包含表位a(或游离,未标记a)的分子的存在将减少与抗体结合的标记a的量。
[0070]“具有统计学意义”是指结果不太可能是偶然发生的。统计显着性可以通过本领域已知的任何方法确定。常用的显着性度量包括p值,p值是在无效假设为真时观察到的事件发生的频率或概率。如果获得的p值小于显着性水平,则拒绝原假设。在简单情况下,显着性水平定义为p值等于或小于0.05。“减少”或“减少”或“较少”的量通常是“统计上显着”或生理上显着的量,并且可以包括减少约1.1、1.2、1.3、1.4、1.5、1.6 1.7、1.8、1.9、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、15、20、30、40或50或更多倍(例如100、500、1000倍)(包括所有整数和介于1与大于1之间的小数点(例如1.5、1.6、1.7、1.8等))。
[0071]
术语“刺激”是指由刺激性分子(例如,tcr/cd3复合物)与其同源配体结合从而诱
导信号转导事件,例如经由tcr/cd3复合物的信号转导而诱导的主要反应。刺激可以介导某些分子表达的改变,例如tgf-β的下调和/或细胞骨架结构的重组。
[0072]
术语“刺激性分子”是指t细胞上与存在于抗原呈递细胞上的同源刺激性配体特异性结合的分子。例如,源自刺激分子的功能性信号传导结构域是与t细胞受体复合物相关的ζ链。刺激分子包括负责信号转导的结构域。
[0073]
术语“刺激性配体”是指当存在于抗原呈递细胞(例如,apc、树突状细胞、b细胞等)上时,可以与细胞(例如,t细胞)上的同源结合配偶体(本文称为“刺激性分子”)特异性结合的配体,从而介导t细胞的主要反应,包括激活、免疫反应的起始、增殖和类似过程。刺激性配体在本领域中是众所周知的,并且尤其包括装载有肽、抗cd3抗体、超激动剂抗cd28抗体和超激动剂抗cd2抗体的mhc i类分子。
[0074]
术语“治疗的”是指治疗和/或预防。通过抑制、减轻或消除疾病状态或减轻疾病状态的症状可获得治疗效果。
[0075]
术语“治疗有效量”是指将引起研究者、兽医、医生或其他临床医生所寻求的组织,系统或受试者的生物学或医学反应的主题化合物的量。术语“治疗有效量”包括当给药时足以防止所治疗的病症或疾病的一种或多种迹象或症状的发展或在某种程度上减轻的化合物的量。治疗有效量将取决于化合物,疾病及其严重程度以及待治疗受试者的年龄、体重等。
[0076]
术语“治疗疾病”是指降低受试者经历的疾病或病症的至少一种体征或症状的频率或严重性。
[0077]
术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞的过程。“转染的”或“转化的”或“转导的”细胞是已经用外源核酸转染,转化或转导的细胞。该细胞包括原代受试者细胞及其后代。
[0078]
术语“载体”是指包含分离的核酸并且可用于将分离的核酸递送至细胞内部的多核苷酸。在本领域中已知许多载体,包括线性多核苷酸、与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制质粒或病毒。该术语还包括促进核酸转移到细胞中的非质粒和非病毒化合物,例如聚赖氨酸化合物、脂质体等。病毒载体的例子包括腺病毒载体、腺伴随病毒载体、逆转录病毒载体等。例如,慢病毒是复杂的逆转录病毒,除了常见的逆转录病毒基因gag、pol和env外,还包含其他具有调节或结构功能的基因。慢病毒载体是本领域众所周知的。慢病毒的一些例子包括人类免疫缺陷病毒:hiv-1、hiv-2和猿猴免疫缺陷病毒:siv。慢病毒载体是通过多重减毒hiv毒力基因而产生的,例如,env、vif、vpr、vpu和nef基因被删除,从而使该载体具有生物学上的安全性。
[0079]
范围:在整个本公开中,本公开的各个方面可以以范围格式给出。应当理解,范围格式的描述仅是为了方便和简洁,并且不应当被解释为对本公开的范围的硬性限制。因此,范围的描述应被认为具有具体公开的所有可能的子范围以及处于那个范围内的单个数值。例如,范围的描述诸如从1至6应被认为具有具体公开的子范围诸如从1至3、从1至4、从1至5、从2至4、从2至6、从3至6等,以及那个范围内的单个数值,例如,1、2、2.7、3、4、5、5.3和6。不管范围的宽度如何,这一点都是适用的。
[0080]“嵌合抗原受体”(car)分子是至少包含细胞外结构域、跨膜结构域和细胞质结构域或细胞内结构域的重组多肽。在实施方案中,car的结构域在相同的多肽链上,例如嵌合
融合蛋白。在实施方案中,结构域在不同的多肽链上,例如结构域不连续。
[0081]
car分子的胞外结构域包括抗原结合结构域。抗原结合结构域用于扩增和/或维持修饰的细胞,例如car t细胞,或用于杀死肿瘤细胞,例如实体瘤。在实施方案中,用于扩增和/或维持修饰的细胞的抗原结合结构域结合wbc表面上的抗原,例如细胞表面分子或标志物。在实施方案中,wbc是gmp(粒细胞巨噬细胞前体)、mdp(单核细胞巨噬细胞/树突状细胞前体)、cmop(普通单核细胞前体)、嗜碱性粒细胞、嗜酸性粒细胞、嗜中性粒细胞、satm(含七叶形核的非典型单核细胞)、巨噬细胞、单核细胞、cdp(常规树突状细胞前体)、cdc(常规dc)、pdc(浆细胞样dc)、clp(常规淋巴细胞前体)、b细胞、ilc(先天淋巴细胞)、天然杀伤性(nk)细胞、巨核细胞、成肌细胞、原髓细胞、骨髓细胞、间质骨髓细胞、带细胞、淋巴母细胞、原淋巴细胞、单核细胞、巨核细胞、原核细胞、巨核细胞、血小板或msdc(髓样来源的抑制细胞)中的至少一种。在实施方案中,wbc是粒细胞、单核细胞和/或淋巴细胞。在实施方案中,wbc是淋巴细胞,例如b细胞。在实施方案中,wbc是b细胞。在实施方案中,b细胞的细胞表面分子包括cd19、cd22、cd20、bcma、cd5、cd7、cd2、cd16、cd56、cd30、cd14、cd68、cd11b、cd18、cd169、cd1c、cd33、cd38、cd138、或cd13。在实施方案中,b细胞的细胞表面分子是cd19、cd20、cd22或bcma。在实施方案中,b细胞的细胞表面分子是cd19。
[0082]
本文所述的细胞,包括修饰的细胞,例如car细胞和修饰的t细胞,可以衍生自干细胞。干细胞可以是成体干细胞、胚胎干细胞,更特别地是非人类干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导性多能干细胞、全能干细胞或造血干细胞。修饰的细胞还可以是树状细胞、nk细胞、b细胞或t细胞,其选自炎性t淋巴细胞,细胞毒性t淋巴细胞,调节性t淋巴细胞或辅助性t淋巴细胞。在实施方案中,修饰的细胞可以源自由cd4+t淋巴细胞和cd8+t淋巴细胞组成的组。在细胞扩增和遗传修饰之前,可通过多种非限制性方法从受试者获得细胞来源。t细胞可从许多非限制性来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位的组织、腹水、胸腔积液、脾脏组织和肿瘤。在实施方案中,可以使用本领域技术人员已知的任何数量的t细胞系。在实施方案中,修饰的细胞可源自健康供体,诊断为癌症的患者或诊断为感染的患者。在实施方案中,修饰的细胞是呈现不同表型特征的混合细胞群的一部分。
[0083]
细胞群体是指两个或多个细胞组成的组。种群的细胞可以是相同的,从而种群是同质的细胞种群。群体的细胞可以是不同的,以使得该群体是细胞的混合群体或异质群体。例如,混合的细胞群可以包括包含第一car的修饰细胞和包含第二car的细胞,其中第一car和第二car结合不同的抗原。
[0084]
术语“干细胞”是指某些具有自我更新能力和分化成其他类型细胞的细胞。例如,干细胞可产生两个子干细胞(如体外培养的胚胎干细胞)或一个干细胞和经历分化的细胞(如在造血干细胞发生的产生血细胞的情况)。可以基于干细胞的来源和/或它们分化为其他类型细胞的能力范围来区分不同类别的干细胞。例如,干细胞可以包括胚胎干(es)细胞(即,多能干细胞)、体细胞干细胞、诱导的多能干细胞和任何其他类型的干细胞。
[0085]
多能胚胎干细胞存在于胚泡的内部细胞团中,具有先天的分化能力。例如,多能胚胎干细胞有可能在体内形成任何类型的细胞。当长时间在体外生长时,es细胞保持多能性,因为子代细胞保留了多谱系分化的潜力。
[0086]
体干细胞可以包括胎儿干细胞(来自胎儿)和成年干细胞(存在于各种组织中,例
如骨髓)。这些细胞被认为具有比多能es细胞低的分化能力-胎儿干细胞的能力大于成年干细胞的能力。体细胞干细胞显然只能分化为有限数量的细胞类型,并已被描述为多能干细胞。“组织特异性”干细胞通常仅产生一种类型的细胞。例如,胚胎干细胞可以分化为血液干细胞(例如,造血干细胞(hsc)),血液干细胞可以进一步分化为各种血细胞(例如,红细胞、血小板、白细胞等)。
[0087]
诱导的多能干细胞(即,ips细胞或ipsc)可以包括通过诱导特定基因的表达而人工衍生自非多能细胞(例如,成年体细胞)的一种多能干细胞。诱导的多能干细胞在许多方面类似于天然多能干细胞,例如胚胎干(es)细胞,例如某些干细胞基因和蛋白质的表达,染色质甲基化模式,倍增时间,胚状体形成,畸胎瘤形成,可行的嵌合体形成以及效价和可分化性。诱导的多能细胞可以从成年的胃,肝,皮肤和血细胞中获得。
[0088]
在实施方案中,用于杀死肿瘤的抗原结合结构域结合肿瘤表面上的抗原,例如肿瘤抗原或肿瘤标志物。肿瘤抗原是由肿瘤细胞产生的蛋白质,其引起免疫反应,特别是t细胞介导的免疫反应。肿瘤抗原是本领域众所周知的,并且包括例如与肿瘤相关的muc1(tmuc1)、与神经胶质瘤相关的抗原、癌胚抗原(cea)、β-人绒毛膜促性腺激素、α甲胎蛋白(afp)、凝集素反应性afp、甲状腺球蛋白、rage-1、mn-caix、人类端粒酶逆转录酶、ru1、ru2(as)、肠羧基酯酶、mut hsp70-2、m-csf、蛋白酶、前列腺特异性抗原(psa)、pap、ny-eso-1、lage-1a、p53、prostein、psma、her2/neu、存活蛋白、端粒酶、前列腺癌肿瘤抗原1(pcta-1)、mage、elf2m、嗜中性弹性蛋白酶、ephrinb2、cd22,胰岛素生长因子(igf)-i、igf-ii、igf-i受体、cd19和间皮素。例如,当肿瘤抗原是cd19时,其car可以被称为cd19car(19car、cd19car或cd19-car),其是包括结合cd19的抗原结合域的car分子。
[0089]
在实施方案中,car的细胞外抗原结合结构域包括至少一种scfv或至少单结构域抗体。例如,car上可以有两个scfv。scfv包括通过柔性接头连接的靶抗原特异性单克隆抗体的轻链可变区(vl)和重链可变区(vh)。可以通过使用短连接肽连接轻链和/或重链可变区来制备单链可变区片段(bird等,science 242:423-426,1988)。连接肽的例子是具有氨基酸序列(ggggs)3的gs接头,其在一个可变区的羧基末端和另一可变区的氨基末端之间桥接约3.5nm。已经设计和使用了其他序列的接头(bird等,1988,同上)。通常,接头可以是短的柔性多肽,并且优选包含约20个或更少的氨基酸残基。单链变体可以重组或合成产生。对于scfv的合成生产,可以使用自动合成器。为了重组产生scfv,可以将含有编码scfv的多核苷酸的合适质粒引入合适的宿主细胞,所述宿主细胞是真核的,例如酵母、植物、昆虫或哺乳动物细胞,或原核的,例如大肠杆菌。编码目的scfv的多核苷酸可以通过常规操作例如多核苷酸的连接来制备。可以使用本领域已知的标准蛋白质纯化技术分离所得的scfv。
[0090]
本文描述的car分子的细胞质结构域包括一个或多个共刺激结构域和一个或多个信号传导结构域。共刺激和信号传导结构域用于响应抗原结合而传递信号并激活分子,例如t细胞。一个或多个共刺激结构域衍生自刺激分子和/或共刺激分子,并且信号传导结构域衍生自主要信号传导结构域,例如cd3ζ结构域。在实施方案中,信号传导结构域还包括衍生自共刺激分子的一个或多个功能信号传导结构域。在实施方案中,共刺激分子是激活对抗原的细胞应答所需的细胞表面分子(抗原受体或其配体除外)。
[0091]
在实施方案中,共刺激结构域包括cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7的细胞内结构域、light、nkg2c、b7-h3、与
cd83特异性结合的配体、或其任何组合。在实施方案中,信号传导结构域包括衍生自t细胞受体的cd3ζ结构域。
[0092]
本文描述的car分子还包括跨膜结构域。在car分子中掺入跨膜结构域使分子稳定。在实施方案中,car分子的跨膜结构域是cd28或4-1bb分子的跨膜结构域。
[0093]
在car的细胞外结构域和跨膜结构域之间,可以掺入间隔结构域。如本文所用,术语“间隔区”通常是指具有将跨膜结构域连接至多肽链上的细胞外结构域和/或细胞质结构域的功能的任何寡聚或多肽。间隔域可以包含多达300个氨基酸,优选10至100个氨基酸,最优选25至50个氨基酸。
[0094]
实施方案涉及编码tcr-cd3复合物的修饰的组分的多核苷酸。实施方案涉及包含多核苷酸的载体。实施方案涉及修饰的包含多核苷酸的细胞。实施方案涉及工程改造以表达tcr-cd3复合物的修饰组分的修饰细胞,其中所述修饰细胞包括抗原结合分子。实施方案涉及多核苷酸的方法或用途,该方法包括提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),该载体基因组包含多核苷酸。向受试者施用一定量的病毒颗粒,以使多核苷酸在受试者中表达。在实施方案中,aav制剂可以包括aav载体颗粒、空衣壳和宿主细胞杂质,从而提供了基本上不含aav空衣壳的aav产物。实施方案涉及包含细胞群体的药物组合物。实施方案涉及在有需要的受试者中引起或引发t细胞应答和/或治疗该受试者的肿瘤的方法,该方法包括施用有效量的组合物。在实施方案中,多核苷酸包含表2中列出的序列中的至少一个。例如,抗原特异性t细胞受体(tcr)由二硫键连接的异二聚体组成,其包含两个克隆分布的,完整的膜糖蛋白链α和β,或与低分子量不变蛋白复合物非共价结合的γ和δ,通常称为cd3(即tcr-cd3复合物)。tcrα和β链决定了抗原的特异性,而cd3结构被认为代表了辅助分子,这些分子可能是激活信号的转导元件,该激活信号是在tcrαβ与其配体结合后引发的。tcr复合物与主要组织相容性复合物(mhc)蛋白中呈现的小肽抗原相互作用。mhc蛋白代表随机分布在整个物种中的另一组高度多态的分子。
[0095]
tcr-cd3复合物的修饰成分可以整体在til或tcr t中表达,并且可以取代cd3中的肽链,因此当cd3被激活时,将有共刺激结构域的信号并增强til/tcr-t。普通tcr仅激活cd3,此处设计的tcr-cd3复合物已添加了共刺激结构域,信号更强。设计的tcr-cd3复合物可以与car的使用相关联,并且可以是通用组件。当cd3被激活时,将会有一个共刺激结构域信号,可以增强tcr-t的杀伤作用。在实施方案中,tcr-cd3复合物包含tcrα、tcrβ、cd3γ、cd3ζ、cd3ε和cd3δ链。在实施方案中,tcr-cd3复合物包含tcrγ、tcrδ、cd3γ、cd3ζ、cd3ε和cd3δ链。在实施方案中,tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的tcr-cd3复合物的组分。
[0096]
在实施方案中,一个或多个共刺激信号传导结构域包括一种或多种蛋白质的一个或多个功能性信号传导结构域,其中蛋白质包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160
(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、sellpg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、nkg2d、vflip k13、k13-opt、nemo突变体、nemo融合蛋白、ikki-s176e-s180e、ikk2-s177e-s181e、rip、ikkα、ikkβ、tcl-1、myd88-l265、nf-kb激活蛋白或蛋白片段、nf-kb抑制剂途径的任何抑制剂、任何能够选择性激活nf-κb的基因编辑系统。
[0097]
在实施方案中,一个或多个共刺激信号传导结构域包括一种或多种蛋白质的一个或多个功能性信号传导结构域,其中蛋白质包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、sellpg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46和nkg2d。
[0098]
在实施方案中,tcr-cd3复合物的修饰的组分包含cd3γ、cd3ζ、cd3ε和/或cd3δ链。在实施方案中,tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3γ。在实施方案中,tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3ζ。在实施方案中,tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3ε。在实施方案中,tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3δ。在实施方案中,cd3γ、cd3ζ、cd3ε和/或cd3δ链和一个或多个共刺激信号传导结构域通过接头(例如gs接头)连接。在实施方案中,一个或多个共刺激信号传导结构域包含至少两个共刺激信号传导结构域。在实施方案中,至少两个共刺激信号传导结构域通过接头(例如,gs接头)连接。在实施方案中,tcr-cd3复合物的修饰的组分是修饰的cd3结构域。在实施方案中,修饰的tcr-cd3复合物被修饰的细胞过表达,和/或修饰的cd3结构域被修饰的细胞过表达。
[0099]
在实施方案中,tcr-cd3复合物的修饰的组分的表达可以由诱导型表达系统调节。诱导型表达系统允许基因的时间和空间控制的激活和/或表达。例如,四环素控制的转录激活是一种诱导型基因表达的方法,其中在存在抗生素四环素或其一种衍生物(例如强力霉素)的情况下可逆地开启或关闭转录。例如,可诱导的自杀基因表达系统允许自杀基因在时间和空间上受控制的激活和/或表达,这导致细胞通过凋亡使其自身死亡。
[0100]
在实施方案中,修饰的细胞包含编码反向四环素反式激活剂(rtta)的核酸序列。在实施方案中,一种或多种分子的表达由rtta调节,使得tcr-cd3复合物的修饰的组分在四环素存在下表达。在实施方案中,细胞培养基中四环素的浓度不小于约2μg/ml。在实施方案中,四环素选自四环素、地美环素、甲氯环素、强力霉素、莱美环素、甲环素、米诺环素、土霉素、四环素和金霉素。在实施方案中,四环素是强力霉素。
[0101]
在实施方案中,可诱导的自杀系统是hsv-tk系统或可诱导的胱天蛋白酶9系统。在实施方案中,修饰的细胞包含编码自杀基因的核酸序列,使得当修饰的细胞以允许自杀基
因表达的方式存在核苷类似物时,使核苷类似物对修饰的细胞具有细胞毒性。在实施方案中,自杀基因选自单纯疱疹病毒的胸苷激酶、水痘带状疱疹病毒的胸苷激酶和细菌胞嘧啶脱氨酶。在实施方案中,自杀基因是单纯疱疹病毒的胸苷激酶。在实施方案中,核苷类似物选自更昔洛韦、阿昔洛韦、比昔洛韦、泛昔洛韦、喷昔洛韦、缬昔洛韦、三氟胸苷、1-[2-脱氧,2-氟,β-d-阿拉伯呋喃呋喃糖基]-5-碘尿嘧啶、ara-a、arat1-β-d-阿拉伯呋喃氧基胸腺嘧啶、5-乙基-2'-脱氧尿苷、5-碘-5'-氨基-2,5'-二脱氧尿苷、异氧尿苷、azt、aiu、双脱氧胞苷和arac。在实施方案中,核苷类似物是更昔洛韦。
[0102]
在实施方案中,tcr-cd3复合物的修饰的组分的表达由一个或多个启动子调节。在实施方案中,多核苷酸包含启动子,所述启动子包含转录调节剂的结合位点,所述转录调节剂调节细胞中tcr-cd3复合物的修饰成分的表达和/或分泌。例如,转录调节剂是或包括hif1a、nfat、foxp3和/或nfkb。例如,tcr-cd3复合物的修饰的组分包含至少一个与氧敏感性多肽结构域缔合的共刺激信号传导结构域,并且氧敏感性多肽结构域包含hif vhl结合结构域。
[0103]
在实施方案中,多核苷酸可以整合到修饰细胞的基因组中,并且修饰细胞的后代也将表达多核苷酸,从而产生稳定转染的修饰细胞。在实施方案中,修饰的细胞可以表达编码car的多核苷酸,但是该多核苷酸不整合到修饰的细胞的基因组中,使得修饰的细胞在有限的时间段(例如几天)中表达瞬时转染的多核苷酸,之后,多核苷酸会因细胞分裂或其他因素而丢失。例如,多核苷酸以重组dna构建体、mrna或病毒载体形式存在于修饰的细胞中,和/或多核苷酸是不整合到修饰的细胞的基因组中的mrna。
[0104]
与多核苷酸的方法或用途有关的实施方案,该方法包括提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),该载体基因组包含编码一个以上分子的多核苷酸和编码结合分子的多核苷酸,所述多核苷酸可操作地连接至赋予所述多核苷酸转录的表达控制元件;向受试者施用一定量的病毒颗粒,以使多核苷酸在受试者中表达。在实施方案中,aav制剂可以包括aav载体颗粒、空衣壳和宿主细胞杂质,从而提供了基本上不含aav空衣壳的aav产物。
[0105]
实施方案涉及多核苷酸的方法或用途。所述方法或用途包括:提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),所述载体基因组包含所述多核苷酸,其中所述多核苷酸可操作地连接至赋予所述多核苷酸转录的表达控制元件,和向受试者施用一定量的病毒颗粒,以使多核苷酸在受试者中表达。在实施方案中,aav制剂可以包括aav载体颗粒、空衣壳和宿主细胞杂质,从而提供了基本上不含aav空衣壳的aav产物。病毒颗粒的给药和制备的更多信息可以在美国专利号:9840719和milani等,sci.natl.acad.sci。翻译中11,eaav7325(2019)may 22 2019,其通过引用并入本文。
[0106]
在实施方案中,可以以约0.5
×
106细胞/ml的细胞密度以大于95%的生存力接种生物反应器。当细胞密度达到大约1.0
×
106细胞/ml时,可以用pei/dna比率为2:1的pei/dna复合物(多聚体)转染细胞。在收获时,可以使用triton x-100方法释放生物反应器中细胞培养物中的aav。可以将所有溶液直接添加到生物反应器中,并将裂解物以4000
×
g离心20分钟。上清液可以储存在-80℃进行进一步处理。aav可以进一步纯化。例如,可以通过分别使用浓度分别为15、25、40和54%碘克沙醇的浓度分别为1、5、7和5ml的aav样品(12.3ml)覆盖一系列阶梯梯度来纯化。15%碘克沙醇的浓度还包含1m nacl,以避免aav与其他细胞
蛋白和带负电荷的核成分聚集。离心完成后,可以在标记为40/54的界面下方2毫米处抽出5ml溶液,然后在sorval超速离心机中的sorvals t-865转子中以385,000
×
g的速度超速离心1小时45分钟。然后可以定量病毒载体。例如,在所有情况下,可以通过使用gfp作为报告基因的基因转移测定(gta)来确定载体aav的感染性。aav感染性分析,可以在将样品添加到细胞之前先对其进行稀释,以使gfp阳性细胞在2%至20%的范围内,以确保只有一种病毒进入细胞以表达gfp。gfp阳性细胞可以使用悬浮的hek293细胞通过facs定量。然后可以将aav施用给受试者。例如,可以将aav稀释在0.9%的无菌nacl盐溶液(补充有0.25%的人血清白蛋白[hsa])中,以向患者输液,最终输液量将根据患者体重计算为3ml/kg。
[0107]
在实施方案中,修饰的细胞包含抗原结合分子,抗原结合分子是嵌合抗原受体(car),其包含抗原结合结构域、跨膜结构域和细胞内信号传导结构域。在实施方案中,抗原结合结构域与肿瘤抗原结合,所述肿瘤抗原包括tshr、cd19、cd123、cd22、cd30、cd171、cs-1、cll-1、cd33、egfrviii、gd2、gd3、bcma、tn ag、psma、ror1、flt3、fap、tag72、cd38、cd44v6、cea、epcam、b7h3、kit、il-13ra2、mesothelin、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、cd20、叶酸受体α、erbb2(her2/neu)、muc1、egfr、ncam、前列腺素酶、pap、elf2m、ephrin b2、igf-i受体、caix、lmp2、gp100、bcr-abl、酪氨酸酶、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、邻乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、ny-eso-1、lage-1a、mage-a1、legumain、hpv e6、e7、mage a1、etv6-aml、精子蛋白17、xage1、tie 2、mad-ct-1、mad-ct-2、fos相关抗原1、p53、p53突变体、prostein、survivin和端粒酶、pcta-1/galectin 8、melana/mart1、ras突变体、htert、sar昏迷易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄激素受体、细胞周期蛋白b1、mycn、rhoc、trp-2、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、rage-1、人端粒酶逆转录酶、ru1、ru2、肠道羧基酯酶、mut hsp70-2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5和igll1。在实施方案中,细胞内信号传导结构域包含共刺激信号传导结构域,或主要信号传导结构域和共刺激信号传导结构域,其中共刺激信号传导结构域包括蛋白质的功能性信号传导结构域,其中蛋白质包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、bl ame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46和nkg2d。
[0108]
在实施方案中,修饰的细胞包含抗原结合分子,抗原结合分子是修饰的tcr。在实施方案中,tcr衍生自患者中自发发生的肿瘤特异性t细胞。在实施方案中,tcr结合肿瘤抗原。在实施方案中,肿瘤抗原包含cea、gp100、mart-1、p53、mage-a3或ny-eso-1。在实施方案
中,tcr包含tcrγ和tcrδ链或tcrα和tcrβ链,或其组合。
[0109]
在实施方案中,第一抗原结合结构域在car上,并且第二抗原结合结构域在t细胞受体(tcr)上。在实施方案中,tcr是修饰的tcr。在实施方案中,tcr衍生自患者中自发发生的肿瘤特异性t细胞。在实施方案中,tcr结合肿瘤抗原。在实施方案中,肿瘤抗原包含cea、gp100、mart-1、p53、mage-a3或ny-eso-1。
[0110]
在实施方案中,可以分离表达对靶抗原具有高亲和力的tcr的t细胞克隆。可以在抗原呈递细胞(apc)的存在下培养肿瘤浸润淋巴细胞(til)或外周血单核细胞(pbmc),所述抗原呈递细胞用代表已知在确定的hla等位基因中呈递时会引发显性t细胞应答的表位的肽进行脉冲。然后可以根据mhc-肽四聚体染色和/或识别和裂解以低滴定浓度的同源肽抗原脉冲化的靶细胞的能力来选择高亲和力克隆。选择克隆后,通过分子克隆鉴定并分离tcrα和tcrβ链或tcrγ和tcrδ链。例如,对于tcrα和tcrβ链,然后将tcrα和tcrβ基因序列用于产生表达构建体,其理想地促进人tc细胞中两条tcr链的稳定,高水平表达。然后可以产生转导载体,例如γ逆转录病毒或慢病毒,并测试其功能性(抗原特异性和功能亲和力),并用于生产临床上大量的载体。然后可以使用等分试样的最终产品转导目标t细胞群体(通常从患者pbmc中纯化),然后在输注到患者体内之前将其扩增。
[0111]
可以实施各种方法来获得编码肿瘤反应性tcr的基因。在kershaw等人的clin transl immunology中提供了更多信息。2014年5月;3(5):e16。在实施方案中,特异性tcr可以源自患者中自发发生的肿瘤特异性t细胞。此类别中包括的抗原包括黑素细胞分化抗原mart-1和gp100,以及mage抗原和ny-eso-1,它们在更广泛的癌症中表达。只要病毒蛋白由转化细胞表达,对病毒相关恶性肿瘤特异的tcrs也可以被分离。此类别的恶性肿瘤包括与肝炎和乳头瘤病毒相关的肝癌和宫颈癌,以及与爱泼斯坦-巴尔病毒相关的恶性肿瘤。在实施方案中,tcr的靶抗原可以包括cea(例如,用于结肠直肠癌)、gp100、mart-1、p53(例如,用于黑色素瘤)、mage-a3(例如,黑色素瘤,食道和滑膜肉瘤)、ny-eso-1(例如,黑色素瘤和肉瘤以及多发性骨髓瘤)。
[0112]
在实施方案中,肿瘤浸润淋巴细胞(til)的制备和输注可以通过以下方式实现。例如,肿瘤组织来自手术或活检标本,可以在无菌条件下获得,并运输到冰箱中的细胞培养室。坏死组织和脂肪组织可以被去除。可以将肿瘤组织切成约1-3立方毫米的小块。可以加入胶原酶,透明质酸酶和dna酶,并在4℃下消化过夜。用0.2um过滤器过滤,可通过淋巴细胞分离液(1500rpm)5分钟分离并收集细胞。用包含pha,2-巯基乙醇和cd3单克隆抗体的培养基扩增细胞,可以加入小剂量的il-2(10-20iu/ml)以诱导活化和增殖。根据生长情况,可以在37℃,5%co2的条件下7-14天仔细检测并保持细胞密度在0.5
×
10
6-2
×
10
6
/ml的范围内。til阳性细胞具有杀死同源癌细胞的能力,可以通过共培养筛选出来。可以在含有高剂量il2(5000-6000iu/ml)的无血清培养基中扩增阳性细胞,直到获得大于1
×
10
11
的til。为了施用til,可首先使用连续流离心将其收集在盐水中,然后通过血小板施用过滤,过滤至体积为200-300ml的含有5%白蛋白和450000 iu il-2的溶液中。可以在30-60分钟内通过中央静脉导管将til注入患者体内。在实施方式中,til经常可以被注入到两个至四个分开的袋子中;例如,在袋中。输液可能要分开几个小时。如果可以施用超过约1.5
×
10
11
的til,通常可以连续2天服用。
[0113]
在实施方案中,细胞是免疫效应细胞(例如,免疫效应细胞群)。在实施方案中,免
疫效应细胞是t细胞或nk细胞。在实施方案中,免疫效应细胞是t细胞。在实施方案中,t细胞是cd4+t细胞、cd8+t细胞或其组合。在实施方案中,细胞是人细胞。
[0114]
在实施方案中,通过引入编码tcr-cd3复合物的修饰的成分和/或结合分子的核酸序列来实现tcr-cd3复合物的修饰的成分的增强的表达和/或功能,所述核酸序列以重组dna构建体、mrna或病毒载体形式存在于修饰的细胞中。
[0115]
在实施方案中,核酸序列是不整合到修饰细胞的基因组中的mrna。在实施方案中,核酸序列与氧敏感性多肽结构域相关。在实施方案中,氧敏感性多肽结构域包含hif vhl结合结构域。在实施方案中,核酸序列由启动子调节,该启动子包含转录调节剂的结合位点,该转录调节剂调节细胞中治疗剂的表达和/或分泌。在实施方案中,转录调节剂是或包括hif1a、nfat、foxp3和/或nfkb。
[0116]
实施方案涉及在肿瘤微环境中增强修饰的细胞(例如,免疫细胞)代谢的组合物和方法。例如,可以提高乳酸的代谢(例如转运蛋白mct1和mct4)。厌氧和有氧呼吸和线粒体功能和/或氨基酸代谢可以得到增强。修饰的细胞通过增强代谢乳酸的途径(例如,使用转运蛋白mct1、mct4来增强乳酸代谢)(例如,表7中列出的分子),厌氧和有氧呼吸线粒体功能(例如,列出的分子)来增强代谢和/或氨基酸的代谢(例如,表9中列出的分子)。
[0117]
肿瘤微环境的条件(例如低氧,高酸等)抑制t细胞的生存能力,增强t细胞单羧酸盐转运蛋白的功能可以有效地帮助t细胞在肿瘤微环境中生存。mct1通常在t细胞上表达,调节乳酸向内和向外的双向运输,并且在肿瘤细胞中也表达。mct4在某些肿瘤细胞中高表达,调节乳酸的向外运输,在正常t细胞上不表达。mct2在正常t细胞上表达,并在体内其他一些细胞上表达,调节乳酸向细胞内的运输。cd147是mct家族蛋白的辅助蛋白,可调节mct家族蛋白在细胞膜上的正确定位。ldhb将乳酸转化为丙酮酸。丙酮酸可以通过线粒体膜上的丙酮酸转运蛋白(mpc)进入线粒体,并最终通过线粒体进行氧化和分解。通过敲除/敲除mct1/2,mct3的过度表达使乳酸不会进入t细胞。通过过度表达mct1/2,敲低/敲除mct3以及过度表达ldhb和mpc,它可以增强乳酸进入t细胞并增强乳酸的代谢,帮助免疫细胞增强对固体的抵抗力。肿瘤。线粒体的氧化功能可以通过过度表达线粒体蛋白如frataxin、hba、hbb、hbd、hbe、hbe和/或hbg等来实现,它促进血红素和血红蛋白的合成并增强线粒体的氧存储能力;通过过表达tomm20、tomm22、tomm40和/或tom70促进线粒体的组装,线粒体的功能最终得到增强,免疫细胞适应肿瘤的微环境,提高了肿瘤的治疗能力。为了使t细胞具有更多的氨基酸,可以使用:氨基酸转运蛋白cd98、snat1、snat2和/或asct2等的过表达,将氨基酸从细胞外转运到细胞内,或者可以转化为谷氨酰胺盐进入通过gls谷氨酰胺进行三羧酸循环。然后通过pck酶将其从poa转换为pep。
[0118]
实施方案涉及修饰为以高于或低于未被修饰以表达一种或多种分子的细胞表达的一种或多种表达水平的水平表达一种或多种分子的细胞,其中一种或多种分子与修饰细胞的代谢有关。实施方案涉及工程改造以表达抗原结合分子的修饰细胞,其中修饰细胞中一个或多个分子的表达和/或功能已经增强或降低(包括消除),其中一个或多个分子与代谢修改后的单元格。在一些实施方案中,修饰的细胞包括与一个或多个分子的生物合成或转运途径相关的内源基因的破坏或外源基因的添加。实施方案涉及包含细胞群体的药物组合物。实施方案涉及在需要其的受试者中引起或引发t细胞应答和/或治疗该受试者的肿瘤的方法,该方法包括向该受试者施用有效量的权利要求6的组合物。实施方案涉及编码一个
或多个分子与修饰的细胞的代谢相关的分离的核酸序列。
[0119]
实施方案涉及多核苷酸的方法或用途,该方法包括提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),该载体基因组包含编码一个以上分子的多核苷酸和编码结合分子的多核苷酸,将多核苷酸可操作地连接至赋予多核苷酸转录的表达控制元件;向受试者施用一定量的病毒颗粒,以使多核苷酸在受试者中表达,其中一种或多种分子在癌细胞中过表达,与免疫细胞的募集有关,和/或与自身免疫有关。在实施方案中,aav制剂可以包括aav载体颗粒、空衣壳和宿主细胞杂质,从而提供了基本上不含aav空衣壳的aav产物。
[0120]
在实施方案中,一种或多种分子包含mct1、mct2、mct3、ldhb和mpc中的至少一种,一种或多种分子的功能变体或一种或多种分子的功能片段;和/或新陈代谢包括乳酸的新陈代谢。
[0121]
在实施方案中,代谢包括改变的修饰细胞的乳酸的运输。
[0122]
在实施方案中,与相应的野生型细胞相比,修饰的细胞将更少或更多的乳酸运输到修饰的细胞中。
[0123]
在实施方案中,与相应的野生型细胞相比,修饰的细胞过表达mct 3并且表达更少的mct1和mct2,并且将更少的乳酸运输到修饰的细胞中。
[0124]
在实施方案中,与相应的野生型细胞相比,修饰的细胞过表达mct1、mct2、ldhb和mpc,表达较少的mct3,并将更多的乳酸运输到修饰的细胞中。
[0125]
在一些实施方案中,所述一种或多种分子包含以下至少一种:frataxin、hba、hbb、hbd、hbe、hbg、tomm20和tomm22,一种或多种分子的功能变体或一种或多种分子的功能片段;和/或新陈代谢包括乳酸的新陈代谢。
[0126]
在实施方案中,代谢包括修饰的细胞的线粒体的氧化功能增强。
[0127]
在实施方案中,修饰的细胞过表达frataxin、hba、hbb、hbd、hbe、hbg,以增强修饰的细胞的线粒体氧存储能力。
[0128]
在实施方案中,修饰的细胞过表达tomm20和tomm22,以增强修饰的细胞的线粒体功能。
[0129]
在实施方案中,一种或多种分子包含cd98、snat1、snat2、asct2、一种或多种分子的功能变体或一种或多种分子的功能性片段中的至少一种;和/或新陈代谢包括乳酸的新陈代谢。
[0130]
在实施方案中,代谢包括增强的修饰细胞的氨基酸代谢。
[0131]
在实施方案中,修饰的细胞过表达cd98、snat1、snat2、asct2,以增强修饰的细胞将氨基酸转运到修饰的细胞中的转运能力。
[0132]
实施方案涉及修饰t细胞中的靶基因组基因座以下调目的基因的方法,该方法包括:将在靶基因组基因座内产生单链或双链断裂的核酸酶引入t细胞中;将核酸插入片段引入细胞中,以敲除或剔除目的基因;选择包含整合到靶基因组基因座中的核酸插入片段的细胞。在一些实施方案中,核酸插入物的侧翼是5'同源臂和3'同源臂,并且核酸插入物的3'同源臂和核酸插入物的5'同源臂与相应的基因组同源目标基因组基因座内的片段。在一些实施方案中,核酸酶剂是锌指核酸酶(zfn),转录激活因子样效应子核酸酶(talen)或大范围核酸酶。在某些实施方案中,核酸酶试剂包含簇状规则间隔的短回文重复序列(crispr)
相关(cas)蛋白和指导rna(grna)。例如,cas蛋白是cas9。
[0133]
在实施方案中,多核苷酸的表达由合成的notch受体调节或调节,所述notch受体从n-末端到c-末端并以共价键合包含:a)包含抗体的细胞外结构域(例如,单链fv(scfv))或纳米抗体)特异性结合抗原;b)notch调节区(nrr)和c)包含转录激活剂的细胞内结构域,该转录激活剂包含dna结合结构域。在实施方案中,notch调节区包含lin 12-notch重复,包含s2蛋白水解切割位点的异二聚结构域和包含s3蛋白水解切割位点的跨膜结构域。细胞内结构域与notch调节区异源。在一些实施方案中,转录激活剂替代天然存在的细胞内缺口结构域,并且抗体与抗原的结合诱导在s2和s3蛋白水解切割位点的切割,从而释放细胞内结构域。细胞内结构域的释放导致转录激活剂诱导修饰细胞中编码一种或多种靶蛋白的多核苷酸的表达。在实施方案中,修饰的细胞包含编码合成的notch受体的多核苷酸和编码转录控制元件的多核苷酸,所述转录控制元件响应转录激活子并与编码一种或多种靶蛋白的多核苷酸可操作地连接(例如,与代谢有关的分子的过表达)
[0134]
示例性实施例
[0135]
以下是示例性实施例:
[0136]
1.编码tcr-cd3复合物的修饰成分的多核苷酸。
[0137]
2.一种载体,其包含实施方案1的多核苷酸。
[0138]
2.修饰的细胞,其包含实施方案1的多核苷酸。
[0139]
3.工程改造以表达tcr-cd3复合物的修饰组分的修饰细胞,其中所述修饰细胞包括抗原结合分子。
[0140]
4.一种多核苷酸的方法或用途,所述方法包括
[0141]
提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),该载体基因组包含实施方案1的多核苷酸;和
[0142]
向受试者施用一定量的病毒颗粒,以使多核苷酸在受试者中表达。
[0143]
5.根据实施例4所述的方法,其中所述aav制备物可包含aav载体颗粒、空衣壳和宿主细胞杂质,从而提供基本不含aav空衣壳的aav产物。
[0144]
6.一种药物组合物,其包含实施方案2和3中任一项的细胞群。
[0145]
7.一种在需要其的受试者中引起或引发t细胞应答和/或治疗该受试者的肿瘤的方法,该方法包括向该受试者施用有效量的实施方案6的组合物。
[0146]
8.任何进行中的实施方案1-7的多核苷酸,其中所述多核苷酸包含表2中列出的序列中的至少一个。
[0147]
9.实施方案1-8中任一项的多核苷酸,载体,修饰的细胞和方法,其中所述tcr-cd3复合物包含tcrα、tcrβ、cd3γ、cd3ζ、cd3ε和cd3δ链。
[0148]
10.实施方案1-8中任一项的多核苷酸,载体,修饰的细胞和方法,其中tcr-cd3复合物包含tcrγ、tcrδ、cd3γ、cd3ζ、cd3ε和cd3δ链。
[0149]
11.实施方案1-10中任一项的多核苷酸,载体,修饰的细胞和方法,其中tcr-cd3复合物的修饰的组分包含连接到一个或多个共刺激信号传导结构域的tcr-cd3复合物的组分。
[0150]
12.实施方案11的多核苷酸、载体、修饰的细胞和方法,其中所述一个或多个共刺激信号传导结构域包括一种或多种蛋白质的一个或多个功能性信号传导结构域,其中蛋白
质包括cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、sellpg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、nkg2d、vflip k13、k13-opt、nemo突变体、nemo融合蛋白、kki-s176e-s180e、ikk2-s177e-s181e、rip、ikkα、ikkβ、tcl-1、myd88-l265、nf-kb激活蛋白或蛋白片段、nf-kb抑制剂途径的任何抑制剂、任何能够选择性激活nf-κb的基因编辑系统。
[0151]
13.实施方案11的多核苷酸、载体、修饰的细胞和方法,其中所述一个或多个共刺激信号传导结构域包括一种或多种蛋白质的一个或多个功能性信号传导结构域,其中蛋白质包括cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、sellpg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46和nkg2d。
[0152]
14.实施方案1-13中任一项的多核苷酸,载体,修饰的细胞和方法,其中tcr-cd3复合物的修饰的组分包含cd3γ、cd3ζ、cd3ε和/或cd3δ链。
[0153]
15.实施方案1-13中任一项的多核苷酸,载体,修饰的细胞和方法,其中tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3γ,和/或tcr的修饰的组分-cd3复合物包含连接至一个或多个共刺激信号传导结构域的cd3ζ。
[0154]
16.实施方案1-13中任一项的多核苷酸、载体、修饰的细胞和方法,其中tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3ε。
[0155]
17.实施方案1-13中任一项的多核苷酸、载体、修饰的细胞和方法,其中tcr-cd3复合物的修饰的组分包含连接至一个或多个共刺激信号传导结构域的cd3δ。
[0156]
18.实施方案14-17中任一项的多核苷酸、载体、修饰的细胞和方法,其中所述cd3γ、cd3ζ、cd3ε和/或cd3δ链以及一个或多个共刺激信号传导结构域通过接头(例如gs接头)连接。
[0157]
19.实施方案14-17中任一项的多核苷酸、载体、修饰的细胞和方法,其中所述一个或多个共刺激信号传导域包含至少两个共刺激信号传导结构域。
[0158]
20.实施方案19的多核苷酸、载体、修饰的细胞和方法,其中所述至少两个共刺激信号传导结构域通过接头(例如gs接头)连接。
[0159]
21.任何进行中的实施方案1-20的修饰的细胞,其中tcr-cd3复合物的修饰的组分
是修饰的cd3结构域。
[0160]
22.任何前述实施方案1-21的修饰的细胞,其中所述修饰的细胞过表达所述修饰的tcr-cd3复合物,和/或所述修饰的细胞过表达所述修饰的cd3结构域。
[0161]
23.前述实施方案中任一项的修饰的细胞,其中所述修饰的细胞包含抗原结合分子,所述抗原结合分子是嵌合抗原受体(car),其包含抗原结合结构域、跨膜结构域和细胞内信号传导结构域。
[0162]
24.实施方案23的修饰的细胞,其中所述抗原结合结构域与肿瘤抗原结合,肿瘤抗原选自:tshr、cd19、cd123、cd22、cd30、cd171、cs-1、cll-1、cd33、egfrviii、gd2、gd3、bcma、tnag、psma、ror1、flt3、fap、tag72、cd38、cd44v6、cea、epcam、b7h3、kit、il-13ra2、间皮素、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、cd20、叶酸受体α、erbb2(her2/neu)、muc1、egfr、ncam、蛋白酶、pap、elf2m、ephrin b2、igf-1受体、caix、lmp2、gp100、bcr-abl、酪氨酸酶、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、邻乙酰基gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、多唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、ny-eso-1、lage-1a、mage-a1、legumain、hpv e6、e7、mage a1、etv6-aml、精子蛋白17、xage1、tie 2、mad-ct-1、mad-ct-2、fos相关抗原1、p53、p53突变体、prostein、survivin和端粒酶、pcta-1/galectin 8、mela na/mart1、ras突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄激素受体、细胞周期蛋白b1、mycn、rhoc、trp-2、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、rage-1、人类端粒酶逆转录酶、ru1、ru2、肠内羧基酯酶、mut hsp70-2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5和igll1。
[0163]
25.实施方案23和24中任一项的修饰的细胞,其中所述细胞内信号传导域包含共刺激信号传导结构域,或初级信号传导结构域和共刺激信号传导结构域,其中所述共刺激信号传导结构域包括蛋白质的功能性信号传导结构域,其中蛋白质包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cdβ、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、sellpg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46和nkg2d。
[0164]
26.实施方案1-22中任一项的修饰的细胞,其中所述修饰的细胞包含抗原结合分子,所述抗原结合分子是修饰的tcr(tcr)或tcr(til)。
[0165]
27.实施方案26的修饰的细胞,其中所述tcr衍生自患者中自发发生的肿瘤特异性t细胞。
[0166]
28.实施方案27的修饰的细胞,其中所述tcr与肿瘤抗原结合。
[0167]
29.实施方案28的修饰的细胞,其中所述肿瘤抗原包含cea、gp100、mart-1、p53、
mage-a3或ny-eso-1。
[0168]
30.根据实施方式28所述的修饰细胞,其中,所述tcr包含tcrγ和tcrδ链或tcrα和tcrβ链,或其组合。
[0169]
31.前述实施方案中任一项的修饰的细胞,其中所述细胞是免疫效应细胞(例如,免疫效应细胞群)。
[0170]
32.实施方案31的修饰的细胞,其中所述免疫效应细胞是t细胞或nk细胞。
[0171]
33.实施方案32的修饰的细胞,其中所述免疫效应细胞是t细胞。
[0172]
34.实施方案32的修饰的细胞,其中所述t细胞是cd4+t细胞,cd8+t细胞或其组合。
[0173]
35.前述实施方案中任一项的修饰的细胞,其中所述细胞是人细胞。
[0174]
36.前述实施方案中任一项的修饰的细胞,其中通过引入编码tcr-cd3复合物的修饰的成分和/或结合分子的多核苷酸来实现tcr-cd3复合物的修饰的成分的增强的表达和/或功能,所述多核苷酸以重组dna构建体、mrna或病毒载体形式存在于修饰的细胞中。
[0175]
37.实施方案36的修饰的细胞,其中所述多核苷酸是不整合到所述修饰的细胞的基因组中的mrna。
[0176]
38.实施方案36的修饰的细胞,其中所述多核苷酸与氧敏感性多肽结构域缔合。
[0177]
39.实施方案38的修饰的细胞,其中所述氧敏感性多肽结构域包含hif vhl结合结构域。
[0178]
40.实施方案36的修饰的细胞,其中所述多核苷酸由启动子调控,所述启动子包含转录调节剂的结合位点,所述转录调节剂调节细胞中治疗剂的表达和/或分泌。
[0179]
41.实施方案40的修饰的细胞,其中所述转录调节剂是或包括hif1a、nfat、foxp3和/或nfkb。
[0180]
42.一种细胞,其经修饰以表达一种或多种分子,其水平高于或低于未被修饰以表达一种或多种分子的细胞表达的一种或多种分子的水平,其中所述一种或多种分子与修饰细胞的代谢有关。
[0181]
43.一种经工程改造以表达抗原结合分子的修饰细胞,其中所述修饰细胞中一个或多个分子的表达和/或功能已经增强或降低(包括消除),其中所述一个或多个分子与所述抗原的代谢有关。修改后的单元格。
[0182]
44.实施方案42和43中任一项的修饰的细胞,其中所述修饰的细胞包含与一个或多个分子的生物合成或转运途径相关的内源基因的破坏或外源基因的添加。
[0183]
45.一种多核苷酸的方法或用途,所述方法包括
[0184]
提供包含载体基因组的病毒颗粒(例如,aav、慢病毒或其变体),该载体基因组包含编码一个以上分子的多核苷酸和编码抗原结合分子的多核苷酸,该多核苷酸可操作地连接至赋予转录的表达控制元件多核苷酸;和
[0185]
向受试者施用一定量的病毒颗粒,以使多核苷酸在受试者中表达,其中一个或多个分子与修饰细胞的代谢相关。
[0186]
46.实施方案45的方法,其中所述aav制备物可以包含aav载体颗粒,空衣壳和宿主细胞杂质,从而提供基本上不含aav空衣壳的aav产物。
[0187]
47.一种药物组合物,其包含实施方案1-3中任一项的细胞群。
[0188]
48.一种在需要其的受试者中引起或引发t细胞应答和/或治疗该受试者的肿瘤的
方法,该方法包括向该受试者施用有效量的实施方案47的组合物或分离的编码与修饰细胞的代谢相关的一种或多种分子。
[0189]
49.实施方案42-48中任一项的分离的核酸序列,修饰的细胞,方法或药物组合物,其中所述一个或多个分子包含mct1、mct2、mct3、ldhb和mpc(其功能性变体)中的至少一种,一个或多个分子的功能变体或一个或多个分子的功能片段;和/或新陈代谢包括乳酸的新陈代谢。
[0190]
50.实施方案42-48中任一项的分离的核酸序列、修饰的细胞、方法或药物组合物,其中所述代谢包括改变的修饰的细胞中乳酸的转运。
[0191]
51.根据任何前述实施方案42-50所述的修饰细胞,其中与相应的野生型细胞相比,所述修饰细胞将更少或更多的乳酸运输到所述修饰细胞中。
[0192]
52.根据任何前述实施方案42-50所述的修饰细胞,其中与相应的野生型细胞相比,所述修饰细胞过表达mct 3并表达较少的mct1和mct2,并且将较少的乳酸转运至修饰的细胞中。
[0193]
53.根据任何前述实施方案42-50所述的修饰细胞,其中与相应的野生型细胞相比,所述修饰细胞过表达mct1、mct2、ldhb和mpc,表达更少的mct3,并将更多的乳酸运输到修饰的细胞中。
[0194]
54.实施方案42-53中任一项的分离的核酸序列、修饰的细胞、方法或药物组合物,其中所述一种或多种分子包含弗拉他汀、hba、hbb、hbd、hbe、hbg、tomm20和tomm22,一种或多种分子的功能变体,或一种或多种分子的功能片段;和/或新陈代谢包括乳酸的新陈代谢。
[0195]
55.实施方案42-54中任一项的分离的核酸序列、修饰的细胞、方法或药物组合物,其中所述代谢包括所述修饰的细胞的线粒体的氧化功能增强。
[0196]
56.任何进行中的实施方案42-55的修饰细胞,其中所述修饰细胞过表达frataxin、hba、hbb、hbd、hbe、hbg,从而增强修饰细胞的线粒体氧存储能力。
[0197]
57.根据任何前述实施方案42-55所述的修饰的细胞,其中所述修饰的细胞过表达tomm20和tomm22,从而增强修饰的细胞的线粒体功能。
[0198]
58.实施方案42-47中任一项的分离的核酸序列、修饰的细胞、方法或药物组合物,其中所述一种或多种分子包含cd98、snat1、snat2、asct2,一种或多种的功能变体中的至少一种,或一个或多个分子的功能片段;和/或代谢包括氨基酸的代谢。
[0199]
59.实施方案42-48中任一项的分离的核酸序列、修饰的细胞、方法或药物组合物,其中所述代谢包括增强的修饰的细胞的乳酸和/或氨基酸的代谢。
[0200]
60.根据任何前述实施方案42-58所述的修饰细胞,其中,所述修饰细胞过表达cd98、snat1、snat2、asct2,以增强所述修饰细胞将氨基酸转运至所述修饰细胞的转运能力。
[0201]
61.实施方案42-60的分离的核酸序列、修饰的细胞、方法或药物组合物,其中表7、8和9中列出的一个或多个序列在修饰的细胞中过表达或下调。
[0202]
62.前述实施方案42-61中任一项的修饰的细胞,其中所述修饰的细胞包含抗原结合分子。
[0203]
63.根据实施方案62所述的修饰细胞,所述抗原结合分子是嵌合抗原受体(car),
其包含抗原结合结构域、跨膜结构域和细胞内信号传导结构域。
[0204]
64.实施方案63的修饰的细胞,其中所述抗原结合结构域与肿瘤抗原结合,肿瘤抗原选自:tshr、cd19、cd123、cd22、cd30、cd171、cs-1、cll-1、cd33、egfrviii、gd2、gd3、bcma、tnag、psma、ror1、flt3、fap、tag72、cd38、cd44v6、cea、epcam、b7h3、kit、il-13ra2、间皮素、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、cd20、叶酸受体α、erbb2(her2/neu)、muc1、egfr、ncam、蛋白酶、pap、elf2m、ephrin b2、igf-1受体、caix、lmp2、gp100、bcr-abl、酪氨酸酶、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、邻乙酰基gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、多唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、ny-eso-1、lage-1a、mage-a1、legumain、hpv e6、e7、mage a1、etv6-aml、精子蛋白17、xage1、tie 2、mad-ct-1、mad-ct-2、fos相关抗原1、p53、p53突变体、脯氨酸、存活蛋白和端粒酶、pcta-1/galectin 8、mela na/mart1、ras突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄激素受体、细胞周期蛋白b1、mycn、rhoc、trp-2、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、rage-1、人类端粒酶逆转录酶、ru1、ru2、肠内羧基酯酶、mut hsp70-2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5和igll1。
[0205]
65.实施方案63和64中任一项的修饰的细胞,其中所述细胞内信号传导结构域包含共刺激信号传导结构域,或主要信号传导结构域和共刺激信号传导结构域,其中所述共刺激信号传导结构域包括蛋白质的功能性信号传导结构域,其中蛋白质包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、一种与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam,ly9(cd229、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、sellpg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、和nkg2d。
[0206]
66.实施方案62的修饰的细胞,其中所述修饰的细胞包含抗原结合分子,所述抗原结合分子是修饰的tcr(tcr)或tcr(til)。
[0207]
67.实施方案65的修饰的细胞,其中所述tcr衍生自患者中自发发生的肿瘤特异性t细胞。
[0208]
68.实施方案67的修饰的细胞,其中所述tcr结合肿瘤抗原。
[0209]
69.实施方案68的修饰的细胞,其中所述肿瘤抗原包含cea、gp100、mart-1、p53、mage-a3或ny-eso-1。
[0210]
70.实施方案68的修饰的细胞,其中tcr包含tcrγ和tcrδ链或tcrα和tcrβ链,或其组合。
[0211]
71.实施方案70的修饰的细胞,其中所述细胞是免疫效应细胞(例如,免疫效应细胞的群体),并且所述免疫效应细胞是dc、巨噬细胞、t细胞或nk细胞。
[0212]
72.实施方案71的修饰的细胞,其中所述免疫效应细胞是t细胞。
[0213]
73.实施方案71的修饰的细胞,其中所述t细胞是cd4+t细胞、cd8+t细胞或其组合。
[0214]
74.前述实施方案42-73中任一项的修饰的细胞,其中所述细胞是人细胞。
[0215]
75.前述实施方案42-74中任一项的修饰的细胞,其中所述一个或多个分子的增强的表达和/或功能是通过引入编码所述一个或多个分子和/或结合分子的核酸序列来实现的,所述核酸序列以重组dna构建体、mrna或病毒载体形式存在于修饰的细胞中。
[0216]
76.实施方案75的修饰的细胞,其中所述核酸序列是不整合到所述修饰的细胞的基因组中的mrna。
[0217]
77.实施方案75的修饰的细胞,其中所述核酸序列与氧敏感性多肽结构域相关。
[0218]
78.实施方案77的修饰的细胞,其中所述氧敏感性多肽结构域包含hif vhl结合结构域。
[0219]
79.实施方案75的修饰的细胞,其中所述核酸序列由启动子调节,所述启动子包含转录调节剂的结合位点,所述转录调节剂调节细胞中治疗剂的表达和/或分泌。
[0220]
80.实施方案79的修饰的细胞,其中所述转录调节剂是或包括hif1a、nfat、foxp3和/或nfkb。
[0221]
例子
[0222]
产生了编码单个car分子的慢病毒载体,并用t细胞转染,下面将对其进行详细说明。与细胞培养有关的技术,细胞毒性t淋巴细胞论文的构建可在“用遗传重定目标的含有cd28和cd137结构域的人类t细胞控制大型的已建立的肿瘤异种移植物”中找到,pnas,2009年3月3日,第一卷,106(9)号,3360-3365和“包含cd137信号转导结构域的嵌合受体介导t细胞存活增强和体内抗白血病功效提高”,《分子疗法》,2009年8月,第1卷,17(8)号,1453-1464,通过引用将其全部内容合并在此。
[0223]
在第0天,从健康志愿者中提取外周血。通过pan t kit筛选cd3+t细胞,并每1
×
10
7
t细胞添加100ul transact。在第1天,将1
×
10
6
t细胞用载体8301转染。将1
×
10
6
t细胞用载体8307转染,而2
×
10
6
t细胞是未转导的t细胞(nt)。去除慢病毒和transact,并将细胞重悬于新鲜培养基中。在第7天,进行tcr比的流量检测。图6显示了各种载体在t细胞中表达的流式细胞仪结果。由于两个载体均编码vβ13.1(tcrβ链的变体),因此使用了抗tcrvβ13.1。vβ13.1在载体8301中的表达率为83.58%。vβ13.1在载体8307中的表达率为51.38%。根据表3和表4进行实验。将样品共培养24h,并进行vβ13.1+多色的fcm染色,并在120h用细胞微量标记通过fcm染色检测扩增。序列可在下表2中找到。关于序列,组成和相关临床试验的更多信息可以在wo2020106843和wo2020146743中找到,其通过引用整体并入本文。
[0224]
表2
[0225]
[0226][0227]
表3
[0228][0229]
表4
[0230][0231]
图7和图8显示了hla-a2和ny-eso-1在底物细胞中的表达以及ζ链在8301和8307中的表达。ny-eso-1的tcrt可识别hla-a2的表达,实验作为实验对照材料(8301),因此检测到hla-a2在底物细胞中的流动表达,并且k19似乎是hla-a2阴性,293t是弱hla-a2阳性,而8505c和saos-2是hla-a2阳性。rt-pcr检测4个底物细胞中ny-eso-1的mrna表达,结果表明8505c和saos-2为ny-eso-1阳性。下表6显示了rt-pcr的引物信息。图8显示了修饰的tcr的结构的蛋白质印迹结果。根据蛋白质印迹结果,8307细胞的大小约为23.3kda,是cd137重组后的ζ链。
[0232]
表5
[0233][0234]
表6
[0235]
引物序列(5'至3')seq id nony-eso-1-rtf1cggcaacatactgactatccg12ny-eso-1-rtr1ctggagacaggagctgatgga13ny-eso-1-rtf2tgcagaccaccgccaact14ny-eso-1-rtr2tccacatcaacagggaaagct15β-actin-rtfcgcccagcacgatgaaa16β-actin-rtrccgccgatccacacagag17
[0236]
表7 乳酸代谢相关分子
[0237]
[0238][0239]
表8 与线粒体功能有关的分子
[0240][0241][0242]
表9 与氨基酸代谢有关的分子
[0243][0244]
通过参考以下示例性实施例和示例来进一步描述本公开。提供这些示例性实施例和示例仅用于说明的目的,并非旨在限制,除非另有说明。因此,本公开绝不应被解释为限于以下示例性实施例和示例,而是应被解释为包含由于本文提供的教导而变得明显的任何和所有变化。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



