使用羟基柠檬酸和/或其盐产生T细胞群体的方法与流程
 2021-02-02 12:02:41|
2021-02-02 12:02:41| 382|
382| 起点商标网
起点商标网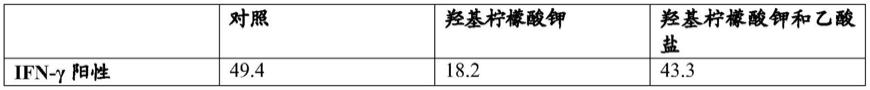
使用羟基柠檬酸和/或其盐产生t细胞群体的方法
相关申请的交叉引用
[0001]
本专利申请要求2018年4月24日提交的共同未决的美国临时专利申请第62/661,941的权益,将该临时专利申请通过引用以其整体并入本文。关于联邦赞助的研究和开发的声明
[0002]
本发明是在政府支持下由国立卫生研究院的国家癌症研究所完成,项目编号为z01zia bc010763-07。政府享有本发明的某些权利。以电子方式提交的材料通过引用并入
[0003]
通过引用以其整体并入本文的是随本文同时提交的并且如下确定的计算机可读的核苷酸/氨基酸序列表:名称为“742111_st25.txt”,日期为2019年4月22日的一份739字节ascii(文本)文件。发明背景
[0004]
使用癌症反应性t细胞的过继细胞疗法(act)可在一些癌症患者中产生积极的临床反应。然而,act成功用于治疗癌症和其它病况仍然存在若干障碍。例如,在一些情况下,t细胞的体内持久性、存活和抗肿瘤活性中的一种或多种可能在过继转移后降低。可选地或另外地,在一些情况下,t细胞增加的凋亡可能对癌症和其它病况的治疗造成障碍。因此,需要获得用于act的改进的分离的细胞群体的方法。发明简述
[0005]
本发明的实施方案提供了产生分离的t细胞群体的方法,所述方法包括在羟基柠檬酸和/或其盐存在下体外培养分离的t细胞,其中所述盐是羟基柠檬酸钾或羟基柠檬酸钠。
[0006]
本发明的另一个实施方案提供了将t细胞施用至哺乳动物的方法,所述方法包括在羟基柠檬酸和/或其盐存在下体外培养分离的t细胞,其中所述盐是羟基柠檬酸钾或羟基柠檬酸钠;以及在羟基柠檬酸和/或其盐存在下培养细胞后,将t细胞施用至哺乳动物。
[0007]
本发明的其它实施方案提供了通过所述方法产生的分离的t细胞群体、相关的药物组合物以及治疗或预防哺乳动物中的癌症的相关方法。附图中若干视图的简述
[0008]
图1是线粒体和细胞质accoa池产生中涉及的分子途径、底物和相关酶的示意图。acly(atp-柠檬酸裂解酶)、acss1(酰基-coa合成酶短链家族成员1)、acss2(酰基-coa合成酶短链家族成员2)、ctp-柠檬酸转运蛋白、羟基柠檬酸钾(羟基柠檬酸盐-5mm)、乙酸盐(5mm)。
[0009]
图2a和2b是显示在用阴性对照(a)或羟基柠檬酸钾(2-hc)(b)处理的细胞中测量的细胞质柠檬酸盐(图2a)和细胞质accoa(图2b)的定量(相对丰度)的图。在选择的相关比较之间**p<0.01;****p<0.0001。
[0010]
图2c是显示在用阴性对照(a)或羟基柠檬酸钾(2-hc)(b)处理的细胞中在ifn-γ基因座处h3k9ac沉积的chip-pcr定量(增强子富集百分比)的图。*p<0.05。
[0011]
图3a是显示用阴性对照(a)、羟基柠檬酸钾(2-hc)(b)、或羟基柠檬酸钾和乙酸盐
(c)处理后表达cd62l的细胞百分比(最大值百分比)的图。
[0012]
图3b是显示在用阴性对照(a)、羟基柠檬酸钾(2-hc)(b)、或羟基柠檬酸钾和乙酸盐(c)处理后在cd62l阳性细胞(x10
3
)中测量的平均荧光强度(mfi)的图。****p<0.0001。
[0013]
图4是显示在将用阴性对照(a)或羟基柠檬酸钾(2-hc)(b)处理的t细胞转移至荷瘤小鼠中后第7天转移的ly5.1+cd8+t细胞的绝对数目(
×
10
6
/脾脏)的图。**p<0.01。
[0014]
图5是显示将用阴性对照(a)或羟基柠檬酸钾(2-hc)(b)处理的t细胞转移至荷瘤小鼠中后测量的肿瘤面积(mm
2
)的图。用无t细胞(x)处理的小鼠作为另一对照。*p<0.05。
[0015]
图6是显示用阴性对照(a)或羟基柠檬酸钾(2-hc)(b)处理的t细胞转移后荷瘤小鼠的存活(%)的图。用无t细胞(虚线)处理的小鼠作为另一对照。
[0016]
图7a是对照或羟基柠檬酸钾(2-hc)t细胞培养条件的示意图。
[0017]
图7b-7c是显示在对照(a)或羟基柠檬酸钾(2-hc)(5mm)(b)中培养的t细胞中cd62l阳性细胞(cd8+细胞百分比)(图7b)和ifn-γ+产生(cd8+细胞百分比)(图7c)的定量的图。中心值和误差条表示平均值
±
s.e.m。***p<0.001。
[0018]
图8是显示在对照或羟基柠檬酸钾(2-hc)中培养的活的(膜联蛋白v-pi-)(a)、凋亡的(膜联蛋白v+pi-)(b)以及坏死群体(膜联蛋白v+pi+)(c)的百分比(亚群组成百分比)的图。中心值和误差条表示平均值
±
s.e.m。***p<0.001。
[0019]
图9是显示在对照(a)或羟基柠檬酸钾(2-hc)(b)中培养过程(培养天数)中定量的绝对cd8+t细胞数目(10
6
/ml)的图。中心值和误差条表示平均值
±
s.e.m。**p<0.01;***p<0.001。
[0020]
图10是显示过继转移的对照(a)或羟基柠檬酸钾(2-hc)(b)的t细胞对cd8+ly5.1
+
设门的定量(细胞
×
10
5
ml-1
)的图。中心值和误差条表示平均值
±
s.e.m。***p<0.001。
[0021]
图11是显示用对照(n=10)(a)或羟基柠檬酸钾(2-hc)(n=10)(b)处理的t细胞处理后14天定量的每个肺中的b16-f10转移性结节的数量的图。中心值和误差条表示平均值
±
s.e.m。**p<0.01。
[0022]
图12a显示了通过在指定的条件下使用流式细胞术测量gfp信号的损失和mcherry的积聚而产生的自噬流(autophagy flux)的代表性流式细胞术的图。2-hc=羟基柠檬酸钾。
[0023]
图12b是显示通过在用对照(a)、羟基柠檬酸钾(2-hc)(b)、对照-g120a(c)或羟基柠檬酸钾g120a(d)处理后使用流式细胞术测量gfp信号的损失和mcherry的积聚来定量自噬流的图。中心值和误差条表示平均值
±
s.e.m。****p<0.0001。
[0024]
图13是显示在用羟基柠檬酸钾(2-hc)和乙酸盐的组合、仅羟基柠檬酸钾或对照(既不是羟基柠檬酸钾也不是乙酸盐)处理后ifn-γ阳性的cd8阳性细胞的百分比的图。中心值和误差条表示平均值
±
s.e.m。****p<0.0001。
[0025]
图14是显示用羟基柠檬酸钾(2-hc)和乙酸盐的组合、仅羟基柠檬酸钾或对照(既不是羟基柠檬酸钾也不是乙酸盐)处理后细胞质accoa的定量的图。中心值和误差条表示平均值
±
s.e.m。***p<0.001;****p<0.0001。
[0026]
图15是对照/羟基柠檬酸钾/柠檬酸盐t细胞培养条件和过继性t细胞转移至携带b16-mhgp100肿瘤的小鼠中的示意图。
[0027]
图16是显示在对照(a)、柠檬酸盐(b)或羟基柠檬酸钾(2-hc)(c)中培养的t细胞过
继转移后10天,脾脏中持续存在的cd8+45.1+细胞(x10
6
)的定量的图。中心值和误差条表示平均值
±
s.e.m。**p<0.01。**p<0.01。
[0028]
图17a-17c是显示用在对照(n=10)((ii);图17a)或羟基柠檬酸钾(2-hc)(n=10)((ii);图17b)或柠檬酸盐(n=10)((ii);图17c)中培养的pmel-1 t细胞处理后在指定的天数携带b16-mhgp100的小鼠中肿瘤大小(mm
2
)的图。未处理的小鼠(i)用作对照。
[0029]
图18a-18b呈现了来自供体1-3的人til的代表性荧光激活细胞分选(facs)数据,所述人til在没有刺激(no-stim)的情况下(图18a)、在媒介物(veh)中(图18a)、或在羟基柠檬酸钾(2-hc)(2.5或5mm)(图18b)中培养。分析细胞中肿瘤坏死因子(tnf)和il-2的表达。象限中的数字表示具有以下表型的细胞的数目:il-2+/tnf+(右上象限)、il-2-/tnf-(左下象限)、il-2+/tnf-(左上象限)和il-2-/tnf+(右下象限)。
[0030]
图19a-19b呈现了来自供体1-3的人til的代表性facs数据,所述人til在没有刺激(no-stim)的情况下(图19a)、在媒介物(veh)(图19a)、或在羟基柠檬酸钾(2-hc)(2.5或5mm)(图19b)中培养。分析细胞中tnf和il-2的表达。象限中的数字表示具有以下表型的细胞的数目:il-2+/tnf+(右上象限)、il-2-/tnf-(左下象限)、il-2+/tnf-(左上象限)和il-2-/tnf+(右下象限)。
[0031]
图20呈现了人til的代表性facs数据,其显示了与对照til相比,在羟基柠檬酸培养的til在til扩增期间,淋巴样归巢标志物cd62l的相对较高的表达。
[0032]
图21是显示用阴性对照或羟基柠檬酸钾处理后表达cd62l的细胞的百分比(%的最大值)的图。
[0033]
图22a和22b显示了图21中所示的数据针对cd45ro
+
cd62l
+
的定量。阴性对照和羟基柠檬酸钾柱条显示在图22a(对于患者a)和图22b(针对患者b)中。发明详述
[0034]
已经发现在羟基柠檬酸和/或其盐存在下培养的t细胞可以提供多种优点中的任何一种或多种。这些优点可以包括,例如,与对照t细胞相比,更强的持久性、更高的抗肿瘤活性、减少的凋亡和减少的分化中的任何一种或多种,其中除了对照t细胞不在羟基柠檬酸和/或其盐存在下培养以外,对照t细胞与在羟基柠檬酸和/或其盐存在下培养的t细胞相同。
[0035]
本发明的实施方案提供了产生分离的t细胞群体的方法。所述方法可以包括在羟基柠檬酸和/或其盐存在下体外培养分离的t细胞。羟基柠檬酸盐可以是,例如,羟基柠檬酸钾或羟基柠檬酸钠。在优选的实施方案中,羟基柠檬酸盐是羟基柠檬酸钾。培养t细胞可以包括在包含羟基柠檬酸和/或其盐的任何细胞培养基中培养t细胞。可用于本发明方法的细胞培养基的实例包括通常用于培养t细胞的那些,并且可以包括例如roswell park memorial institute(rpmi)1640培养基、aim v培养基(thermofisher scientific,waltham,ma)或它们的组合(例如aim v:rpmi(50:50)培养基)。此类可商购获得的细胞培养基(即“现成的(off the shelf)”培养基)可能缺乏羟基柠檬酸和羟基柠檬酸盐。所述方法可以包括将羟基柠檬酸和/或羟基柠檬酸盐加入到缺乏羟基柠檬酸和羟基柠檬酸盐的细胞培养基中以用于本发明的方法中。缺乏羟基柠檬酸和羟基柠檬酸盐的细胞培养基在本文中被称为“对照细胞培养基(control cell culture medium)”或“对照细胞培养基(control cell culture media)”。
[0036]
在本发明的实施方案中,所述方法包括在约1.0mm至约10.0mm的羟基柠檬酸盐存在下培养t细胞。例如,t细胞可以在约1.0mm、约1.5mm、约2.0mm、约2.5mm、约3.0mm、约3.5mm、约4.0mm、约4.5mm、约5.0mm、约5.5mm、约6.0mm、约6.5mm、约7.0mm、约7.5mm、约8.0mm、约8.5mm、约9.0mm、约9.5mm、约10.0mm、或由上述端点中的任何两个限定的任何浓度的存在下培养。在优选的实施方案中,所述方法包括在约2.0mm至约6.0mm的羟基柠檬酸盐存在下培养t细胞。
[0037]
在本发明的实施方案中,所述方法包括在约1.0mm至约10.0mm的羟基柠檬酸存在下培养t细胞。例如,t细胞可以在约1.0mm、约1.5mm、约2.0mm、约2.5mm、约3.0mm、约3.5mm、约4.0mm、约4.5mm、约5.0mm、约5.5mm、约6.0mm、约6.5mm、约7.0mm、约7.5mm、约8.0mm、约8.5mm、约9.0mm、约9.5mm、约10.0mm、或由上述端点中的任何两个限定的任何浓度的存在下培养。在优选的实施方案中,所述方法包括在约2.0mm至约6.0mm的羟基柠檬酸存在下培养t细胞。
[0038]
t细胞可以在羟基柠檬酸和/或其盐(即钠盐或钾盐)存在下培养。羟基柠檬酸盐可以以一元盐、二元盐或三元盐的形式存在。例如,羟基柠檬酸盐可以是羟基柠檬酸单钾盐、羟基柠檬酸二钾盐、羟基柠檬酸三钾盐、羟基柠檬酸单钠盐、羟基柠檬酸二钠盐或羟基柠檬酸三钠盐。在某些实施方案中,羟基柠檬酸盐是其水合物。
[0039]
细胞培养基还可以包含多种添加剂中的任何一种。例如,细胞培养基还可以包含一种或多种抗体和/或一种或多种细胞因子。
[0040]
所述方法还可以包括通过本领域已知的任何合适的方法从哺乳动物中分离细胞。例如,可以通过抽血或白细胞去除术(leukapheresis)从哺乳动物获得细胞。在本发明的实施方案中,细胞包含外周血单核细胞(pbmc)。优选地,细胞包含t细胞。在这点上,所述方法还可以包括从哺乳动物中分离t细胞。可选地或另外地,t细胞可以从取自哺乳动物的肿瘤样品获得。在这点上,t细胞可以是肿瘤浸润性淋巴细胞(til)。
[0041]
t细胞群体可以包括任何类型的t细胞。例如,t细胞可以是培养的t细胞,例如原代t细胞;或来自培养的t细胞系,例如jurkat、supt1等的t细胞;或从哺乳动物获得的t细胞。如果从哺乳动物获得,则t细胞可以从多种来源获得,包括但不限于血液、骨髓、淋巴结、胸腺、肿瘤或者其它组织或流体。t细胞也可以被富集或纯化。t细胞可以是人t细胞。t细胞可以是任何类型的t细胞,并且可以处于任何发育阶段,包括但不限于cd4
+
/cd8
+
双阳性t细胞、cd4
+ t细胞(例如th1和th2细胞)、cd8
+ t细胞(例如细胞毒性t细胞)、th
9
细胞、til、记忆t细胞、天然t细胞等。t细胞可以是cd8
+ t细胞或cd4
+ t细胞。在优选的实施方案中,t细胞是til。
[0042]
除非另有说明,否则本文所用的术语“哺乳动物”是指任何哺乳动物,包括但不限于logomorpha目的哺乳动物,如兔;食肉目,包括猫科动物(猫)和犬科动物(狗);偶蹄目,包括牛科动物(牛)和猪科动物(猪);或奇蹄目,包括马科动物(马)。优选哺乳动物是非人灵长类动物,例如灵长目、ceboids或simoids(猴)或者类人目(人和猿)。在一些实施方案中,哺乳动物可以是啮齿目的哺乳动物,如小鼠和仓鼠。在其它实施方案中,哺乳动物不是小鼠。优选地,哺乳动物是非人灵长类动物或人。尤其优选的哺乳动物是人。
[0043]
在本发明的实施方案中,所述方法包括在(a)羟基柠檬酸和/或其盐以及(b)细胞因子存在下培养细胞,所述细胞因子诸如例如白细胞介素-2(il-2)、白细胞介素-7(il-7)、
白细胞介素-15(il-15)、白细胞介素-12(il-12)或者两种或更多种上述细胞因子的组合。
[0044]
在本发明的实施方案中,t细胞对癌症抗原具有抗原特异性。本文所用的术语“癌症抗原”是指仅由或主要由肿瘤细胞或癌细胞表达或过表达的任何分子(例如蛋白质、多肽、肽、脂质、碳水化合物等),使得抗原与肿瘤或癌症相关。癌症抗原可以另外由正常的非肿瘤或非癌细胞表达。然而,在这种情况下,正常的非肿瘤或非癌细胞的癌症抗原表达不如肿瘤或癌细胞的表达稳健。在这点上,与正常的非肿瘤或非癌细胞表达抗原相比,肿瘤或癌细胞可以过表达抗原或以显著较高的水平表达抗原。此外,癌症抗原可以另外由不同发育或成熟状态的细胞表达。例如,癌症抗原可以另外由胚胎或胎儿期的细胞表达,这些细胞通常在成年宿主中不存在。可选地,癌症抗原可以另外由干细胞或前体细胞表达,这些细胞通常在成年宿主中不存在。
[0045]
癌症抗原可以是由任何癌症或肿瘤(包括本文所述的癌症和肿瘤)的任何细胞表达的抗原。所述癌症抗原可以是仅一种类型的癌症或肿瘤的癌症抗原,使得癌症抗原仅与一种类型的癌症或肿瘤相关或者仅是一种类型的癌症或肿瘤的特征。可选地,癌症抗原可以是一种以上类型的癌症或肿瘤的癌症抗原(例如,可以是特征性的)。例如,癌症抗原可以由乳腺癌细胞和前列腺癌细胞表达,而完全不由正常的非肿瘤或非癌细胞表达。癌症抗原是本领域已知的,包括例如cxorf61、间皮素、cd19、cd22、cd276(b7h3)、gp100、mart-1、表皮生长因子受体变体iii(egfrviii)、trp-1、trp-2、酪氨酸酶、ny-eso-1(也称为cag-3)、mage-1、mage-3等。
[0046]
癌症可以是任何癌症,包括急性淋巴细胞癌、急性髓样白血病、腺泡状横纹肌肉瘤、骨癌、脑癌、乳腺癌、肛门癌、肛管癌或肛门直肠癌、眼癌、肝内胆管癌、关节癌、颈癌、胆囊癌或胸膜癌、鼻癌、鼻腔癌或中耳癌、口腔癌,外阴癌,慢性淋巴细胞性白血病,慢性髓样癌,胆管癌,结肠癌,食道癌,宫颈癌,胃肠类癌瘤,霍奇金淋巴瘤,下咽癌,肾癌,喉癌,肝癌,肺癌,恶性间皮瘤,黑色素瘤,多发性骨髓瘤,鼻咽癌,非霍奇金淋巴瘤、卵巢癌、胰腺癌、腹膜癌、网膜癌和肠系膜癌、咽癌、前列腺癌、直肠癌、肾癌(例如,肾细胞癌(rcc))、小肠癌、软组织癌、胃癌、睾丸癌、甲状腺癌、输尿管癌和膀胱癌。在某些优选的实施方案中,抗原特异性受体对黑色素瘤抗原具有特异性。在某些优选的实施方案中,抗原特异性受体对乳腺癌症抗原具有特异性。
[0047]
在本发明的实施方案中,癌症抗原是癌症新抗原。癌症新抗原是由癌症特异性突变编码的免疫原性突变的氨基酸序列。癌症新抗原不由正常的非癌细胞表达,并且可以是患者特有的。用对癌症新抗原具有抗原特异性的t细胞进行act可以为患者提供“个性化”治疗。
[0048]
因此,在本发明的实施方案中,所述方法还可以包括通过筛选从哺乳动物获得的t细胞中对癌症新抗原具有抗原特异性的t细胞来获得分离的t细胞。筛选可以在羟基柠檬酸和/或其盐存在或不存在下进行。所述方法还可以包括从哺乳动物获得的细胞中分离对癌症新抗原具有抗原特异性的t细胞。t细胞的分离可以在羟基柠檬酸和/或其盐存在或不存在下进行。以这种方式获得的t细胞然后可以在如本文关于本发明的其它方面所述的羟基柠檬酸和/或其盐存在下培养。在例如美国专利申请公开号2017/0218042和2017/0224800以及tran等人,science,344(9):641-645(2014)中描述了筛选和分离对癌症新抗原具有抗原特异性的t细胞的方法。
[0049]
t细胞可以包含并表达抗原特异性受体。本文所用的短语“抗原特异的”和“抗原特异性”意指抗原特异性受体能够特异性结合并免疫学上识别抗原或其表位,使得抗原特异性受体与抗原或其表位的结合引发免疫应答。优选地,抗原特异性受体对癌症抗原(也称为肿瘤抗原或肿瘤相关抗原)具有抗原特异性。
[0050]
在本发明的实施方案中,抗原特异性受体是t细胞受体(tcr)。tcr通常包含两条多肽(即多肽链),如tcr的α链、tcr的β链、tcr的γ链、tcr的δ链、或它们的组合。tcr的此类多肽链是本领域已知的。抗原特异性tcr可以包含任何氨基酸序列,条件是tcr能够特异性结合并免疫学上识别抗原,如癌症抗原或其表位。
[0051]
t细胞可以包含并表达内源性tcr,即对于t细胞是内源性的或天然的(天然存在于细胞上)tcr。在这种情况下,包含内源性tcr的t细胞可以是从已知表达特定癌症抗原的哺乳动物中分离的t细胞。在某些实施方案中,t细胞是从患有癌症的哺乳动物中分离的原代t细胞。在一些实施方案中,细胞是从人癌症患者中分离的til或t细胞。
[0052]
在一些实施方案中,用癌症抗原或癌症特异性抗原免疫从中分离细胞的哺乳动物。哺乳动物可以在从所述哺乳动物获得细胞之前进行免疫。以这种方式,分离的细胞可以包括被诱导以对要治疗的癌症具有特异性的t细胞,或者可以包括较高比例的对癌症具有特异性的细胞。
[0053]
可选地,包含和表达内源性抗原特异性tcr的t细胞可以是从哺乳动物中分离的混合细胞群体内的t细胞,并且混合的群体可以暴露于在体外培养时被内源性tcr识别的抗原。以这种方式,包含识别癌症抗原的tcr的t细胞在体外扩增或增殖,从而增加了具有内源性抗原特异性tcr的t细胞的数目。
[0054]
包含内源性抗原特异性tcr的细胞也可以被修饰以表达编码外源性(例如重组)抗原特异性受体的一种或多种核酸。此类外源性抗原特异性受体,例如外源性tcr和嵌合抗原受体(car)(下文更详细描述的),可以赋予t细胞对超出内源性tcr天然特异性的抗原的另外抗原的特异性。这可以但不必须导致产生具有双重抗原特异性的t细胞。
[0055]
在本发明的实施方案中,所述方法还包括在细胞表达外源性tcr的条件下将编码外源性tcr的核酸引入细胞。“外源性”意指tcr不是细胞天然的(天然存在于细胞上)。外源性tcr可以是重组tcr。重组tcr是通过重组表达一种或多种外源性tcrα-、β-、γ-和/或δ-链编码基因而产生的tcr。重组tcr可以包含完全衍生自单一哺乳动物物种的多肽链,或者抗原特异性tcr可以是包含从来自两种不同哺乳动物物种的tcr衍生的氨基酸序列的嵌合或杂合tcr。例如,外源性抗原特异性tcr可以包含衍生自人tcr的可变区和小鼠tcr的恒定区,使得tcr被“鼠源化(murinized)”。重组tcr及其制备方法是本领域已知的。参见,例如,美国专利7,820,174;7,915,036;8,088,379;8,216,565;8,785,601;9,345,748;9,487,573;9,879,065;9,822,162;美国专利申请公开号2014/0378389和2017/0145070。
[0056]
在本发明的实施方案中,所述方法还包括在细胞表达car的条件下将编码car的核酸引入细胞。通常,car包含抗体的抗原结合结构域(例如单链可变片段(scfv)),其与tcr的跨膜和细胞内结构域融合。因此,car的抗原特异性可以由特异性结合抗原或其表位的scfv编码。car及其制备方法是本领域已知的。参见,例如,美国专利8,465,743;9,266,960;9,868,774;9,765,342;9,359,447;9,790,282;以及美国专利申请公开号2015/0299317和2016/0333422。
[0057]
可以使用编码抗原特异性受体的任何合适的核酸。由核酸编码的抗原特异性受体可以是任何合适的形式,包括例如单链tcr、单链car、或者与其它蛋白质或多肽(例如,但不限于共刺激分子)的融合物。尽管将编码抗原特异性受体的核酸引入细胞可以在对照细胞培养基中进行,但在优选的实施方案中,将编码抗原特异性受体的核酸引入细胞可以在羟基柠檬酸和/或其盐存在下进行。
[0058]
可以使用任何合适的方法,例如转染、转导或电穿孔将核酸引入细胞。例如,可以使用病毒(例如逆转录病毒或慢病毒)用病毒载体转导细胞,并且可以使用电穿孔用转座子载体转导细胞。
[0059]
本文所用的术语“核酸”和“多核苷酸”是指任何长度的核苷酸(核糖核苷酸(rna)或者脱氧核糖核苷酸(dna))的聚合形式。这些术语是指分子的一级结构,因此包括双链和单链dna、双链和单链rna以及双链dna-rna杂交体。该术语包括由核苷酸类似物和修饰的多核苷酸制备的rna或dna的类似物作为等效物,所述修饰的多核苷酸例如但不限于甲基化的和/或加帽的多核苷酸。在本发明的实施方案中,核酸是互补dna(cdna)。
[0060]
本文所用的术语“核苷酸”是指由杂环碱基、糖和一个或多个磷酸基团组成的多核苷酸的单体亚基。天然存在的碱基(鸟嘌呤(g)、腺嘌呤(a)、胞嘧啶(c)、胸腺嘧啶(t)和尿嘧啶(u))通常是嘌呤或嘧啶的衍生物,尽管本发明包括使用天然和非天然存在的碱基类似物。天然存在的糖是戊糖(五碳糖)脱氧核糖(其形成dna)或核糖(其形成rna),尽管本发明包括使用天然和非天然存在的糖类似物。核酸通常通过磷酸键连接以形成核酸或多核苷酸,尽管许多其它连键是本领域已知的(例如,硫代磷酸酯(phosphorothioate)、硼烷磷酸酯(boranophosphate)等)。制备多核苷酸的方法在本领域普通技术范围内(green和sambrook,molecular cloning:a laboratory manual,(第4版)cold spring harbor laboratory press,new york(2012))。
[0061]
本文所述的核酸可以掺入重组表达载体中。为了本文的目的,术语“重组表达载体”意指遗传修饰的寡核苷酸或多核苷酸构建体,当该构建体包含编码mrna、蛋白质、多肽或肽的核苷酸序列,并且在载体足以使所述mrna、蛋白质、多肽或肽在细胞内表达的条件下与细胞接触时,允许宿主细胞表达mrna、蛋白质、多肽或肽。载体可以不是整体天然存在的。然而,载体的一部分可以是天然存在的。重组表达载体可以包含任何类型的核苷酸,包括但不限于dna和rna,其可以是单链或双链的,合成的或部分从天然来源获得的,并且其可以含有天然的、非天然的或改变的核苷酸。重组表达载体可以包含天然存在的或非天然存在的核苷酸间连键、或者这两种类型的连键。优选地,非天然存在的或改变的核苷酸或核苷酸间连键不会阻碍载体的转录或复制。可用于本发明方法的重组表达载体的实例包括但不限于质粒、病毒载体(逆转录病毒载体、γ-逆转录病毒载体或慢病毒载体)和转座子。然后,可以通过任何合适的技术将载体继而引入细胞,所述技术诸如例如基因编辑、转染、转化或转导,如例如green和sambrook,molecular cloning:a laboratory manual(4
th ed.),cold spring harbor laboratory press(2012)中所述的。许多转染技术是本领域已知的,并且包括,例如,磷酸钙dna共沉淀;deae-葡聚糖;电穿孔;阳离子脂质体介导的转染;钨颗粒促进的微粒轰击;磷酸锶dna共沉淀。噬菌体或病毒载体可以在合适的包装细胞中生长感染性颗粒后引入宿主细胞,许多所述包装细胞是可商购获得的。
[0062]
尽管细胞可以在羟基柠檬酸和/或其盐存在下在体外间歇地培养,但在本发明的
优选实施方案中,细胞在羟基柠檬酸和/或其盐存在下在体外培养的整个持续时间内进行培养,包括在细胞数目扩增期间和在将编码抗原特异性t细胞受体或嵌合抗原受体的核酸向细胞中任何引入期间。
[0063]
在本发明的实施方案中,所述方法还包括在以下物质存在下扩增细胞的数目:(i)羟基柠檬酸和/或其盐以及(ii)(a)和(b)之一或两者,其中(a)一种或多种细胞因子和(b)一种或多种非特异性t细胞刺激物。非特异性t细胞刺激物的实例包括但不限于辐照的同种异体饲养细胞、辐照的自体饲养细胞、抗cd3抗体(例如okt3抗体)、抗4-1bb抗体和抗cd28抗体中的一种或多种。在优选的实施方案中,非特异性t细胞刺激物可以是与珠粒缀合的抗cd3抗体和抗cd28抗体。在本发明的方法中可以使用任何一种或多种细胞因子。可用于扩增细胞数目的示例性细胞因子包括白细胞介素(il)-2、il-7、il-21和il-15。
[0064]
细胞数目的扩增可以通过本领域已知的许多方法中的任何一种来实现,如例如美国专利8,034,334;美国专利8,383,099;和美国专利申请公开号2012/0244133中所述。在本发明的实施方案中,在羟基柠檬酸和/或其盐存在下,通过使细胞与一种或多种非特异性t细胞刺激物以及一种或多种细胞因子物理接触来扩增细胞的数目。例如,可以通过在羟基柠檬酸和/或其盐存在下将细胞与okt3抗体、il-2和饲养pbmc(例如,辐照的同种异体pbmc)一起培养来进行细胞数目的扩增。在本发明的实施方案中,在羟基柠檬酸和/或其盐存在下扩增细胞的数目包括在羟基柠檬酸和/或其盐存在下将细胞培养至少约14天。
[0065]
在本发明的实施方案中,所述方法包括在羟基柠檬酸和/或其盐存在下非特异性地刺激t细胞。非特异性刺激可以通过使t细胞与本文关于本发明的其它方面描述的任何一种或多种非特异性t细胞刺激物接触来进行。
[0066]
在本发明的实施方案中,所述方法包括在羟基柠檬酸和/或其盐存在下特异性地刺激t细胞。特异性刺激可以通过使t细胞与癌症抗原接触来进行,所述t细胞对所述癌症抗原抗原特异性。例如,t细胞可以与表达癌症抗原的抗原呈递细胞(apc)共培养,例如(i)已经用癌症抗原脉冲的apc或(ii)已经引入编码癌症抗原的核苷酸序列的apc。
[0067]
本发明的实施方案还提供了通过本文所述的本发明方法中的任一种产生的分离的或纯化的t细胞群体。通过本发明方法产生的t细胞群体可以提供许多优点。例如,与施用对照细胞相比,将在羟基柠檬酸和/或其盐存在下培养的t细胞施用至哺乳动物可以提供更强的持久性、更高的抗肿瘤活性、减少的凋亡和减少的分化中的任何一种或多种,其中除了对照细胞不在羟基柠檬酸和/或其盐存在下培养以外,对照细胞与在羟基柠檬酸和/或其盐存在下培养的细胞相同。
[0068]
在本发明的实施方案中,与对照细胞相比,在羟基柠檬酸和/或其盐存在下培养t细胞增加了t细胞对cd62l、il-2和肿瘤坏死因子(tnf)中的一种或多种的表达,其中除了对照细胞不在羟基柠檬酸和/或其盐存在下培养以外,对照细胞与在羟基柠檬酸和/或其盐存在下培养的细胞相同。
[0069]
在本发明的实施方案中,与对照细胞相比,已经在羟基柠檬酸和/或其盐存在下培养的细胞可以较低分化,其中除了对照细胞不在羟基柠檬酸和/或其盐存在下培养以外,对照细胞与在羟基柠檬酸和/或其盐存在下培养的细胞相同。根据本发明方法产生的较低分化的羟基柠檬酸和/或其盐培养的t细胞群体可以有利地减少或避免具有终末分化表型的t细胞的产生,所述终末分化表型与降低的抗肿瘤活性和长期体内持久性能力差有关。
[0070]
在本发明的实施方案中,羟基柠檬酸和/或其盐培养的t细胞具有天然t细胞(t
n
)、t记忆干细胞(t
scm
)或中枢记忆t细胞(t
cm
)表型。可选地或另外地,羟基柠檬酸和/或其盐培养的t细胞缺乏效应记忆t细胞(t
em
)表型。例如,ccr7和cd62l由t
n
、t
scm
和t
cm
细胞表达,但不由t
em
细胞表达。转录因子lef1、foxp1和klf7由t
n
、t
scm
和t
cm
细胞表达,但不由t
em
细胞表达。cd45ro和klrg1不由t
n
或t
scm
细胞表达,但由t
em
细胞表达。gattinoni等人,nat.rev.cancer,12:671-84(2012)。在本发明的实施方案中,在羟基柠檬酸和/或其盐存在下培养的t细胞可以是cd62l
+
、klrg1-、lef1
+
、foxp1
+
以及klf7
+
、ccr7
+
、cd57
+
和cd45ro-中的任何一种或多种。t细胞可以是cd62l
+
。可选地或另外地,t细胞可以是cd8
+
。在尤其优选的实施方案中,在羟基柠檬酸和/或其盐存在下培养的t细胞可以是较低分化的t细胞,其既是cd62l
+
的又是cd8
+
的。
[0071]
在本发明的实施方案中,根据本发明方法产生的t细胞具有与t
n
、t
scm
或t
cm
表型相关的基因表达增加。例如,与对照t细胞相比,根据本发明方法在羟基柠檬酸和/或其盐存在下培养的t细胞可以具有更高的cd27和/或cd28表达,其中除了对照t细胞不在羟基柠檬酸和/或其盐存在下培养以外,对照t细胞与在羟基柠檬酸和/或其盐存在下培养的t细胞相同。不受特定理论或机制的束缚,认为cd27和cd28与t细胞的增殖、体内持久性和较低分化状态有关(认为t细胞增加的分化不利地影响t细胞在体内发挥功能的能力)。认为表达较高水平的cd27的t细胞比cd27-低细胞具有更好的抗肿瘤活性。
[0072]
本文所用的术语“分离的”意指已经从其天然环境中移出。本文所用的术语“纯化的”意指纯度增加,其中“纯度”是相对术语,并且不一定解释为绝对纯度。例如,纯度可以是至少约50%、可以是大于约60%、约70%或约80%,约90%或者可以是约100%。
[0073]
根据本发明方法,通过在羟基柠檬酸和/或其盐存在下培养细胞产生的细胞群体可以是异质群体,其除至少一种其它细胞,例如非t细胞的细胞(例如b细胞、巨噬细胞、嗜中性粒细胞、红细胞、肝细胞、内皮细胞、上皮细胞、肌细胞、脑细胞等)之外还包含本文所述的细胞。可选地,通过本发明方法产生的细胞群体可以是基本上均质的群体,其中所述群体主要包含例如本文所述的t细胞的细胞。该群体也可以是细胞的克隆群体,其中该群体的所有细胞是单个细胞(例如t细胞)的克隆。在本发明的一个实施方案中,细胞群体是克隆群体,其包含细胞,例如包含编码如本文所述的抗原特异性受体的重组表达载体的t细胞。
[0074]
根据本发明方法产生的本发明的分离的或纯化的细胞群体可以包含在组合物,如药物组合物中。在这点上,本发明的实施方案提供了药物组合物,其包含本文所述的分离的或纯化的细胞群体和药学上可接受的载体。
[0075]
优选地,载体是药学上可接受的载体。关于药物组合物,载体可以是常规用于施用细胞的那些载体中的任何一种。此类药学上可接受的载体是本领域技术人员众所周知的,并且是公众容易获得的。优选药学上可接受的载体是在使用条件下没有有害副作用或毒性的载体。
[0076]
载体的选择将部分地由用于施用细胞群体的特定方法确定。因此,存在本发明的药物组合物的多种合适的制剂。合适的制剂可包括用于肠胃外施用、皮下施用、静脉内施用、肌内施用、动脉内施用、鞘内施用、瘤内施用或腹腔内施用的那些制剂中的任何一种。可以使用一种以上的途径来施用细胞群体,并且在某些情况下,特定的途径可以提供比另一种途径更直接且更有效的应答。
[0077]
优选地,通过注射,例如静脉内注射施用细胞群体。用于注射的细胞的合适的药学上可接受的载体可以包括任何等渗载体,诸如例如生理盐水(约0.90%w/v的nacl水溶液、约300mosm/l nacl水溶液或约9.0g nacl/升水)、normosol r电解质溶液(abbott,chicago,il)、plasma-lyte a(baxter,deerfield,il)、约5%右旋糖水溶液或林格氏乳酸盐(ringer
’
s lactate)。在实施方案中,药学上可接受的载体补充有人血清白蛋白。
[0078]
本发明的实施方案提供了将t细胞施用至哺乳动物的方法,所述方法包括在羟基柠檬酸和/或其盐存在下体外培养分离的t细胞,其中所述盐是羟基柠檬酸钾或羟基柠檬酸钠;以及在羟基柠檬酸和/或其盐存在下培养细胞后,将t细胞施用至哺乳动物。在羟基柠檬酸和/或其盐存在下培养t细胞可以如本文关于本发明的其它方面所述进行。分离的细胞群体可以在羟基柠檬酸和/或其盐存在下离体培养,然后直接转移至受癌症影响的哺乳动物(优选人)中。此类细胞转移方法在本领域中被称为“过继细胞转移”或“过继细胞疗法”(act)。在本发明的实施方案中,在将细胞施用至哺乳动物之前,从细胞中去除(例如洗涤)羟基柠檬酸和/或其盐。在本发明的另一个实施方案中,在将细胞施用至哺乳动物之前不从细胞中去除羟基柠檬酸和/或其盐。在本发明的实施方案中,所述方法包括将包含t细胞的药物组合物施用至哺乳动物,其中所述药物组合物如本文关于本发明的其它方面所述。
[0079]
施用至哺乳动物的t细胞可以是哺乳动物同种异体的或自体的。在“自体”施用方法中,将细胞从哺乳动物中移出、储存(和任选地修饰)并返回到同一哺乳动物中。在“同种异体”施用方法中,哺乳动物接收来自遗传相似但不相同的供体的细胞。优选地,t细胞是哺乳动物自体的。有利的是,自体细胞可以减少或避免不期望的免疫应答,所述免疫应答可以靶向同种异体细胞,诸如例如移植物抗宿主病。
[0080]
在t细胞是哺乳动物自体的情况下,在从哺乳动物中分离细胞之前,哺乳动物可以是免疫学上天然的、免疫的、患病的、或处于另一种状态。在一些情况下,所述方法优选包括在从哺乳动物中分离t细胞之前用癌症抗原免疫哺乳动物,将核酸引入所述细胞,以及施用所述t细胞或其组合物。如本文所讨论的,用癌症抗原免疫哺乳动物将允许具有与癌症抗原反应的内源性tcr的t细胞群体数目增加,这将增加在羟基柠檬酸和/或其盐存在下培养获得的t细胞具有期望的抗原特异性tcr的可能性。
[0081]
根据本发明的实施方案,患有癌症的哺乳动物可以用来自该癌症或与该癌症相关的抗原治疗性地免疫,包括通过疫苗免疫。尽管不希望受任何特定理论或机制的束缚,但提供疫苗或免疫原以增强哺乳动物对癌组织中存在的癌症抗原的免疫应答。此类治疗性免疫包括但不限于使用重组或天然的癌蛋白、肽或其类似物,或者修饰的癌肽或其类似物,其可以作为过继免疫疗法的一部分在治疗上用作疫苗。疫苗或免疫原可以是细胞、细胞裂解物(例如,来自用重组表达载体转染的细胞),重组表达载体、或抗原性蛋白或多肽。可选地,疫苗或免疫原可以是部分或基本上纯化的重组癌蛋白、多肽、肽或其类似物,或者修饰的蛋白、多肽、肽或其类似物。蛋白质、多肽或肽可以与脂蛋白缀合或者以脂质体形式施用或与佐剂一起施用。优选地,疫苗包含以下中的一种或多种:(i)抗原特异性受体对其具有抗原特异性的癌症抗原,(ii)抗原的表位和(iii)编码抗原或表位的载体。
[0082]
为了本发明的目的,施用的剂量,例如细胞数目应在合理的时间范围内足以在哺乳动物中实现例如治疗或预防应答。例如,施用的细胞数目应在从施用时起约2小时或更长,例如12至24小时或更长的时间内足以结合癌症抗原,或者治疗或预防癌症。在某些实施
方案中,该时间段可以甚至更长。施用的细胞数目将通过例如待施用的特定细胞群体的功效和动物(例如人)的状况以及待治疗的动物(例如人)的体重来确定。
[0083]
用于确定施用的细胞数目的许多测定是本领域已知的。为了本发明的目的,测定可以用于确定施用至哺乳动物的起始数目,所述测定包括比较在将给定数目的此类细胞施用至一组哺乳动物中的哺乳动物后靶细胞裂解或者分泌一种或多种细胞因子,诸如例如ifn-γ和il-2的程度,所述哺乳动物各自被给予不同数目的细胞,例如t细胞。可以通过本领域已知的方法测定在施用一定数目后靶细胞裂解或分泌细胞因子诸如例如ifn-γ和il-2的程度。细胞因子诸如例如il-2的分泌也可以提供t细胞制备物的质量(例如表型和/或有效性)的指示。
[0084]
施用的细胞数目也将由可能伴随施用特定细胞群体的任何不良副作用的存在、性质和程度来确定。通常,主治医师将考虑各种因素,如年龄、体重、一般健康状况、饮食、性别、施用途径和所治疗病况的严重程度,决定治疗每个个体患者的细胞数目。例如但不旨在限制本发明,待施用的细胞例如t细胞的数目可以是每次输注约10
×
10
6
至约10
×
10
11
个细胞、每次输注约10
×
10
9
至约10
×
10
11
个细胞、或每次输注10
×
10
7
至约10
×
10
9
个细胞。
[0085]
本文涉及通过在羟基柠檬酸和/或其盐存在下培养t细胞产生的t细胞群体可以用于治疗或预防哺乳动物中的癌症的方法中。在这点上,本发明的实施方案提供了治疗或预防哺乳动物中的癌症的方法,其包括(i)根据本文所述的任何方法将细胞施用至哺乳动物;(ii)将根据本文所述的任何方法产生的细胞施用至哺乳动物;或(iii)将本文所述的分离的细胞群体或药物组合物中的任何一种施用至哺乳动物,施用的量可有效治疗或预防哺乳动物中的癌症。
[0086]
在本发明的实施方案中,治疗或预防癌症的方法可以包括将细胞或药物组合物以有效减少哺乳动物中的转移的量施用至哺乳动物。例如,本发明的方法可以减少哺乳动物中的转移性结节。
[0087]
可以将一种或多种另外的治疗剂共同施用至哺乳动物。“共同施用”意指在时间上足够接近地施用一种或多种另外的治疗剂和分离的细胞群体,使得分离的细胞群体可以增强一种或多种另外的治疗剂的效果,或者反之亦然。在这方面,可以首先施用分离的细胞群体,然后可以施用一种或多种另外的治疗剂,或者反之亦然。可选地,可以同时施用分离的细胞群体和一种或多种另外的治疗剂。可以增强分离的细胞群体的功能的另外的治疗剂可以包括,例如,一种或多种细胞因子或者一种或多种抗体(例如,抑制pd-1功能的抗体)。可以与分离的细胞群体共同施用的示例性治疗剂是il-2。不受特定理论或机制的束缚,认为il-2可以增强分离的细胞群体(例如t细胞)的治疗效果。
[0088]
本发明的实施方案还包括在施用分离的细胞群体之前对哺乳动物进行淋巴清除。淋巴清除的实例包括但不限于非清髓性淋巴清除化疗、清髓性淋巴清除化疗、全身辐照等。
[0089]
本文所用的术语“治疗”和“预防”以及由其产生的词语不一定意味着100%或完全的治疗或预防。相反,可以存在本领域普通技术人员认识到其具有潜在的益处或治疗效果的不同程度的治疗或预防。在这方面,本发明的方法可以提供任何量或任何水平的哺乳动物中癌症的治疗或预防。此外,由本发明方法提供的治疗或预防可以包括治疗或预防正被治疗或预防的疾病(例如癌症)的一种或多种病况或症状。此外,为了本文的目的,“预防”可以涵盖延迟疾病或其症状或病况的发作或复发。
[0090]
关于本发明的方法,癌症可以是任何癌症,包括本文关于本发明的其它方面描述的任何癌症。
[0091]
以下实施例进一步说明本发明,但当然不应解释为以任何方式限制其范围。
实施例
[0092]
在实施例1-9描述的实验中使用以下材料和方法。研究批准
[0093]
在国家癌症研究所(nci)和国家关节炎与肌肉骨骼和皮肤病研究所(niams)动物使用和护理委员会的批准下进行动物实验。t细胞的体外活化
[0094]
用1μm hgp100
25-33
肽体外刺激来自pmel-1小鼠的cd8
+ t细胞5天,用板结合的抗cd3(1μg/ml;bd biosciences,franklin lakes,nj)和可溶性抗cd28(1μg/ml;bd biosciences)进行二次再刺激,并在含有60iu il-2的培养基中扩增。条件对照/羟基柠檬酸钾(图7)在上述条件下活化总共10天。为了测量t细胞效应器功能,在指定的条件下,在布雷菲德菌素a和莫能酶素(monesin)(bd biosciences)存在下,没有il-2的情况下,用抗cd3和抗cd28在第10天刺激这些细胞5小时。小鼠和细胞系
[0095]
除非另有说明,将6-8周龄的c57bl/6小鼠(获自charles river,frederick,md)用作过继转移的接受者宿主。将pmel-1 ly5.1转基因小鼠用于过继细胞转移。为了获得pmel-1 ly5.1小鼠,将pmel-1(b6.cg-/cy tg[tcratcrb]8rest/j)小鼠与ly5.1小鼠(b6.sjl-ptprcapepcb/boyj)杂交。将所有小鼠维持在无特定病原体的条件下。修饰的b16-mhgp100(h-2d
b
),即一种小鼠黑色素瘤细胞系,用作肿瘤模型,如先前所述转导上述细胞系以表达在位置25-27处具有人残基(egs至kvp残基)的糖蛋白100(gp100)。将细胞系维持在含有10%fbs、1%谷氨酰胺和1%青霉素-链霉素的完全培养基dmem(gibco,waltham,ma)中。细胞内细胞因子染色、phosphoflow和流式细胞术
[0096]
对于所有流式细胞术实验,将t细胞用磷酸盐缓冲盐水(pbs)中的可固定的活/死染色剂(invitrogen,waltham,ma)染色,随后在facs缓冲液(含0.5%牛血清白蛋白(bsa)和0.1%叠氮化钠的pbs)中进行表面抗体染色。对于细胞内细胞因子染色,在固定和透化(bd cytofix/cytoperm固定/透化溶液试剂盒)后首先对细胞进行表面标志物染色,然后对细胞内分子进行染色。对于磷染色(phospho-staining),使用bd phosflow试剂(bd biosciences),并根据制造商的方案进行方案。洗涤后,将细胞用购自cell signaling(danvers,ma)的含磷抗体染色。用于表面染色和细胞内细胞因子染色的抗体购自bd biosciences and e biosciences(san diego,ca)。所有实验在bd fortessa流式细胞仪(becton dickinson,downers grove,il)上进行,并用flowjo软件(treestar,ashland,or)分析。过继细胞转移(act)和肿瘤免疫疗法
[0097]
对于免疫疗法研究,c57bl/6小鼠植入皮下黑色素瘤系b16-mhgp100(5
×
10
5
个细胞)。肿瘤植入后10天,对小鼠(对于所有组,n=10)进行亚致死辐照(600cgy),随机分组,静脉注射5
×
10
5
个用对照/羟基柠檬酸钾转导的pmel-1 ly5.1 t细胞。t细胞转移后,小鼠在
细胞转移当天开始接受腹腔内注射在pbs(18
×
10
4
iu/0.5ml)中的il-2,每天一次,持续3天。对t细胞转移和肿瘤测量进行编码并以盲法进行。转移后每2-3天测量肿瘤,并根据肿瘤的长度
×
宽度计算肿瘤面积。使具有接近400mm
2
的肿瘤的小鼠安乐死。在act后的指定时间,肿瘤测量值表示为平均值
±
s.e.m。转移后,用牛痘rhgp100 1
×
10
7
噬菌斑形成单位(pfu)接种小鼠。在指定时间点通过下颌下静脉穿刺获得小鼠血液用于cd62l表型和绝对数目的定量。实验性转移
[0098]
为了理解过继转移的t细胞治愈确立的肺肿瘤结节或防止进一步定植的功效,使用重组表达mhgp100的b16-f10黑色素瘤细胞。将b16-f10-mhgp100(2x10
5
)静脉内注射到亚致死辐照(600cgy)的小鼠中。在第10天,将小鼠随机分组,并用在对照(n=10)或羟基柠檬酸钾(n=10)条件中处理的1
×
10
5
个pmel-1 ly5.1 t细胞静脉内注射小鼠。两周后,使小鼠安乐死,并收集肺以计数肺结节。逆转录病毒转导
[0099]
在转染前1天,将铂-e嗜亲性(plate)包装细胞(cell biolabs,san diego,ca)以每板6
×
10
6
个细胞的浓度铺板在含完全培养基的聚-d-赖氨酸包被的10cm板(corning,corning,ny)上。在转染当天,用不含抗生素的培养基替换完全培养基。使用在optimem还原血清培养基(invitrogen)中的60μl lipofectamine 2000转染试剂,将包装细胞用编码msgv-lc3-mcherry-egfp-thy1.1、msgv-lc3g120a-mcherry-egfp-thy1.1(g120a-自噬无效构建体)的20μg逆转录病毒质粒dna以及12μg pcl-eco质粒转染8小时。转染后8小时替换培养基,细胞在完全培养基中再孵育48小时。为了捕获病毒颗粒用于有效转导,将逆转录病毒上清液在24孔retronectin试剂(takara bio,shiga,japan)包被的非组织培养处理板中在32℃下以2,000g旋转2小时。accoa和柠檬酸盐定量
[0100]
收集在对照或羟基柠檬酸钾条件下培养的t细胞(n=3),并在pbs中洗涤以进行总的和细胞质accoa和柠檬酸盐水平。将样品在1%triton x-100非离子表面活性剂、20mm tris-hcl(ph=7.4)、150mm nacl中于冰上均质化10分钟(sigma乙酰辅酶a测定试剂盒-mak039),或者照试剂盒中提供的说明在柠檬酸盐缓冲液(sigma柠檬酸盐测定试剂盒-mak057)(sigma,st.louis,mo)中均质化。对于总accoa定量,使用80%甲醇或5%磺基水杨酸与50m dtt一起提取沉淀的细胞。在细胞裂解后,在测定之前用10kda分子量截止(mwco)旋转过滤器对样品进行脱蛋白。使用荧光测定(ex=535,em=587)或通过质谱用accoa标准品插补accoa浓度。使用比色测定(570nm)用柠檬酸盐标准品插补柠檬酸盐浓度。chip-seq和chip-pcr
[0101]
用来自先前文献的验证抗体进行染色质免疫沉淀(gray等人,immunity,46(4):596-608(2017);peng等人,science,354(6311):481-484(2016)),并根据通过chip-it表达剪切试剂盒(active motif,carlsbad,ca)提供的制造说明书进行方案。简而言之,将cd8+pmel-1细胞在摇动平台上用甲醛固定7分钟,并用1x甘氨酸淬灭。将细胞用苯甲基磺酰氟(pmsf)和蛋白质抑制混合物沉淀,并在细胞裂解前储存在-80。将解冻的细胞悬浮在冰冷的裂解缓冲液中以获得细胞核材料。通过在37℃下与酶混合物孵育15分钟来剪切细胞核材料。将总共7.5μg/样品的剪切的染色质与具有抗h3k27ac(abcam cat#ab4729)、h3k9ac
(abcam cat#ab4441)(abcam,cambridge,uk)和抗igg的蛋白g磁珠在4℃孵育过夜。用缓冲液洗涤磁珠以去除未结合的免疫复合物,并用150μl洗脱缓冲液洗脱。将获得的dna反向交联并通过酚氯仿纯化。用高灵敏dna测定方案在tape station上测量chip dna的浓度以使dna标准化。以每个样品约40m读取以单端模式用75bp读取在illumina next seq系统(illumina,san diego,ca)上对样品进行测序。为了验证chip测序结果,对ifng基因座进行chip-pcr。使用abi sybr green pcr预混合物扩增试剂盒(thermo fischer scientific,waltham,ma)通过qpcr进行ifng基因座在不同处理条件中的chip富集和效率。用稀释输入dna产生的标准曲线推测不同处理条件下的染色质富集。以下引物用于qpcr:ifng启动子f:5
’-
ggagccttcgatcaggtataaa-3
’
(seq id no:1),ifng启动子r:5
’-
ctcaagtcagagggtccaaag-3
’
(seq id no:2)。chip-seq和峰调用分析
[0102]
通过使用illumina pipeline软件(illumina)获得单端75bp的测序读取。修剪适配子的测序读取,用bowtie v2与小鼠基因组(ncbi37/mm9)比对,并且只保留唯一映射的读取。将bowtie的输出转换为bam文件,其代表每次读取的基因组坐标。使用rpkm将bam文件标准化,并使用deeptools(command#bamcoverage-b bam_file
--
normalizeusingrpkm
--
binsize 10
--
smoothlength 30-blmm9.blacklist.bed
--
centerreads
--
minmappingquality 30-o output_file.bw)将其转换为big wig格式的覆盖轨迹。使用igv(integrative genomics viewer)查看生成的轨迹。使用具有(#findpeaks tag_directory-i input-region-size 1000-mindist 2500>output.txt)的homer软件来调用峰,并且使用deseq2在2个生物学重复上计算对照与测试条件之间富集的统计显著性。用log倍数变化对比从desq2输出文件获得的p值绘制火山图(volcano plot)。统计分析
[0103]
对于过继转移实验,在细胞转移之前将接受者小鼠随机化。将各数据点的肿瘤测量绘制为平均值
±
s.e.m.,通过使用wilcoxon秩和检验比较肿瘤处理图,并使用log-rank检验评估动物存活的分析。在所有情况下,p值小于0.05被认为是显著的。使用graphpad prism 7软件(graphpad software inc.,la jolla,ca)计算统计量。实施例1
[0104]
本实施例显示了羟基柠檬酸钾暴露导致t细胞中柠檬酸盐积聚和细胞质accoa耗尽。
[0105]
为了评价细胞质乙酰-coa(accoa)丰度对t细胞表型的影响,使用了accoa代谢和相对丰度的操作。细胞质accoa可以通过三磷酸腺苷(atp)柠檬酸裂解酶(acly)将柠檬酸盐转化为accoa和草酰乙酸盐而产生。测试了acly抑制剂2-羟基柠檬酸盐(羟基柠檬酸钾)对t细胞成熟和功能的影响(图1)。
[0106]
在用羟基柠檬酸钾或阴性对照处理细胞后定量细胞质柠檬酸盐和细胞质accoa。阴性对照是不含羟基柠檬酸钾的细胞培养基。结果显示在图2a-2b中。与其中核质accoa浓度决定t细胞功能的模型一致,发现羟基柠檬酸钾暴露导致柠檬酸盐积聚和细胞质accoa耗尽(图2a-2b)。实施例2
[0107]
本实施例显示了羟基柠檬酸钾处理减少了t细胞中ifn-γ启动子处活化组蛋白标
志物。
[0108]
组蛋白乙酰化起到破坏dna-组蛋白盐桥的作用,允许常染色质结构组织和增加的局部基因转录(garcia-ramirez等人,j.biol.chem.,270:17923
–
17928(1995))。在用羟基柠檬酸钾或阴性对照处理t细胞之后,进行组蛋白h3蛋白在残基9和27处赖氨酸(与转录诱导相关的组蛋白标志物)乙酰化的染色质免疫沉淀测序和pcr(chip-seq和chip-pcr)。
[0109]
结果显示在图2c中。chip-pcr定量显示在羟基柠檬酸钾处理的细胞中在ifn-γ基因座处的h3k9ac沉积减少。因此,在用羟基柠檬酸钾处理后,观察到在ifn-γ启动子处活化组蛋白标志物的减少(图2c)。实施例3
[0110]
本实施例显示了对t细胞的羟基柠檬酸钾处理增强了自噬。
[0111]
用羟基柠檬酸钾或阴性对照处理t细胞。通过测量mcherry+群体中绿色荧光蛋白(gfp)的损失来确定自噬流。为了评价活细胞中的自噬流,使用了一种动态荧光gfp-mcherry-lc3b融合报告系统(xu等人,nat.immunol.,15:1152
–
1161(2014))。由于自噬体与溶酶体融合,使用这种构建体,通过mcherry+群体内gfp的损失来测量自噬流,表明通过自噬降解消耗gfp-lc3b或由于细胞器内ph低而损失gfp强度。在位置120(g120a)处具有甘氨酸至丙氨酸取代的不能自噬的构建体起gfp损失的阴性对照的作用。
[0112]
通过流式细胞术测量gfp阳性或阴性的mcherry阳性细胞的百分比,并显示在表a和图12a-12b中。在羟基柠檬酸钾处理后观察到增强的自噬。表a 阴性对照羟基柠檬酸钾gfp+83.060.8gfp-12.133.2实施例4
[0113]
本实施例显示了用羟基柠檬酸钾处理t细胞阻断效应器分化并减少凋亡。
[0114]
在5mm羟基柠檬酸钾存在下用mhgp100肽活化cd8+pmel-1 t细胞5天,随后用抗cd3(1μg/ml)和抗cd28(1μg/ml)二次刺激(图7a)。在第10天分析细胞的表面标志物或细胞内细胞因子。
[0115]
代表性流式细胞术分析以及在对照或2-羟基柠檬酸盐(羟基柠檬酸钾(5mm))中培养的t细胞中cd62l对比cd44阳性细胞的定量和ifn-γ+产生显示在表b以及图7a和7b中。cd62l(也称为l-选择素)是淋巴样归巢标志物和具有持久性能力的t
mem
群体的标志。具有所示表型的细胞的百分比显示在表b中。表b 阴性对照羟基柠檬酸钾cd44+cd62l+3.530.7ifn-γ+59.314.2
[0116]
定义在对照或羟基柠檬酸钾中培养的活的(膜联蛋白v-pi-)、凋亡的(膜联蛋白v+pi-)和坏死群体(膜联蛋白v+pi+)的百分比的代表性facs数据提供在表c和图8中。具有所示表型的细胞的百分比显示在表c中。表c
ꢀ
阴性对照羟基柠檬酸钾pi+膜联蛋白+9.742.4pi-膜联蛋白-71.095.2pi-膜联蛋白+18.11.6
[0117]
在培养过程中定量绝对cd8+t细胞数目。结果显示在图9中。
[0118]
结果显示在羟基柠檬酸钾存在下,效应器分化的阻断(表b和图7b-7c)和细胞凋亡的减少(表c和图8-9)。实施例5
[0119]
本实施例显示了t细胞的羟基柠檬酸钾处理逆转了t
mem
标志物的获得。
[0120]
用羟基柠檬酸钾和乙酸盐的组合、单独的羟基柠檬酸钾或阴性对照处理t细胞。通过荧光激活细胞分选(facs)测量cd62l的表达。结果显示在图3a-3b中。facs数据显示通过在羟基柠檬酸钾处理的细胞中提供外部乙酸盐逆转cd62l表型。
[0121]
在用对照、单独的羟基柠檬酸钾或羟基柠檬酸钾和乙酸盐的组合处理后也通过facs测量ifn-γ分泌(表d),并对其进行定量(图13)。ifn-γ阳性细胞的百分比显示在表d中。表d
[0122]
在用羟基柠檬酸钾和5mm乙酸钾的组合、仅羟基柠檬酸钾或对照(既不是羟基柠檬酸钾也不是乙酸盐)处理后定量细胞质accoa(图14)。
[0123]
在用羟基柠檬酸钾和5mm乙酸盐的组合、仅羟基柠檬酸钾或对照(既不是羟基柠檬酸钾也不是乙酸盐)处理后通过免疫印迹测量自噬的消融。β-肌动蛋白用作对照。自噬流的定量由lc3ii/lc3i强度比表示。结果显示在表e中。表e羟基柠檬酸钾-++乙酸盐
--
+lc3ii/lc3i0.72.10.4
[0124]
在羟基柠檬酸钾处理后,外源性乙酸盐的提供恢复了细胞质accoa水平(图14),又逆转了t
mem
标志物cd62l的获得,减少了自噬,并促进了效应器功能(图3a-3b和表d-e)。实施例6
[0125]
本实施例显示了用羟基柠檬酸钾处理t细胞增强了过继转移后的体内持久性并改善了抗肿瘤功效。
[0126]
在阴性对照(n=10)或羟基柠檬酸钾(n=10)中培养pmel-1 t细胞。将处理的细胞转移至携带b16-mhgp100肿瘤的小鼠中。在转移后第7天进行转移的ly5.1+cd8+ t细胞在荷瘤小鼠中的流式细胞术分析和绝对数目定量。代表性的流式细胞术结果(ly5.1+cd8+ t细胞百分比)显示在表f中。转移的ly5.1+ cd8+ t细胞的绝对数目定量结果显示在图4。表f 阴性对照羟基柠檬酸钾
ly5.1+ cd8+ t细胞9.246.3
[0127]
测量抗肿瘤功效和存活率。结果显示在图5(抗肿瘤功效)和图6(存活)中。
[0128]
对cd8+ly5.1+设门的过继转移的对照或羟基柠檬酸钾t细胞通过facs分析(表g)并定量(图10)。通过用牛痘rhgp100 1
×
10
7
噬斑形成单位(pfu)攻击小鼠进行回忆应答(recall response)。代表性的facs数据(具有所示表型的细胞百分比)显示在表g中。表g 阴性对照羟基柠檬酸钾ly5.1+ cd8+ t细胞7.825.9
[0129]
用对照(n=10)或羟基柠檬酸钾(n=10)处理的t细胞在处理后14天定量每个肺中的b16-f10肺转移性结节的数目。结果显示在图11中。
[0130]
在功能上,在过继转移后,羟基柠檬酸钾处理增强了体内持久性并改善了抗肿瘤功效(图4-6,表f-g和图10-11)。实施例7
[0131]
本实施例显示了用羟基柠檬酸钾而不是柠檬酸盐处理t细胞改善了b16黑色素瘤模型中的抗肿瘤功效。
[0132]
如图15所示,分离脾细胞,在对照(媒介物)、柠檬酸盐或羟基柠檬酸钾中培养,再刺激,并转移至携带b16-mhgp100肿瘤的小鼠中。在第10天分析脾脏中转移的t细胞的持久性。通过facs分析过继转移的对照或处理的细胞的cd45.2和cd45.1表达并定量(对cd8+ly5.1设门)(表h和图16)。代表性的facs数据(cd45.1阳性/cd45.2阴性的细胞百分比)显示在表h中。表h
[0133]
在过继细胞转移后也测量了抗肿瘤功效。结果显示在图17a-17c中。
[0134]
如表h、图16和图17a-17c所示,用羟基柠檬酸钾而不是柠檬酸盐处理t细胞改善了b16黑色素瘤模型中的抗肿瘤功效。实施例8
[0135]
本实施例显示了羟基柠檬酸钾处理改善了人肿瘤浸润性淋巴细胞的多功能性。
[0136]
在没有刺激的情况下,在媒介物中或在羟基柠檬酸钾(2.5或5mm)中培养人til。分析细胞中肿瘤坏死因子(tnf)和il-2的表达。代表性数据阐释在图18a-18b和19a-19b中。如图18a-18b和19a-19b所示,羟基柠檬酸钾处理改善了人til的多功能性。实施例9
[0137]
本实施例显示了用羟基柠檬酸钾处理t细胞增加乐cd62l的表达。
[0138]
在羟基柠檬酸钾(5mm)存在或不存在(对照)下培养来自多种组织学的人cd8+til。简而言之,使用在补充有5%内部人血清、100μg/ml-1
链霉素和100μg/ml-1
青霉素、2mm l-谷氨酰胺,10μgml-1
庆大霉素的rpmi 1640和aim-v中的3,000iu ml-1
il-2中培养生长的辐照的外周血单核细胞(pbmc),在30ng ml-1
okt3的情况下,使来自新鲜肿瘤消化物中的til经历快速扩增方案(rep),持续约14天。
[0139]
通过facs测量cd62l的表达。结果显示在图20-22b中。在til扩增过程中,向til提供羟基柠檬酸钾维持了淋巴样归巢标志物cd62l的相对较高的表达。具体地,图20呈现了人til的代表性facs数据,其显示了在til扩增期间,与对照til相比的羟基柠檬酸钾培养的til的淋巴样归巢标志物cd62l的相对较高的表达(56.2对比66.6,增加14%)。图21是显示用阴性对照或羟基柠檬酸钾处理后表达cd62l的细胞的百分比(最大值百分比)的图。图22a和22b显示了图21中所示的数据针对两个患者样品(患者a和患者b)的cd45ro
+
cd62l
+
的定量。
[0140]
本文引用的所有参考文献,包括出版物、专利申请和专利在此通过引用并入,其程度如同每份参考文献单独地和具体地表示为通过引用并入并且在本文以其整体示出。
[0141]
在描述本发明的上下文中(尤其是在以下权利要求的上下文中)使用的术语“一个/一种(a)”、“一个/一种(an)”、“所述”、至少一种/一个以及类似的引用应被解释为涵盖单数和复数,除非本文另外指明或与上下文明显矛盾。术语“至少一种/一个”之后一项或多项列举(例如,“a和b中的至少一种/一个”)的使用应被解释为意指选自列出的项中的一项(a或b)或者两个或更多个列出的项的组合(a和b),除非本文另外指出或与上下文明显矛盾。术语“包含”、“具有”、“包括”和“含有”应被解释为开放式的术语(即意指“包括,但不限于”),除非另外指明。本文叙述的值的范围仅旨在作为分别提及落入该范围内的每个单独值的速记法,除非本文另外指明,并且将每一单独的值并入本说明书,如同本文对其单独叙述。本文所述的所有方法可以任何合适的顺序进行,除非本文另外指出或与上下文明显矛盾。使用的本文提供的任何以及全部实例或示例性语言(例如“诸如”)仅旨在更好地说明本发明,并不对本发明的范围进行限制,除非另有声明。不应将本说明书中的语言解释为表明任何未要求保护的元素对实施本发明是必要的。
[0142]
本文描述了本发明的优选实施方案,包括发明人已知的实施本发明最佳方式。通过阅读前面的描述,这些优选实施方案的变化对本领域普通技术人员是显而易见的。发明人期望技术人员适当地使用此类变型,并且发明人意欲以不同于本文具体描述的方式实施本发明。因此,如适用法律所允许的,本发明包括所附权利要求中叙述的主题的所有修饰和等同主题。此外,本发明涵盖上述元素以其所有可能的变体形式的任何组合,除非本文另外指明或者与上下文明显矛盾。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



