OsMYB63基因在改良水稻抗病性中的应用的制作方法
 2021-02-02 12:02:28|
2021-02-02 12:02:28| 378|
378| 起点商标网
起点商标网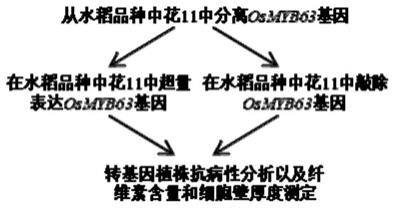
osmyb63基因在改良水稻抗病性中的应用
技术领域
[0001]
本发明属于植物基因工程技术领域,具体涉及水稻myb类转录因子osmyb63的应用,所述的基因为水稻osmyb63基因,所述的基因可用于增强抗白叶枯病水稻品种的培育。
背景技术:
[0002]
水稻是世界上重要的粮食作物之一,其产量在过去的很长一段时间里饱受各种病菌的威胁,水稻白叶枯病菌就是其中一种危害极为严重的病菌。我国是世界上重要的水稻生产大国和消费大国,水稻的产量和品质严重影响我国经济社会的可持续发展。白叶枯病是一种水稻维管束病害,病菌通过叶片的伤口或者水孔进入水稻体内并繁殖,常常导致水稻叶片形成长条枯死的病斑症状,最终导致水稻枯死,影响水稻产量,严重时可使得水稻减产20%-30%。相关研究以及生产实践表明,发掘和利用优良抗性基因资源改良水稻抗病性是最为经济有效的措施。随着生物技术的发展,越来越多的抗白叶枯病基因被鉴定和克隆,并应用于水稻抗病育种。挖掘抗病基因、探究抗病的分子机理以及抗病信号的级联传递是水稻进行抗病育种的分子基础,也是研究水稻抗病的热点。
[0003]
目前,生产中常常利用主效抗病基因来培育抗白叶枯病的水稻品种。但主效基因所介导的白叶枯病抗性常常具有小种特异性,且抗性易丧失等缺点;抗白叶枯病相关基因可以很好的克服主效抗病基因的这些缺陷。因此挖掘更多的抗白叶枯病相关基因对于改良水稻对白叶枯病菌的抗性具有重要意义。许多植物特有的转录因子作为抗病相关基因,在调控植物响应生物胁迫反应中起着重要而独特的作用,例如wrky、nac、myb、bzip和erf等,而其中myb类转录因子参与的水稻抗病鲜有报道。相关研究发现细胞壁介导的抗病性在植物抵御真菌和细菌性病害中扮演着重要的角色。植物细胞壁通常被认为是一道抵御外界病原菌的天然物理屏障,植株也能通过感知细胞壁被病原菌分泌的酶类分解而产生的降解产物激发自身的免疫反应。
[0004]
本发明中发现水稻osmyb63基因超量表达材料可以增强对白叶枯病菌的抗性,同时还表现出导管周围细胞壁厚度的增加,与此相反,osmyb63突变体则增强了水稻对白叶枯的感病性,有着更薄的导管细胞壁厚度。本发明对于改良水稻对白叶枯的抗性,培育水稻新品种具有重要的意义。
技术实现要素:
[0005]
本发明的目的在于克服现有技术存在的缺陷,通过对osmyb63基因的生物学功能的研究,发现osmyb63基因在水稻抗白叶枯病上具有重要调控作用,通过调节该基因的表达水平影响水稻对白叶枯病的广谱抗病性。因此,本发明对于重要粮食作物水稻在抗白叶枯病的改良上具有重要的意义。
[0006]
本发明的技术方案如下所述:
[0007]
本发明证实在水稻中超量表达osmyb63基因使水稻对白叶枯病菌表现出抗性增强的能力。通过系统研究,申请人发现osmyb63基因在水稻抗白叶枯病方面有着重要的调控功
能。
[0008]
经过生物学功能验证证明本发明所提供的水稻osmyb63基因具有以下特性:
[0009]
1、osmyb63基因的核苷酸序列如seq id no:1所示。
[0010]
seq id no:1所示的核苷酸序列由水稻osmyb63基因及其上、下游非编码序列共1952个脱氧核糖核苷酸组成。seq id no:1所示序列中第1位至127位的脱氧核糖核苷酸为osmyb63基因的上游非编码序列;第128位至268位的脱氧核糖核苷酸为osmyb63基因的第一个外显子序列;第269位至374位的脱氧核糖核苷酸为osmyb63基因的第一个内含子序列;第375位至504位的脱氧核糖核苷酸为osmyb63基因的第二个外显子序列;第505位至608位的脱氧核糖核苷酸为osmyb63基因的第二个内含子序列;第609位至1453位的脱氧核糖核苷酸为osmyb63基因的第三个外显子序列;第1454位至1952位的脱氧核糖核苷酸为osmyb63基因的下游非编码序列。
[0011]
2、本发明的osmyb63基因序列可用于在作物,特别是水稻的抗病育种、转基因株系培育和转基因新品种创造中的应用。
[0012]
更详细的技术方案参见《具体实施方式》。
[0013]
与现有技术相比,本发明的有益效果在于:
[0014]
osmyb63基因正向调控水稻对白叶枯病菌的抗病性。
附图说明
[0015]
图1:本发明鉴定和分离克隆水稻抗病相关基因osmyb63基因以及验证osmyb63基因功能的技术流程图。
[0016]
图2:本发明所用遗传转化载体pu1301-osmyb63的载体图谱。附图标记说明:rb和lb分别表示t-dna的右边界和左边界,gus表示β-葡糖苷酸酶基因,hpt表示潮霉素磷酸转移酶基因,p
ubi
表示玉米泛素基因启动子,tev表示烟草蚀刻病毒翻译前导肽序列,nos表示胭脂碱合成酶基因的多聚腺苷酸化信号。
[0017]
图3:osmyb63突变体材料的鉴定。附图标记说明:图3中的a图表示该突变体osmyb63-1和osmyb63-2敲除位点的碱基缺失情况;图3中的b图表示pcr扩增突变体osmyb63-1,osmyb63-2和野生型中花11的osmyb63基因缺失片段。
[0018]
图4:osmyb63基因超量表达水稻株系t
0
代表型鉴定。附图标记说明:图4中的a图表示qrt-pcr显示osmyb63基因超量表达水稻阳性单株的表达量明显高于野生型,而且表达量上升的单株表现出更短的病斑长度;图4中的b图表示接种白叶枯病菌14天后osmyb63超量植株和野生型中花11的叶片发病情况展示。图中星号表示转基因材料和野生型对比的差异达到极显著p<0.01。
[0019]
图5:osmyb63基因超量表达水稻株系t
1
表型鉴定。附图标记说明:图5中的a图表示osmyb63基因超量表达家系15接种白叶枯病菌14天后的发病病斑长度与野生型植株和转基因阴性植株相比显著性变短;图5中的b图表示osmyb63基因超量表达家系31接种白叶枯病菌14天后的发病病斑长度与野生型植株和转基因阴性植株相比显著性变短。结果表明osmyb63基因超量表达水稻株系增强了对白叶枯病菌的抗病性。图中星号表示转基因材料和野生型对比的差异达到极显著p<0.01。
[0020]
图6:osmyb63突变体t
1
代接种白叶枯病菌表型鉴定。附图标记说明:图6中的a图表
示osmyb63-1和osmyb63-2接种白叶枯病菌14天后病斑长度统计。图6中的b图表示接种白叶枯病菌14天后osmyb63突变体和野生型中花11的叶片发病情况展示。图中星号表示转基因材料和野生型对比的差异达到极显著p<0.01。
[0021]
图7:osmyb63基因超量表达和osmyb63突变体材料接种白叶枯病菌后叶片中白叶枯病菌生长量。相对于野生型对照,osmyb63基因超量表达水稻株系中白叶枯病菌数量显著降低。osmyb63突变体材料中白叶枯病菌数量显著上升。单星号和双星号分别表示转基因材料和野生型中花11对比的差异达到显著p<0.05和极显著p<0.01。
[0022]
图8:osmyb63转录因子正调控水稻次生细胞壁中纤维素的合成。图8中的a图表示osmyb63超量和osmyb63突变体中纤维素含量。图8中的b图表示透射电镜观测osmyb63超量和osmyb63突变体叶片导管周围细胞壁的形态。图8中的c图表示osmyb63超量和osmyb63突变体叶片导管周围细胞壁厚度。图中星号表示转基因材料和野生型对比的差异达到极显著p<0.01。
具体实施方式
[0023]
对序列表的说明:
[0024]
序列表seq id no:1是本发明克隆的osmyb63基因的核苷酸序列,序列长度为1952bp。
[0025]
下面结合具体的实施例进一步阐述本发明。图1描述了鉴定和分离克隆osmyb63基因以及验证osmyb63基因功能的流程。需要说明的是,这些实施例仅仅是为了说明本发明,而不能以任何方式构成对本发明权利要求范围的限制。
[0026]
下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参考:《molecular cloning:a laboratory manual》(sambrook,j.,russell,david w.,molecular cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)或相关产品。所用试剂或仪器未注明生产厂商者,均为可以通过市场采购的常规产品。
[0027]
实施例1:osmyb63基因超量表达材料的获得
[0028]
(1)osmyb63基因超量表达载体和敲除载体的构建
[0029]
本实施例是关于pu1301-osmyb63载体构建的一个通用说明。
[0030]
以水稻品种中花11(或称zh11,来自中国农业科学院作物科学研究所一个公知公用的水稻验证用地模式品种,其遗传背景比较清楚)的cdna为模板,设计引物myb63f(5
’-
ttacgaacgatagccggtaccatggggaagggccgggcaccgtgctgc-3
’
)和myb63r(5
’-
atgatctttgtaatcggatcccacgtagtaatccatggggttactcgt-3
’
)利用高保真dna聚合酶pcr扩增得到osmyb63基因的全长cds片段(seq id no:1所示序列中第128位至268位脱氧核糖核苷酸,第375位至504位脱氧核糖核苷酸,第609位至1453位脱氧核糖核苷酸。电泳回收pcr产物,用限制性内切酶kpni和bamhi酶切pu1301载体过夜并回收。将回收的pcr产物与载体片段以摩尔比约3:1的量进行重组(one step cloning kit,vazyme,c112),37℃重组反应1小时后,将重组产物吸取1ul并电击转化大肠杆菌dh5α,并于37℃培养过夜,可获得单克隆。选取单克隆在3ml含卡那霉素抗生素的液体培养基中过夜培养,第二天提取质粒,然后酶切质粒,对切出外源片段的单克隆进一步测序验证。从而获得植物转化载体(pu1301-osmyb63)。所述植物转化载体pu1301-osmyb63的图谱见图2。
[0031]
在osmyb63基因的第一个外显子和内含子区域选取两个靶位点,设计2对引物扩增得到两条不同的sgrnas,通过重组的方法连入pcxun-cas9载体(华中农业大学赵云德教授提供)中,获得植物转化载体(pcxun-cas9-osmyb63)。设计的引物如下,其中下划线序列为两个不同的靶位点。
[0032]
m63crs-f1:acgtacgatggggaagggccgttttagagctagaaatagcaagtta
[0033]
m63crs-r1:ggcccttccccatcgtacgtgccacggatcatctgcacaac
[0034]
m63crs-f2:acaagctgctctctctgcgggttttagagctagaaatagcaagtta
[0035]
m63crs-r2:ccgcagagagagcagcttgtgccacggatcatctgcacaac
[0036]
(2)osmyb63基因超量表达材料和敲除材料的获得和鉴定
[0037]
申请人将含有强启动子p
ubi
驱动osmyb63基因全长cds的pu1301-osmyb63载体和pcxun-cas9-osmyb63载体通过农杆菌介导的遗传转化方法导入水稻品种中花11,获得了多个独立的转基因家系。针对pu1301-osmyb63载体遗传转化获得的转基因材料,选取超表达家系15和家系31,利用qrt-pcr方法来检测osmyb63基因的表达水平。针对pcxun-cas9-osmyb63载体遗传转化获得的转基因材料,选取osmyb63-1和osmyb63-2两个不同突变类型用于后续研究。
[0038]
从中国,湖北,武汉大田取水稻孕穗期的剑叶叶片,根据transzol(北京全式金生物技术有限公司试剂盒)使用说明书抽提rna。取5μg总rna用dnasei(美国invitrogen公司)处理15分钟以去除基因组dna污染,然后使用oligo(dt)
15
寡聚引物和m-mlv反转录酶(美国promega公司)进行反转录。采用实时定量pcr分析试剂盒pcr master mix(宝生物工程大连有限公司,即日本takara公司的中国公司),并根据试剂盒使用说明书,在abi 7500real-time pcr system(美国applied biosystems公司)仪器上进行实时定量pcr反应。用水稻内源肌动蛋白基因的表达量衡量、并均一化样品rna含量。qrt-pcr分析中osmyb63基因特异pcr引物是myb63realtime-f(5
′-
gactccggtggatcaactac-3
′
)和myb63realtime-r(5
’-
aaggccgtgaagcttgatga-3
’
),肌动蛋白基因pcr引物是actin-f(5
’-
tgctatgtacgtcgccatccag-3
’
),actin-r(5
’-
aatgagtaaccacgctccgtca-3
’
)。qrt-pcr结果显示,转基因家系中阳性单株中osmyb63基因的表达水平显著高于野生型对照中的表达水平,结果见图4和图5。
[0039]
osmyb63突变体材料的鉴定则通过pcr的方式进行检测,使用的引物为:
[0040]
crs63mdna-f(5
’-
gcagcttggccgcacgcctgaacac-3
’
)
[0041]
crs63mdna-r(5
’-
ggtgaagttgccgcgcttgaggtcc-3
’
)
[0042]
扩增的结果如图3所示,纯合敲除突变体显示出单一的比野生型pcr长度更短的片段。
[0043]
实施例2:osmyb63转基因材料的相关分析与功能验证
[0044]
(1)osmyb63基因超量表达和osmyb63突变体材料孕穗期接种白叶枯病菌的表型鉴定
[0045]
在中国,湖北,武汉的夏季田间对osmyb63基因超量表达材料、osmyb63突变体(实施例1获得)和野生型对照进行白叶枯病菌接种实验。结果显示,本发明的osmyb63基因超量表达水稻株系在孕穗期接种白叶枯病菌(菌株号pxo347,国际水稻研究所提供,菲律宾),与野生型中花11(野生型,在本领域的约定俗成的概念是非转基因的品种称之为野生型,下
同)相比,osmyb63基因超量表达水稻家系15和家系31阳性单株发病长度均显著性短于野生型对照(p<0.01)。见图4和图5。osmyb63突变体材料的病斑长度显著长于野生型对照。见图6。以上结果表明,osmyb63基因超量表达材料可以增强水稻对白叶枯病菌的抗性。
[0046]
(3)osmyb63转基因材料中白叶枯病菌数量分析
[0047]
在中国,湖北,武汉夏季田间对osmyb63基因超量表达材料、osmyb63突变体和野生型在孕穗期接种白叶枯病菌(菌株号pxo347,国际水稻研究所提供,菲律宾)后分析叶片中白叶枯病菌生长情况。在孕穗期于田间对osmyb63基因超量表达材料、osmyb63突变体和野生型对照分别接种白叶枯病菌,接种后在不同时间取叶片材料(接种剪口下3cm的叶片),同一份材料取三片叶(代表三个实验重复)。根据已报道的方法处理叶片材料,分析细菌(即白叶枯病菌)的生长数量。主要分析步骤如下:用75%酒精消毒叶片表面1分钟,晾干,置于研钵中加1ml灭菌蒸馏水研磨成匀浆,然后加倍灭菌水稀释成不同浓度梯度,每个浓度梯度重复涂三个psa培养皿(马铃薯200g,琼脂20g,蔗糖20g,去离子水定容至1000ul),22~25℃黑暗下生长2-3天后统计细菌菌落数。以每片叶上白叶枯病菌菌落数的log10值绘制细菌生长曲线。白叶枯病菌生长分析表明,在接种白叶枯病菌后,osmyb63基因超量表达水稻株系叶片中白叶枯病菌数量显著低于野生型对照。见图7。
[0048]
实施例3:osmyb63调控植物细胞壁的相关分析
[0049]
(1)osmyb63基因超量表达和osmyb63突变体材料中纤维素含量的检测
[0050]
取osmyb63基因超量表达材料、osmyb63突变体和野生型孕穗期的剑叶,105℃杀青15分钟,在60℃烘干至恒重,随后磨粉过60目筛。称取0.1000克的样品测定细胞壁纤维素的相对含量,每个样品做3个技术重复,主要步骤如下:
[0051]
1)称量0.1000克粉末,加入适量的单蒸水拌成匀浆状态。转移到15ml离心管中。4000转/分钟离心5分钟。弃上清,保留残渣。
[0052]
2)加入10ml二甲基亚砜:超纯水(9:1,v/v),室温振荡过夜。4000转/分钟离心5分钟。弃上清,沉淀用10ml二甲基亚砜:超纯水洗2次,再用10ml单蒸水洗3次。
[0053]
3)加入10ml 0.5%(w/v)草酸铵,在沸水中加热1小时,在这期间每隔10分钟摇动一次,4000转/分钟离心5分钟。取1ml上清于比色管中用于测定糖醛酸含量。沉淀用10ml 0.5%(w/v)草酸铵洗1次,10ml单蒸水洗2次。
[0054]
4)碱溶半纤维素提取:加入10ml 4.0mol/l氢氧化钾(含1.0mg/ml硼氢化钠),25℃,150转/分钟水平摇动1小时。4000转/分钟离心5分钟。沉淀用10ml 4.0mol/l氢氧化钾洗1次,10ml单蒸水洗5-6次,直到ph值成中性。
[0055]
5)总纤维素含量测定:将步骤4的残渣,加入4ml 67.0%(v/v)硫酸,25℃水解1小时,取出后用单蒸水定容至12ml终止反应,随后定容至100ml,取10ml上清离心,取200ul上清加入到96孔酶标板中,置于全波长酶标仪(tecan)中,在波长600纳米处检测吸光值,根据吸光值以及稀释的倍数综合计算出水稻叶片细胞壁总纤维素含量。检测结果见图8中的a图。
[0056]
(2)osmyb63基因超量表达和osmyb63突变体材料细胞壁厚度的测定
[0057]
采用透射电子显微镜研究水稻叶细胞的超微结构。将孕穗期的水稻剑叶组织切成1毫米
×
3毫米的小块,在4℃将小块组织置于2.5%(w/v)戊二醛的0.1m磷酸盐缓冲液(ph=7.2)中固定12小时。将固定后的组织在室温(20-25℃)中用0.1m磷酸盐缓冲液洗涤3次,每
次30分钟,在1%四氧化锇中固定2小时,随后用不同浓度的丙酮脱水,并用spurr树脂(spi,spi chem,美国宾夕法尼亚州西切斯特市)在65℃下包埋48小时。将样品切成超薄切片(60-70纳米的厚度),用2%乙酸铀酰染色,并用hitachi透射电子显微镜(h-7650;hitachi,japan)在80kv的电压下激发电子轰击超薄切片通过电脑显示并观测细胞壁,根据透射电子显微镜放大倍数和标尺计算细胞壁厚度。细胞壁的透射电镜结果见图8中的b图,测量的细胞壁厚度见图8中的c图。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



