巨噬细胞分离用组合试剂及其应用的制作方法
 2021-02-02 11:02:17|
2021-02-02 11:02:17| 468|
468| 起点商标网
起点商标网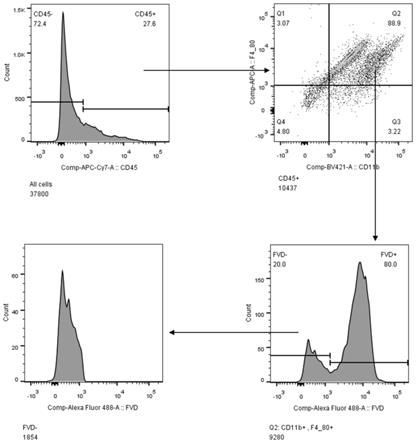
巨噬细胞分离用组合试剂及其应用
[0001]
技术领域
[0002]
本发明属于细胞分离技术领域,具体涉及一种有效消化分离心脏组织细胞,从而高效分离出心脏组织中巨噬细胞的细胞分离提取方法。
[0003]
背景技术:
[0004]
巨噬细胞是由ilya ilyich mechnikov在1882年首次发现,并被认为是脊椎动物抵抗损伤感染的第一道防线。随着科学技术的不断发展人们对巨噬细胞的认知更加全面,例如基因图谱以及谱系示踪技术的出现使我们更清楚的认识了巨噬细胞的生理学以及病理生理学功能。众所周知,巨噬细胞存在于所有组织器官中,除肠道与皮肤组织中的巨噬细胞是仅靠外源的单核细胞补充外,其他组织中的巨噬细胞既可以从外源单核细胞中补充又可自我增殖维持组织中巨噬细胞数量。当感染与损伤发生时,循环的单核细胞会迅速的募集到发炎组织分化为巨噬细胞,并成为组织中急性炎症反应阶段的主要细胞群落。此外,不同组织中的巨噬细胞具有不同的生理学功能,例如皮肤中的巨噬细胞参与调节细胞内外的盐水平衡;脂肪组织中的巨噬细胞可以产生儿茶酚胺从而维持脂肪产热,并且还可参与胰岛素抵抗;肝脏中的巨噬细胞涉及红细胞的转移以及铁循环等作用。
[0005]
近年来,在心血管领域研究中人们发现巨噬细胞在心血管疾病的发生发展过程中起到了至关重要的作用。在胚胎发育初期,巨噬细胞就已存在于心脏组织中,并在心脏发育与成熟阶段起到了免疫监控以及维持心脏组织中各类细胞自我平衡的作用。在健康人心脏中的巨噬细胞主要起到了清理衰老以及死亡细胞的功能,并且协助心脏组织中的电信号传导。然而在衰老的心脏组织中,心脏中的巨噬细胞的功能却发生改变,分化为促炎型巨噬细胞,并引起心脏中的炎症反应。并且在众多心脏疾病中,巨噬细胞同样起到至关重要的作用。在心肌梗死时,巨噬细胞可以通过在心肌梗死发生发展不同阶段的炎症调节效应从而帮助心脏组织的修复以及改善心脏功能。
[0006]
如今,越来越多的学者已经投身于心脏巨噬细胞的相关研究中,而随着心脏中巨噬细胞在心脏疾病中的相关研究的深入,心脏中的巨噬细胞分离与检测的需求也日渐增加。但目前分离心脏中巨噬细胞仍没有特别有效的方法,因此寻找一种有效分离心脏中巨噬细胞的方法显的尤为重要。
[0007]
技术实现要素:
[0008]
解决的技术问题:为了解决心脏中巨噬细胞难以提取,以及提取活性低,数量少这一技术问题,本发明提供一种分离心脏中巨噬细胞的方法,可以有效保留心脏中巨噬细胞的细胞活性,增加心脏中巨噬细胞的分离效率,有利于研究人员分离小鼠心脏中的巨噬细胞进行科学研究,尤其可以提高分离出的心脏中巨噬细胞的分离效率,可以很好的保留巨
噬细胞中特异性蛋白活性,促进分离巨噬细胞表面marker完美保留,使流式细胞术分选效果更加明显。
[0009]
技术方案:一种巨噬细胞分离用组合试剂,包括:心脏消化液a(a液): 0.02g-0.05g
ꢀⅱ
型胶原酶,0.01g
ꢀⅳ
型胶原酶,0.02g-0.05g bsa加入50ml pbs缓冲液中;缓冲液b(b液): 无钙镁hbss缓冲液中加入1 wt.%-3wt.%的血清。
[0010]
优选的具体组成为:心脏消化液a(a液): 0.03g
ꢀⅱ
型胶原酶,0.01g
ꢀⅳ
型胶原酶, 0.03g bsa加入50ml pbs缓冲液中;缓冲液b(b液): 无钙镁hbss缓冲液中加入2wt.%的血清。
[0011]
所述巨噬细胞分离用组合试剂的应用,将小鼠进行麻醉,麻醉后将小鼠心脏灌流,当小鼠心脏中的血液清除后将小鼠心脏取出放入b液中,将心脏组织修剪为1mm
3
的组织块,修剪完毕后用 pbs缓冲液冲洗,冲洗完成后将小鼠心脏装入10 ml ep管中,加入a液进行消化;消化结束后将心脏组织消化液使用300 g离心5分钟,离心结束后弃上清,使用3 ml pbs将沉淀重悬,依次加入1 ml去碎片试剂与4 ml pbs缓冲液,300 g离心5分钟;离心结束后将带有细胞碎片的悬浊液弃去,加入500 μl c液将沉淀重悬,并加入避光的1.5 ml ep管中;向细胞悬液中加入cd45、cd11b、f4/80以及死活细胞染料的流式抗体,在4℃转盘上旋转孵育抗体30分钟,抗体孵育结束时加入1 ml c液后300 g离心5分钟,使用pbs缓冲液重悬细胞清洗后300 g离心5分钟,离心结束后弃去pbs,使用300 μl b液对细胞进行重悬后加入流式管中进行流式细胞术分选巨噬细胞。
[0012]
上述去碎片试剂为debris removal solution。
[0013]
上述消化方法为向10 ml ep管中加入2 ml a液在37℃恒温摇床中使用150转速进行心脏组织消化;首次消化20分钟后将消化液吸出经70 μm滤网过滤后加入置于冰上的15 ml离心管中;接下来向剩余组织中加入2 ml a液,37℃恒温摇床消化10分钟后吸出消化液经滤网过滤并加入上述离心管中,此步骤重复4次。
[0014]
有益效果:本发明提出的心脏消化分离方法可以降低心脏中巨噬细胞的死亡率,明显提高由心脏中分离的巨噬细胞活性,更好的保留巨噬细胞中的表面标记物,避免传统消化方法导致的小鼠心脏中分离的巨噬细胞中表面标记物f4/80的丢失。本发明所使用材料易得并且毒副作用小,分离心脏中细胞的消化操作方法简易行,减少实验负担。
[0015]
附图说明
[0016]
图1为流式细胞术分选实验组心脏细胞悬液中巨噬细胞的分选步骤与细胞数目。
[0017]
图2为流式细胞术分选对照组心脏细胞悬液中巨噬细胞的分选步骤与细胞数目。
[0018]
图3为定量收取的心脏中50000个细胞分析巨噬细胞占收取总细胞数的百分比统计图。
[0019]
图4为流式细胞术分析实验组分离出的心脏细胞中巨噬细胞的存活率。
[0020]
图5为流式细胞术分析对照组分离出的心脏细胞中巨噬细胞的存活率。
[0021]
图6为分离出心脏中巨噬细胞的存活率统计图。
[0022]
图7为一个心脏分离出巨噬细胞数量的统计图。
[0023]
图8为消化液中不同浓度-型胶原酶在一个心脏分离出巨噬细胞数量的统计图。
[0024]
图9为消化液中不同浓度bsa分离出心脏中巨噬细胞的存活率统计图。
[0025]
图10为消化液中不同浓度-型胶原酶定量收取的心脏中50000个细胞分析巨噬细胞占收取总细胞数的百分比统计图。
[0026]
图11为消化液中不同浓度-型胶原酶分离出心脏中巨噬细胞的存活率统计图。
[0027]
图12为消化液中不同浓度-型胶原酶在一个心脏分离出巨噬细胞数量的统计图。
[0028]
具体实施方式
[0029]
下面,通过具体实施例对本发明的技术方案进行详细说明。
[0030]
实施例1选用6只体重为23
±
2g的雄性c57bl/6小鼠,随机分配到实验组(使用本发明心脏消化方法)和对照组(使用传统的心脏消化方法)。配制实验组小鼠心脏消化液a(a液): 0.03g
ꢀⅱ
型胶原酶,0.01g
ꢀⅳ
型胶原酶,0.03g bsa(牛血清蛋白)加入50ml pbs缓冲液中;缓冲液b(b液): hbss缓冲液(无钙镁)中加入2wt.%的血清。配制对照组小鼠消化液c(c液): 0.03g
ꢀⅱ
型胶原酶加入50ml pbs缓冲液中;缓冲液d(d液):pbs缓冲液中加入2wt.%的血清。
[0031]
将实验组与对照组小鼠进行麻醉,小鼠麻醉后将小鼠心脏灌流,当小鼠心脏中的血液清除后将小鼠心脏取出。实验组小鼠心脏放入b液中,对照组小鼠心脏放入d液中。将两组小鼠的心脏组织修剪为1mm
3
的组织块,小鼠心脏修剪完毕后用 pbs缓冲液冲洗一遍。冲洗完成后将实验组小鼠心脏与对照组小鼠心脏组织装入10 ml ep管中,并分别加入a液与c液进行消化。
[0032]
实验组小鼠的消化方法为向10 ml ep管中加入2 ml a液在37℃恒温摇床中使用150转速进行心脏组织消化。 首次消化20分钟后将消化液吸出经70 μm滤网过滤后加入置于冰上的15 ml离心管中。接下来向剩余组织中加入2 ml a液,37℃恒温摇床消化10分钟后吸出消化液经滤网过滤并加入上述离心管中,此实验步骤重复4次。
[0033]
对照组小鼠的消化方法为常规消化方法,即向10 ml ep管中加入8 ml c液在37℃恒温摇床中使用150转速进行心脏组织消化。消化45分钟后将消化液吸出经70μm滤网过滤后加入置于冰上的15 ml离心管中。
[0034]
消化结束后将实验组与对照组心脏组织消化液使用300 g离心5分钟,离心结束后弃上清,使用3 ml pbs将沉淀重悬,依次加入1 ml去碎片试剂与pbs缓冲液,300 g离心5分钟。离心结束后将带有细胞碎片的悬浊液弃去,分别向实验组以及对照组中加入500 μl c液与d液将沉淀重悬,并加入避光的1.5 ml ep管中。接下来向细胞悬液中加入cd45、cd11b、f4/80以及死活细胞染料的流式抗体,在4℃转盘上旋转孵育抗体30分钟。抗体孵育结束时分别向实验组以及对照组中加入1 ml c液与d液后300 g离心5分钟,使用pbs缓冲液重悬细胞清洗后300 g离心5分钟。离心结束后弃去pbs,实验组与对照组分别使用300 μl b液与d液对细胞进行重悬后加入流式管中进行流式细胞术分选巨噬细胞。
[0035]
我们将装有细胞悬液的流式分选管装配到11色流式细胞分选仪中进行巨噬细胞分选,首先通过f488通道的死活细胞抗体在细胞群落中标记出活细胞,再通过apc-cy
™
7通道的cd45抗体、bv421通道的cd11b抗体、apc通道的f4/80抗体在活细胞中进行巨噬细胞标记,通过上述标记进行巨噬细胞分选,将巨噬细胞从消化的细胞悬液中分离,分选结果如图
1、图2所示。接下来我们将分选结果进行统计分析后发现改进后的实验方法即实验组可以明显提高心脏中巨噬细胞的收取率,如图3所示。同时,我们为了研究新方法对于心脏中巨噬细胞活性的影响,我们分析了收取的细胞悬液中活的巨噬细胞占总巨噬细胞中的百分率。首先我们使用apc-cy
™
7通道的cd45抗体、bv421通道的cd11b抗体、apc通道的f4/80抗体标记细胞悬液中的巨噬细胞,再通过f488通道的死活细胞抗体在巨噬细胞群落中标记出活的巨噬细细胞,如图4、图5,发现巨噬细胞中活细胞所占比例明显升高,如图6。最后,我们统计了两组不同的巨噬细胞分离方法最终从一个心脏中分离出的活的巨噬细胞数量后发现,使用新的分离心脏中巨噬细胞的分离方法会更有效的分离小鼠心脏中的巨噬细胞,如图7所示。
[0036]
结果显示:改良后的心脏消化方法可以明显提高心脏中巨噬细胞的收取量与存活率,并且两组之间的差异均有统计学意义(p<0.0001)。
[0037]
相比于传统的-型胶原酶消化方法,本发明在此基础上加入了辅助消化心脏组织的-型胶原酶,提高心脏组织分离效率,更好的分离出心脏中的细胞组分。将心脏组织消化液中加入bsa可以辅助维持细胞在细胞长时间消化过程中的营养摄取并抑制胶原酶中混杂的胰酶对细胞的伤害,同时在缓冲液中加入血清可以为心脏组织中的细胞提供其维持自身活性的营养。同时使用hbss液可以更好的维持细胞活性,而hbss液中不含钙镁有助于分离出的巨噬细胞可以直接用于细胞测序等生物学实验的进行。
[0038]
在摸索巨噬细胞的提取方法时,首先,我们为了确定-型胶原酶的浓度,我们在传统方法的基础上调整-型胶原酶浓度,筛选出最适合的二型胶原酶浓度。因此,在其他条件不变的情况下,我们在50ml pbs中分别加入0.02g、0.03g、0.04g、0.05g的-型胶原酶,对小鼠的心脏组织进行消化,我们发现向50ml pbs中加入0.3g的-型胶原酶时小鼠心脏中的巨噬细胞收取数量最多,如图8.为了提高巨噬细胞在心脏消化分离中的成活率,我们在消化液中加入bsa为细胞提供营养,并设置浓度梯度,找到维持细胞活性的最佳浓度。我们分别在50ml加有0.03g-型胶原酶的pbs中加入0.02g、0.03g、0.04g、0.05g bsa,在消化小鼠心脏组织后发现,加入0.03g的bsa可以明显提高心脏中巨噬细胞的成活率,如图9.最后,为找出最适合的-型胶原酶使用计量,我们在配方中使用了不同计量的-型胶原酶处理心脏组织,发现在50ml的心脏组织消化液中加入0.01g的-型胶原酶为最适计量,既可以有效的分离心脏组织中的巨噬细胞又可以节约试剂成本。在我们研发的配方中保证其他试剂比例相同的情况下,使用不同浓度的-型胶原酶消化小鼠的心脏组织,发现在50ml的心脏组织消化液中加入0.01g的-型胶原酶其心脏中巨噬细胞的收取效率、存活率以及收取数量均为最佳,如图10,图11,图12所示。
[0039]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



